Method Article
Двухэтапная стратегия, которая сочетает эпигенетическую модификацию и биомеханические сигналы для создания плюрипотентных клеток млекопитающих
В этой статье
Резюме
Здесь мы представляем метод, который сочетает в себе использование химического эпигенетического стирания с сигналами, связанными с механозондированием, для эффективной генерации плюрипотентных клеток млекопитающих без необходимости трансфекции генов или ретровирусных векторов. Таким образом, эта стратегия является многообещающей для трансляционной медицины и представляет собой заметный прогресс в технологии органоидных стволовых клеток.
Аннотация
Клеточный фенотип может быть изменен или модифицирован различными методами, с преимуществами и ограничениями, которые специфичны для каждой техники. Здесь мы описываем новую стратегию, которая сочетает в себе использование химического эпигенетического стирания с сигналами, связанными с механозондированием, для создания плюрипотентных клеток млекопитающих. Необходимо сделать два основных шага. На первом этапе взрослые зрелые (терминально дифференцированные) клетки подвергаются воздействию эпигенетического ластика 5-аза-цитидина, чтобы привести их в плюрипотентное состояние. Эта часть протокола была разработана на основе растущего понимания эпигенетических механизмов, контролирующих судьбу и дифференцировку клеток, и включает в себя использование эпигенетического модификатора для стирания дифференцированного состояния клеток, а затем вгоняет в переходное окно высокой пластичности.
На втором этапе стертые клетки инкапсулируют в микробиореакторы политетрафторэтилена (PTFE), также известные как жидкие шарики, для содействия перегруппировке 3D-клеток для расширения и стабильного поддержания приобретенной высокой пластичности. PTFE является нереакционноспособным гидрофобным синтетическим соединением, и его использование позволяет создать клеточную микросреду, которая не может быть достигнута в традиционных системах 2D-культур. Эта система поощряет и повышает поддержание плюрипотентности с помощью сигналов, связанных с биомеханозонированием.
Технические процедуры, описанные здесь, представляют собой простые стратегии, позволяющие индукции и поддерживать состояние высокой пластичности во взрослых соматических клетках. Протокол позволил получить клетки высокой пластичности у всех протестированных видов млекопитающих. Поскольку он не связан с использованием трансфекции генов и свободен от вирусных векторов, он может представлять собой заметный технологический прогресс для применения в трансляционной медицине. Кроме того, система микробиореакторов обеспечивает заметный прогресс в технологии органоидов стволовых клеток путем воссоздания in vitro специфической микросреды, которая позволяет проводить долгосрочную культивирование клеток с высокой пластичностью, а именно в виде ЭСК, иПСК, эпигенетически стертых клеток и МСК.
Введение
В течение последних десятилетий широко распространенная концепция однонаправленной прогрессии в направлении клеточной приверженности и дифференцировки была полностью пересмотрена. Было продемонстрировано, что спецификация ячейки может быть обращена вспять, и терминально дифференцированная клетка может быть подтолкнута к менее зафиксированному и более высокому разрешительному состоянию, используя различные методы.
Среди нескольких предложенных способов один из наиболее перспективных методов включает использование химических соединений для индуцирования клеток в так называемую химически индуцированную плюрипотентность. Малые молекулы, используемые в этом подходе, способны взаимодействовать и модифицировать эпигенетическую сигнатуру взрослой зрелой клетки, избегая необходимости в любом трансгенном и/или вирусном векторе 1,2,3,4,5,6,7,8,9,10 . Многочисленные исследования недавно показали, что можно переключать клетки с одного фенотипа на другой, предоставляя специфические биохимические и биологические стимулы, которые индуцируют реактивацию гиперметилированных генов 11,12,13,14,15. Эти события деметилирования позволяют превращать терминально дифференцированные клетки в примитивный предшественник, мультипотентную или высокопластичную/плюрипотентную клетку 1,2,3,4,5,6,7,8,9,10.
Параллельно многие исследования в последнее время сосредоточены на понимании сигналов, связанных с механозондированием, и, более конкретно, на возможности использования механических сил для непосредственного влияния на пластичность и/или дифференцировку клеток 16,17,18,19. Действительно, было ясно продемонстрировано, что внеклеточный матрикс (ECM) играет ключевую роль в контроле судьбы клеток. В частности, биомеханические и биофизические сигналы, производимые ECM, непосредственно регулируют молекулярные механизмы и сигнальные пути, влияя на поведение и функции клеток20,21. Эти последние данные проложили путь к разработке новых систем 3D-культур, которые более точно имитируют микросреду клеток in vivo, воспроизводя механические и физические стимулы, определяющие поведение клеток.
Здесь мы описываем двухэтапный протокол, который сочетает в себе использование химического эпигенетического стирания с сигналами, связанными с механозондированием, для генерации плюрипотентных клеток млекопитающих. На первом этапе клетки инкубируют с деметилирующей молекулой 5-аза-цитидин (5-аза-CR). Этот агент способен индуцировать значительное глобальное деметилирование ДНК посредством комбинированного эффекта прямого действия 8,10, опосредованного транслокацией 2 (TET2) и косвенного ингибирования ДНК-метилтрансфераз (DNMT)22,23. Этот этап индуцирует удаление эпигенетических блоков с последующей реактивацией экспрессии генов, связанных с плюрипотентностью, и, следовательно, генерацию клеток высокой пластичности 1,2,3,8,10, далее именуемых «эпигенетически стертыми клетками». На втором этапе клетки инкапсулируются в систему 3D-культуры. С этой целью в качестве микробиореактора используется нереакционноспособное гидрофобное синтетическое соединение политетрафторэтилен (PTFE; с размером частиц 1 мкм), что позволяет создать клеточную микросреду, недостижимую с помощью традиционных 2D-культуральных систем10. Частицы порошка PTFE прилипают к поверхности капли жидкости, в которой клетки повторно суспендируются, и изолируют жидкое ядро от опорной поверхности, обеспечивая при этом газообмен между внутренней жидкостью и окружающей средой24. Полученный таким образом «микробиореактор PTFE», также известный как «Жидкий мрамор», побуждает клетки свободно взаимодействовать друг с другом, способствуя 3D-перегруппировке клеток 25,26,27, а также расширяет и стабильно поддерживает приобретенное состояние высокой пластичности через биомеханозондирующие сигналы 10.
протокол
Все исследования были рассмотрены и одобрены Этическим комитетом Миланского университета. Все эксперименты на животных проводились в соответствии с Руководством по уходу и использованию лабораторных животных, опубликованным Национальными институтами здравоохранения США (NIH). Изоляция клеток человека от здоровых взрослых людей была одобрена Этическим комитетом ospedale Maggiore Policlinico, Милан. Все методы в нашем исследовании были проведены в соответствии с утвержденными руководящими принципами.
1. Выделение фибробластов кожи
ПРИМЕЧАНИЕ: Все процедуры, описанные ниже, могут быть применены к фибробластам, выделенным из различных видов млекопитающих, включая мышей, свиней и человека. Мышиные клетки были выделены из 7-недельных самцов мышей, а ткань кожи свиней была собрана на местной скотобойне. Клетки человека были выделены из взрослых пациентов после письменного информированного согласия.
- Приготовить 0,1% раствор желатина свиней.
- Взвесьте 0,1 г свиного желатина и растворите его в 100 мл воды. Стерилизуйте желатиновый раствор путем автоклавирования перед использованием.
- Покрыть 35 мм чашку Петри 0,1% свиным желатином, добавив 1,5 мл приготовленного раствора. Инкубировать в течение 2 ч при комнатной температуре.
- Вырежьте биопсии кожи млекопитающих (мыши, свиней и человека) длиной около 2-5 см и поместите их в фосфатно-буферный физиологический раствор (PBS) Dulbecco, содержащий 2% антимикотический раствор антибиотика. Хранить при температуре + 4 °C до использования.
ПРИМЕЧАНИЕ: Биопсийные сборы должны проводиться по согласованию и после одобрения Этического комитета в соответствии с установленными руководящими принципами. - Тщательно промыть собранные биопсии три раза свежим стерильным ПБС, содержащим 2% антимикотический раствор антибиотика.
- Соберите биопсии с последней промывки и поместите их в стерильную 100-миллиметровую чашку Петри. Используйте стерильный скальпель, чтобы разрезать их на кусочки размером примерно 2 мм3 .
- В конце 2 ч инкубации удаляют избыток раствора желатина из 35-мм чашки Петри (описанной на этапе 1.1.2) и, используя стерильный хирургический пинцет, сразу же помещают 5-6 фрагментов кожи в каждую предварительно покрытую культуральную чашку.
- Смочите фрагменты, добавив 100 мкл капель изоляционной среды фибробластов (табл. 1) поверх каждого из них. Культивирование при 37 °C в 5% CO2 инкубаторе.
ПРИМЕЧАНИЕ: Чтобы предотвратить испарение среды, поместите чашку Петри толщиной 35 мм в чашку Петри толщиной 100 мм или больше, содержащую стерильную воду. Убедитесь, что обе чашки Петри закрыты. - После 24 ч культуры проверьте количество среды в 35 мм культуры чашки Петри. При необходимости добавьте 500 мкл среды выделения фибробластов, чтобы сохранить фрагменты влажными.
- Осторожно удалите среду и обновляйте ее не реже чем через 2 дня посева с помощью пипетки.
- Когда фибробласты начинают вырастать из фрагментов кожи, помещаются в 35 мм чашку Петри (описана в шаге 1.5.) и начинают образовывать клеточный монослой (обычно через 6 дней). Удалите кусочки кожи с помощью стерильного хирургического пинцета и культивируйте в 2 мл среды выделения фибробластов.
- Продолжают культивировать клеточный монослой при 37 °C в 5% CO2 инкубаторе до 80% слияния и обновлять среду через день.
2. Культура первичной клеточной линии фибробластов
- Когда фибробласты достигнут 80% слияния, осторожно удаляют изоляционную среду фибробластов и трижды промывают клетки 3 мл PBS, содержащего 1% антимикотический раствор антибиотика.
- Для отсоединения клеток добавляют 600 мкл 0,25% раствора трипсина-ЭДТА в чашку для культивирования и инкубируют при 37 °C в течение 3-5 мин.
- Добавьте 5,4 мл питательной среды фибробластов для нейтрализации трипсина, когда клетки начнут отделяться от чашки для культивирования (таблица 1).
- Вытесняйте клетки путем многократного и мягкого пипетирования. Пластинчатые клетки в новой культуральной посуде (без желатина), сохраняя соотношение прохождения между 1:2 и 1:4 (в зависимости от скорости роста).
ПРИМЕЧАНИЕ: Центрифугирование не требуется. - Поддерживают клетки в культуре и меняют среду каждые 2 дня, пока они не достигнут 80% слияния и проходят их.
ПРИМЕЧАНИЕ: Размножайте фибробласты два раза в неделю для поддержания энергичного роста.
3. Воздействие фибробластов на 5-аза-CR
- Приготовить свежий 1 мМ 5-аза-CR стоковый раствор.
- Взвесьте 2,44 мг 5-аза-CR и растворите его в 10 мл ДМЭМ с высоким содержанием глюкозы. Повторное суспендирование порошка путем вихря. Стерилизуйте раствор фильтром 0,22 мкм.
ПРИМЕЧАНИЕ: 5-аза-CR раствор должен быть приготовлен непосредственно перед использованием. - Готовят 5-аза-CR рабочий раствор, разбавляя 1 мкл 5-аза-CR запасного раствора (3.1.1.) в 1 мл культуральной среды фибробластов.
ПРИМЕЧАНИЕ: Концентрация рабочего раствора 5-аза-CR составляет 1 мкМ 1,2,3,8,9.
- Взвесьте 2,44 мг 5-аза-CR и растворите его в 10 мл ДМЭМ с высоким содержанием глюкозы. Повторное суспендирование порошка путем вихря. Стерилизуйте раствор фильтром 0,22 мкм.
- Трипсинизируют клетки, как описано ранее (2.1.-2.3.) и вытесняют клетки путем многократного и мягкого пипетирования.
- Соберите клеточную суспензию и переложите ее в коническую трубку.
- Подсчитывайте ячейки с помощью счетной камеры под оптическим микроскопом при комнатной температуре. Рассчитать объем среды, необходимый для повторной суспендации клеток для получения 4 х 104 клеток в 30 мкл культуральной среды фибробластов, дополненной 1 мкМ 5-аза-CR (см. этап 3.1.2.).
ПРИМЕЧАНИЕ: Формула, которая будет использоваться, зависит от конкретного типа камеры.
- Центрифугируют клеточную суспензию при 150 х г в течение 5 мин при комнатной температуре. Удалить супернатант и повторно суспендировать гранулу с культуральной средой фибробластов, дополненной 1 мкМ 5-аза-CR (см. этап 3.1.2.). Объем используемой питательной среды фибробластов см. на этапе 3.4.
ПРИМЕЧАНИЕ: В качестве отрицательного контроля повторно суспендируют клетки с одинаковой концентрацией в культуральной среде фибробластов без 5-аза-CR и продолжают инкапсуляцию клеток в порошке PTFE (этап 4.1.-4.13.).
4. Инкапсуляция фибробластов в микробиореакторах PTFE
- Наполните чашку Петри толщиной 35 мм порошком политетрафторэтилена (PTFE) для получения слоя (рисунок 1A).
ПРИМЕЧАНИЕ: Используйте 35 мм бактериологические чашки Петри, чтобы избежать адгезии жидкого мрамора. Чтобы получить тонкую гидрофобную и пористую оболочку, используйте порошок ptfe со средним размером частиц 1 мкм и полученный с максимальным измельчением 2,0 NPIRI. Это позволяет создавать газопроницаемые жидкие шарики. Кроме того, полупрозрачное покрытие облегчает наблюдение за процессами агрегации клеток в режиме реального времени Больший размер частиц приводит к высокой полидисперсности, что может вызвать повышенное испарение, деформацию и потерю сферической формы, а также преждевременное растворение микробиореакторов. - Распределите 30 мкл одной капли, содержащей 4 x 104 клетки (см. шаги 3.4.- 3.5.), на слой порошка (рисунок 1B).
- Осторожно поверните 35-миллиметровую чашку Петри круговыми движениями, чтобы гарантировать, что порошок PFTE полностью покроет поверхность капли жидкости, образуя жидкий мраморный микробиореактор (рисунок 1C).
- Возьмите микробиореактор из жидкого мрамора с помощью наконечника пипетки объемом 1000 мкл, разрезанного по краю, чтобы приспособиться к диаметру мрамора (рисунок 1D, E). Нанесите микробиореактор из жидкого мрамора на чистую бактериологическую чашку Петри, чтобы стабилизировать ее (рисунок 1F).
ПРИМЕЧАНИЕ: Чтобы создать трение для захвата мрамора внутри наконечника, вырежьте наконечники пипетки диаметром примерно меньше диаметра жидкого мрамора. - Перенесите жидкий мраморный микробиореактор из чашки Петри в 96-луночную пластину (один мрамор/лунку) (рисунок 1G).
- Медленно добавляйте 100 мкл среды с края скважины. Микробиореактор начинает плавать поверх среды (рисунок 1H).
ПРИМЕЧАНИЕ: Микробиореактор разрывается при прямом контакте с жидкостью из-за нарушения гидрофобности PTFE. В качестве альтернативного подхода микробиореакторы из жидкого мрамора могут быть индивидуально помещены в 35-миллиметровую бактериологическую культуральную чашку. В этом случае, чтобы предотвратить испарение жидкого мрамора, 35-мм чашка Петри, содержащая микробиореактор, должна быть вставлена в 100-миллиметровую чашку Петри, предварительно аликвотированную стерильной водой. - Инкубировать жидкий мраморный микробиореактор в течение 18 ч при 37 °C в 5% CO2 инкубаторе 1,2,3,8,9.
ПРИМЕЧАНИЕ: Размер частиц PTFE 1 мкм может обеспечить оптимальный газообмен между внутренней жидкостью и окружающей средой. - После инкубации 5-аза-CR в течение 18 ч соберите жидкий мраморный микробиореактор, используя наконечник пипетки объемом 1000 мкл, разрезанный по краю (см. этап 4.5).
- Поместите микробиореактор в новую 35-миллиметровую бактериологическую чашку Петри (рисунок 1D-F).
- Используйте иглу, чтобы проколоть жидкий мрамор и разбить его.
- Восстановленные сформированные сфероиды с наконечником пипетки объемом 200 мкл, разрезанным по краю, под стереомикроскопом (рисунок 1I,J).
ПРИМЕЧАНИЕ: Эпигенетически стертые клетки, инкапсулированные в PTFE, образуют 3D-сферическую структуру (по одному агрегату в каждом жидком мраморе). - Чтобы оценить приобретение плюрипотентного состояния в ответ на 5-аза-CR, проверьте начало экспрессии генов, связанных с плюрипотентностью, OCT4, NANOG, REX1 и SOX2, с помощью качественной ПЦР (таблица 2).
- Перейдите ко второму шагу протокола, как описано ниже.
5. Культура в микробиореакторах PTFE эпигенетически стертых клеток
- Готовят свежую питательную среду ESC (таблица 1).
- Перенос органоидов в чашку Петри, содержащую среду ESC, для промывки остатков 5-аза-CR (см. шаги 5.1.-5.2.).
- Приготовьте новую 35-миллиметровую бактериологическую чашку Петри, содержащую слой порошка из ПТФЭ (см. также шаг 4.1.).
- Распределите один органоид в капле 30 мкл питательной среды ESC на слой порошка с помощью наконечника пипетки объемом 200 мкл, разрезанного по краю (см. шаги 4.9.; 5.3.).
- Осторожно поверните 35-миллиметровую чашку Петри круговыми движениями, чтобы сформировать новый жидкий мраморный микробиореактор, поднимите его с помощью кончика пипетки объемом 1000 мкл, вырежьте по краю и поместите вновь образованный микробиореактор в колодец из 96-луночной пластины (один мрамор / лунка) (см. шаги 4.3.-4.6.).
- Чтобы всплыть микробиореакторы, добавьте 100 мкл среды с края скважины, чтобы медленно омыть мрамор (см. примечание 4.7.).
- Культивируйте жидкие мраморные микробиореакторы при 37 °C в инкубаторе с 5%CO2 столько, сколько потребуется. Меняйте среду через день, следуя процедуре, описанной в 5.3.-5.7.
ПРИМЕЧАНИЕ: В настоящей рукописи приведены результаты, полученные с культурой органоидов за 28 дней. Однако при необходимости может быть выполнен более длительный период культивирования.
Результаты
Настоящий протокол описывает все этапы, которые должны быть выполнены для генерации и стабильного поддержания плюрипотентных клеток млекопитающих из взрослых соматических клеток. Этот метод был успешным с фибробластами, выделенными из различных видов млекопитающих, а именно мыши, свиней и человека. Репрезентативные результаты, представленные здесь, получены из всех клеточных линий, независимо от вида происхождения.
Морфологические анализы показывают, что после 18-часовой инкубации с деметилирующим агентом 5-аза-CR фибробласты, инкапсулированные в микробиореакторы PTFE (3D Post 5-aza-CR) агрегатируются и образуют 3D сферические структуры, отображающие одинаковую геометрию размера, у всех трех рассмотренных видов. (Рисунок 2A-C, 3D Post 5-aza-CR). 86.31 ± 4,13% инкапсулированных клеток замечательно модифицировали свой фенотип, демонстрируя особенности, обычно связанные с фенотипом8 с высокой пластичностью. Напротив, клетки после 5-аза-CR, культивируемые в стандартных условиях 2D, хотя и заменены типичной фибробластной вытянутой формой круглой или овальной, были значительно меньше по размеру с более крупными и гранулированными ядрами, сохраняли монослойное распределение (рисунок 2). Морфологические изменения сопровождались началом экспрессии генов, связанных с плюрипотентностью, как в 3D, так и в 2D Post 5-aza-CR клетках. Также наблюдалась транскрипция для Гомеобокса 1 класса POU 5 (OCT4), гомеобокса Nanog (NANOG), цинкового белка цинкового пальца ZFP42 (REX1) и определяющей пол области Y-box 2 (SOX2), которая отсутствует в необработанных фибробластах (T0), была обнаружена (Рисунок 3, Рисунок 4, Рисунок 5). Кроме того, количественный анализ ПЦР продемонстрировал значительное повышение регуляции вышеупомянутых генов, а также десяти-одиннадцати транслокационных-2 (TET2), молекулы адгезии эпителиальных клеток (EPCAM) и генов кадгерина 1 (CDH1) в клетках 3D Post 5-aza-CR (Рисунок 3, Рисунок 4, Рисунок 5, Синие полосы) по сравнению с клетками, культивируемыми в стандартных пластиковых чашках 2D (2D Post 5-aza-CR) (Рисунок 3, Рисунок 4, Рисунок 5, оранжевые полосы). Параллельно со значительным понижением регуляции специфического маркера фибробластов Thy-1 клеточного поверхностного антигена (THY1) была четко обнаружена в 3D и 2D post 5-aza-CR клетках (Рисунок 3, Рисунок 4, Рисунок 5).
Достижение состояния высокой пластичности было также подтверждено ИФА-анализом глобального метилирования ДНК, что демонстрирует значительное снижение уровней метилирования как в 3D, так и в 2D пост-5-аза-CR клетках (рисунок 6A-C). Более того, в соответствии с результатами экспрессии генов, уровни метилирования ДНК были значительно ниже в клетках 3D Post 5-aza-CR (рисунок 6A-C, синие полосы) по сравнению с 2D Post 5-aza-CR (рисунок 6A-C, оранжевые полосы).
Еще более интересно, что 3D-клетки Post 5-aza-CR сохраняют приобретенную 3D сферическую структуру (рисунок 2A, 3D 28d) и поддерживают высокие уровни экспрессии генов, связанных с плюрипотентностью (рисунок 3, рисунок 4 и рисунок 5 синие полосы), а также низкие уровни метилирования ДНК (рисунок 6A-C, синие полосы) в течение всего последующего периода культивирования и, в частности, до 28 дней, когда культура была арестована. Напротив, хотя клетки 2D Post 5-aza-CR транскрибируют те же гены плюрипотентности после обработки деметилирующим агентом, они отказались от такой экспрессии к 7-му дню (Рисунок 3, Рисунок 4, Рисунок 5, nd). Аналогичным образом, снижение уровней метилирования сохранялось в течение первых 72 часов; затем метилирование медленно увеличивалось, возвращаясь сравнимым с необработанными фибробластами (фиг.6А-С, Т0, белые полосы) к 7-му дню культуры (Фиг.6А-С, оранжевые полосы).

Рисунок 1: Инкапсуляция клеток в микробиореакторе PTFE и восстановление органоидов. (A) Бактериологическая чашка Петри была заполнена PTFE для приготовления порошкового слоя. (B) Одну каплю среды, содержащей клетки, дозировали поверх слоя из ПТФЭ. (C) Чашку Петри осторожно вращали круговыми движениями, чтобы покрыть каплю и получить микробиореактор. (D) Наконечник пипетки объемом 1000 мкл был разрезан на конце (красная стрелка) и (E) использован для сбора микробиореактора. (F) Жидкий мрамор переносили в чистую чашку Петри для его стабилизации, (G) помещали в 96-луночную пластину (один мрамор/колодец) и (H) плавали на носителе. (I) Для сбора вновь образованного органоида микробиореактор прокалывали иглой и (J) полученные клеточные агрегаты восстанавливали под стереомикроскопом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
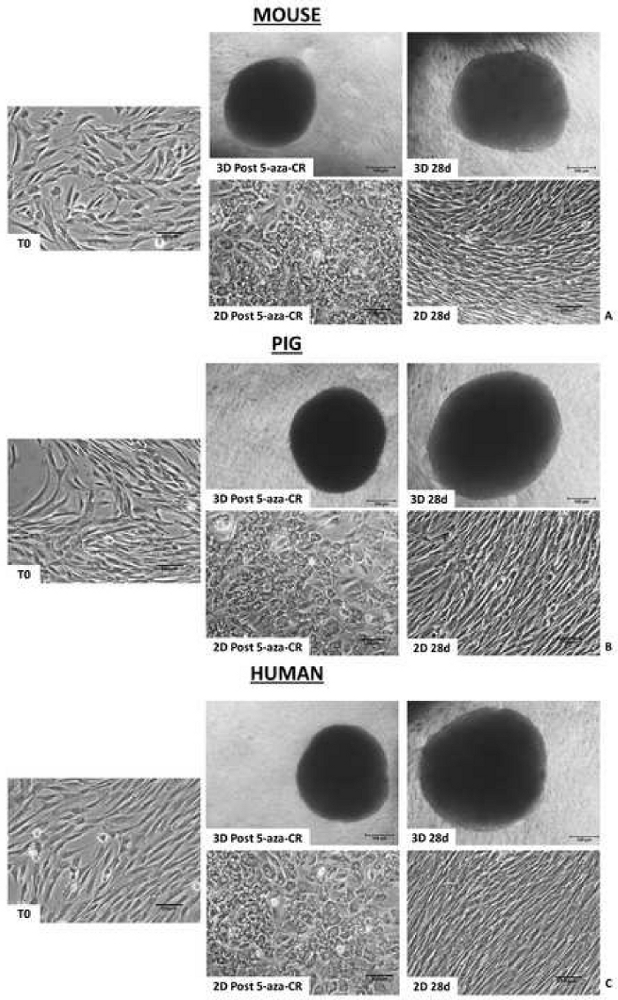
Рисунок 2: Эпигенетически стертые клетки млекопитающих, инкапсулированные в микробиореакторы PTFE, образуют 3D сферические структуры. Мышиные (A), свиные (B) и человеческие (C) клетки, инкапсулированные в PTFE и обработанные 5-aza-CR формой 3D сферических структур (3D Post 5-aza-CR), которые стабильно поддерживались в течение всего последующего периода культивирования (3D 28d; Шкала, 100 мкм). Напротив, мышиные (A), свиные (B) и человеческие (C) клетки, покрытые пластиковой посудой и обработанные 5-aza-CR, заменили типичную удлиненную форму фибробластов (T0) в круглый эпителиоидный фенотип и сохранили монослойное распределение (2D Post 5-aza-CR). К 7-му дню культивирования 2D-клетки вернулись к своей первоначальной вытянутой форме, которая стабильно сохранялась в течение последующего периода культивирования (2D 28 d; Шкала, 100 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Мышиные эпигенетически стертые клетки, инкапсулированные в микробиореакторах PTFE, демонстрируют высокий уровень и долгосрочное поддержание экспрессии генов, связанных с плюрипотентностью. Уровни транскрипции для генов Oct4, Nanog, Rex1, Sox2, Tet2, Epcam, Cdh1 и Thy1 в мышиных необработанных фибробластах (T0, белые полосы), фибробластах, подвергшихся воздействию 5-aza-CR (Post 5-aza-CR), и в разные моменты времени культивирования для инкапсулированных PTFE (синие полоски) и стандартной пластиковой посуды (оранжевые батончики) культивируемых клеток. Значения экспрессии генов сообщаются с самой высокой экспрессией, установленной на 1, и все остальные относительно этого. Различные надстрочные индексы обозначают существенные различия (P < 0,05). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
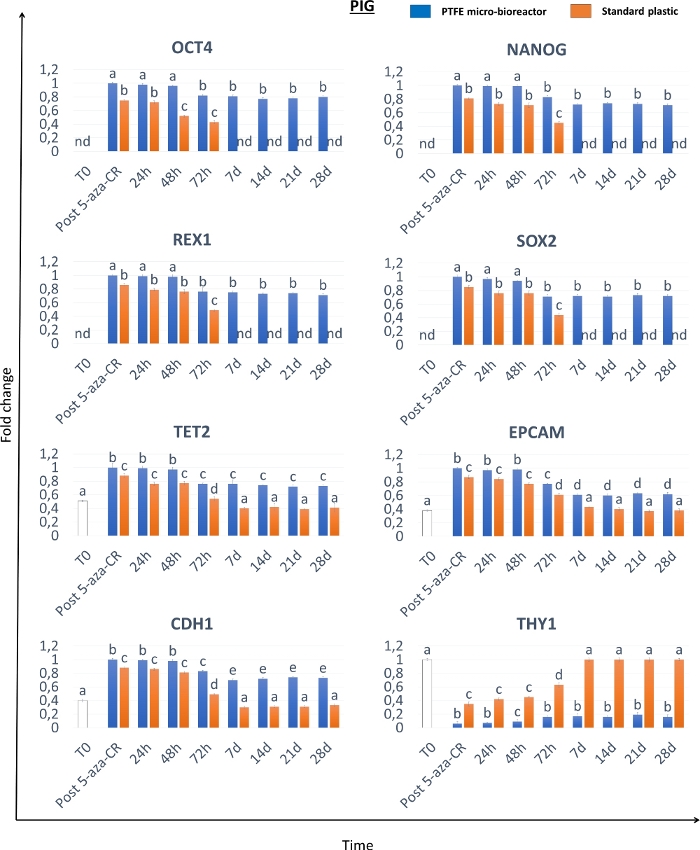
Рисунок 4: Эпигенетически стертые клетки свиней, инкапсулированные в микробиореакторах PTFE, демонстрируют высокий уровень и долгосрочное поддержание экспрессии генов, связанных с плюрипотентностью. Уровни транскрипции для генов OCT4, NANOG, REX1, SOX2, TET2, EPCAM, CDH1 и THY1 в необработанных фибробластах свиней (T0, белые полосы), фибробластах, подвергшихся воздействию 5-аза-CR (Post 5-aza-CR), и в разные моменты времени культивирования для инкапсулированных клеток PTFE (синие полоски) и стандартной пластиковой посуды (оранжевые полосы) культивируемых клеток. Значения экспрессии генов сообщаются с самой высокой экспрессией, установленной на 1, и все остальные относительно этого. Различные надстрочные индексы обозначают существенные различия (P < 0,05). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Эпигенетически стертые клетки человека, инкапсулированные в микробиореакторах PTFE, демонстрируют высокий уровень и долгосрочное поддержание экспрессии генов, связанных с плюрипотентностью. Уровни транскрипции для генов OCT4, NANOG, REX1, SOX2, TET2, EPCAM, CDH1 и THY1 в необработанных фибробластах человека (T0, белые полосы), фибробластах, подвергшихся воздействию 5-aza-CR (Post 5-aza-CR), и в разные моменты времени культивирования для инкапсулированных PTFE (синие полоски) и стандартных пластиковых форм (оранжевые полосы) культивируемых клеток. Значения экспрессии генов сообщаются с самой высокой экспрессией, установленной на 1, и все остальные относительно этого. Различные надстрочные индексы обозначают существенные различия (P < 0,05). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
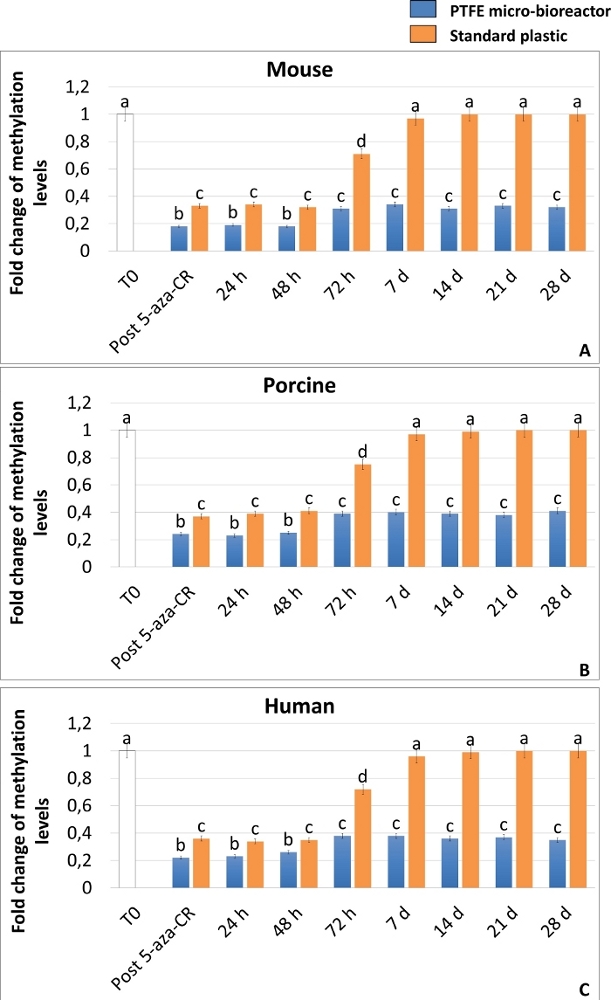
Рисунок 6: Микробиореактор PTFE усиливает деметилирующий эффект 5-аза-CR и поддерживает долгосрочное гипометилирование ДНК в эпигенетически стертых фибробластах млекопитающих. Глобальные уровни метилирования ДНК клеток мышей (А), свиней (В) и человека (С), инкапсулированных в микробиореакторах PTFE (синие полосы) или покрытых стандартным пластиком (оранжевые батончики), подвергаемому воздействию 5-аза-CR (Пост 5-аза-CR) и культивируемым в среде ESC в течение 28 дней. Необработанные фибробласты (Т0; белые полосы). Результаты представляют собой среднее ± SD трех независимых экспериментов с пятью независимыми биологическими репликациями. Различные надстрочные индексы обозначают существенные различия (P < 0,05). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Изоляционная среда фибробластов (100 мл) | |
| DMEM, высокая глюкоза, пируват | 77 мл |
| Фетальная бычья сыворотка, квалифицированная, инактивированная теплом | 20 мл |
| Раствор L-глутамина | 1 мл |
| Антимикотический раствор антибиотика (100×) | 2 мл |
| Культуральная среда фибробластов (100 мл) | |
| DMEM, высокая глюкоза, пируват | 88 мл |
| Фетальная бычья сыворотка, квалифицированная, инактивированная теплом | 10 мл |
| Раствор L-глутамина | 1 мл |
| Антимикотический раствор антибиотика (100×) | 1 мл |
| Культуральная среда ESC (10 мл) | |
| Смесь питательных веществ F-10 от Ham's | 3,99 мл |
| DMEM, низкий уровень глюкозы, пируват | 3,99 мл |
| Замена сыворотки KnockOut | 1 мл |
| Фетальная бычья сыворотка, квалифицированная, инактивированная теплом | 500 мкл |
| Антимикотический раствор антибиотика (100×) | 100 мкл |
| Раствор L-глутамина | 100 мкл |
| MEM Раствор заменимых аминокислот (100X) | 100 мкл |
| 2-Меркаптоэтанол (10 мМ) | 100 мкл (0,1 мМ) |
| Нуклеозидная смесь (0,3 М гуанозина, 0,3 М аденозина, 0,3 М цитидина, 0,3 М уридина и 0,1 М тимидина) | 100 мкл (3 мМ гуанозина, 3 мМ Аденозина, 3 мМ цитидина, 3 мМ Уридина и 1 мМ Тимидина) |
| ESGRO Рекомбинантный мышиный liF белок (1000 единиц/мл) | 10 мкл (1 единица/мл) |
| Рекомбинантный человеческий FGF основной (bFGF) (5 мкг/мл) | 10 мкл (5 нг/мл) |
Таблица 1: Состав среды выделения фибробластов, культуральной среды фибробластов и питательной среды ЭКУ.
| Цель | Наборы для праймеров для ПЦР | Вид | |
| Cdh1 | Нападающий: ГАГГААККАККАККККАТКАТА | Мышь | |
| Реверс: GTTGACCGTCCCTTCACAGT | Мышь | ||
| Эпкам | Нападающий: TGGCAACAAGTTGCTCTCTG | Мышь | |
| Реверс: CTTGTCGGTTCTTCGGACTC | Мышь | ||
| Наног | Нападающий: АГГГАТТТТГГТТГГТЦ | Мышь | |
| Реверс: CCAGGAAGACCCACACTCAT | Мышь | ||
| Окт4 | Вперед: ACACCTGGCTTCAGACTTCG | Мышь | |
| Реверс: AGTTGCTTTCCACTCGTGCT | Мышь | ||
| Рекс1 | Нападающий: CAGGTTCTGGAAGCGAGTTC | Мышь | |
| Реверс: GACAAGCATGTGCTTCCTCA | Мышь | ||
| Сокс2 | Нападающий: АГААКККААГАТГЦАКААК | Мышь | |
| Реверс: CTCCGGGAAGCGTGTACTTA | Мышь | ||
| Тет2 | Нападающий: ГКАКАГГГАГКААГАГАТТЦ | Мышь | |
| Реверс: ATGTTGACATTGCCAGTGGA | Мышь | ||
| Твой1 | Нападающий: AACTCTTGGCACCATGAACC | Мышь | |
| Реверс: GCACGTGCTTCCTCTCCTCTCT | Мышь | ||
| КДН1 | Нападающий: GAATGACAATGGCCCCATAC | Свиной | |
| Реверс: AGGTGGTCACCTGGTCTTTG | Свиной | ||
| EPCAM | Нападающий: GCTTGGTCAGTGCCAGTGTA | Свиной | |
| Реверс: CTTCTGACCCCAGCAGTGTT | Свиной | ||
| НАНОГ | Нападающий: ATCCAGCTTGTCCCCAAAG | Свиной | |
| Реверс: ATTTCATTCGCTGGTTCTGG | Свиной | ||
| ОКТ4 | Нападающий: GTTCAGCCAAACGACCATCT | Свиной | |
| Реверс: CTCCAGGTTGCCTCTCACTC | Свиной | ||
| РЕКС1 | Нападающий: CTTCAAGGAGAGCGCAAAAC | Свиной | |
| Реверс: TGTCCCCAATCAAAAATGCT | Свиной | ||
| SOX2 | Нападающий: GCCCTGCAGTACAACTCCAT | Свиной | |
| Реверс: GCTGATCATGTCCCGTAGGT | Свиной | ||
| ТЕТ2 | Нападающий: CAGAAAACAATGCAGCCAGA | Свиной | |
| Реверс: GAATGGCTCGGTCTCTGAAG | Свиной | ||
| ТВОЙ1 | Нападающий: GGCATCGCTCTCTTGCTAAC | Свиной | |
| Реверс: GCTGGAGAAGTTGGTTCGAG | Свиной | ||
| КДН1 | Нападающий: TGCCCAGAAAATGAAAAAGG | Человеческий | |
| Реверс: GTGTATGTGGCAATGCGTTC | Человеческий | ||
| EPCAM | Форвард: GCTGGTGTGTGAACACTGCT | Человеческий | |
| Реверс: ACGCGTTGTGATCTCCTTCTCT | Человеческий | ||
| НАНОГ | Нападающий: АГАААААКААКГГЧЦГААГ | Человеческий | |
| Реверс: TGCTCCAGGACTGGATGTTC | Человеческий | ||
| ОКТ4 | Нападающий: AATTTGCCAAGCTCCTGAAG | Человеческий | |
| Реверс: GTTGCCTCTCACTCGGTTCT | Человеческий | ||
| РЕКС1 | Нападающий: ACGTTTCGTGTGTCCCTTTC | Человеческий | |
| Реверс: TATAACCGCTTTTGGGGTTG | Человеческий | ||
| SOX2 | Нападающий: ACACCAATCCCATCCACACT | Человеческий | |
| Реверс: GCAAACTTCCTGCAAAGCTC | Человеческий | ||
| ТЕТ2 | Нападающий: CCCACTTACCTGCGTTTCAT | Человеческий | |
| Реверс: ACTGTGACCTTTCCCCACTG | Человеческий | ||
| ТВОЙ1 | Нападающий: АГАТККАГААККАТГААКК | Человеческий | |
| Реверс: GCACGTGCTTCTTTGTCTCTCA | Человеческий | ||
| Цель | TaqMan Анализы Номер в каталоге | Вид | |
| Актб | Mm02619580_g1 | Мышь | |
| Cdh1 | Mm01247357_m1 | Мышь | |
| Эпкам | Mm00493214_m1 | Мышь | |
| Гапдх | Mm99999915_g1 | Мышь | |
| Наног | Mm02019550_s1 | Мышь | |
| Окт4 | Mm03053917_g1 | Мышь | |
| Рекс1 | Mm03053975_g1 | Мышь | |
| Сокс2 | Mm03053810_s1 | Мышь | |
| Тет2 | Mm00524395_m1 | Мышь | |
| Твой1 | Mm00493681_m1 | Мышь | |
| АКТБ | Ss03376563_uH | Свиной | |
| КДН1 | Ss06942341_m1 | Свиной | |
| EPCAM | Ss03384752_u1 | Свиной | |
| ГАПДХ | Ss03375629_u1 | Свиной | |
| НАНОГ | Ss04245375_s1 | Свиной | |
| ОКТ4 | Ss03389800_m1 | Свиной | |
| РЕКС1 | Ss03373622_g1 | Свиной | |
| SOX2 | Ss03388002_u1 | Свиной | |
| ТЕТ2 | Ss06880359_m1 | Свиной | |
| ТВОЙ1 | Ss03376963_u1 | Свиной | |
| АКТБ | Hs01060665_g1 | Человеческий | |
| КДН1 | Hs01023895_m1 | Человеческий | |
| EPCAM | Hs00901885_m1 | Человеческий | |
| ГАПДХ | Hs02786624_g1 | Человеческий | |
| НАНОГ | Hs02387400_g1 | Человеческий | |
| ОКТ4 | Hs00999632_g1 | Человеческий | |
| РЕКС1 | Hs00399279_m1 | Человеческий | |
| SOX2 | Hs01053049_s1 | Человеческий | |
| ТЕТ2 | Hs00325999_m1 | Человеческий | |
| ТВОЙ1 | Hs00174816_m1 | Человеческий | |
Таблица 2: Информация о грунтовке.
Обсуждение
В течение последних десятилетий несколько исследований были сосредоточены на разработке стратегий возврата терминально дифференцированной клетки к менее приверженному и более высокому разрешительному состоянию. Описанный здесь протокол позволяет генерировать и длительно поддерживать плюрипотентные клетки, начиная со взрослых зрелых терминально дифференцированных клеток. Метод сочетает в себе два независимых этапа, которые предполагают индукцию состояния высокой разрешительности, которое достигается за счет химического эпигенетического стирания и его последующего поддержания, обеспечиваемого с помощью системы 3D-культуры.
Формирование 3D-сфероидных структур, наблюдаемое в инкапсулированных клетках PTFE (фиг.2), согласуется с другими исследованиями, демонстрирующими способность PTFE эффективно стимулировать агрегацию клеток, облегчая создание обонятельных сфероидных структур25 клеток (OEC) или формирование 3D-тороидальных агрегатов26. Эти морфологические изменения параллельны началу экспрессии генов, связанных с плюрипотентностью (рисунок 3, рисунок 4, рисунок 5), который показывает значительно более высокие уровни в 3D-клетках Post 5-aza-CR по сравнению с 2D-клетками Post 5-aza-CR (рисунок 3, рисунок 4, рисунок 5). Последовательно, 3D-клетки Post 5-aza-CR демонстрируют более высокое гипометилирование ДНК, чем 2D Post 5-aza-CR (рисунок 6). В целом, эти результаты указывают на способность 5-аза-CR индуцировать состояние высокой пластичности, независимо от используемой системы клеточных культур. Тем не менее, химически индуцированное состояние плюрипотентности, достигаемое клетками, значительно стимулируется с помощью микробиореактора PTFE, который повышает транскрипцию гена плюрипотентности и увеличивает деметилирующие эффекты 5-aza-CR. Еще более интересно, что только клетки 3D Post 5-aza-CR стабильно сохраняют приобретенную 3D сферическую структуру (рисунок 2) и поддерживают высокие уровни экспрессии генов, связанных с плюрипотентностью (рисунок 3, рисунок 4, рисунок 5), а также низкие уровни метилирования ДНК (рисунок 6) в течение всего последующего периода культивирования. В целом, представленные здесь репрезентативные результаты демонстрируют, что эта двухэтапная стратегия является высокоэффективной и надежной, а использование микробиореактора PTFE не только повышает высокую пластичность, но и позволяет обеспечить его стабильное, долгосрочное поддержание у рассматриваемых видов млекопитающих. Недавно мы продемонстрировали, что эти полезные эффекты связаны с активацией сигнального пути Гиппопотама и его сигналов, связанных с механотрансдукцией10, которые, как было ранее показано, играют ключевую роль в активной регуляции плюрипотентности клеток 28,29,30.
Двумя наиболее важными шагами для успешной процедуры являются строгое поддержание клеток при 37 °C в любое время, включая их обработку под стерильным ламинаром и микроскопом, а также использование правильного количества клеток / объемной скорости жидкости во время производства микробиореактора, которая может варьироваться в зависимости от конкретного типа используемой клетки. По нашему опыту, также настоятельно рекомендуется готовить реагенты в свежем виде, перед их использованием в культуре (это абсолютно необходимо для 5-аза-CR стандартного раствора). Кроме того, освежение среды должно проводиться под стереомикроскопом, поскольку 3D-сферические органоиды могут быть потеряны во время изменений среды.
Основными сильными сторонами этого метода являются отсутствие трансгенных и/или вирусных векторных требований; устойчивость и воспроизводимость у различных видов млекопитающих; низкие затраты; и высокая гибкость к различным типам клеток. С другой стороны, возможное ограничение может быть представлено ограниченным числом получаемых данных из-за небольших объемов микробиореакторов. Кроме того, использование высокой плотности клеток может вызвать низкие скорости переноса кислорода и ограниченный рост суспензии. Для преодоления этих проблем по-прежнему необходима дальнейшая работа над стратегиями расширения масштабов и/или сокращения масштабов.
Важно подчеркнуть, что ключевыми аспектами, общими для всех приложений на основе 3D-сфероидов, являются воспроизводимость, эффективность производства, однородность размеров органоидов и влияние на клеточную физиологию. Эти особенности строго коррелируют с механическими силами, генерируемыми в системе культуры, и варьируются в зависимости от различных используемых методов. Например, многоклеточные органоиды можно культивировать с использованием неадгезивных тарелок в стационарных системах. Этот подход в первую очередь основан на условиях ограниченной диффузии и, как правило, приводит к образованию слабо агрегированных кластеров. Техника подвешивания-падения показывает то же ограничение. Действительно, осаждение клеточной суспензии на нижнюю сторону крышки чашки для культуры тканей приводит к созданию микрогравитационной среды, которая концентрирует клетки на границе раздела свободная жидкость-воздух, вызывая генерацию низкоагрегированных многоклеточных сфер. Возможная альтернатива представлена техникой колбы спиннера. Однако этот метод является очень дорогим, поскольку он требует повышенного количества питательной среды. Кроме того, сформированные органоиды должны быть перенесены в стационарную культуральную систему при использовании для характеристики или дальнейших тестов in vitro. Все эти проблемы можно преодолеть, используя жидкие мраморные микробиореакторы. Действительно, они обеспечивают неадгезивную жидкую поверхность, которая сочетает в себе преимущества как стационарных, так и прядильных методов, вызывая быструю агрегацию клеток и генерацию компактных сфероидов. Параллельно вогнутое дно, сферическая форма и внутренний поток жидкости каждого мрамора позволяют клеткам оседать на дне микробиореактора, что приводит к образованию органоидов, однородных по размеру и форме. Еще одно существенное преимущество в использовании жидких шариков представлено оптимальными газообменами, которые благодаря своей сферической форме могут происходить через всю поверхность.
В заключение, описанный здесь протокол позволяет эффективно и просто генерировать плюрипотентные клетки млекопитающих. Поскольку эта стратегия не содержит вирусных векторов и не предполагает использования какой-либо трансфекции генов, она очень перспективна для применения в трансляционной медицине и может рассматриваться как шаг вперед в клеточной терапии, специфичной для пациента. Кроме того, использование 3D-систем микробиореакторных культур может представлять собой заметный прорыв в технологии органоидов стволовых клеток и может представлять собой выгодную микросреду для долгосрочной культивирования различных типов клеток, таких как ЭСК, иПСК и МСК. Дополнительным преимуществом является небольшой объем, позволяющий изучать эффект паракринной/аутокринной сигнализации богатой среды, установленной внутри микробиореактора.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа финансировалась Фондом Каррарези и MiND FoodS Hub ID: 1176436. Все авторы являются членами COST Action CA16119 In vitro 3-D общее руководство клетками и фитнес (CellFit).
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma-Aldrich | M7522 | Component of ESC medium |
| 5-Azacytidine | Sigma-Aldrich | A2385 | 5-aza-CR, for fibroblast epigenetic erasing |
| Adenosine | Sigma-Aldrich | A4036 | Component of nucleoside mix for ESC medium |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | Component of fibroblast and ESC media |
| CFX96 Real-Time PCR | Bio-Rad Laboratories | NA | Thermal cycler for quantitative PCR |
| Cytidine | Sigma-Aldrich | C4654 | Component of nucleoside mix for ESC medium |
| DMEM, high glucose, pyruvate | Thermo Fisher Scientific | 41966052 | For fibroblast isolation and culture medium |
| DMEM, low glucose, pyruvate | Thermo Fisher Scientific | 31885023 | For ESC medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D5652 | PBS; for biopsy and cell wash and for solution preparation |
| Dynabeads mRNA DIRECT Micro Purification Kit | Thermo Fisher Scientific | 61021 | mRNA estraction |
| ESGRO Recombinant Mouse LIF Protein | Sigma-Aldrich | ESG1106 | Component of ESC medium |
| Fetal Bovine Serum, qualified, heat inactivated | Thermo Fisher Scientific | 10500064 | Component of fibroblast and ESC media |
| FGF-Basic (AA10-155) Recombinant Human Protein | Thermo Fisher Scientific | PHG0024 | Component of ESC medium |
| Gelatin from porcine skin | Sigma-Aldrich | G1890 | For dish coating |
| GeneAmp PCR System 2700 | Applied Biosystems | NA | Thermal cycler for qualitative PCR |
| Global DNA Methylation ELISA Kit | CELL BIOLABS | STA-380 | Methylation study |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7801 | Qualitative PCR |
| Guanosine | Sigma-Aldrich | G6264 | Component of nucleoside mix for ESC medium |
| Ham's F-10 Nutrient Mix | Thermo Fisher Scientific | 31550031 | For ESC medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Component of ESC medium |
| KOVA glasstic slide 10 with grids | Hycor Biomedical | 87144 | For cell counting |
| Leica MZ APO Stereo Microscope | Leica | NA | For organoid observation |
| L-Glutamine solution | Sigma-Aldrich | G7513 | Component of fibroblast and ESC media |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140035 | Component of ESC medium |
| Millex-GS 0.22 µm pore filters | Millipore | SLGS033SB | For solution sterilization |
| M-MLV Reverse Transcriptase, RNase H Minus, Point Mutant | Promega | M3681 | mRNA reverse transcription |
| Multiskan FC Microplate Photometer | Thermo Fisher Scientific | 51119000 | For ELISA plate reading |
| Nikon Eclipse TE300 Inverted Phase Contrast Microscope | Nikon | NA | For cell observation |
| Perkin Elmer Thermal Cycler 480 | Perkin Elmer | NA | Thermal cycler for reverse transcription |
| Poly(tetrafluoroethylene) 1 μm particle size | Sigma-Aldrich | 430935 | For generating micro-bioreactor |
| PureLink Genomic DNA Mini Kit | Thermo Fisher Scientific | K182001 | Genomic DNA estraction |
| TaqMan Gene Expression Cells-to-CT Kit | Thermo Fisher Scientific | AM1728 | Quantitative PCR |
| Thymidine | Sigma-Aldrich | T1895 | Component of nucleoside mix for ESC medium |
| Tissue Culture Dish 100X20 mm, Standard | Sarstedt | 833902 | For fibroblast isolation |
| Tissue Culture Dish 35X10 mm, Standard | Sarstedt | 833900 | For Fibroblast isolation |
| Tissue Culture Dish 35X10 mm, Suspension | Sarstedt | 833900500 | Bacteriology petri dish for liquid marble culture |
| Tissue Culture Plate 96 Well,Standard,F | Sarstedt | 833924005 | For liquid marble culture |
| Trypsin-EDTA solution | Sigma-Aldrich | T3924 | For fibroblast dissociation |
| Tube 15ml, 120x17mm, PS | Sarstedt | 62553041 | For cell suspension centrifugation |
| Uridine | Sigma-Aldrich | U3003 | Component of nucleoside mix for ESC medium |
Ссылки
- Pennarossa, G., et al. Brief demethylation step allows the conversion of adult human skin fibroblasts into insulin-secreting cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), 8948-8953 (2013).
- Pennarossa, G., et al. Reprogramming of pig dermal fibroblast into insulin secreting cells by a brief exposure to 5-aza-cytidine. Stem Cell Reviews and Reports. 10 (1), 31-43 (2014).
- Brevini, T. A. L., et al. Morphological and molecular changes of human granulosa cells exposed to 5-azacytidine and addressed toward muscular differentiation. Stem Cell Reviews and Reports. 10 (5), 633-642 (2014).
- Mirakhori, F., Zeynali, B., Kiani, S., Baharvand, H. Brief azacytidine step allows the conversion of suspension human fibroblasts into neural progenitor-like cells. Cell Journal. 17 (1), 153-158 (2015).
- Tan, S. J., et al. Muscle tissue engineering and regeneration through epigenetic reprogramming and scaffold manipulation. Scientific Reports. 5, 16333 (2015).
- Brevini, T. A. L., Pennarossa, G., Acocella, F., Brizzola, S., Zenobi, A., Gandolfi, F. Epigenetic conversion of adult dog skin fibroblasts into insulin-secreting cells. Veterinary Journal. 211, 52-56 (2016).
- Chandrakanthan, V., et al. PDGF-AB and 5-Azacytidine induce conversion of somatic cells into tissue-regenerative multipotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 2306-2315 (2016).
- Manzoni, E. F. M., et al. 5-azacytidine affects TET2 and histone transcription and reshapes morphology of human skin fibroblasts. Scientific Reports. 6, 37017 (2016).
- Pennarossa, G., et al. Epigenetic erasing and pancreatic differentiation of dermal fibroblasts into insulin-producing cells are boosted by the use of low-stiffness substrate. Stem Cell reviews and reports. 14 (3), 398-411 (2018).
- Pennarossa, G., et al. Use of a PTFE micro-bioreactor to promote 3D cell rearrangement and maintain high plasticity in epigenetically erased fibroblasts. Stem Cell Reviews and Reports. 15 (1), 82-92 (2019).
- Constantinides, P. G., Jones, P. A., Gevers, W. Functional striated muscle cells from non-myoblast precursors following 5-azacytidine treatment. Nature. 267 (5609), 364-366 (1977).
- Taylor, S. M., Jones, P. A. Multiple new phenotypes induced in 10T1/2 and 3T3 cells treated with 5-azacytidine. Cell. 17 (4), 771-779 (1979).
- Taylor, S. M., Constantinides, P. A., Jones, P. A. 5-Azacytidine, DNA methylation, and differentiation. Current Topics in Microbiology and Immunology. 108, 115-127 (1984).
- Jones, P. A. Effects of 5-azacytidine and its 2'-deoxyderivative on cell differentiation and DNA methylation. Pharmacology & Therapeutics. 28 (1), 17-27 (1985).
- Palii, S. S., Van Emburgh, B. O., Sankpal, U. T., Brown, K. D., Robertson, K. D. DNA methylation inhibitor 5-Aza-2'-deoxycytidine induces reversible genome-wide DNA damage that is distinctly influenced by DNA methyltransferases 1 and 3B. Molecular and Cellular Biology. 28 (2), 752-771 (2008).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews. Molecular Cell Biology. 18 (12), 728 (2017).
- Matamoro-Vidal, A., Levayer, R. Multiple influences of mechanical forces on cell competition. Current Biology. 29 (15), 762-774 (2019).
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Research & Therapy. 3 (5), 41 (2012).
- Kumar, A., Placone, J. K., Engler, A. J. Understanding the extracellular forces that determine cell fate and maintenance. Development. 144 (23), 4261-4270 (2017).
- Bissell, M. J., Rizki, A., Mian, I. S. Tissue architecture: the ultimate regulator of breast epithelial function. Current Opinion in Cell Biology. 15 (6), 753-762 (2003).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. The Journal of Cell Biology. 129 (3), 591-603 (1995).
- Christman, J. K. 5-Azacytidine and 5-aza-2[prime]-deoxycytidine as inhibitors of DNA methylation: mechanistic studies and their implications for cancer therapy. Oncogene. 21, 5483-5495 (2002).
- Stresemann, C., Lyko, F. Modes of action of the DNA methyltransferase inhibitors azacytidine and decitabine. International Journal of Cancer. 123 (1), 8-13 (2008).
- Ledda, S., Idda, A., Kelly, J., Ariu, F., Bogliolo, L., Bebbere, D. A novel technique for in vitro maturation of sheep oocytes in a liquid marble microbioreactor. Journal of Assisted Reproduction and Genetics. 33 (4), 513-518 (2016).
- Vadivelu, R. K., et al. Generation of three-dimensional multiple spheroid model of olfactory ensheathing cells using floating liquid marbles. Scientific Reports. 5, 15083 (2015).
- Vadivelu, R. K., Kamble, H., Munaz, A., Nguyen, N. T. Liquid Marble as bioreactor for engineering three-dimensional toroid tissues. Scientific Reports. 7 (1), 12388 (2017).
- Vadivelu, R. K., Kamble, H., Munaz, A., Nguyen, N. T. Liquid Marbles as bioreactors for the study of three-dimensional cell interactions. Biomedical Microdevices. 19 (2), 31 (2017).
- Varelas, X., et al. TAZ controls Smad nucleocytoplasmic shuttling and regulates human embryonic stem-cell self-renewal. Nature Cell Biology. 10 (7), 837-848 (2008).
- Panciera, T., et al. Induction of Expandable Tissue-Specific Stem/Progenitor Cells through Transient Expression of YAP/TAZ. Cell Stem Cell. 19 (6), 725-737 (2016).
- Pennarossa, G., Paffoni, A., Ragni, G., Gandolfi, F., Brevini, T. A. L. Rho signaling-directed YAP/TAZ regulation encourages 3D spheroid colony formation and boosts plasticity of parthenogenetic stem cells. Advances in Experimental Medicine and Biology. 1237, 49-60 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены