Method Article
Uma estratégia de duas etapas que combina modificação epigenética e sinais biomecânicos para gerar células pluripotentes mamíferas
Neste Artigo
Resumo
Apresentamos aqui um método que combina o uso de apagamento epigenético químico com pistas relacionadas à mecanosensagem para gerar eficientemente células pluripotentes de mamíferos, sem a necessidade de transfecção genética ou vetores retrovirais. Essa estratégia é, portanto, promissora para a medicina translacional e representa um notável avanço na tecnologia organoide de células-tronco.
Resumo
O fenótipo celular pode ser invertido ou modificado com diferentes métodos, com vantagens e limitações específicas para cada técnica. Aqui descrevemos uma nova estratégia que combina o uso de apagamento epigenético químico com pistas relacionadas à mecanosensagem, para gerar células pluripotentes de mamíferos. Dois passos principais são necessários. Na primeira etapa, as células adultas maduras (terminantemente diferenciadas) são expostas à borracha epigenética 5-aza-cytidina para levá-las a um estado pluripotente. Esta parte do protocolo foi desenvolvida, com base na compreensão crescente dos mecanismos epigenéticos que controlam o destino e a diferenciação celular, e envolve o uso do modificador epigenético para apagar o estado diferenciado celular e, em seguida, dirigir para uma janela transitória de alta plasticidade.
Na segunda etapa, as células apagadas são encapsuladas em micro-bioreatores de politetrafluoroetileno (PTFE), também conhecidos como Mármores Líquidos, para promover o rearranjo celular 3D para estender e manter a alta plasticidade adquirida. O PTFE é um composto sintético hidrofóbico não reativo e seu uso permite a criação de um microambiente celular, que não pode ser alcançado em sistemas tradicionais de cultura 2D. Este sistema incentiva e aumenta a manutenção da pluripotência, embora as pistas relacionadas à bio-mecanosensing.
Os procedimentos técnicos aqui descritos são estratégias simples para permitir a indução e manutenção de um estado de alta plasticidade em células somáticas adultas. O protocolo permitiu a derivação de células de alta plasticidade em todas as espécies de mamíferos testadas. Uma vez que não envolve o uso de transfecção genética e é livre de vetores virais, pode representar um notável avanço tecnológico para aplicações de medicina translacional. Além disso, o sistema micro-bioreator fornece um notável avanço na tecnologia organoide de células-tronco, recriando in vitro um microambixo específico que permite a cultura de longo prazo de células de alta plasticidade, ou seja, como ESCs, iPSCs, células epigeneticamente apagadas e MSCs.
Introdução
Durante as últimas décadas, o conceito amplamente aceito de progressão unidirecional em direção ao comprometimento e diferenciação celular foi completamente revisto. Foi demonstrado que a especificação celular pode ser revertida, e uma célula terminantemente diferenciada pode ser empurrada para um estado permissivo menos comprometido e mais alto, usando diferentes métodos.
Entre os vários métodos propostos, um dos métodos mais promissores envolve o uso de compostos químicos para induzir células em uma chamada pluripotência quimicamente induzida. As pequenas moléculas utilizadas nesta abordagem são capazes de interagir e modificar a assinatura epigenética de uma célula adulta madura, evitando a necessidade de qualquer vetor transgênico e/ou viral 1,2,3,4,5,6,7,8,9,10 . Inúmeros estudos têm mostrado recentemente que é possível mudar as células de um fenótipo para outro, fornecendo estímulos bioquímicos e biológicos específicos que induzem a reativação de genes hipermetilados 11,12,13,14,15. Esses eventos de desmetilação permitem a conversão de células terminais diferenciadas em um progenitor primitivo, um multipotente ou uma célula de alta plasticidade/pluripotente 1,2,3,4,5,6,7,8,9,10.
Paralelamente, muitos estudos têm se concentrado recentemente na compreensão de pistas relacionadas à mecanosensagem e, mais especificamente, na possibilidade de usar forças mecânicas para influenciar diretamente a plasticidade celular e/ou diferenciação 16,17,18,19. De fato, foi claramente demonstrado que a matriz extracelular (ECM) desempenha um papel fundamental no controle do destino celular. Em particular, os sinais biomecânicos e biofísicos produzidos pelo ECM regulam diretamente mecanismos moleculares e vias de sinalização, influenciando o comportamento celular e funções20,21. Esses dados recentes abriram caminho para o desenvolvimento de novos sistemas de cultura 3D que imitam mais de perto o microambiente de células in vivo, replicando estímulos mecânicos e físicos impulsionando o comportamento celular.
Descrevemos aqui um protocolo de duas etapas que combina o uso de apagamento epigenético químico com pistas relacionadas à mecanosensagem, para gerar células pluripotentes de mamíferos. No primeiro passo, as células são incubadas com a molécula desmetilante 5-aza-citidina (5-aza-CR). Este agente é capaz de induzir uma significativa desmetilação global de DNA através de um efeito combinado da translocação direta 2 (TET2)-mediada ação 8,10 e a inibição indireta das metiltransferases de DNA (DNMT)22,23. Esta etapa induz a remoção dos blocos epigenéticos com uma posterior reativação da expressão genética relacionada à pluripotency e, portanto, a geração de células de alta plasticidade 1,2,3,8,10, a partir de agora referidas como "células apagadas epigenéticas". Na segunda etapa, as células são encapsuladas em um sistema de cultura 3D. Para isso, o composto sintético hidrofóbico não reativo politetrafluoroetileno (PTFE; com tamanho de partícula de 1 μm) é usado como micro-bioreator, que permite a criação de um microambiente celular inalcançável através do uso de sistemas tradicionais de cultura 2D10. As partículas de pó PTFE aderem à superfície da gota líquida na qual as células são re-suspensas e isolam o núcleo líquido da superfície de suporte, permitindo a troca de gás entre o líquido interior e o ambiente circundante24. O "micro-bioreator PTFE" obtido, também conhecido como "Mármore Líquido", incentiva as células a interagir livremente entre si, promovendo o rearranjo de células 3D 25,26,27, e estende e mantém de forma estável o estado de alta plasticidade adquirido, embora a sinalização relacionada à bio-mecanosensing 10.
Protocolo
Todos os estudos foram revisados e aprovados pelo Comitê de Ética da Universidade de Milão. Todos os experimentos em animais foram realizados de acordo com o Guia para o Cuidado e Uso de Animais de Laboratório, publicado pelo Instituto Nacional de Saúde dos EUA (NIH). O isolamento de células humanas de indivíduos adultos saudáveis foi aprovado pelo Comitê de Ética do Ospedale Maggiore Policlinico, Milano. Todos os métodos do nosso estudo foram realizados de acordo com as diretrizes aprovadas.
1. Isolamento do fibroblasto de pele
NOTA: Todos os procedimentos descritos abaixo podem ser aplicados a fibroblastos isolados de diferentes espécies de mamíferos, incluindo camundongos, suínos e humanos. As células murinas foram isoladas de camundongos machos de 7 semanas de idade e tecido da pele suína foram coletados no matadouro local. As células humanas foram isoladas de pacientes adultos, após consentimento por escrito.
- Prepare 0,1% solução de gelatina suína.
- Pesar 0,1 g de gelatina suína e dissolvê-la em 100 mL de água. Esterilizar a solução de gelatina por autoclaving antes de usar.
- Cubra placa de Petri de 35 mm com gelatina suína de 0,1%, adicionando 1,5 mL da solução preparada. Incubar por 2h em temperatura ambiente.
- Corte biópsias de pele de mamíferos (camundongos, suínos e humanos) de aproximadamente 2-5 cm de comprimento e coloque-os na linha salina tamponada fosfato (PBS) de Dulbecco contendo 2% de solução antimíctica antimíctica antimíctica. Armazenar a + 4 °C até usar.
NOTA: As coletas de biópsia devem ser realizadas de acordo e após a aprovação do Comitê de Ética, de acordo com as diretrizes estabelecidas. - Lave extensivamente as biópsias coletadas três vezes em PBS fresco estéril contendo 2% de solução antimicomolética antibiótico.
- Coletar biópsias da última lavagem e colocá-las em uma placa de Petri estéril de 100 mm. Use um bisturi estéril para cortá-los em pedaços de aproximadamente 2 mmde tamanho 3 .
- Ao final da incubação de 2 h, remova o excesso de solução de gelatina da placa de Petri de 35 mm (descrita na etapa 1.1.2) e, usando uma pinça cirúrgica estéril, coloque imediatamente 5-6 fragmentos de pele em cada prato de cultura pré-revestido.
- Molhe os fragmentos adicionando 100 gotículas μL de meio de isolamento do fibroblasto (Tabela 1) sobre cada uma delas. Cultura a 37 °C em 5% incubadora de CO2 .
NOTA: Para evitar que o meio se evase, coloque a placa de Petri de 35 mm dentro de uma placa de Petri de 100 mm ou maior contendo água estéril. Certifique-se de tampar ambas as placas de Petri. - Após 24h de cultura, verifique a quantidade do meio na placa de Petri cultura de 35 mm. Se necessário, adicione 500 μL de meio de isolamento do fibroblasto para manter molhado os fragmentos.
- Remova cuidadosamente o meio e atualize-o pelo menos a cada 2 dias de cultura usando uma pipeta.
- Quando os fibroblastos começam a crescer fora dos fragmentos de pele colocados na placa de Petri de 35 mm (descrita na etapa 1.5.) e começam a formar uma monocamada celular (geralmente 6 dias). Remova as peças da pele usando uma pinça cirúrgica estéril e cultura em 2 mL de meio de isolamento do fibroblasto.
- Continue a cultivar a monocamada celular a 37 °C em 5% de incubadora de CO2 até 80% de confluência e atualizar o meio a cada dois dias.
2. Cultura da linha celular primária do fibroblasto
- Quando os fibroblastos atingirem 80% de confluência, remova cuidadosamente as células de isolamento do fibroblasto e lave as células três vezes com 3 mL de PBS contendo 1% de solução antimicocótica antibiótico.
- Para desapego celular, adicione 600 μL de solução trypsin-EDTA de 0,25% no prato de cultura e incubar a 37 °C por 3-5 min.
- Adicione 5,4 mL de cultura fibroblasto para neutralizar a trippsina quando as células começarem a se desprender do prato de cultura (Tabela 1).
- Desalojar células por tubulação repetida e suave. Células de placas em novos pratos de cultura (sem gelatina), mantendo a razão de passagem entre 1:2 e 1:4 (dependendo da taxa de crescimento).
NOTA: A centrifugação não é necessária. - Manter as células na cultura e mudar de meio a cada 2 dias, até que elas tenham atingido 80% de confluência e passá-las.
NOTA: Propagar fibroblastos duas vezes por semana para manter o crescimento vigoroso.
3. Exposição do fibroblasto ao 5-aza-CR
- Prepare a solução fresca de estoque 1 mM 5-aza-CR.
- Pese 2,44 mg de 5-aza-CR e dissolva-o em 10 mL de DMEM de alta glicose. Resuspend o pó por vórtice. Esterilize a solução com filtro de 0,22 μm.
NOTA: A solução de estoque de 5 aza-CR deve ser preparada imediatamente antes do uso. - Prepare a solução de trabalho de 5 aza-CR diluindo 1 μL de solução de estoque de 5 aza-CR (3.1.1.) em 1 mL de meio de cultura fibroblasto.
NOTA: A concentração da solução de trabalho de 5 aza-CR é de 1 μM 1,2,3,8,9.
- Pese 2,44 mg de 5-aza-CR e dissolva-o em 10 mL de DMEM de alta glicose. Resuspend o pó por vórtice. Esterilize a solução com filtro de 0,22 μm.
- Células de trypsinize como descrito anteriormente (2.1.-2.3.) e desalojam células repetidamente e suavemente.
- Pegue a suspensão da célula e transfira-a para um tubo cônico.
- Conte células usando uma câmara de contagem sob um microscópio óptico à temperatura ambiente. Calcule o volume de células médias necessárias para re suspendê-los para obter 4 x 104 células em 30 μL de cultura fibroblasto complementada com 1 μM 5-aza-CR (ver passo 3.1.2.).
NOTA: A fórmula a ser utilizada depende do tipo específico de câmara.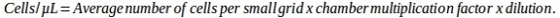
- Centrifugar a suspensão celular a 150 x g por 5 min a temperatura ambiente. Remova a pelota supernascedora e resuspend com o meio de cultura fibroblasto suplementado com 1 μM 5-aza-CR (ver passo 3.1.2.). Para que o volume do meio de cultura do fibroblasto seja utilizado, consulte o passo 3.4.
NOTA: Como controle negativo, as células resuspend ad a mesma concentração no meio de cultura fibroblasto sem 5-aza-CR e proceder com encapsulamento celular em pó PTFE (passo 4.1.-4.13.).
4. Encapsulamento de fibroblasto em micro-bioreatores PTFE
- Encha uma placa de Petri de 35 mm com pó de politetrafluoroetileno (PTFE) para produzir uma cama (Figura 1A).
NOTA: Use placas de Petri de bacteriologia de 35 mm para evitar a adesão ao mármore líquido. Para obter uma fina concha hidrofóbica e porosa, use um pó PTFE com um tamanho médio de partícula de 1 μm e produzido com uma moagem máxima de 2,0 NPIRI. Isso permite a criação de mármores líquidos permeáveis a gás. Além disso, o revestimento translúcido facilita a observação de processos de agregação celular em tempo real Tamanho de partícula maior leva a alta polidispersidade que pode causar evaporação elevada, deformidade e perda da forma esférica, e a dissolução prematura dos micro-bioreatores. - Dispense 30 μL de gotícula única contendo 4 x 104 células (ver passos 3.4.- 3,5.) no leito de pó (Figura 1B).
- Gire suavemente a placa de Petri de 35 mm em um movimento circular para garantir que o pó PFTE cubra inteiramente a superfície da gota líquida para formar um micro-bioreator de mármore líquido (Figura 1C).
- Pegue o micro-bioreator de mármore líquido usando uma ponta de pipeta de 1.000 μL, cortada na borda, para acomodar o diâmetro do mármore (Figura 1D,E). Coloque o micro-bioreator de mármore líquido em uma placa de Petri bacteriologia limpa para estabilizá-la (Figura 1F).
NOTA: Para criar um atrito para segurar o mármore dentro da ponta, corte as pontas da pipeta com um diâmetro aproximadamente ligeiramente menor do que o diâmetro do mármore líquido. - Transfira o micro-bioreator de mármore líquido da placa de Petri para uma placa de 96 poços (um mármore/bem) (Figura 1G).
- Adicione lentamente 100 μL de mídia da margem do poço. O micro-bioreator começa a flutuar em cima da mídia (Figura 1H).
NOTA: O micro-bioreator quebra em contato líquido direto, devido ao rompimento da hidrofobiidade ptfe. Como abordagem alternativa, os micro-bioreatores de mármore líquido podem ser colocados individualmente em um prato de cultura bacteriologia de 35 mm. Neste caso, para evitar a evaporação líquida do mármore, a placa de Petri de 35 mm contendo o micro-bioreator deve ser inserida em uma placa de Petri de 100 mm, anteriormente aliquoed com água estéril - Incubar micro-bioreator de mármore líquido por 18 h a 37 °C em incubadora de CO2 de 5% 1,2,3,8,9.
NOTA: O tamanho da partícula PTFE de 1 μm pode garantir uma troca de gás ideal entre o líquido interior e o ambiente circundante. - Após a incubação de 5 aza-CR por 18 h, colete o micro-bioreator de mármore líquido usando um corte de ponta de pipeta de 1.000 μL na borda (ver passo 4.5).
- Coloque o micro-bioreator em uma nova placa petriologia de 35 mm (Figura 1D-F).
- Use uma agulha para perfurar o mármore líquido e quebrá-lo.
- Recuperar esferoides formados com uma ponta de pipeta de 200 μL, cortada na borda, sob um estereomicroscope (Figura 1I,J).
NOTA: Células epigeneticamente apagadas encapsuladas em PTFE formam uma estrutura esférica 3D (um agregado em cada mármore líquido). - Para avaliar a aquisição de estado pluripotente em resposta ao 5-aza-CR, verifique o início da expressão genética relacionada à pluripotência, OCT4, NANOG, REX1 e SOX2, por PCR qualitativo (Tabela 2).
- Prossiga com a segunda etapa do protocolo, conforme descrito abaixo.
5. Cultura em micro-bioreatores ptfe de células epigeneticamente apagadas
- Prepare o meio de cultura ESC fresco (Tabela 1).
- Transfira organoides em uma placa de Petri contendo meio ESC para lavagem de resíduos de 5 aza-CR (ver etapas 5.1.-5.2.).
- Prepare uma nova placa petriologia de 35 mm contendo cama de pó PTFE (veja também o passo 4.1.).
- Dispense um organoide único em uma gotícula de 30 μL ESC meio de cultura no leito de pó usando uma ponta de pipeta de 200 μL, cortada na borda (ver passos 4.9.; 5.3.).
- Gire suavemente a placa de Petri de 35 mm em um movimento circular para formar um novo micro-bioreator de mármore líquido, pegue-a usando uma ponta de pipeta de 1.000 μL, corte na borda e coloque o micro-bioreator recém-formado em um poço de placa de 96 poços (um mármore/bem) (ver passos 4.3.-4.6.).
- Para flutuar os micro-bioreatores, adicione 100 μL de mídia da margem do poço para banhar lentamente o mármore (ver nota 4.7.).
- Micro-bioreatores de mármore líquido de cultura a 37 °C em incubadora de CO2 de 5% pelo tempo necessário. Troque de meio a cada dois dias, seguindo o procedimento descrito em 5.3.-5.7.
NOTA: No presente manuscrito, são fornecidos resultados obtidos com cultura organoides durante 28 dias. No entanto, se necessário, um período de cultura mais longo pode ser realizado.
Resultados
O presente protocolo descreve todas as etapas a serem executadas para gerar e manter as células pluripotentes dos mamíferos a partir de células somáticas adultas. Este método tem sido bem sucedido com fibroblastos isolados de diferentes espécies de mamíferos, ou seja, camundongos, suínos e humanos. Os resultados representativos aqui relatados são obtidos de todas as linhas celulares, independentemente da espécie de origem.
Análises morfológicas mostram que, após a incubação de 18 h com o agente desmetilante 5-aza-CR, os fibroblastos encapsulados em micro-bioreatores PTFE (3D Post 5-aza-CR) agregaram e formaram estruturas esféricas 3D exibindo uma geometria de tamanho uniforme, em todas as três espécies consideradas. (Figura 2A-C, 3D Post 5-aza-CR). 86,31 ± 4,13% das células encapsuladas notavelmente modificaram seu fenótipo, mostrando características tipicamente relacionadas a um fenótipo de alta plasticidade8. Em contraste, as células pós-5-aza-CR cultivadas em condições padrão 2D, embora substituíram a forma alongada do fibroblasto típico por uma redonda ou oval, eram consideravelmente menores em tamanho com núcleos maiores e granulados, retiveram uma distribuição de monocamadas (Figura 2). As alterações morfológicas foram acompanhadas pelo início da expressão genética relacionada à pluripotency, tanto em células 3D quanto 2D Post 5-aza-CR. Transcrição para homeobox classe 5 POU 1 (OCT4), nanog homeobox (NANOG), proteína de dedo de zinco ZFP42 (REX1) e região determinante sexual Y-box 2 (SOX2) também foi detectada, que está ausente em fibroblastos não tratados (T0), foi detectada (Figura 3, Figura 4, Figura 5). Além disso, a análise quantitativa da PCR demonstrou uma regulação significativa dos genes acima mencionados, assim como dos genes de translocação 11-10 (TET2), molécula de adesão celular epitelial (EPCAM) e cadherin 1 (CDH1) genes em células 3D Post 5-aza-CR (Figura 3, Figura 4, Figura 5, barras azuis) em comparação com células cultivadas em pratos plásticos padrão 2D (2D Post 5-aza-CR) (Figura 3, Figura 3, Figura 3, Figura 3, Figura 3, Figura 3, Figura 3, Figura 3, Figura 3, Figura 3, Figura 3, Figura 4, Figura 5, barras laranja). Em paralelo, uma redução significativa do marcador específico do fibroblasto Thy-1 cell surface antgen (THY1) foi claramente detectável em células 3D e 2D Post 5-aza-CR (Figura 3, Figura 4, Figura 5).
A realização de um estado de alta plasticidade também foi confirmada pela análise ELISA da metilação global de DNA, que demonstra uma diminuição significativa dos níveis de metilação nas células 3D e 2D Post 5-aza-CR (Figura 6A-C). Além disso, de acordo com os resultados da expressão genética, os níveis de metilação de DNA foram significativamente menores em células 3D Post 5-aza-CR (Figura 6A-C, barras azuis), em comparação com as 2D Post 5-aza-CR (Figura 6A-C, barras laranjas).
Ainda mais interessante, As células 3D Post 5-aza-CR mantêm a estrutura esférica 3D adquirida (Figura 2A, 3D 28d) e mantêm altos níveis de expressão de genes relacionados à pluripotency (Figuras 3, Figura 4 e Figura 5 barras azuis) bem como baixos níveis de metilação de DNA (Figura 6A-C, barras azuis), durante todo o período de cultura subsequente e, especificamente, até 28 dias, quando a cultura foi presa. Em contraste, embora as células 2D Post 5-aza-CR transcrevam para os mesmos genes de pluripotência após o tratamento com o agente desmetilante, eles recusaram tal expressão até o dia 7 (Figura 3, Figura 4, Figura 5, nd). Da mesma forma, a diminuição dos níveis de metilação foi mantida nas primeiras 72 horas; em seguida, a metilação aumentou lentamente, retornando comparável aos fibroblastos não tratados (Figura 6A-C, T0, barras brancas) até o dia 7 da cultura (Figura 6A-C, barras laranja).

Figura 1: Encapsulamento celular na recuperação de micro-bioreatores e organoides do PTFE. (A) Uma placa de Petri bacteriologia foi preenchida com PTFE para preparar um leito de pó. (B) Uma única gota de células de médio porte foi dispensada em cima do leito PTFE. (C) A placa de Petri foi suavemente girada com movimentos circulares para revestir a gota e produzir o micro-bioreator. (D) Uma ponta de pipeta de 1000 μL foi cortada no final (seta vermelha) e (E) usada para coletar o micro-bioreator. (F) O mármore líquido foi transferido para uma placa de Petri limpa para estabilizá-la, (G) colocada em uma placa de 96 poços (um mármore/bem) e (H) flutuada na mídia. (I) Para coletar organoide recém-formado, o micro-bioreator foi perfurado com uma agulha e (J) os agregados celulares obtidos foram recuperados sob um estereótipo. Clique aqui para ver uma versão maior desta figura.
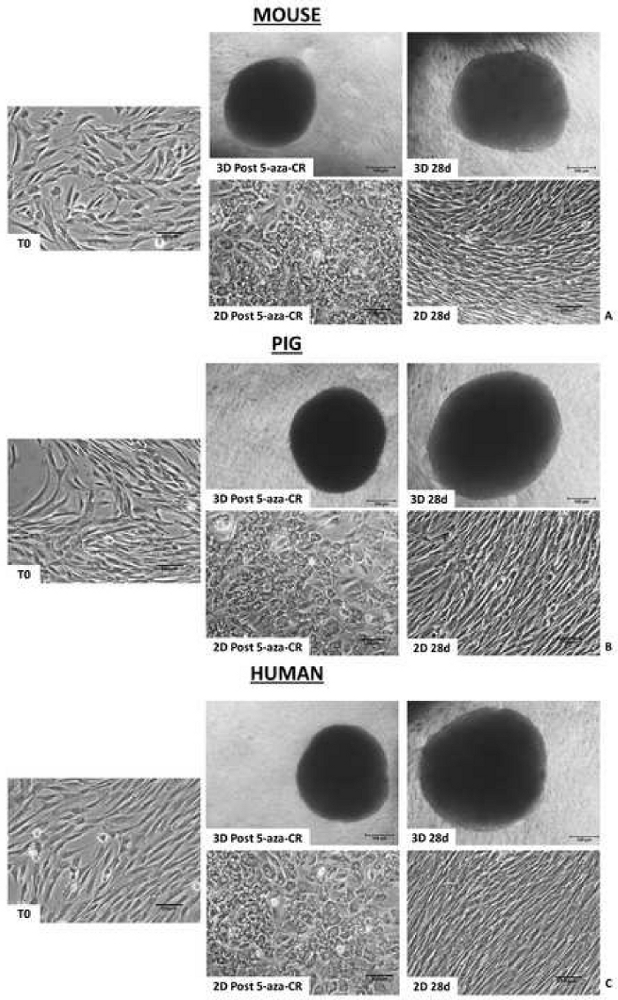
Figura 2: Células epigeneticamente apagadas por mamíferos encapsuladas em micro-bioreatores PTFE formam estruturas esféricas 3D. Células murinas (A), suína (B) e humana (C) encapsuladas em PTFE e tratadas com estruturas esféricas 3D (3D Post 5-aza-CR), que foram mantidas com facadas durante todo o período de cultura subsequente (3D 28d; Barra de escala, 100 μm). Em contraste, células murinas (A), suína (B) e humana (C) banhadas em pratos plásticos e tratadas com 5-aza-CR substituíram o típico fibroblast elongado formato (T0) em um fenótipo epitelióide redondo e manteve uma distribuição monocamada (2D Post 5-aza-CR). No 7º dia da cultura, as células 2D reverteram à sua forma alongada original, que foi mantida para o período de cultura subsequente (2D 28 d; Barra de escala, 100 μm). Clique aqui para ver uma versão maior desta figura.

Figura 3: As células epigeneticamente apagadas de murina encapsuladas em micro-bioreatores PTFE mostram alta manutenção de alto nível e longo prazo da expressão genética relacionada à pluripotência. Níveis de transcrição para os genes Oct4, Nanog, Rex1, Sox2, Tet2, Epcam, Cdh1 e Thy1 em fibroblastos murine não tratados (T0, barras brancas), fibroblastos expostos a 5-aza-CR (Post 5-aza-CR), e em diferentes pontos de tempo de cultura para ptfe encapsulado (barras azuis) e pratos plásticos padrão (barras laranja). Os valores de expressão genética são relatados com a expressão mais alta definida para 1 e todas as outras em relação a isso. Diferentes sobrecritos denotam diferenças significativas (P < 0,05). Clique aqui para ver uma versão maior desta figura.
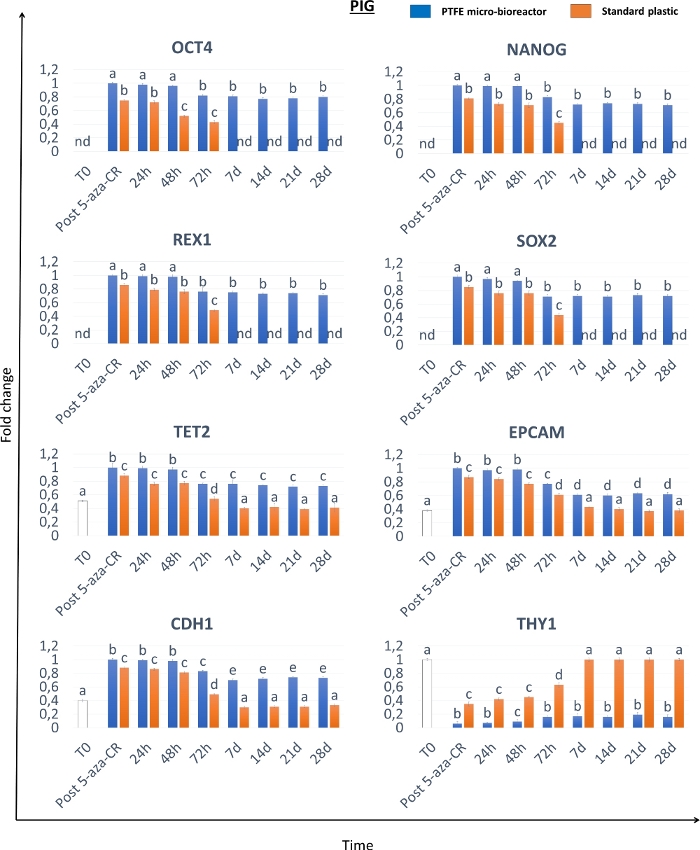
Figura 4: Células epigeneticamente apagadas porcina encapsuladas em micro-bioreatores PTFE mostram alta níveis e manutenção a longo prazo da expressão genética relacionada à pluripotência. Níveis de transcrição para genes OCT4, NANOG, REX1, SOX2, TET2, EPCAM, CDH1 e THY1 em fibroblastos não tratados porcina (T0, barras brancas), fibroblastos expostos a células cultivadas de 5 aza-CR (Post 5-aza-CR), e em diferentes pontos de tempo de cultura para ptfe encapsulado (barras azuis) e pratos plásticos padrão (barras laranja). Os valores de expressão genética são relatados com a expressão mais alta definida para 1 e todas as outras em relação a isso. Diferentes sobrecritos denotam diferenças significativas (P < 0,05). Clique aqui para ver uma versão maior desta figura.

Figura 5: Células epigeneticamente apagadas humanas encapsuladas em micro-bioreatores PTFE mostram alta níveis e manutenção a longo prazo da expressão genética relacionada à pluripotência. Níveis de transcrição para genes OCT4, NANOG, REX1, SOX2, TET2, EPCAM, CDH1 e THY1 em fibroblastos humanos não tratados (T0, barras brancas), fibroblastos expostos a células cultivadas de 5 aza-CR (Post 5-aza-CR), e em diferentes pontos de tempo de cultura para células cultivadas de PTFE encapsuladas (barras azuis) e pratos plásticos padrão (barras laranjas). Os valores de expressão genética são relatados com a expressão mais alta definida para 1 e todas as outras em relação a isso. Diferentes sobrecritos denotam diferenças significativas (P < 0,05). Clique aqui para ver uma versão maior desta figura.
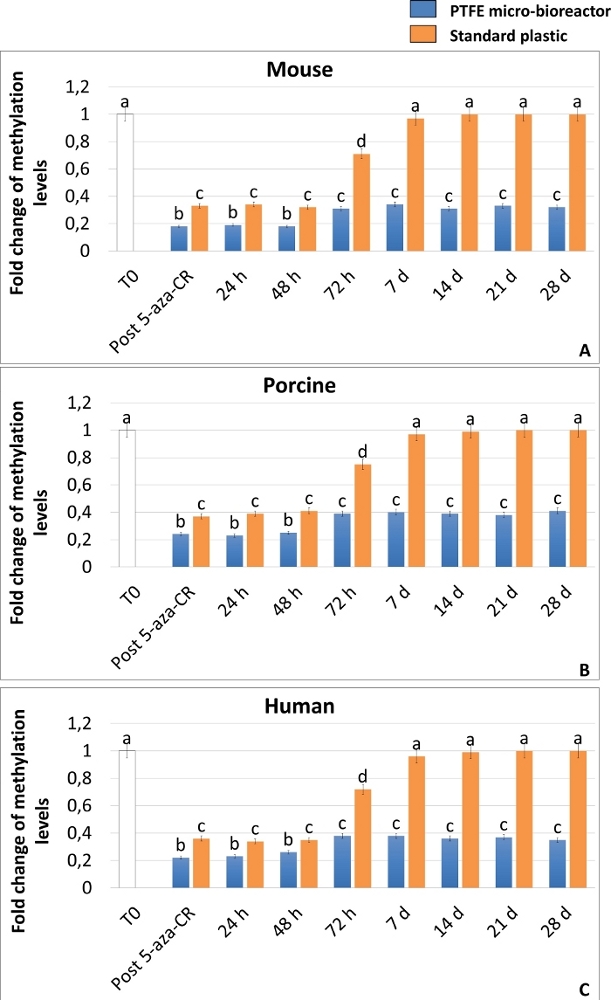
Figura 6: O micro-bioreator PTFE aumenta o efeito desmetilação de 5 aza-CR e mantém hipometilação de DNA a longo prazo em fibroblastos epigeneticamente apagados por mamíferos. Níveis globais de metilação de DNA de células murinas (A), suína (B) e humana (C) encapsuladas em micro-bioreatores PTFE (barras azuis) ou banhadas em plástico padrão (barras laranja) expostas a 5-aza-CR (Post 5-aza-CR) e cultivadas em meio ESC por 28 dias. Fibroblastos não tratados (T0; barras brancas). Os resultados representam a média ± SD de três experimentos independentes com cinco réplicas biológicas independentes. Diferentes sobrecritos denotam diferenças significativas (P < 0,05). Clique aqui para ver uma versão maior desta figura.
| Meio de isolamento do fibroblasto (100 mL) | |
| DMEM, alta glicose, piruvato | 77 mL |
| Soro bovino fetal, qualificado, inativado | 20 mL |
| Solução L-Glutamina | 1 mL |
| Solução antimicocética antimíctica de antibióticos (100×) | 2 mL |
| Meio de Cultura do Fibroblasto (100 mL) | |
| DMEM, alta glicose, piruvato | 88 mL |
| Soro bovino fetal, qualificado, inativado | 10 mL |
| Solução L-Glutamina | 1 mL |
| Solução antimicocética antimíctica de antibióticos (100×) | 1 mL |
| Meio de cultura ESC (10 mL) | |
| Mistura de nutrientes F-10 do presunto | 3,99 mL |
| DMEM, baixa glicose, piruvato | 3,99 mL |
| Substituição de soro knockout | 1 mL |
| Soro bovino fetal, qualificado, inativado | 500 μL |
| Solução antimicocética antimíctica de antibióticos (100×) | 100 μL |
| Solução L-Glutamina | 100 μL |
| Solução de aminoácidos não essenciais MEM (100X) | 100 μL |
| 2-Mercaptoetanol (10 mM) | 100 μL (0,1 mM) |
| Mistura nucleosídeo (0,3 M guanosine, 0,3 M de Adenosina, 0,3 M Cytidine, 0,3 M Uridine e 0,1 M Timidina) | 100 μL (3 mM Guanosine, 3 mM Adenosine, 3 mM Cytidine, 3 mM Uridine e 1 mM Timidina) |
| Proteína LIF de rato recombinante ESGRO (1000 unidades/mL) | 10 μL (1 unidade/mL) |
| Básico FGF humano recombinante (bFGF) (5 μg/mL) | 10 μL (5 ng/mL) |
Tabela 1: Composição do meio de isolamento do fibroblasto, meio de cultura fibroblasto e meio de cultura ESC.
| Alvo | Conjuntos de primer PCR | Espécie | |
| Cdh1 | Avante: GAGGAACCCACAGCCTCATA | Rato | |
| Reverso: GTTGACCGTCCCTTCACAGT | Rato | ||
| Epcam | Avante: TGGCAACAAGTTGCTCTCTG | Rato | |
| Reverso: CTTGTCGGCTTCGGACTC | Rato | ||
| Nanog | Avante: AGGCTGATTTGGTTGGTGTC | Rato | |
| Reverso: CCAGGAAGACCCACACTCAT | Rato | ||
| 4 de outubro | Avanço: ACACCTGGCTTCAGACTTCG | Rato | |
| Reverso: AGTTGCTTTCCACTCGTGCT | Rato | ||
| Rex1 | Avante: CAGGTTCTGGAAAGCGAGTTC | Rato | |
| Reverso: GACAAGCATGTGCTTCCTCA | Rato | ||
| Sox2 | Avante: AGAACCCCAAGATGCACAAC | Rato | |
| Reverso: CTCCGGGAAGCGTGTACTTA | Rato | ||
| Tet2 | Avante: GCAGGGAGCAAGAGATTC | Rato | |
| Reverso: ATGTTGACATTGCCAGTGGA | Rato | ||
| Teu1 | Forward: AACTCTTGGCACCATGAACC | Rato | |
| Reverso: GCACGTGCTTCCCTCTCTCT | Rato | ||
| CDH1 | Avante: GAATGACAATGGCCCCATAC | Porcino | |
| Reverso: AGGTGGACCTGGTCTTTTTG | Porcino | ||
| EPCAM | Avante: GCTTGGTCAGTGCCAGTGTA | Porcino | |
| Reverso: CTTCTGACCCCAGCAGTGTT | Porcino | ||
| NANOG | Avante: ATCCAGCTTGTCCCCAAAG | Porcino | |
| Reverso: ATTTCATTCGCTGGTTCTGG | Porcino | ||
| OCT4 | Avante: GTTCAGCCAAACGACCATCT | Porcino | |
| Reverso: CTCCAGGTTGCCTCTCACTCC | Porcino | ||
| REX1 | Avante: CTTCAAGGAGAGCGCAAAAC | Porcino | |
| Reverso: TGTCCCCAATCAAAAAAATGCT | Porcino | ||
| SOX2 | Avanço: GCCCTGCAGTACAACTCCAT | Porcino | |
| Reverso: GCTGATCATGTCCCGTAGGT | Porcino | ||
| TET2 | Avanço: CAGAAAACAATGCAGCCAGA | Porcino | |
| Reverso: GAATGGCTCGGTCTGAAG | Porcino | ||
| TEU1 | Avante: GGCATCGCTCTTGCTAAC | Porcino | |
| Reverso: GCTGGAGAAGTTGGTTCGAG | Porcino | ||
| CDH1 | Avante: TGCCCAGAAAATGAAAAAAAGG | Humano | |
| Reverso: GTGTATGGCAATGCGTTC | Humano | ||
| EPCAM | Avanço: GCTGGTGTGAACACTGCT | Humano | |
| Reverso: ACGCGTTGTGATCTCCCTCTCTCTCTCTCTCTCTCTCTCTCTCTCTCT | Humano | ||
| NANOG | AVante: AGAAAAAACTGGCCGAAG | Humano | |
| Reverso: TGCTCCAGGACTGGATGTTC | Humano | ||
| OCT4 | Forward: AATTTGCCAAGCTCCTGAAG | Humano | |
| Reverso: GTTGCCTCTCACTCGGTTCT | Humano | ||
| REX1 | Avanço: ACGTTTCGTGTGTCCCTTTCC | Humano | |
| Reverso: TATAACCGCTTGGGGTTTTG | Humano | ||
| SOX2 | Avante: ACACCAATCCCATCCACACT | Humano | |
| Reverso: GCAAACTCTGCAAAGCTC | Humano | ||
| TET2 | Avante: CCCACTTACCTGCGTTTCAT | Humano | |
| Reverso: ACTGTGACCTTTCCCCACTG | Humano | ||
| TEU1 | AVANTE: AGATCCCAGAACCATGAACC | Humano | |
| Reverso: GCACGTGTTTCTTTCTCA | Humano | ||
| Alvo | TaqMan ensaios número do catálogo | Espécie | |
| Actb | Mm02619580_g1 | Rato | |
| Cdh1 | Mm01247357_m1 | Rato | |
| Epcam | Mm00493214_m1 | Rato | |
| Gapdh | Mm99999915_g1 | Rato | |
| Nanog | Mm02019550_s1 | Rato | |
| 4 de outubro | Mm03053917_g1 | Rato | |
| Rex1 | Mm03053975_g1 | Rato | |
| Sox2 | Mm03053810_s1 | Rato | |
| Tet2 | Mm00524395_m1 | Rato | |
| Teu1 | Mm00493681_m1 | Rato | |
| ACTB | Ss03376563_uH | Porcino | |
| CDH1 | Ss06942341_m1 | Porcino | |
| EPCAM | Ss03384752_u1 | Porcino | |
| GAPDH | Ss03375629_u1 | Porcino | |
| NANOG | Ss04245375_s1 | Porcino | |
| OCT4 | Ss03389800_m1 | Porcino | |
| REX1 | Ss03373622_g1 | Porcino | |
| SOX2 | Ss03388002_u1 | Porcino | |
| TET2 | Ss06880359_m1 | Porcino | |
| TEU1 | Ss03376963_u1 | Porcino | |
| ACTB | Hs01060665_g1 | Humano | |
| CDH1 | Hs01023895_m1 | Humano | |
| EPCAM | Hs00901885_m1 | Humano | |
| GAPDH | Hs02786624_g1 | Humano | |
| NANOG | Hs02387400_g1 | Humano | |
| OCT4 | Hs00999632_g1 | Humano | |
| REX1 | Hs00399279_m1 | Humano | |
| SOX2 | Hs01053049_s1 | Humano | |
| TET2 | Hs00325999_m1 | Humano | |
| TEU1 | Hs00174816_m1 | Humano | |
Tabela 2: Informações do primer.
Discussão
Durante as últimas décadas, diversos estudos se concentraram no desenvolvimento de estratégias para reverter uma célula terminalmente diferenciada para um estado permissivo menos comprometido e maior. O protocolo aqui descrito permite a geração e manutenção a longo prazo de células pluripotentes a partir de células adultas maduras terminais diferenciadas. O método combina duas etapas independentes que envolvem a indução de um estado permissivo elevado que é alcançado através de apagamento epigenético químico e sua manutenção subsequente garantida usando um sistema de cultura 3D.
A formação de estruturas esferoides 3D observadas em células encapsuladas de PTFE (Figura 2) é consistente com outros estudos que demonstram a capacidade de PTFE de incentivar eficientemente a agregação celular, facilitando o estabelecimento de estruturas esferoides de células olfativas (OEC)25 ou a formação de agregados toroidal 3D26. Essas alterações morfológicas são paralelas ao início da expressão genética relacionada à pluripotency (Figura 3, Figura 4, Figura 5) que mostra níveis significativamente mais elevados em células 3D Post 5-aza-CR, quando comparadas às células 2D Post 5-aza-CR (Figura 3, Figura 4, Figura 5). Consistentemente, as células 3D Post 5-aza-CR exibem uma hipometilação de DNA maior do que as 2D Post 5-aza-CR (Figura 6). No geral, esses resultados indicam capacidade de 5 aza-CR para induzir um estado de alta plasticidade, independentemente do sistema de cultura celular utilizado. No entanto, o estado de pluripotência quimicamente induzido alcançado pelas células, é significativamente promovido usando um micro-bioreator PTFE que aumenta a transcrição genética da pluripotência e aumenta os efeitos de desmetilação de 5 aza-CR. Ainda mais interessante, apenas as células 3D Post 5-aza-CR mantêm a estrutura esférica 3D adquirida (Figura 2) e mantêm altos níveis de expressão de genes relacionados à pluripotência (Figura 3, Figura 4, Figura 5) bem como baixos níveis de metilação de DNA (Figura 6), durante todo o período subsequente de cultura. Ao todo, os resultados representativos aqui relatados demonstram que essa estratégia de duas etapas é altamente eficiente e robusta, e o uso de um micro-bioreparator PTFE não só aumenta a alta plasticidade, mas também permite sua manutenção estável e de longo prazo nas espécies de mamíferos consideradas. Recentemente demonstramos que esses efeitos benéficos estão relacionados com a ativação da via de sinalização de Hipopótamo e suas sugestõesrelacionadas à mecanotransdução 10, que foram anteriormente demonstradas ter um papel fundamental na regulação ativa da pluripotência celular 28,29,30.
As duas etapas mais críticas para um procedimento bem-sucedido são a rigorosa manutenção das células a 37 °C, em todos os momentos, incluindo seu manuseio sob o fluxo laminar estéril e o microscópio e o uso de uma taxa de volume celular/líquido correto durante a produção de micro-bioreatores, que pode variar de acordo com o tipo específico de célula utilizado. Em nossa experiência, também é altamente recomendável preparar reagentes recentemente, antes de seu uso na cultura (isso é absolutamente crucial para a solução de estoque de 5 aza-CR). Além disso, o refrescante médio deve ser realizado sob um estereoscópio, uma vez que os organoides esféricos 3D podem ser perdidos durante alterações médias.
Os principais pontos fortes deste método não são a exigência de vetor transgênico e/ou viral; a robustez e a reprodutibilidade em diferentes espécies de mamíferos; baixos custos; e alta flexibilidade para diferentes tipos de células. Por outro lado, uma possível limitação poderia ser representada pelo número restrito de dados obtidos, devido aos pequenos volumes dos microrepartores. Além disso, o uso de alta densidade celular pode causar baixas taxas de transferência de oxigênio e crescimento limitado na suspensão. Para superar esses problemas, continua sendo necessário um trabalho adicional em estratégias de escala e/ou de descida.
É importante ressaltar que os principais aspectos comuns a todas as aplicações baseadas em esferoide 3D são a reprodutibilidade, a eficiência de produção, a uniformidade do tamanho organoide e a influência na fisiologia celular. Essas características estão estritamente correlacionadas com as forças mecânicas geradas dentro do sistema de cultura e variam de acordo com os diferentes métodos utilizados. Por exemplo, organoides multicelulares podem ser cultivados usando pratos não aderentes em sistemas estacionários. Esta abordagem baseia-se principalmente em condições limitadas de difusão e, geralmente, resulta na formação de aglomerados agregados soltos. A técnica de queda de suspensão mostra a mesma limitação. De fato, a deposição da suspensão celular cai na parte inferior da tampa de um prato de cultura tecidual leva à criação de um ambiente de microgravidade que concentra células na interface líquido-ar livre, induzindo a geração de esferas multicelulares de baixa agregação. Uma possível alternativa é representada pela técnica de frasco rotador. No entanto, este método é altamente caro, pois requer quantidades elevadas de meio de cultura. Além disso, os organoides formados precisam ser transferidos para o sistema de cultura estacionária quando utilizados para caracterização ou outros testes in vitro. Todas essas questões podem ser superadas usando micro-bioreatores de mármore líquido. Na verdade, eles fornecem uma superfície líquida não aderente que combina as vantagens tanto de métodos estacionários quanto de fiação, induzindo uma rápida agregação celular e a geração de esferoides compactos. Em paralelo, o fundo côncavo, a forma esférica e o fluxo líquido interno de cada mármore permitem que as células se instalem na parte inferior do micro-bioreator, resultando na formação de organoides uniformes em tamanho e forma. Outra vantagem significativa no uso das bolinhas líquidas é representada pelas trocas de gás ideais que, graças à sua forma esférica, podem ocorrer através de toda a superfície.
Em conclusão, o protocolo aqui descrito permite uma geração eficiente e simples de células pluripotentes mamíferas. Uma vez que essa estratégia é livre de vetores virais e não envolve o uso de qualquer transfecção genética, é altamente promissora para aplicações de medicamentos translacionais e pode ser considerada um avanço na terapia celular específica do paciente. Além disso, o uso de sistemas de cultura micro-bioreatores 3D pode representar um avanço notável na tecnologia organoide de células-tronco e pode constituir um microambique vantajoso para a cultura de longo prazo de diferentes tipos de células, como ESCs, iPSCs e MSCs. Uma vantagem adicional é representada pelo pequeno volume que permite estudar o efeito da sinalização paracrina/autocrina do ambiente rico estabelecido dentro do microreparator.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado pela Fundação Carraresi e pelo MiND Foods Hub ID: 1176436. Todos os autores são membros do COST Action CA16119 In vitro 3D total cell guidance and fitness (CellFit).
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma-Aldrich | M7522 | Component of ESC medium |
| 5-Azacytidine | Sigma-Aldrich | A2385 | 5-aza-CR, for fibroblast epigenetic erasing |
| Adenosine | Sigma-Aldrich | A4036 | Component of nucleoside mix for ESC medium |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | Component of fibroblast and ESC media |
| CFX96 Real-Time PCR | Bio-Rad Laboratories | NA | Thermal cycler for quantitative PCR |
| Cytidine | Sigma-Aldrich | C4654 | Component of nucleoside mix for ESC medium |
| DMEM, high glucose, pyruvate | Thermo Fisher Scientific | 41966052 | For fibroblast isolation and culture medium |
| DMEM, low glucose, pyruvate | Thermo Fisher Scientific | 31885023 | For ESC medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D5652 | PBS; for biopsy and cell wash and for solution preparation |
| Dynabeads mRNA DIRECT Micro Purification Kit | Thermo Fisher Scientific | 61021 | mRNA estraction |
| ESGRO Recombinant Mouse LIF Protein | Sigma-Aldrich | ESG1106 | Component of ESC medium |
| Fetal Bovine Serum, qualified, heat inactivated | Thermo Fisher Scientific | 10500064 | Component of fibroblast and ESC media |
| FGF-Basic (AA10-155) Recombinant Human Protein | Thermo Fisher Scientific | PHG0024 | Component of ESC medium |
| Gelatin from porcine skin | Sigma-Aldrich | G1890 | For dish coating |
| GeneAmp PCR System 2700 | Applied Biosystems | NA | Thermal cycler for qualitative PCR |
| Global DNA Methylation ELISA Kit | CELL BIOLABS | STA-380 | Methylation study |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7801 | Qualitative PCR |
| Guanosine | Sigma-Aldrich | G6264 | Component of nucleoside mix for ESC medium |
| Ham's F-10 Nutrient Mix | Thermo Fisher Scientific | 31550031 | For ESC medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Component of ESC medium |
| KOVA glasstic slide 10 with grids | Hycor Biomedical | 87144 | For cell counting |
| Leica MZ APO Stereo Microscope | Leica | NA | For organoid observation |
| L-Glutamine solution | Sigma-Aldrich | G7513 | Component of fibroblast and ESC media |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140035 | Component of ESC medium |
| Millex-GS 0.22 µm pore filters | Millipore | SLGS033SB | For solution sterilization |
| M-MLV Reverse Transcriptase, RNase H Minus, Point Mutant | Promega | M3681 | mRNA reverse transcription |
| Multiskan FC Microplate Photometer | Thermo Fisher Scientific | 51119000 | For ELISA plate reading |
| Nikon Eclipse TE300 Inverted Phase Contrast Microscope | Nikon | NA | For cell observation |
| Perkin Elmer Thermal Cycler 480 | Perkin Elmer | NA | Thermal cycler for reverse transcription |
| Poly(tetrafluoroethylene) 1 μm particle size | Sigma-Aldrich | 430935 | For generating micro-bioreactor |
| PureLink Genomic DNA Mini Kit | Thermo Fisher Scientific | K182001 | Genomic DNA estraction |
| TaqMan Gene Expression Cells-to-CT Kit | Thermo Fisher Scientific | AM1728 | Quantitative PCR |
| Thymidine | Sigma-Aldrich | T1895 | Component of nucleoside mix for ESC medium |
| Tissue Culture Dish 100X20 mm, Standard | Sarstedt | 833902 | For fibroblast isolation |
| Tissue Culture Dish 35X10 mm, Standard | Sarstedt | 833900 | For Fibroblast isolation |
| Tissue Culture Dish 35X10 mm, Suspension | Sarstedt | 833900500 | Bacteriology petri dish for liquid marble culture |
| Tissue Culture Plate 96 Well,Standard,F | Sarstedt | 833924005 | For liquid marble culture |
| Trypsin-EDTA solution | Sigma-Aldrich | T3924 | For fibroblast dissociation |
| Tube 15ml, 120x17mm, PS | Sarstedt | 62553041 | For cell suspension centrifugation |
| Uridine | Sigma-Aldrich | U3003 | Component of nucleoside mix for ESC medium |
Referências
- Pennarossa, G., et al. Brief demethylation step allows the conversion of adult human skin fibroblasts into insulin-secreting cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), 8948-8953 (2013).
- Pennarossa, G., et al. Reprogramming of pig dermal fibroblast into insulin secreting cells by a brief exposure to 5-aza-cytidine. Stem Cell Reviews and Reports. 10 (1), 31-43 (2014).
- Brevini, T. A. L., et al. Morphological and molecular changes of human granulosa cells exposed to 5-azacytidine and addressed toward muscular differentiation. Stem Cell Reviews and Reports. 10 (5), 633-642 (2014).
- Mirakhori, F., Zeynali, B., Kiani, S., Baharvand, H. Brief azacytidine step allows the conversion of suspension human fibroblasts into neural progenitor-like cells. Cell Journal. 17 (1), 153-158 (2015).
- Tan, S. J., et al. Muscle tissue engineering and regeneration through epigenetic reprogramming and scaffold manipulation. Scientific Reports. 5, 16333 (2015).
- Brevini, T. A. L., Pennarossa, G., Acocella, F., Brizzola, S., Zenobi, A., Gandolfi, F. Epigenetic conversion of adult dog skin fibroblasts into insulin-secreting cells. Veterinary Journal. 211, 52-56 (2016).
- Chandrakanthan, V., et al. PDGF-AB and 5-Azacytidine induce conversion of somatic cells into tissue-regenerative multipotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 2306-2315 (2016).
- Manzoni, E. F. M., et al. 5-azacytidine affects TET2 and histone transcription and reshapes morphology of human skin fibroblasts. Scientific Reports. 6, 37017 (2016).
- Pennarossa, G., et al. Epigenetic erasing and pancreatic differentiation of dermal fibroblasts into insulin-producing cells are boosted by the use of low-stiffness substrate. Stem Cell reviews and reports. 14 (3), 398-411 (2018).
- Pennarossa, G., et al. Use of a PTFE micro-bioreactor to promote 3D cell rearrangement and maintain high plasticity in epigenetically erased fibroblasts. Stem Cell Reviews and Reports. 15 (1), 82-92 (2019).
- Constantinides, P. G., Jones, P. A., Gevers, W. Functional striated muscle cells from non-myoblast precursors following 5-azacytidine treatment. Nature. 267 (5609), 364-366 (1977).
- Taylor, S. M., Jones, P. A. Multiple new phenotypes induced in 10T1/2 and 3T3 cells treated with 5-azacytidine. Cell. 17 (4), 771-779 (1979).
- Taylor, S. M., Constantinides, P. A., Jones, P. A. 5-Azacytidine, DNA methylation, and differentiation. Current Topics in Microbiology and Immunology. 108, 115-127 (1984).
- Jones, P. A. Effects of 5-azacytidine and its 2'-deoxyderivative on cell differentiation and DNA methylation. Pharmacology & Therapeutics. 28 (1), 17-27 (1985).
- Palii, S. S., Van Emburgh, B. O., Sankpal, U. T., Brown, K. D., Robertson, K. D. DNA methylation inhibitor 5-Aza-2'-deoxycytidine induces reversible genome-wide DNA damage that is distinctly influenced by DNA methyltransferases 1 and 3B. Molecular and Cellular Biology. 28 (2), 752-771 (2008).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews. Molecular Cell Biology. 18 (12), 728 (2017).
- Matamoro-Vidal, A., Levayer, R. Multiple influences of mechanical forces on cell competition. Current Biology. 29 (15), 762-774 (2019).
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Research & Therapy. 3 (5), 41 (2012).
- Kumar, A., Placone, J. K., Engler, A. J. Understanding the extracellular forces that determine cell fate and maintenance. Development. 144 (23), 4261-4270 (2017).
- Bissell, M. J., Rizki, A., Mian, I. S. Tissue architecture: the ultimate regulator of breast epithelial function. Current Opinion in Cell Biology. 15 (6), 753-762 (2003).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. The Journal of Cell Biology. 129 (3), 591-603 (1995).
- Christman, J. K. 5-Azacytidine and 5-aza-2[prime]-deoxycytidine as inhibitors of DNA methylation: mechanistic studies and their implications for cancer therapy. Oncogene. 21, 5483-5495 (2002).
- Stresemann, C., Lyko, F. Modes of action of the DNA methyltransferase inhibitors azacytidine and decitabine. International Journal of Cancer. 123 (1), 8-13 (2008).
- Ledda, S., Idda, A., Kelly, J., Ariu, F., Bogliolo, L., Bebbere, D. A novel technique for in vitro maturation of sheep oocytes in a liquid marble microbioreactor. Journal of Assisted Reproduction and Genetics. 33 (4), 513-518 (2016).
- Vadivelu, R. K., et al. Generation of three-dimensional multiple spheroid model of olfactory ensheathing cells using floating liquid marbles. Scientific Reports. 5, 15083 (2015).
- Vadivelu, R. K., Kamble, H., Munaz, A., Nguyen, N. T. Liquid Marble as bioreactor for engineering three-dimensional toroid tissues. Scientific Reports. 7 (1), 12388 (2017).
- Vadivelu, R. K., Kamble, H., Munaz, A., Nguyen, N. T. Liquid Marbles as bioreactors for the study of three-dimensional cell interactions. Biomedical Microdevices. 19 (2), 31 (2017).
- Varelas, X., et al. TAZ controls Smad nucleocytoplasmic shuttling and regulates human embryonic stem-cell self-renewal. Nature Cell Biology. 10 (7), 837-848 (2008).
- Panciera, T., et al. Induction of Expandable Tissue-Specific Stem/Progenitor Cells through Transient Expression of YAP/TAZ. Cell Stem Cell. 19 (6), 725-737 (2016).
- Pennarossa, G., Paffoni, A., Ragni, G., Gandolfi, F., Brevini, T. A. L. Rho signaling-directed YAP/TAZ regulation encourages 3D spheroid colony formation and boosts plasticity of parthenogenetic stem cells. Advances in Experimental Medicine and Biology. 1237, 49-60 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados