Method Article
エピジェネティック修飾と生体力学的手がかりを組み合わせて哺乳類多能性細胞を生成する2段階戦略
要約
ここでは、化学的エピジェネティック消去と機械化関連の手がかりを組み合わせて、遺伝子トランスフェクションやレトロウイルスベクターを必要とせずに哺乳類の多能性細胞を効率的に生成する方法を紹介します。したがって、この戦略はトランスレーショナル医療にとって有望であり、幹細胞オルガノイド技術の顕著な進歩を表しています。
要約
細胞表現型は、各技術に固有の利点および制限を有する、異なる方法で逆転または改変することができる。ここでは、哺乳類の多能性細胞を生成するために、化学的エピジェネティック消去と機械化関連の手がかりを組み合わせた新しい戦略について説明します。主に 2 つの手順が必要です。第1のステップでは、成体成熟(末端分化)細胞をエピジェネティック消しゴム5-アザ-シチジンに曝露し、多能性状態に駆動する。プロトコルのこの部分は、細胞の運命と分化を制御するエピジェネティックなメカニズムの理解の高まりに基づいて開発され、エピジェネティック修飾剤を使用して細胞の分化状態を消去し、その後、一時的な高可塑性ウィンドウに駆動することを含む。
第2のステップでは、消去された細胞は、液体大理石としても知られるポリテトラフルオロエチレン(PTFE)マイクロバイオリアクターに封入され、3D細胞の再配列を促進し、獲得した高い可塑性を伸長および安定に維持する。PTFEは非反応性疎水性合成化合物であり、その使用は、従来の2D培養システムでは達成できない細胞微小環境の創出を可能にする。このシステムは、バイオメカノセンシング関連の手がかりを通じて多能性の維持を奨励し、促進する。
ここで説明する技術的手順は、成体体細胞における高い可塑性状態の誘導および維持を可能にするための単純な戦略である。このプロトコルは、試験したすべての哺乳動物種における可塑性の高い細胞の誘導を可能にした。遺伝子トランスフェクションの使用を伴わず、ウイルスベクターを含まないため、トランスレーショナルメディシンアプリケーションにとって顕著な技術的進歩を表す可能性があります。さらに、マイクロバイオリアクターシステムは、可塑性の高い細胞、すなわちESC、iPSC、エピジェネティックに消去された細胞およびMSCの長期培養を可能にする特定の微小環境をin vitroで再現することにより、幹細胞オルガノイド技術の顕著な進歩を提供する。
概要
過去数十年間、細胞の関与と分化に向けた一方向の進行という広く受け入れられている概念は完全に改訂されました。セルの仕様を逆転させることができ、最終分化したセルを、異なる方法を使用して、あまりコミットされず、より高い許容状態にプッシュできることが実証されています。
提案されているいくつかの方法の中で、最も有望な方法の1つは、いわゆる化学的に誘導された多能性に細胞を誘導するための化合物の使用を含む。このアプローチで使用される小分子は、成体成熟細胞のエピジェネティックなシグネチャーと相互作用および修飾することができ、トランスジェニックおよび/またはウイルスベクター1、2、3、4、5、6、7、8、9、10の必要性を回避することができる。.多数の研究が最近、高メチル化遺伝子の再活性化を誘導する特定の生化学的および生物学的刺激を提供することによって、細胞をある表現型から別の表現型に切り替えることが可能であることを示している11、12、13、14、15。これらの脱メチル化事象は、最終分化細胞を原始的前駆細胞、多能性または高可塑性/多能性細胞1、2、3、4、5、6、7、8、9、10に変換することを可能にする。
並行して、多くの研究は最近、機械化関連の手がかりの理解、より具体的には、機械的力を使用して細胞の可塑性および/または分化に直接影響を与える可能性に焦点を当てている16,17,18,19。実際、細胞外マトリックス(ECM)が細胞運命の制御において重要な役割を果たしていることが明確に実証されている。特に、ECMによって産生される生体力学的および生物物理学的シグナルは、分子機構およびシグナル伝達経路を直接調節し、細胞の挙動および機能に影響を及ぼす20、21。これらの最近のデータは、in vivo細胞微小環境をより厳密に模倣し、細胞挙動を駆動する機械的および物理的刺激を複製する新しい3D培養システムの開発への道を開いた。
ここでは、哺乳類の多能性細胞を生成するために、化学的エピジェネティック消去と機械化関連の手がかりの使用を組み合わせた2段階のプロトコルについて説明します。第1の工程では、細胞を脱メチル化分子5−アザ−シチジン(5−アザ−CR)と共にインキュベートする。この薬剤は、直接テン-イレブン転座2(TET2)媒介作用8,10およびDNAメチルトランスフェラーゼ(DNMT)22,23の間接阻害の併用効果を通じて、有意なグローバルDNA脱メチル化を誘導することができる。この工程は、多能性関連遺伝子発現のその後の再活性化を伴うエピジェネティックブロックの除去を誘導し、したがって、可塑性の高い細胞1、2、3、8、10、以下「エピジェネティック消去細胞」という。第2のステップでは、細胞は3D培養系に封入される。この目的のために、非反応性疎水性合成化合物ポリテトラフルオロエチレン(PTFE;粒径1μm)がマイクロバイオリアクターとして使用され、従来の2D培養システム10の使用によって達成不可能な細胞微小環境の創造を可能にする。PTFE粉末粒子は、細胞が再懸濁され、液体コアを支持表面から隔離する液体滴の表面に付着し、内部液体と周囲環境24との間のガス交換を可能にする。このようにして得られた「PTFEマイクロバイオリアクター」は、「液体大理石」とも呼ばれ、細胞同士の自由な相互作用を促し、3D細胞再構成25,26,27を促進し、バイオメカノセンシング関連の手がかり10を通じて獲得した高い可塑性状態を延長し、安定に維持する。
プロトコル
すべての研究は、ミラノ大学の倫理委員会によってレビューされ、承認されました。すべての動物実験は、米国国立衛生研究所(NIH)が発行した実験動物のケアと使用のためのガイドに従って実施されました。健康な成人からのヒト細胞単離は、ミラノのマッジョーレ・ポリクリニコの倫理委員会によって承認された。我々の研究におけるすべての方法は、承認されたガイドラインに従って実施された。
1. 皮膚線維芽細胞の単離
注:以下に記載するすべての手順は、マウス、ブタ、およびヒトを含む異なる哺乳動物種から単離された線維芽細胞に適用することができる。7週齢の雄マウスからマウス細胞を単離し、ブタ皮膚組織を地元の屠殺場で採取した。ヒト細胞は、書面によるインフォームドコンセントの後、成人患者から単離した。
- 1%ブタゼラチン溶液を調製する。
- ブタゼラチン0.1gの重さを量り、100mLの水に溶かす。ゼラチン溶液は、使用前にオートクレーブ処理で滅菌してください。
- 調製した溶液1.5mLを加えることによって0.1%ブタゼラチンで35mmシャーレをコーティングする。室温で2時間インキュベートする。
- 哺乳動物(マウス、ブタ、およびヒト)の皮膚生検を長さ約2〜5cm切断し、2%抗生物質抗真菌溶液を含むダルベッコリン酸緩衝生理食塩水(PBS)に入れる。使用時まで+ 4°Cで保存してください。
注:生検の収集は、確立されたガイドラインに従って、倫理委員会の承認を得て実施する必要があります。 - 採取した生検を2%抗生物質抗真菌溶液を含む新鮮な滅菌PBSで3回広範囲に洗浄する。
- 最後の洗浄から生検を収集し、滅菌された100mmのペトリ皿に入れる。滅菌メスを使用して、それらを約2mm3 サイズの断片に切断する。
- 2時間のインキュベーションの終わりに、35mmペトリ皿から過剰のゼラチン溶液を除去し(ステップ1.1.2に記載)、滅菌手術ピンセットを使用して、直ちに5〜6個の皮膚断片を各プレコーティング培養皿に入れる。
- 線維芽細胞分離培地(表1)の液滴をそれぞれに100μL加えて断片を湿潤させた。5%CO2 インキュベーター中で37°Cで培養する。
注:培地が蒸発するのを防ぐため、35 mmのペトリ皿を滅菌水を含む100 mm以上のペトリ皿の中に置きます。両方のペトリ皿をキャップするようにしてください。 - 24時間培養後、35mm培養シャーレ内の培地の量を確認する。必要に応じて、500 μLの線維芽細胞分離培地を加えて断片を濡らしておく。
- 培地を慎重に取り出し、ピペットを使用して培養の少なくとも2日ごとにそれをリフレッシュする。
- 線維芽細胞が35mmシャーレに置かれた皮膚断片から成長し始めると(ステップ1.5に記載)、細胞単層を形成し始める(通常6日間)。滅菌外科用ピンセットを用いて皮膚片を取り出し、2mLの線維芽細胞単離培地中で培養した。
- 細胞単層を5%CO2 インキュベーター内で37°Cで80%コンフルエントになるまで培養し続け、1日おきに培地をリフレッシュした。
線維芽細胞初代細胞株培養
- 線維芽細胞が80%コンフルエントに達したら、線維芽細胞単離培地を慎重に除去し、1%抗生物質抗真菌溶液を含むPBS3mLで細胞を3回洗浄する。
- 細胞剥離のために、培養皿に600 μLの0.25%トリプシン-EDTA溶液を加え、37°Cで3〜5分間インキュベートする。
- 5.4 mLの線維芽細胞培養培地を加え、細胞が培養皿から剥離し始めたときにトリプシンを中和した(表1)。
- 反復的かつ穏やかなピペッティングによって細胞を脱落させる。プレート細胞を新しい培養皿(ゼラチンなし)に入れ、継代比を1:2〜1:4(増殖速度に依存する)に保つ。
注:遠心分離は必要ありません。 - 培養中の細胞を維持し、それらが80%のコンフルエントに達するまで2日ごとに培地を交換し、それらを継代する。
注:線維芽細胞を週に2回増殖させ、活発な成長を維持します。
3. 5-アザ-CRへの線維芽細胞曝露
- 新鮮な1 mM 5-アザ-CRストック溶液を調製する。
- 2.44mgの5-アザ-CRの重量を量り、10mLのDMEM高グルコースに溶解する。渦巻きによって粉末を再懸濁させる。溶液を0.22μmフィルターで滅菌する。
注:5-aza-CRストック溶液は、使用直前に調製する必要があります。 - 5-aza-CRストック溶液(3.1.1.1.)を1 mLの線維芽細胞培養液で1 μL希釈して5-aza-CR作業溶液を調製する。
注:5-アザ-CR作動溶液の濃度は1μM 1,2,3,8,9である。
- 2.44mgの5-アザ-CRの重量を量り、10mLのDMEM高グルコースに溶解する。渦巻きによって粉末を再懸濁させる。溶液を0.22μmフィルターで滅菌する。
- 前述のように細胞をトリプシン処理し(2.1.-2.3.)、繰り返し穏やかにピペッティングすることによって細胞を取り除きます。
- 細胞懸濁液を収集し、円錐形のチューブに移す。
- 室温で光学顕微鏡下の計数チャンバを用いて細胞を計数する。細胞を再懸濁するのに必要な培地の体積を計算し、1 μM 5-aza-CRを添加した30 μLの線維芽細胞培養培地中の4 x 104 細胞を得た(ステップ3.1.2参照)。
メモ: 使用する式は、チャンバーの特定のタイプによって異なります。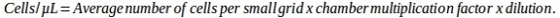
- 細胞懸濁液を室温で5分間150 x g で遠心分離する。上清を除去し、ペレットを1μM 5-aza-CRを添加した線維芽細胞培養培地で再懸濁した(ステップ3.1.2参照。使用する線維芽細胞培養液の容量については、工程3.4を参照されたい。
注:ネガティブコントロールとして、5-aza-CRを含まない線維芽細胞培養培地に同じ濃度の細胞を再懸濁し、PTFE粉末への細胞封入を進める(ステップ4.1.-4.13。
4. PTFEマイクロバイオリアクターにおける線維芽細胞のカプセル化
- 35mmのシャーレにポリテトラフルオロエチレン(PTFE)粉末を充填し、ベッドを製造した(図1A)。
注:液体大理石の付着を避けるために、35mmの細菌学ペトリ皿を使用してください。薄い疎水性および多孔質シェルを得るためには、平均粒径1μmのPTFE粉末を使用し、最大粉砕物2.0NPIRIで製造する。これにより、気体透過性の液体大理石の作成が可能になります。さらに、透光性コーティングは、リアルタイムでの細胞凝集プロセスの観察を容易にし、より大きな粒径は、蒸発の上昇、変形および球形の喪失、ならびにマイクロバイオリアクターの早期溶解を引き起こす可能性がある高い多分散性をもたらす。 - 4 x 104個の細胞 を含む 30 μL の単一液滴 (ステップ 3.4.-3.5 を参照) を粉末床に分注します (図 1B)。
- 35mmのシャーレを円運動で静かに回転させ、PFTE粉末が液体滴の表面を完全に覆うようにして、液体大理石のマイクロバイオリアクターを形成します(図1C)。
- 1,000 μLのピペットチップを使用して液体大理石マイクロバイオリアクターを拾い上げ、エッジで切断し、大理石の直径を収容する(図1D、E)。液体大理石のマイクロバイオリアクターを清潔な細菌学ペトリ皿にプレートして安定化させます(図1F)。
メモ: 先端の内側の大理石をつかむための摩擦を引き起こすには、液体大理石の直径よりわずかに小さい直径のピペットチップを切断します。 - 液体大理石マイクロバイオリアクターをペトリ皿から96ウェルプレート(1つの大理石/ウェル)に移します(図1G)。
- ウェルの縁から100μLの培地をゆっくりと加える。マイクロバイオリアクターは、培地の上に浮かび始めます(図1H)。
注:マイクロバイオリアクターは、PTFE疎水性の破壊のために、直接液体接触で壊れる。代替アプローチとして、液体大理石マイクロバイオリアクターを35mmの細菌学培養皿に個々に配置することができる。この場合、液体大理石の蒸発を防ぐために、マイクロバイオリアクターを含む35mmのシャーレを100mmのシャーレに挿入し、滅菌水で事前に割り振る必要があります。 - 液体大理石マイクロバイオリアクターを5%CO2インキュベーター1、2、3、8、9中で37°Cで18時間インキュベートする。
注:1μmのPTFE粒径は、内部液体と周辺環境との間の最適なガス交換を保証することができる。 - 5-aza-CRインキュベーションを18時間行った後、エッジで切断した1,000 μLのピペットチップを用いて液体大理石マイクロバイオリアクターを回収する(ステップ4.5参照)。
- マイクロバイオリアクターを新しい35mm細菌学ペトリ皿に入れる(図1D-F)。
- 針を使って液体大理石を穿刺し、それを壊す。
- 形成されたスフェロイドを200 μLのピペットチップで回収し、エッジで切断し、実体顕微鏡下で(図1I、J)。
注:PTFEに封入されたエピジェネティックに消去された細胞は、3D球状構造(各液体大理石に1つの凝集体)を形成する。 - 5-aza-CRに応答した多能性状態の獲得を評価するために、定性PCRにより、多能性関連遺伝子発現OCT4、NANOG、REX1、およびSOX2の発症を確認する(表2)。
- 以下で説明するように、プロトコルの 2 番目のステップに進みます。
5. エピジェネティック消去細胞のPTFEマイクロバイオリアクターでの培養
- 新鮮なESC培養液を調製する(表1)。
- オルガノイドを、5−アザ−CR残留物を洗浄するためのESC培地を含むシャーレに移す(ステップ5.1.〜5.2を参照されたい)。
- PTFEパウダーベッドを含む新しい35mm細菌学ペトリ皿を準備する(ステップ4.1も参照のこと)。
- 200 μL のピペットチップを使用して、30 μL の ESC 培養培地の液滴中の単一のオルガノイドを粉末床に分注し、端で切断します (ステップ 4.9 を参照。5.3.).
- 35mmのシャーレを円運動で静かに回転させて新しい液体大理石マイクロバイオリアクターを形成し、1,000μLのピペットチップを使用してそれを拾い上げ、端で切断し、新しく形成されたマイクロバイオリアクターを96ウェルプレート(1つの大理石/ウェル)のウェルに入れます(ステップ4.3.-4.6を参照)。
- マイクロバイオリアクターを浮かべるには、ウェルの縁から100μLの培地を加えて大理石をゆっくりと浸します(注4.7参照)。
- 培養液は大理石マイクロバイオリアクターで37°Cで、必要な限り5%CO2 インキュベーター内で培養する。5.3.-5.7で説明されている手順に従って、1日おきに培地を交換してください。
注:本原稿では、オルガノイドを28日間培養して得られた結果を提供する。ただし、必要に応じてより長い培養期間を行うことができる。
結果
本プロトコールは、成体体細胞から哺乳動物多能性細胞を生成しかつ安定に維持するために行われるべき全てのステップを記載する。この方法は、異なる哺乳動物種、すなわちマウス、ブタおよびヒトから単離された線維芽細胞で成功している。ここで報告される代表的な結果は、起源の種のそれぞれにかかわらず、すべての細胞株から得られている。
形態学的分析は、脱メチル化剤5-aza-CRとの18時間のインキュベーション後、PTFEマイクロバイオリアクター(3D Post 5-aza-CR)に封入された線維芽細胞が凝集し、考慮された3つの種すべてにおいて、均一なサイズの幾何学的形状を示す3D球状構造を形成したことを示している。(図2A-C、3Dポスト5-アザ-CR)。86.31±封入された細胞の4.13%がそれらの表現型を著しく改変し、典型的には高い可塑性表現型に関連する特徴を示す8。対照的に、2D標準条件に培養した後の5−aza−CR細胞は、典型的な線維芽細胞細長い形状を円形または楕円形のものに置き換えたが、より大きくかつ顆粒化した核を有するサイズにおいてかなり小さかった、単層分布を保持する(図2)。形態学的変化は、3Dおよび2Dポスト5-アザ-CR細胞の両方における多能性関連遺伝子発現の開始を伴った。POUクラス5ホメオボックス1(OCT4)、Nanogホメオボックス(NANOG)、ZFP42ジンクフィンガータンパク質(REX1)、および性決定領域Y-box 2(SOX2)についても転写が観察されたが、これは未処理線維芽細胞(T0)には存在しない、検出された(図3、図4、図5)。さらに、定量的PCR解析は、2D標準プラスチックディッシュ(2D Post 5-aza-CR)で培養した細胞(図3、図4、図5、青いバー)における上記の遺伝子、ならびに10-11の転座-2(TET2)、上皮細胞接着分子(EPCAM)、およびカドヘリン1(CDH1)遺伝子の有意なアップレギュレーションを実証した(図3、 図4、図5、オレンジ色のバー)。並行して、線維芽細胞特異的マーカーThy−1細胞表面抗原(THY1)の有意なダウンレギュレーションは、3Dおよび2Dポスト5−アザ−CR細胞において明確に検出可能であった(図3、図4、図5)。
高い可塑性状態の達成は、DNAグローバルメチル化のELISA分析によっても確認され、3Dおよび2Dポスト5-aza-CR細胞の両方におけるメチル化レベルの有意な減少を実証する(図6A-C)。さらに、遺伝子発現結果と一致して、DNAメチル化レベルは、2Dポスト5−アザ−CR細胞(図6のA−C、青色のバー)と比較して、3Dポスト5−アザ−CR細胞(図6のA−C、オレンジ色のバー)において有意に低かった。
さらに興味深いことに、3D Post 5-aza-CR細胞は、獲得した3D球状構造(図2A、3D 28d)を保持し、多能性関連遺伝子の高発現レベル(図3、図4、および図5の青いバー)ならびに低いDNAメチル化レベル(図6のA-C、青いバー)を、その後のすべての培養期間中、具体的には28日まで維持し、 文化が逮捕されたとき。対照的に、2D Postの5-aza-CR細胞は、脱メチル化剤による処理後に同じ多能性遺伝子について転写するが、7日目までにそのような発現を低下させた(図3、図4、図5、nd)。同様に、メチル化レベルの低下は、最初の72時間維持された。次いでメチル化はゆっくりと増加し、培養7日目までに未処理の線維芽細胞(図6のA−C、T0、白い棒)に匹敵するものに戻った(図6のA−C、オレンジ色の棒)。

図1:PTFEマイクロバイオリアクターでの細胞封入とオルガノイド回収。 (a)細菌学用シャーレにPTFEを充填し、粉末床を作製した。(b)細胞を含む培地の単一液滴をPTFE床の上に分注した。(C)シャーレを円運動で穏やかに回転させ、液滴をコーティングし、マイクロバイオリアクターを作製した。(D)1000μLのピペットチップを端(赤矢印)で切断し、(E)マイクロバイオリアクターを回収するために使用した。(F)液体大理石を清潔なペトリ皿に移して安定させ、(G)96ウェルプレート(1つの大理石/ウェル)に入れ、(H)媒体上に浮かべた。(i)新たに形成されたオルガノイドを採取するために、マイクロバイオリアクターを針で穿刺し、(J)得られた細胞凝集体を実体顕微鏡下で回収した。 この図の拡大版を表示するには、ここをクリックしてください。
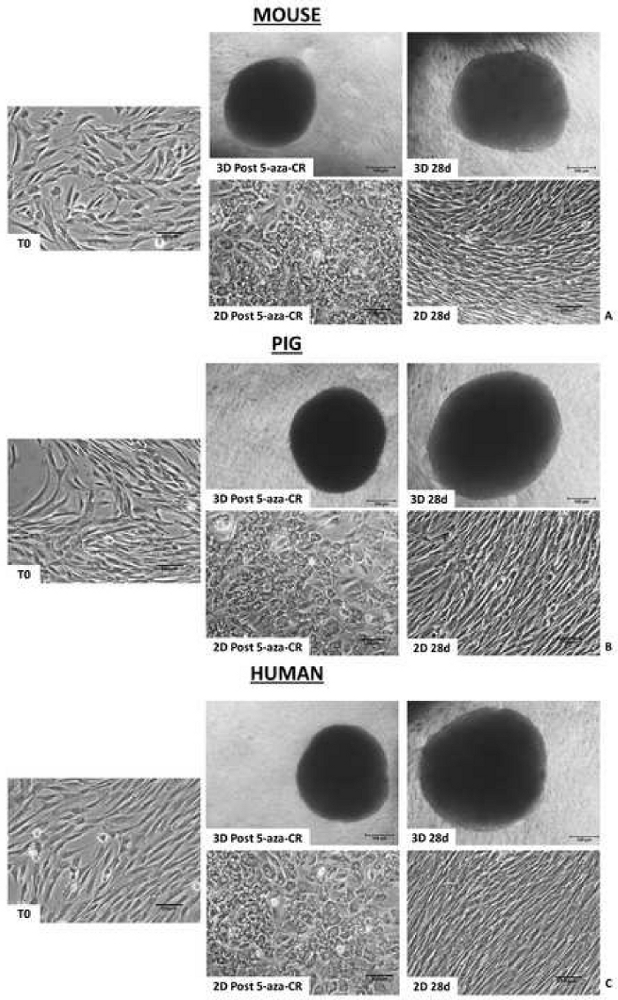
図2:PTFEマイクロバイオリアクターに封入された哺乳類のエピジェネティック消去細胞は、3D球状構造を形成する。 マウス(A)、ブタ(B)およびヒト(C)細胞をPTFEに封入し、5-aza-CR形態の3D球状構造(3D Post 5-aza-CR)で処理し、その後のすべての培養期間中安定に維持した(3D 28d;スケールバー、100μm)。対照的に、マウス(A)、ブタ(B)およびヒト(C)細胞をプラスチック皿に播種し、5−aza−CRで処理し、典型的な線維芽細胞細長い形状(T0)を丸い上皮表現型に置換し、単層分布(2D Post 5−aza−CR)を保持した。培養7日目までに、2D細胞は元の細長い形状に戻り、その後の培養期間にわたって安定に維持された(2D 28 d;スケールバー、100μm)。 この図の拡大版を表示するには、ここをクリックしてください。

図3:PTFEマイクロバイオリアクターに封入されたマウスのエピジェネティックに消去された細胞は、多能性関連遺伝子発現の高レベルかつ長期的維持を示す。 マウス未処理線維芽細胞(T0、白色バー)、5-aza-CRに曝露された線維芽細胞(ポスト5-アザ-CR)、およびPTFE封入(青色のバー)および標準的なプラスチックディッシュ(オレンジ色のバー)培養細胞におけるOct4、Nanog、Rex1、Sox2、Tet2、Epcam、Cdh1およびThy1遺伝子の転写レベル。 遺伝子発現値は、最高発現を1に設定し、これに関連する他のすべての発現で報告されます。異なる上付き文字は有意差を示す(P<0.05)。この図の拡大版を表示するには、ここをクリックしてください。
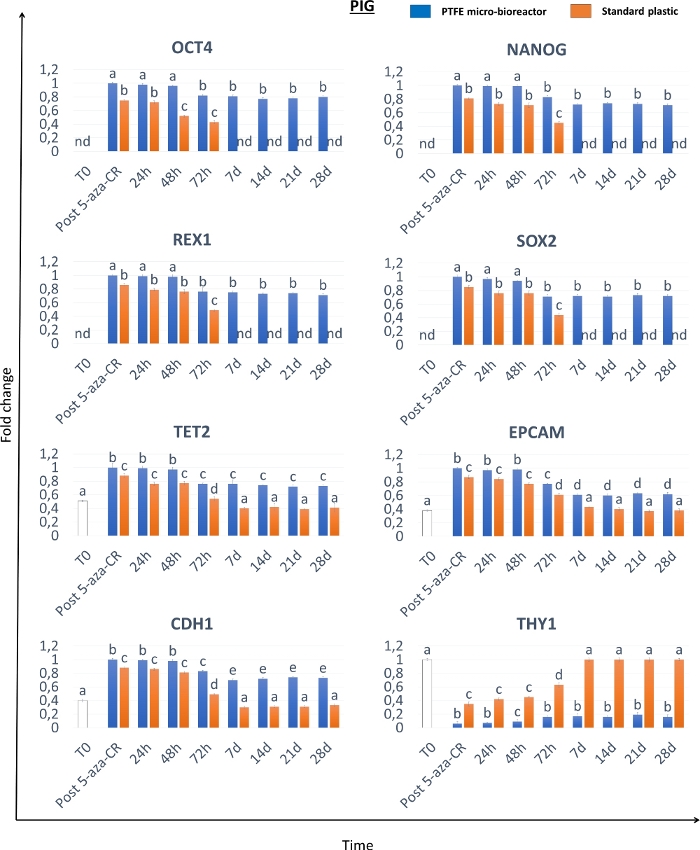
図4:PTFEマイクロバイオリアクターに封入されたブタエピジェネティックに消去された細胞は、多能性関連遺伝子発現の高レベルかつ長期的維持を示す。 ブタ未処理の線維芽細胞(T0、白色バー)、5-aza-CRに曝露された線維芽細胞(ポスト5-アザ-CR)、およびPTFE封入(青色のバー)および標準的なプラスチックディッシュ(オレンジ色のバー)培養細胞におけるOCT4、NANOG、REX1、SOX2、TET2、EPCAM、CDH1およびTHY1遺伝子の転写レベル。遺伝子発現値は、最高発現を1に設定し、これに関連する他のすべての発現で報告されます。異なる上付き文字は有意差を示す(P<0.05)。 この図の拡大版を表示するには、ここをクリックしてください。

図5:PTFEマイクロバイオリアクターに封入されたヒトエピジェネティック消去細胞は、多能性関連遺伝子発現の高レベルかつ長期的維持を示す。 ヒト未処理線維芽細胞(T0、白色バー)、5-aza-CRに曝露された線維芽細胞(ポスト5-アザ-CR)、およびPTFE封入(青色のバー)および標準的なプラスチックディッシュ(オレンジ色のバー)培養細胞におけるOCT4、NANOG、REX1、SOX2、TET2、EPCAM、CDH1およびTHY1遺伝子の転写レベル。遺伝子発現値は、最高発現を1に設定し、これに関連する他のすべての発現で報告されます。異なる上付き文字は有意差を示す(P<0.05)。 この図の拡大版を表示するには、ここをクリックしてください。
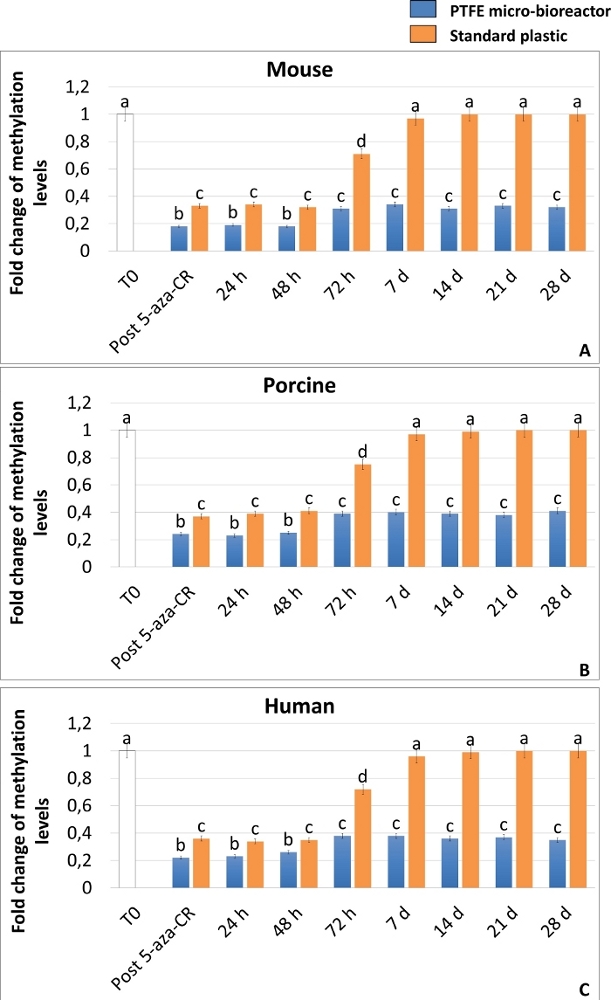
図6:PTFEマイクロバイオリアクターは、5-アザCR脱メチル化効果を高め、哺乳類のエピジェネティックに消去された線維芽細胞においてDNA低メチル化を長期間維持する。 マウス(A)、ブタ(B)およびヒト(C)細胞のグローバルDNAメチル化レベルをPTFEマイクロバイオリアクター(青色のバー)に封入するか、または標準的なプラスチック(オレンジ色のバー)に播種し、5-aza-CR(ポスト5-アザ-CR)に曝露し、ESC培地中で28日間培養した。未処理の線維芽細胞(T0;白いバー)。結果は、5つの独立した生物学的反復±持つ3つの独立した実験の平均SDを表す。異なる上付き文字は有意差を示す(P<0.05)。 この図の拡大版を表示するには、ここをクリックしてください。
| 線維芽細胞分離培地 (100 mL) | |
| DMEM、高グルコース、ピルビン酸 | 77キロリットル |
| ウシ胎児血清、認定済み、熱不活性化 | 20 ミリリットル |
| L-グルタミン溶液 | 1キロリットル |
| 抗生物質抗真菌剤溶液 (100×) | 2キロリットル |
| 線維芽細胞培養培地(100mL) | |
| DMEM、高グルコース、ピルビン酸 | 88キロバイト |
| ウシ胎児血清、認定済み、熱不活性化 | 10ミリリットル |
| L-グルタミン溶液 | 1キロリットル |
| 抗生物質抗真菌剤溶液 (100×) | 1キロリットル |
| ESC 培養培地 (10 mL) | |
| ハムのF-10ニュートリエントミックス | 3,99キログラム |
| DMEM, 低グルコース, ピルビン酸 | 3,99キログラム |
| ノックアウト血清置換術 | 1キロリットル |
| ウシ胎児血清、認定済み、熱不活性化 | 500 μL |
| 抗生物質抗真菌剤溶液 (100×) | 100 μL |
| L-グルタミン溶液 | 100 μL |
| MEM非必須アミノ酸溶液(100X) | 100 μL |
| 2-メルカプトエタノール (10 mM) | 100 μL (0.1 mM) |
| ヌクレオシドミックス(0.3 M グアノシン、0.3 M アデノシン、0.3 M シチジン、0.3 M ウリジンおよび 0.1 M チミジン) | 100 μL (3 mM グアノシン、3 mM アデノシン、3 mM シチジン、3 mM ウリジンおよび 1 mM チミジン) |
| ESGRO組換えマウスLIFタンパク質(1000単位/mL) | 10 μL (1 単位/mL) |
| 組換えヒトFGFベーシック(bFGF)(5μg/mL) | 10 μL (5 ng/mL) |
表1:線維芽細胞分離培地、線維芽細胞培養培地及びESC培地の組成。
| ターゲット | PCR プライマーセット | 種 | |
| ティッカー | フォワード: GAGGAACCCACAGCCTCATA | 鼠 | |
| Reverse: GTTGACCGTCCCTTCACAGT | 鼠 | ||
| エプカム | Forward: TGGCAACAAGTTGCTCTCTG | 鼠 | |
| 逆: CTTGTCGGTTCTTCGGACTC | 鼠 | ||
| ナノグ | フォワード: AGGCTGATTTGGTTGGTC | 鼠 | |
| リバース: CCAGGAAGACCCACACTCAT | 鼠 | ||
| 10月4日 | フォワード: ACACCTGGCTTCAGACTTCG | 鼠 | |
| Reverse: AGTTGCTTTCCACTCGTGCT | 鼠 | ||
| レックス1 | フォワード: CAGGTTCTGGAAGCGAGTTC | 鼠 | |
| Reverse: GACAAGCATGTGCTTCCTCA | 鼠 | ||
| ソックス2 | フォワード: アガアッッカガトガトカカアク | 鼠 | |
| Reverse: CTCCGGGAAGCGTGTACTTA | 鼠 | ||
| テット2 | フォワード: GCACAGGGAGCAAGAGATTC | 鼠 | |
| リバース: ATGTTGACATTGCCAGTGGA | 鼠 | ||
| 汝1 | フォワード: AACTCTTGGCACCATGAACC | 鼠 | |
| Reverse: GCACGTGCTTCCTCTCTTCTCT | 鼠 | ||
| ティッカー | フォワード: GAATGACAATGGCCCCATAC | ブタ | |
| Reverse: AGGTGGTCACCTGGTCTTTG | ブタ | ||
| エプカム | フォワード: GCTTGGTCAGTGCCAGTA | ブタ | |
| Reverse: CTTCTGACCCCAGCAGTT | ブタ | ||
| ナノグラム | フォワード: ATCCAGCTTGTCCCCAAAG | ブタ | |
| Reverse: ATTTCATTCGCTGGTTCTGG | ブタ | ||
| 10月4日 | フォワード: GTTCAGCCAAACGACCATCT | ブタ | |
| Reverse: CTCCAGGTTGCCTCTCACTC | ブタ | ||
| レックス1 | 転送: CTTCAAGGAGAGCGCAAAAC | ブタ | |
| Reverse: TGTCCCCAATCAAAAAATGCT | ブタ | ||
| ソックス2 | フォワード: GCCCTGCAGTACAACTCCAT | ブタ | |
| 逆: GCTGATCATGTCCCGTAGGT | ブタ | ||
| ティット2 | フォワード: CAGAAAACAATGCAGCCAGA | ブタ | |
| Reverse: GAATGGCTCGGTCTCTGAAG | ブタ | ||
| ティ1 | フォワード: GGCATCGCTCTCTTGCTAAC | ブタ | |
| Reverse: GCTGGAGAAGTTGGTTCGAG | ブタ | ||
| ティッカー | フォワード: TGCCCAGAAAATGAAAAAAAGG | 人間 | |
| Reverse: GTGTATGTGGCAATGCGTTC | 人間 | ||
| エプカム | Forward: GCTGGTGTGTGAACACTGCT | 人間 | |
| Reverse: ACGCGTTGTGATCTCCTTCT | 人間 | ||
| ナノグラム | フォワード: AGAAAAAAACAACTGGCCGAAG | 人間 | |
| Reverse: TGCTCCAGGACTGGATGTTC | 人間 | ||
| 10月4日 | フォワード: AATTTGCCAAGCTCCTGAAG | 人間 | |
| Reverse: GTTGCCTCTCACTCGGTTCT | 人間 | ||
| レックス1 | フォワード: ACGTTTCGTGTGTCCCTTTC | 人間 | |
| Reverse: TATAACCGCTTTTGGGGTTG | 人間 | ||
| ソックス2 | フォワード: アカッカアトッカッカクト | 人間 | |
| Reverse: GCAAACTTCCTGCAAAGCTC | 人間 | ||
| ティット2 | フォワード: CCCACTTACCTGCGTTTCAT | 人間 | |
| Reverse: ACTGTGACCTTTCCCCACTG | 人間 | ||
| ティ1 | フォワード: アガッチカガアッカトガアッ | 人間 | |
| Reverse: GCACGTGCTTCTTTTTCTCA | 人間 | ||
| ターゲット | TaqMan Assays カタログ番号 | 種 | |
| アクトブ | Mm02619580_g1 | 鼠 | |
| ティッカー | Mm01247357_m1 | 鼠 | |
| エプカム | Mm00493214_m1 | 鼠 | |
| ガプド | Mm99999915_g1 | 鼠 | |
| ナノグ | Mm02019550_s1 | 鼠 | |
| 10月4日 | Mm03053917_g1 | 鼠 | |
| レックス1 | Mm03053975_g1 | 鼠 | |
| ソックス2 | Mm03053810_s1 | 鼠 | |
| テット2 | Mm00524395_m1 | 鼠 | |
| 汝1 | Mm00493681_m1 | 鼠 | |
| ティッカー | Ss03376563_uH | ブタ | |
| ティッカー | Ss06942341_m1 | ブタ | |
| エプカム | Ss03384752_u1 | ブタ | |
| ガプド | Ss03375629_u1 | ブタ | |
| ナノグラム | Ss04245375_s1 | ブタ | |
| 10月4日 | Ss03389800_m1 | ブタ | |
| レックス1 | Ss03373622_g1 | ブタ | |
| ソックス2 | Ss03388002_u1 | ブタ | |
| ティット2 | Ss06880359_m1 | ブタ | |
| ティ1 | Ss03376963_u1 | ブタ | |
| ティッカー | Hs01060665_g1 | 人間 | |
| ティッカー | Hs01023895_m1 | 人間 | |
| エプカム | Hs00901885_m1 | 人間 | |
| ガプド | Hs02786624_g1 | 人間 | |
| ナノグラム | Hs02387400_g1 | 人間 | |
| 10月4日 | Hs00999632_g1 | 人間 | |
| レックス1 | Hs00399279_m1 | 人間 | |
| ソックス2 | Hs01053049_s1 | 人間 | |
| ティット2 | Hs00325999_m1 | 人間 | |
| ティ1 | Hs00174816_m1 | 人間 | |
表2:プライマー情報。
ディスカッション
過去数十年間、いくつかの研究は、終末分化した細胞をあまりコミットされておらず、より高い許容状態に戻すための戦略の開発に焦点を当てていました。ここに記載されるプロトコルは、成体成熟末端分化細胞から始まる多能性細胞の生成および長期維持を可能にする。この方法は、化学的エピジェネティック消去およびその後の3D培養システムを使用して保証されるその維持によって達成される高い許容状態の誘導を含む2つの独立したステップを組み合わせる。
PTFE内包細胞で観察された3Dスフェロイド構造の形成(図2)は、細胞凝集を効率的に促進するPTFEの能力を実証する他の研究と一致し、嗅覚被覆細胞(OEC)スフェロイド構造25の確立または3Dトロイダル凝集体26の形成を促進する。これらの形態学的変化は、多能性関連遺伝子発現の発症(図3、図4、図5)と平行しており、2D後5-aza-CR細胞(図3、図4、図5)と比較すると、3D Post 5-aza-CR細胞において有意に高いレベルを示す。一貫して、3Dポスト5-アザ-CR細胞は、2Dポスト5-アザ-CR細胞よりも高いDNA低メチル化を示す(図6)。全体として、これらの結果は、使用される細胞培養系にかかわらず、高い可塑性状態を誘導する5−aza−CR能力を示す。しかし、細胞によって達成される化学的に誘導された多能性状態は、多能性遺伝子転写をブーストし、5-アザ-CR脱メチル化効果を増加させるPTFEマイクロバイオリアクターを用いて有意に促進される。さらに興味深いことに、3D Post 5-aza-CR細胞のみが、その後の培養期間中、獲得した3D球状構造を安定に保持し(図2)、多能性関連遺伝子の高発現レベル(図3、図4、図5)および低いDNAメチル化レベル(図6)を維持します。全体として、ここで報告された代表的な結果は、この2段階戦略が非常に効率的で堅牢であり、PTFEマイクロバイオリアクターの使用は、高い可塑性を高めるだけでなく、考慮された哺乳類種におけるその安定した長期的な維持を可能にすることを実証する。我々は最近、これらの有益な効果が、カバシグナル伝達経路の活性化およびそのメカノトランスダクション関連の手がかり10に関連していることを実証し、細胞多能性の能動的調節において重要な役割を果たすことが以前に示されている28、29、30。
手順を成功させるための2つの最も重要なステップは、滅菌層流および顕微鏡下での取り扱い、およびマイクロバイオリアクター製造中の正しい細胞数/液体体積速度の使用を含む、常に37°Cでの細胞の厳格な維持であり、使用される特定の細胞タイプに応じて異なる可能性がある。私たちの経験では、培養に使用する前に試薬を新しく調製することも強くお勧めします(これは5-aza-CRストックソリューションにとって非常に重要です)。さらに、培地交換中に3D球状オルガノイドが失われる可能性があるため、培地リフレッシュは実体顕微鏡下で行わなければならない。
この方法の主な強みは、トランスジェニックおよび/またはウイルスベクターの要件がないことです。異なる哺乳類種における堅牢性と再現性。低コスト;異なる細胞タイプに対する高い柔軟性。一方、可能な制限は、マイクロバイオリアクターの容量が少ないため、得られるデータの数が制限されていることによって表すことができる。さらに、高い細胞密度の使用は、低い酸素移動速度および懸濁液中での限られた増殖を引き起こす可能性がある。これらの問題を克服するためには、スケールアップ及び/又はスケールダウン戦略に関する更なる作業が引き続き必要である。
すべての3Dスフェロイドベースのアプリケーションに共通する重要な側面は、再現性、生産効率、オルガノイドサイズの均一性、および細胞生理機能への影響であることを強調することが重要です。これらの特徴は、培養システム内で生成される機械的力と厳密に相関しており、使用されるさまざまな方法に応じて変化する。例えば、多細胞オルガノイドは、静止系において非付着性皿を用いて培養することができる。このアプローチは、主に拡散制限条件に基づいており、通常、緩やかに凝集したクラスターの形成をもたらす。ハンギングドロップ技術も同じ制限を示しています。実際、細胞懸濁液の沈着は、組織培養皿の蓋の下側に落下し、自由液体 - 空気界面で細胞を濃縮する微小重力環境の作成をもたらし、低凝集多細胞スフェアの生成を誘導する。可能な代替案は、スピナーフラスコ技術によって表される。しかしながら、この方法は、高い量の培養培地を必要とするため、非常に高価である。さらに、形成されたオルガノイドは、特性評価またはさらなるインビトロ試験に使用される場合、静置培養系に移す必要がある。これらの問題はすべて、液体大理石のマイクロバイオリアクターを使用することで克服できます。実際、それらは、固定法と紡糸法の両方の利点を兼ね備えた非接着性液体表面を提供し、迅速な細胞凝集および コンパクトな回転楕円体の生成を誘導する。並行して、凹状の底部、球状、および各大理石の内部液体流は、細胞がマイクロバイオリアクターの底部に沈降することを可能にし、サイズおよび形状が均一なオルガノイドの形成をもたらす。液体大理石の使用におけるもう一つの重要な利点は、それらの球形のおかげで、表面全体を通して起こり得る最適なガス交換によって表される。
結論として、ここで記載されるプロトコルは、哺乳動物多能性細胞の効率的かつ単純な生成を可能にする。この戦略はウイルスベクターフリーであり、いかなる遺伝子トランスフェクションも伴わないため、トランスレーショナル・メディシンの応用に非常に有望であり、患者特異的細胞療法における一歩前進と見なすことができます。さらに、3Dマイクロバイオリアクター培養システムの使用は、幹細胞オルガノイド技術における顕著なブレークスルーを表し、ESC、iPSC、およびMSCなどの異なる細胞タイプの長期培養に有利なマイクロ環境を構成し得る。さらなる利点は、マイクロバイオリアクター内に確立された豊富な環境のパラクリン/オートクリンシグナル伝達の効果を研究することを可能にする小さな体積によって表される。
開示事項
著者らは開示するものは何もありません。
謝辞
この研究は、Carraresi FoundationとMiND FoodS Hub ID:1176436から資金提供を受けました。著者らは全員、COST Action CA16119 In vitro 3-D Total cell guidance and fit(CellFit)のメンバーである。
資料
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma-Aldrich | M7522 | Component of ESC medium |
| 5-Azacytidine | Sigma-Aldrich | A2385 | 5-aza-CR, for fibroblast epigenetic erasing |
| Adenosine | Sigma-Aldrich | A4036 | Component of nucleoside mix for ESC medium |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | Component of fibroblast and ESC media |
| CFX96 Real-Time PCR | Bio-Rad Laboratories | NA | Thermal cycler for quantitative PCR |
| Cytidine | Sigma-Aldrich | C4654 | Component of nucleoside mix for ESC medium |
| DMEM, high glucose, pyruvate | Thermo Fisher Scientific | 41966052 | For fibroblast isolation and culture medium |
| DMEM, low glucose, pyruvate | Thermo Fisher Scientific | 31885023 | For ESC medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D5652 | PBS; for biopsy and cell wash and for solution preparation |
| Dynabeads mRNA DIRECT Micro Purification Kit | Thermo Fisher Scientific | 61021 | mRNA estraction |
| ESGRO Recombinant Mouse LIF Protein | Sigma-Aldrich | ESG1106 | Component of ESC medium |
| Fetal Bovine Serum, qualified, heat inactivated | Thermo Fisher Scientific | 10500064 | Component of fibroblast and ESC media |
| FGF-Basic (AA10-155) Recombinant Human Protein | Thermo Fisher Scientific | PHG0024 | Component of ESC medium |
| Gelatin from porcine skin | Sigma-Aldrich | G1890 | For dish coating |
| GeneAmp PCR System 2700 | Applied Biosystems | NA | Thermal cycler for qualitative PCR |
| Global DNA Methylation ELISA Kit | CELL BIOLABS | STA-380 | Methylation study |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7801 | Qualitative PCR |
| Guanosine | Sigma-Aldrich | G6264 | Component of nucleoside mix for ESC medium |
| Ham's F-10 Nutrient Mix | Thermo Fisher Scientific | 31550031 | For ESC medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Component of ESC medium |
| KOVA glasstic slide 10 with grids | Hycor Biomedical | 87144 | For cell counting |
| Leica MZ APO Stereo Microscope | Leica | NA | For organoid observation |
| L-Glutamine solution | Sigma-Aldrich | G7513 | Component of fibroblast and ESC media |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140035 | Component of ESC medium |
| Millex-GS 0.22 µm pore filters | Millipore | SLGS033SB | For solution sterilization |
| M-MLV Reverse Transcriptase, RNase H Minus, Point Mutant | Promega | M3681 | mRNA reverse transcription |
| Multiskan FC Microplate Photometer | Thermo Fisher Scientific | 51119000 | For ELISA plate reading |
| Nikon Eclipse TE300 Inverted Phase Contrast Microscope | Nikon | NA | For cell observation |
| Perkin Elmer Thermal Cycler 480 | Perkin Elmer | NA | Thermal cycler for reverse transcription |
| Poly(tetrafluoroethylene) 1 μm particle size | Sigma-Aldrich | 430935 | For generating micro-bioreactor |
| PureLink Genomic DNA Mini Kit | Thermo Fisher Scientific | K182001 | Genomic DNA estraction |
| TaqMan Gene Expression Cells-to-CT Kit | Thermo Fisher Scientific | AM1728 | Quantitative PCR |
| Thymidine | Sigma-Aldrich | T1895 | Component of nucleoside mix for ESC medium |
| Tissue Culture Dish 100X20 mm, Standard | Sarstedt | 833902 | For fibroblast isolation |
| Tissue Culture Dish 35X10 mm, Standard | Sarstedt | 833900 | For Fibroblast isolation |
| Tissue Culture Dish 35X10 mm, Suspension | Sarstedt | 833900500 | Bacteriology petri dish for liquid marble culture |
| Tissue Culture Plate 96 Well,Standard,F | Sarstedt | 833924005 | For liquid marble culture |
| Trypsin-EDTA solution | Sigma-Aldrich | T3924 | For fibroblast dissociation |
| Tube 15ml, 120x17mm, PS | Sarstedt | 62553041 | For cell suspension centrifugation |
| Uridine | Sigma-Aldrich | U3003 | Component of nucleoside mix for ESC medium |
参考文献
- Pennarossa, G., et al. Brief demethylation step allows the conversion of adult human skin fibroblasts into insulin-secreting cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), 8948-8953 (2013).
- Pennarossa, G., et al. Reprogramming of pig dermal fibroblast into insulin secreting cells by a brief exposure to 5-aza-cytidine. Stem Cell Reviews and Reports. 10 (1), 31-43 (2014).
- Brevini, T. A. L., et al. Morphological and molecular changes of human granulosa cells exposed to 5-azacytidine and addressed toward muscular differentiation. Stem Cell Reviews and Reports. 10 (5), 633-642 (2014).
- Mirakhori, F., Zeynali, B., Kiani, S., Baharvand, H. Brief azacytidine step allows the conversion of suspension human fibroblasts into neural progenitor-like cells. Cell Journal. 17 (1), 153-158 (2015).
- Tan, S. J., et al. Muscle tissue engineering and regeneration through epigenetic reprogramming and scaffold manipulation. Scientific Reports. 5, 16333 (2015).
- Brevini, T. A. L., Pennarossa, G., Acocella, F., Brizzola, S., Zenobi, A., Gandolfi, F. Epigenetic conversion of adult dog skin fibroblasts into insulin-secreting cells. Veterinary Journal. 211, 52-56 (2016).
- Chandrakanthan, V., et al. PDGF-AB and 5-Azacytidine induce conversion of somatic cells into tissue-regenerative multipotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 2306-2315 (2016).
- Manzoni, E. F. M., et al. 5-azacytidine affects TET2 and histone transcription and reshapes morphology of human skin fibroblasts. Scientific Reports. 6, 37017 (2016).
- Pennarossa, G., et al. Epigenetic erasing and pancreatic differentiation of dermal fibroblasts into insulin-producing cells are boosted by the use of low-stiffness substrate. Stem Cell reviews and reports. 14 (3), 398-411 (2018).
- Pennarossa, G., et al. Use of a PTFE micro-bioreactor to promote 3D cell rearrangement and maintain high plasticity in epigenetically erased fibroblasts. Stem Cell Reviews and Reports. 15 (1), 82-92 (2019).
- Constantinides, P. G., Jones, P. A., Gevers, W. Functional striated muscle cells from non-myoblast precursors following 5-azacytidine treatment. Nature. 267 (5609), 364-366 (1977).
- Taylor, S. M., Jones, P. A. Multiple new phenotypes induced in 10T1/2 and 3T3 cells treated with 5-azacytidine. Cell. 17 (4), 771-779 (1979).
- Taylor, S. M., Constantinides, P. A., Jones, P. A. 5-Azacytidine, DNA methylation, and differentiation. Current Topics in Microbiology and Immunology. 108, 115-127 (1984).
- Jones, P. A. Effects of 5-azacytidine and its 2'-deoxyderivative on cell differentiation and DNA methylation. Pharmacology & Therapeutics. 28 (1), 17-27 (1985).
- Palii, S. S., Van Emburgh, B. O., Sankpal, U. T., Brown, K. D., Robertson, K. D. DNA methylation inhibitor 5-Aza-2'-deoxycytidine induces reversible genome-wide DNA damage that is distinctly influenced by DNA methyltransferases 1 and 3B. Molecular and Cellular Biology. 28 (2), 752-771 (2008).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews. Molecular Cell Biology. 18 (12), 728 (2017).
- Matamoro-Vidal, A., Levayer, R. Multiple influences of mechanical forces on cell competition. Current Biology. 29 (15), 762-774 (2019).
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Research & Therapy. 3 (5), 41 (2012).
- Kumar, A., Placone, J. K., Engler, A. J. Understanding the extracellular forces that determine cell fate and maintenance. Development. 144 (23), 4261-4270 (2017).
- Bissell, M. J., Rizki, A., Mian, I. S. Tissue architecture: the ultimate regulator of breast epithelial function. Current Opinion in Cell Biology. 15 (6), 753-762 (2003).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. The Journal of Cell Biology. 129 (3), 591-603 (1995).
- Christman, J. K. 5-Azacytidine and 5-aza-2[prime]-deoxycytidine as inhibitors of DNA methylation: mechanistic studies and their implications for cancer therapy. Oncogene. 21, 5483-5495 (2002).
- Stresemann, C., Lyko, F. Modes of action of the DNA methyltransferase inhibitors azacytidine and decitabine. International Journal of Cancer. 123 (1), 8-13 (2008).
- Ledda, S., Idda, A., Kelly, J., Ariu, F., Bogliolo, L., Bebbere, D. A novel technique for in vitro maturation of sheep oocytes in a liquid marble microbioreactor. Journal of Assisted Reproduction and Genetics. 33 (4), 513-518 (2016).
- Vadivelu, R. K., et al. Generation of three-dimensional multiple spheroid model of olfactory ensheathing cells using floating liquid marbles. Scientific Reports. 5, 15083 (2015).
- Vadivelu, R. K., Kamble, H., Munaz, A., Nguyen, N. T. Liquid Marble as bioreactor for engineering three-dimensional toroid tissues. Scientific Reports. 7 (1), 12388 (2017).
- Vadivelu, R. K., Kamble, H., Munaz, A., Nguyen, N. T. Liquid Marbles as bioreactors for the study of three-dimensional cell interactions. Biomedical Microdevices. 19 (2), 31 (2017).
- Varelas, X., et al. TAZ controls Smad nucleocytoplasmic shuttling and regulates human embryonic stem-cell self-renewal. Nature Cell Biology. 10 (7), 837-848 (2008).
- Panciera, T., et al. Induction of Expandable Tissue-Specific Stem/Progenitor Cells through Transient Expression of YAP/TAZ. Cell Stem Cell. 19 (6), 725-737 (2016).
- Pennarossa, G., Paffoni, A., Ragni, G., Gandolfi, F., Brevini, T. A. L. Rho signaling-directed YAP/TAZ regulation encourages 3D spheroid colony formation and boosts plasticity of parthenogenetic stem cells. Advances in Experimental Medicine and Biology. 1237, 49-60 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved