Method Article
후성유전학적 변형과 생체역학적 단서를 결합하여 포유류 다능성 세포를 생성하는 두 단계 전략
요약
여기서는 화학적 후성유전학적 소거와 메카노센싱 관련 단서를 결합하여 유전자 형질감염이나 레트로바이러스 벡터가 필요 없이 포유동물 다능성 세포를 효율적으로 생성하는 방법을 제시한다. 따라서이 전략은 번역 의학에 유망하며 줄기 세포 오가노이드 기술의 주목할만한 발전을 나타냅니다.
초록
세포 표현형은 다른 방법으로 역전되거나 변형될 수 있으며, 각 기술에 특정한 장점과 한계가 있다. 여기서 우리는 화학적 후성 유전 적 지우기와 메카노 센싱 관련 단서의 사용을 결합하여 포유류 다능성 세포를 생성하는 새로운 전략을 설명합니다. 두 가지 주요 단계가 필요합니다. 첫 번째 단계에서, 성숙한(말단 분화된) 세포는 후성유전학적 지우개 5-아자-시티딘에 노출되어 다능성 상태로 그들을 구동시킨다. 프로토콜의 이 부분은 세포 운명 및 분화를 조절하는 후성유전학적 메커니즘에 대한 이해의 증가에 기초하여 개발되었으며, 후성유전학적 개질제를 사용하여 세포 분화 상태를 지운 다음 일시적인 높은 가소성 창으로 구동하는 것을 포함한다.
두 번째 단계에서, 지워진 세포는 액체 대리석으로도 알려진 폴리테트라플루오로에틸렌(PTFE) 마이크로 생물반응기에 캡슐화되어 획득한 높은 소성을 연장하고 안정적으로 유지하기 위해 3D 세포 재배열을 촉진합니다. PTFE는 비 반응성 소수성 합성 화합물이며 그 사용은 전통적인 2D 배양 시스템에서 달성 될 수없는 세포 미세 환경의 생성을 허용합니다. 이 시스템은 바이오 메카노센싱 관련 단서에도 불구하고 다능성의 유지를 장려하고 강화합니다.
여기에 설명 된 기술 절차는 성인 체세포에서 높은 가소성 상태의 유도 및 유지를 허용하는 간단한 전략입니다. 이 프로토콜은 시험된 모든 포유동물 종에서 높은 가소성 세포의 유도를 허용하였다. 유전자 형질감염의 사용을 수반하지 않으며 바이러스 벡터가 없기 때문에, 번역 의학 응용을 위한 주목할 만한 기술적 진보를 나타낼 수 있다. 더욱이, 마이크로바이오리액터 시스템은 높은 가소성 세포, 즉 ESC, iPSCs, 후성유전학적으로 소거된 세포 및 MSCs의 장기 배양을 허용하는 특정 마이크로환경을 시험관내 재생성함으로써 줄기 세포 오가노이드 기술의 주목할만한 발전을 제공한다.
서문
지난 수십 년 동안, 세포 투입 및 분화를 향한 단방향 진행에 대한 널리 받아 들여지는 개념이 완전히 개정되었습니다. 세포 사양을 되돌릴 수 있고, 말단으로 분화된 세포는 다른 방법을 사용하여 덜 헌신적이고 더 높은 허용 상태로 밀릴 수 있다는 것이 입증되었다.
제안 된 몇 가지 방법 중 가장 유망한 방법 중 하나는 세포를 소위 화학적으로 유도 된 다능성으로 유도하기 위해 화학 화합물을 사용하는 것입니다. 이 접근법에 사용 된 소분자는 성인 성숙 세포의 후성 유전 학적 서명과 상호 작용하고 수정할 수있어 트랜스제닉 및 / 또는 바이러스 벡터1,2,3,4,5,6,7,8,9,10의 필요성을 피할 수 있습니다. . 최근 수많은 연구에 따르면 하이퍼메틸화 유전자 11,12,13,14,15의 재활성화를 유도하는 특정 생화학적 및 생물학적 자극을 제공함으로써 세포를 한 표현형에서 다른 표현형으로 전환시킬 수 있음을 보여주었습니다. 이러한 탈메틸화 사건은 말단으로 분화된 세포를 원시적 선조, 다능성 또는 높은 가소성/다능성 세포 1,2,3,4,5,6,7,8,9,10으로 전환시키는 것을 허용한다.
동시에, 많은 연구들이 최근 메카노센싱 관련 단서에 대한 이해, 더 구체적으로는 기계적 힘을 사용하여 세포 가소성 및/또는 분화에 직접적으로 영향을 미칠 가능성에 초점을 맞추고 있다16,17,18,19. 실제로, 세포외 기질 (ECM)이 세포 운명의 조절에 중요한 역할을한다는 것이 명확하게 입증되었습니다. 특히, ECM에 의해 생성된 생체역학적 및 생물물리학적 신호는 분자 메커니즘 및 신호전달 경로를 직접 조절하여 세포 거동 및 기능(20,21)에 영향을 미친다. 이러한 최근의 데이터는 생체 내 세포 미세 환경을보다 밀접하게 모방하고 세포 행동을 유도하는 기계적 및 물리적 자극을 복제하는 새로운 3D 배양 시스템의 개발로 향하는 길을 열었습니다.
여기서는 화학적 후성유전학적 지우기와 메카노센싱 관련 단서를 결합하여 포유류 다능성 세포를 생성하는 두 단계 프로토콜을 설명합니다. 첫 번째 단계에서, 세포는 탈메틸화 분자 5-아자-시티딘 (5-aza-CR)과 함께 인큐베이션된다. 이 작용제는 직접 10-열한 전좌 2 (TET2)-매개 작용8,10 및 DNA 메틸트랜스퍼라제 (DNMT)22,23의 간접적 억제의 조합 효과를 통해 상당한 글로벌 DNA 탈메틸화를 유도할 수 있다. 이 단계는 다능성 관련 유전자 발현의 후속 재활성화와 함께 후성유전학적 블록의 제거를 유도하고, 따라서, 높은 가소성 세포 1,2,3,8,10, 이하 "후성유전학적으로 소거된 세포"로 지칭된다. 두 번째 단계에서, 세포는 3D 배양 시스템에 캡슐화된다. 이를 위해, 비반응성 소수성 합성 화합물 폴리테트라플루오로에틸렌(PTFE; 입자 크기가 1 μm)을 마이크로생물반응기로 사용하며, 이는 전통적인 2D 배양 시스템(10)의 사용을 통해 달성할 수 없는 세포 미세환경의 생성을 허용한다. PTFE 분말 입자는 세포가 다시 현탁되는 액체 방울의 표면에 부착되고, 내부 액체와 주변 환경(24) 사이의 가스 교환을 허용하면서 지지 표면으로부터 액체 코어를 분리한다. 이렇게 얻어진 "PTFE 마이크로바이오리액터"는, "리퀴드 마블"로도 알려져 있으며, 세포들이 서로 자유롭게 상호작용하도록 장려하여, 3D 세포 재배열(25,26,27)을 촉진하고, 바이오메카노센싱-관련 단서들(10)에도 불구하고 획득된 높은 가소성 상태를 연장하고 안정적으로 유지한다.
프로토콜
모든 연구는 밀라노 대학의 윤리위원회에 의해 검토되고 승인되었습니다. 모든 동물 실험은 미국 국립 보건원 (NIH)에 의해 출판 된 실험실 동물의 관리 및 사용을위한 가이드에 따라 수행되었습니다. 건강한 성인 개인으로부터의 인간 세포 분리는 밀라노의 Ospedale Maggiore Policlinico의 윤리위원회에 의해 승인되었습니다. 우리 연구의 모든 방법은 승인 된 지침에 따라 수행되었습니다.
1. 피부 섬유아세포 분리
참고: 아래에 설명된 모든 절차는 마우스, 돼지 및 인간을 포함한 다른 포유동물 종으로부터 분리된 섬유아세포에 적용될 수 있다. 뮤린 세포를 7주령의 수컷 마우스로부터 분리하고, 돼지 피부 조직을 지역 도살장에서 수집하였다. 인간 세포는 서면 정보에 입각한 동의 후에 성인 환자로부터 분리되었다.
- 0.1 % 돼지 젤라틴 용액을 준비하십시오.
- 돼지 젤라틴 0.1g을 무게로 100mL의 물에 녹인다. 사용하기 전에 오토클레이빙을 통해 젤라틴 용액을 살균하십시오.
- 35 mm 페트리 접시를 0.1% 돼지 젤라틴과 함께 코팅하여 준비된 용액 1.5 mL를 첨가한다. 실온에서 2시간 동안 인큐베이션한다.
- 약 2-5cm 길이의 포유류(마우스, 돼지 및 인간) 피부 생검을 절단하고 2% 항생제 항균 용액을 함유하는 둘베코의 인산염 완충 식염수(PBS)에 넣는다. 사용 전까지 + 4°C에서 보관하십시오.
참고 : 생검 수집은 합의하에 그리고 윤리위원회의 승인 후에 확립 된 지침에 따라 수행되어야합니다. - 수집된 생검을 2% 항생제 항균 용액을 함유하는 신선한 멸균 PBS에서 세 번 광범위하게 세척한다.
- 마지막 세척에서 생검을 수집하여 멸균 된 100mm 페트리 접시에 넣으십시오. 멸균 메스를 사용하여 약 2mm3 크기의 조각으로 자릅니다.
- 2시간 인큐베이션이 끝날 때, 35 mm 페트리 디쉬(단계 1.1.2에 기재됨)로부터 과량의 젤라틴 용액을 제거하고, 멸균 수술용 트위저를 사용하여, 즉시 5-6개의 피부 단편을 각각의 예비코팅된 배양 접시에 넣는다.
- 단편을 100 μL 액적의 섬유아세포 분리 배지 (표 1)를 그들 각각에 첨가하여 적시다. 5%CO2 배양기에서 37°C에서 배양한다.
참고: 배지가 증발하지 않도록 하려면 멸균수가 들어있는 100mm 이상의 페트리 접시 내에 35mm 페트리 접시를 놓습니다. 페트리 요리를 모두 뚜껑을 닫으십시오. - 24시간 배양 후, 35 mm 배양 페트리 디쉬에서 배지의 양을 확인하였다. 필요한 경우, 500 μL의 섬유아세포 분리 배지를 첨가하여 단편을 습윤 상태로 유지한다.
- 배지를 조심스럽게 제거하고 피펫을 사용하여 배양 후 적어도 2일마다 새로 고칩니다.
- 섬유아세포가 피부 단편으로부터 성장하기 시작하면, 35 mm 페트리 디쉬(단계 1.5에 기재됨)에 넣고 세포 단일층을 형성하기 시작한다(보통 6일). 멸균 수술용 핀셋을 이용하여 피부 조각을 제거하고 2 mL의 섬유아세포 분리 배지에서 배양하였다.
- 세포 단일층을 80% 합류될 때까지 5%CO2 배양기에서 37°C에서 계속 배양하고 격일로 배지를 리프레시한다.
2. 섬유아세포 1차 세포주 배양
- 섬유아세포가 80% 합류에 도달하면, 섬유아세포 분리 배지를 조심스럽게 제거하고 1% 항생제 항균 용액을 함유하는 PBS 3 mL로 세포를 3회 세척한다.
- 세포 분리를 위해, 배양 접시에 0.25% 트립신-EDTA 용액 600 μL를 첨가하고, 3-5분 동안 37°C에서 인큐베이션한다.
- 섬유아세포 배양 배지 5.4 mL를 첨가하여 세포가 배양 접시에서 분리되기 시작할 때 트립신을 중화시킨다(표 1).
- 반복적이고 부드러운 피펫팅으로 세포를 제거합니다. 새로운 배양 접시 (젤라틴 제외)에서 플레이트 세포를 1 : 2와 1 : 4 사이의 통과 비율을 유지합니다 (성장 속도에 따라 다름).
참고: 원심분리는 필요하지 않습니다. - 배양물에 세포를 유지하고 80 % confluency에 도달 할 때까지 2 일마다 배지를 변경하고 통과시킵니다.
참고 : 활발한 성장을 유지하기 위해 일주일에 두 번 섬유 아세포를 전파하십시오.
3. 5-aza-CR에 섬유아세포 노출
- 신선한 1 mM 5-aza-CR 원액을 준비하십시오.
- 2.44 mg의 5-aza-CR을 재가량 10 mL의 DMEM 고포도당에 용해시킨다. 볼텍싱하여 분말을 재현탁하십시오. 0.22 μm 필터로 용액을 멸균하십시오.
참고: 5-aza-CR 원액은 사용 직전에 준비해야 합니다. - 섬유아세포 배양액 1 mL에 5-aza-CR 원액(3.1.1.) 1 μL를 희석하여 5-aza-CR 작업액을 제조하였다.
참고: 5-aza-CR 작동 용액의 농도는 1 μM 1,2,3,8,9입니다.
- 2.44 mg의 5-aza-CR을 재가량 10 mL의 DMEM 고포도당에 용해시킨다. 볼텍싱하여 분말을 재현탁하십시오. 0.22 μm 필터로 용액을 멸균하십시오.
- 앞서 기술한 바와 같이 세포를 트립신화하고(2.1.-2.3.) 반복적이고 부드럽게 피펫팅함으로써 세포를 제거한다.
- 세포 현탁액을 수집하여 원뿔형 튜브로 옮깁니다.
- 실온에서 광학 현미경 하에서 카운팅 챔버를 사용하여 세포를 계수한다. 1 μM 5-aza-CR로 보충된 섬유아세포 배양 배지 30 μL에 4 x 104 세포를 수득하기 위해 세포를 재현탁하는데 필요한 배지의 부피를 계산한다(단계 3.1.2 참조).
참고: 사용할 수식은 챔버의 특정 유형에 따라 다릅니다.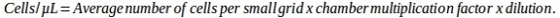
- 세포 현탁액을 실온에서 5분 동안 150 x g 에서 원심분리한다. 상청액을 제거하고 1 μM 5-aza-CR로 보충된 섬유아세포 배양 배지로 펠렛을 재현탁시켰다(단계 3.1.2 참조). 사용되는 섬유아세포 배양 배지의 부피에 대해서는 단계 3.4를 참조한다.
주: 음성 대조군으로서, 세포를 5-aza-CR 없이 섬유아세포 배양 배지에 동일한 농도로 재현탁시키고 PTFE 분말로 세포 캡슐화를 진행한다(단계 4.1.-4.13.).
4. PTFE 마이크로 생물 반응기에서 섬유 아세포 캡슐화
- 35mm 페트리 접시에 폴리테트라플루오로에틸렌(PTFE) 분말을 채워 침대를 만듭니다(그림 1A).
참고: 액체 대리석 접착을 피하기 위해 35mm 세균학 페트리 접시를 사용하십시오. 얇은 소수성 및 다공성 쉘을 얻기 위해, 평균 입자 크기가 1 μm인 PTFE 분말을 사용하고 최대 분쇄 2.0 NPIRI로 제작하였다. 이것은 가스 투과성 액체 대리석의 생성을 허용합니다. 더욱이, 반투명 코팅은 실시간으로 세포 응집 과정의 관찰을 용이하게 하고, 입자 크기가 커질수록 높은 증발, 구형 형상의 기형 및 손실, 및 마이크로생물반응기의 조기 용해를 야기할 수 있는 높은 다분산성을 유도한다. - 4 x 104 세포가 들어있는 30 μL 단일 액적(단계 3.4.- 3.5 참조)을 파우더 베드 상에 분주한다(그림 1B).
- 35mm 페트리 접시를 원형 운동으로 부드럽게 회전시켜 PFTE 분말이 액체 방울의 표면을 완전히 덮도록 하여 액체 대리석 마이크로 생물반응기를 형성합니다(그림 1C).
- 대리석의 직경을 수용하기 위해 가장자리에서 자른 1,000 μL 피펫 팁을 사용하여 액체 대리석 마이크로 생물 반응기를 집어 들으십시오 (그림 1D, E). 액체 대리석 마이크로 생물반응기를 깨끗한 박테리아학 페트리 접시 상에 플레이트화하여 안정화시킨다(도 1F).
참고: 팁 내부의 대리석을 잡기 위해 마찰을 일으키려면 피펫 끝을 액체 대리석 직경보다 약간 작은 직경으로 자릅니다. - 액체 대리석 마이크로 생물반응기를 페트리 접시에서 96웰 플레이트(하나의 대리석/웰)로 옮깁니다(그림 1G).
- 웰의 여백에서 100μL의 배지를 천천히 첨가한다. 마이크로 생물반응기는 배지 위에 떠 다니기 시작합니다(그림 1H).
참고 : 마이크로 생물 반응기는 PTFE 소수성의 붕괴로 인해 직접 액체 접촉에서 중단됩니다. 대안적인 접근법으로서, 액체 대리석 마이크로바이오리액터는 35 mm 세균학 배양 접시에 개별적으로 배치될 수 있다. 이 경우, 액체 대리석 증발을 방지하기 위해, 마이크로 생물반응기가 들어있는 35mm 페트리 접시를 100mm 페트리 접시에 삽입해야 하며, 이전에는 멸균수로 분취되어야 합니다. - 액체 대리석 마이크로바이오리액터를 5% CO2 인큐베이터 1,2,3,8,9에서 37°C에서 18시간 동안 인큐베이션한다.
참고: 1μm의 PTFE 입자 크기는 내부 액체와 주변 환경 간의 최적의 가스 교환을 보장할 수 있습니다. - 18시간 동안 5-aza-CR 인큐베이션한 후, 가장자리에서 절단된 1,000 μL 피펫 팁을 사용하여 액체 대리석 마이크로생물반응기를 수집하였다(단계 4.5 참조).
- 마이크로 생물반응기를 새로운 35mm 박테리아 페트리 접시에 넣습니다(그림 1D-F).
- 바늘을 사용하여 액체 대리석에 구멍을 뚫고 부러 뜨립니다.
- 입체 현미경으로 가장자리에서 절단한 200μL 피펫 팁으로 형성된 구상체를 회수합니다(그림 1I,J).
참고: PTFE로 캡슐화된 후성유전학적으로 소거된 세포는 3D 구형 구조(각 액체 대리석에 하나의 응집체)를 형성합니다. - 5-aza-CR에 대한 반응에서 다능성 상태의 획득을 평가하기 위해, 정성적 PCR에 의해 다능성-관련 유전자 발현, OCT4, NANOG, REX1 및 SOX2의 발병을 확인하였다(표 2).
- 아래에 설명된 대로 프로토콜의 두 번째 단계를 진행합니다.
5. 후성유전학적으로 지워진 세포의 PTFE 마이크로바이오리액터에서의 배양
- 신선한 ESC 배지를 준비한다(표 1).
- 오가노이드를 5-aza-CR 잔차를 세척하기 위한 ESC 배지를 함유하는 페트리 접시에 옮긴다(단계 5.1.-5.2 참조).
- PTFE 파우더 베드를 함유하는 새로운 35mm 세균학 페트리 접시를 준비한다(또한 단계 4.1 참조).
- 단일 오가노이드를 30 μL ESC 배지의 액적에 분주하여 200 μL 피펫 팁을 이용하여 분말 베드 상에 분주하고, 가장자리에서 절단한다(단계 4.9 참조; 5.3.).
- 원형 운동으로 35mm 페트리 접시를 부드럽게 회전시켜 새로운 액체 대리석 마이크로 바이오 리액터를 형성하고, 1,000 μL 피펫 팁을 사용하여 픽업하고, 가장자리에서 자르고, 새로 형성된 마이크로 생물 반응기를 96 웰 플레이트 (하나의 대리석 / 웰)의 웰에 놓습니다 (단계 4.3.-4.6 참조).
- 마이크로 생물반응기를 부유시키려면, 우물의 여백에서 100μL의 배지를 첨가하여 대리석을 천천히 목욕시킨다(참고 4.7 참조).
- 액체 대리석 마이크로바이오리액터를 필요한 기간 동안 5%CO2 인큐베이터에서 37°C에서 배양한다. 5.3.-5.7에 설명된 절차에 따라 격일로 배지를 변경한다.
참고 : 본 원고에서는 28 일 동안 오가노이드 배양으로 얻은 결과가 제공됩니다. 그러나, 필요하다면 더 긴 배양 기간이 수행될 수 있다.
결과
본 프로토콜은 성체 체세포로부터 포유동물 다능성 세포를 생성하고 안정적으로 유지하기 위해 수행되는 모든 단계를 기술한다. 이 방법은 상이한 포유동물 종, 즉 마우스, 돼지 및 인간으로부터 분리된 섬유아세포로 성공적이었다. 여기에 보고된 대표적인 결과는 기원의 종에 관계없이 모든 세포주로부터 얻어진다.
형태학적 분석은, 탈메틸화제 5-aza-CR과 함께 18시간 인큐베이션한 후, PTFE 마이크로바이오리액터(3D Post 5-aza-CR)에 캡슐화된 섬유아세포가 응집체를 형성하고 3D 구형 구조물을 형성하여 고려된 세 종 모두에서 균일한 크기 기하학적 구조를 나타낸다는 것을 보여준다. (그림 2A-C, 3D Post 5-aza-CR). 86.31 ± 캡슐화된 세포의 4.13%가 그들의 표현형을 현저하게 변형시켰으며, 이는 전형적으로 높은 가소성 표현형(high plasticity phenotype)8과 관련된 특징을 나타낸다. 대조적으로, 2D 표준 조건으로 배양된 포스트 5-aza-CR 세포는 전형적인 섬유아세포 길쭉한 형상을 원형 또는 타원형으로 대체하였지만, 크기가 상당히 작았고, 더 크고 과립화된 핵으로, 단층 분포를 유지하였다(도 2). 형태학적 변화는 3D 및 2D 포스트 5-aza-CR 세포 둘 다에서 다능성 관련 유전자 발현의 개시를 수반하였다. POU 클래스 5 호메오박스 1(OCT4), 나노그 호메오박스(NANOG), ZFP42 징크 핑거 단백질(REX1), 및 성별 결정 영역 Y-box 2(SOX2)에 대한 전사도 관찰되었으며, 이는 처리되지 않은 섬유아세포(T0)에서 부재한 것으로 검출되었다(도 3, 도 4, 도 5). 더욱이, 정량적 PCR 분석은 3D 포스트 5-aza-CR 세포에서 10-10-10 전좌-2 (TET2), 상피 세포 부착 분자 (EPCAM), 및 카데린 1 (CDH1) 유전자의 10 개 뿐만 아니라 2D 표준 플라스틱 접시 (2D Post 5-aza-CR)에서 배양 된 세포 (도 3, 도 4, 도 5, 파란색 막대)의 현저한 상향 조절을 입증했다 (도 3, 그림 4, 그림 5, 주황색 막대). 병행하여, 섬유아세포 특이적 마커인 Thy-1 세포 표면 항원(THY1)의 유의한 하향조절은 3D 및 2D Post 5-aza-CR 세포에서 명확하게 검출가능하였다(도 3, 도 4, 도 5).
높은 가소성 상태의 달성은 또한 DNA 글로벌 메틸화의 ELISA 분석에 의해 확인되었으며, 이는 3D 및 2D Post 5-aza-CR 세포 모두에서 메틸화 수준의 현저한 감소를 입증한다 (도 6A-C). 더욱이, 유전자 발현 결과와 일치하여, DNA 메틸화 수준은 2D 포스트 5-aza-CR 세포에 비해 3D Post 5-aza-CR 세포 (도 6 A-C, 청색 막대)에서 유의하게 낮았다 (도 6A-C, 오렌지색 막대).
더욱 흥미롭게도, 3D Post 5-aza-CR 세포는 획득된 3D 구형 구조 (도 2A, 3D 28d)를 보유하고, 다능성 관련 유전자의 높은 발현 수준 (도 3, 도 4, 및 도 5의 청색 막대)뿐만 아니라 낮은 DNA 메틸화 수준 (도 6A-C, 청색 막대)을 유지하며, 특히 28 일까지, 문화가 체포되었을 때. 대조적으로, 2D Post 5-aza-CR 세포는 탈메틸화제로 처리한 후 동일한 다능성 유전자에 대해 전사하였지만, 이들은 7일째까지 이러한 발현을 거절하였다(도 3, 도 4, 도 5, nd). 유사하게, 메틸화 수준의 감소는 처음 72시간 동안 유지되었다; 그 후 메틸화는 서서히 증가하여, 배양 7일째까지 처리되지 않은 섬유아세포(도 6의 A-C, T0, 백색 막대)에 필적하는 것으로 복귀하였다(도 6의 A-C, 오렌지색 막대).

도 1: PTFE 마이크로바이오리액터에서의 세포 캡슐화 및 오가노이드 회수. (A) 세균학 페트리 접시에 PTFE를 채워 파우더 베드를 제조하였다. (b) 세포를 함유하는 배지의 단일 액적을 PTFE 베드의 상부에 분주하였다. (c) 페트리 접시를 원형 운동으로 부드럽게 회전시켜 액적을 코팅하고 마이크로바이오리액터를 생성하였다. (d) 1000 μL 피펫 팁을 끝에서 절단하고(적색 화살표) (E) 마이크로바이오리액터를 수집하는데 사용하였다. (F) 액체 대리석을 깨끗한 페트리 접시로 옮겨 안정화시키고, (G) 96 웰 플레이트 (하나의 대리석 / 우물)에 넣고 (H) 매체에 떠 다녔다. (i) 새로 형성된 오가노이드를 수집하기 위해, 마이크로바이오리액터를 바늘로 천공하고, (J) 수득된 세포 응집체를 입체현미경으로 회수하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
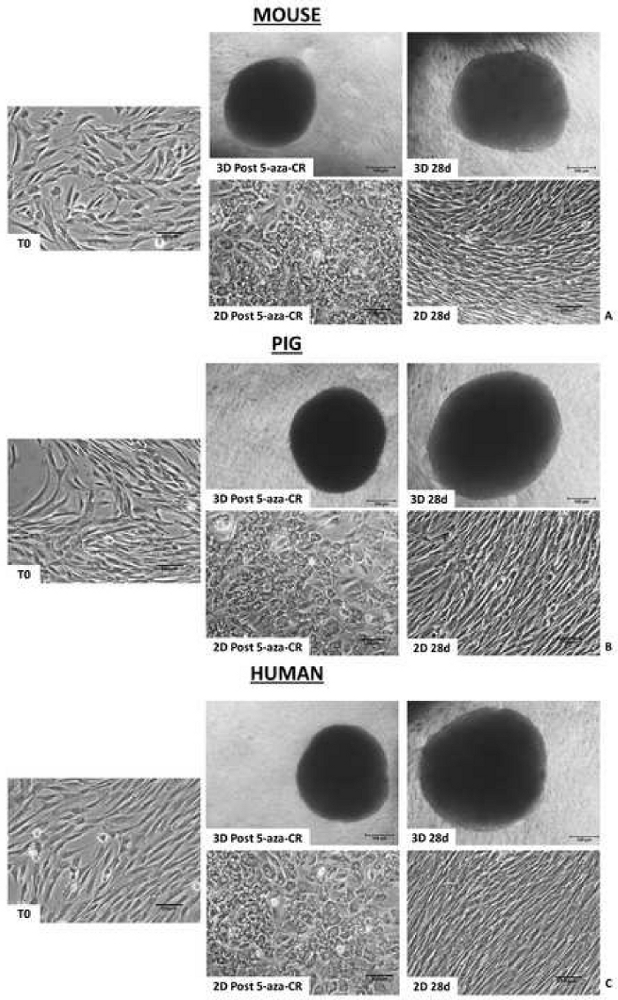
도 2: PTFE 마이크로바이오리액터에 캡슐화된 포유류의 후성유전학적으로 소거된 세포는 3D 구형 구조를 형성한다. 뮤린(A), 돼지(B) 및 인간(C) 세포를 PTFE에 캡슐화하고 5-aza-CR 형태의 3D 구형 구조체(3D Post 5-aza-CR)로 처리하고, 모든 후속 배양 기간 동안 안정적으로 유지하였다(3D 28d; 스케일 바, 100 μm). 대조적으로, 뮤린 (A), 돼지 (B) 및 인간 (C) 세포를 플라스틱 접시 상에 플레이팅하고 5-aza-CR로 처리하여 전형적인 섬유아세포 길쭉한 형상 (T0)을 둥근 상피 표현형으로 대체하고 단층 분포 (2D Post 5-aza-CR)를 유지하였다. 배양 7일째까지, 2D 세포는 원래의 길쭉한 형상으로 되돌아갔고, 이는 후속 배양 기간 동안 안정하게 유지되었다 (2D 28d; 스케일 바, 100 μm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: PTFE 마이크로바이오리액터에 캡슐화된 뮤린 후성유전학적으로 소거된 세포는 다능성 관련 유전자 발현의 높은 수준 및 장기간 유지를 보여준다. 뮤린 미처리 섬유아세포(T0, 백색 막대), 5-aza-CR(Post 5-aza-CR)에 노출된 섬유아세포, 및 PTFE 캡슐화(청색 막대) 및 표준 플라스틱 접시(오렌지 바)에 대한 배양의 상이한 시점에서 Oct4, Nanog, Rex1, Sox2, Tet2, Epcam, Cdh1 및 Thy1 유전자에 대한 전사 수준은 배양된 세포를 배양하였다. 유전자 발현 값은 1로 설정된 가장 높은 발현 세트와 이에 비해 다른 모든 다른 모든 것으로 보고된다. 상이한 위 첨자는 유의한 차이를 나타낸다(P < 0.05). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
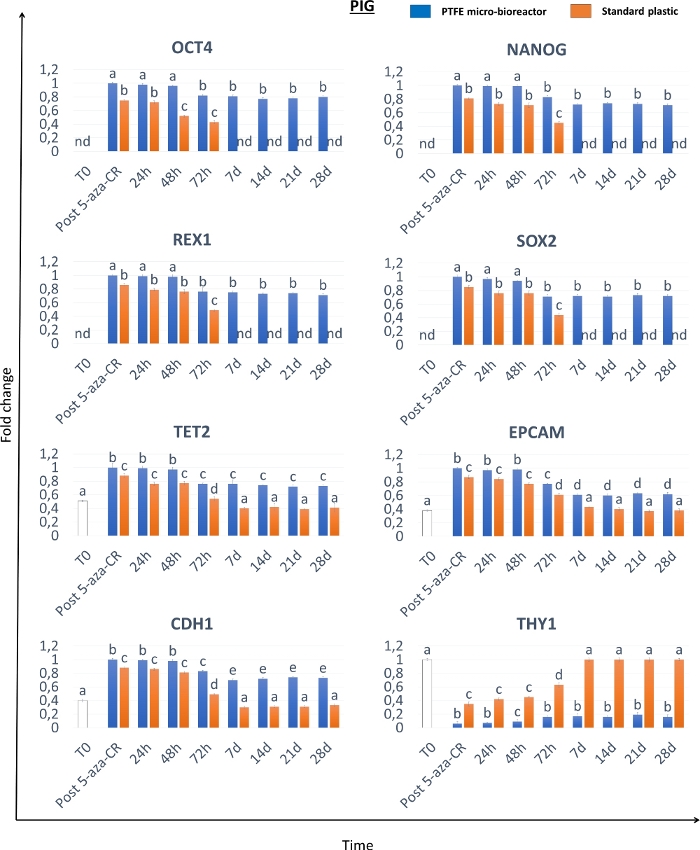
도 4: PTFE 마이크로바이오리액터에 캡슐화된 돼지 후성유전학적으로 소거된 세포는 다능성 관련 유전자 발현의 높은 수준 및 장기간 유지를 보여준다. OCT4, NANOG, REX1, SOX2, TET2, EPCAM, CDH1 및 THY1 유전자에 대한 전사 수준은 돼지 미처리 섬유아세포(T0, 백색 막대), 5-아자-CR(Post 5-aza-CR)에 노출된 섬유아세포, 및 PTFE 캡슐화(청색 막대) 및 표준 플라스틱 접시(오렌지 바)에 대한 배양의 상이한 시점에서, 배양된 세포를 배양하였다. 유전자 발현 값은 1로 설정된 가장 높은 발현 세트와 이에 비해 다른 모든 다른 모든 것으로 보고된다. 상이한 위 첨자는 유의한 차이를 나타낸다(P < 0.05). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 5: PTFE 마이크로바이오리액터에 캡슐화된 인간 후성유전학적으로 소거된 세포는 다능성 관련 유전자 발현의 높은 수준 및 장기간 유지를 보여준다. 인간 미처리 섬유아세포(T0, 백색 막대), 5-aza-CR(Post 5-aza-CR)에 노출된 섬유아세포(포스트 5-aza-CR), 및 PTFE 캡슐화(청색 막대) 및 표준 플라스틱 접시(오렌지색 막대)에 대한 배양의 상이한 시점에서 OCT4, NANOG, REX1, SOX2, TET2, EPCAM, CDH1 및 THY1 유전자에 대한 전사 수준은 배양된 세포이다. 유전자 발현 값은 1로 설정된 가장 높은 발현 세트와 이에 비해 다른 모든 다른 모든 것으로 보고된다. 상이한 위 첨자는 유의한 차이를 나타낸다(P < 0.05). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
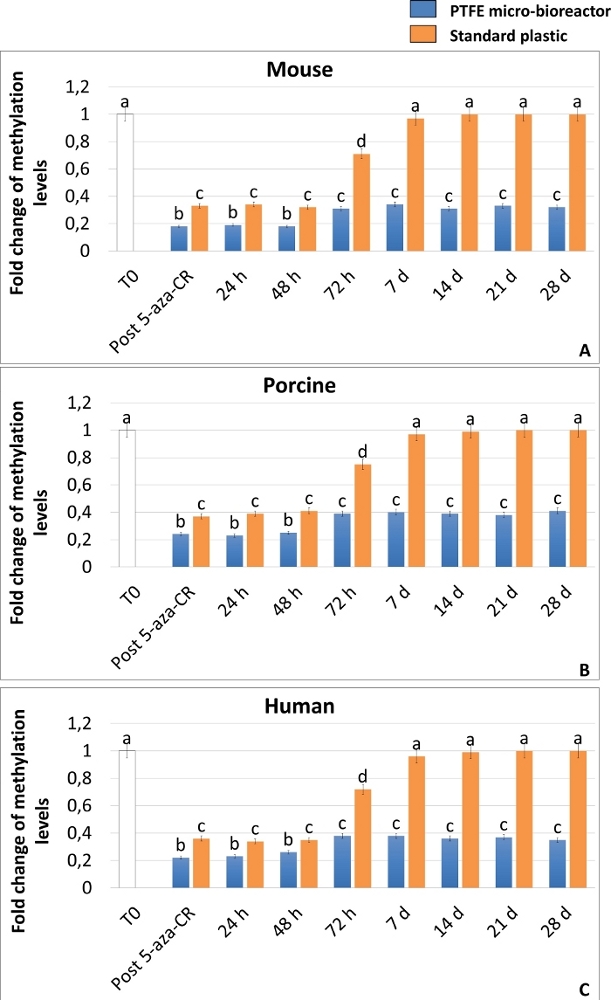
그림 6: PTFE 마이크로 생물반응기는 5-aza-CR 탈메틸화 효과를 향상시키고 포유류 후성유전학적으로 지워진 섬유아세포에서 장기간 DNA 하이포메틸화를 유지한다. 뮤린 (A), 돼지 (B) 및 인간 (C) 세포의 글로벌 DNA 메틸화 수준은 PTFE 마이크로 생물 반응기 (파란색 막대)에 캡슐화되거나 표준 플라스틱 (오렌지 바)에 도말하여 5-aza-CR (Post 5-aza-CR)에 노출시키고 28 일 동안 ESC 배지에서 배양하였다. 처리되지 않은 섬유아세포(T0; 흰색 막대). 결과는 다섯 개의 독립적인 생물학적 반복실험을 사용한 세 개의 독립적인 실험의 평균 ± SD를 나타낸다. 상이한 위 첨자는 유의한 차이를 나타낸다(P < 0.05). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 섬유아세포 분리 배지 (100 mL) | |
| DMEM, 고 글루코스, 피루베이트 | 77 mL |
| 태아 소 혈청, 자격, 열 불활성화 | 20 mL |
| L- 글루타민 용액 | 1 mL |
| 항생제 항균 용액 (100×) | 2 mL |
| 섬유아세포 배양 배지 (100 mL) | |
| DMEM, 고 글루코스, 피루베이트 | 88 mL |
| 태아 소 혈청, 자격, 열 불활성화 | 10 mL |
| L- 글루타민 용액 | 1 mL |
| 항생제 항균 용액 (100×) | 1 mL |
| ESC 배지 (10 mL) | |
| 햄의 F-10 영양소 믹스 | 3,99 mL |
| DMEM, 저포도당, 피루베이트 | 3,99 mL |
| 녹아웃 혈청 대체 | 1 mL |
| 태아 소 혈청, 자격, 열 불활성화 | 500 μL |
| 항생제 항균 용액 (100×) | 100 μL |
| L- 글루타민 용액 | 100 μL |
| MEM 비필수 아미노산 용액 (100X) | 100 μL |
| 2- 메르캅토 에탄올 (10 mM) | 100 μL (0.1 밀리미터) |
| 뉴클레오시드 믹스 (0.3 M 구아노신, 0.3 M 아데노신, 0.3 M 시티딘, 0.3 M 우리딘 및 0.1 M 티미딘) | 100 μL (3 mM 구아노신, 3 mM 아데노신, 3 mM 시티딘, 3 mM 우리딘 및 1 mM 티미딘) |
| ESGRO 재조합 마우스 LIF 단백질 (1000 단위 / mL) | 10 μL (1 유닛/mL) |
| 재조합 인간 FGF 베이직 (bFGF) (5 μg/mL) | 10 μL (5 ng/mL) |
표 1: 섬유아세포 분리 배지, 섬유아세포 배양 배지 및 ESC 배양 배지의 조성.
| 과녁 | PCR 프라이머 세트 | 종 | |
| Cdh1 | 앞으로: GAGGAACCCACAGCCTCATA | 마우스 | |
| 역: GTTGACCGTCCCTTCACAGT | 마우스 | ||
| 엡캄 | 앞으로: TGGCAACAAGTTGCTCTCTCTG | 마우스 | |
| 역: CTTGTCGGTTCTTCGGACTC | 마우스 | ||
| 나노그 | 앞으로: AGGCTGATTTGGTTGGTGTC | 마우스 | |
| 역: CCAGGAAGACCCACACTCAT | 마우스 | ||
| 10월4일 | 앞으로: ACACCTGGCTTCAGACTTCG | 마우스 | |
| 역: AGTTGCTTTCCACTCGTGCT | 마우스 | ||
| 렉스1 | 앞으로: CAGGTTCTGGAAGCGAGTTC | 마우스 | |
| 역: GACAAGCATGTGCTTCCTCA | 마우스 | ||
| 삭스2 | 앞으로: AGAACCCCAAGATGCACAAC | 마우스 | |
| 역방향: CTCCGGGAAGCGTGTGTACTTA | 마우스 | ||
| 테트2 | 앞으로: GCACAGGGAGCAAGAGATTC | 마우스 | |
| 역: ATGTTGACATTGCCAGTGGA | 마우스 | ||
| 당신의1 | 앞으로: AACTCTTGGCACCATGAACC | 마우스 | |
| 역: GCACGTGCTTCCTTCTCT | 마우스 | ||
| CDH1 | 앞으로: GAATGACAATGGCCCCATAC | 돼지 | |
| 역: AGGTGGTCACCTGGTCTTTG | 돼지 | ||
| 증권 시세 표시기 | 앞으로: GCTTGGTCAGTGCCAGTA | 돼지 | |
| 역: CTTCTGACCCCAGCAGTGTT | 돼지 | ||
| 나노그 | 앞으로: ATCCAGCTTGTCCCCAAAG | 돼지 | |
| 역: ATTTCATTCGCTGGTTCTGG | 돼지 | ||
| 10월 4일 | 앞으로: GTTCAGCCAAACGACCATCT | 돼지 | |
| 역: CTCCAGGTTGCCTCTCACTC | 돼지 | ||
| 렉스1 | 앞으로: CTTCAAGGAGAGCGCAAAAC | 돼지 | |
| 역: TGTCCCCAATCAAAAATGCT | 돼지 | ||
| SOX2 | 앞으로: GCCCTGCAGTACAACTCCAT | 돼지 | |
| 역: GCTGATCATGTCCCGTAGGT | 돼지 | ||
| TET2 | 앞으로: CAGAAAACAATGCAGCCAGA | 돼지 | |
| 역: GAATGGCTCGGTCTCTGAAG | 돼지 | ||
| THY1 | 앞으로: GGCATCGCTCTCTTGCTAAC | 돼지 | |
| 역: GCTGGAGAAGTTGGTTCGAG | 돼지 | ||
| CDH1 | 앞으로: TGCCCAGAAAATGAAAAAGG | 사람의 | |
| 역: GTGTATGTGGCAATGCGTTC | 사람의 | ||
| 증권 시세 표시기 | 앞으로: GCTGGTGTGTGAACACTGCT | 사람의 | |
| 역: ACGCGTTGTGATCTCCTCTCTT | 사람의 | ||
| 나노그 | 앞으로: AGAAAAACAACTGGCCGAAG | 사람의 | |
| 역: TGCTCCAGGACTGGATGTTC | 사람의 | ||
| 10월 4일 | 앞으로: AATTTGCCAAGCTCCTGAAG | 사람의 | |
| 역: GTTGCCTCTCACTCGGTTCT | 사람의 | ||
| 렉스1 | 앞으로: ACGTTTCGTGTGTCCCTTTC | 사람의 | |
| 역: TATAACCGCTTTTGGGGTTG | 사람의 | ||
| SOX2 | 앞으로: ACACCAATCCCATCCACACT | 사람의 | |
| 역: GCAAACTTCCTGCAAAGCTC | 사람의 | ||
| TET2 | 앞으로: CCCACTTACCTGCGTTTCAT | 사람의 | |
| 역: ACTGTGACCTTTCCCCACTG | 사람의 | ||
| THY1 | 앞으로: AGATCCCAGAACCATGAACC | 사람의 | |
| 역: GCACGTGCTTCTTTGTCTCA | 사람의 | ||
| 과녁 | TaqMan 분석 카탈로그 번호 | 종 | |
| 액트 | Mm02619580_g1 | 마우스 | |
| Cdh1 | Mm01247357_m1 | 마우스 | |
| 엡캄 | Mm00493214_m1 | 마우스 | |
| 갓드 | Mm99999915_g1 | 마우스 | |
| 나노그 | Mm02019550_s1 | 마우스 | |
| 10월4일 | Mm03053917_g1 | 마우스 | |
| 렉스1 | Mm03053975_g1 | 마우스 | |
| 삭스2 | Mm03053810_s1 | 마우스 | |
| 테트2 | Mm00524395_m1 | 마우스 | |
| 당신의1 | Mm00493681_m1 | 마우스 | |
| 액티브 | Ss03376563_uH | 돼지 | |
| CDH1 | Ss06942341_m1 | 돼지 | |
| 증권 시세 표시기 | Ss03384752_u1 | 돼지 | |
| 갭드 | Ss03375629_u1 | 돼지 | |
| 나노그 | Ss04245375_s1 | 돼지 | |
| 10월 4일 | Ss03389800_m1 | 돼지 | |
| 렉스1 | Ss03373622_g1 | 돼지 | |
| SOX2 | Ss03388002_u1 | 돼지 | |
| TET2 | Ss06880359_m1 | 돼지 | |
| THY1 | Ss03376963_u1 | 돼지 | |
| 액티브 | Hs01060665_g1 | 사람의 | |
| CDH1 | Hs01023895_m1 | 사람의 | |
| 증권 시세 표시기 | Hs00901885_m1 | 사람의 | |
| 갭드 | Hs02786624_g1 | 사람의 | |
| 나노그 | Hs02387400_g1 | 사람의 | |
| 10월 4일 | Hs00999632_g1 | 사람의 | |
| 렉스1 | Hs00399279_m1 | 사람의 | |
| SOX2 | Hs01053049_s1 | 사람의 | |
| TET2 | Hs00325999_m1 | 사람의 | |
| THY1 | Hs00174816_m1 | 사람의 | |
표 2: 프라이머 정보.
토론
지난 수십 년 동안 여러 연구는 말기 분화 된 세포를 덜 헌신적이고 더 높은 허용 상태로 되돌리기위한 전략 개발에 중점을 두었습니다. 여기에 기술된 프로토콜은 성숙한 성숙 말단 분화된 세포로부터 출발하는 다능성 세포의 생성 및 장기 유지를 허용한다. 이 방법은 화학적 후성 유전 적 소거를 통해 달성되는 높은 허용 상태의 유도와 3D 배양 시스템을 사용하여 보장 된 후속 유지 보수를 포함하는 두 가지 독립적 인 단계를 결합합니다.
PTFE 캡슐화된 세포에서 관찰된 3D 스페로이드 구조의 형성(도 2)은 세포 응집을 효율적으로 촉진하는 PTFE 능력을 입증하는 다른 연구와 일치하며, 후각 포집 세포(OEC) 스페로이드 구조(25) 또는 3D 토로이드 응집체(26)의 형성을 촉진한다. 이러한 형태학적 변화는 다능성 관련 유전자 발현의 개시(도 3, 도 4, 도 5)에 의해 병행되며, 이는 2D Post 5-aza-CR 세포와 비교했을 때 3D Post 5-aza-CR 세포에서 유의하게 더 높은 수준을 보여준다(도 3, 도 4, 도 5). 일관되게 3D Post 5-aza-CR 세포는 2D Post 5-aza-CR 세포보다 더 높은 DNA 하이포메틸화를 나타낸다(그림 6). 전반적으로, 이러한 결과는 사용된 세포 배양 시스템에 관계없이 높은 가소성 상태를 유도하는 5-aza-CR 능력을 나타낸다. 그러나, 세포에 의해 달성되는 화학적으로 유도된 다능성 상태는, 다능성 유전자 전사를 촉진하고 5-aza-CR 탈메틸화 효과를 증가시키는 PTFE 마이크로생물반응기를 사용하여 상당히 촉진된다. 더욱 흥미롭게도, 3D Post 5-aza-CR 세포만이 획득된 3D 구형 구조를 안정적으로 보유하고(도 2), 다능성 관련 유전자의 높은 발현 수준(도 3, 도 4, 도 5)뿐만 아니라 낮은 DNA 메틸화 수준(도 6)을 유지하며, 모든 후속 배양 기간 동안 유지한다. 전체적으로, 여기에 보고된 대표적인 결과는 이 두 단계 전략이 매우 효율적이고 강력하며, PTFE 마이크로 생물반응기의 사용은 높은 소성을 향상시킬뿐만 아니라 고려된 포유류 종에서 안정적이고 장기적인 유지를 가능하게 한다는 것을 보여준다. 우리는 최근에 이러한 유익한 효과가 하마 신호전달 경로 및 그의 메카노형질도입-관련 단서(10)의 활성화와 관련이 있음을 입증하였으며, 이는 이전에 세포 다능성 28,29,30의 활성 조절에 중요한 역할을 하는 것으로 밝혀졌다.
성공적인 절차를 위한 가장 중요한 두 단계는 멸균 층류 및 현미경 하에서의 취급 및 마이크로 생물반응기 생산 중 정확한 세포 수/액체 부피 속도의 사용을 포함하여 항상 37°C에서 세포를 엄격하게 유지하는 것이며, 이는 사용된 특정 세포 유형에 따라 달라질 수 있습니다. 우리의 경험에 비추어 볼 때, 시약을 배양에 사용하기 전에 신선하게 준비하는 것이 좋습니다 (이것은 5-aza-CR 원액에 절대적으로 중요합니다). 또한, 중간 리프레싱은 중간 변화 중에 3D 구형 오가노이드가 손실 될 수 있기 때문에 입체 현미경으로 수행되어야합니다.
이 방법의 주요 강점은 트랜스제닉 및/또는 바이러스 벡터 요건이 없다; 다른 포유동물 종에서의 견고성 및 재현성; 저렴한 비용; 다른 세포 유형에 높은 유연성. 한편, 가능한 제한은 마이크로바이오리액터의 작은 부피로 인해 획득된 데이터의 제한된 수로 표현될 수 있었다. 또한, 높은 세포 밀도의 사용은 낮은 산소 전달 속도 및 현탁액에서의 제한된 성장을 야기할 수 있다. 이러한 문제를 극복하기 위해서는 스케일 업 및 / 또는 스케일 다운 전략에 대한 추가 작업이 필요합니다.
모든 3D 구상체 기반 응용 분야에 공통적 인 주요 측면은 재현성, 생산 효율성, 오가노이드 크기 균일 성 및 세포 생리학에 미치는 영향이라는 것을 강조하는 것이 중요합니다. 이러한 특징은 배양 시스템 내에서 발생하는 기계적 힘과 엄격하게 상관 관계가 있으며 사용 된 다양한 방법에 따라 다릅니다. 예를 들어, 다세포 오가노이드는 고정 시스템에서 비부착성 접시를 사용하여 배양할 수 있습니다. 이 접근법은 주로 확산 제한 조건을 기반으로하며, 일반적으로 느슨한 응집 된 클러스터의 형성을 초래합니다. 교수형 드롭 기술은 동일한 한계를 보여줍니다. 실제로, 조직 배양 접시의 뚜껑 아래쪽에 세포 현탁액이 떨어지는 퇴적은 자유 액체 - 공기 계면에서 세포를 집중시키는 미세 중력 환경의 생성으로 이어지고, 저응집 다세포 구체의 생성을 유도한다. 가능한 대안은 스피너 플라스크 기술로 표현된다. 그러나, 이 방법은 상승된 양의 배양 배지를 필요로 하기 때문에 매우 비쌉니다. 또한, 형성된 오가노이드는 특성화 또는 추가 시험관내 시험에 사용될 때 고정식 배양 시스템으로 옮겨질 필요가 있다. 이러한 모든 문제는 액체 대리석 마이크로 생물 반응기를 사용하여 극복 할 수 있습니다. 실제로, 그들은 고정 및 방사 방법의 장점을 결합한 비 부착성 액체 표면을 제공하여 신속한 세포 응집과 소형 구상체의 생성을 유도합니다. 평행하게, 오목한 바닥, 구형 모양 및 각 대리석의 내부 액체 흐름은 세포가 마이크로 생물 반응기의 바닥에 정착 할 수있게하여 크기와 모양이 균일 한 오가노이드를 형성합니다. 액체 대리석의 사용에서 또 다른 중요한 이점은 구형 모양 덕분에 전체 표면을 통해 발생할 수있는 최적의 가스 교환으로 표현됩니다.
결론적으로, 여기에 기술된 프로토콜은 포유동물 다능성 세포의 효율적이고 간단한 생성을 허용한다. 이 전략은 바이러스 벡터가 없고 어떠한 유전자 형질감염의 사용도 수반하지 않기 때문에, 번역 의학 응용에 매우 유망하며 환자 특이적 세포 요법에서 한 걸음 앞으로 나아갈 것으로 간주될 수 있다. 더욱이, 3D 마이크로생물반응기 배양 시스템의 사용은 줄기 세포 오가노이드 기술에서 주목할 만한 돌파구를 나타낼 수 있고, ESC, iPSC 및 MSCs와 같은 상이한 세포 유형의 장기 배양을 위한 유리한 마이크로환경을 구성할 수 있다. 추가적인 이점은 마이크로 생물반응기 내에 확립된 풍부한 환경의 파라크린/자가분비 신호전달의 효과를 연구할 수 있게 하는 작은 부피로 대표된다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 Carraresi Foundation과 MiND FoodS Hub ID : 1176436가 자금을 지원했습니다. 모든 저자는 COST Action CA16119 시험관내 3-D 총 세포 안내 및 적합성 (CellFit)의 회원입니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma-Aldrich | M7522 | Component of ESC medium |
| 5-Azacytidine | Sigma-Aldrich | A2385 | 5-aza-CR, for fibroblast epigenetic erasing |
| Adenosine | Sigma-Aldrich | A4036 | Component of nucleoside mix for ESC medium |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | Component of fibroblast and ESC media |
| CFX96 Real-Time PCR | Bio-Rad Laboratories | NA | Thermal cycler for quantitative PCR |
| Cytidine | Sigma-Aldrich | C4654 | Component of nucleoside mix for ESC medium |
| DMEM, high glucose, pyruvate | Thermo Fisher Scientific | 41966052 | For fibroblast isolation and culture medium |
| DMEM, low glucose, pyruvate | Thermo Fisher Scientific | 31885023 | For ESC medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D5652 | PBS; for biopsy and cell wash and for solution preparation |
| Dynabeads mRNA DIRECT Micro Purification Kit | Thermo Fisher Scientific | 61021 | mRNA estraction |
| ESGRO Recombinant Mouse LIF Protein | Sigma-Aldrich | ESG1106 | Component of ESC medium |
| Fetal Bovine Serum, qualified, heat inactivated | Thermo Fisher Scientific | 10500064 | Component of fibroblast and ESC media |
| FGF-Basic (AA10-155) Recombinant Human Protein | Thermo Fisher Scientific | PHG0024 | Component of ESC medium |
| Gelatin from porcine skin | Sigma-Aldrich | G1890 | For dish coating |
| GeneAmp PCR System 2700 | Applied Biosystems | NA | Thermal cycler for qualitative PCR |
| Global DNA Methylation ELISA Kit | CELL BIOLABS | STA-380 | Methylation study |
| GoTaq G2 Flexi DNA Polymerase | Promega | M7801 | Qualitative PCR |
| Guanosine | Sigma-Aldrich | G6264 | Component of nucleoside mix for ESC medium |
| Ham's F-10 Nutrient Mix | Thermo Fisher Scientific | 31550031 | For ESC medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Component of ESC medium |
| KOVA glasstic slide 10 with grids | Hycor Biomedical | 87144 | For cell counting |
| Leica MZ APO Stereo Microscope | Leica | NA | For organoid observation |
| L-Glutamine solution | Sigma-Aldrich | G7513 | Component of fibroblast and ESC media |
| MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140035 | Component of ESC medium |
| Millex-GS 0.22 µm pore filters | Millipore | SLGS033SB | For solution sterilization |
| M-MLV Reverse Transcriptase, RNase H Minus, Point Mutant | Promega | M3681 | mRNA reverse transcription |
| Multiskan FC Microplate Photometer | Thermo Fisher Scientific | 51119000 | For ELISA plate reading |
| Nikon Eclipse TE300 Inverted Phase Contrast Microscope | Nikon | NA | For cell observation |
| Perkin Elmer Thermal Cycler 480 | Perkin Elmer | NA | Thermal cycler for reverse transcription |
| Poly(tetrafluoroethylene) 1 μm particle size | Sigma-Aldrich | 430935 | For generating micro-bioreactor |
| PureLink Genomic DNA Mini Kit | Thermo Fisher Scientific | K182001 | Genomic DNA estraction |
| TaqMan Gene Expression Cells-to-CT Kit | Thermo Fisher Scientific | AM1728 | Quantitative PCR |
| Thymidine | Sigma-Aldrich | T1895 | Component of nucleoside mix for ESC medium |
| Tissue Culture Dish 100X20 mm, Standard | Sarstedt | 833902 | For fibroblast isolation |
| Tissue Culture Dish 35X10 mm, Standard | Sarstedt | 833900 | For Fibroblast isolation |
| Tissue Culture Dish 35X10 mm, Suspension | Sarstedt | 833900500 | Bacteriology petri dish for liquid marble culture |
| Tissue Culture Plate 96 Well,Standard,F | Sarstedt | 833924005 | For liquid marble culture |
| Trypsin-EDTA solution | Sigma-Aldrich | T3924 | For fibroblast dissociation |
| Tube 15ml, 120x17mm, PS | Sarstedt | 62553041 | For cell suspension centrifugation |
| Uridine | Sigma-Aldrich | U3003 | Component of nucleoside mix for ESC medium |
참고문헌
- Pennarossa, G., et al. Brief demethylation step allows the conversion of adult human skin fibroblasts into insulin-secreting cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), 8948-8953 (2013).
- Pennarossa, G., et al. Reprogramming of pig dermal fibroblast into insulin secreting cells by a brief exposure to 5-aza-cytidine. Stem Cell Reviews and Reports. 10 (1), 31-43 (2014).
- Brevini, T. A. L., et al. Morphological and molecular changes of human granulosa cells exposed to 5-azacytidine and addressed toward muscular differentiation. Stem Cell Reviews and Reports. 10 (5), 633-642 (2014).
- Mirakhori, F., Zeynali, B., Kiani, S., Baharvand, H. Brief azacytidine step allows the conversion of suspension human fibroblasts into neural progenitor-like cells. Cell Journal. 17 (1), 153-158 (2015).
- Tan, S. J., et al. Muscle tissue engineering and regeneration through epigenetic reprogramming and scaffold manipulation. Scientific Reports. 5, 16333 (2015).
- Brevini, T. A. L., Pennarossa, G., Acocella, F., Brizzola, S., Zenobi, A., Gandolfi, F. Epigenetic conversion of adult dog skin fibroblasts into insulin-secreting cells. Veterinary Journal. 211, 52-56 (2016).
- Chandrakanthan, V., et al. PDGF-AB and 5-Azacytidine induce conversion of somatic cells into tissue-regenerative multipotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 2306-2315 (2016).
- Manzoni, E. F. M., et al. 5-azacytidine affects TET2 and histone transcription and reshapes morphology of human skin fibroblasts. Scientific Reports. 6, 37017 (2016).
- Pennarossa, G., et al. Epigenetic erasing and pancreatic differentiation of dermal fibroblasts into insulin-producing cells are boosted by the use of low-stiffness substrate. Stem Cell reviews and reports. 14 (3), 398-411 (2018).
- Pennarossa, G., et al. Use of a PTFE micro-bioreactor to promote 3D cell rearrangement and maintain high plasticity in epigenetically erased fibroblasts. Stem Cell Reviews and Reports. 15 (1), 82-92 (2019).
- Constantinides, P. G., Jones, P. A., Gevers, W. Functional striated muscle cells from non-myoblast precursors following 5-azacytidine treatment. Nature. 267 (5609), 364-366 (1977).
- Taylor, S. M., Jones, P. A. Multiple new phenotypes induced in 10T1/2 and 3T3 cells treated with 5-azacytidine. Cell. 17 (4), 771-779 (1979).
- Taylor, S. M., Constantinides, P. A., Jones, P. A. 5-Azacytidine, DNA methylation, and differentiation. Current Topics in Microbiology and Immunology. 108, 115-127 (1984).
- Jones, P. A. Effects of 5-azacytidine and its 2'-deoxyderivative on cell differentiation and DNA methylation. Pharmacology & Therapeutics. 28 (1), 17-27 (1985).
- Palii, S. S., Van Emburgh, B. O., Sankpal, U. T., Brown, K. D., Robertson, K. D. DNA methylation inhibitor 5-Aza-2'-deoxycytidine induces reversible genome-wide DNA damage that is distinctly influenced by DNA methyltransferases 1 and 3B. Molecular and Cellular Biology. 28 (2), 752-771 (2008).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews. Molecular Cell Biology. 18 (12), 728 (2017).
- Matamoro-Vidal, A., Levayer, R. Multiple influences of mechanical forces on cell competition. Current Biology. 29 (15), 762-774 (2019).
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Research & Therapy. 3 (5), 41 (2012).
- Kumar, A., Placone, J. K., Engler, A. J. Understanding the extracellular forces that determine cell fate and maintenance. Development. 144 (23), 4261-4270 (2017).
- Bissell, M. J., Rizki, A., Mian, I. S. Tissue architecture: the ultimate regulator of breast epithelial function. Current Opinion in Cell Biology. 15 (6), 753-762 (2003).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. The Journal of Cell Biology. 129 (3), 591-603 (1995).
- Christman, J. K. 5-Azacytidine and 5-aza-2[prime]-deoxycytidine as inhibitors of DNA methylation: mechanistic studies and their implications for cancer therapy. Oncogene. 21, 5483-5495 (2002).
- Stresemann, C., Lyko, F. Modes of action of the DNA methyltransferase inhibitors azacytidine and decitabine. International Journal of Cancer. 123 (1), 8-13 (2008).
- Ledda, S., Idda, A., Kelly, J., Ariu, F., Bogliolo, L., Bebbere, D. A novel technique for in vitro maturation of sheep oocytes in a liquid marble microbioreactor. Journal of Assisted Reproduction and Genetics. 33 (4), 513-518 (2016).
- Vadivelu, R. K., et al. Generation of three-dimensional multiple spheroid model of olfactory ensheathing cells using floating liquid marbles. Scientific Reports. 5, 15083 (2015).
- Vadivelu, R. K., Kamble, H., Munaz, A., Nguyen, N. T. Liquid Marble as bioreactor for engineering three-dimensional toroid tissues. Scientific Reports. 7 (1), 12388 (2017).
- Vadivelu, R. K., Kamble, H., Munaz, A., Nguyen, N. T. Liquid Marbles as bioreactors for the study of three-dimensional cell interactions. Biomedical Microdevices. 19 (2), 31 (2017).
- Varelas, X., et al. TAZ controls Smad nucleocytoplasmic shuttling and regulates human embryonic stem-cell self-renewal. Nature Cell Biology. 10 (7), 837-848 (2008).
- Panciera, T., et al. Induction of Expandable Tissue-Specific Stem/Progenitor Cells through Transient Expression of YAP/TAZ. Cell Stem Cell. 19 (6), 725-737 (2016).
- Pennarossa, G., Paffoni, A., Ragni, G., Gandolfi, F., Brevini, T. A. L. Rho signaling-directed YAP/TAZ regulation encourages 3D spheroid colony formation and boosts plasticity of parthenogenetic stem cells. Advances in Experimental Medicine and Biology. 1237, 49-60 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유