Method Article
Крыса Модель давления Перегрузки индуцированной умеренной ремоделирования и систолической дисфункции в противоположную систолическую сердечную недостаточность
В этой статье
Резюме
Мы описываем создание крысиной модели давления перегрузки индуцированной умеренной реконструкции и ранней систолической дисфункции, где сигнал трансдукции пути, участвующие в начале процесса реконструкции активируются. Эта модель животных поможет в определении молекулярных целей для применения ранних терапевтических стратегий борьбы с реконструкцией для сердечной недостаточности.
Аннотация
В ответ на травму, такую как инфаркт миокарда, длительная гипертония или кардиотоксическое средство, сердце изначально адаптируется через активацию путей трансдукции сигнала, чтобы противодействовать, в краткосрочной перспективе, для сердечной потери миоцита и или увеличения напряжения стенки. Однако длительная активация этих путей становится вредной, что приводит к инициированию и распространению ремоделирования сердца, что приводит к изменениям в геометрии левого желудочка и увеличению объемов левого желудочка; фенотип, наблюдаемый у пациентов с систолической сердечной недостаточностью (HF). Здесь мы описываем создание крысиной модели давления перегрузки индуцированной умеренной реконструкции и ранней систолической дисфункции (MOD) путем восходящего аортального бандажа (AAB) через сосудистый клип с внутренней площадью 2 мм2. Операция проводится на 200 г крыс Спраг-Доули. Фенотип MOD HF развивается через 8-12 недель после ААБ и характеризуется неинвазивно с помощью эхокардиографии. Предыдущая работа предполагает активацию путей трансдукции сигнала и измененную экспрессию генов и посттрансляционную модификацию белков в фенотипе MOD HF, которые имитируют те, которые наблюдаются в систолическом HF человека; поэтому, что делает ФЕнотип MOD HF подходящей моделью для трансляционных исследований для выявления и тестирования потенциальных терапевтических целей по борьбе с ремоделированием в HF. Преимущества фенотипа MOD HF по сравнению с явным систолическим фенотипом HF заключается в том, что он позволяет выявлять молекулярные цели, участвующие в процессе ранней реконструкции и раннее применение терапевтических вмешательств. Ограничение фенотипа MOD HF заключается в том, что он не может имитировать спектр заболеваний, ведущих к систолическим HF у человека. Кроме того, это сложный фенотип для создания, как AAB хирургии связано с высокой смертностью и отказов только с 20% эксплуатируемых крыс развивающихся желаемого фенотипа HF.
Введение
Сердечная недостаточность (HF) является распространенным заболеванием и связано с высокой заболеваемости и смертности1. Модели HF, связанные с перегрузкой давления грызунов (PO), созданные восходящим или поперечным аортическим перевязкой, обычно используются для изучения молекулярных механизмов, ведущих к HF, и для проверки потенциальных новых терапевтических целей в HF. Они также имитируют изменения, наблюдаемые в hF человека вторичной длительной системной гипертензии или тяжелой стеноз аорты. После PO, левая стенка желудочка (LV) постепенно увеличивается в толщине, процесс, известный как концентрическая гипертрофия LV (LVH), чтобы компенсировать и адаптировать для увеличения напряжения стены LV. Однако, это связано с активацией ряда неадаптивных сигнальных путей, которые приводят к нарушениям в велоспорте кальция и гомеостаза, метаболической и внеклеточной матрице ремоделирования и изменениям в экспрессии генов, а также усиленным апоптозом и аутофагией2,,33,4,5,6. Эти молекулярные изменения представляют собой триггер для начала и распространения миокарда ремоделирования и перехода в декомпенсированный фенотип HF.
Несмотря на использование инбредных штаммов грызунов и стандартизацию размера клипа и хирургической техники, существует огромная фенотипическая изменчивость в структуре камеры LV и функции в аортальной бандаж модели7,8,9. Фенотипическая изменчивость встречается после PO у крыс, штамм Sprague-Dawley, описывается в другом месте10,11. Из них два Фенотипа HF встречаются с доказательствами миокарда ремоделирования и активации путей трансдукции сигнала, ведущих к состоянию повышенного окислительного стресса. Это связано с метаболической ремоделированием, измененной экспрессией генов и изменениями в постпереводной модификации белков, в целом играющих роль в процессе ремоделирования10,12. Первый является фенотипом умеренной ремоделирования и ранней систолической дисфункции (MOD), а второй - фенотипом откровенного систолического HF (HFrEF).
Модель PO HF выгодна по сравнению с моделью инфаркта миокарда (MI) HF, потому что вызванные PO окружной и меридиональных настенных напряжений однородны распределены по всем сегментам миокарда. Тем не менее, обе модели страдают от изменчивости в тяжести PO10,11 и в infarct размер13,14 наряду с интенсивным воспалением и рубцов на infarct сайте15, а также прилипание к грудной стенке и окружающих тканей, которые наблюдаются в модели MI HF. Кроме того, крысы PO индуцированных HF модель является сложной задачей для создания, как это связано с высокой смертностью и отказов10, и только 20% из эксплуатируемых крыс развивающихся MOD HF фенотип10.
Мод является привлекательным Фенотипом HF и представляет собой эволюцию традиционно созданного фенотипа HFrEF, поскольку он позволяет раннее таргетинг путей передачи сигнала, которые играют роль в ремоделировании миокарда, особенно когда он относится к возмущениям в митохондриальной динамике и функции, метаболизме миокарда, евидуке и внеклеточной матрице ремоделирования. Эти патофизиологические процессы очень очевидны в фенотипе MOD HF11. В этой рукописи мы описываем, как создать фенотипы MOD и HFrEF, и мы устраняем подводные камни при выполнении восходящей процедуры аортального бандирования (AAB). Мы также подробно о том, как лучше всего охарактеризовать эхокардиографии двух HF фенотипов, MOD и HFrEF, и как отличить их от других фенотипов, которые не в состоянии развивать сяртовое PO или которые развиваются тяжелые PO и концентрической реконструкции, но без значительных эксцентричный ремоделирования.
протокол
Все методы и процедуры, описанные здесь, были одобрены Институциональным комитетом по уходу и использованию животных (IACUC) Медицинской школы Тулейнского университета.
1. Инструменты и инструменты для создания модели AAB
- Получайте дезинфицирующие средства, такие как 70% изопропиловый спирт и повидон-йод.
- Получить кетамин и ксилазин для анестезии и бупренорфина для обезболивания.
- Получить грелку и тяжелые абсорбции одноразовые underpad с размерами 18 дюймов х 30 дюймов.
- Получить 100% хлопчатобумажный шпагат рулон, лента и клипер для волос.
- Получить 20 см х 25 см пластиковой доске, толщина колеблется от 3-5 мм.
- Получите волоконно-оптический иллюминатор з-LITE.
- Получить механический вентилятор для мелких животных (например, SAR-830/AP).
- Получить 2-0 и 3-0 Vicryl конус швы и нейлона 3-0 монофиловых швов, стерильные марлевые прокладки и стерильные дополнительные большие кончики хлопка и стерильные перчатки.
- Получить 16 G ангиокат для интубации.
- Приобретите следующие хирургические инструменты.
- Получить Weck из нержавеющей стали Hemoclip перевязки и нержавеющей стали ligating клипы.
- Получить затвердевшей тонкой радужной оболочки ножницы.
- Получить Adson щипкете.
- Получить два изогнутых щиптого Graefe.
- Получить Halsted-Москито Hemostats-прямые щипцы.
- Получите держатель иглы Майо-Хегара.
- Получить Alm груди ретрактор с тупыми зубами.
- Используйте и получите автоклав и стерилизатор из биса.
2. Восходящая аортаическая хирургическая процедура бандажирования
- Анестезия животного с интраперитонеальной инъекции смеси 75-100 мг/кг кетамин и 10 мг/кг ксилазин.
ПРИМЕЧАНИЕ: Разрешить несколько минут для животного, чтобы быть полностью успокоительное и вялым. Если анестетической дозы недостаточно и животное все еще движется в клетке, повторно вводить животное с той же обеззараживаением дозы после предоставления достаточновремени времени, около 5-10 минут между последующими инъекциями. Большинству животных требуется 1-2 инъекции для достижения глубокой седации и анестезии. - Бритьволосы на хирургическом участке, расположенном в правой боковой грудной области под правой подмышкой.
- Стабилизировать животное, аккуратно лентой все четыре конечности на пластиковую доску. Затем выполните эндотрахеялки интубации с 16 G ангиокат. После того, как животное успешно интубировано, инициируйте механическую вентиляцию с приливными объемами 2 мл при 50 циклах/мин и FiO2 из 21%. Ищите симметричный рост в груди стены с каждым дыханием.
- Поверните животное медленно, чтобы лечь на левую боковую сторону, а затем согнуть хвост в U-образной манере и стабилизировать его, аккуратно лентой его на пластиковую доску. Затем идите вперед и дезинфицировать бритую область с актуальным применением повидон-йод.
- Проникайте в кожу в месте разреза с смесью 50/50 по объему 1-2% лидокаина/0,25-0,5 % Бупивакаин в качестве упреждающей анальгезии перед созданием разреза.
- Выполните правый горизонтальный разрез кожи, 1-2 сантиметра в длину, в правой подмышечной области 1 см ниже правой подмышки. Затем вскрыть грудной мышечный слой до достижения грудной клетки грудной клетки. Сделайте 1 см торакотомии между2-й и3-й грудной клетки.
- При вскрытии мышечного слоя груди, будьте осторожны и избежать повреждения правой подмышечной артерии, которая проходит под правой подмышкой.
ПРИМЕЧАНИЕ: Торакотомия выполняется между1-й и2-й ребро несет в себе риск полоскания правой брахиоцефалической артерии вместо восходящей аорты. Торакотомия между3-м и четвертым ребро затрудняет визуализацию и полосу восходящей аорты, так как оператор будет смотреть на правое предсердие.
ПРИМЕЧАНИЕ: Избегайте расширения торакотомии слишком медиально к грудине, чтобы избежать вскрытия и травмирования правой внутренней молочной артерии.
- При вскрытии мышечного слоя груди, будьте осторожны и избежать повреждения правой подмышечной артерии, которая проходит под правой подмышкой.
- Вскрыть две доли тимуса железы осторожно и нажмите их друг от друга на стороне. Затем определите восходящую аорту и изолировать ее от верхней полы вены тупым рассечением через изогнутые щипцы Graefe.
ПРИМЕЧАНИЕ: Значительные манипуляции с железой тимуса сделает его опухшим и делает его трудно визуализировать восходящей аорты.- Вскрыть начальник полы вены от аорты с дополнительной осторожностью, чтобы избежать травмы или разрыв верхней полы вены, которая является фатальной. Это может быть сложнее часть процедуры и, как ожидается, произойдет время от времени даже в самых опытных руках, но часто с новичками и учащимися.
- Поднимите мягко восходящей аорты с изогнутыми щипками Graefe и поместите сосудистый клип вокруг восходящей аорты.
- Отрегулируйте инструмент перевязки сосудистого гемоклипа с помощью пластиковой предварительно вырезанной части 7", чтобы получить сосудистый зажим желаемой внутренней области 1,5 мм2 или 2 мм2,в зависимости от того, какая модель HF желательна.
- Шов грудной клетки через Викрил 2-0 монофилатамент шов. Затем шов мышечного слоя груди через 3-0 Vicryl конус шов. Затем шов разрез кожи через нейлон 3-0 монофиломент шов.
- Администрирование комбинации следующих препаратов после завершения операции в течение 48-72 часов, чтобы служить в качестве обезболивания в послеоперационный период: 1) Бупренорфин 0,01-0,05 мг/кг субкожно каждые 8-12h, 2) Meloxicam 2 мг/кг подкожно каждые 12h, и 3) Морфин 2,5 мг/кг подкожно каждые 2-4h по мере необходимости для сильной боли.
ПРИМЕЧАНИЕ: Оставьте животное, чтобы восстановить на грелке под регулярным наблюдением. Как только животное проявляет признаки выздоровления от анестезии (способно дышать спонтанно - без признаков задыхаясь или использования вспомогательных мышц более двух минут - и имеет хорошие рефлексы, красные и теплые конечности), выдвинет животное и верните его в клетку.
3. Эхокардиография
- Успокоите животное интраперитонеальной инъекцией 80-100 мг/кг кетамина. Обеспечить адекватное седляции для правильного приобретения хорошего качества эхо изображения.
ПРИМЕЧАНИЕ: Использование изофрурана в качестве анестезии не рекомендуется для его кардиодепрессор эффект, особенно в условиях сильной перегрузки давления и может дать ложное впечатление о lv расширение и систолической дисфункции, которая решает раз животное от анестезии.- Будьте осторожны и вводить половину или даже одну треть дозы кетамина у животных, которые выглядят обезнотакими и тахипнейными с подозрением, что они разработали фенотип HFrEF.
- Бритье волос груди, передняя, в полностью успокоительное животное.
- Положите животное на спину и стабилизировать его на пластиковую доску.
- Приобретите 2D парастернальной длинной оси и 2D парастернальной короткой оси вид клипс на уровне папиллярной мышцы. Кроме того, получить M-режим изображения из короткого парастернальной оси зрения на уровне папиллярной мышцы для измерения LV перегородки и задней толщины стены в диастоле, а также LV конечно-диастолический и конечный систолический диаметр.
- Приобретайте изображения или клипы с частотой сердечных сокращений 370 - 420 ударов в минуту, чтобы обеспечить надлежащую оценку размера и функции LV. Приобретение изображений при более низких сердечных приступах приведет к ложному впечатлению депрессии функции LV и расширения LV.
ПРИМЕЧАНИЕ: Приобретение предисосновенных 2D длинных изображений парастернальной оси/клипов приводит к ложным измерениям. Для целей контроля качества, убедитесь, что вершина LV и аорто-митральный угол визуализируется в пределах той же плоскости разреза. - Приобретите 2D короткие изображения парастернальной оси/клипы на уровне средней папиллярной мышцы. Это послужит отсылкой к получению надежных серийных и последующих измерений LV, следуя за животными с течением времени в течение всего периода исследования.
- Приобретайте изображения или клипы с частотой сердечных сокращений 370 - 420 ударов в минуту, чтобы обеспечить надлежащую оценку размера и функции LV. Приобретение изображений при более низких сердечных приступах приведет к ложному впечатлению депрессии функции LV и расширения LV.
- Получение M-режима изображения в длинном видпарастеральной оси на уровне аортального клапана для оценки относительной аорты левого атриума (LA) диаметр в конце систолы.
ПРИМЕЧАНИЕ: животные с фенотипами МОД и HFrEF должны показать доказательства расширения LA с la/Ao соотношение составляет 1,25 и lt;1,5 в ФЕнотипе MOD HF и 1,5 в фенотипе HFrEF10.
Результаты
Характеристика фенотипов HF, которые развиваются через 8-12 недель после AAB, может быть легко выполнена с помощью эхокардиографии. Представитель M-режим изображения Шам, Неделя 3 пост-AAB, MOD и HFrEF фенотипы представлены на рисунке 1A. На рисунке 1B и Рисунок 1C показан размер сосудистого клипа для создания фенотипа MOD HF и фенотипа HFrEF, соответственно. Объемы лВ-диастолических (LVEDV) и конечного систолического (LVESV) можно было бы вычислить с помощью формулы метода длины области: V'5/6'A'L, где V является объемом в мл; A - это поперечная секционная область полости LV всм 2,полученная из короткого вида парастеральной оси на уровне среднепапиллярной мышцы в диастоле (Ad) и в систоле (As); и L — это длина полости LV в см, измеренная с длинной парастеральной оси, как расстояние от вершины эндокардиального LV до митрально-аортального соединения в диастоле (Ld) и в систоле (Ls). Представитель 2D длинной парастернальной оси и короткие изображения эхокардиографии парастеральной оси, с иллюстрацией о том, как измерить Ld, Ls, Ad и As, в Шаме и МОД HF фенотип представлены на рисунке 2. LVEDV в фенотипе MOD HF обычно колеблется между 600 - 700 л, при этом очень мало животных, имеющих LVEDV больше, чем 700 л и до 1000 л; в то время как LVESV в фенотипе МОД колеблется от 120 до 160 л(таблица 1). Из 2D короткий парастернальной оси зрения эхокардиографии изображения, представленные на рисунке 2, можно было бы оценить степень LVH в мод фенотип по сравнению с обманом. Репрезентативные петли шама, 3 недели после ААБ, МО и фенотипов HFrEF представлены на рисунке 3. Максимальное давление LV составляет не менее 200 мм рт. ст., даже на неделе 3 после ААБ, и увеличивается еще больше на неделе 8 после AAB из-за несоответствия между ростом животного и аорты и фиксированной созданной стеноз в восходящей аорты. Обратите внимание, что животные на 3-й неделе после AAB полностью компенсированы с переходом LVEDV и LVESV влево по сравнению с обманом. С прогрессивной эксцентричной гипертрофией и ремоделированием, происходит сдвиг в LVEDV и LVESV вправо в моде и HFrEF фенотипов по сравнению с неделей 3 после AAB. Можно было бы оценить также значительное увеличение LVESV в фенотипе МОД и глубокое увеличение LVESV в фенотипе HFrEF, что отражает значительное и глубокое снижение объема инсульта и LVEF в фенотипах MOD и HFrEF, соответственно, по сравнению с неделей 3 после AAB. Кроме того, можно было бы оценить значительное увеличение LVEF на 3-й неделе после AAB и значительное снижение LVEF в фенотипе HFrEF по сравнению с обманом.
Модель HF, индуцированная крысой PO, связана с высокой смертностью и показателями отказов. Только около 20% крыс, которые проходят AAB, с сосудистой зажим 2 мм2 во внутреннем диаметре, будет переход на развитие моздовы HF фенотип. Представитель M-режима изображения не удавшихся фенотипов представлены на рисунке 4. Рисунок 4А показывает представитель M-режим изображения животных, которые не развиваются LVH на 8 неделе после AAB, и полностью потерял PO с полной регрессии LVH (sham-like) или имели переменную степень LVH и PO на неделе 8 после AAB вызывая мягкий-умеренный фенотип LVH. Вторая неудачная группа фенотипа представлена на рисунке 4B, показывающая репрезентативные изображения M-режима животных с тяжелым PO (максимальное давление LV)и тяжелым LVH, которые остались компенсированы без каких-либо доказательств эксцентричной реконструкции, концентрической ремоделирования (CR) группы, или с мягкой (MILD группы) эксцентричный ремоделирования. Эхокардиография и гемодинамические данные обмана, неудачных и успешных/желаемых фенотипов представлены на рисунке 5 и таблице 1. Обратите внимание на прогрессивное увеличение веса сердца и LV, как животные переход от компенсированного фенотипа к более эксцентричный и реконструированный фенотип. Кроме того, наблюдается экспоненциальное увеличение LVESV и снижение LVEF, как животные переход от компенсированной концентрической реконструкции к декомпенсированной эксцентрично реконструированный фенотип. Особый интерес представляет то, что как МОД, так и Фенотипы HF HF имеют сходную степень жесткости миокарда, измеряемую жесткостью-коэффициентом - конечно-диастолического отношения объема давления (EDPVR (mmHg/l)) по сравнению со всеми другими фенотипами, в то время как происходит постепенное снижение эффективности LV в качестве перехода животных к более эксцентричному ремодельному. Эффективность LV рассчитывается из отношений объема объема конечных систолического давления (ESPVR), разделенных артериальным эластированием (EA). Несмотря на то, что нет существенной статистической разницы в ESPVR и ESPVR/EA между МОД и Фенотипами HFrEF и фиктивной группой, это ложно, так как фенотипы MOD и HFrEF имеют значительно более высокое концестольное давление LV по сравнению с фиктивным, что делает склон ESPVR ложно крутее со сдвигом в V0 вправо по сравнению с шамом. Кроме того, когда ФЕнотипы МОД и HFrEF сравниваются с компенсированными и концентрически реконструированных фенотипами, которые имеют такую же степень PO, то можно было бы оценить значительное и прогрессивное увеличение LVESV и падение ESPVR и ESPVR/EA с Table 1прогрессивной эксцентричной ремоделированием, как это наблюдается в MOD и HFrEF фенотипы по сравнению с CR и P/Figure 5

Рисунок 1: Представитель фенотипов сердечной недостаточности на неделе 8 после восходящего аорты полосы. (A) Представитель M-режим изображения фиктивных животных, животных через три недели после восходящего аорты бандаж (AAB) и восемь недель после AAB. Рисунок 1A был изменен из Chaanine et al., Американский журнал физиологии и физиологии сердечного и циркулятора, 2016. (B) Размер сосудистого клипа для создания тяжелой гипертрофии левого желудочка (LVH) с умеренной эксцентричной реконструкцией (MOD). (C) Размер сосудистого клипа для создания тяжелой LVH с явной систолической сердечной недостаточностью (HFrEF). Цифры 1B и 1C были получены и изменены от Chaanine et al., Методы молекулярной биологии, 2018. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
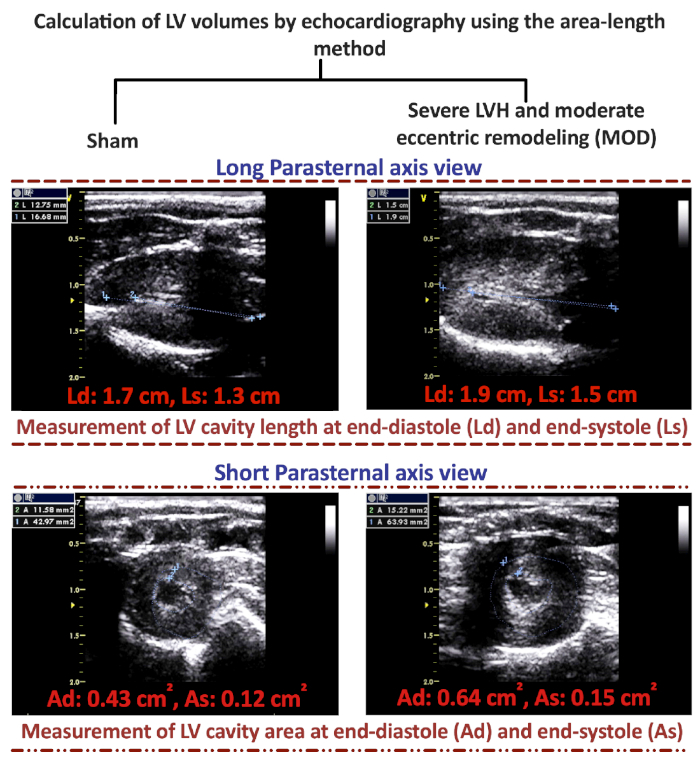
Рисунок 2: Вычисление объемов левого желудочка с помощью эхокардиографии с помощью метода длины области. Представитель 2D длинные парастернальной и 2D короткий парастернальной оси зрения эхокардиографии изображения для измерения левого желудочка (LV) длина полости в диастоле (Ld) и в систоле (Ls) и LV полости поперечной области в диастоле (Ad) и в систоле (As) для того, чтобы вычислить объемы LV в конце диастолы и systole. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
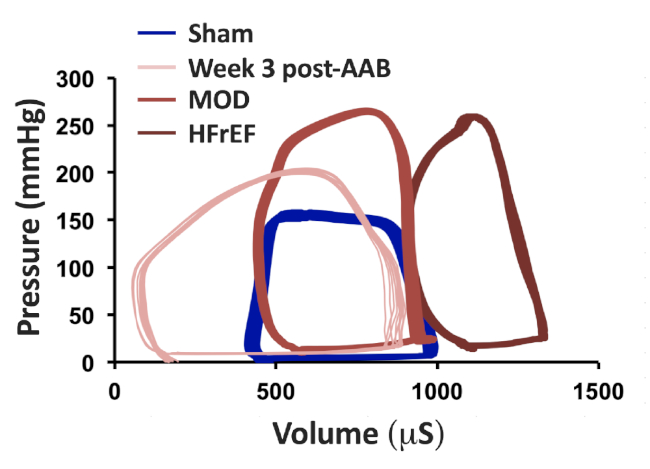
Рисунок 3: Отслеживание петли давления-объема было получено через катетер давления крысы 1.9 F- с использованием открытой комода и левого желудочкового подхода apical прокола. Отслеживание циклов типа давления в Шаме, неделя 3 после AAB, MOD и фенотипов HFrEF на 8-й неделе после AAB. Рисунок был изменен из Chaanine и др., Циркуляция: Сердечная недостаточность, 2013. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
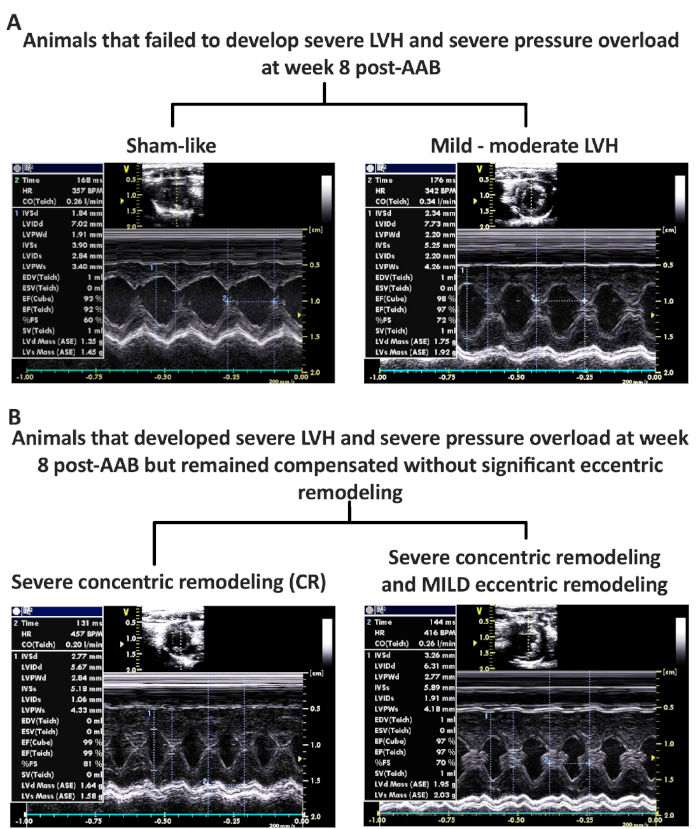
Рисунок 4: Столкнулись фенотипов на неделе 8 после AAB с неспособностью развивать желаемый фенотип сердечной недостаточности (ы). (A) Представитель M-режим изображения животных, которые потеряли перегрузки давления (PO) и не развивать LVH (Sham-как) и тех, с переменной PO и LVH (мягкий-умеренный LVH) фенотипов. (B) Представитель M-режим изображения животных, которые разработали тяжелые PO, LVH и концентрической реконструкции (CR), но без (CR) или с мягким (MILD) эксцентричный ремоделирования фенотипов. Рисунок 4B был изменен из Chaanine et al., Journal of American Heart Association, 2017. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Параметры петли эхокардиографии и давления объема в различных фенотипах. Данные представлены в виде индивидуальных значений (точек) с медианой (горизонтальной линией) в различных фенотипах на 8-й неделе после ААБ. Результаты статистического анализа представленных данных в различных фенотипах отображаются в таблице 1. LVESV: левый желудочковой конечный систолический объем, LVEF: левая фракция выброса желудочка, EDPVR: конечная диастолическая связь с объемом давления, ESPVR: конечная систолическая связь объема давления, EA: артериальная эластика. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Шам (n'5) | Шам-как (n'5) | Мягкий мод LVH (n'8) | CR (n-11) | MILD (n-14) | Мод (n-14) | HFrEF (n'5) | |
| Вес тела (г) | 594 х 37 | 466 и 66 | 464 х 22 | 497 и 43 | 530 и 59 | 478 х 39 | 546 и 18 |
| HW (мг) | 1269 г. 124,5 | 1328 г. 119 | 1614 г. - 177 | 1645 г. и 191а | 1821 г. - 169а,b | 2106 292a,b,c,d,e | 2897 й 182a,b,c,d,e,f |
| LVW (мг) | 897 - 94 | 968 х 91 | 1161 г. 144 г. | 1222 г. 152а | 1372 г. 135а,б | 1580 и 219a,b,c,d,e | 1726 г. 82а,б,к,д,зе |
| RVW (мг) | 218 х 22 | 218 х 23 | 266 и 24 | 239 и 26 | 249 х 26 | 283 и 42а,b | 565 й 76a,b,c,d,e,f |
| IVSd (см) | 0,19 х 0,01 | 0,21 евро 0,01 | 0,23 и 0,01а | 0,29 и 0,01а, б,c | 0,28 и 0,02а, б,c | 0,28 и 0,01а, б,c | 0,28 и 0,02а, б,c |
| LVPWd (см) | 0,20 и 0,01 | 0,21 евро 0,02 | 0,24 и 0,01а,b | 0,29 и 0,02а, б,c | 0,28 и 0,02а, б,c | 0,28 и 0,01а, б,c | 0,30 и 0,02а, б,c |
| LVEDV (Лл) | 560,5 и 25,8 | 570 и 32 | 668 и 143 | 442 и 42,c | 583 х 45d | 697 и 129d,e | 881.5 55.7a,b,c,d,e,f |
| LVESV (L) | 105,9 и 8,9 | 93 и 15 | 111 и 20 | 59 и 7a,b,c | 85,3 и 10,6д | 139.7 и 22.5a,b,c,d,e | 319.2 51.5a,b,c,d,e,f |
| LVEF (%) | 81.1 и 1,2 | 83,7 и 2,9 | 83,1 и 2,5 | 86,5 и 2,2а, c | 85,4 и 1,7а | 79,8 и 1,9б,c,d,e | 64.1 и 3.6a,b,c,d,e,f |
| LVPmax (ммГг) | 121 и 19 | 126 и 23 | 186 и 23а,b | 218 и 18а,b | 221 и 22а, б,к | No 234 и 25а, б, к | 262 и 16a,b,c,d,e |
| EDPVR (ммГ/л) | 0,018 и 0,005 | 0,017 и 0,004 | 0,041 и 0,013 | 0,043 и 0,017 | 0,039 х 0,015 | 0,068 евро 0,025а,б,к,д,д,е | 0,079 й 0,017a,b,c,d,e |
| ESPVR/EA | 1,57 и 0,67 | 1,96 и 0,61 | 2,63 и 1,52 | 3,35 и 1,23а | 2,62 и 0,55 | 1,63 евро 0,41д | 0,82 и 0,24c,d,e |
| Данные представлены в виде среднего стандартного отклонения. Статистический анализ проводился с использованием односторонней ANOVA. P злт; 0,05 был признан значительным. | |||||||
| аП Злт; 0,05 против Шама | |||||||
| б.П. Злт; 0,05 против Шам-как | |||||||
| cP Злт; 0,05 против Mild-modearte LVH | |||||||
| dP Злт; 0,05 против CR | |||||||
| eP Злт; 0,05 против MILD | |||||||
| fP Злт; 0,05 против МОД | |||||||
| Зн6 | |||||||
| Аббревиаты: HW: вес сердца, LVW: вес левого желудочка, RVW: вес правого желудочка, IVSd: толщина стенки перегородки в диастоле, LVPWd: толщина задней стенки левого желудочка в диастоле. LVEDV: левый желудочковой конечный диастолический объем, LVESV: левый желудочковой конечный систолический объем, LVEF: левая фракция выброса желудочка, LVPmax: левожелудочковое максимальное давление, EDPVR: конечная диастолическая связь с давлением, ESPVR: конечная систолическая связь с давлением, EA: | |||||||
Таблица 1: Эхокардиография и параметры давления объема в Шаме, Шам-подобном, мягко-умеренном LVH, CR, MILD, MOD и фенотипах HFrEF.
Обсуждение
После PO, связанных с AAB в крысы, LV проходит концентрическую реконструкцию за счет увеличения толщины стены LV, известный как концентрический LVH, как компенсационный механизм для противодействия для увеличения стресса стены LV. Увеличение толщины стены LV становится заметным в течение первой недели после AAB и достигает своей максимальной толщины на 2-3 недели после AAB. В течение этого периода времени, активация неправильной пути трансдукции сигнала приводит к постепенному расширению LV с увеличением объемов LV, процесс, известный как эксцентричная гипертрофия или ремоделирования. Ожидается, что фенотип HF у крыс развивается около 8 недель после AAB в большинстве животных с немногими из них развивающихся HF на неделе 12 после AAB. В зависимости от тяжести AAB возникают два фенотипа HF в зависимости от тяжести ААБ. Фенотип Мода получен путем создания восходящего аортального бандажа (AAB) с сосудистой зажимом 2 мм2 внутреннего диаметра, в то время как для создания фенотипа HFrEF требуется AAB с более жесткой сосудистой зажимом 1,5 мм2 внутреннего диаметра. Важно выполнять эхокардиографию в течение 2-3 недель после восходящего аорты, чтобы проверить наличие тяжелой концентрической LVH. Тяжелый LVH определяется как LV перегородки и задней стены толщиной в 1,5 раза нормально (0,19 см), и обычно колеблется между 0,27 - 0,3 см. Животные, которые не развиваются тяжелые LVH на неделе 3 после AAB, будет считаться неудавшихся AAB и не должны следовать после этого. Те, которые разработали тяжелые LVH на неделе 3 после AAB, будет проходить эхокардиографии на 8 неделе после AAB для оценки развития желаемого фенотипа HF. Это не редкость, чтобы столкнуться с животными, которые имели серьезные LVH на неделе 3 после AAB иметь регрессии или разрешение LVH на неделе 8 после AAB, по причинам, которые мы будем рассматривать в последнем разделе обсуждения. Звери с тяжелой LVH и концентрической реконструкции без или с мягким эксцентричный ремоделирования на неделе 8 после AAB, поэтому CR и MILD фенотипов, соответственно, вряд ли развивать дальнейшее эксцентричное ремоделирование, даже если они следуют в течение длительного месяца или двух. Те, которые находятся между MILD и мод фенотип, может разработать ФЕнотип MOD HF, если они следуют в течение еще одного месяца.
Модель PO крысы может быть разочарование из-за связанных высокой смертности и отказов10, несмотря на использование стандартизированных размер сосудистого клипа и хирургической техники, которая также добавляет к расходам на исследования, в связи с большим количеством животных, которые должны пройти AAB для того, чтобы достичь желаемого целевого числа (n), и продолжительность времени, что животные должны следовать, прежде чем они развивают желаемый hF фенотип. Неспособность развить тяжелый LVH связана либо с неудачной бандацией, либо с полосой правой брахиоцефалической артерии вместо аорты, что не редкость. Регрессия и/или разрешение тяжелой LVH в последующих оценках связана с образованием аневризмы и пери-полосой аорты ремоделирования, что приводит к потере в тяжести PO9. Остается неясным, почему животные с тяжелыми LVH и PO развивать фенотипической изменчивости в отношении эксцентричной реконструкции, несмотря на то, что тот же размер клипа, секс и деформации. Рекомендуется визуализировать восходящую аорту для скрининга для переделки аорты пери-диапазона и аневризма. Звери, которые развивают восходящую аневризму аорты в диаметре 1 см, должны быть усыплены, так как это вызовет одышку и бедствие животному из-за посягательства на окружающие структуры. Кроме того, рекомендуется проверить турбулентный поток по полосе по цвету Доплера, но, к сожалению, точная оценка градиента давления по всей полосе непрерывным Доплером не представляется возможным из-за невозможности выровнять непрерывный Доплер с направлением кровотока в восходящей аорте.
Мод является привлекательным HF фенотип и представляет собой эволюцию традиционно созданного hFrEF фенотипа, как это позволяет для ориентации сигнала трансдукции пути, которые играют роль в миокарда ремоделирования на ранних стадиях в процессе болезни, особенно когда она относится к возмущениям в митохондриальной динамики и функции, метаболизма миокарда и велосипедной и внеклеточной матрицы рефреймогенса; особенности, которые очень очевидны в MOD HF фенотип11. Кроме того, ранняя послеоперационная смертность (определяется как смертность в первые 7 дней после ААБ) ниже с размером клипа 2 мм2, для создания фенотипа МОД, чем размер клипа 1,5 мм2, для создания фенотипа HFrEF10, (5% против 21%, P 0,009 с помощью точного теста Фишера). Тем не менее, показатель успеха между двумя размерами клипов, для создания мода и HFrEF фенотипов, не является статистически значимым10, (20% против 13%, P 0,56 с помощью точного теста Фишера). Кроме того, аортатические полоски сосудистого клипа выгодно над аортальной повязкой, затягивая нейлоновый шов против 27 G иглы, техника часто используется для сужения поперечной аорты у мышей, потому что меньше вариаций в размере клипа и меньше травмы аорты по сравнению с техникой швы.
Модель PO HF выгодна по сравнению с моделью инфаркта миокарда (MI) HF, потому что по-индуцированный окружной и меридиональный стресс стены однородно распределен во всех сегментах миокарда. Тем не менее, обе модели страдают от изменчивости в тяжести PO10,11 и в infarct размер13,14 наряду с интенсивным воспалением и рубцов на infarct сайте15, а также прилипание к грудной стенке и окружающих тканей наблюдается в модели MI HF. Кроме того, крысы PO индуцированных HF модель является сложной задачей для создания, как это связано с высокой смертностью и отказов10, и только 20% из эксплуатируемых крыс развивающихся MOD HF фенотип10. По сравнению с спонтанно гипертонической крысы (SHR) модель, PO-индуцированной модели HF является лучшей моделью для изучения путей, связанных с миокарда ремоделирования. Увеличение посленагрузки и миокарда стены стресс в систоле гораздо выше в PO-индуцированной модели HF, чем модель SHR. Это займет около двух лет для SHR разработать систолический HF и механизм систолического HF не совсем известно, и путают старения16. Модель SHR и другие модели гипертонии, такие как модель соли DOCA, чаще используются для исследования механизмов и методов лечения, связанных с гипертонией и, возможно, диастолической дисфункцией16.
В заключение, ФЕнотип MOD HF является привлекательной моделью для изучения путей трансдукции сигнала в контексте ремоделирования миокарда и может быть использован для применения и тестирования потенциальных терапевтических стратегий, до проверки их эффективности в крупных моделях животных и в сердечной недостаточности человека.
Раскрытие информации
Все авторы не сообщают о конфликте интересов.
Благодарности
NIH предоставить HL070241 в P.D.
Материалы
| Name | Company | Catalog Number | Comments |
| Adson forceps | F.S.T. | 11019-12 | surgical tool |
| Alm chest retractor with blunt teeth | ROBOZ | RS-6510 | surgical tool |
| Graefe forceps, curved | F.S.T. | 11152-10 | surgical tool |
| Halsted-Mosquito Hemostats, straight | F.S.T. | 13010-12 | surgical tool |
| Hardened fine iris scissors, straight | Fine Science Tools F.S.T. | 14090-11 | surgical tool |
| hemoclip traditional-stainless steel ligating clips | Weck | 523735 | surgical tool |
| Mayo-Hegar needle holder | F.S.T. | 12004-18 | surgical tool |
| mechanical ventilator | CWE inc | SAR-830/AP | mechanical ventilator for small animals |
| Weck stainless steel Hemoclip ligation | Weck | 533140 | surgical tool |
Ссылки
- McMurray, J. J., Petrie, M. C., Murdoch, D. R., Davie, A. P. Clinical epidemiology of heart failure: public and private health burden. European Heart Journal. 19 (Suppl P), P9-P16 (1998).
- Berk, B. C., Fujiwara, K., Lehoux, S. ECM remodeling in hypertensive heart disease. Journal of Clinical Investigation. 117 (3), 568-575 (2007).
- Frey, N., Olson, E. N. Cardiac hypertrophy: the good, the bad, and the ugly. Annual Review of Physiology. 65, 45-79 (2003).
- Hill, J. A., Olson, E. N. Cardiac plasticity. New England Journal of Medicine. 358 (13), 1370-1380 (2008).
- Kehat, I., Molkentin, J. D. Molecular pathways underlying cardiac remodeling during pathophysiological stimulation. Circulation. 122 (25), 2727-2735 (2010).
- Rothermel, B. A., Hill, J. A. Autophagy in load-induced heart disease. Circulation Research. 103 (12), 1363-1369 (2008).
- Barrick, C. J., et al. Parent-of-origin effects on cardiac response to pressure overload in mice. American Journal of Physiology-Heart and Circulatory Physiology. 297 (3), H1003-H1009 (2009).
- Barrick, C. J., Rojas, M., Schoonhoven, R., Smyth, S. S. Cardiac response to pressure overload in 129S1/SvImJ and C57BL/6J mice: temporal- and background-dependent development of concentric left ventricular hypertrophy. American Journal of Physiology-Heart and Circulatory Physiology. 292 (5), H2119-H2130 (2007).
- Lygate, C. A., et al. Serial high resolution 3D-MRI after aortic banding in mice: band internalization is a source of variability in the hypertrophic response. Basic Research in Cardiology. 101 (1), 8-16 (2006).
- Chaanine, A. H., Hajjar, R. J. Characterization of the Differential Progression of Left Ventricular Remodeling in a Rat Model of Pressure Overload Induced Heart Failure. Does Clip Size Matter?. Methods in Molecular Biology (Clifton, N.J.). 1816, 195-206 (2018).
- Chaanine, A. H., et al. Mitochondrial Integrity and Function in the Progression of Early Pressure Overload-Induced Left Ventricular Remodeling. Journal of the American Heart Association. 6 (6), (2017).
- Chaanine, A. H., et al. Potential role of BNIP3 in cardiac remodeling, myocardial stiffness, and endoplasmic reticulum: mitochondrial calcium homeostasis in diastolic and systolic heart failure. Circulation: Heart Failure. 6 (3), 572-583 (2013).
- Takagawa, J., et al. Myocardial infarct size measurement in the mouse chronic infarction model: comparison of area- and length-based approaches. Journal of Applied Physiology (Bethesda, Md. : 1985). 102 (6), 2104-2111 (2007).
- Vietta, G. G., et al. Early use of cardiac troponin-I and echocardiography imaging for prediction of myocardial infarction size in Wistar rats. Life Sciences. 93 (4), 139-144 (2013).
- Frangogiannis, N. G. The inflammatory response in myocardial injury, repair, and remodelling. Nature Reviews. Cardiology. 11 (5), 255-265 (2014).
- Doggrell, S. A., Brown, L. Rat models of hypertension, cardiac hypertrophy and failure. Cardiovascular Research. 39 (1), 89-105 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены