Method Article
Un modèle de rat de surcharge de pression induit modéré remodelage et dysfonction systolique par opposition à l’insuffisance cardiaque systolique manifeste
Dans cet article
Résumé
Nous décrivons la création d’un modèle de rat de surcharge de pression induite transformant modéré et le dysfonctionnement systolique tôt où les voies de transduction de signal impliquées dans le déclenchement du processus de remodelage sont activées. Ce modèle animal aidera à identifier les cibles moléculaires pour l’application précoce des stratégies thérapeutiques anti-remodelage pour l’insuffisance cardiaque.
Résumé
En réponse à une blessure, comme l’infarctus du myocarde, une hypertension prolongée ou un agent cardiotoxique, le cœur s’adapte d’abord par l’activation des voies de transduction du signal, pour contrecarrer, à court terme, pour la perte cardiaque de myocyte et ou l’augmentation du stress mural. Cependant, l’activation prolongée de ces voies devient préjudiciable menant à l’initiation et à la propagation du remodelage cardiaque menant aux changements dans la géométrie ventriculaire gauche et aux augmentations des volumes ventriculaires gauches ; un phénotype vu dans les patients présentant l’insuffisance cardiaque systolique (HF). Ici, nous décrivons la création d’un modèle de rat de surcharge de pression induite transformant modéré et le dysfonctionnement systolique précoce (MOD) en montant le baguage aortique (AAB) via un clip vasculaire avec une zone interne de 2 mm2. La chirurgie est réalisée chez 200 g de rats Sprague-Dawley. Le phénotype de HF de MOD se développe à 8-12 semaines après AAB et est caractérisé non invasivement par le moyen de l’échocardiographie. Les travaux précédents suggèrent l’activation des voies de transduction de signal et l’expression de gène altérée et la modification post-translationnelle des protéines dans le phénotype de HF de MOD qui imitent ceux vus dans le HF systolique humain ; par conséquent, faire du phénotype DE HF de MOD un modèle approprié pour la recherche translationnelle afin d’identifier et de tester des cibles thérapeutiques potentielles anti-remodelage dans HF. Les avantages du phénotype de HF de MOD comparé au phénotype systolique manifeste de HF est qu’il permet l’identification des cibles moléculaires impliquées dans le processus de remodelage tôt et l’application tôt des interventions thérapeutiques. La limitation du phénotype de HF de MOD est qu’il ne peut pas imiter le spectre des maladies menant au HF systolique dans l’homme. En outre, il est un phénotype difficile à créer, comme la chirurgie AAB est associée à des taux élevés de mortalité et d’échec avec seulement 20% des rats opérés développant le phénotype désiré de HF.
Introduction
L’insuffisance cardiaque (HF) est une maladie répandue et est associée à une morbidité et une mortalité élevées1. Les modèles de surcharge de pression des rongeurs (PO), produits par le baguage aortique ascendant ou transversal, sont couramment utilisés pour explorer les mécanismes moléculaires menant à la HF et pour tester de nouvelles cibles thérapeutiques potentielles dans le HF. Ils imitent également les changements vus dans l’HF humain secondaire à l’hypertension systémique prolongée ou à la sténose aortique grave. Après PO, la paroi ventriculaire gauche (LV) augmente progressivement en épaisseur, un processus connu sous le nom d’hypertrophie concentrique de LV (LVH), pour compenser et adapter l’augmentation du stress de mur de LV. Cependant, cela est associé à l’activation d’un certain nombre de voies de signalisation inadaptées, qui conduisent à des dérangements dans le cyclisme de calcium et l’homéostasie, métabolique et extracellulaire matrice remodelage et les changements dans l’expression des gènes ainsi que l’apoptose améliorée et l’autophagie2,3,4,5,6. Ces changements moléculaires constituent le déclencheur de l’initiation et de la propagation du remodelage myocardique et de la transition vers un phénotype décompensé de HF.
Malgré l’utilisation de souches de rongeurs consanguines et la normalisation de la taille du clip et de la technique chirurgicale, il existe une variabilité phénotypique énorme dans la structure de la chambre LV et la fonction dans les modèles de baguage aortique7,8,9. La variabilité phénotypique rencontrée après PO dans le rat, souche Sprague-Dawley, est décrite ailleurs10,11. De ceux-ci, deux phénotypes de HF sont rencontrés avec l’évidence du remodelage myocardique et l’activation des voies de transduction de signal menant à un état de stress oxydatif accru. Ceci est associé au remodelage métabolique, à l’expression des gènes altérés et aux changements dans la modification posttranslationnelle des protéines, jouant tout à fait un rôle dans le processus de remodelage10,12. Le premier est un phénotype de remodelage modéré et de dysfonctionnement systolique précoce (MOD) et le second est un phénotype de HF systolique manifeste (HFrEF).
Le modèle DE PO de HF est avantageux par rapport au modèle d’infarctus du myocarde (MI) de HF parce que les contraintes circumferentielles et méridionales induites par le PO sont réparties de façon homogène sur tous les segments du myocarde. Cependant, les deux modèles souffrent de variabilité dans la sévérité de PO10,11 et dans la taille infarctus13,14 avec une inflammation intense et des cicatrices au site infarctus15 ainsi que l’adhésion à la paroi thoracique et les tissus environnants, qui sont observés dans le modèle MI de HF. En outre, le modèle HF induit par le rat PO est difficile à créer car il est associé à des taux élevés de mortalité et d’échec10, avec seulement 20% des rats opérés développant le phénotype de HFMOD 10.
Le MOD est un phénotype HF attrayant et constitue une évolution du phénotype HFrEF traditionnellement créé car il permet le ciblage précoce des voies de transduction du signal qui jouent un rôle dans le remodelage myocardique, en particulier quand il se rapporte à des perturbations dans la dynamique mitochondriale et la fonction, le métabolisme myocardial, le cycle du calcium et le remodelage de matrice extracellulaire. Ces processus pathophysiologiques sont très évidents dans le phénotype de HF de MOD11. Dans ce manuscrit, nous décrivons comment créer les phénotypes MOD et HFrEF et nous abordons les pièges tout en effectuant la procédure ascendante de baguage aortique (AAB). Nous avons également élaboré sur la meilleure façon de caractériser par l’échocardiographie les deux phénotypes HF, MOD et HFrEF, et comment les différencier d’autres phénotypes qui ne parviennent pas à développer PO grave ou qui développent po sévère et remodelage concentrique, mais sans remodelage excentrique significatif.
Protocole
Toutes les méthodes et procédures décrites ici ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux (IACUC) de l’École de médecine de l’Université tulane.
1. Outils et instruments pour la création du modèle AAB
- Obtenir des désinfectants, comme 70 % d’alcool isopropyl et de povidone-iode.
- Obtenez de la kétamine et de la xylazine pour l’anesthésie et la buprénorphine pour l’analgésie.
- Obtenez un coussin chauffant et un sous-bloc jetable à forte absorption avec les dimensions de 18 pouces x 30 pouces.
- Obtenez un rouleau de ficelle 100% coton, une bande et une tondeuse à cheveux.
- Obtenir une planche en plastique de 20 cm x 25 cm, l’épaisseur varie entre 3-5 mm.
- Obtenir un illuminateur de fibre optique Z-LITE.
- Obtenir un ventilateur mécanique pour les petits animaux (p. ex., SAR-830/AP).
- Obtenez 2-0 et 3-0 Vicryl sutures effilés et nylon 3-0 suture monofilament, tampons de gaze stériles et stériles extra larges pointes de coton et gants stériles.
- Obtenez 16 G d’angiocath pour l’intubation.
- Achetez les outils chirurgicaux suivants.
- Obtenez une ligature Hemoclip en acier inoxydable Weck et des clips de ligature en acier inoxydable.
- Obtenir des ciseaux d’iris fin durcis.
- Obtenir des forceps Adson.
- Obtenez deux forceps Graefe incurvés.
- Obtenez un halsted-Mosquito Hemostats-straight forceps.
- Obtenir un porte-aiguille Mayo-Hegar.
- Obtenez un rétracteur de poitrine d’Alm avec des dents émoussées.
- Utilisez et obtenez un autoclave et un stérilisateur perlé.
2. Procédure chirurgicale de baguage aortique ascendante
- Anesthésiez l’animal avec une injection intraperitonéale d’un mélange de 75-100 mg/kg de kétamine et de 10 mg/kg de Xylazine.
REMARQUE : Prévoyez quelques minutes pour que l’animal soit complètement sous sédatif et flasque. Si la dose anesthésique n’est pas suffisante et que l’animal se déplace toujours dans la cage, réinjectez à l’animal la même dose anesthésique après avoir accordé suffisamment de temps, environ 5-10 minutes entre les injections ultérieures. La plupart des animaux ont besoin de 1-2 injections pour atteindre la sédation profonde et l’anesthésie. - Rasez les cheveux sur le site chirurgical situé à la zone thoracique latérale droite sous l’aisselle droite.
- Stabiliser l’animal en scotchant doucement les quatre membres sur la planche en plastique. Ensuite, effectuer l’intubation endotrachéale avec un angiocath de 16 G. Après que l’animal a été intubé avec succès, initier la ventilation mécanique avec des volumes de marée de 2 ml à 50 cycles/min et FiO2 de 21%. Recherchez l’élévation symétrique de la paroi thoracique à chaque respiration.
- Tournez l’animal lentement pour s’allonger sur son côté latéral gauche, puis pliez la queue d’une manière en forme de U et stabilisez-la en l’encochant doucement à la planche en plastique. Ensuite, allez-y et désinfectez la zone rasée avec l’application topique de povidone-iode.
- Infiltrer la peau au site d’incision avec 50/50 mélange par volume de 1-2% Lidocaine/0.25-0.5% Bupivacaine comme analgésie préventive avant de faire l’incision.
- Effectuer une incision horizontale droite de la peau, 1-2 centimètres de long, dans la zone axillaire droite 1 cm au-dessous de l’aisselle droite. Ensuite, disséquez la couche musculaire thoracique jusqu’à ce qu’elle atteigne la cage thoracique thoracique. Faire une thoracotomie de 1 cm entre la cage thoracique de 2et 3rd.
- Tout en disséquant la couche musculaire de la poitrine, soyez prudent et évitez les blessures de l’artère axillaire droite, qui passe sous l’aisselle droite.
REMARQUE : La thoracotomie exécutée entre le1er et le 2nd rib comporte le risque de bander l’artère brachiocéphalique droite au lieu de l’aorte ascendante. La thoracotomie entre la3ème et la quatrième côte rend difficile de visualiser et de bander l’aorte ascendante, comme l’opérateur sera à la recherche de l’oreillette droite.
REMARQUE : Évitez d’étendre la thoracotomie trop medially vers le sternum pour éviter de disséquer et de blesser l’artère mammaire interne droite.
- Tout en disséquant la couche musculaire de la poitrine, soyez prudent et évitez les blessures de l’artère axillaire droite, qui passe sous l’aisselle droite.
- Disséquer les deux lobes de la glande thymus doucement et les pousser à part sur le côté. Ensuite, identifiez l’aorte ascendante et isolez-la du cava supérieur par dissection émoussée par l’intermédiaire d’un Foréfe incurvé.
REMARQUE : Une manipulation significative de la glande thymus la rendra enflée et rendra difficile la visualisation de l’aorte ascendante.- Disséquez le cava supérieur de vena de l’aorte avec une précaution supplémentaire pour éviter les blessures ou la rupture du cava supérieur de vena, qui est fatale. Cela peut être la partie la plus délicate de la procédure et on s’attend à ce qu’il se produise de temps en temps, même dans les mains les plus expérimentées, mais souvent avec les débutants et les apprenants.
- Soulevez doucement l’aorte ascendante avec un Foréfe incurvé et placez le clip vasculaire autour de l’aorte ascendante.
- Ajuster l’outil de ligature des hémoclips vasculaires via une pièce prédécoupée en plastique de 7 po pour obtenir un clip vasculaire de la zone interne désirée de 1,5 mm2 ou 2 mm2, selon le modèle HF souhaité.
- Suture le thorax via une suture Vicryl 2-0 monofilament. Puis suture la couche musculaire de la poitrine via une suture 3-0 Vicryl cône. Puis suture l’incision de la peau par un nylon 3-0 suture monofilament.
- Administrer une combinaison des médicaments suivants après l’achèvement de la chirurgie pendant 48-72 heures pour servir d’analgésie dans la période postopératoire: 1) Buprénorphine 0.01-0.05 mg/kg sous-cutanée tous les 8-12h, 2) Meloxicam 2 mg/kg sous-cutanée tous les 12h, et 3) Morphine 2,5 mg/kg sous-cutanée tous les 2-4h au besoin pour une douleur intense.
REMARQUE : Laissez l’animal récupérer sur un coussin chauffant sous surveillance régulière. Une fois que l’animal montre des signes de rétablissement de l’anesthésie (capable de respirer spontanément - sans preuve de haletant ou d’utilisation de muscles accessoires pendant plus de deux minutes - et a de bons réflexes, des extrémités rouges et chaudes), extubate l’animal et le retourner à la cage.
3. Échocardiographie
- Sedate l’animal avec l’injection intraperitonéale de 80-100 mg/kg de kétamine. Assurer une sédation adéquate pour l’acquisition appropriée d’images d’écho de bonne qualité.
REMARQUE : L’utilisation de l’isoflurane comme anesthésique est déconseillée pour son effet cardiodépresseur, particulièrement dans le réglage de la surcharge de pression grave et pourrait donner une fausse impression de dilatation de LV et de dysfonctionnement systolique qui résout une fois que l’animal est hors anesthésique.- Soyez prudent et administrez la moitié ou même un tiers de la dose de kétamine chez les animaux qui semblent dyspnéniques et tachypnériques avec suspicion qu’ils ont développé le phénotype HFrEF.
- Raser les cheveux de la poitrine, antérieurement, dans l’animal complètement sous sédatif.
- Posez l’animal sur le dos et stabilisez-le sur la planche en plastique.
- Acquérir 2D parasternal long axe et 2D parasternal short axis view clips au niveau du muscle papillaire. Aussi, obtenir des images en mode M de la vue courte de l’axe parasternal au niveau du muscle papillaire pour mesurer l’épaisseur septale et postérieure de la paroi LV dans la diastole ainsi que le diamètre fin-diastolique et fin-systolique de LV.
- Acquérir des images ou des clips à une fréquence cardiaque de 370 à 420 battements par minute pour assurer une évaluation appropriée de la taille et de la fonction de LV. L’acquisition d’images à des fréquences cardiaques plus basses conduira à une fausse impression de la fonction LV déprimée et de la dilatation de LV.
REMARQUE : L’acquisition d’images/clips d’axe parasternal 2D raccourcis mènent à de fausses mesures. Pour des raisons de contrôle de la qualité, assurez-vous que le sommet LV et l’angle aorto-mitral sont visualisés dans la même coupe de plan. - Acquérir 2D courte vue parasternale de l’axe images / clips au niveau du muscle papillaire mi. Cela servira de référence pour obtenir des mesures de série fiables et de Vbl subséquent tout en suivant les animaux au fil du temps tout au long de la période d’étude.
- Acquérir des images ou des clips à une fréquence cardiaque de 370 à 420 battements par minute pour assurer une évaluation appropriée de la taille et de la fonction de LV. L’acquisition d’images à des fréquences cardiaques plus basses conduira à une fausse impression de la fonction LV déprimée et de la dilatation de LV.
- Obtenez des images en mode M dans une longue vue parasternale de l’axe au niveau de la valve aortique pour évaluer le diamètre relatif aortique à gauche de l’atrium (LA) à la systole de fin.
REMARQUE : Les animaux avec les phénotypes de MOD et de HFrEF devraient montrer l’évidence de la dilatation de LA avec le rapport LA/Ao étant '1.25 et 'lt;1.5 dans le phénotype de HF de MOD et 1.5 dans le phénotype de HFrEF10.
Résultats
La caractérisation des phénotypes de HF, qui se développent 8-12 semaines suivant AAB, pourrait être facilement exécutée par l’échocardiographie. Les images représentatives en mode M de Sham, Semaine 3 post-AAB, MOD et phénotypes HFrEF sont présentées dans la figure 1A. La figure 1B et la figure 1C montrent la taille du clip vasculaire pour la création du phénotype de HF mod et du phénotype HFrEF, respectivement. Les volumes LV de fin-diastolique (LVEDV) et de fin systolique (LVESV) pourraient être calculés en utilisant les formules de la méthode de longueur de la zone : V-5/6'A-L, où V est le volume en ml ; A est la zone transversale de la cavité LV en cm2, obtenue à partir de la vue courte de l’axe parasternal au niveau du muscle papillaire moyen dans la diastole (Ad) et dans la systole (As); et L est la longueur de la cavité LV en cm, mesurée à partir de la longue vue de l’axe parasternal comme la distance de l’apex endocardial LV à la jonction mitral-aortique dans diastole (Ld) et en systole (Ls). Un long axe parasternal représentatif 2D et de courtes images d’échocardiographie de l’axe parasternal, avec illustration sur la façon de mesurer Ld, Ls, Ad et As, dans Sham et MOD HF phénotype sont présentés dans la figure 2. Le LVEDV dans le phénotype mod HF varie généralement entre 600 - 700 lL, avec très peu d’animaux ayant LVEDV plus de 700 L et jusqu’à 1000 'L; tandis que le LVESV dans le phénotype MOD varie entre 120 - 160 L (tableau 1). À partir des images d’échocardiographie de vue parasternale courtes 2D présentées dans la figure 2, on pouvait apprécier le degré de LVH dans le phénotype de MOD comparé à la feinte. Les tracés représentatifs en boucle de volume de pression des phénotypes Sham, Week 3 post-AAB, MOD et HFrEF sont présentés à la figure 3. La pression maximale LV est d’au moins 200 mmHg, même à la semaine 3 post-AAB, et augmente encore à la semaine 8 post-AAB en raison de l’inadéquation entre la croissance de l’animal et l’aorte et la sténose créée fixe dans l’aorte ascendante. Notez que les animaux à la semaine 3 post-AAB sont entièrement compensés par le déplacement du LVEDV et LVESV à gauche par rapport à la feinte. Avec l’hypertrophie excentrique progressive et le remodelage, il y a un changement dans LVEDV et LVESV à droite dans les phénotypes de MOD et de HFrEF comparés à la semaine 3 post-AAB. On pourrait également apprécier l’augmentation significative du LVESV dans le phénotype de MOD et l’augmentation profonde du LVESV dans le phénotype de HFrEF, qui reflète les diminutions significatives et profondes du volume d’AVC et du LVEF dans les phénotypes de MOD et de HFrEF, respectivement, comparés à la semaine 3 post-AAB. En outre, on pourrait apprécier l’augmentation significative de LVEF à la semaine 3 post-AAB et la diminution significative du LVEF dans le phénotype HFrEF par rapport à la simulacre.
Le modèle HF induit par le rat PO est associé à des taux élevés de mortalité et d’échec. Seulement environ 20% des rats qui subissent AAB, avec un clip vasculaire de 2 mm2 dans le diamètre interne, fera la transition pour développer le phénotype de HF DE MOD. Les images représentatives en mode M des phénotypes échoués sont présentées à la figure 4. La figure 4A montre des images représentatives en mode M d’animaux qui n’ont pas développé de LVH à la semaine 8 post-AAB, et qui avaient complètement perdu le PO avec une régression complète de LVH (comme un simulacre) ou qui avaient un degré variable de LVH et de PO à la semaine 8 post-AAB causant un phénotype LVH modéré. Le deuxième groupe de phénotype échoué est présenté dans la figure 4B montrant des images représentatives de M-mode d’animaux avec po grave (pression maximale de LV 'gt;200 mmHg) et LVH grave qui est resté compensé sans aucune preuve de remodelage excentrique, groupe de remodelage concentrique (CR), ou avec un léger (groupe MILD) remodelage excentrique. L’échocardiographie et les données hémodynamiques des phénotypes fictifs, défaillants et réussis/désirés sont présentées à la figure 5 et au tableau 1. Notez les augmentations progressives du poids cardiaque et du poids de LV pendant que les animaux passent d’un phénotype compensé à un phénotype plus excentrique et remodelé. En outre, il ya une augmentation exponentielle de LVESV et une diminution de LVEF que les animaux de transition d’un remodelage concentrique compensé à un phénotype décompensé excentriquement remodelé. L’intérêt particulier est que les phénotypes de volume de pression de mod et de HFrEF ont un degré similaire de rigidité myocardique tel que mesuré par la rigidité-coefficient de la relation de volume de pression fin-diastolique (EDPVR (mmHg/L)) comparé à tous les autres phénotypes, alors qu’il y a une diminution graduelle de l’efficacité de LV pendant que les animaux passent à un phénotype remodelé plus excentrique. L’efficacité de LV est calculée à partir de la relation de volume de pression fin-systolique (ESPVR) divisée par l’élasance artérielle (EA). Malgré cela, il n’y a pas de différence statistique significative dans ESPVR et ESPVR/EA entre le MOD et HFrEF phénotypes et le groupe de faux, c’est faussement le cas que les phénotypes MOD et HFrEF ont une pression LV fin-systolique significativement plus élevée par rapport à la feinte, ce qui rend la pente ESPVR faussement plus raide avec le déplacement de V0 à droite par rapport à la feinte. En outre, lorsque les phénotypes MOD et HFrEF sont comparés aux phénotypes compensés et remodelés concentriquement, qui ont le même degré de PO, alors on pourrait apprécier l’augmentation significative et progressive de LVESV et de baisse de ESPVR et ESPVR/EA avec le remodelage excentrique progressif, comme observé dans le MOD et les phénotypes HFrEF par rapport aux phenotypes CR et MILD(figure 5 et tableau 1).

Figure 1 : Phénotypes représentatifs d’insuffisance cardiaque à la semaine 8 suivant le baguage aortique ascendant. (A) Images en mode M représentatifs d’animaux fictifs, d’animaux trois semaines après le baguage aortique ascendant (AAB) et huit semaines après L’AAB. Figure 1A a été modifiée à partir de Chaanine et coll., American Journal of Physiology-Heart and Circulatory physiology, 2016. (B) taille vasculaire de clip pour la création de l’hypertrophie ventriculaire gauche sévère (LVH) avec le remodelage excentrique modéré (MOD). (C) taille de clip vasculaire pour la création de LVH sévère avec l’insuffisance cardiaque systolique manifeste (HFrEF). Les figures 1B et 1C ont été obtenues et modifiées à partir de Chaanine et coll., Methods in Molecular Biology, 2018. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
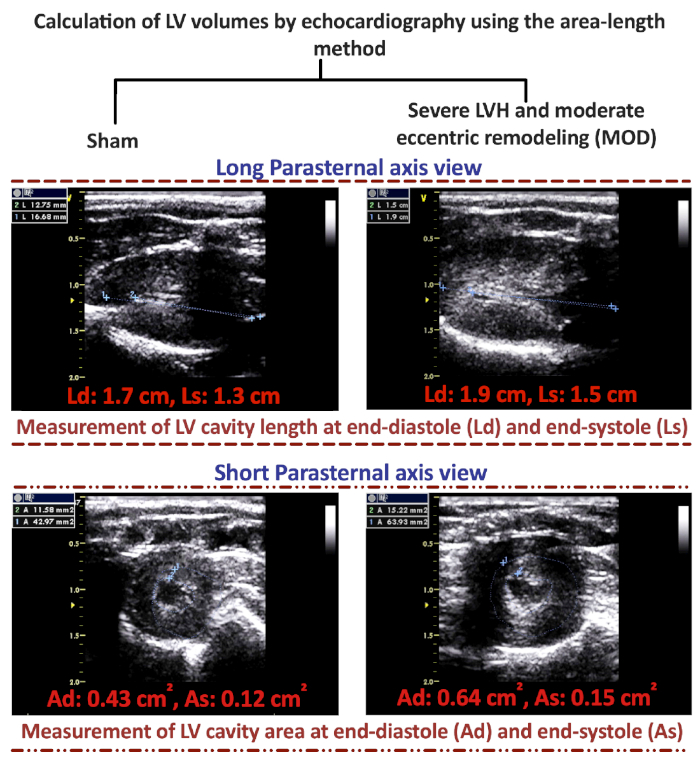
Figure 2 : Calcul des volumes ventriculaires gauches par échocardiographie à l’aide de la méthode de longueur de zone. Représentant 2D long parasternal et 2D courtes images parasternale d’avant-garde de l’échocardiographie pour mesurer la longueur gauche de cavité ventriculaire (LV) dans la diastole (Ld) et dans la systole (Ls) et la zone transversale de cavité de LV dans le diastole (Ad) et dans le systole (As) afin de calculer les volumes de LV à la fin du diastole et du systole. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
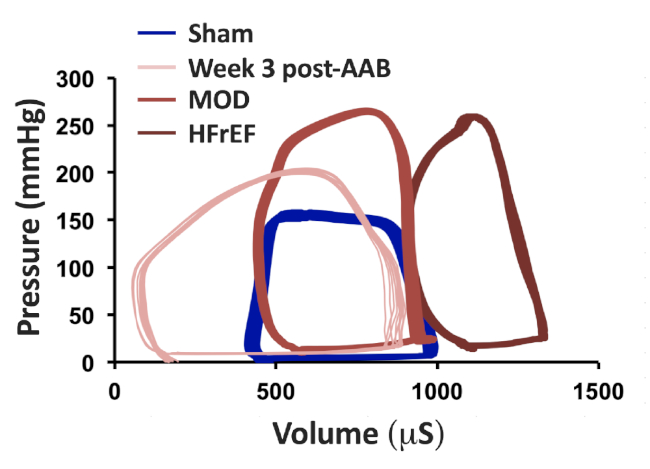
Figure 3 : Des tracés de boucle de volume de pression ont été obtenus par l’intermédiaire d’un cathéter de pression-volume de rat de 1,9 F utilisant l’approche ouverte de perforation apicale de la poitrine et du ventriculaire gauche. Traçages de boucles de volume de pression représentatifs à Sham, semaine 3 suivant les phénotypes AAB, MOD et HFrEF à la semaine 8 suivant AAB. Figure a été modifiée à partir de Chaanine et coll., Circulation: Heart Failure, 2013. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
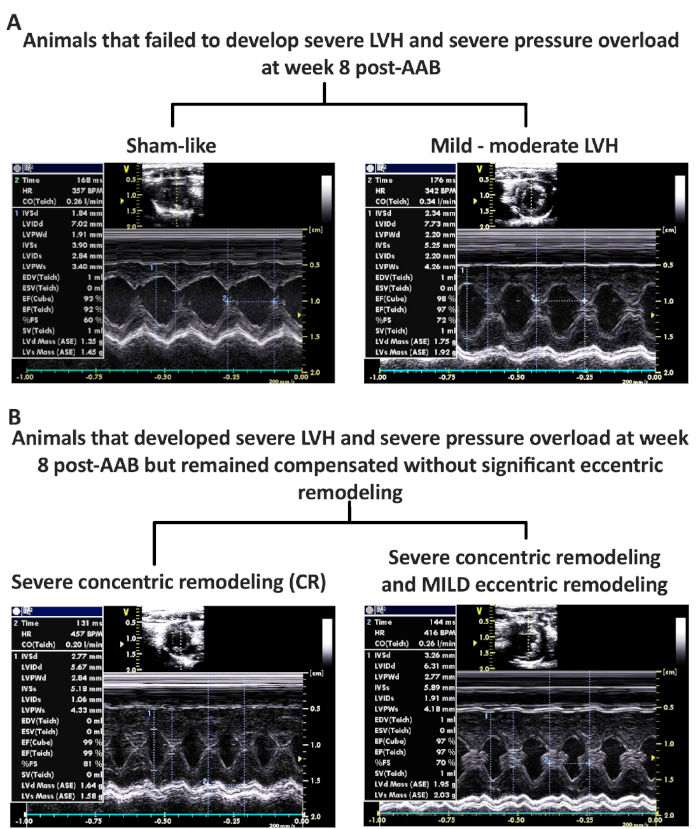
Figure 4 : Phénotypes rencontrés à la semaine 8 suivant AAB avec l’échec de développer le phénotype désiré d’insuffisance cardiaque (s). (A) Images représentatives en mode M d’animaux qui ont perdu la surcharge de pression (PO) et qui n’ont pas développé de phénotypes LVH (Sham-like) et ceux dont les phénotypes variables DE PO et de LVH (mild-moderate LVH). (B) Images représentatives en mode M d’animaux qui ont développé des PO sévères, LVH et remodelage concentrique (CR), mais sans (CR) ou avec des phénotypes de remodelage excentriques doux (MILD). Figure 4B a été modifié à partir de Chaanine et coll., Journal of American Heart Association, 2017. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5 : Échocardiographie et paramètres de boucle de volume de pression dans les différents phénotypes. Les données sont présentées comme des valeurs individuelles (points) avec médiane (ligne horizontale) dans les différents phénotypes à la semaine 8 post-AAB. Les résultats d’analyse statistique des données présentées dans les différents phénotypes sont indiqués dans le tableau 1. LVESV : volume ventriculaire gauche de fin-systolique, LVEF : fraction gauche d’éjection ventriculaire, EDPVR : relation de volume de pression fin-diastolique, ESPVR : relation de volume de pression fin-systolique, EA : élasance artérielle. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| Sham (n'5) | Sham-like (n 5) | Mild-mod LVH (n'8) | CR (n 11) | MILD (n-14) | MOD (n-14) | HFrEF (n 5) | |
| Poids corporel (g) | 594 à 37 | 466 à 66 ans | 464 à 22 | 497 à 43 | 530 à 59 | 478 à 39 | 546 à 18 ans |
| HW (mg) | 1269 124,5 | 1328 119 | 1614 à 177 | 1645 191a | 1821 169a,b | 2106 - 292a,b,c,d,e | 2897 - 182a,b,c,d,e,f |
| LVW (mg) | 897 94 | 968 91 | 1161 à 144 | 1222 152a | 1372 135a,b | 1580 219a,b,c,d,e | 1726 82a,b,c,d,e |
| RVW (mg) | 218 à 22 ans | 218 à 23 | 266 à 24 ans | 239 à 26 | 249 à 26 | 283 à 42a,b | 565 76a,b,c,d,e,f |
| IVSd (cm) | 0,19 à 0,01 | 0,21 à 0,01 | 0,23 à 0,01a | 0,29 à 0,01a,b,c | 0,28 à 0,02a,b,c | 0,28 à 0,01a,b,c | 0,28 à 0,02a,b,c |
| LVPWd (cm) | 0,20 à 0,01 | 0,21 à 0,02 | 0,24 à 0,01a,b | 0,29 à 0,02a,b,c | 0,28 à 0,02a,b,c | 0,28 à 0,01a,b,c | 0,30 à 0,02a,b,c |
| LVEDV (l) | 560,5 à 25,8 | 570 à 32 | 668 143 | 442 à 42,c | 583 à 45d | 697 129d,e | 881,5 à 55,7a,b,c,d,e,f |
| LVESV (l) | 105,9 à 8,9 | 93 à 15 ans | 111 à 20 | 59 à 7a,b,c | 85,3 à 10,6d | 139,7 à 22,5a,b,c,d,e | 319,2 à 51,5a,b,c,d,e,f |
| LVEF (%) | 81,1 à 1,2 | 83,7 à 2,9 | 83,1 à 2,5 | 86,5 à 2,2a,c | 85,4 à 1,7a | 79,8 à 1,9b,c,d,e | 64.1 '3.6a,b,c,d,e,f |
| LVPmax (mmHg) | 121 à 19 | 126 à 23 | 186 à 23a,b | 218 à 18a,b | 221 à 22a,b,c | 234 à 25a,b,c | 262 16a,b,c,d,e |
| EDPVR (mmHg/l) | 0.018 à 0.005 | 0.017 à 0.004 | 0.041 0.013 | 0.043 0.017 | 0.039 0.015 | 0,068 - 0.025a,b,c,d,e | 0,079 - 0.017a,b,c,d,e |
| ESPVR/EA | 1,57 à 0,67 | 1,96 à 0,61 | 2,63 à 1,52 | 3.35 1.23a | 2,62 à 0,55 | 1,63 à 0,41 d | 0,82 à 0,24c,d,e |
| Les données sont présentées comme moyennes et dérogations standard. L’analyse statistique a été effectuée à l’aide d’ANOVA à sens unique. P et lt; 0,05 a été considéré comme significatif. | |||||||
| aP 'lt; 0.05 vs Sham | |||||||
| bP 'lt; 0.05 vs Sham-like | |||||||
| cP 'lt; 0.05 vs Mild-modearte LVH | |||||||
| dP 'lt; 0.05 vs CR | |||||||
| eP 'lt; 0.05 vs MILD | |||||||
| fP 'lt; 0.05 vs MOD | |||||||
| N 6 | |||||||
| Abréviations: HW : poids de coeur, LVW : poids ventriculaire gauche, RVW : poids ventriculaire droit, IVSd : épaisseur septale de mur dans diastole, LVPWd : épaisseur postérieure ventriculaire gauche dans le diastole. LVEDV : volume ventriculaire gauche de fin-diastolique, LVESV : volume ventriculaire gauche de fin-systolique, LVEF : fraction ventriculaire gauche d’éjection, LVPmax : pression maximale ventriculaire gauche, EDPVR : relation de volume de pression fin-diastolique, ESPVR : relation de volume de pression fin-systolique, EA : élasance artérielle. | |||||||
Tableau 1 : Paramètres d’échocardiographie et de volume de pression dans les phénotypes Sham, Sham-like, Mild-moderate LVH, CR, MILD, MOD et HFrEF.
Discussion
Suivant PO lié à AAB chez le rat, le LV subit un remodelage concentrique en augmentant l’épaisseur de la paroi de LV, connue sous le nom de LVH concentrique, comme mécanisme compensatoire pour contrer l’augmentation du stress de mur de LV. L’augmentation de l’épaisseur du mur LV se remarque au cours de la première semaine suivant LAB et atteint son épaisseur maximale à 2-3 semaines après l’AAB. Pendant cette période, l’activation des voies de transduction de signal maladaptive mène à l’élargissement progressif du LV avec l’augmentation des volumes de LV, un processus connu sous le nom d’hypertrophie excentrique ou de remodelage. On s’attend à ce que le phénotype de HF dans le rat se développe autour de 8 semaines suivant AAB dans la plupart des animaux avec peu d’entre eux développant HF à la semaine 12 suivant AAB. Deux phénotypes de HF s’ensuivent selon la sévérité de l’AAB. Le phénotype DE MOD est obtenu par la création de baguage aortique ascendant (AAB) avec un clip vasculaire de 2 mm2 de diamètre interne, tandis que, la création du phénotype HFrEF nécessite AAB avec un clip vasculaire plus serré de 1,5 mm2 dans le diamètre interne. Il est important d’effectuer l’échocardiographie à 2-3 semaines après le baguage aortique ascendant pour vérifier la présence de LVH concentrique sévère. LVH sévère est défini comme LV septal et l’épaisseur postérieure de la paroi 1,5 fois normale (0,19 cm), et varie habituellement entre 0,27 - 0,3 cm. Les animaux qui ne développent pas de LVH sévère à la semaine 3 suivant AAB, seront considérés comme ayant échoué AAB et ne devraient pas être suivis par la suite. Ceux qui ont développé LVH grave à la semaine 3 suivant AAB, subiront l’échocardiographie à la semaine 8 suivant AAB pour évaluer pour le développement du phénotype désiré de HF. Il n’est pas rare de rencontrer des animaux qui avaient un LVH sévère à la semaine 3 suivant l’AAB d’avoir régression ou résolution de LVH à la semaine 8 suivant AAB, pour des raisons que nous aborderons dans la dernière section de la discussion. Les animaux avec LVH sévère et le remodelage concentrique sans ou avec le remodelage excentrique doux à la semaine 8 suivant AAB, donc les phénotypes CR et MILD, respectivement, sont peu susceptibles de développer davantage de remodelage excentrique, même si elles sont suivies pendant un mois prolongé ou deux. Ceux qui sont entre le phénotype MILD et MOD, peuvent développer le phénotype de HF de MOD s’ils sont suivis pendant un mois de plus.
Le modèle de rat DE PO peut être frustrant en raison des taux élevés de mortalité et d’échec associés10, en dépit de l’utilisation d’une taille de clip vasculaire normalisée et la technique chirurgicale, qui ajoute également à la dépense de recherche, en raison du grand nombre d’animaux qui ont besoin de subir AAB afin d’atteindre le nombre cible souhaité (n), et la durée que les animaux doivent être suivis avant de développer le phénotype HF désiré. L’échec de développer LVH grave est lié au baguage ou au baguage infructueux de l’artère brachiocéphalique droite au lieu de l’aorte, ce qui n’est pas rare. La régression et/ou la résolution de LVH sévère dans les évaluations subséquentes de suivi sont liées à la formation d’anévrisme et au remodelage aortique péri-bande qui mène à la perte de la sévérité de PO9. Il n’est pas clair pourquoi les animaux avec LVH sévère et PO développer la variabilité phénotypique en ce qui concerne le remodelage excentrique en dépit d’avoir la même taille de clip, le sexe et la souche. Il est recommandé de visualiser l’aorte ascendante à l’écran pour le remodelage aortique péri-bande et la formation anévrique. Les animaux qui développent un anévrisme aortique ascendant de 1 cm de diamètre doivent être euthanasiés, car cela causera la dyspnée et la détresse de l’animal en raison de l’imprécisement sur les structures environnantes. En outre, il est recommandé de vérifier le flux turbulent à travers la bande par la couleur Doppler, mais malheureusement l’estimation précise du gradient de pression à travers la bande par Doppler continu n’est pas faisable en raison de l’incapacité d’aligner le Doppler continu avec la direction de flux sanguin dans l’aorte ascendante.
Le MOD est un phénotype attrayant de HF et constitue une évolution du phénotype HFrEF traditionnellement créé car il permet le ciblage des voies de transduction de signal qui jouent le rôle dans le remodelage myocardique dès le début du processus de la maladie, particulièrement quand il se rapporte aux perturbations dans la dynamique et la fonction mitochondriales, le métabolisme myocardique et le cycle de calcium et le remodelage extracellulaire de matrice et la rigidité myocardique ; caractéristiques qui sont très évidentes dans le phénotype HF MOD11. En outre, la mortalité postopératoire précoce (définie comme la mortalité dans les 7 premiers jours post-AAB) est plus faible avec la taille du clip de 2 mm2, pour la création de phénotype MOD, que la taille du clip de 1,5 mm2, pour la création de phénotype HFrEF10, (5% vs 21%, P - 0,009 en utilisant le test exact de Fisher). Cependant, le taux de réussite entre les deux tailles de clip, pour la création de phénotypes MOD et HFrEF, n’est pas statistiquement significatif10, (20% vs 13%, P - 0,56 en utilisant le test exact de Fisher). En outre, le baguage aortique par clip vasculaire est avantageux sur le baguage aortique en resserrant une suture de nylon contre une aiguille de 27 G, une technique souvent utilisée pour resserrer l’aorte transversale chez la souris, parce qu’il ya moins de variation dans la taille du clip et moins de traumatisme à l’aorte par rapport à la technique de suture.
Le modèle DE PO de HF est avantageux par rapport au modèle d’infarctus du myocarde (MI) de HF parce que le stress circumferentiel et méridional de mur induit par PO est réparti uniformément sur tous les segments du myocarde. Cependant, les deux modèles souffrent de variabilité dans la sévérité de PO10,11 et dans la taille infarctus13,14 avec une inflammation intense et des cicatrices au site infarctus15 ainsi que l’adhésion à la paroi thoracique et les tissus environnants observés dans le modèle MI de HF. En outre, le modèle HF induit par le rat PO est difficile à créer car il est associé à des taux élevés de mortalité et d’échec10, avec seulement 20% des rats opérés développant le phénotype de HFMOD 10. Par rapport au modèle spontanément hypertendu de rat (SHR), le modèle HF po-induit est un meilleur modèle pour étudier les voies liées au remodelage myocardique. L’augmentation du stress après charge et du mur myocardique dans le systole est beaucoup plus élevée dans le modèle HF induit par les PO que le modèle SHR. Il faut environ deux ans pour que le SHR développe un HF systolique et le mécanisme de la HF systolique n’est pas entièrement connu et est confondu par le vieillissement16. Le modèle SHR et d’autres modèles d’hypertension, tels que le modèle de sel DOCA, sont plus fréquemment utilisés pour étudier les mécanismes et les thérapies liés à l’hypertension et éventuellement le dysfonctionnement diastolique16.
En conclusion, le phénotype de HF de MOD est un modèle attrayant pour étudier les voies de transduction de signal dans le contexte du remodelage myocardique et peut être utilisé pour l’application et l’essai des stratégies thérapeutiques potentielles, avant la validation de leur efficacité dans les grands modèles animaux et dans l’insuffisance cardiaque humaine.
Déclarations de divulgation
Tous les auteurs ne signalent aucun conflit d’intérêts.
Remerciements
Les NIH accordent HL070241 à la police.
matériels
| Name | Company | Catalog Number | Comments |
| Adson forceps | F.S.T. | 11019-12 | surgical tool |
| Alm chest retractor with blunt teeth | ROBOZ | RS-6510 | surgical tool |
| Graefe forceps, curved | F.S.T. | 11152-10 | surgical tool |
| Halsted-Mosquito Hemostats, straight | F.S.T. | 13010-12 | surgical tool |
| Hardened fine iris scissors, straight | Fine Science Tools F.S.T. | 14090-11 | surgical tool |
| hemoclip traditional-stainless steel ligating clips | Weck | 523735 | surgical tool |
| Mayo-Hegar needle holder | F.S.T. | 12004-18 | surgical tool |
| mechanical ventilator | CWE inc | SAR-830/AP | mechanical ventilator for small animals |
| Weck stainless steel Hemoclip ligation | Weck | 533140 | surgical tool |
Références
- McMurray, J. J., Petrie, M. C., Murdoch, D. R., Davie, A. P. Clinical epidemiology of heart failure: public and private health burden. European Heart Journal. 19 (Suppl P), P9-P16 (1998).
- Berk, B. C., Fujiwara, K., Lehoux, S. ECM remodeling in hypertensive heart disease. Journal of Clinical Investigation. 117 (3), 568-575 (2007).
- Frey, N., Olson, E. N. Cardiac hypertrophy: the good, the bad, and the ugly. Annual Review of Physiology. 65, 45-79 (2003).
- Hill, J. A., Olson, E. N. Cardiac plasticity. New England Journal of Medicine. 358 (13), 1370-1380 (2008).
- Kehat, I., Molkentin, J. D. Molecular pathways underlying cardiac remodeling during pathophysiological stimulation. Circulation. 122 (25), 2727-2735 (2010).
- Rothermel, B. A., Hill, J. A. Autophagy in load-induced heart disease. Circulation Research. 103 (12), 1363-1369 (2008).
- Barrick, C. J., et al. Parent-of-origin effects on cardiac response to pressure overload in mice. American Journal of Physiology-Heart and Circulatory Physiology. 297 (3), H1003-H1009 (2009).
- Barrick, C. J., Rojas, M., Schoonhoven, R., Smyth, S. S. Cardiac response to pressure overload in 129S1/SvImJ and C57BL/6J mice: temporal- and background-dependent development of concentric left ventricular hypertrophy. American Journal of Physiology-Heart and Circulatory Physiology. 292 (5), H2119-H2130 (2007).
- Lygate, C. A., et al. Serial high resolution 3D-MRI after aortic banding in mice: band internalization is a source of variability in the hypertrophic response. Basic Research in Cardiology. 101 (1), 8-16 (2006).
- Chaanine, A. H., Hajjar, R. J. Characterization of the Differential Progression of Left Ventricular Remodeling in a Rat Model of Pressure Overload Induced Heart Failure. Does Clip Size Matter?. Methods in Molecular Biology (Clifton, N.J.). 1816, 195-206 (2018).
- Chaanine, A. H., et al. Mitochondrial Integrity and Function in the Progression of Early Pressure Overload-Induced Left Ventricular Remodeling. Journal of the American Heart Association. 6 (6), (2017).
- Chaanine, A. H., et al. Potential role of BNIP3 in cardiac remodeling, myocardial stiffness, and endoplasmic reticulum: mitochondrial calcium homeostasis in diastolic and systolic heart failure. Circulation: Heart Failure. 6 (3), 572-583 (2013).
- Takagawa, J., et al. Myocardial infarct size measurement in the mouse chronic infarction model: comparison of area- and length-based approaches. Journal of Applied Physiology (Bethesda, Md. : 1985). 102 (6), 2104-2111 (2007).
- Vietta, G. G., et al. Early use of cardiac troponin-I and echocardiography imaging for prediction of myocardial infarction size in Wistar rats. Life Sciences. 93 (4), 139-144 (2013).
- Frangogiannis, N. G. The inflammatory response in myocardial injury, repair, and remodelling. Nature Reviews. Cardiology. 11 (5), 255-265 (2014).
- Doggrell, S. A., Brown, L. Rat models of hypertension, cardiac hypertrophy and failure. Cardiovascular Research. 39 (1), 89-105 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon