Method Article
Создание высокоспецифических химически индуцированных систем димеризации белка по шагу Phage Выбор комбинаторных однодоменных антител библиотеки
В этой статье
Резюме
Создание химически индуцированных систем димеризации белка с желаемой близостью и специфичностью для любой небольшой молекулы лиганд будет иметь много биологических приложений зондирования и активации. Здесь мы описываем эффективный, обобщенный метод де Ново-инженерии химически индуцированных систем димеризации через пошаговый выбор фаговычной библиотеки антител, отображаемой фагой.
Аннотация
События димеризации белка, происходящие только в присутствии маломолекулярного лигана, позволяют развивать маломолекулярные биосенсоры для вскрытия и манипуляции биологическими путями. В настоящее время существует лишь ограниченное число химически индуцированных систем димеризации (CID), и проектирование новых с желаемой чувствительностью и избирательностью для конкретных малых молекуловых лигандов остается проблемой в области белковой инженерии. Мы здесь описываем метод скрининга высокой пропускной записи, комбинаториальный биндерс-e nabled sизбрание CID (COMBINES-CID), для de novo инженерных систем CID, применимых к большому разнообразию лигандов. Этот метод использует двухступенчатый выбор фаговычных комбинаторных нано-библиотеки для получения 1) "якорных связующих", которые сначала связываются с лигандой интереса, а затем 2) "димеризации связующих", которые связывают только якорь связующего-лигандкомплексов. Для выбора якорных связующих, комбинаторная библиотека более 109 комплементарно-определяющих области (CDR)-рандомизированные нанотела проверяются с помощью биотиниляции лиганда и хиты проверяются с немаркированной лигандостью биослойной интерферометрией (BLI). Для получения димеризации связующих, наникто библиотека проверяется с якорным связующего-лиганд комплексов в качестве мишеней для положительного скрининга и несвязанных связующих якорных связующих для отрицательного скрининга. COMBINES-CID широко применима к выбору связующих CID с другими иммуноглобулином, неиммуноглобулином или вычислительно разработанными эшафотами для создания биосенсоров для in vitro и in vivo обнаружения лекарств, метаболитов, сигнальных молекул и т.д.
Введение
СИСТЕМы CID, в которых два белка димеризируются только в присутствии маломолекулярного лиганда(рисунок 1), предлагают универсальные инструменты для вскрытия и манипулирования метаболическими, сигнальными и другими биологическими путями1. Они продемонстрировали потенциал в биологической активации, таких как контролируемые препаратами Т-клеточной активации2 и апоптоз3,4, для повышения безопасности и эффективности приемной Т-клеточной терапии. Кроме того, они обеспечивают новую методологию для in vivo или in vitro обнаружения малых молекул. Например, белки CID могут быть генетически слиты с системами репортера флуоресценции (например, флуоресцентный резонанс передачи энергии (FRET)5 и круговой перемутированный флуоресцентные белки)6 для измерения в режиме реального времени в виво, или служить в качестве сродства реагентов для сэндвич фермент-связанных иммуносорбентовых анализов (ELISA) - как анализы.
Несмотря на их широкое применение, создание новых систем CID, которые могут управляться данной маломолекулярной лигандой, имеет серьезные проблемы. Установленные методы инженерного связующего белка, включая иммунизацию животных7,выбор в пробирке8,9,и вычислительный дизайн белка10 может генерировать лиганд связывающие белки, которые функционируют через бинарные взаимодействия белка-лигада. Тем не менее, эти методы имеют трудности создания лиганд-индуцированной ternary CID комплекса. Некоторые методы создают CID путем химически соединяя 2 ligands которые независимо связывают к таким же или по-разному протеитам11,12,13,14,15,16или полагаются на выбирать протеины связующего, such as антитела пристрелящие preexisting малые комплексы молекул-протеина17,18, и таким образом имеют лимитированный выбор ligands.
Недавно мы разработали комбинаториальный биндерс-e nabled сизбранием CID (COMBINES-CID) метод для де Ново инженерных систем CID19. Этот метод может получить высокую специфичность лиганд-индуцированной димеризации (например, якорь-димеризации связующего диссоциации постоянной, KD (без лиганда)/KD (с лигандой) Специфика димеризации достигается с помощью якорных связующих с гибкими связывающими участками, которые могут вводить конформационные изменения при связывании лиганда, обеспечивая основу для выбора конформистски селективных связующих только распознавающих связующие якорные связующие, связанные с лигандой. Мы продемонстрировали доказательство принципа, создавая каннабидиол (CBD) индуцированных гетеродидеров нанотел, 12-15 kDa функциональный фрагмент антитела из верескации, состоящий из универсальной эшафот и три гибких CDR петли (Рисунок 2)20, который может сформировать связывающий карман с адаптируемыми размерами для малых молекул эпитопов21. Примечательно, что выбор в пробирке библиотеки комбинаторного белка должен быть экономически эффективным и обобщенным для инженерии CID, поскольку один и тот же высококачественный библиотечный может быть применен к различным лиганам.
В этом протоколе и видео, мы сосредоточены на описании двухступенчатой в пробирке выбор и проверка якоря(Рисунок 3A) и димеризации связующих(Рисунок 3B) путем скрининга комбинаторных наивных библиотек с разнообразием выше 109 использованием КБР в качестве мишени, но протокол должен быть применим к другим библиотекам белка или малых молекул цели. Скрининг CID связующих обычно занимает 6-10 недель(рисунок 4).
протокол
1. Строительство библиотеки
- Используйте синтетические комбинаторные однодоменных антител библиотеки с разнообразием 1,23-7,14 х 109, как ранее описано19. Хотя этот протокол не включает в себя строительство библиотеки, он может быть применен к другим комбинированных библиотек связующего.
2. Биотинилагация лиганды цели или лиганд
- Биотинилат выбранный лиганд, например, КБР и тетрагидроканнабинол (ТГК)19, с помощью различных стратегий химического синтеза, в зависимости от подходящих участков биотиниляции цели.
3. Скрининг якорного связующего
- Начало отбора
- Начните каждый раунд отбора, прививая одну колонию TG1-клеток, свежевыращенную в 6 мл 2YT при 37 градусах Цельсия и 250 оборотах в минуту (об/ ч) до 600 нм (OD600) поглощения 0,5 евро. Инкубировать клетки на льду для использования в шаге 3.5.1.
- Отрицательный отбор с биотином стрептавидин бисером
- Подготовка "отрицательный выбор бусин" путем мытья 300 л стрептавидина покрытием магнитных бусин с помощью магнитного разделения стойки, 3x с 0,05% фосфат-буфера сотеряния с Tween буфера (PBST, 1 х PBS с 0,05% vol/vol Tween 20%) и 2x с 1 х PBS.
- Приостановите бисер с 1 мл 1% казеина в 1 х PBS (pH 7,4), и насытить бусы, добавив 5x сообщили связывающей емкости с использованием биотина. Инкубировать при комнатной температуре (RT) на ротаторе на 1 ч.
- Вымойте бисер 5x с помощью 0,05% PBST и 3x с помощью 1 х PBS, в общей сложности восемь моет.
- Добавьте 1013 фаговых частиц в 1% казеина/1% BSA в 1 х PBS (pH 7.4) и инкубировать на RT на ротаторе в течение 1 ч.
- После инкубации соберите супернатант, который будет использоваться в шаге 3.3.6.
- Положительный отбор с биотинилатированными лиганд-связанными стрептавидина бисером
- Подготовьте «положительный отбор бусин» с использованием 1/2 объема бисера, используемого для «отрицательного выбора бусин» следующими шагами 3.2.1.
- Повторно приостановить бисер с 1 мл 1% казеина в 1 й PBS, рН 7,4 и насытить бисер, добавив 5x полную пропускную способность рассчитывается на основе руководства с использованием биотинилатированных лиганд выбора. Инкубировать на RT на ротаторе на 1 ч.
- Вымойте бисер 5x с помощью 0,05% PBST и 3x с помощью 1 х PBS, в общей сложности восемь моет.
- Заблокируйте бусины 1 мл 1% казеина/1% BSA в 1 х PBS (рН 7,4) и инкубируйте на РТ на ротаторе в течение 1 ч, чтобы предотвратить неспецифическую связывание между фагами и стрептавидиновымпокрытием покрытием магнитных бусин.
- Вымойте стрептавидин покрытием магнитных шариков 3x с помощью 0,05% PBST и один раз с помощью 1 х PBS, в общей сложности четыре моет.
- Отрептить стрептавидин покрытием магнитных бусин с использованием несвязанных фагов, взятых из шага 3.2.5 и инкубировать на RT на ротатор е 1 ч.
- Извлеките супернатант, не нарушая магнитные бусы. Сохраните несвязанные фаги в качестве ввода, которые будут использоваться в шаге 3.5.1.
- Вымойте бисер 10x с помощью 0,05% PBST и 5x с помощью 1 х PBS. Между каждыми тремя мойками переносить их в новую трубку, чтобы избежать фагов, не связанных со стенками трубки.
- Удаление фаговычных нанотел
- Конкурентоспособно щелкая связанных фагов, добавляя 450 л небиотинилагенного лиганда,используя концентрацию в микромолярной гамме (например, 10-50 мкм) и инкубируя на РТ на ротаторе в течение 30 мин. Выбранная концентрация лиганда для конкурентного элютации связанных фагов зависит от желаемого KD "якорного связующего". Концентрации лиганда могут быть относительно высокими в первоначальных раундах отбора, а затем уменьшаться в более поздних раундах.
- Соберите супернатант и сохранить eluted фаги в качестве вывода, которые будут использоваться в шаге 3.5.2.
- Ввод /выход титрования и инфекции
- Для входной титрования подготовьте 10x серийных разбавлений в 1 х PBS до 109-разс входной фагой от шага 3.3.7. Используйте 107-109 серийных разбавлений, чтобы сделать инфекции, переведя 10 phput-фага qL от каждого разбавления в 70 клеток TG1 (OD600 из 0,5). Инкубировать при 37 градусах По области в течение 45 мин, наклеить инфицированные клетки TG1 на три 90 мм 20-мм 200 мкм-агара, содержащую 100 мкг/мл ампициллин и 2% (wt/vol) глюкозы, и инкубировать на ночь при 37 градусах Цельсия. Из ночных пластин ввод фагов можно рассчитать следующим образом:

- Для выходной инфекции и титрации перенесите элютированные фаги со ступени 3,4,2 на 3 мл клеток TG1 (OD600 из 0,5). Инкубировать на водяной бане при 37 градусах по Цельсию в течение 45 мин. Затем приготовьте 10x серийных разбавления в 2YT до 10 3-см, пластины каждого разбавления на 90 мм 2YT-агар блюда, и инкубировать на ночь при 37 градусов по Цельсию. Из ночных пластин выход фагов можно рассчитать следующим образом:

- Разделите оставшиеся инфицированные клетки TG1 на три 150 мм 2YT-агарпластины, содержащие 100 мкг/мл ампициллин и 2% (wt/vol) глюкозы. Инкубировать тарелки на ночь при 37 градусах Цельсия.
- Для входной титрования подготовьте 10x серийных разбавлений в 1 х PBS до 109-разс входной фагой от шага 3.3.7. Используйте 107-109 серийных разбавлений, чтобы сделать инфекции, переведя 10 phput-фага qL от каждого разбавления в 70 клеток TG1 (OD600 из 0,5). Инкубировать при 37 градусах По области в течение 45 мин, наклеить инфицированные клетки TG1 на три 90 мм 20-мм 200 мкм-агара, содержащую 100 мкг/мл ампициллин и 2% (wt/vol) глюкозы, и инкубировать на ночь при 37 градусах Цельсия. Из ночных пластин ввод фагов можно рассчитать следующим образом:
- Усиление библиотеки и восстановление для дальнейших раундов отбора
- Добавьте 3 мл 2Тыс на тарелку, соскребите стерильным клеточным скребоком и соберите все клетки в конической трубке 50 мл. Смешайте собранные клетки со стерильным глицеролом (20% Wt/vol окончательной концентрации). Измерьте OD600 смеси и сделайте 3-5 акций aliquots. Хранить при -80 градусах по Цельсию для длительного хранения.
- Для спасения фагов разбавьте фагемид-содержащую бактериальную смесь TG1, используя 25 мл 2Тыс-носителей, дополненных 2% глюкозы и 100 мкг/мл ампициллина к OD600 из 0,1 евро. Культурные ячейки при 37 градусах Цельсия и 250 об/мин до OD600 из 0,5 евро.
- Зафеть клетки, добавив CM13 помощник фаг на 5 х 109 pfu/mL и инкубировать при 37 кв. и 250 об/мин в течение 45 минут. Фаг помощника CM13 обеспечивает необходимые белки фагового пальто для сборки полных фаговых частиц.
- Центрифуги культуры на 8000 х г в течение 10 минут, чтобы удалить глюкозу. Resuspend клетки с помощью 50 мл 2YT средств массовой информации дополнены 100 мкг/мл ампициллин и 50 мкг /мл канамицин и инкубировать при 25 кв. м и 250 об/мин в одночасье.
- Центрифуги клетки из ночной культуры на 9000 х г, 4 КК в течение 30 мин. Передача супернатанта в новую трубку и осадок фаги в супернатанте с использованием 1/5 объема PEG/ NaCl решение (20% WT/vol полиэтиленгликоль-6,000 и 2.5 M NaCl). Смешайте осторожно и поместите на лед на 1 ч.
- Соберите частицы фага центрифугированием, используя 12 000 х г при 4 градусах по Цельсию в течение 30 мин. Отрежь гранулы с помощью 1 мл 1 х PBS, и перенесите подвеску в микроцентрифугую трубку. Центрифуги трубки на 20000 х г и 4 кв 10 мин, чтобы удалить остаточные бактерии.
- Перенесите супернатант в новую микроцентрифуговую трубку, не нарушая бактериальные гранулы. Используйте 1:100 разбавления для измерения поглощения на 269 нм и 320 нм. Общее количество фагов можно рассчитать по следующей формуле23:

- Храните фаговую библиотеку при 4 градусах по Цельсию для краткосрочного использования или с 25% глицерола при -80 градусах по Цельсию для длительного хранения.
- Повторите раунды отбора (шаги 3.1-3.6) для 3-6 раундов или до желаемого обогащения наблюдается (ссылка на раздел Результаты). Плита и выбрать одиночные клоны (раздел 4) для того чтобы охарактеризовать их сродство и специфическость к ligand (разделы 5-7).
4. Изоляция одного клона
- Чтобы изолировать отдельные клоны из обогащенной подбиблиотеки, приготовьте 10x серийных разбавления фаго-инфицированных клеток TG1 (шаг 3.5.2). Пластины серийных разбавления на 90 мм 2YT-агар блюда, содержащие 100 мкг/мл ампициллин и 2% (Wt/vol) глюкозы и инкубировать при 37 градусов по Цельсию в одночасье.
- Из ночных пластин, выбрать одиночных колоний в 250 qL 2YT средств массовой информации дополняется 100 мкг / мЛ ампициллин на хорошо в стерильных глубоководных пластин и расти на 37 градусов по Цельсию в одночасье.
- Из ночных культур, прививать 10 л в 500 л свежих 2YT средств массовой информации дополняется 100 мкг /мл ампициллина.
- Выращивайте клетки доOD 600 из 0,5 евро, добавляйте фаг помощника CM13 по 5 х10 pfu/mL и инкубируют при 37 градусах Цельсия и 250 об/мин в течение 45 мин.
- Добавьте 500 л 2Тыс-носителей, дополненных 100 мкг/мл ампициллином и 50 мкг/мл канамицина. Инкубировать при 25 градусах Цельсия и 250 об/мин на ночь.
- Centrifuge глубоководных пластин из ночных культур на 3000 х г в течение 10 мин. Соберите супернатант, содержащий частицы фага, не нарушая клеточные гранулы.
- Частицы фагов могут быть использованы для ELISA для определения специфики выбранных клонов к лиганду. Биотин или структурный омолог и мишени могут быть использованы в качестве отрицательного контроля.
5. Проверка якорного связующего звена от ELISA
- Пальто 96 хорошо ELISA пластин, используя 100 л 5 мкг /мЛ стрептавидин в буфере покрытия (100 мм карбонат буфера, рН 8,6) на 4 кв. C ночь.
- Вымойте пластины ELISA 3x, используя 0,05% PBST и добавьте 100 кЛ 1 мкм биоинтиниляционных целей к целевой скважины. Добавьте 100 кЛ 1 мкм биотин или цель омологик в контрольные скважины. Инкубировать на RT за 1 ч.
- Вымойте пластины 5x с использованием 0,05% PBST и блокировать неспецифические связывания, добавив 300 зл и 1% казеина в 1 х PBS. Инкубировать на RT за 1 ч.
- Вымойте пластины ELISA 3x, используя 0,05%-PBST и добавьте очищенный фаг супернатант. Инкубировать 1 ч на RT.
- Вымойте пластины ELISA 10x с помощью 0,05% PBST и добавить 100 л хрен пероксидазы (HRP)-M13 основных антитела белка пальто (1:10000 разбавления с 1 х PBS с 1% казеина). Инкубировать на RT за 1 ч.
- Вымойте пластины ELISA 3x, используя 0,05% PBST и добавьте 100 юанейтфилбензидин (TMB) субстрата. Инкубировать в течение 10 минут или до видимого изменения цвета наблюдается. Остановите реакцию, добавив 100 qL 1 M HCl. Прочитайте пластину на 450 нм на спектрофотометре.
- Для выражения белка и очищения выберите клоны, показывающие высокую близость и специфичность для цели (см. Обсуждение).
6. Выражение белка, очищение и биотинилация
- Как сообщалось ранее19, подклон выбранных клонов из раздела 5 и выразить как C-терминал Ави помечены и его помечены нанотели.
- Экспресс выбранные нанотела в периплазме клеток E. coli WK6 (обычно в культуре 1 л), высвобождение осмотическим шоком и очистите с помощью колонки никель-NTA (см. Таблица материалов).
- Обмен буфера с опреснительной колонкой (1 х PBS с 5% глицерола; см. Таблица материалов).
- Биотинилат нанотела с помощью коммерческого комплекта (см. Таблица материалов)для дальнейшего использования.
7. Характеристика якорного связующего звена BLI
- Проанализируйте связывающее сродство и кинетику выбранных якорных связующих путем иммобилизации 200 нм биоинтинилатированных якорных связующих на стрептавидиновых биосенсорах (см. Таблица Материалов)с связывающим буфером анализа (1 х PBS (pH 7.4), 0.05% Tween 20, 0.2% BSA, 3% метанол).
- Рассчитайте константы диссоциации(KD) якорных связующих взаимодействий с помощью анализа устойчивого состояния с помощью программного обеспечения для анализа данных (см. Таблица материалов). Полученные значения KD обычно варьируются от однодогих до двузначных микромоляров.
8. Скрининг димеризмового связующего
ПРИМЕЧАНИЕ: Биопанирование скрининга "димеризации связующих" похож на якорные связующие, за исключением двух критических шагов: 1) Димеризация связующих выбираются с помощью выбранного биотинилатена якорь связующего и якорь связующего лиганского комплекса для отрицательных и положительный выбор, соответственно. 2) Во время шага elution, 100 mM триэтиламин использован для того чтобы elute положительно выбранные фаги которые только были прыгнуты к связующего якоря--ligand целевому комплексу. Раствор триметиламина 100 мМ (рН 11,5) используется для выяснения положительных клонов, нарушая взаимодействие белка.
- Начало отбора
- Начните каждый раунд отбора, прививая одну колонию клеток TG1, свежевыращенную на минимальных носителях, в 6 мл 2YT при 37 градусах Цельсия и 250 об/мин доOD 600 из 0,5 евро. Инкубировать клетки на льду.
- Удаление отрицательно отобранных нанотел
- Подготовьте «трубку для вычитания» с помощью 400 л магнитных бусин с стрептавидином покрытием и следуйте шагу 3.2. Однако вместо насыщения биотином добавьте 5x рассчитанную полную связывающую емкость с использованием выбранного биотиниляционного якорного связующего и сохраните несвязанные фаги, которые будут использоваться в шаге 8.3.3.
- Выбор положительно отобранных нанотел
- Подготовьте «трубку захвата» с помощью 1/2 объема стрептавидиновых магнитных бусин, используемых для «трубки для вычитания» и следующих шагов 3.3.2 до 3.3.3. Однако вместо насыщения биотинизатированным лигандой добавьте в пять раз рассчитанную полную связывающую способность с использованием выбранного биотинителия якорного связующего.
- Чтобы сформировать якорный связующего-лигандного комплекса для положительного выбора димеризации связующего, добавьте достаточно высокую концентрацию небиотинилатного лиганда. Это позволит большинству стрептавидино-связанных якорный связующего образуют лиганд-связанных комплекса.
- Выполните шаги 3.3.3 до 3.3.8, используя несвязанные фаги, взятые из «трубки для вычитания».
- Удаление положительно отобранных нанотел
- Выясните фаги, связанные с якорным связующим комплексом, добавив 450 л триэтиламина 100 мМ и инкубируя на RT на ротаторе в течение 10 мин.
- Соберите конкурентоспособные электораии фагов и выполните шаги 3.4.1 до 3.4.2.
- Дальнейшие раунды выделения димеризации связующего
- Выполните шаги 3.5 и 3.6 для усиления и восстановления библиотеки для выполнения дальнейших раундов отбора. Повторите раунды отбора на 3–6 раундов или до желаемого обогащения. Плита и выбрать отдельные клоны (обратитесь к разделу 4) для того, чтобы охарактеризовать их близость и специфичность к цели.
9. Димеризация связующего характеристики ELISA
- Выполните шаги в разделе 4, чтобы изолировать отдельные клоны для характеристики через ELISA.
- Чтобы проверить сродство димеризации связующего кандидатов на якорь связующего комплекса, пальто ELISA целевой пластины с помощью 100 зЛ из 100 нМ биотинилатированных якорь связующего. После инкубации в течение 1 ч добавьте 1 мкм лигандной цели, чтобы сформировать якорный связующего-лиганд-комплекс.
- Контрольная пластина должна быть покрыта с помощью биотинилатированного якоря связующего только для отсеивания клонов, которые также могут связываться с свободным связующего якоря. Добавьте 100 зЛ из 100 нм биотинилапотированный якорный связующего и инкубировать на RT в течение 1 ч.
- Следуйте разделам 5.3-5.7.
10. Димеризация связующего характеристики BLI
- Связывающее сродство и кинетика димеризации связующих для якорного связующего - лигандкомплекса можно проанализировать путем иммобилизации биотинилатизованных дезинфекционных связующих веществ на стрептавидина (SA) биосенсора хеппи-сервера с связывающим буфером анализа, а затем анализироваться с 1 мкм якоря связующего предварительно уравновешенным с последовательным разбавлением лиганда. KD, kна, и kот взаимодействий могут быть рассчитаны с помощью нашего методасообщили 19.
Результаты
Мы описываем двухэтапный выбор in vitro и проверку якорных и димеризированных связующих путем скрининга комбинаторной библиотеки наноя с разнообразием выше 109 с использованием КБР в качестве мишени. Важное значение имеет оценка обогащения фагового биопанирования во время последовательных раундов отбора как якорных, так и димеризирующих связующих. Типичные результаты обогащения после 4-6 раундов отбора, как показано на рисунке 5, являются хорошим показателем того, что в суббиблиотеках существует высокое соотношение потенциальных попаданий, поэтому дальнейшие раунды отбора могут оказаться ненужными.
Одноклонный ELISA подходит для анализа относительной связывания сродства и избирательности якорных и димеризирующих связующих. Рисунок 6А является репрезентативным результатом выбора якоря после шести раундов биопанизации. Клоны, показывающие высокую (например, #87) или низкую (например, #27) избирательность лиганд, можно сравнить. Высокой избирательности клоны должны быть выбраны в качестве якорных кандидатов связующего. Аналогичным образом, на рисунке 6B показаны результаты выбора димеризации связующего после четырех раундов биопанизации. Обычно мы наблюдали клонов, которые образовали неоздоровую с обездвижевным якорным связующего только с лигандом (например, #49) или без (например, #80). Первый, показывающий специфику димеризации, должен быть выбран для дальнейшей проверки.
Якорный связующего ELISA опирается на использование биотиниляции цели. Таким образом, мы должны использовать BLI для дальнейшего подтверждения привязки к немаркированной цели. BLI также позволяет характеристику связывающей кинетики. Представитель BLI результаты якорных и димеризционных связующих показаны на рисунке 7А и 7Bсоответственно. Левые панели показывают лиганд концентрационно-зависимый связывательство, предполагая, что они подходят для построения системы CID. Правые панели показывают отрицательные элементы управления. Рассчитанный KD якоря и димеризации связующего взаимодействий в присутствии лиганда обычно варьировался от двузначных наномоллярных до двузначных микромоляров. Они могут варьироваться в зависимости от лиганда и комбинаторной библиотеки выбора.
Аналитическая хроматография размеров исключения (SEC) была выполнена для подтверждения формирования гетеродимеров между якорными и димеризуционными связующих. Пик димеризации наблюдался, когда якорь и димеризация связующих и КБР были смешаны(рисунок 8A, красная линия). В отличие от этого, не димеризации пик был обнаружен в отсутствие КБР(Рисунок 8A, синяя линия) или когда каждый связующего был загружен в столбец в одиночку (Рисунок 8B). Химическое перекрестное соединение использовалось для стабилизации комплексов CID, а перекрестные нанотела имеют несколько увеличенные размеры, соответствующие более ранним нивелированным пикам.
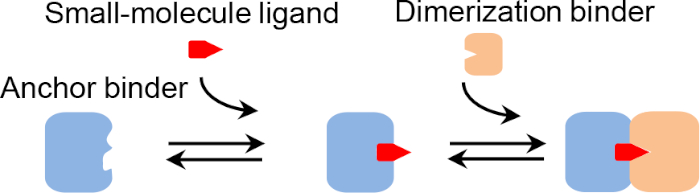
Рисунок 1: Механизм химически индуцированной димеризации белка. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
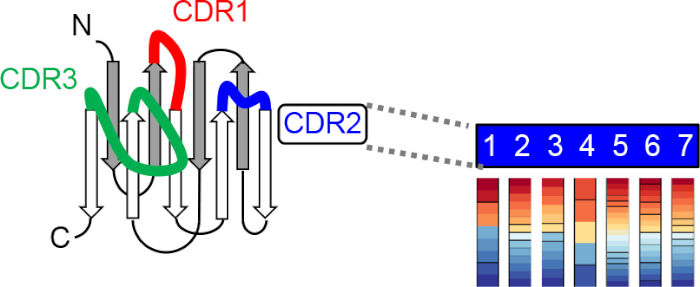
Рисунок 2: Схема поколения синтетической нано-комбинаторной библиотеки. Библиотека построена с помощью универсального нано эшафот и включения разработан распределения аминокислот для каждой позиции рандомизации в трех комплементарно-определяющих регионах (CDRs) по технологии Тринуклеотид мутагенез (TRIM) технологии 24. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
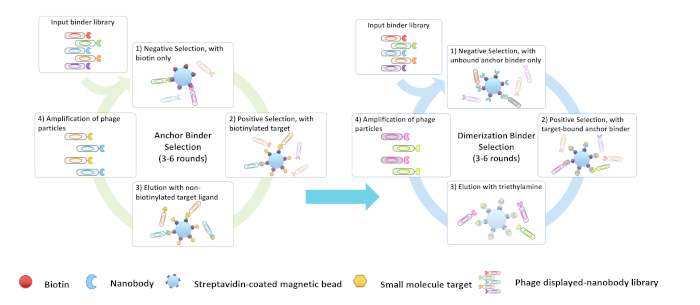
Рисунок 3: Flowchart (A) якорь и (B) dimerization связующего скрининга. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
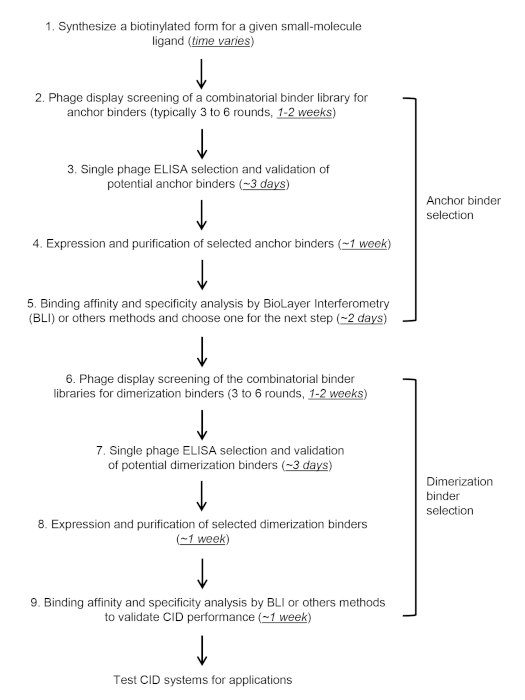
Рисунок 4: Хронология КОМБиОНС-CID. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
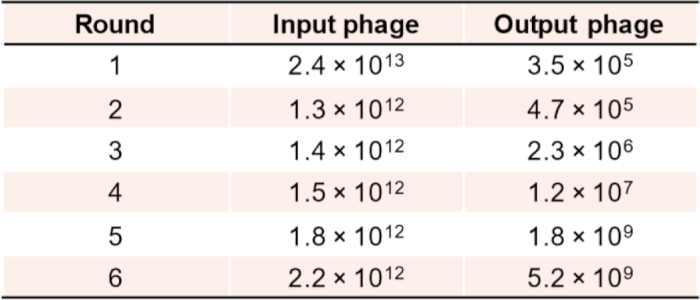
Рисунок 5: Обогащение фаговых титров после каждого раунда биопанирования для выбора якорного связующего. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
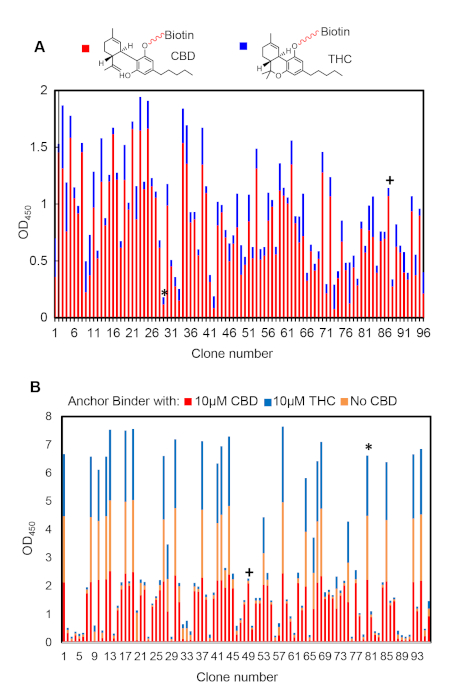
Рисунок 6: Представитель ELISA результаты, показывающие положительные (я) и отрицательные клоны . (A) Якорь связующего ELISA результаты из 96 случайно выбрали клонов после шести раундов отбора. (B) Димеризация связующего ELISA результаты 96 случайно выбрали клонов после четырех раундов отбора. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
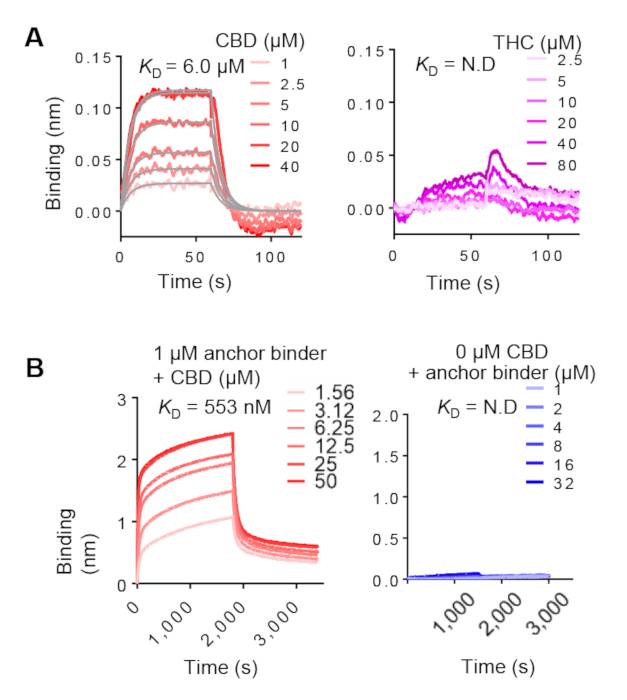
Рисунок 7: Якорь и димеризации связующего кинетический анализ BLI. (A) Анализ якорного связующего с немаркированными КБР (слева) и ТГК (справа). Биотинилатированный якорный связующего был обездвижен на супер стрептавидина (SSA) биосенсоров титров с различными концентрациями КБР. Измеренные данные для привязки КБР (красные кривые) были установлены во всем мире (серые линии). (B) Слева, BLI анализ SA биосенсорной димеризации связующего связующего связующего к якорю связующего предварительно equilibrated с различными концентрациями КБР. Так, концентрация якорного связующего была титрована и привязана к иммобилизованной димеризации в отсутствие КБР. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
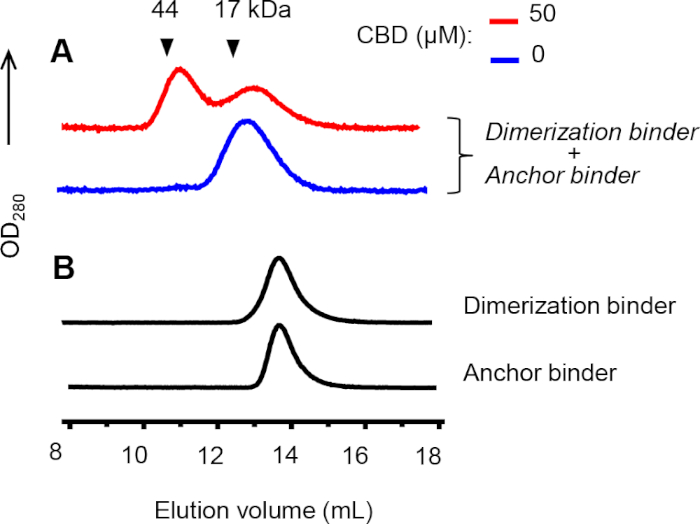
Рисунок 8: АНАЛИЗ SEC гетеродимеризации между якорем и димеризациюю связующих. ()Димеризация и якорь связующих (5 мКм каждый) в присутствии или отсутствии КБР были перекрестными 100 мкм бис-N -succinimidyl-(пенэтиленгликоль) эфир в течение 30 минут на RT до анализа. Объемы белковых стандартов характеризуются треугольниками. (B) Некроссуклепорные якорные и димеризующие связующие (по 30 мкм каждый) вводились отдельно. Хроматограммы в A и B показаны в разных масштабах Y. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Очень важно выбрать правильные концентрации входных фаговых библиотек для различных раундов биопанирования. Как правило, мы начинали с входной библиотеки в 1012-1013 фаговых частиц с разнообразием no109, что позволяет 100-1000 копий каждого фагового клона, которые будут представлены в выдвижной асссе. Если концентрация фага в связывающем асссе слишком высока или низка, вероятность неспецифических связывания или потери положительных клонов возрастет. Якорь или димеризация связующего выбор обычно состоит из трех до шести раундов биопанирования, и выход фагов рассчитывает обычно начинаются от 104 и увеличивается до 108-109. Подходит для выбора одиночных клонов для проверки ELISA после наблюдения за таким обогащением. Дополнительные раунды биопанирования могут уменьшить шансы на выявление подходящих положительных клонов с низким изобилием.
Важно настроить подходящий отрицательный контроль и выбор для повышения успеха выбора. Например, использование структурных аналогов лигандовых целей облегчит отбор специфики лиганд. В нашей работе, очень похожий аналог, ТГК, был использован в качестве контроля для КБР в ELISA и BLI проверки якорных и димеризации связующих19. В димеризации связующего выбора, если якорные связующие имеют относительно низкий ligand связывания сродство, как свободные, так и лиганд-связанные якорные связующие могут быть представлены в качестве целей в положительном выборе. Таким образом, важно тщательно удалить связующие вещества, которые связываются с свободными якорными связующих во время отрицательного отбора. Это может быть достигнуто путем выполнения нескольких раундов вычитания с помощью свободных якорных связующих.
Ограничение нашего протокола заключается в том, что молекулы-мишени должны быть биотиниланированы для выбора якорного связующего, и только один или несколько якорных связующих может быть использован для выбора димеризации. Использование биотинителированных целей может обогатить связующие вещества, которые частично связываются с связующим звеном между биотином и целями. Таким образом, важно проверять хиты с помощью немаркированных целей BLI или других методов. Выбор одного или нескольких якорных связующих для выбора димеризации связующего может уменьшить вероятность идентификации систем CID с подходящей чувствительностью и специфичностью. Таким образом, мультиплексная способность выбора ожидает дальнейшего совершенствования путем соединения с другими методами, например, одномолекулярно-взаимодействие секвенирования (SMI-Seq), который позволяет "библиотека за библиотекой" белка-белка взаимодействияскрининга 25.
Раскрытие информации
Временный патент, связанный с этой работой, был подан Вашингтонским университетом.
Благодарности
Эта работа была поддержана Университетом Вашингтона Инновационная премия (Л.Г.), грант от Национальных институтов здравоохранения США (1R35GM128918 в L.G.), и стартап-фонд Университета Вашингтона (в L.G.). H.J. была поддержана стипендией Вашингтонского исследовательского фонда. KW была поддержана стипендией бакалавриата из Вашингтонского университета Института белкового дизайна.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-Step Ultra TMB ELISA substrate solution | Thermo Fisher Scientific | 34029 | |
| Agar | Thermo Fisher Scientific | BP1423-2 | |
| Amicon Ultra-15 Centrifugal Filter unit (3 kDa cutoff) | Millipore | UFC900324 | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | |
| Bio-Rad Protein Assay Kit II | Bio-Rad | 5000002 | |
| BirA biotin-protein ligase standard reaction kit | Avidity | BirA500 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Casein | Sigma-Aldrich | C7078-1KG | |
| CM13 Helper phage | Antibody Design Labs | PH020L | |
| D-(+)-Glucose monohydrate | Alfa Aesar | A11090 | |
| Dynabeads M-280 Streptavidin | Thermo Fisher Scientific | 11205D | |
| DynaMag-2 Magnet | Thermo Fisher Scientific | 12321D | |
| EDTA | Thermo Fisher Scientific | BP120-1 | |
| Fast DNA Ladder | New England Biolabs | N3238S | |
| FastDigest BglI | Thermo Fisher Scientific | FD0074 | |
| Glycerol | Thermo Fisher Scientific | BP229-1 | |
| HiLoad 16/600 Superdex 200 pg | GE Healthcare | 28989335 | |
| HiPrep 26/10 Desalting Column | GE Healthcare | 17508701 | |
| HisTrap-FF-1ml | GE Healthcare | 11000458 | |
| Imidazole | Alfa Aesar | 161-0718 | |
| IPTG | Thermo Fisher Scientific | 34060 | |
| Kanamycin | Thermo Fisher Scientific | BP906-5 | |
| M13 Major Coat Protein Antibody | Santa Cruz Biotechnology | sc-53004 | |
| NaCl | Sigma-Aldrich | S3014-500G | |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ND-2000 | |
| Nunc 96-Well Polypropylene DeepWell Storage Plates | Thermo Fisher Scientific | 260251 | |
| Nunc MaxiSorp | Thermo Fisher Scientific | 44-2404-21 | |
| Octet RED96 | ForteBio | N/A | |
| pADL-23c Phagemid Vector | Antibody Design Labs | PD0111 | |
| PEG-6000 | Sigma-Aldrich | 81260-1KG | |
| Platinum SuperFi DNA Polymerase | Invitrogen | 12351010 | |
| PureLink PCR Purification Kit | Thermo Fisher Scientific | K310001 | |
| QIAprep Spin M13 Kit | Qiagen | 27704 | |
| Recovery Medium | Lucigen | 80026-1 | |
| SpectraMax Plus 384 | Molecular Devices | N/A | |
| Sucrose | Sigma-Aldrich | S0389-1KG | |
| Super Streptavidin (SSA) Biosensors | ForteBio | 18-5057 | |
| Superdex 75 increase 10/300 GL Column | GE Healthcare | 28-9909-44 | |
| T4 DNA Ligase | Thermo Fisher Scientific | 15224-025 | |
| TG1 Electrocompetent Cells | Lucigen | 60502-1 | |
| Triethylamine | Sigma-Aldrich | 471283-100mL | |
| Trizma Base | Sigma-Aldrich | T1503 | |
| Tryptone | Thermo Fisher Scientific | BP9726-5 | |
| Tween 20 | Thermo Fisher Scientific | BP337-500 | |
| Yeast Extract | Thermo Fisher Scientific | BP1422-2 | |
| Zeba Spin Desalting Column | Thermo Fisher Scientific | 89882 |
Ссылки
- Stanton, B. Z., Chory, E. J., Crabtree, G. R. Chemically induced proximity in biology and medicine. Science. 359 (6380), (2018).
- Wu, C. Y., Roybal, K. T., Puchner, E. M., Onuffer, J., Lim, W. A. Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science. 350 (6258), (2015).
- Straathof, K. C., et al. An inducible caspase 9 safety switch for T-cell therapy. Blood. 105 (11), 4247-4254 (2005).
- Di Stasi, A., et al. Inducible apoptosis as a safety switch for adoptive cell therapy. The New England Journal of Medicine. 365 (18), 1673-1683 (2011).
- Mank, M., et al. A FRET-based calcium biosensor with fast signal kinetics and high fluorescence change. Biophysical Journal. 90 (5), 1790-1796 (2006).
- Nagai, T., Sawano, A., Park, E. S., Miyawaki, A. Circularly permuted green fluorescent proteins engineered to sense Ca2+. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3197-3202 (2001).
- Hunter, M. M., Margolies, M. N., Ju, A., Haber, E. High-affinity monoclonal antibodies to the cardiac glycoside, digoxin. Journal of Immunology. 129 (3), 1165-1172 (1982).
- Bradbury, A. R. M., Sidhu, S., Dubel, S., McCafferty, J. Beyond natural antibodies: the power of in vitro display technologies. Nature Biotechnology. 29 (3), 245-254 (2011).
- Chen, G., et al. Isolation of high-affinity ligand-binding proteins by periplasmic expression with cytometric screening (PECS). Nature. Biotechnology. 19 (6), 537-542 (2001).
- Tinberg, C. E., et al. Computational design of ligand-binding proteins with high affinity and selectivity. Nature. 501 (7466), 212-216 (2013).
- Spencer, D. M., Wandless, T. J., Schreiber, S. L., Crabtree, G. R. Controlling signal transduction with synthetic ligands. Science. 262 (5136), 1019-1024 (1993).
- Ho, S. N., Biggar, S. R., Spencer, D. M., Schreiber, S. L., Crabtree, G. R. Dimeric ligands define a role for transcriptional activation domains in reinitiation. Nature. 382 (6594), 822-826 (1996).
- Belshaw, P. J., Ho, S. N., Crabtree, G. R., Schreiber, S. L. Controlling protein association and subcellular localization with a synthetic ligand that induces heterodimerization of proteins. Proceedings of the National Academy of Sciences of the United States of America. 93 (10), 4604-4607 (1996).
- Farrar, M. A., AlberolaIla, J., Perlmutter, R. M. Activation of the Raf-1 kinase cascade by coumermycin-induced dimerization. Nature. 383 (6596), 178-181 (1996).
- Erhart, D., et al. Chemical Development of Intracellular Protein Heterodimerizers. Chemistry & Biology. 20 (4), 549-557 (2013).
- Ballister, E. R., Aonbangkhen, C., Mayo, A. M., Lampson, M. A., Chenoweth, D. M. Localized light-induced protein dimerization in living cells using a photocaged dimerizer. Nature Communications. 17 (5), 5475(2014).
- Hill, Z. B., Martinko, A. J., Nguyen, D. P., Wells, J. A. Human antibody-based chemically induced dimerizers for cell therapeutic applications. Nature Chemical Biology. 14 (2), 112-117 (2018).
- Foight, G. W., et al. Multi-input chemical control of protein dimerization for programming graded cellular responses. Nature Biotechnology. 37 (10), 1209-1216 (2019).
- Kang, S., et al. COMBINES-CID: An efficient method for de novo engineering of highly specific chemically induced protein dimerization systems. Journal of the American Chemical Society. 141 (28), 10948-10952 (2019).
- Muyldermans, S. Nanobodies: natural single-domain antibodies. Annual Review of Biochemistry. 82, 775-797 (2013).
- Fanning, S. W., Horn, J. R. An anti-hapten camelid antibody reveals a cryptic binding site with significant energetic contributions from a nonhypervariable loop. Protein Science. 20 (7), 1196-1207 (2011).
- Zavrtanik, U., Luken, J., Loris, R., Lah, J., Hadzi, S. Structural basis of epitope recognition by heavy-chain camelid antibodies. Journal of Molecular Biology. 430 (21), 4369-4386 (2018).
- Denhardt, D. T., Dressler, D., Ray, D. S. The Single-Stranded DNA Phages. , 605-625 (1978).
- Virnekas, B., et al. Trinucleotide phosphoramidites: ideal reagents for the synthesis of mixed oligonucleotides for random mutagenesis. Nucleic Acids Research. 22 (25), 5600-5607 (1994).
- Gu, L., et al. Multiplex single-molecule interaction profiling of DNA-barcoded proteins. Nature. 515 (7528), 554-557 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены