Method Article
결합 단일 도메인 항체 라이브러리의 단계별 파지 선택에 의해 고도로 특이적 화학적으로 유도된 단백질 이분화 시스템 생성
요약
임의의 주어진 소분자 리간드에 대해 원하는 친화성 및 특이성을 가진 화학적으로 유도된 단백질 이분화 시스템을 만드는 것은 많은 생물학적 감지 및 작동 응용을 가질 것이다. 여기서, 우리는 파지 디스플레이 조합 단일 도메인 항체 라이브러리의 단계적 선택을 통해 화학적으로 유도된 이량화 시스템의 de novo 엔지니어링을 위한 효율적이고 일반화 가능한 방법을 설명한다.
초록
작은 분자 리간드의 존재에서만 발생하는 단백질 이분화 이벤트는 생물학적 경로의 해부 및 조작을 위한 소분자 바이오 센서의 개발을 가능하게 합니다. 현재, 제한된 수의 화학적으로 유도된 이량화(CID) 시스템이 존재하며 특정 소분자 리간드에 대한 원하는 감도 및 선택성을 갖춘 새로운 시스템을 엔지니어링하는 것은 단백질 공학 분야에서 여전히 과제로 남아 있습니다. 우리는 여기에 리간드의 큰 다양성에 적용 CID 시스템의 de novo 엔지니어링에 대한 높은 처리량 스크리닝 방법, combinatorial 빈ders-e nabledCID (COMBINES-CID)의 선거를 설명합니다. 이 방법은 파지 디스플레이 조합 nanobody 라이브러리의 2단계 선택을 사용하여 1) 관심 있는 리간드에 먼저 결합하는 "앵커 바인더"를 얻은 다음 2) 앵커 바인더-리간드 복합체에만 결합하는 "이각 바인더"를 얻습니다. 앵커 바인더를 선택하기 위해,109개 이상의 상보성 결정 영역(CDR)-무작위 나노체의 조합 라이브러리가 생체 티니글리드 리간드로 스크리닝되고 적중은 바이오 층 간섭측정(BLI)에 의해 표지되지 않은 리간드로 검증됩니다. 이광 바인더를 얻기 위해, nanobody 라이브러리는 포지티브 스크리닝을 위한 표적으로서 앵커 바인더-리간드 복합체로 스크리닝되고, 음의 스크리닝을 위한 언바운드 앵커 바인더를 갖는다. COMBINES-CID는 다른 면역 글로불린, 비면역글로불린 또는 전산으로 설계된 스캐폴드와 함께 선택한 CID 바인더에 광범위하게 적용되어 약물, 대사 산물, 신호 분자 등의 생체 내 및 생체 내 검출을 위한 바이오 센서를 생성합니다.
서문
CID 시스템은 두 단백질이 소분자 리간드의 존재 에서만 이화(그림 1)를분석하고 신진 대사, 신호 화 및 기타 생물학적 경로를 조작하기위한 다양한 도구를 제공합니다1. 이들은 약물 조절 T 세포 활성화2 및 세포사멸3,4,입양 T 세포 치료의 안전성 및 효능을 향상시키기 위한 생물학적 작용의 잠재력을 입증하였다. 추가적으로, 그(것)들은 작은 분자 표적의 생체내 또는 생체외 탐지를 위한 새로운 방법론을 제공합니다. 예를 들어, CID 단백질은 형광 리포터 시스템(예를 들어, 형광 공명 에너지 전달(FRET)5 및 원형 투과형 형광 단백질6과 유전적으로 융합될 수 있으며, 생체 내 실시간 측정을 위해, 또는 샌드위치 효소 연계 면역소자 분석(ELISA)에 대한 친화성 시약으로서 작용할 수 있다.
광범위한 응용 분야에도 불구하고 주어진 소분자 리간드에 의해 제어될 수 있는 새로운 CID 시스템을 만드는 것은 큰 과제입니다. 동물 면역7,시험관 내 선택8,9및전산 단백질설계(10)를 포함한 확립된 단백질 바인더 엔지니어링 방법은 이진 단백질-리간드 상호작용을 통해 기능하는 리간드 결합 단백질을 생성할 수 있다. 그러나, 이들 방법은 리간드-유도 삼차 CID 복합체를 만드는 데 어려움이 있다. 일부 방법은 동일하거나 상이한단백질11,12,13,14,15, 16에 독립적으로 결합하는 2개의 리간드를 화학적으로 연결함으로써 CID를 생성하거나 기존의 소분자 단백질 복합체를 표적화하는 항체와 같은 바인더 단백질을 선택에 의존하여17,18,따라서 리간드의 제한된 선택을 갖는다.
우리는 최근 CID 시스템19의드 노보 엔지니어링을위한 CID (COMBINES-CID) 방법의 combinatorial 빈ders-e nabled s선거를 개발했다. 이 방법은 리간드-유도 이량화의 높은 특이성을 얻을 수 있다(예를 들어, 앵커-이량화 바인더 해리 상수, K D(리간드 제외)/KD(리간드)> 1,000). 이분 특이성은 리간드 결합 시 형태 변화를 유발할 수 있는 유연한 결합 부위가 있는 앵커 바인더를 사용하여 달성되며, 리간드 결합 앵커 바인더만인식하는 형태선택적 바인더의 선택을 위한 기초를 제공한다. 우리는 나노체의 칸 나비 디올 (CBD)-유도 이종, 보편적 인 스캐폴드와 세 개의 유연한 CDR 루프(그림 2)20을포함하는 카멜리드에서 12-15 kDa 기능성 항체 단편을 생성함으로써 원리 증명을 입증했으며, 이는 소분자 에피토페21,22에대한 적응 가능한 크기의 결합 포켓을 형성할 수 있다. 특히, 결합 단백질 라이브러리의 시험관 내 선택은 동일한 고품질 라이브러리가 상이한 리간드에 적용될 수 있기 때문에 CID 엔지니어링에 대해 비용 효율적이고 일반화되어야 합니다.
이 프로토콜 및 비디오에서, 우리는 앵커의 2단계 체외 선택 및검증(그림 3A)및 이량화 바인더(그림3B)를CBD를 대상으로109보다 높은 다양성을 가진 조합나노라이브러리를 스크리닝함으로써 설명에 초점을 맞추고 있으나, 프로토콜은 다른 단백질 라이브러리 또는 소분자 표적에 적용되어야 한다. CID 바인더의 스크리닝은 일반적으로 6-10 주가 걸립니다(그림 4).
프로토콜
1. 도서관 건설
- 앞서설명한 바와같이 ~ 1.23-7.14 x 109의다양성을 가진 합성 결합 단일 도메인 항체 라이브러리를 사용한다. 이 프로토콜에는 라이브러리 구성이 포함되지 않지만 다른 조합 바인더 라이브러리에 적용할 수 있습니다.
2. 리간드 대상 또는 리간드의 생체 동화
- 선택된 리간드, 예를 들어, CBD 및 테트라하이드로칸나비놀(THC)19,대상의 적합한 생물항화 부위에 따라 다양한 화학 합성 전략을 통해 바이오티니어를.
3. 앵커 바인더 스크리닝
- 선택 시작
- 단일 TG1 세포 콜로니를 접종하여 모든 라운드를 시작하고, 37°C에서 2YT의 6 mL및 분당 250회 회전수(rpm)에서 600 nm(OD600)의흡광도 ~0.5의 흡수를 접종한다. 3.5.1 단계에서 사용하기 위해 얼음 상에 세포를 배양합니다.
- 비오틴 결합 스트렙타비딘 비즈를 가진 부정적인 선택
- 자기 분리 랙을 사용하여 스트렙타비딘 코팅 된 자기 비드 300 μL을 세척하여 "네거티브 선택 구슬"을 준비하고, 3 x 0.05 % 인산 완충식식염수와 트웬 버퍼 (PBST, 0.05 % vol / vol / vol Tween 20 %)를 사용하여 준비하십시오. 1 x PBS로 2배.
- 1 x PBS(pH=7.4)에서 1 mL의 카제인 1 mL로 비드를 재중단하고, 비오틴을사용하여 보고된 결합 용량을 5배 첨가하여 비드를 포화시된다. 1 시간 동안 회전자에서 실온 (RT)에서 배양하십시오.
- 총 8회 세척시 1x PBS를 사용하여 0.05% PBST와 3x를 사용하여 구슬을 5x 세척합니다.
- 1% 카제인/1% BSA에~10~13개의 파지 입자를 1 x PBS(pH = 7.4)에 넣고 1시간 동안 회전자에서 RT로 배양합니다.
- 배양 후, 3.3.6단계에서 사용할 상상액을 수집한다.
- 생체용 리간드 결합 스트렙타비딘 비즈로 포지티브 셀렉션
- 3.2.1단계 다음의 "네거티브 선택 비드"에 사용되는 비드의 부피를 1/2를 사용하여 "양수 선택 비드"를 준비합니다.
- 1× PBS, pH 7.4에서 1 mL 1% 카제인으로 비드를 다시 중단하고 선택된 생체티니글리드 리간드를 사용하여 수동에 기초하여 계산된 전체 결합 용량을 5배 추가하여 비드를 포화시켰다. 1 시간 동안 회전자에서 RT에서 배양하십시오.
- 총 8회 세척시 1x PBS를 사용하여 0.05% PBST와 3x를 사용하여 구슬을 5x 세척합니다.
- 1 x PBS (pH = 7.4)에서 1 % 카제인 / 1 % BSA의 1 mL로 비드를 차단하고 파지와 스트렙 타비딘 코팅 된 자기 구슬 사이의 비특이적 결합을 방지하기 위해 1 시간 동안 회전자에서 RT에서 배양하십시오.
- 스트렙타비딘 코팅 된 자기 비드를 0.05 % PBST를 사용하여 3 x 씻어 내고 1 x PBS를 사용하여 1 회 세척하여 총 4 번 씻으하십시오.
- 스트렙타비딘 코팅 된 자기 구슬은 단계 3.2.5에서 가져온 언바운드 파지를 사용하여 재중단하고 1 시간 동안 회전자에서 RT에서 배양하십시오.
- 자기 구슬을 방해하지 않고 상류물을 추출하십시오. 3.5.1 단계에서 사용할 언바운드 파지를 입력으로 저장합니다.
- 1 x PBS를 사용하여 0.05 % PBST 및 5 x를 사용하여 구슬을 10 x로 씻으하십시오. 세 번의 세차 사이에 는 튜브 벽에 특별히 구속되지 않은 파지를 피하기 위해 새로운 튜브로 전달합니다.
- 파지 표시 나노바디용출
- 비생체측 리간드의450 μL을 첨가하고, 마이크로몰 범위(예를 들어, 10-50 μM)의 농도를 사용하고, 30분 동안 로터상에서 RT에서 인큐베이팅함으로써 경쟁적으로 결합된 파지를 용출한다. 결합 파지의 경쟁용 용출을 위한 선택된 리간드 농도는 "앵커 바인더"의 원하는 KD에 의존한다. 리간드 의 농도는 초기 선발 라운드에서 상대적으로 높을 수 있으며 이후 라운드에서 감소할 수 있습니다.
- 상급을 수집하고 3.5.2 단계에서 사용할 수, 출력으로 용출 파지를 저장합니다.
- 입력/출력 적정 및 감염
- 입력 적정을 위해 3.3.7 단계에서 입력 파지와 함께 1 x PBS에서 최대 109-fold로 10x 직렬 희석을 준비합니다. 107-109 직렬 희석을 사용하여 각 희석으로부터 10 μL 입력 파지를 70 μL TG1 세포(~0.5의 OD600)로 이송하여 감염을 수행한다. 37°C에서 45분 동안 배양하고, 감염된 TG1 세포를 100 μg/mL 암피실린과 2% (wt/vol) 포도당을 함유한 3개의 90 mm 2YT-한천 접시에 플레이트하고, 37°C에서 밤새 배양한다. 야간 플레이트에서 파지 입력은 다음과 같이 계산할 수 있습니다.

- 출력 감염 및 적정을 위해, TG1 세포의 단계 3.4.2 에서 3 mL (~0.5의 OD600)에서 용출 된 파지를 전송합니다. 37 °C에서 45 분 동안 수조에서 배양하십시오. 그런 다음 2YT에서 10x 직렬 희석을 최대 103-fold로준비하고, 90 mm 2YT-한천 접시에 각 희석을 플레이트하고, 37°C에서 밤새 배양한다. 야간 플레이트에서 파지 출력은 다음과 같이 계산할 수 있습니다.

- 100 μg/mL 암피실린과 2% (wt/vol) 포도당을 함유한 3개의 150 mm 2YT-한천 플레이트에 나머지 감염된 TG1 세포를 나눕니다. 37 °C에서 하룻밤 동안 인큐베이트 플레이트.
- 입력 적정을 위해 3.3.7 단계에서 입력 파지와 함께 1 x PBS에서 최대 109-fold로 10x 직렬 희석을 준비합니다. 107-109 직렬 희석을 사용하여 각 희석으로부터 10 μL 입력 파지를 70 μL TG1 세포(~0.5의 OD600)로 이송하여 감염을 수행한다. 37°C에서 45분 동안 배양하고, 감염된 TG1 세포를 100 μg/mL 암피실린과 2% (wt/vol) 포도당을 함유한 3개의 90 mm 2YT-한천 접시에 플레이트하고, 37°C에서 밤새 배양한다. 야간 플레이트에서 파지 입력은 다음과 같이 계산할 수 있습니다.
- 추가 선택 라운드를 위한 라이브러리 증폭 및 복구
- 플레이트당 3 mL의 2YT를 추가하고 멸균 세포 스크레이퍼로 긁어 내고 50 mL 원엽 튜브에 있는 모든 세포를 수집합니다. 수집된 세포를 멸균 글리세롤(20% wt/vol 최종 농도)과 혼합합니다. 혼합물의 OD600을 측정하고 3-5 스톡 알리쿼트합니다. 장기 보관을 위해 -80°C에서 보관하십시오.
- 파지 레스큐를 위해, 2YT 매체 의 25 mL를 사용하여 파지미드 함유 TG1 세균 혼합물을 희석하고 2% 포도당과 100 μg/mL 암피실린을600~0.1의 OD로 보충하였다. 배양 세포는 37°C 및 250 rpm에서~0.5의 OD600으로 하였다.
- CM13 도우미 파지를 5 x 109 pfu/mL에 추가하여 세포를 과소 감염시키고 37°C및 250rpm에서 45분 동안 배양합니다. CM13 도우미 파지는 완전한 파지 입자의 조립에 필요한 파지 코팅 단백질을 제공합니다.
- 포도당을 제거하기 위해 10 분 동안 8,000 x g에서 배양한다. 100 μg/mL ampicillin 및 50 μg/mL 카나마이신으로 보충된 2YT 매체의 50 mL를 사용하여 세포를 다시 중단하고 밤새 25°C 및 250 rpm에서 배양합니다.
- 9,000 x g,4 °C에서 하룻밤 배양으로부터 세포를 원심분리기 30 분 동안. 1/5 볼륨 PEG / NaCl 용액 (20 % wt / vol 폴리에틸렌 글리콜 -6,000 및 2.5 M NaCl)을 사용하여 상급체에서 상구체로 상급체로 상급체를 옮긴다. 부드럽게 섞어서 1시간 동안 얼음 위에 놓습니다.
- 30 분 동안 4 °C에서 12,000 x g를 사용하여 파지 입자를 수집합니다. 1 x PBS의 1 mL을 사용하여 펠릿을 다시 중단하고 현탁액을 미세 원심 분리튜브로 옮긴다. 튜브를 20,000 x g 및 4°C에서 10분 동안 원심분리하여 잔류 박테리아를 제거한다.
- 세균성 펠릿을 방해하지 않고 상급을 새로운 미세 원심 분리관으로 옮김. 1:100 희석을 사용하여 269 nm 및 320 nm에서 흡수를 측정합니다. 파지의 총 수는 다음 공식23을사용하여 계산할 수 있습니다.

- 파지 라이브러리를 단기 사용하거나 장기 보관을 위해 -80°C에서 25% 글리세롤로 4°C에 보관하십시오.
- 3~6회 또는 원하는 보강이 관찰될 때까지 선택 횟수(3.1-3.6단계)를 반복합니다(결과 섹션 참조). 플레이트 및 리간드에 대한 그들의 친화성 및 특이성을 특성화하기 위해 단일 클론(섹션 4)을 선택한다(섹션 5-7).
4. 단일 클론 격리
- 농축된 서브라이브러리로부터 개별 클론을 분리하려면 파지에 감염된 TG1 세포의 10x 직렬 희석을 준비합니다(단계 3.5.2). 100 μg/mL ampicillin 및 2% (wt/vol) 포도당을 함유한 90 mm 2YT-한천 접시에 플레이트 직렬 희석및 37°C에서 밤새 배양한다.
- 하룻밤 접시에서, 멸균 깊은 우물 플레이트에 잘 당 100 μg / mL ampicillin보충 2YT 매체의 250 μL로 단일 식민지를 선택하고 밤새 37 °C에서 성장.
- 하룻밤 배양물에서 10 μL을 100 μg/mL ampicillin으로 보충된 신선한 2YT 배지 500 μL로 접종합니다.
- ~0.5의 OD600으로 세포를 성장시키고, CM13 도우미 파지를 5 x 109 pfu/mL에 넣고 37°C및 250 rpm에서 45분 동안 배양한다.
- 100 μg/mL ampicillin과 50 μg/mL 카나마이신으로 보충된 2YT 용지 500 μL을 첨가합니다. 밤새 25°C 및 250 rpm에서 배양합니다.
- 10 분 동안 3,000 x g에서 하룻밤 배양으로부터 깊은 웰 플레이트를 원심 분리. 세포 펠렛을 방해하지 않고 파지 입자를 함유하는 상급물질을 수집한다.
- 파지 입자는 ELISA를 사용하여 리간드에 대한 선택된 클론의 특이성을 결정할 수 있다. 비오틴 또는 표적의 구조적 상동체는 음성 대조군으로서 사용될 수 있다.
5. ELISA에 의한 앵커 바인더 검증
- 코팅 버퍼 (100 mM 탄산염 완충제, pH = 8.6)에서 5 μg / mL 스트렙타비딘의 100 μL을 사용하여 96 웰 ELISA 플레이트를 밤새 4 °C에서 코팅합니다.
- 0.05% PBST를 사용하여 ELISA 플레이트를 3x 세척하고 대상 웰에 1 μM 생체 측화 표적 100 μL을 추가합니다. 100 μL의 1 μM 비오틴 또는 표적 호몰로그를 대조군 웰에 추가합니다. RT에서 1 시간 동안 배양하십시오.
- 0.05% PBST를 사용하여 세척 플레이트 5x및 1 x PBS에 1% 카제인의 300 μL을 첨가하여 비특이적 결합을 차단합니다. RT에서 1 시간 동안 배양하십시오.
- 0.05%-PBST를 사용하여 ELISA 플레이트를 3x 세척하고 정제된 파지 상판을 첨가합니다. RT에서 1 시간 동안 배양하십시오.
- 0.05% PBST를 사용하여 ELISA 플레이트를 10x 세척하고 100 μL 고추냉이 과산화물 (HRP)-M13 주요 코트 단백질 항체 (1 x PBS와 1 % 카제인)를 추가하십시오. RT에서 1 시간 동안 배양하십시오.
- 0.05% PBST를 사용하여 ELISA 플레이트를 3x 세척하고 100 μL 테트라메틸벤지딘(TMB) 기판을 추가합니다. 10 분 동안 또는 눈에 보이는 색상 변화가 관찰 될 때까지 배양하십시오. 1M HCl. 분광광도계에서 450 nm에서 플레이트를 100 μL을 추가하여 반응을 멈춥시다.
- 단백질 발현 및 정제를 위해, 타겟에 대한 높은 친화성 및 특이성을 나타내는 클론을 선택한다(토론 참조).
6. 단백질 발현, 정화 및 생물항화
- 이전에 보고된 바와 같이19,서브클론은 섹션 5에서 클론을 선택하고 C-단말 Avi-tagged 및 His-tagged 나노체로서 표현한다.
- 대장균 WK6 세포의 주변에서 선택된 나노체를 발현(전형적으로 1 L 배양), 삼투성 쇼크에 의해 방출하고, 니켈-NTA 컬럼을 사용하여 정제한다(재료 표참조).
- 탈염 컬럼으로 버퍼교환(글리세롤 5%가 있는 1 x PBS; 재료 표참조).
- 상업용 키트를 사용하는 바이오티닐레이트 나노바디(재료 표참조)를 사용하여 추가 용도로 사용한다.
7. BLI에 의한 앵커 바인더 특성화
- 결합 분석 버퍼(1 x PBS =7.4), 0.05% 트웬 20, 0.2% BSA, 3% 메탄올을 가진 스트렙타비딘 바이오센서에 200 nM 바이오티닐화된 앵커 바인더를 고정시킴으로써 선택된 앵커 바인더의결합 친화성 및 역학을 분석한다.
- 데이터 분석 소프트웨어를 사용하여 정상 상태 분석을 통해 앵커 바인더-리간드 상호작용의 해리상수(KD)를 계산합니다(재료 표참조). 얻어진 KD 값은 일반적으로 단일-두 자리 마이크로몰에서 범위.
8. 이분화 바인더 스크리닝
참고: "이량화 바인더"의 바이오패닝 스크리닝은 두 가지 중요한 단계를 제외하고 앵커 바인더의 바이오패닝 스크리닝과 유사합니다: 1) 이량화 바인더는 음성에 대해 선택된 생체티닐화된 앵커 바인더 및 앵커 바인더 복합체를 사용하여 선택됩니다. 각각 양수 선택. 2) 용출 단계 동안, 100 mM 트리에틸아민은 앵커 바인더-리간드 표적 복합체에만 결합된 양면 선택파지를 용출하는데 사용된다. 100 mM 트리메틸아민 용액(pH = 11.5)은 단백질 상호작용을 방해하여 양성 클론을 용출하는 데 사용된다.
- 선택 시작
- 최소 한 매체상에서 갓 자란 단일 TG1 세포 콜로니를 37°C및 250 rpm에서 6mL에서 ~0.5의 OD600으로 접종하여 모든 라운드를 시작한다. 얼음에 세포를 배양.
- 음수 선택된 나노바디 제거
- 스트렙타비딘 코팅 된 자기 비드 400 μL을 사용하여 "빼기 튜브"를 준비하고 3.2 단계를 따릅니다. 그러나, 비오틴으로 포화하는 대신, 선택된 생체틸화 앵커 바인더를 사용하여 계산된 전체 결합 용량의 5배를 추가하고 8.3.3 단계에서 사용되는 언바운드 파지를 저장한다.
- 긍정적으로 선택된 나노바디 선택
- "빼기 튜브"에 사용되는 스트렙타비딘 코팅 된 자기 비드의 부피를 1/2를 사용하고 3.3.2 ~ 3.3.3 단계 다음 단계를 사용하여 "캡처 튜브"를 준비합니다. 그러나, 바이오티니화 리간드를 포화시키는 대신, 선택된 생체티니레이팅 앵커 바인더를사용하여 계산된 전체 결합 용량을 5배 더한다.
- 양성 이량화 바인더 선택을 위한 앵커 바인더-리간드 복합체를 형성하기 위해, 비생체화 리간드의충분히 높은 농도를 추가한다. 이것은 대부분의 스트렙타비딘 바인딩 앵커 바인더가 리간드 바인딩 복합체를 형성할 수 있게 합니다.
- 3.3.3에서 3.3.8 단계, "빼기 튜브"에서 가져온 언바운드 파지를 사용하여 수행합니다.
- 양면 선택된 나노체용출
- 100 mM 트리에틸아민의 450 μL을 첨가하고, 10 분 동안 로터상에서 RT에서 배양함으로써 앵커 바인더-리간드 복합체에 결합된 파지를 용출한다.
- 경쟁적으로 용출된 파지를 수집하고 3.4.1에서 3.4.2 단계를 따릅니다.
- 이화 바인더 선택의 추가 라운드
- 3.5 단계와 3.6 단계를 수행하여 라이브러리를 증폭하고 복구하여 추가 선택 라운드를 수행합니다. 3-6라운드 또는 원하는 농축이 관찰될 때까지 선택 과정을 반복합니다. 플레이트 및 단일 클론(섹션 4 참조)을 선택하여 대상에 대한 그들의 친화성 및 특이성을 특성화한다.
9. ELISA에 의한 이분화 바인더 특성화
- 섹션 4의 단계를 수행하여 ELISA를 통해 특성화를 위해 개별 복제본을 분리합니다.
- 앵커 바인더-리간드 복합체에 대한 이량화 바인더 후보의 친화도를 테스트하기 위해, 100 nM 의 100 μL의 생체결합 앵커 바인더를 사용하여 ELISA 표적 플레이트를 코팅한다. 1 시간 동안 배양 한 후, 앵커 바인더 - 리간드 복합체를 형성하기 위해 리간드 타겟의 1 μM을 추가합니다.
- 제어 플레이트는 또한 자유 앵커 바인더에 결합 할 수있는 클론을 스크리클을 선별하기 위해 단독으로 생체 용 앵커 바인더를 사용하여 코팅되어야한다. 100 nM의 100 μL을 추가하고 1 시간 동안 RT에서 배양하십시오.
- 5.3-5.7 섹션을 따르십시오.
10. BLI에 의한 이분화 바인더 특성화
- 앵커 바인더-리간드 복합체에 대한 이량화 바인더의 결합 친화도 및 역학은 결합 분석 버퍼를 가진 스트렙타비딘(SA) 바이오 센서상에 생체티니화 이물질화 바인더를 고정시킨 다음 1 μM 앵커 바인더로 미리 분석하여 리간드의 직렬 희석과 미리 보정하여 분석할 수 있다. KD, kon및 k오프 상호작용은 보고된 방법19를사용하여 계산할 수 있다.
결과
우리는 CBD를 대상으로 109 보다 높은 다양성을 가진 조합 nanobody 라이브러리를 선별하여 앵커 및 이량화 바인더의 2 단계 체외 선택 및 검증을 설명합니다. 앵커 및 이광 바인더 모두에 대한 연속적인 선택 라운드 동안 파지 바이오패닝의 농축을 평가하는 것이 중요하다. 그림 5와 같이 4~6라운드 선택 후의 일반적인 보강 결과는 서브라이브러리에서 잠재적인 적중률이 높다는 것을 나타내는 좋은 표시이므로 추가 선택 라운드가 필요하지 않을 수 있습니다.
단일 클론 ELISA는 앵커 및 이화 바인더의 상대적 결합 친화도 및 선택성을 분석하는데 적합하다. 도6A는 바이오패닝6라운드 후 대표적인 앵커 바인더 선택 결과이다. 높은(예를 들어, #87) 또는 낮음(예를 들어, #27) 리간드 선택성을 나타내는 클론을 비교할 수 있다. 높은 선택성 클론은 앵커 바인더 후보로 선택되어야 합니다. 마찬가지로, 도 6B는 바이오패닝의 4라운드 후 이광 바인더 선택 결과를 나타낸다. 우리는 전형적으로 리간드(예를 들어, #49) 또는(예를 들어, #80)없이 만 고정된 앵커 바인더로 이종odimer를 형성하는 클론을 관찰하였다. 이머화 특이성을 나타내는 전자는 추가 유효성 검사를 위해 선택되어야 합니다.
앵커 바인더 ELISA는 생체티니제 표적의 사용에 의존한다. 따라서, 우리는 더 비 표지 된 대상에 대한 결합을 확인하기 위해 BLI를 사용할 필요가있다. BLI는 또한 결합 역학의 특성화를 허용합니다. 앵커 및 이각 바인더의 대표적인 BLI 결과는 각각 도 7A 및 7B에도시되어 있다. 좌측 패널은 리간드 농도 의존적 결합을 보여 주며, 이는 CID 시스템을 구성하는 데 적합하다는 것을 시사한다. 오른쪽 패널에는 네거티브 컨트롤이 표시됩니다. 리간드의 존재 에서 앵커 및 이량화 바인더 상호작용의 계산된 KD는 전형적으로 두 자리 수 나노몰에서 두 자리 수 마이크로몰까지 범위. 그들은 리간드 와 선택의 조합 라이브러리에 따라 다를 수 있습니다.
분석 크기 배제 크로마토그래피(SEC)는 앵커와 이량화 바인더 사이의 이종성 형성을 확인하기 위해 수행되었다. 앵커 및 이각 바인더 및 CBD를 혼합했을 때 이각 피크가 관찰되었다(도8A,레드 라인). 대조적으로,CBD(도 8A,파란색 선)의 부재 또는 각 바인더가 컬럼에 단독으로 로딩되었을 때 이량화 피크가 검출되지 않았다(도8B). 화학 적 가교는 CID 복합체를 안정화하는 데 사용되었으며, 가교 나노 체는 이전의 용출 피크에 해당하는 크기를 약간 증가시켰습니다.
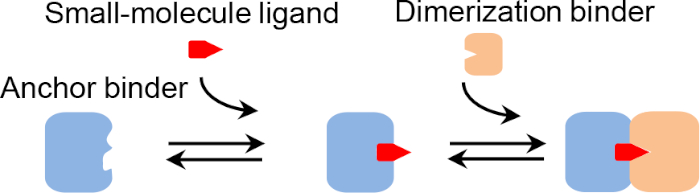
그림 1: 화학적으로 유도된 단백질 이분화의 메커니즘. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
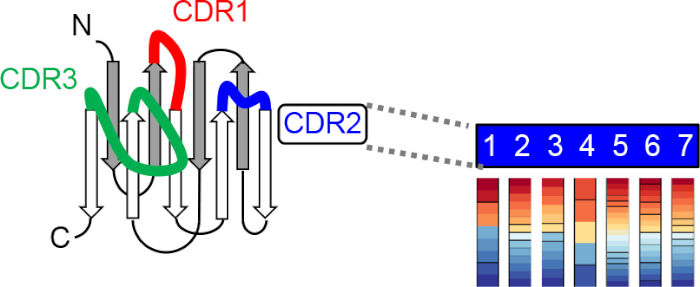
도 2: 합성 나nobody 조합 라이브러리의 생성의 회로도. 상기 라이브러리는 삼중핵항 돌연변이체(TRIM) 기술(24)에의해 3개의 상보성 결정 영역(CDRs)에서 각 무작위화 위치에 아미노산의 설계 분포를 통합하여 보편적 인 nanobody 스캐폴드를 사용하여 시공된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
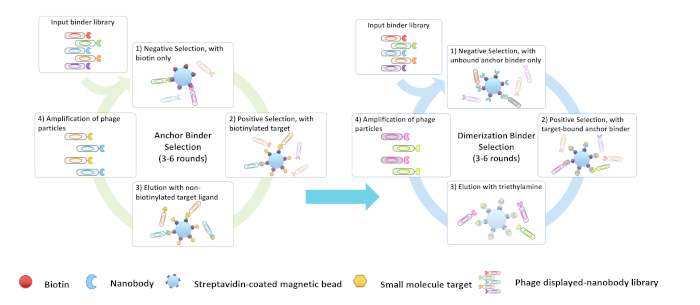
도 3: (A) 앵커 및 (B) 이량화 바인더 스크리닝의 순서도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
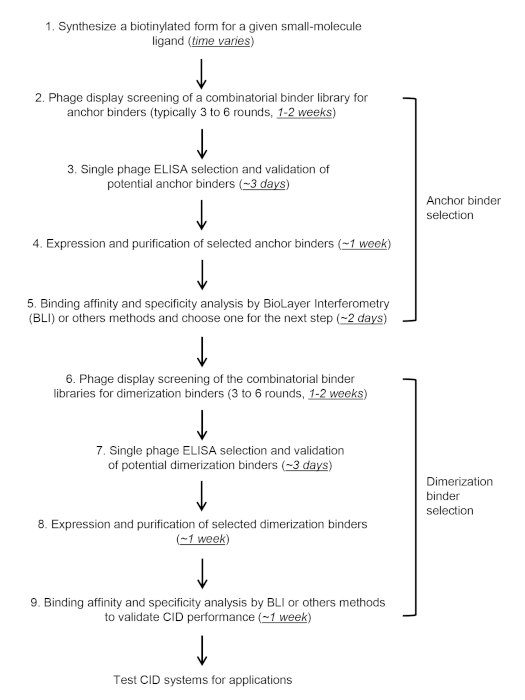
그림 4: 결합-CID의 타임라인입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
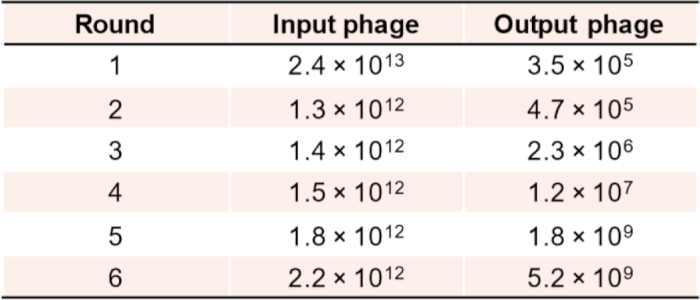
그림 5: 앵커 바인더 선택을 위한 바이오패닝의 각 라운드에 따른 파지 역가의 농축. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
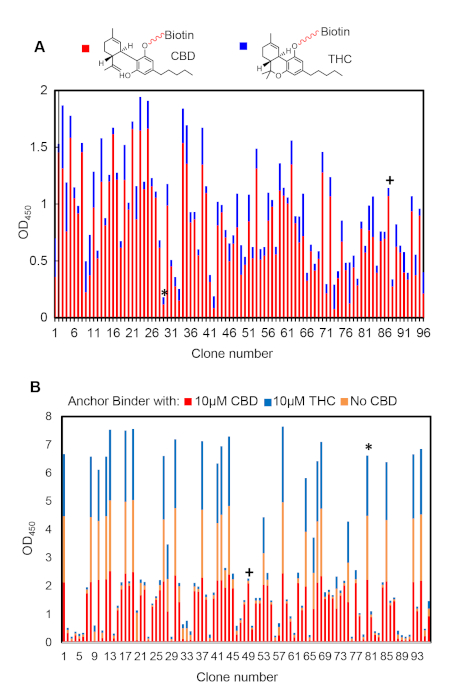
그림 6: 양수(+) 및 음수(*) 클론을 나타내는 대표 ELISA 결과입니다. (A)앵커 바인더 ELISA는 6번의 선택 후 무작위로 고른 클론 96개에서 생성됩니다. (B)이분화 바인더 ELISA 결과는 4회 선택 후 무작위로 고른 클론 96개이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
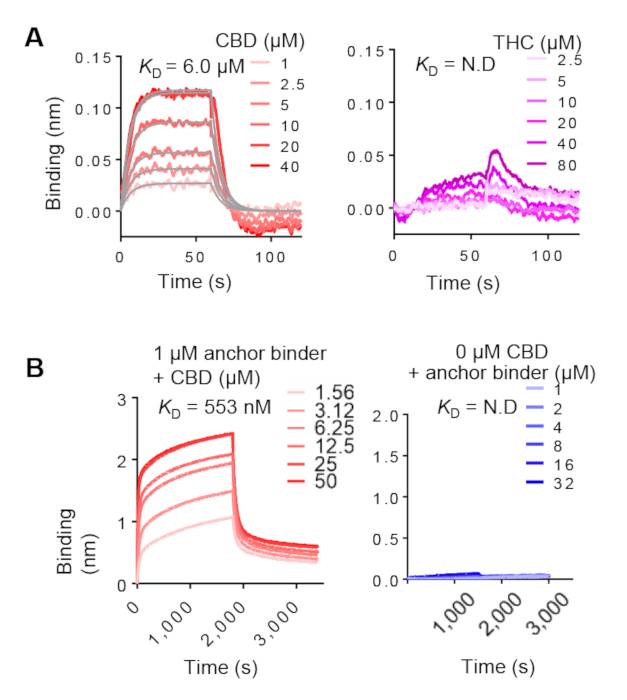
도 7: BLI에 의한 앵커 및 이각 바인더 운동 분석. (A)레이블이 지정되지 않은 CBD(왼쪽)와 THC(오른쪽)가 있는 앵커 바인더 분석. 바이오티니어 앵커 바인더는 CBD의 다른 농도로 정성된 슈퍼 스트렙타비딘(SSA) 바이오 센서에 고정되었다. CBD 바인딩 (빨간색 곡선)에 대한 측정 된 데이터는 전역적으로 장착되었습니다 (회색 선). (B)왼쪽, SA 바이오 센서-고정이량화 바인더의 BLI 분석은 CBD의 상이한 농도로 서식형을 배합된 앵커 바인더에 결합한다. 오른쪽, 앵커 바인더 농도는 CBD가 없는 상태에서 고정화 이량화 바인더에 적정및 결합되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
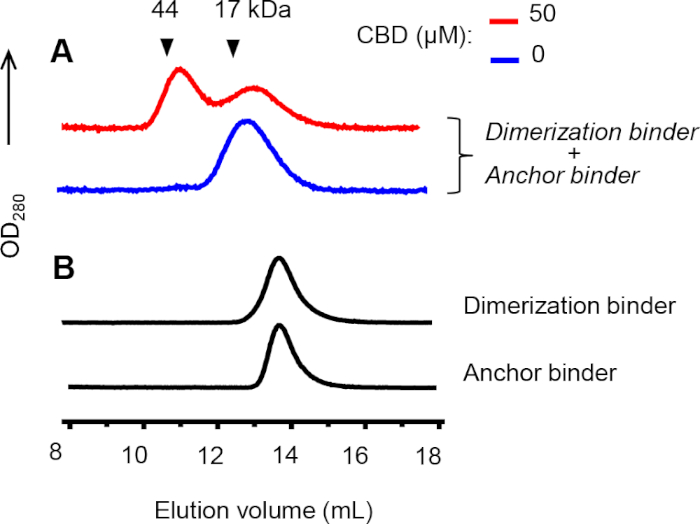
그림 8: 앵커와 이분화 바인더 사이의 이종화에 대한 SEC 분석. (a)CBD의 존재 또는 부재 에서 이량화 및 앵커 바인더(5 μM 각각)를 분석 하기 전에 RT에서 30 분 동안 100 μM 비스-N-succinimidyl-(펜타에틸렌 글리콜) 에스테르에 의해 가교되었다. 단백질 표준의 용출 볼륨은 삼각형으로 표시됩니다. (B)비가교재 앵커 및 이량화 바인더(각각 30 μM)를 별도로 주입하였다. A 및 B의 크로마토그램은 상이한 Y 스케일로 나타난다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
다양한 바이오패닝 라운드에 대해 입력 파지 라이브러리의 정확한 농도를 선택하는 것이 중요합니다. 우리는 일반적으로 ~1012-1013 파지 입자의 입력 라이브러리에서 시작 다양성 >109,각 파지 클론의 ~ 100-1,000 사본을 풀 다운 분석에 제시 할 수 있도록. 결합 분석에서 파지 농도가 너무 높거나 낮으면 비특이적 결합 또는 양성 클론의 손실 가능성이 증가합니다. 앵커 또는 이량화 바인더 선택은 일반적으로 바이오패닝의 3~ 6라운드로 구성되며, 출력 파지 카운트는 보통 ~104에서 시작하여 ~108-109로증가합니다. 이러한 농축을 관찰한 후 ELISA 유효성 검사를 위해 단일 클론을 선택하는 것이 적합합니다. 바이오 패닝의 추가 라운드는 적합한 낮은 풍부 긍정적 인 클론을 식별의 기회를 줄일 수 있습니다.
선택 의 성공을 향상시키기 위해 적절한 네거티브 컨트롤 과 선택을 설정하는 것이 중요합니다. 예를 들어, 리간드 표적의 구조적 유사체의 사용은 리간드 특이성의 선택을 용이하게 할 것이다. 우리의 작품에서, 매우 유사한 아날로그, THC는, 앵커 및 이화 바인더19의ELISA 및 BLI 검증에서 CBD에 대한 제어로 사용되었다 . 이화 바인더 선택에서, 앵커 바인더가 상대적으로 낮은 리간드 결합 친화도를 가지는 경우, 자유 및 리간드 바운드 앵커 바인더 모두 양성 선택에서 표적으로서 제시될 수 있다. 따라서 음수 선택 중에 자유 앵커 바인더에 바인딩되는 바인더를 철저히 제거하는 것이 중요합니다. 이것은 자유 앵커 바인더로 감산의 여러 라운드를 수행하여 달성 될 수있다.
당사의 프로토콜의 한계는 표적 분자가 앵커 바인더 선택을 위해 생체조가 될 필요가 있고 오직 하나 또는 몇 개의 앵커 바인더만이 이량화 선택을 위해 사용될 수 있다는 것이다. 생체 동화 된 표적의 사용은 부분적으로 비오틴과 표적 사이의 링커에 결합 바인더를 풍부하게 할 수 있습니다. 따라서 BLI 또는 기타 기술에 의해 레이블이 지정되지 않은 대상을 사용하여 조회의 유효성을 검사하는 것이 중요합니다. 이광 바인더 선택을 위해 단일 또는 몇 개의 앵커 바인더를 선택하면 적절한 감도와 특이성을 가진 CID 시스템을 식별할 가능성이 줄어듭니다. 따라서, 선택의 다중화 능력은 다른 기술들(예를 들어, 단일 분자-상호작용 시퀀싱(SMI-Seq)과 결합함으로써 추가적인 개선을 기다리고 있으며, 이는 "라이브러리별 라이브러리"단백질 상호작용스크리닝(25)을가능하게 한다.
공개
이 작품과 관련된 임시 특허는 워싱턴 대학에 의해 출원되었습니다.
감사의 말
이 작품은 워싱턴 대학 혁신 상 (L.G.), 미국 국립 보건원 (1R35GM128918에서 L.G.에) 및 워싱턴 대학의 스타트업 기금 (L.G.)의 보조금에 의해 지원되었습니다. H.J.는 워싱턴 연구 재단 학부 펠로우십의 지원을 받았습니다. K.W.는 워싱턴 대학 단백질 디자인 연구소의 학부 펠로우십을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1-Step Ultra TMB ELISA substrate solution | Thermo Fisher Scientific | 34029 | |
| Agar | Thermo Fisher Scientific | BP1423-2 | |
| Amicon Ultra-15 Centrifugal Filter unit (3 kDa cutoff) | Millipore | UFC900324 | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | |
| Bio-Rad Protein Assay Kit II | Bio-Rad | 5000002 | |
| BirA biotin-protein ligase standard reaction kit | Avidity | BirA500 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Casein | Sigma-Aldrich | C7078-1KG | |
| CM13 Helper phage | Antibody Design Labs | PH020L | |
| D-(+)-Glucose monohydrate | Alfa Aesar | A11090 | |
| Dynabeads M-280 Streptavidin | Thermo Fisher Scientific | 11205D | |
| DynaMag-2 Magnet | Thermo Fisher Scientific | 12321D | |
| EDTA | Thermo Fisher Scientific | BP120-1 | |
| Fast DNA Ladder | New England Biolabs | N3238S | |
| FastDigest BglI | Thermo Fisher Scientific | FD0074 | |
| Glycerol | Thermo Fisher Scientific | BP229-1 | |
| HiLoad 16/600 Superdex 200 pg | GE Healthcare | 28989335 | |
| HiPrep 26/10 Desalting Column | GE Healthcare | 17508701 | |
| HisTrap-FF-1ml | GE Healthcare | 11000458 | |
| Imidazole | Alfa Aesar | 161-0718 | |
| IPTG | Thermo Fisher Scientific | 34060 | |
| Kanamycin | Thermo Fisher Scientific | BP906-5 | |
| M13 Major Coat Protein Antibody | Santa Cruz Biotechnology | sc-53004 | |
| NaCl | Sigma-Aldrich | S3014-500G | |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ND-2000 | |
| Nunc 96-Well Polypropylene DeepWell Storage Plates | Thermo Fisher Scientific | 260251 | |
| Nunc MaxiSorp | Thermo Fisher Scientific | 44-2404-21 | |
| Octet RED96 | ForteBio | N/A | |
| pADL-23c Phagemid Vector | Antibody Design Labs | PD0111 | |
| PEG-6000 | Sigma-Aldrich | 81260-1KG | |
| Platinum SuperFi DNA Polymerase | Invitrogen | 12351010 | |
| PureLink PCR Purification Kit | Thermo Fisher Scientific | K310001 | |
| QIAprep Spin M13 Kit | Qiagen | 27704 | |
| Recovery Medium | Lucigen | 80026-1 | |
| SpectraMax Plus 384 | Molecular Devices | N/A | |
| Sucrose | Sigma-Aldrich | S0389-1KG | |
| Super Streptavidin (SSA) Biosensors | ForteBio | 18-5057 | |
| Superdex 75 increase 10/300 GL Column | GE Healthcare | 28-9909-44 | |
| T4 DNA Ligase | Thermo Fisher Scientific | 15224-025 | |
| TG1 Electrocompetent Cells | Lucigen | 60502-1 | |
| Triethylamine | Sigma-Aldrich | 471283-100mL | |
| Trizma Base | Sigma-Aldrich | T1503 | |
| Tryptone | Thermo Fisher Scientific | BP9726-5 | |
| Tween 20 | Thermo Fisher Scientific | BP337-500 | |
| Yeast Extract | Thermo Fisher Scientific | BP1422-2 | |
| Zeba Spin Desalting Column | Thermo Fisher Scientific | 89882 |
참고문헌
- Stanton, B. Z., Chory, E. J., Crabtree, G. R. Chemically induced proximity in biology and medicine. Science. 359 (6380), (2018).
- Wu, C. Y., Roybal, K. T., Puchner, E. M., Onuffer, J., Lim, W. A. Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science. 350 (6258), (2015).
- Straathof, K. C., et al. An inducible caspase 9 safety switch for T-cell therapy. Blood. 105 (11), 4247-4254 (2005).
- Di Stasi, A., et al. Inducible apoptosis as a safety switch for adoptive cell therapy. The New England Journal of Medicine. 365 (18), 1673-1683 (2011).
- Mank, M., et al. A FRET-based calcium biosensor with fast signal kinetics and high fluorescence change. Biophysical Journal. 90 (5), 1790-1796 (2006).
- Nagai, T., Sawano, A., Park, E. S., Miyawaki, A. Circularly permuted green fluorescent proteins engineered to sense Ca2+. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3197-3202 (2001).
- Hunter, M. M., Margolies, M. N., Ju, A., Haber, E. High-affinity monoclonal antibodies to the cardiac glycoside, digoxin. Journal of Immunology. 129 (3), 1165-1172 (1982).
- Bradbury, A. R. M., Sidhu, S., Dubel, S., McCafferty, J. Beyond natural antibodies: the power of in vitro display technologies. Nature Biotechnology. 29 (3), 245-254 (2011).
- Chen, G., et al. Isolation of high-affinity ligand-binding proteins by periplasmic expression with cytometric screening (PECS). Nature. Biotechnology. 19 (6), 537-542 (2001).
- Tinberg, C. E., et al. Computational design of ligand-binding proteins with high affinity and selectivity. Nature. 501 (7466), 212-216 (2013).
- Spencer, D. M., Wandless, T. J., Schreiber, S. L., Crabtree, G. R. Controlling signal transduction with synthetic ligands. Science. 262 (5136), 1019-1024 (1993).
- Ho, S. N., Biggar, S. R., Spencer, D. M., Schreiber, S. L., Crabtree, G. R. Dimeric ligands define a role for transcriptional activation domains in reinitiation. Nature. 382 (6594), 822-826 (1996).
- Belshaw, P. J., Ho, S. N., Crabtree, G. R., Schreiber, S. L. Controlling protein association and subcellular localization with a synthetic ligand that induces heterodimerization of proteins. Proceedings of the National Academy of Sciences of the United States of America. 93 (10), 4604-4607 (1996).
- Farrar, M. A., AlberolaIla, J., Perlmutter, R. M. Activation of the Raf-1 kinase cascade by coumermycin-induced dimerization. Nature. 383 (6596), 178-181 (1996).
- Erhart, D., et al. Chemical Development of Intracellular Protein Heterodimerizers. Chemistry & Biology. 20 (4), 549-557 (2013).
- Ballister, E. R., Aonbangkhen, C., Mayo, A. M., Lampson, M. A., Chenoweth, D. M. Localized light-induced protein dimerization in living cells using a photocaged dimerizer. Nature Communications. 17 (5), 5475 (2014).
- Hill, Z. B., Martinko, A. J., Nguyen, D. P., Wells, J. A. Human antibody-based chemically induced dimerizers for cell therapeutic applications. Nature Chemical Biology. 14 (2), 112-117 (2018).
- Foight, G. W., et al. Multi-input chemical control of protein dimerization for programming graded cellular responses. Nature Biotechnology. 37 (10), 1209-1216 (2019).
- Kang, S., et al. COMBINES-CID: An efficient method for de novo engineering of highly specific chemically induced protein dimerization systems. Journal of the American Chemical Society. 141 (28), 10948-10952 (2019).
- Muyldermans, S. Nanobodies: natural single-domain antibodies. Annual Review of Biochemistry. 82, 775-797 (2013).
- Fanning, S. W., Horn, J. R. An anti-hapten camelid antibody reveals a cryptic binding site with significant energetic contributions from a nonhypervariable loop. Protein Science. 20 (7), 1196-1207 (2011).
- Zavrtanik, U., Luken, J., Loris, R., Lah, J., Hadzi, S. Structural basis of epitope recognition by heavy-chain camelid antibodies. Journal of Molecular Biology. 430 (21), 4369-4386 (2018).
- Denhardt, D. T., Dressler, D., Ray, D. S. . The Single-Stranded DNA Phages. , 605-625 (1978).
- Virnekas, B., et al. Trinucleotide phosphoramidites: ideal reagents for the synthesis of mixed oligonucleotides for random mutagenesis. Nucleic Acids Research. 22 (25), 5600-5607 (1994).
- Gu, L., et al. Multiplex single-molecule interaction profiling of DNA-barcoded proteins. Nature. 515 (7528), 554-557 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유