Method Article
Тестирование целевых методов лечения рака с использованием структурных анализа изменения ДНК и пациентов, полученных Xenografts
В этой статье
Резюме
Здесь мы представляем протокол для проверки эффективности целевых методов лечения, отобранных на основе геномного состава опухоли. Протокол описывает идентификацию и проверку структурных перестановок ДНК, привитие опухолей пациентов в мышей и тестирование ответов на соответствующие препараты.
Аннотация
Мы представляем здесь интегративный подход для тестирования эффективности целевых методов лечения, который сочетает в себе следующее поколение секвенирования техноло-ги, терапевтических целевых анализов и мониторинга реакции на лекарства с использованием пациентов, полученных ксенотрансплантатов (PDX). Эта стратегия была подтверждена с использованием опухолей яичников в качестве примера. Протокол последовательности следующего поколения (MPseq) был использован для выявления структурных изменений, после чего был проведен анализ потенциально целевых изменений. Опухоли человека, выращенные у иммунокомпромиссных мышей, лечились препаратами, отобранными на основе геномного анализа. Результаты продемонстрировали хорошую корреляцию между прогнозируемыми и наблюдаемыми реакциями в модели PDX. Представленный подход может быть использован для проверки эффективности комбинированного лечения и оказания помощи персонализированным лечением пациентов с рецидивирующим раком, особенно в тех случаях, когда стандартная терапия не удается и существует необходимость использования лекарств от этикетки.
Введение
Ксенографты, полученные от пациентов (PDX), которые генерируются в результате имплантации частей опухоли пациента в иммунодефицитных мышей, стали мощной доклинической моделью для оказания персонализированной противораковой помощи. Модели PDX были успешно разработаны для различных злокачественных новообразований человека. К ним относятся рак молочной железы и яичников, злокачественная меланома, колоректальный рак, аденокарцинома поджелудочной железы, и немелкоклеточный рак легких1,2,3,4,5. Опухолевую ткань можно имплантировать ортопедически или гетеротопически. Первый, считается более точным, но технически трудно, включает в себя трансплантацию непосредственно в орган опухоли происхождения. Эти типы моделей, как полагают, точно имитировать гистологию оригинальной опухоли из-за "естественной" микроокружения для опухоли6,7. Например, ортотопическая трансплантация в бурсу яичника мыши привела к распространению опухоли в брюшной полости и выработке асцита, характерного для рака яичников8. Аналогичным образом, инъекция опухолей молочной железы в грудной клетки вместо брюшной молочной железы влияет на уровень успеха PDX и поведение9. Тем не менее, ортопедические модели требуют сложных систем визуализации для мониторинга роста опухоли. Гетеротопная имплантация твердой опухоли обычно выполняется путем имплантации ткани в подкожный фланг мыши, что позволяет легче контролировать рост опухоли и является менее дорогостоящим и трудоемким7. Тем не менее, опухоли, выращенные подкожной, редко метастазируют в отличие от наблюдаемых в случае ортопедической имплантации10.
Было показано, что скорость успешного ирования в него варьируется и в значительной степени зависит от типа опухоли. Более агрессивные опухоли и образцы тканей, содержащие более высокий процент опухолевых клеток, как сообщается, лучше успеха12,13. В соответствии с этим, опухоли, полученные из метастатических сайтов было показано, engraft на частотах 50-80%, в то время как те из первичных сайтов engraft на частотах, как низко как 14%12. В отличие от этого, ткани, содержащие некротические клетки и меньше жизнеспособных опухолевых клеток приопят плохо. Рост опухоли также может быть повышен путем добавления подвала мембраны матричных белков в ткани смеси во время инъекции в мышей14 без ущерба для свойств оригинальной опухоли. Было также установлено, что размер и количество частей тканей, предназначенных для имплантации, влияют на успешность имплантации. Большие опухоли принять ставки были зарегистрированы для имплантации в подпональная капсула по сравнению с подкожной имплантации из-за способности подпонаальной капсулы для поддержания первоначальной стромы опухоли и обеспечить принимающей стромальных клеток, а также15.
Большинство исследований используют NOD / SCID иммунодефицитных мышей, которые не имеют естественных клеток-убийц16 и было показано, что увеличение опухоли engraftment, рост и метастазы по сравнению с другими штаммами14. Тем не менее, дополнительный мониторинг требуется, поскольку они могут развиваться тимимы лимфомы уже в 3-4 месяца в возрасте13лет. В трансплантации опухоли яичников, выращенных у SCID мышей, рост В-клеток был успешно ингибируется ритуксимаб, предотвращая развитие лимфомы, но без влияния на инплантирование опухолей яичников17.
Совсем недавно, NSG (NOD. Cg-Prkdcscid Il2rgtm1Wjl/SzJ) мышей, неся нулевую мутацию в гене кодирования интерлейкина 2 рецептора гамма-цепи18, стал часто используемым штаммом для поколения моделей PDX. Опухоли от установленных моделей PDX, передавшихся будущим поколенияммышей,как сообщается, сохраняют гистологические и молекулярные свойства в течение 3 до 6 поколений19,20. Многочисленные исследования показали, что результаты лечения в моделях PDX имитируют результаты соответствующих пациентов2,,3,,4,,21,,22,,23. Скорость реакции на химиотерапию в моделях PDX для немалых рака легких и колоректальной карциномы была аналогична той, что в клинических испытаниях для тех же препаратов24,25. Исследования, проведенные в моделях PDX, разработанные для пациентов, зачисленных в клинические испытания, продемонстрировали ответы на проверенные препараты, аналогичныетем,которые наблюдаются клинически у соответствующих пациентов2,3,,4.
Геномный анализ опухоли пациента с высокой пропускной способностью в сочетании с моделями PDX является мощным инструментом для изучения корреляций между конкретными геномными изменениями и терапевтической реакцией. Они были описаны в нескольких публикациях26,27. Например, терапевтические реакции на ингибитор EGFR cetuximab в наборе колоректальных моделей PDX, несущих усиление EGFR, параллельные клинические реакции на цетуксимаб у пациентов28.
Есть несколько проблем, связанных с разработкой и применением моделей PDX. Среди них неоднородность опухоли29,30, которые могут поставить под угрозу точность интерпретации реакции лечения в качестве одного клона клетки с более высокой пролиферативной способностью в PDX может перерасти другие31, что приводит к потере неоднородности., Кроме того, когда один биопсии опухоли используются для разработки PDX, некоторые из популяций клеток могут быть пропущены и не будут представлены в окончательном трансплантата. Несколько образцов из одной и той же опухоли рекомендуется для имплантации, чтобы решить эту проблему. Хотя ОПУХОЛи PDX, как правило, содержат все типы клеток первоначальной донорской опухоли, эти клетки постепенно заменяются опухолями муринского происхождения3. Взаимодействие между муринской стромой и опухолевыми клетками человека в моделях PDX не очень хорошо изучено. Тем не менее, стромальные клетки были показаны, чтобы резюмировать микроэквипедииопухоли 33.
Несмотря на эти ограничения, модели PDX остаются одними из наиболее ценных инструментов для трансляционных исследований, а также персонализированной медицины для выбора лечения пациентов. Основные применения PDXs включают биомаркер обнаружения и тестирования на наркотики. Модели PDX также успешно используются для изучения механизмов лекарственной устойчивости и определения стратегий по преодолению лекарственной устойчивости34,,35. Подход, описанный в настоящей рукописи, позволяет исследователю выявлять потенциальные терапевтические цели в опухолях человека и оценивать эффективность соответствующих препаратов in vivo , умышей, укрывающих привитые опухоли, которые изначально были геномно охарактеризованы. Протокол использует опухоли яичников, привитые интраперитонально, но применимы к любому типу опухоли достаточно агрессивным, чтобы расти у мышей2,,3,12.
протокол
Свежие ткани от согласия пациентов с раком яичников были собраны во время хирургии debulking согласно протоколу, одобренному Советом по институциональному обзору клиники Майо (IRB). Все процедуры и процедуры для животных, используемые в этом протоколе, были одобрены Комитетом по уходу и использованию животных клиники Майо (IACUC) и следовали рекомендациям по уходу за животными.
1. Секвенирование и анализ пары мате
ПРИМЕЧАНИЕ: Либо свежие или флэш-замороженные ткани должны быть использованы для спаривания пара (MPseq) секвенирования. Парафин встроенный материал не подходит, поскольку он содержит фрагментированные ДНК.
- Изолировать ДНК от замороженных опухолевых тканей. Используйте оригинальный образец человека, полученный из хирургического материала или биопсии36.
- Используйте 1000 нг ДНК, чтобы сделать MPseq библиотек и последовательности, как 2 образца на полосу на следующее поколение секвенсор (см. Таблицу Материалов)36.
- Проанализируйте данные с помощью набора алгоритмов для обнаружения крупных хромосомных аберраций (удаления, вставки, усиления, инверсии и транслокации), как описано ранее36,37.
2. Выбор терапевтических целей
- Используйте инструмент с открытым доступом Panda (Pathway and Annotation) или аналогичный инструмент для определения целевых изменений (http://bioinformaticstools.mayo.edu/Panda).
- Составьте список генов, которые определены MSeq как измененные, как простой файл, разграниченный вкладкой, с использованием стандартных общепринятых символов генов.
ПРИМЕЧАНИЕ: Включенный пример особенностей анализа усилений и выгод. - Добавьте знак «Я» в строку заголовка списка, чтобы убедиться, что заголовок таблицы переносится на представление уровня пути программного обеспечения.
- Загрузите файл, нажав на навигационную вкладку Upload Annotation Set.
- Назначить один значок из меню для представления базовых данных, нажав на значок выбора, а затем нажав на вкладку "Заработать".
- После загрузки файлов аннотации определите столбец, отображаемый количество аннотированных генов на один путь. Это последняя колонка справа.
- Используйте фильтр Pathway в левом верхнем углу главного окна, чтобы показать пути, содержащие гены, представляющие интерес.
- Определите пути, которые имеют больше аннотированных генов, чем ожидается случайно. Используйте функцию, расположенную под вкладкой Обогащение.
- Выберите базу данных для отображения потенциально лекарственно-опасных генов из предустановленной аннотации, проверив соответствующую иконку слева от главного окна (например, DGIdb, PharmGKB).
- Выберите путь для визуализации, нажав на его имя, отображаемое на странице Pathway Viewer.
ПРИМЕЧАНИЕ: Иконки, представляющие каждый набор аннотаций, отображаются рядом с соответствующим геном. Нажмите на интересующий ген, чтобы открыть соответствующую веб-страницу GeneCards. - Выберите пути, которые показали аннотированные гены, представляющие интерес (т.е. изменены в данной опухоли) и "хиты" для потенциальных препаратов для дальнейшего анализа.
- Составьте список генов, которые определены MSeq как измененные, как простой файл, разграниченный вкладкой, с использованием стандартных общепринятых символов генов.
- Используйте базу данных, содержащую препараты, одобренные для клинического применения (https://clinicaltrials.gov/), для перекрестной ссылки на выявленные цели.
- Приоритеты целевых изменений для дальнейшего тестирования в моделях PDX путем выполнения обзора литературы (например, PubMed), чтобы подтвердить отношение к биологии конкретного типа опухоли.
3. Проверка геномных перестановок с помощью секвенирования ПЦР и Сэнгера
- Дизайн грунтовки с использованием последовательности читает, полученные из данных MPseq.
- Выберите узел интереса для проверки (т.е. потенциальной терапевтической цели) на основе анализа MPseq.
- Дизайн грунтовки направлены таким образом, что ампликон содержит соединение. Дизайн 2 грунтовки на каждой стороне перекрестка, в общей сложности 4, чтобы увеличить шансы на усиление соединения.
ПРИМЕЧАНИЕ: Название грунтовки в зависимости от корпуса и расположения хромосомы. - Используйте стандартные параметры PCR для дизайна грунтовка и программного обеспечения по выбору. Выберите температуру плавления (60-62 градусов по Цельсию) и содержание GC (40-60%). Убедитесь, что последовательность грунтовки не образует грунтовки, палиндромы или петли шпильки.
- Подтвердите, что последовательность грунтовки не имеет гомологии к другим областям генома человека, проверяя его с помощью BLAT (http://genome.ucsc.edu/cgi-bin/hgBlat?command=start).
- Выполнить ПЦР, чтобы усилить соединение интереса.
- Разбавить грунтовки с водой до 10 мМ и объединить 10 мл каждого грунтовки так, что каждый передний грунтовка в паре с каждой обратной грунтовки в грунтовке.
ПРИМЕЧАНИЕ: Последовательности для грунтовок для выбранного примера отображаются в таблице 1. - Этикетка 0,2 мл полосы трубок, как: C1, T1, C2, T2, C3, C4 и T4, где C'control человеческой геномной ДНК (коммерческая), T'Tumor ДНК, изолированные от пациента или PDX опухоли, и число указывает грунтовка смеси.
- Добавьте 1 мл каждой смеси грунтовки в помеченные трубки.
- Подготовка Taq mastermix путем объединения реагентов, перечисленных в таблице 2, оставляя фермент в морозильной камере до необходимости, добавив его в смесь в самом конце.
- Сделать 2 мастер смеси, по одному для каждого шаблона ДНК, контроль ДНК человека и ДНК опухоли. Добавьте 24 мЛ каждой смеси Taq Master в соответствующую полосную трубку. Общий объем реакции составляет 25 мл. Vortex очень кратко, а затем спина полоса трубки вниз.
- Выполнить ПЦР в термоциклер. Используйте параметры, указанные в таблице 3. Отрегулируйте температуру аннулирования так, чтобы она была по крайней мере на 1 градус цельсия холоднее температуры плавления грунтовки.
- Храните завершенный продукт ПЦР при уровне -20 градусов по Цельсию (долгосрочный срок) или охлаждайте при 4 градусах (короткий срок) до тех пор, пока это необходимо.
- Выполните электрофорез на 1-5 В/см, чтобы визуализировать продукт ПЦР с помощью геля агарозы 1,5%. Оставьте 2 mL aliquot продукта, который будет использоваться для секвенирования Sanger.
- Разбавить грунтовки с водой до 10 мМ и объединить 10 мл каждого грунтовки так, что каждый передний грунтовка в паре с каждой обратной грунтовки в грунтовке.
- Выполните секвенирование Сэнгера, чтобы подтвердить соединение и определить точную точку разрыва38.
- Используйте продукт PCR, если ПЦР генерирует один продукт (диапазон). Кроме того, вырезать полосу из геля, очистить и представить для Сэнгера секвенирования вместе с грунтовки, используемые для усиления.
ПРИМЕЧАНИЕ: Опухоли, для которых геномные анализы были выполнены затем используются для имплантации у мышей.
- Используйте продукт PCR, если ПЦР генерирует один продукт (диапазон). Кроме того, вырезать полосу из геля, очистить и представить для Сэнгера секвенирования вместе с грунтовки, используемые для усиления.
4. Обмыльная инкплантата и техническое обслуживание
- Настройка препаратов для миографа опухолей в модели мыши PDX. Выберите для обимки, для которых будут выполнены или выполнены геномные анализы.
- Убедитесь, что на момент начала разработки любых моделей PDX имеется вспомогательная инфраструктура, включая специализированные лабораторные и животноводческие установки, квалифицированный технический персонал и подробные стандартные операционные процедуры.
- Обеспечить быструю транспортировку и обработку образцов, так как скорость имеет решающее значение для жизнеспособности клеток и успешного ирования.
- Используйте стерильную среду для уменьшения бактериального и грибкового загрязнения для обработки и приготовив образцы.
- Обработайте образцы человека с осторожностью, в соответствии с институциональной политикой в отношении потенциально биологически опасных материалов, так как они могут гавани крови патогенов.
- Подготовьте ткань (0,5-0,7 см3 в размере) для инфплантирования, помесив хирургический образец в предварительно ознобную 50-мл трубку с 20 мл тканей культуры средств массовой информации.
ПРИМЕЧАНИЕ: Опухолевая ткань может быть свежей или восстановлена из ранее криоконсервированного материала5. - Подтвердите содержание опухоли в образце, посоветовавшись с патологоанатомом.
- Поместите опухолевую ткань в блюдо, содержащее 10-15 мл холодного PBS, или ткани культуры средств массовой информации, такие как RPMI 1640 или DMEM содержащие антибиотики (1% пенициллин и стрептомицин).
- Определить и изолировать жизнеспособный материал опухоли из соседних нормальных и некротических тканей с помощью патологоанатома. Используйте стерильные щипцы и скальпель для удаления некротического материала, на который указал патологоанатом.
ПРИМЕЧАНИЕ: Опухоль может быть имплантирована либо внутриперитонально, либо подкожно в мышей. Следуйте шагу 4.2 для выполнения интраперитонеальной имплантации или пропустите шаг 4.3 для выполнения подкожного оплодотворения. В этом исследовании, целевые методы лечения, отобранные на основе геномного анализа были протестированы в серии моделей PDX для высокого класса серозного рака яичников с интраперитонеальной имплантации.
- Подготовьте ткань для интраперитонеальной (IP) имплантации, измельчая ткани с стерильными щипцами и скальпелем на льду, чтобы сделать кусочки размером примерно1-1,5 мм 3 и смешивание с холодной культурой среды. Впрысните 0,3-0,5 мл опухолевой суспензии с помощью 16-17 калибровочной иглы.
ПРИМЕЧАНИЕ: Все хирургические процедуры выполняются с помощью асептических методов. Для снижения вероятности инфицирования использовались стерильные перчатки, стерильные инструменты, принадлежности и имплантированные материалы.- Смешайте части 1:1 с ледяной среды культуры и впрыснуть 100 мЛ интраперитонально, по крайней мере в трех самок SCID мышей.
- Разрежьте опухолевую ткань для подкожного интрансплантата с помощью стерильных щипцов, скальпеля или хирургических ножниц на мелкие фрагменты размером, размером примерно 2 х 2 мм, и перенесите фрагментированные ткани в предварительно охлажденную чашку Петри на льду.
- Добавьте холодную мембранную матрицу подвала в блюдо с раздробленной тканью (приблизительно 200 мл на 10 частей ткани), хорошо перемешайте и дайте фрагментам ткани замочить в холодной мембранной матрице подвала в течение 10 минут.
- Анестезировать 5 женщин NOD / SCID мышей, чтобы подготовить их к engraftment.
- Вводить каждую мышь интраперитонально с кетамина (150 мг/кг) и ксилазина (10 мг/кг) комбинации.
- Подтвердите, что мышь правильно анестезируется, ущипнув кончик хвоста с атрауматическими щипцами.
- Удалить мягко полностью обезболивающее мышь из камеры и положить на мышь нос конус, который имеет вход от испарителя и выход из системы очистки отходов газа.
- Положите ветеринар мазь на глаза мыши, чтобы предотвратить сухость в то время как под наркозом. Подготовьте область, где будет проведена операция. Используйте асептическую технику для выполнения операции.
- Убедитесь, что поверхность, на которой будет проходить операция, не пористы, запечатана и дезинфицирована до операции.
- Начните операцию с стерильными (по автоклаву, газу или химической стерилизации) инструментами.
- Используйте перчатки для обработки инструментов и поддерживать стерильность инструмент советы на протяжении всей процедуры, погружая их в этанол между этапами хирургии.
- Стерилизовать хирургическое место, применяя 3 чередующихся скрабов йода и алкоголя. Используйте стерильные хирургические ножницы и щипцы, чтобы сделать 5-10 мм вертикальный разрез кожи на обоих флангах мыши.
- Вставьте прямые щипцы мягко в подкожное пространство, чтобы создать карман достаточно большой для фрагмента опухоли, которые будут помещены под жировой площадки.
- Используйте стерильные прямые щипцы, чтобы вставить фрагменты опухоли в ранее подготовленный карман в каждой из 5 мышей.
ПРИМЕЧАНИЕ: Поместите 3-4 кусочка опухолевой ткани в один карман. - Закройте разрезы кожи с помощью тканевого клея.
- Интраперитонально вводят каждой мыши 100 мл ритуксимаба после имплантации для ингибирования пролиферации лимфоцитов.
- Поместите мышь в клетку под тепловой лампой в течение примерно 20 минут, пока не оправится от анестезии. Мониторинг жизненно важных признаков мыши и обеспечить ее достаточную гидратацию.
- Верните мышь в компанию других мышей после того, как она оправилась от анестезии и начала есть пищу и воду. Обеспечить послеоперационный уход и мониторинг в соответствии с институциональными руководящими принципами. Проверьте наличие признаков боли и бедствия ежедневно в течение 3 дней после операции.
ПРИМЕЧАНИЕ: Критерии боли или дистресса включают некроз или язвы, потеря веса / состояние тела скоринга, поведенческие признаки, такие как уровень активности, двигательная функция и осанка. - Регулярно проверяйте мышей на образование опухоли раз в две недели, пока опухоли не достигнут размера 0,5 см в диаметре, измеряемого калипером.
- Оцените оценку здоровья каждой мыши, как производные от внешнего вида, поведения и состояния тела39. Используйте десятки No 6 в качестве критериев для умирающих мышей, которые будут принесены в жертву при вдыхании двуокиси углерода.
5. Тестирование ответных мер на геномно выявленные цели в моделях PDX
- Начните выбранное целевое лечение, когда опухоли ощутимы и достигают 0,5 см3, измеряемого ультразвуковым сканированием.
- Перед проведением УЗИ брюшной полости удалите мышь брюшного меха и нанесите стерильную желе.смазно.
- Используйте ультразвуковой аппарат с преобразоваемым для получения изображений с опухолью, расположенной в поперечном сечении. Сделайте 3 измерения за сеанс для каждого животного и среднее значение для более точной оценки размера опухоли.
- Проанализируйте изображения с помощью имеющегося программного обеспечения40.
- Администрирование химиотерапии, состоящей из смеси карбоплатина на 51 мг/кг и паклитаксела на 15 мг/кг интраперитонально (IP) один раз в неделю в общей продолжительности лечения 4-6 недель. Убедитесь, что общий объем инъекций не превышает 0,2 мл.
- Сделать MK-220641 фондовый раствор в 30% циклодекстрин (например, Captisol) и доставить через устные gavage на 120 мг/кг ежедневно в течение 4 недель подряд.
- Подготовьте мышь для устного gavage, удерживая его, щипать кожу спины и прижимая его обратно, так что голова и конечности мыши обездвижены.
- Вставьте зонд gavage вниз задней части горла мыши до тех пор пока зонд не достигнут esophagus. Убедитесь, что зонд не вставляется слишком далеко, так как легкие мыши могут перфорировать, вызывая смерть.
- Сделать MK-866942 фондовый раствор в этаноле на 25 мг / мл. Разбавить его в транспортном средстве, содержащем 5,2% Tween 80, 5,2% PEG400 в стерильной воде для инъекций ИС на 10 мг/кг в течение 5 дней каждые две недели, с общей продолжительностью лечения 4 недели.
ПРИМЕЧАНИЕ: Объем, вводимый мышам, должен быть 50-120 мЛ, в зависимости от веса животного. - Используйте 7-8 мышей в группе лечения, чтобы иметь достаточную статистическую мощность для выявления различий43,,44.
- Оценить массу тела и общее состояние мышей в терапии ежедневно. Утайте наркотики, если вес животного падает на 20% или более от их первоначального веса.
- Оцените размер опухоли еженедельно с помощью ультразвукового сканирования. Убедитесь, что человек, выполняющий мониторинг роста опухоли, ослеплен лечением, чтобы обеспечить объективный скоринг ответов.
ПРИМЕЧАНИЕ: Небольшие лаборатории могут использовать 2 разных людей для администрирования лечения и ультразвукового мониторинга.
Результаты
Ткань из резектированных опухолей яичников во время операций по размывания были собраны в соответствии с руководством IRB и использованы для 1) геномной характеристики и 2) интрансплантации у иммунокомпромиссных мышей(рисунок 1). Протокол секвенированиямат-пары 36,37 был использован для выявления структурных изменений в ДНК, включая потери, прибыль и усиления. На рисунке 2показан репрезентативный участок генома, иллюстрирующий ландшафт геномных изменений в одной опухоли (обозначенный как OC101). Типичные для высокого класса серозные опухоли подтипа, несколько прибылей (синие линии) и удаления (красные линии) были отмечены, что свидетельствует о высоком уровне геномной нестабильности, а также хромосомные потери и выгоды, указывающие на анеуплоидии, наблюдались. В среднем 300-700 изменений всего определены в высоком классе серозных подтипа опухолей45. Последующие анализы выявили несколько изменений ДНК, которые потенциально были нацелены с клинически значимыми препаратами. Топ-рейтинг изменения для терапевтического вмешательства в OC101 опухоли было усиление в хромосоме 17 с участием ERBB2(Рисунок 2 и рисунок 3A). ERBB2 является геном, который кодирует рецептор HER2, который известен при димеризации с EGFR, HER3 или HER4, чтобы активировать RAS/ERK и PI3K/AKT сигнальные пути и способствовать росту клеток, миграции клеток и вторжения. Ингибиторы HER2 (например, моноклональные антитела pertuzumab и trastuzumab) эффективны в лечении больных раком молочной железы, когда опухоли переэкспрессируют белок HER2. Анти-HER2 терапии рака яичников, однако, не FDA утвержден.
Сравнение геномного профиля опухоли пациентов-доноров(рисунок 1)с соответствующей моделью PDX (не показано) выявило поразительное сходство, согласуясь со всеми предыдущими исследованиями, сообщающими о молекулярной близости оригинальных опухолей к их производным PDX.
Для проверки результатов MPseq на уровне ДНК, несколько наборов конкретных грунтовок были разработаны для краев усиленной области, содержащей ген ERBB2, и ПЦР был проведен с использованием ДНК, изолированной от первоначальной опухоли, а также от опухоли, распространяемой в течение нескольких поколений у мышей. Репрезентативное изображение геля усиленных продуктов с использованием двух различных наборов грунтовок показано на рисунке 3B. Ни одна полоса не была обнаружена, когда была усилена нормальная объединяемая геномная ДНК (обозначенная как C), которая не содержала усиления локуса ERBB. Очистка продуктов от геля и секвенирования Сэнгера (не показано) еще раз подтвердила изменение, предсказанное MPseq. Дальнейшая проверка была проведена путем изучения экспрессии белка HER2 в соответствующей опухоли PDX с помощью иммуноблокирования. Анализ выявил высокий уровень белка HER2 (результат не показан), что соответствует наблюдаемым усилению гена ERBB2.
В ДНК другой опухоли яичников (назначенный T14) наблюдались многочисленные региональные достижения. К ним относятся гены AKT2 и RICTOR (Рисунок 3C). Оба были представлять большой интерес с терапевтической точки зрения, как ингибиторы AKT2 и mTOR, которые РИКТ ассоциируется с, доступны и в настоящее время в клинических испытаниях. В виду того что не было никакие спаривания спаривания считывая близости любого гена, просто проверка ПЦР увеличения как обнаружено MPseq не была по возможности. Поэтому мы проверили уровень экспрессии соответствующих белков путем иммуноблокирования. Были отмечены высокие уровни АКТ И РИКТОР(рисунок 3D),что свидетельствует о том, что лечение целевыми препаратами является оправданным.
Чтобы проверить чувствительность этой опухоли к ингибиторам АКТ и mTOR, мышам PDX с интраперитонно имплантированой опухолью Т14 были расширены и рандомизированы, чтобы получить только химиотерапию (карбоплатин/паклитаксел) или комбинацию химиотерапии с ингибитором PAN-AKT MK-220641 или mTOR ингибитором MK-866942. Химиотерапия была дана мышам в комбинационной руке в течение 2 недель до добавления целевой терапии(Рисунок 4). Ультразвуковые измерения проводились еженедельно для мониторинга регрессии/роста опухоли.
Каждая лечащей рука содержала не менее 7 мышей. Этого числа было достаточно для наблюдения за различиями в ответах между группами при сохранении расходов на исследование на значительно более низком уровне. Меньше мышей (три-четыре) могут быть использованы в борьбе необработанной группы, как отдельные изменения в скорости роста опухоли являются незначительными и рост нормализуется до размера опухоли, при котором лечение в других руках начинается.
В течение первых 3 недель наблюдения не наблюдалось никакой разницы между обработанными химиотерапией и необработанными группами (не показанными). Значительное снижение опухолевого бремени (58% медианы) наблюдалось в группе химиотерапии к концу 6-й недели. Дополнительное преимущество по сравнению с химиотерапией только наблюдалось в группах, которые получили сочетание химиотерапии с целенаправленной терапии. Разница стала очевидной на 4 и 3 неделе для МК-8669(рисунок 4A) и MK-2206(Рисунок 4B) соответственно.
Зверей усыпили, а опухолевую ткань собрали для молекулярного анализа реакции на лечение в конце лечебного исследования на 7-й неделе. Для этого с использованием иммуноблокирования были определены объемы общего и фосфорилированного киназы S6(рисунок 5A,B),AKT и mTOR(рисунок 5C,D)с использованием иммуноблокирования. Рибосомный белок S6 киназы является посланником вниз по течению пути AKT-mTOR, как известно, вверх-регулируется и фосфорил после стимуляции оси AKT-mTOR факторами роста для содействия выживанию и росту клеток. Сравнение уровней этих белков в необработанных или лечение с химиотерапией PDX опухолей мышей, которые получили AKT или mTOR ингибиторы показали заметное снижение в последних двух (Рисунок 5), что указывает на эффективность целевой терапии на молекулярном уровне. Необходимо внести коррективы в курс лечения, что касается сроков применения комбинированных препаратов и продолжительности терапии, и быть проверены для достижения более эффективных ответных мер.
| Имя праймера | Последовательности | Праймер Микс | Праймеры вместе взятые | ||
| OC101 17a-17b R1 | CTGGTCCTGGGAATAGACACTAGATAATCATC | 1 | OC101 F1 и R1 | ||
| OC101 17a-17b R2 | ГКТКААГАГАТТААКККАГТАГТТГТАКТТКТОКТРАК | 2 | OC101 F1 и R2 | ||
| OC101 17b-17a F1 | ГГАТТАГГГААКГГГТАКТАКТАТТГТГ | 3 | OC101 F2 и R1 | ||
| OC101 17b-17a F2 | AATGCCCTAGCAGCTCTATCCACTGG | 4 | OC101 F2 и R2 | ||
Таблица 1: Праймеры, используемые для проверки изменения OC101chromosome 17.
| Реагента | Количество, которое можно добавить для 1 реакции (ЗЛ) | Количество, чтобы добавить для 4 реакций (ЗЛ). «Умножьте на 4,3, чтобы сделать достаточно для каждого грунтового микса (4)» |
| Нуклеазная вода без нуклеазы | 20.45 | 89.94 |
| 10x буфер (легко A) | 2.5 | 10.75 |
| dNTPs 10 mM | 0.5 | 2.15 |
| Шаблон ДНК (концентрация | 0.3 | 1.29 |
| Так Полимераза | 0.25 | 1.08 |
Таблица 2: настройка ПЦР для проверки соединения.
| Темп (К) | Время | |
| 94 | 5 мин. | |
| 94 | 40 с | 35 циклов |
| 59 | 40 с | |
| 72 | 2 мин | |
| 72 | 5 мин. | |
| 4 | Держать |
Таблица 3: Велосипедные условия для PCR для проверки соединения.
Рисунок 1: Схемаическое представление стратегии геномно-управляемого тестирования терапии с использованием моделей PDX для серозной карциномы яичников. Показано окрашивание опухоли яичников (вверху). Масштабная панель 100 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 2: Геномная характеристика опухолей яичников с помощью MPseq. Геномный участок, показывающий ландшафт структурных изменений и изменений числа копий, как обнаруживается MPseq. Ось Х охватывает длину хромосомы с хромосомным номером положения показано. Каждая хромосома обозначена справа и левой Y-оси. Высота горизонтальных следов для каждой хромосомы указывает на количество считывок, обнаруженных для 30k базовых парных окон. Номера копий ДНК указаны цветом, серый - нормальным состоянием 2N копии, красным, соответствующим удалениям и синим и синим. Соединение черных линий соответствует хромосомным перестановкам. Изменения в локусе ERBB2 изображены. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
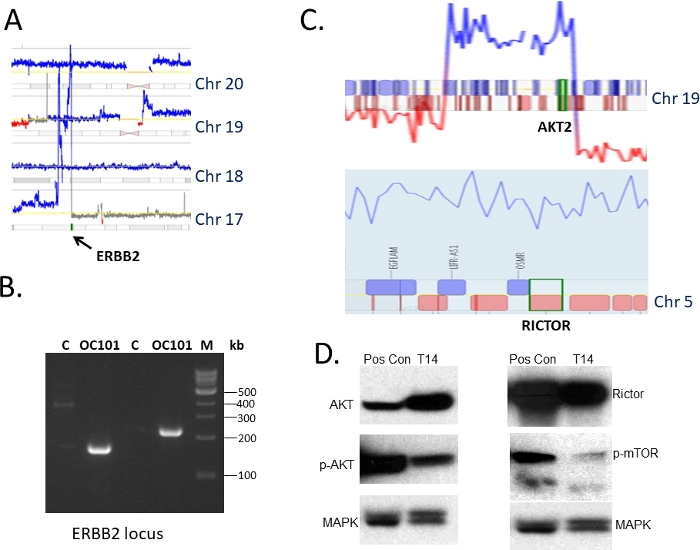
Рисунок 3: Выбор целевых изменений и их проверка. (A) Крупным планом сегмент участка генома показано в рис.1 иллюстрирующие усиление гена ERBB2 на хромосоме 17 (синим цветом). Номера хромосом, как указано. (B) Анализ валидации точек на ERBB2 локус, как определено MPseq с помощью ПЦР усиления. C - это объединенный геномный контроль ДНК, OC101 - ДНК из опухоли пациента, M - ДНК-лестница. (C) Крупным планом сегментов участка генома для другой опухоли яичников, показывающие выгоды (указанные синей линией) в локусе AKT (вверху) и на гене RICTOR (внизу). Хромосомы, как указано. (D) Анализ валидации экспрессии белков пути АКТ/МТОР путем иммуноблокирования с использованием опухолевой ткани из PDX (T14), геномные изменения, для которых изображены в C. 30 мг общего белка и специфических антител к АКТ, РИКТ, р-мТОР. MAPK служил в качестве контроля погрузки. Pos Con является независимой опухоли, используемые в качестве положительного контроля. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
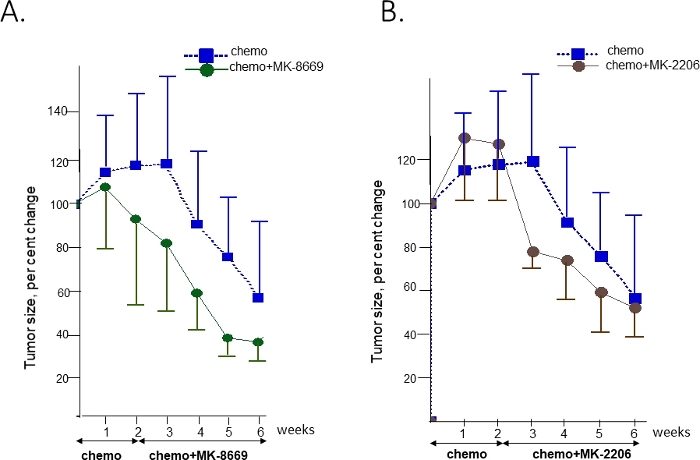
Рисунок 4: Сравнение ответов на химиотерапию в одиночку и в сочетании с целевой терапии в опухоли укрывательство выгоды на AKT2 и RICTOR генов с соответствующими препаратами. Реакция лечения на комбинацию химиотерапии и анти-mTOR препарата MK-8669(A)или ингибитора пан-АКТ MK2206(B)по сравнению с химиотерапией в одиночку. Время введения для каждого лечения и продолжительность показаны стрелками. Объемы выражаются в процентах от первоначального объема в начале лечения в качестве среднего q/- SD. Химиотерапия химиотерапии. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 5: Сравнение молекулярных изменений, вызванных каждым лечением, определяемым анализом иммуноблокирования. (A) Показаны уровни S6 и phospho-S6, нисходящего эффектора пути AKT-mTOR. Было использовано 30 мг общего белка и специфических антител к S6 и p-S6. GAPDH использовался в качестве погрузочного контроля. Количественная оценка уровней белка, нормализованная до уровняCGAPDH, показана в (B) Уровни mTOR, p-mTOR, AKT и p-AKT, как обнаружено иммуноблатированием. GAPDH использовался в качестве погрузочного контроля. (D) Количественная оценка уровня белка нормализована до уровня GAPDH. NT не лечится, химиотерапия химиотерапии. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
Обсуждение
Мы описываем подход и протоколы, которые мы использовали для проведения «клинических испытаний» в моделях PDX, которые используют молекулярные характеристики опухоли, полученные путем геномного профилирования, чтобы определить лучший выбор препаратов для тестирования. Несколько платформ секвенирования в настоящее время используются для геномной характеристики первичных опухолей, включая секвенирование всего генома, РНКсек и индивидуальные генные панели. Для высокого класса серозной карциномы яичников, MPseq для выявления структурных изменений, ДНК перестановки и изменения числа копий, особенно полезно из-за высокой степени геномной нестабильности наблюдается в этом типе опухоли. Вторым преимуществом платформы MPseq является то, что она охватывает весь геном, но стоит значительно меньше, чем другие комплексные технологии секвенирования. MPseq, однако, не подходит для обнаружения точечных мутаций, так как базового покрытия недостаточно, достигая всего 8-10x. Одним из ограничений использования MPseq в одиночку для геномной характеристики опухоли является наличие сложных кластерных хромосомных перестановок, анализ которых не предсказывает экспрессию затронутых генов, представляющих интерес. Соединение, обнаруженное MPseq предсказал создать предполагаемого синтеза гена, который проверяет в ДНК ПЦР не может быть выражена из-за сдвига кадра или небольших удалений и вставок в регионе промоутера. Аналогичным образом, хромосомные достижения и усиления для потенциальных терапевтических целей должны быть тщательно оценены и проверены на уровне РНК или белка для обеспечения экспрессии интересующего гена.
Хотя, молекулярный состав опухоли в значительной степени сохраняется после распространения у мышей в течение нескольких поколений, изменения в уровнях экспрессии ключевых генов могут произойти с течением времени либо отражает эволюцию опухоли, клональный отбор или адаптивный ответ на мурин окружающей среды. Таким образом, проверка изменения, предназначенного для терапевтического вмешательства как в оригинальной донорской опухоли и опухоли PDX имеет решающее значение. Для опухоли, выделенной из моделей PDX, РНК и белок могут быть использованы для допроса уровня экспрессии, так как материал в изобилии. Любой из них может быть выбран для перекрестной проверки экспрессии в исходной опухоли, в зависимости от наличия и типа хранимой ткани, а также наличие антител для соответствующего обнаружения белка. Модель PDX имеет особое неоценимое значение в тестировании комбинированной терапии, как in vivo настройки позволяет мониторинг побочных эффектов, а также дозировка или продолжительность корректировки в режиме лечения.
Выбор между ортотопическим и подкожным инплантированием может быть сделан в зависимости от конкретных вопросов, рассматриваемых в исследовании. Однако важно иметь в виду, что чувствительность ксенотрансплантированных опухолей к терапии может модулироваться местом имплантации46. С другой стороны, никаких доказательств еще не было сообщено об открытии препаратов, показывающих терапевтический ответ в ортотопных моделях, но отсутствует в подкожно имплантированных PDX9.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Мы благодарим членов Клиники Майо Центр индивидуальной медицины (CIM) д-р Лин Ян и Фэй Р. Харрис, MS, за помощь в проведении экспериментов. Эта работа была поддержана г-н и г-жа Нил Е. Эклс 'Подарок в клинике Майо Центр индивидуальной медицины (CIM).
Материалы
| Name | Company | Catalog Number | Comments |
| 3M Vetbond | 3M, Co. | 1469SB | |
| anti-AKT antibody | Cell Signaling Technologies, Inc. | 9272 | |
| Anti-GAPDH antibody(G-9) | Santa Cruz Biotech. Inc. | sc-365062 | |
| Anti-MAPK antibody | Cell Signaling Technologies, Inc. | 9926 | |
| Anti-phospho-AKT antibody | Cell Signaling Technologies, Inc. | 9271 | |
| Anti-mTOR antibody | Cell Signaling Technologies, Inc. | 2972 | |
| Anti-Phospho-mTOR antibody | Cell Signaling Technologies, Inc. | 2971 | |
| Anti-Phospho-S6 antibody | Cell Signaling Technologies, Inc. | 4858 | |
| Anti-Rictor antibody | Cell Signaling Technologies, Inc. | 2114 | |
| Anti-S6 antibody | Cell Signaling Technologies, Inc. | 2217 | |
| Captisol | ChemScene, Inc. | cs-0731 | |
| Carboplatin | NOVAPLUS, Inc. | 61703-360-18 | |
| DMEM | Mediatech, Inc. | 10-013-CV | |
| Easy-A Hi-Fi PCR Cloning Enzyme | Agilent, Inc. | 600404-51 | |
| Lubricant | Cardinal Healthcare | 82-280 | |
| Matrigel | Corning, Inc. | 356234 | |
| McCoy's media | Mediatech, Inc. | 10-050-CV | |
| MK-2206 | ApexBio, Inc. | A3010 | |
| MK-8669 | ARIAD Pharmaceuticals, Inc. | AP23573 | |
| Nair Sensitive Skin | Church & Dwight Co. | Nair Hair Remover Shower Power Sensitive | |
| NOD/SCID mice | Charles River, Inc. | NOD.CB17-Prkdcscid/NCrCrl | |
| Paclitaxel | NOVAPLUS, Inc. | 55390-304-05 | |
| PEG400 | Millipore Sigma, Inc. | 88440-250ML-F | |
| Perjeta | Genetech, Co. | Pertuzumab | |
| Rituximab | Genetech, Co. | Rituxan | |
| RPMI1640 | Mediatech, Inc. | 10-040-CV | |
| SCID mice | Harlan Laboratories, Inc. | C.B.-17/IcrHsd-PrkdcscidLystbg | |
| SLAx 13-6MHz linear transducer | FUJIFILM SonoSite, Inc | HFL38xp | |
| SonoSite S-series Ultrasound machine | FUJIFILM SonoSite, Inc | SonoSite SII | |
| Tween 80 | Millipore Sigma, Inc. | P4780-100ML |
Ссылки
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nature Reviews Clinical Oncology. 9, 338-350 (2012).
- Marangoni, E., et al. A new model of patient tumor-derived breast cancer xenografts for preclinical assays. Clinical Cancer Research. 13, 3989-3998 (2007).
- Zhang, X., et al. A renewable tissue resource of phenotypically stable, biologically and ethnically diverse, patient-derived human breast cancer xenograft models. Cancer Research. 73, 4885-4897 (2013).
- Hidalgo, M., et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discovery. 4, 998-1013 (2014).
- Weroha, S. J., et al. Tumorgrafts as in vivo surrogates for women with ovarian cancer. Clinical Cancer Research. 20, 1288-1297 (2014).
- Rubio-Viqueira, B., et al. Optimizing the development of targeted agents in pancreatic cancer: tumor fine-needle aspiration biopsy as a platform for novel prospective ex vivo drug sensitivity assays. Molecular Cancer Therapeutics. 6, 1079-1088 (2007).
- Rubio-Viqueira, B., Hidalgo, M. Direct in vivo xenograft tumor model for predicting chemotherapeutic drug response in cancer patients. Clinical Pharmacology and Therapeutics. 85, 217-221 (2009).
- Ricci, F., et al. Patient-derived ovarian tumor xenografts recapitulate human clinicopathology and genetic alterations. Cancer Research. 74, 6980-6990 (2014).
- Fleming, J. M., et al. Local regulation of human breast xenograft models. Journal of Cellular Physiology. 224, 795-806 (2010).
- Hoffman, R. M. Patient-derived orthotopic xenografts: better mimic of metastasis than subcutaneous xenografts. Nature Reviews Cancer. 15, 451-452 (2015).
- Jung, J., Seol, H. S., Chang, S. The Generation and Application of Patient-Derived Xenograft Model for Cancer Research. Cancer Research and Treatment. 50, 1-10 (2018).
- Sivanand, S., et al. A validated tumorgraft model reveals activity of dovitinib against renal cell carcinoma. Science Translational Medicine. 4, 137-152 (2012).
- Pavía-Jiménez, A., Tcheuyap, V. T., Brugarolas, J. Establishing a human renal cell carcinoma tumorgraft platform for preclinical drug testing. Nature Protocols. 9, 1848-1859 (2014).
- Fridman, R., Benton, G., Aranoutova, I., Kleinman, H. K., Bonfil, R. D. Increased initiation and growth of tumor cell lines, cancer stem cells and biopsy material in mice using basement membrane matrix protein (Cultrex or Matrigel) co-injection. Nature Protocols. 7, 1138-1144 (2012).
- Cutz, J. C., et al. Establishment in severe combined immunodeficiency mice of subrenal capsule xenografts and transplantable tumor lines from a variety of primary human lung cancers: potential models for studying tumor progression-related changes. Clinical Cancer Research. 12, 4043-4054 (2006).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Research. 73, 5315-5319 (2013).
- Butler, K. A., et al. Prevention of Human Lymphoproliferative Tumor Formation in Ovarian Cancer Patient-Derived Xenografts. Neoplasia. 19, 628-636 (2017).
- Cao, X., et al. Defective lymphoid development in mice lacking expression of the common cytokine receptor gamma chain. Immunity. 2, 223-238 (1995).
- Dobbin, Z. C., et al. Using heterogeneity of the patient-derived xenograft model to identify the chemoresistant population in ovarian cancer. Oncotarget. 5, 8750-8764 (2014).
- Choi, Y. Y., et al. Establishment and characterisation of patient-derived xenografts as paraclinical models for gastric cancer. Scientific Reports. 6, 22172 (2016).
- Malaney, P., Nicosia, S. V., Davé, V. One mouse, one patient paradigm: New avatars of personalized cancer therapy. Cancer Letters. 344, 1-12 (2014).
- Rosfjord, E., Lucas, J., Li, G., Gerber, H. P. Advances in patient-derived tumor xenografts: from target identification to predicting clinical response rates in oncology. Biochemical Pharmacology. 91, 135-143 (2014).
- Braekeveldt, N., Bexell, D. Patient-derived xenografts as preclinical neuroblastoma models. Cell and Tissue Research. 372, 233-243 (2018).
- 'Perez-Soler, R., et al. Response and determinants of sensitivity to paclitaxel in human non-small cell lung cancer tumors heterotransplanted in nude mice. Clinical Cancer Research. 6, 4932-4938 (2000).
- Fichtner, I., et al. Anticancer drug response and expression of molecular markers in early-passage xenotransplanted colon carcinomas. European Journal of Cancer. 40, 298-307 (2004).
- Gao, H., et al. High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response. Nature Medicine. 21, 1318-1325 (2015).
- Izumchenko, E., et al. Patient-derived xenografts effectively capture responses to oncology therapy in a heterogeneous cohort of patients with solid tumors. Annals of Oncology. 28, 2595-2605 (2017).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discovery. 1, 508-523 (2011).
- Mengelbier, L. H., et al. Intratumoral genome diversity parallels progression and predicts outcome in pediatric cancer. Nature Communications. 27, 6125 (2015).
- McGranahan, N., Swanton, C. Clonal Heterogeneity and Tumor Evolution: Past, Present, and the Future. Cell. 168, 613-628 (2017).
- Marusyk, A., et al. Non-cell-autonomous driving of tumour growth supports sub-clonal heterogeneity. Nature. 514, 54-58 (2014).
- Braekeveldt, N., et al. Neuroblastoma patient-derived orthotopic xenografts reflect the microenvironmental hallmarks of aggressive patient tumours. Cancer Letters. 375, 384-389 (2016).
- DeRose, Y. S., et al. Tumor grafts derived from women with breast cancer authentically reflect tumor pathology, growth, metastasis and disease outcomes. Nature Medicine. 17, 1514-1520 (2011).
- Das Thakur, M., et al. Modelling vemurafenib resistance in melanoma reveals a strategy to forestall drug resistance. Nature. 494, 251-255 (2013).
- Girotti, M. R., et al. Application of Sequencing, Liquid Biopsies, and Patient-Derived Xenografts for Personalized Medicine in Melanoma. Cancer Discovery. 6, 286-299 (2016).
- Murphy, S. J., et al. Mate pair sequencing of whole-genome-amplified DNA following laser capture microdissection of prostate cancer. DNA Research. 19, 395-406 (2012).
- Smadbeck, J. B., et al. Copy number variant analysis using genome-wide mate-pair sequencing. Genes Chromosomes and Cancer. 57, 459-470 (2018).
- Kovtun, I. V., et al. Lineage relationship of Gleason patterns in Gleason score 7 prostate cancer. Cancer Research. 73, 3275-3284 (2013).
- Paster, E. V., Villines, K. A., Hickman, D. L. Endpoints for mouse abdominal tumor models: refinement of current criteria. Comparative Medicine. 59, 234-241 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9, 671-675 (2012).
- Cheng, Y., et al. MK-2206, a novel allosteric inhibitor of Akt, synergizes with gefitinib against malignant glioma via modulating both autophagy and apoptosis. Molecular Cancer Therapeutics. 11, 154-164 (2012).
- Rivera, V. M., et al. Ridaforolimus (AP23573; MK-8669), a potent mTOR inhibitor, has broad antitumor activity and can be optimally administered using intermittent dosing regimens. Molecular Cancer Therapeutics. 10, 1059-1071 (2011).
- Heitjan, D. F., Manni, A., Santen, R. J. Statistical analysis of in vivo tumor growth experiments. Cancer Research. 53, 6042-6050 (1993).
- Vargas, R., et al. Case study: patient-derived clear cell adenocarcinoma xenograft model longitudinally predicts treatment response. NPJ Precision Oncology. 2, 14 (2018).
- Harris, F. R., et al. Targeting HER2 in patient-derived xenograft ovarian cancer models sensitizes tumors to chemotherapy. Molecular Oncology. 13, 132-152 (2019).
- Fidler, I. J., et al. Modulation of tumor cell response to chemotherapy by the organ environment. Cancer and Metastasis Reviews. 13, 209-222 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены