Method Article
使用结构DNA改变分析和患者衍生异种移植测试癌症的靶向疗法
摘要
在这里,我们提出了一个方案,以测试基于肿瘤的基因组构成选择的靶向疗法的疗效。该协议描述了结构DNA重组的识别和验证,将患者的肿瘤引入小鼠,并测试对相应药物的反应。
摘要
我们在这里介绍一种综合方法,用于测试靶向疗法的疗效,该方法结合了下一代测序技术、治疗靶点分析和药物反应监测,使用患者衍生异种移植(PDX)。以卵巢肿瘤为例验证了此策略。配合对下一代测序 (MPSeq) 协议用于识别结构变化,然后分析潜在的可定位变化。在免疫功能低下的小鼠中生长的人类肿瘤使用基于基因组分析选择的药物进行治疗。结果表明,在PDX模型中,预测响应与观测响应之间具有良好的相关性。提出的方法可用于测试联合治疗的疗效,并协助复发性癌症患者进行个性化治疗,特别是在标准治疗失败且需要使用标签外药物的情况下。
引言
患者衍生的异种移植(PDX),这是从患者肿瘤片段植入免疫缺陷小鼠中产生的,已成为一个强大的临床前模型,以帮助个性化的抗癌护理。PDX模型已成功开发用于各种人类恶性肿瘤。这些包括乳腺癌和卵巢癌,恶性黑色素瘤,结肠直肠癌,胰腺癌,和非小细胞肺癌1,2,3,4,5。2,3,4,51肿瘤组织可以植入正畸或异位。前者被认为更准确,但技术上是困难的,涉及直接移植到肿瘤起源的器官。这些类型的模型被认为是精确模仿原始肿瘤的组织学由于"自然"微环境的肿瘤6,7。,7例如,正畸移植到小鼠卵巢的毛刺导致肿瘤扩散到腹腔和产生腹水,典型的卵巢癌8。同样,将乳腺肿瘤注射到胸腔而不是腹部乳腺中,也影响了PDX的成功率和行为9。然而,正畸模型需要复杂的成像系统来监测肿瘤的生长。实体肿瘤的异位植入通常通过将组织植入小鼠的皮下侧翼进行,这样可以更容易地监测肿瘤的生长,而且成本更低,耗时更耗时。然而,肿瘤生长皮下很少转移不像在正畸植入10的情况下观察到的。
包皮的成功率已证明不同,并在很大程度上取决于肿瘤类型。据报道,含有较高百分比肿瘤细胞的更具侵略性的肿瘤和组织标本的成功率为12,13。,13与这一点一致,从转移位点衍生的肿瘤被证明以50-80%的频率生长,而来自原位点的肿瘤以低至14%的频率12。相比之下,含有坏死细胞和存活性肿瘤细胞较少的组织感染不良。肿瘤生长也可以通过添加地下室膜基质蛋白到组织组合时注射到小鼠14,而不影响原肿瘤的特性。还发现用于植入的组织件的大小和数量会影响植入的成功率。与皮下植入相比,由于肾下胶囊能够维持原有的肿瘤频闪并提供宿主频闪细胞以及15,因此在肾后胶囊中植入肿瘤的接受率更高。
大多数研究使用NOT/SCID免疫缺陷小鼠,缺乏自然杀伤细胞16,并已被证明增加肿瘤移植,生长和转移相比,其他菌株14。然而,需要额外的监测,因为他们可能发展胸腺淋巴瘤早在3-4个月的13岁。在SCID小鼠生长的卵巢肿瘤移植中,B细胞的生长被利托西马成功抑制,防止淋巴瘤的发展,但不会影响卵巢肿瘤的移植17。
最近,NSG(NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ)小鼠,携带编码白细胞间2受体伽马链18的基因的空突变,成为PDX模型的生成常用菌株。据报道,从已建立的PDX模型传至后代小鼠的肿瘤,在3至6代19、20代中保留组织学和分子特性。许多研究表明,PDX模型中的治疗结果模仿了相应的患者2、3、4、21、22、23。,4,21,22,232,非小肺癌和结直肠癌PDX模型对化疗的响应率与同一药物24、25的临床试验相似。在PDX模型中进行的研究,为参加临床试验的患者开发,表明对测试药物的反应类似于在相应患者2,3,43的临床观察。2
结合 PDX 模型对患者肿瘤进行高通量基因组分析,为研究特定基因组变化与治疗反应之间的相关性提供了一个强大的工具。这些已经在几个出版物26,27,描述。例如,在一组携带EGFR扩增的结直肠PDX模型中对EGFR抑制剂cetuximab的治疗反应,在28的患者中对切图西马布的临床反应。
PDX 模型的开发和应用存在一些挑战。其中肿瘤异质性29,30,,30可能损害治疗反应解释的准确性,因为单细胞克隆在PDX中具有较高的增殖能力,可以超过其他31,从而导致异质性的损失。此外,当单个肿瘤活检用于开发PDX时,一些细胞群体可能会错过,不会代表在最后的移植。建议从同一肿瘤的多个样本进行植入,以解决此问题。虽然PDX肿瘤往往包含原始供体肿瘤的所有细胞类型,但这些细胞逐渐被那些穆林起源3的细胞替代。PDX模型中的乳氨酸频闪细胞与人类肿瘤细胞之间的相互作用尚不清楚。然而,频闪细胞被证明可以重述肿瘤微环境33。
尽管有这些限制,PDX 模型仍然是最有价值的转化研究工具之一,以及选择患者疗法的个性化医学。PDX 的主要应用包括生物标志物发现和药物测试。PDX模型还成功地用于研究耐药性机制和确定克服耐药性34,35,的策略。本手稿中描述的方法使研究人员能够识别人类肿瘤中潜在的治疗靶点,并评估体内相应药物的疗效,在携带最初基因组特征的内藏肿瘤的小鼠中。该协议使用卵巢肿瘤,在内包,但适用于任何类型的肿瘤足够侵略性生长在小鼠2,3,12。3,122
研究方案
根据梅奥诊所机构审查委员会(IRB)批准的一项协议,在切除手术时收集了同意卵巢癌患者的新鲜组织。本协议中使用的所有动物程序和治疗都得到梅奥诊所机构动物护理和使用委员会 (IACUC) 的批准,并遵循动物护理指南。
1. 配合对测序和分析
注:新鲜或闪光冷冻组织必须用于配合对(MPseq)测序。石蜡嵌入材料不适合,因为它含有支离破碎的DNA。
- 从冷冻肿瘤组织分离DNA。使用从手术材料或活检36获得的原始人类标本。
- 使用 1000 ng 的 DNA 使 MPseq 库和序列作为每通道 2 个样本的下一代测序器 (参见材料表)36。
- 使用一组算法分析数据,以检测大型染色体畸变(删除、插入、放大、反转和转移),如前面所述的 36、37。,
2. 治疗靶点的选择
- 使用开放式访问熊猫工具(路径和注释)或类似工具来识别可定位的更改(http://bioinformaticstools.mayo.edu/Panda)。
- 使用标准接受的基因符号,将 MSeq 鉴定为已更改的基因列表作为一个简单的选项卡分隔文件。
注:包含的示例功能分析放大和增益。 - 向列表的标头行添加"#"符号,以确保表标题传输到软件的路径级视图。
- 单击"上传注释集导航"选项卡上传文件。
- 单击选择的图标,然后单击"最终完成"选项卡,从菜单中分配一个图标来表示基础数据。
- 上载注释文件后,确定显示每个路径的带注释基因数的列。这是右侧的最后一列。
- 使用主窗口左上角的路径过滤器显示包含感兴趣基因的路径。
- 确定具有比偶然预期更多的带注释基因的通路。使用位于"扩充"选项卡下的函数。
- 通过检查主窗口左侧的适当图标(例如,DGIdb、PharmGKB),选择一个数据库,从预设注释中显示可能可药物的基因。
- 单击路径查看器页面中显示的其名称,选择实现可视化的路径。
注:表示每个注释集的图标显示在关联基因旁边。单击感兴趣的基因打开相应的基因卡网页。 - 选择显示感兴趣的注释基因(即在给定肿瘤中改变)和"命中"的路径,以进行进一步分析。
- 使用标准接受的基因符号,将 MSeq 鉴定为已更改的基因列表作为一个简单的选项卡分隔文件。
- 使用包含批准用于临床应用(https://clinicaltrials.gov/)的药物的数据库交叉引用已确定的目标。
- 通过执行文献综述(例如,PubMed)来确定可针对的改变,以在 PDX 模型中进行进一步测试,以确认与特定类型肿瘤生物学的相关性。
3. PCR和桑格测序基因组重新排列的验证
- 使用从 MPseq 数据获取的排序读取设计底像。
- 根据 MPseq 分析,为验证(即潜在治疗目标)选择感兴趣的交汇点。
- 设计方向的底向,使放大器包含交汇点。在交汇点的每一侧设计 2 个底向器,共 4 个,以增加放大交汇点的机会。
注:根据病例和染色体位置命名底因。 - 使用标准 PCR 参数进行底件设计和首选软件。选择熔化温度 (60-62 °C) 和 GC 含量 (40-60%)。确保底像序列不会形成底像二丁板、回音或发夹环。
- 使用 BLAT (http://genome.ucsc.edu/cgi-bin/hgBlat?command=start) 检查底源序列与人类基因组的其他区域http://genome.ucsc.edu/cgi-bin/hgBlat?command=start。
- 运行 PCR 以放大兴趣的交汇点。
- 将水底转稀释至 10 mM,并将每个底转的 10 mL 组合在一起,使每个正向底转与每个反向底转配对到底转组合中。
注:表 1 中显示了所选示例的底项序列。 - 将0.2 mL条带管标记为:C1、T1、C2、T2、C3、T3、C4和T4,其中C+控制人类基因组DNA(商业),T+TumorDNA,从患者或PDX肿瘤分离,数字表示底源混合。
- 将每个底材混合物的 1 mL 添加到其标记的管中。
- 通过组合表2中列出的试剂来准备Taq主混合,将酶留在冷冻室,直到需要,最后将其加入混合。
- 制作2个主混合,每个模板DNA一个,控制人类DNA和肿瘤DNA。将每个 Taq 主混合物的 24 mL 添加到各自的条管中。总反应量为25 mL。漩涡非常短暂,然后旋转带管下来。
- 在热循环器中运行 PCR。使用表3 中显示的参数。调整退火温度,使退火温度比底片的熔化温度至少冷 1 °C。
- 将已完成的 PCR 产品储存在 -20 °C(长期)或冷藏在 4°C(短期),直到需要。
- 在 1-5 V/cm 下执行电泳,使用 1.5% 的 agarose 凝胶可视化 PCR 产品。将产品 2 mL 等分用于桑格测序。
- 将水底转稀释至 10 mM,并将每个底转的 10 mL 组合在一起,使每个正向底转与每个反向底转配对到底转组合中。
- 执行桑格测序以确认交汇点并确定确切的断点 38。
- 如果 PCR 生成单个产品(带),请使用 PCR 产品。或者,将带子从凝胶中切开,纯化并提交桑格测序以及用于放大的底片。
注:进行基因组分析的肿瘤用于小鼠植入。
- 如果 PCR 生成单个产品(带),请使用 PCR 产品。或者,将带子从凝胶中切开,纯化并提交桑格测序以及用于放大的底片。
4. 肿瘤的包养和维护
- 设置将肿瘤引入PDX小鼠模型的制剂。选择基因组分析将或已经进行的生长肿瘤。
- 确保在开始开发任何 PDX 模型时建立支持性基础设施,包括专门的实验室和动物设施、熟练的技术人员和详细的标准操作程序。
- 确保样品的快速运输和处理,因为速度对细胞的生存能力和成功采集至关重要。
- 使用无菌环境减少细菌和真菌污染,用于加工和采集样品。
- 根据有关潜在生物危害物质的体制政策,谨慎处理人类标本,因为它们可能含有血液传播的病原体。
- 将手术标本放入具有 20 mL 组织培养培养介质的预冷却 50 mL 管中,准备组织(0.5-0.7 厘米3大小) 进行移植。
注:肿瘤组织可以新鲜或从以前冷冻保存的材料5恢复。 - 通过咨询病理学家确认标本中的肿瘤含量。
- 将肿瘤组织放在含有 10-15 mL 冷 PBS 的培养皿中,或将含有抗生素(1% 青霉素和链霉素)的组织培养基(如 RPMI 1640 或 DMEM)放在培养皿中。
- 在病理学家的帮助下,从相邻的正常组织和坏死组织中识别和分离可行的肿瘤物质。使用无菌钳子和手术刀去除病理学家指出的坏死材料。
注:肿瘤可以植入内皮或皮下植入小鼠。按照步骤4.2执行内皮植入或跳到步骤4.3执行皮下植入。在这项研究中,基于基因组分析选择的靶向疗法在一系列PDX模型中进行了测试,该模型用于高品位血清卵巢癌的内皮内植入。
- 准备组织内性 (IP) 植入用无菌钳和手术刀在冰上切碎组织, 使碎片约 1-1.5 mm3的大小,并混合与冷培养基。使用 16-17 量表针注射 0.3~0.5 mL 肿瘤浆。
注:所有外科手术都使用无菌技术进行。无菌手套、无菌仪器、用品和植入材料用于降低感染的可能性。- 将片断1:1与冰冷的培养基混合,在至少三只雌性SCID小鼠中注射100 mL。
- 使用无菌钳子、手术刀或手术剪刀将肿瘤组织切割成小碎片,大小约为 2 x 2 x 2 mm,然后将碎裂组织转移到冰上预冷却的培养皿中。
- 将冷地下室膜基质与碎裂组织(每10块组织约200 mL)一起加入到盘中,混合好,让组织碎片浸泡在冷地下室膜基质中10分钟。
- 麻醉5只雌性NOT/SCID小鼠,为它们进行诱杀做好准备。
- 将每只小鼠注射氯胺酮(150毫克/千克)和锡拉辛(10毫克/千克)组合。
- 通过用创伤钳捏尾尖,确认小鼠麻醉得当。
- 将完全麻醉的鼠标从室内轻轻取出,并在鼠标上放入一个鼻锥,鼻锥有蒸发器和废气清除系统输出的输入。
- 在小鼠眼睛上戴上兽医软膏,防止麻醉时干燥。准备手术的进行区域。使用无菌技术进行手术。
- 确保手术表面无孔、密封,并在手术前进行消毒。
- 使用无菌(通过灭菌器、气体或化学灭菌)仪器开始手术。
- 使用手套处理仪器,并在整个手术过程中保持仪器尖端的无菌性,在手术步骤之间将其淹没在乙醇中。
- 通过应用碘和酒精的3次交替磨砂,对手术地点进行消毒。使用无菌手术剪刀和钳子在鼠标的两侧面进行 5-10 mm 垂直皮肤切口。
- 将直钳轻轻地插入皮下空间,以创建一个足够大的口袋,使肿瘤片段被放置在脂肪垫下。
- 使用无菌直钳将肿瘤片段插入 5 只小鼠中先前准备的口袋。
注:将3-4块肿瘤组织放在一个口袋中。 - 使用组织胶水关闭皮肤切口。
- 植入后,内向注射每只小鼠100 mL的Rituximab,以抑制淋巴细胞增殖。
- 将鼠标放入热灯下的笼子约 20 分钟,直到麻醉恢复。监测小鼠生命体征并确保其足够的水化。
- 将小鼠从麻醉中恢复过来并开始有食物和水后,将鼠标返回其他小鼠的陪伴。根据机构指南提供术后护理和监测。手术后连续3天每天检查疼痛和不适的迹象。
注:疼痛或痛苦的标准包括坏死或溃疡,体重减轻/身体状况评分,行为迹象,如活动水平,运动功能和姿势。 - 定期检查小鼠的肿瘤形成每两周,直到肿瘤达到直径0.5厘米的大小,由卡钳测量。
- 评估每只鼠标的运行状况分数,如从外观、行为和身体状况39 派生。使用 +6 的分数作为因吸入二氧化碳而牺牲的垂死小鼠的标准。
5. 在PDX模型中测试对基因组识别目标的反应
- 当肿瘤明显且达到 0.5 cm3时,开始选择的目标治疗,通过超声波扫描进行测量。
- 在进行腹部超声波扫描之前,取出小鼠腹部皮毛并应用无菌果冻润滑剂。
- 使用带传感器的超声波机获取肿瘤位于横截面的图像。每个动物每期进行 3 次测量,并平均评估肿瘤大小。
- 使用可用软件40 分析图像。
- 管理化疗,包括51毫克/千克的卡博铂和15毫克/千克的帕利塔塞尔的混合物,每周一次,总治疗期为4-6周。确保注射的总体积不超过 0.2 mL。
- 在 30% 环糊精(例如,卡皮索尔)中制作 MK-220641库存溶液,并连续 4 周以每天 120 毫克/千克的口服量交付。
- 通过捏住背部的皮肤并固定它,让鼠标的头部和四肢固定不动,为鼠标准备口服鼠。
- 将球垫探针插入鼠标喉咙后面,直到探针到达食道。确保探头没有插入太远,因为小鼠的肺可能会穿孔,导致死亡。
- 以 25 mg/mL 的乙醇制造MK-8669 42库存溶液。在含有5.2%Tween 80、5.2%PEG400的无菌水中稀释,每隔一周以10毫克/千克进行IP注射,持续5天,治疗总持续时间为4周。
注:注射到小鼠的体积应为50-120 mL,具体取决于动物的重量。 - 每个治疗组使用7-8只小鼠,以足够的统计能力来检测差异43,44。,44
- 每天评估小鼠在治疗中的体重和一般状况。如果动物的体重比初始体重下降 20% 或更多, 请保留药物。
- 使用超声波扫描每周评估肿瘤大小。确保执行肿瘤生长监测的个人对治疗视而不见,以确保反应的公正评分。
注:较小的实验室可以雇用2个不同的人来管理治疗和超声波监测。
结果
脱毛手术时从切除卵巢肿瘤中的组织根据 IRB 指导收集,用于 1) 基因组表征和 2) 免疫功能低下小鼠(图1)。配合测序协议36,37用于识别DNA的结构变化,包括损耗、增益和扩增。36,图2显示了一个肿瘤(指定为OC101)中显示基因组变化情况的代表性基因组图谱。发现高品位血清亚型肿瘤的典型,发现多个增益(蓝线)和删除(红线),表明基因组不稳定性水平高,以及染色体损失和增益,表明异体。在高品位血清亚型肿瘤45中,平均有300-700个改变总数。随后的分析显示,一些DNA改变,可能是针对临床相关的药物。OC101肿瘤治疗干预的最高级改变是涉及ERBB2的17号染色体的扩增(图2和图3A)。ERBB2是一种编码 HER2 受体的基因,在用 EGFR、HER3 或 HER4 进行二化时已知,可激活 RAS/ERK 和 PI3K/AKT 信号通路,促进细胞生长、细胞迁移和入侵。HER2抑制剂(例如,单克隆抗体 pertuzumab 和 trastuzumab)在肿瘤过度表达 HER2 蛋白质时对乳腺癌患者有效治疗。然而,抗 HER2 治疗卵巢癌,是 FDA 批准的。
将供体患者肿瘤的基因组图(图1)与相应的PDX模型(未显示)的基因组特征进行比较,显示出惊人的相似性,与以往报告原肿瘤与PDX衍生物分子接近的所有研究一致。
为了在DNA水平上验证MPSeq结果,为含有ERBB2基因的扩增区域的边缘设计了几组特定的底原,并且使用从原始肿瘤和小鼠中繁殖了几代人的肿瘤分离的DNA进行PCR。图3B显示了使用两套不同底像的放大产品的代表性凝胶图像。当正常汇集基因组DNA(指定为C)未被放大时,未检测到不带状,该DNA不包含ERBB位点扩增。凝胶和桑格测序产品的纯化(未显示)进一步证实了MPSeq预测的改变。通过利用免疫印迹检查相应的PDX肿瘤中 HER2蛋白的表达,进一步验证。分析显示,HER2蛋白水平很高(结果未显示),与观察到的ERBB2基因扩增一致。
在不同的卵巢肿瘤(指定T14)的DNA中观察到许多区域增益。其中包括 AKT2 和 RICTOR 基因(图 3C)。从治疗的角度来看,这两种抑制剂都引起了极大的兴趣,因为由RICTOR联合的ACT2和mTOR的抑制剂已经提供,目前正在临床试验中。由于没有跨越任一基因附近的配合对读取,因此无法对 MPSeq 检测到的增益进行简单的 PCR 验证。因此,我们通过免疫印迹测试了相应蛋白质的表达水平。观察到高水平的 AKT 和 RICTOR (图 3D) 表明使用靶向药物治疗是有必要的.
为了测试该肿瘤对 AKT 和 mTOR 抑制剂的敏感性,将植入 T14 肿瘤的 PDX 小鼠扩大并随机化,仅接受化疗(卡博铂/帕利塔塞尔)或化疗与泛 AKT 抑制剂 MK-220641 或mTOR 抑制剂42的组合。在添加靶向疗法之前,对联合臂小鼠进行了2周的化疗(图4)。每周进行超声波测量以监测肿瘤回归/生长。
每个治疗臂包含不少于7只小鼠。这个数字足以观察各组之间反应的差异,同时将研究费用保持在相当低的标记。在对照治疗的小鼠中可以使用更少的小鼠(三到四只),因为肿瘤生长速度的个体变异可以忽略不计,并且生长被规范化为肿瘤大小,而肿瘤大小则开始在其他手臂上接受治疗。
在观察的前3周(未显示)中,化疗组和未经治疗的组之间没有观察到差异。到第6周结束时,在化疗治疗组观察到肿瘤负担显著减少(58%中位数)。单独化疗比接受化疗与靶向疗法相结合的组观察到额外的益处。MK-8669(图4A)和MK-2206(图4B)分别在第4周和第3周明显存在差异。
动物被安乐死,并在第7周治疗试验结束时收集肿瘤组织进行治疗反应的分子分析。为此,使用免疫印迹确定总和磷酸化S6激酶(图5A、B)、AKT和mTOR(图5C、D)。的量。Figure 5AD核糖体蛋白S6激酶是KT-mTOR通路下游的信使,已知在通过生长因子刺激AKT-mTOR轴时进行上调节和磷酸化,以促进细胞存活和生长。将这些蛋白质在未经治疗或用化疗PDX肿瘤治疗的小鼠中与接受KT或mTOR抑制剂的小鼠进行比较,发现后两种蛋白明显减少(图5),表明靶向治疗在分子水平上的有效性。应调整治疗团,至于药物和治疗结合时间的应用时间,并进行测试,以达到更好的反应。
| 底写名 | 序列 | 底首相混合 | 底片组合 | ||
| OC101 17a-17b R1 | Ctggctcgatagataagatacatc | 1 | OC101 F1 和 R1 | ||
| OC101 17a-17b R2 | 格茨卡卡加加格塔卡卡塔格特格特克特克特克 | 2 | OC101 F1 和 R2 | ||
| OC101 17b-17a F1 | 格加特加特格特克克特克特格特 | 3 | OC101 F2 和 R1 | ||
| OC101 17b-17a F2 | AATGCCCTACGTTCCCCCTT | 4 | OC101 F2 和 R2 | ||
表1:用于验证OC101色体17改性底片的底片。
| 试剂 | 为 1 反应 (μL) 添加的数量 | 4 反应 (μL) 的添加数量。[乘以 4.3 使每个底法混合足够 (4)] |
| 无核酶水 | 20.45 | 89.94 |
| 10x 缓冲器(简单 A) | 2.5 | 10.75 |
| ntps 10 mm | 0.5 | 2.15 |
| 模板DNA(浓度>10纳克/+升) | 0.3 | 1.29 |
| 塔克聚合物酶 | 0.25 | 1.08 |
表 2:用于验证交汇点的 PCR 设置。
| 温度 (C) | 时间 | |
| 94 | 5 分钟 | |
| 94 | 40 s | 35 周期 |
| 59 | 40 s | |
| 72 | 2 分钟 | |
| 72 | 5 分钟 | |
| 4 | 保持 |
表 3:PCR 验证交汇点的循环条件。
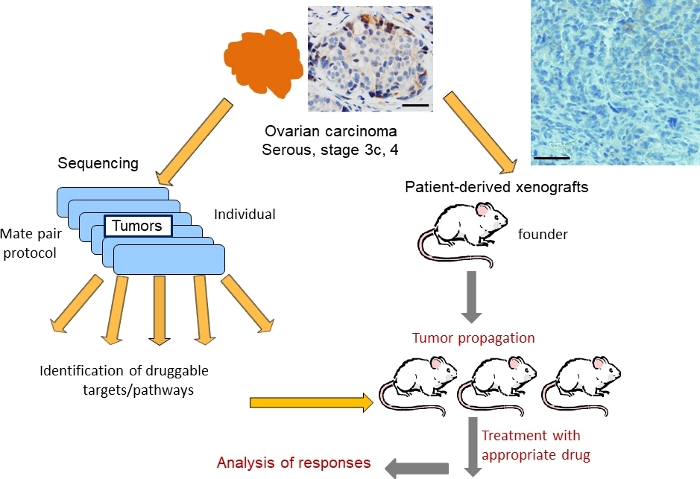
图1:使用PDX模型进行血清卵巢癌基因组引导治疗测试策略的示意图。显示卵巢肿瘤的 H&E 染色(顶部)。比例杆=100毫米。请点击这里查看这个数字的较大版本。

图2:使用MPSeq对卵巢肿瘤进行基因组表征。显示 Mpseq 检测到的结构改变和拷贝编号变化的景观的基因组图。X 轴跨越染色体的长度,显示染色体位置编号。每个染色体都指示在左右 Y 轴上。每个染色体的水平轨迹的高度表示为 30k 基对窗口检测到的读取数。DNA 拷贝编号按颜色表示,灰色表示正常 2N 拷贝状态,红色对应于删除和蓝色到增益。连接黑线对应于染色体重新排列。描述了ERBB2位点的变化。请单击此处查看此图的较大版本。
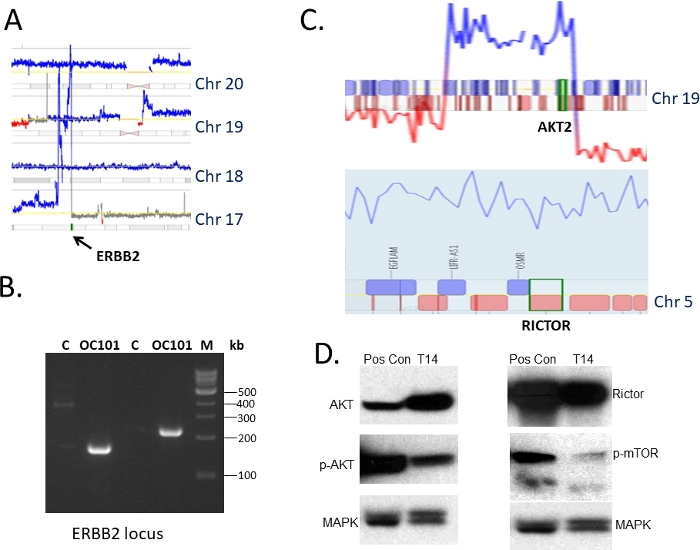
图 3:目标更改的选择及其验证。(A) 图1所示的基因组图的特写部分,显示了17号染色体上ERBB2基因的扩增(蓝色)。染色体编号如所示。(B) 使用PCR放大法对ERBB2位点的断点进行验证分析。C是一种汇集的基因组DNA控制,OC101是患者肿瘤的DNA,M是DNA阶梯。(C) 另一个卵巢肿瘤的基因组图段的特写,显示在 AKT 位点(顶部)和 RICTOR 基因(底部)的增益(以蓝线表示)。染色体是指示的。(D) 使用PDX(T14)肿瘤组织的免疫印迹对AKT/mTOR通路蛋白质表达进行验证分析,使用C.30mg总蛋白和AKT、RICTOR、p-mTOR特异性抗体中描述的基因组改变。MAPK 用作加载控制。Pos con 是一种独立的肿瘤,用作阳性对照。请单击此处查看此图的较大版本。
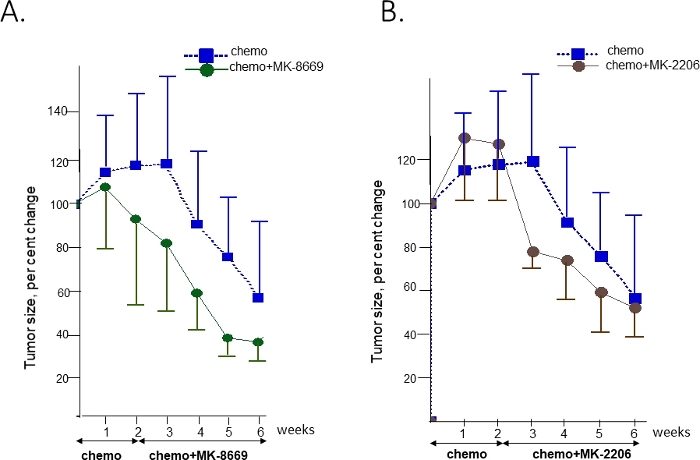
图4:单独对化疗的反应的比较,结合靶向治疗,在阿克托2和RICTOR基因与相应的药物。化疗和抗mTOR药物MK-8669(A)或泛阿克特AMK2206(B)抑制剂与化疗的抑制剂的组合B的治疗反应。每次治疗的给火时间和持续时间由箭头显示。在治疗开始时,体积表示为初始体积的百分比,为均值 +/- SD. Chemo 是化疗。请单击此处查看此图的较大版本。

图5:免疫印迹分析确定的每种治疗引起分子变化的比较。(A) S6和磷-S6的水平,显示KT-mTOR通路的下游效应器。使用了30毫克总蛋白和S6和p-S6特异性抗体。GAPDH 用作装载控制。将蛋白质水平正常化到GAPDH水平的定量表现为: (B) (C) mTOR、p-mTOR、AKT和p-AKT水平,通过免疫印迹检测。GAPDH 用作装载控制。(D) 蛋白质水平的定量正常化为GAPDH水平。NT 不治疗,化疗是化疗。请单击此处查看此图的较大版本。
讨论
我们描述了我们在PDX模型中用于进行"临床试验"的方法和方案,这些方法和方案利用基因组分析获得的肿瘤分子特性来确定用于测试的药物的最佳选择。多个测序平台目前用于原发肿瘤的基因组表征,包括全基因组测序、RNAseq 和定制基因面板。对于高品位血清卵巢癌,Mpseq 识别结构变化,DNA重排和拷贝数变化,是特别有用的,因为在这种类型的肿瘤中观察到高度的基因组不稳定。Mpseq 平台的第二个优点是它覆盖了整个基因组,但成本明显低于其他综合测序技术。然而,MPseq不适合点突变检测,因为基覆盖不足,仅达到8-10倍。单独使用MPSeq对肿瘤进行基因组表征的局限性之一是存在复杂的聚类染色体重排,分析这些重排不预测受影响的基因的表达。Mpseq 检测到的结,预测产生一个通过 PCR 在 DNA 中验证的定值融合基因,由于启动子区域中的帧移位或小删除和插入,可能无法表示。同样,应仔细评估和验证潜在治疗靶目标的染色体增益和扩增,以确保感兴趣的基因的表达。
虽然,肿瘤的分子组成在小鼠繁殖几代人后基本上被保存下来,但关键基因的表达水平可能会随时间而变化,这些变化要么反映了肿瘤的进化、克隆选择或对鼠的适应反应。因此,验证用于原供体肿瘤和PDX肿瘤治疗干预的改变至关重要。对于从PDX模型中分离出的肿瘤,RNA和蛋白质都可用于检测表达水平,因为材料丰富。根据储存组织的可用性和类型,以及用于相应蛋白质检测的抗体可用性,可以选择其中任何一种来交叉检查原始肿瘤中的表达。PDX模型在测试联合疗法方面特别无价,因为体内设置允许监测不良反应,以及治疗方案中的剂量或持续时间调整。
正畸和皮下包皮之间的选择可以根据研究中涉及的具体问题进行。然而,重要的是要记住,异种移植肿瘤对治疗的敏感性可以通过植入46的位点调节。另一方面,目前还没有证据表明发现的药物在正畸模型中显示出治疗反应,但在皮下植入的PDX9中却不存在。
披露声明
提交人声明,他们没有利益冲突。
致谢
我们感谢梅奥临床个人医学中心(CIM)的成员林阳博士和Faye R. Harris,MS,帮助进行实验。这项工作得到了尼尔·埃克尔斯先生和夫人向梅奥临床个性化医学中心(CIM)赠送的礼物的支持。
材料
| Name | Company | Catalog Number | Comments |
| 3M Vetbond | 3M, Co. | 1469SB | |
| anti-AKT antibody | Cell Signaling Technologies, Inc. | 9272 | |
| Anti-GAPDH antibody(G-9) | Santa Cruz Biotech. Inc. | sc-365062 | |
| Anti-MAPK antibody | Cell Signaling Technologies, Inc. | 9926 | |
| Anti-phospho-AKT antibody | Cell Signaling Technologies, Inc. | 9271 | |
| Anti-mTOR antibody | Cell Signaling Technologies, Inc. | 2972 | |
| Anti-Phospho-mTOR antibody | Cell Signaling Technologies, Inc. | 2971 | |
| Anti-Phospho-S6 antibody | Cell Signaling Technologies, Inc. | 4858 | |
| Anti-Rictor antibody | Cell Signaling Technologies, Inc. | 2114 | |
| Anti-S6 antibody | Cell Signaling Technologies, Inc. | 2217 | |
| Captisol | ChemScene, Inc. | cs-0731 | |
| Carboplatin | NOVAPLUS, Inc. | 61703-360-18 | |
| DMEM | Mediatech, Inc. | 10-013-CV | |
| Easy-A Hi-Fi PCR Cloning Enzyme | Agilent, Inc. | 600404-51 | |
| Lubricant | Cardinal Healthcare | 82-280 | |
| Matrigel | Corning, Inc. | 356234 | |
| McCoy's media | Mediatech, Inc. | 10-050-CV | |
| MK-2206 | ApexBio, Inc. | A3010 | |
| MK-8669 | ARIAD Pharmaceuticals, Inc. | AP23573 | |
| Nair Sensitive Skin | Church & Dwight Co. | Nair Hair Remover Shower Power Sensitive | |
| NOD/SCID mice | Charles River, Inc. | NOD.CB17-Prkdcscid/NCrCrl | |
| Paclitaxel | NOVAPLUS, Inc. | 55390-304-05 | |
| PEG400 | Millipore Sigma, Inc. | 88440-250ML-F | |
| Perjeta | Genetech, Co. | Pertuzumab | |
| Rituximab | Genetech, Co. | Rituxan | |
| RPMI1640 | Mediatech, Inc. | 10-040-CV | |
| SCID mice | Harlan Laboratories, Inc. | C.B.-17/IcrHsd-PrkdcscidLystbg | |
| SLAx 13-6MHz linear transducer | FUJIFILM SonoSite, Inc | HFL38xp | |
| SonoSite S-series Ultrasound machine | FUJIFILM SonoSite, Inc | SonoSite SII | |
| Tween 80 | Millipore Sigma, Inc. | P4780-100ML |
参考文献
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nature Reviews Clinical Oncology. 9, 338-350 (2012).
- Marangoni, E., et al. A new model of patient tumor-derived breast cancer xenografts for preclinical assays. Clinical Cancer Research. 13, 3989-3998 (2007).
- Zhang, X., et al. A renewable tissue resource of phenotypically stable, biologically and ethnically diverse, patient-derived human breast cancer xenograft models. Cancer Research. 73, 4885-4897 (2013).
- Hidalgo, M., et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discovery. 4, 998-1013 (2014).
- Weroha, S. J., et al. Tumorgrafts as in vivo surrogates for women with ovarian cancer. Clinical Cancer Research. 20, 1288-1297 (2014).
- Rubio-Viqueira, B., et al. Optimizing the development of targeted agents in pancreatic cancer: tumor fine-needle aspiration biopsy as a platform for novel prospective ex vivo drug sensitivity assays. Molecular Cancer Therapeutics. 6, 1079-1088 (2007).
- Rubio-Viqueira, B., Hidalgo, M. Direct in vivo xenograft tumor model for predicting chemotherapeutic drug response in cancer patients. Clinical Pharmacology and Therapeutics. 85, 217-221 (2009).
- Ricci, F., et al. Patient-derived ovarian tumor xenografts recapitulate human clinicopathology and genetic alterations. Cancer Research. 74, 6980-6990 (2014).
- Fleming, J. M., et al. Local regulation of human breast xenograft models. Journal of Cellular Physiology. 224, 795-806 (2010).
- Hoffman, R. M. Patient-derived orthotopic xenografts: better mimic of metastasis than subcutaneous xenografts. Nature Reviews Cancer. 15, 451-452 (2015).
- Jung, J., Seol, H. S., Chang, S. The Generation and Application of Patient-Derived Xenograft Model for Cancer Research. Cancer Research and Treatment. 50, 1-10 (2018).
- Sivanand, S., et al. A validated tumorgraft model reveals activity of dovitinib against renal cell carcinoma. Science Translational Medicine. 4, 137-152 (2012).
- Pavía-Jiménez, A., Tcheuyap, V. T., Brugarolas, J. Establishing a human renal cell carcinoma tumorgraft platform for preclinical drug testing. Nature Protocols. 9, 1848-1859 (2014).
- Fridman, R., Benton, G., Aranoutova, I., Kleinman, H. K., Bonfil, R. D. Increased initiation and growth of tumor cell lines, cancer stem cells and biopsy material in mice using basement membrane matrix protein (Cultrex or Matrigel) co-injection. Nature Protocols. 7, 1138-1144 (2012).
- Cutz, J. C., et al. Establishment in severe combined immunodeficiency mice of subrenal capsule xenografts and transplantable tumor lines from a variety of primary human lung cancers: potential models for studying tumor progression-related changes. Clinical Cancer Research. 12, 4043-4054 (2006).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Research. 73, 5315-5319 (2013).
- Butler, K. A., et al. Prevention of Human Lymphoproliferative Tumor Formation in Ovarian Cancer Patient-Derived Xenografts. Neoplasia. 19, 628-636 (2017).
- Cao, X., et al. Defective lymphoid development in mice lacking expression of the common cytokine receptor gamma chain. Immunity. 2, 223-238 (1995).
- Dobbin, Z. C., et al. Using heterogeneity of the patient-derived xenograft model to identify the chemoresistant population in ovarian cancer. Oncotarget. 5, 8750-8764 (2014).
- Choi, Y. Y., et al. Establishment and characterisation of patient-derived xenografts as paraclinical models for gastric cancer. Scientific Reports. 6, 22172 (2016).
- Malaney, P., Nicosia, S. V., Davé, V. One mouse, one patient paradigm: New avatars of personalized cancer therapy. Cancer Letters. 344, 1-12 (2014).
- Rosfjord, E., Lucas, J., Li, G., Gerber, H. P. Advances in patient-derived tumor xenografts: from target identification to predicting clinical response rates in oncology. Biochemical Pharmacology. 91, 135-143 (2014).
- Braekeveldt, N., Bexell, D. Patient-derived xenografts as preclinical neuroblastoma models. Cell and Tissue Research. 372, 233-243 (2018).
- 'Perez-Soler, R., et al. Response and determinants of sensitivity to paclitaxel in human non-small cell lung cancer tumors heterotransplanted in nude mice. Clinical Cancer Research. 6, 4932-4938 (2000).
- Fichtner, I., et al. Anticancer drug response and expression of molecular markers in early-passage xenotransplanted colon carcinomas. European Journal of Cancer. 40, 298-307 (2004).
- Gao, H., et al. High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response. Nature Medicine. 21, 1318-1325 (2015).
- Izumchenko, E., et al. Patient-derived xenografts effectively capture responses to oncology therapy in a heterogeneous cohort of patients with solid tumors. Annals of Oncology. 28, 2595-2605 (2017).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discovery. 1, 508-523 (2011).
- Mengelbier, L. H., et al. Intratumoral genome diversity parallels progression and predicts outcome in pediatric cancer. Nature Communications. 27, 6125 (2015).
- McGranahan, N., Swanton, C. Clonal Heterogeneity and Tumor Evolution: Past, Present, and the Future. Cell. 168, 613-628 (2017).
- Marusyk, A., et al. Non-cell-autonomous driving of tumour growth supports sub-clonal heterogeneity. Nature. 514, 54-58 (2014).
- Braekeveldt, N., et al. Neuroblastoma patient-derived orthotopic xenografts reflect the microenvironmental hallmarks of aggressive patient tumours. Cancer Letters. 375, 384-389 (2016).
- DeRose, Y. S., et al. Tumor grafts derived from women with breast cancer authentically reflect tumor pathology, growth, metastasis and disease outcomes. Nature Medicine. 17, 1514-1520 (2011).
- Das Thakur, M., et al. Modelling vemurafenib resistance in melanoma reveals a strategy to forestall drug resistance. Nature. 494, 251-255 (2013).
- Girotti, M. R., et al. Application of Sequencing, Liquid Biopsies, and Patient-Derived Xenografts for Personalized Medicine in Melanoma. Cancer Discovery. 6, 286-299 (2016).
- Murphy, S. J., et al. Mate pair sequencing of whole-genome-amplified DNA following laser capture microdissection of prostate cancer. DNA Research. 19, 395-406 (2012).
- Smadbeck, J. B., et al. Copy number variant analysis using genome-wide mate-pair sequencing. Genes Chromosomes and Cancer. 57, 459-470 (2018).
- Kovtun, I. V., et al. Lineage relationship of Gleason patterns in Gleason score 7 prostate cancer. Cancer Research. 73, 3275-3284 (2013).
- Paster, E. V., Villines, K. A., Hickman, D. L. Endpoints for mouse abdominal tumor models: refinement of current criteria. Comparative Medicine. 59, 234-241 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9, 671-675 (2012).
- Cheng, Y., et al. MK-2206, a novel allosteric inhibitor of Akt, synergizes with gefitinib against malignant glioma via modulating both autophagy and apoptosis. Molecular Cancer Therapeutics. 11, 154-164 (2012).
- Rivera, V. M., et al. Ridaforolimus (AP23573; MK-8669), a potent mTOR inhibitor, has broad antitumor activity and can be optimally administered using intermittent dosing regimens. Molecular Cancer Therapeutics. 10, 1059-1071 (2011).
- Heitjan, D. F., Manni, A., Santen, R. J. Statistical analysis of in vivo tumor growth experiments. Cancer Research. 53, 6042-6050 (1993).
- Vargas, R., et al. Case study: patient-derived clear cell adenocarcinoma xenograft model longitudinally predicts treatment response. NPJ Precision Oncology. 2, 14 (2018).
- Harris, F. R., et al. Targeting HER2 in patient-derived xenograft ovarian cancer models sensitizes tumors to chemotherapy. Molecular Oncology. 13, 132-152 (2019).
- Fidler, I. J., et al. Modulation of tumor cell response to chemotherapy by the organ environment. Cancer and Metastasis Reviews. 13, 209-222 (1994).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。