Method Article
構造DNA改変解析と患者由来異種移植片を用いたがんの標的治療の試験
要約
ここでは、腫瘍のゲノム構成に基づいて選択された標的療法の有効性を試験するプロトコルを提示する。このプロトコルは、構造的DNA再構成の同定と検証、患者の腫瘍のマウスへの生着、および対応する薬物に対する応答のテストを記述する。
要約
ここでは、次世代シーケンシングテクノギー、治療対象分析、患者由来異種移植片(PDX)を用いた薬物応答モニタリングを組み合わせた標的療法の有効性をテストするための統合的なアプローチを紹介します。この戦略は、例として卵巣腫瘍を使用して検証されました.mate ペア次世代シーケンシング(MpPeq)プロトコルは、構造変化を特定し、その後、潜在的に標的可能な変更の分析に使用されました。免疫不全マウスで増殖したヒト腫瘍は、ゲノム解析に基づいて選択された薬物で治療した。結果は、PDXモデルにおける予測応答と観測応答との間の良好な相関を示した。提示されたアプローチは、組み合わせ治療の有効性をテストし、特に標準的な治療が失敗し、ラベル外の薬物を使用する必要がある場合に、再発癌患者のためのパーソナライズされた治療を支援するために使用することができる。
概要
患者由来の異種移植片(PDXs)は、患者の腫瘍片を免疫不全マウスに移植して生成し、パーソナライズされた抗癌ケアを支援する強力な前臨床モデルとして登場した。PDXモデルは、さまざまなヒト悪性腫瘍のために開発に成功しています。これらには、乳癌および卵巣癌、悪性黒色腫、大腸癌、膵臓腺癌、および非小細胞肺癌11、2、3、4、52,3,4,5が含まれる。腫瘍組織は、異所性または異所性に移植することができる。前者は、より正確であるが技術的に困難であると考えられ、腫瘍起源の器官に直接移植することを含む。これらのタイプのモデルは、腫瘍,6,7の「自然」微小環境のために、元の腫瘍の組織学を正確に模倣すると考えられている。例えば、マウス卵巣のブルサへの異形性移植は、腹腔への腫瘍の播種および腹水の産生をもたらし、卵巣癌8の典型的な。同様に、腹部乳腺の代わりに胸部腫瘍を胸部に注入すると、PDXの成功率と行動9に影響を及した。しかし、直交性のモデルには、腫瘍の成長を監視するための高度なイメージングシステムが必要です。固形腫瘍の異所性移植は、典型的には、腫瘍の成長の容易なモニタリングを可能にし、より安価で時間のかかるマウスの皮下側面に組織を移植することによって行われる7。しかしながら、皮下に成長した腫瘍は、正交性移植10の場合に観察されたように転移することはほとんどありません。
生着の成功率は、腫瘍の種類によって異なり、大きく依存することが示されている。より高い割合の腫瘍細胞を含むより積極的な腫瘍および組織標本は、より良い成功率12,13,13を有することが報告された。これと一致して、転移部位に由来する腫瘍は50〜80%の頻度で生着することが示され、原発部位からの腫瘍は14%の低い頻度で生着する。対照的に、壊死細胞を含む組織は、生存可能な腫瘍細胞が少ないが、生着が悪い。腫瘍増殖はまた、元の腫瘍の特性を損なうことなくマウス14への注入時の組織ミックスに基膜マトリックスタンパク質を加えることによって促進することができる。移植を目的とした組織片の大きさと数は、生着の成功率に影響を与えることも判明した。より大きな腫瘍取り速度は、元の腫瘍間質を維持し、宿主間質細胞を提供するサブ腎嚢の能力による皮下移植と比較して、腎臓下のカプセルへの移植のために報告された。
ほとんどの研究は、NOD/SCID免疫不全マウスを使用し、これはナチュラルキラー細胞16を欠き、他の株14と比較して腫瘍の生着、成長および転移を増加させることが示されている。しかし、13歳の早い時期に3~4ヶ月の間に胸腺リンパ腫を発症する可能性があるため、追加のモニタリングが必要である。SCIDマウスで増殖した卵巣腫瘍移植では、B細胞の成長はリツキシマブによって正常に阻害され、リンパ腫の発症を予防するが、卵巣腫瘍17の生着に影響を与えない。
最近では、NSG(NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ)マウスは、インターロイキン2受容体γ鎖18をコードする遺伝子にヌル突然変異を運び、PDXモデルの生成に頻繁に使用される株となった。確立されたPDXモデルからマウスの将来の世代に継代された腫瘍は、3〜6世代の19、20,20の組織学的および分子特性を保持すると報告されている。多くの研究は、PDXモデルの治療結果が,対応する患者2、3、4、21、22、233,の患者のものを模倣することを示,21,22している。2423非小肺癌および大腸癌に対するPDXモデルにおける化学療法に対する応答率は、同じ薬剤24,25,25の臨床試験におけるそれと同様であった。臨床試験に登録された患者のために開発されたPDXモデルで行われた研究は、対応する患者22、3、43で臨床的に観察されたものと同様の試験薬に対する応答を実証した。
PDXモデルと組み合わせた患者腫瘍のハイスループットゲノム解析は、特定のゲノム変化と治療応答との間の相関関係を研究するための強力なツールを提供します。これらはいくつかの出版物26,27,27に記載されている。例えば、EGFR阻害剤セツキシマブに対する治療応答は、EGFR増幅を担う大腸PDXモデルのセットにおいて、患者28におけるセツキシマブに対する並行した臨床的応答である。
PDX モデルの開発と適用に関連するいくつかの課題があります。その中には、PDX内でより高い増殖能力を有する単一細胞クローンとしての治療応答解釈の精度を損なう可能性のある腫瘍不均一性29、30,30が、他のもの31を上回ることができ、したがって異質性の喪失をもたらす。さらに、PDXの開発に単一腫瘍生検を使用すると、細胞集団の一部が見逃され、最終的な移植片では表されない。この問題を解決するために、同じ腫瘍からの複数のサンプルが移植に推奨されます。PDX腫瘍は、元のドナー腫瘍のすべての細胞型を含む傾向があるが、これらの細胞は、マウス起源3のものに徐々に置換される。PDXモデルにおけるマウス間質とヒト腫瘍細胞の相互作用はよく理解されていない。それにもかかわらず、間質細胞は腫瘍微小環境33を再現することが示された。
これらの制限にもかかわらず、PDXモデルは、患者の治療を選択するための個別化された医療だけでなく、翻訳研究のための最も貴重なツールの一つです。PDXの主な用途には、バイオマーカーの発見と薬物検査が含まれます。PDXモデルは薬剤耐性メカニズムの研究や薬剤耐性34、35,35を克服するための戦略を特定するためにもうまく使用される。本稿に記載されているアプローチは、研究者がヒト腫瘍における潜在的な治療標的を同定し、最初に属的に特徴付けられた生着腫瘍を収容するマウスにおいて生体内の対応する薬物の有効性を評価することを可能にする。プロトコルは、腹腔,内に生着した卵巣腫瘍を使用するが、マウス2、3、123で成長するのに十分2に積極的なあらゆるタイプの腫瘍に適用可能である。12
プロトコル
卵巣癌の同意された患者からの新鮮な組織は、メイヨークリニック機関審査委員会(IRB)によって承認されたプロトコルに従って、脱バルク手術の時点で収集されました。このプロトコルで使用されるすべての動物の手順と治療は、メイヨークリニックの施設動物ケアと使用委員会(IACUC)によって承認され、動物ケアガイドラインに従いました。
1. 合致ペアのシーケンシングと解析
注: 新鮮な組織またはフラッシュ凍結組織は、メイトペア(MPseq)シーケンシングに使用する必要があります。パラフィン埋め込み材料は、断片化したDNAを含むため、適さない。
- 凍結腫瘍組織からDNAを分離する。外科材料または生検36から得られる元のヒト標本を使用する。
- 1000 ng の DNA を使用して、次世代シーケンサー上のレーン当たり 2 サンプルとして MPEQ ライブラリとシーケンスを作成します (材料表を参照)36。
- 上記の36,37,37のように大きな染色体収差(欠失、挿入、増幅、反転および転座)を検出するための一連のアルゴリズムを用いてデータを分析する。
2. 治療対象の選択
- オープンアクセスパンダツール(パスウェイと注釈)または類似のツールを使用して、ターゲット可能な変更(http://bioinformaticstools.mayo.edu/Panda)を識別します。
- MSeqによって変更された遺伝子のリストを、標準の受け入れられた遺伝子シンボルを使用して、単純なタブ区切りファイルとして作成します。
注: 含まれているサンプルは、増幅とゲインの分析を特徴としています。 - リストのヘッダー行に「#」記号を追加して、テーブルヘッダーがソフトウェアの経路レベルビューに転送されるようにします。
- [アノテーションセットのアップロード] ナビゲーション タブをクリックして、ファイルをアップロードします。
- メニューから 1 つのアイコンを割り当てて、目的のアイコンをクリックし、[確定] タブをクリックして、基になるデータを表します。
- アノテーション ファイルがアップロードされた後、経路ごとの注釈付き遺伝子数を表示する列を特定します。これは、右側の最後の列です。
- メインウィンドウの左上にある経路フィルタを使用して、目的の遺伝子を含む経路を表示します。
- 偶然に予想されるよりも多くのアコード化された遺伝子を持つ経路を特定する。[エンリッチメント] タブの下にある関数を使用します。
- メインウィンドウの左側にある適切なアイコン(例えば、DGIdb、PharmGKB)をチェックして、事前設定アノテーションから潜在的に薬物性の可能性のある遺伝子を表示するデータベースを選択します。
- [経路ビューア] ページに表示される名前をクリックして、視覚化する経路を選択します。
注: 各アノテーションセットを表すアイコンは、関連するジーンの横に表示されます。対象の遺伝子をクリックして、対応するGeneCardsウェブページを開きます。 - 関心のある遺伝子(つまり、特定の腫瘍で変化した)とさらなる分析のための潜在的な薬物の「ヒット」を示した経路を選択します。
- MSeqによって変更された遺伝子のリストを、標準の受け入れられた遺伝子シンボルを使用して、単純なタブ区切りファイルとして作成します。
- 臨床応用(https://clinicaltrials.gov/)に承認された薬剤を含むデータベースを使用して、同定された標的を相互参照する。
- 特定のタイプの腫瘍の生物学との関連性を確認するために文献レビュー(例えば、PubMed)を行うことによって、PDXモデルのさらなるテストのためのターゲット可能な変化を優先する。
PCRとサンガーシーケンシングによるゲノム再配列の検証
- MpPseqデータから取得したシーケンシング読み取りを使用してプライマーを設計します。
- MPseq分析に基づいて、検証の対象となる接合部(すなわち、潜在的な治療目標)を選択します。
- アンプリコンが接合を含むような方向にプライマーを設計します。ジャンクションの両側に2つのプライマーを設計し、合計4で、ジャンクションを増幅する可能性を高めます。
注:ケースと染色体の位置に応じてプライマーに名前を付けます。 - プライマー設計および選択したソフトウェアには、標準 PCR パラメータを使用します。溶解温度(60~62°C)とGC含有量(40~60%)を選択します。プライマーシーケンスがプライマーダイマー、パリンドローム、ヘアピンループを形成していないことを確認します。
- プライマー配列がBLAT(http://genome.ucsc.edu/cgi-bin/hgBlat?command=start)を用いて確認することで、ヒトゲノムの他の領域に対する相同性を欠いていることを確認する。
- PCR を実行して、対象の接合部を増幅します。
- 水でプライマーを10 mMに希釈し、各プライマーの10 mLを組み合わせて、各フォワードプライマーと各リバースプライマーをプライマーミックスに組み合わせます。
注: 選択した例のプライマーのシーケンスを表1に示します。 - ラベル0.2 mLストリップチューブとして:C1、T1、C2、T2、C3、T3、C4およびT4、C=対照ヒトゲノムDNA(商業)、T=腫瘍DNA、患者またはPDX腫瘍から単離された、および数はプライマーミックスを示す。
- 各プライマーミックスの1 mLをラベル付きチューブに加えます。
- 表2に記載されている試薬を組み合わせて、必要になるまでフリーザーに酵素を残し、最後の最後にミックスに加えてTaqマスターミックスを準備します。
- 各テンプレートDNAに1つずつ、2つのマスターミックスを作り、ヒトDNAと腫瘍DNAを制御する。それぞれのストリップチューブに各Taqマスターミックスの24 mLを追加します。総反応量は25mLです。渦は非常に簡単に、その後、ストリップチューブを下に回転させます。
- サーモサイクラーで PCR を実行します。表 3 に示すパラメーターを使用します。アニーリング温度を、プライマーの溶融温度より少なくとも1°C寒くなるように調整します。
- 完成したPCR製品を-20°C(長期)または4°C(短期間)で必要になるまで冷蔵保存してください。
- 1-5 V/cmで電気泳動を行い、1.5%アガロースゲルを使用してPCR産物を可視化します。サンガーシーケンシングに使用する製品の2 mLアリコートを残します。
- 水でプライマーを10 mMに希釈し、各プライマーの10 mLを組み合わせて、各フォワードプライマーと各リバースプライマーをプライマーミックスに組み合わせます。
- サンガーシーケンシングを実行してジャンクションを確認し、正確なブレークポイント38を特定します。
- PCR が単一の製品(バンド)を生成した場合は、PCR 産物を使用します。あるいは、バンドをゲルから切り出し、増幅に使用されるプライマーと一緒にサンガーシーケンシングのために精製して提出します。
注:ゲノム解析を行った腫瘍は、マウスの移植に使用されます。
- PCR が単一の製品(バンド)を生成した場合は、PCR 産物を使用します。あるいは、バンドをゲルから切り出し、増幅に使用されるプライマーと一緒にサンガーシーケンシングのために精製して提出します。
4. 腫瘍の生着と維持
- PDXマウスモデルに腫瘍を生着させる準備を設定する。ゲノム解析が行われる、または行われた生着腫瘍を選択します。
- 専用の研究所や動物施設、熟練した技術スタッフ、詳細な標準的な運用手順など、PDXモデルの開発開始時に、支援インフラストラクチャが整っていることを確認してください。
- 細胞の生存率と成功した生着のためには、迅速な輸送と試料の処理を確保します。
- 滅菌環境を使用して、標本の処理および生着のための細菌および真菌汚染を低減します。
- 血液媒介病原体を収容する可能性があるため、生体有害物質に関する制度上の方針に従って、ヒトの標本を注意深く扱う。
- 手術標本を20 mLの組織培養培地で冷やされた50 mLチューブに入れて、生着のために組織(0.5-0.7 cm3の大きさ)を準備します。
注:腫瘍組織は新鮮であるか、以前凍結保存材料5から回復することができます。 - 病理医に相談して検体中の腫瘍の内容を確認する。
- 腫瘍組織を10〜15mLの冷たいPBSを含む皿に入れるか、または抗生物質を含むRPMI 1640またはDMEMなどの組織培養培地(1%ペニシリンおよびストレプトマイシン)を含む。
- 病理学者の助けを借りて、隣接する正常および壊死組織から生存可能な腫瘍材料を同定し、単離する。生殖不能鉗子およびメスを使用して、病理学者によって指摘された壊死性物質を除去する。
注:腫瘍は、腹腔内または皮下のいずれかにマウスに移植することができます。ステップ4.2に従って腹腔内移植を行うか、またはステップ4.3にスキップして皮下の生着を行う。本研究では、ゲノム解析に基づいて選択された標的療法を、腹腔内移植を伴う高等漿性卵巣癌の一連のPDXモデルで試験された。
- 滅菌鉗子で組織をミンチし、氷の上にメスを注入する腹腔内(IP)移植のための組織を準備し、約1〜1.5mm3の大きさの部分を作り、冷たい培養培地と混合します。16-17ゲージ針を使用して、0.3~0.5 mLの腫瘍スラリーを注入します。
注:すべての外科手術は無菌技術を使用して行われます。滅菌手袋、滅菌器具、消耗品、および埋め込み材料を使用して、感染の可能性を低減した。- 1:1を氷冷培養培地と混合し、少なくとも3匹の雌SCIDマウスに腹腔内100mLを注入する。
- 滅菌鉗子、メス、または外科用はさみを使用して皮下生着のために腫瘍組織を小さな断片(約2 x 2 x 2 mmの大きさ)に切り、断片化した組織を氷の上の冷蔵ペトリ皿に移します。
- 断片化した組織(組織10個あたり約200mL)を含む冷たい基体膜マトリックスを皿に加え、よく混ぜ合わせ、組織断片を冷たい基体膜マトリックスに10分間浸します。
- 5匹の雌のNOD/SCIDマウスを麻酔して、生着のためにそれらを準備する。
- 各マウスをケタミン(150mg/kg)とキシラジン(10mg/kg)の組み合わせで腹腔内に注入する。
- マウスが外傷性鉗子で尾先をつまんで適切に麻酔されていることを確認します。
- チャンバーから静かに完全に麻酔をかけられたマウスを取り出し、気化器からの入力と廃ガス清掃システムからの出力を持つノーズコーンをマウスに置きます。
- 麻酔下で乾燥を防ぐために、マウスの目に獣医軟膏を置きます。手術が行われる領域を準備します。無菌技術を使用して手術を行います。
- 手術が行われる表面が非多孔質で密封され、手術前に汚染されていることを確認してください。
- 滅菌(オートクレーブ、ガスまたは化学滅菌による)器具で手術を開始します。
- 手袋を使用して器具を扱い、手術ステップ間のエタノールに浸すことによって、手順全体にわたって器械の先端の無菌性を維持する。
- ヨウ素とアルコールの3つの交互のスクラブを適用することによって、外科部位を殺菌する。無菌の外科用ハサミと鉗子を使用して、マウスの両側面に5〜10mm垂直皮膚切開を行います。
- ストレート鉗子を皮下空間にそっと挿入して、脂肪パッドの下に腫瘍片を置くのに十分な大きさのポケットを作ります。
- 滅菌ストレート鉗子を使用して、5匹のマウスのそれぞれで以前に準備されたポケットに腫瘍断片を挿入する。
注:1つのポケットに腫瘍組織の3〜4個を置きます。 - 組織接着剤を使用して皮膚切開を閉じます。
- リンパ球増殖を阻害するために、注入後に100mLのリツキシマブを各マウスに腹腔内注入する。
- 麻酔から回復するまで、約20分間、ヒートランプの下のケージにマウスを入れます。マウスのバイタルサインを監視し、十分な水分補給を確認します。
- 麻酔から回復し、食べ物と水を持ち始めた後、マウスを他のマウスの会社に戻します。制度上のガイドラインに従って、術後のケアとモニタリングを行います。手術後3日間連続して、毎日痛みや苦痛の兆候がないか確認してください。
注:痛みや苦痛の基準には、壊死または潰瘍、体重減少/身体状態のスコアリング、活動レベル、運動機能および姿勢などの行動徴候が含まれる。 - 腫瘍がキャリパーで測定された直径0.5cmに達するまで、マウスの腫瘍形成を隔週で定期的にチェックする。
- 各マウスの健康スコアを、外観、行動、および身体状態39から派生したものとして評価する。二酸化炭素吸入によって犠牲になるモリバンドマウスの基準として≤6のスコアを使用してください。
5. PDXモデルにおける一体的に同定されたターゲットに対する応答のテスト
- 腫瘍が触知可能で、超音波スキャンで測定された0.5 cm3に達したときに、選択された標的治療を開始する。
- 腹部の超音波スキャンを行う前に、マウス腹部の毛皮を除去し、無菌ゼリー潤滑剤を適用します。
- トランスデューサ付きの超音波機械を使用して、断面に位置する腫瘍の画像を取得します。各動物のセッションごとに3つの測定値を行い、腫瘍サイズのより正確な評価のための値を平均します。
- 利用可能なソフトウェア40を使用して画像を分析します。
- カルボプラチンの混合物からなる化学療法を投与 51 mg/kg とパクリタキセル 15 mg/kg 腹腔内(IP)で週に1回、4-6週間の全治療期間。射出の総容積が0.2 mLを超えないことを確認してください。
- 30%シクロデキストリン(例えば、Captiol)でMK-220641ストック溶液を作り、4週連続で毎日120mg /kgの経口ギャージを介して送達します。
- マウスの頭と手足が固定化されるように、背中の皮膚をつまんで後ろに固定して、それを保持することによって経口ギャバジのためにマウスを準備します。
- プローブが食道に到達するまで、マウスの喉の後ろにガビンプローブを挿入します。マウスの肺が穿穿して死を引き起こす可能性があるため、プローブがあまり遠くに挿入されないようにしてください。
- 25 mg/mL で、MK-866942ストック溶液をエタノールに入れてください。5.2% Tween 80,5.2% PEG400 を含む車両で希釈し、10 mg/kg で 10 mg/kg で 1 週間おきに IP 注射用の無菌水を 4 週間の治療の全期間で行います。
注:マウスに注入される容積は、動物の体重に応じて50〜120mLでなければなりません。 - 治療群ごとに7〜8匹のマウスを使用して、差43,44,44を検出するのに十分な統計的パワーを有する。
- 毎日の治療でマウスの体重と一般的な状態を評価します。動物の体重が最初の体重から20%以上低下した場合、薬物を差し控える。
- 超音波スキャンを使用して、毎週腫瘍のサイズを評価します。腫瘍の成長のモニタリングを行う個人が治療に盲目であることを確認して、応答の公平なスコアリングを確実に行います。
注:小規模な実験室は、治療と超音波モニタリングを管理するために2人の異なる人々を採用することができます。
結果
脱バルク手術時に切除された卵巣腫瘍からの組織をIRBガイダンスに従って採取し、1)遺伝子組み換えおよび2)免疫不全マウスにおける生着に使用した(図1)。Mateペアシーケンシングプロトコル36,37は36、損失、利益および増幅を含むDNAの構造的変化を同定するために使用された。1つの腫瘍におけるゲノム変化の風景を示す代表的なゲノムプロット(OC101と指定)を図2に示す。高品位の漿液性サブタイプ腫瘍では、複数の利益(青線)および欠失(赤線)が見つかり、高レベルのゲノム不安定性、染色体の損失および利益、すなわち異数理を示す、観察された。平均300〜700の変化の合計は、高等級漿液性サブタイプ腫瘍45で同定される。その後の分析は、臨床的に関連する薬物で標的に可能ないくつかのDNA変化を明らかにした。OC101腫瘍における治療介入のためのトップランクの変化は、ERBB2を含む染色体17での増幅であった(図2および図3A)。ERBB2は、RAS/ERKおよびPI3K/AKTシグナル伝達経路を活性化し、細胞増殖、細胞遊びおよび浸潤を促進するためにEGFR、HER3またはHER4との二量体化時に知られているHER2受容体のコードをコードする遺伝子である。HER2阻害剤(例えば、モノクローナル抗体ペルツズマブおよびトラスツズマブ)は、腫瘍がHER2タンパク質を過剰発現させると乳癌患者の治療に有効である。しかし、卵巣癌に対する抗HER2療法はFDA承認されていない。
ドナー患者の腫瘍のゲノムプロファイル(図1)を対応するPDXモデル(図示せず)のゲノムプロファイルと比較すると、PDX誘導体に対する元の腫瘍の分子近合感を報告する以前のすべての研究と一致する顕著な類似性が明らかになった。
DNAレベルでのMPeqの結果を検証するために、ERBB2遺伝子を含む増幅領域の縁に対していくつかの特定のプライマーのセットを設計し、PCRはマウスの数世代にわたって伝播した腫瘍からだけでなく、元の腫瘍から単離されたDNAを使用して行った。2つの異なるプライマーセットを使用した増幅産物の代表的なゲル画像を図3Bに示す。ERBB遺伝子座の増幅を含まない正常なプールゲノムDNA(Cと指定)の場合にはバンドは検出されなかったが、増幅された。ゲルおよびサンガーシーケンシング(図示せず)からの製品の精製は、さらに、MpPeqによって予測される変化を確認した。さらに、対応するPDX腫瘍におけるHER2タンパク質の発現を免疫ブロット法を用いて調べることにより、検証を行った。分析は、ERBB2遺伝子の観察された増幅と一致する高レベルのHER2タンパク質(結果は示されていない)を明らかにした。
異なる卵巣腫瘍(指定T14)のDNAでは、多数の地域的利益が観察された。これらには、AKT2およびRICTOR遺伝子が含まれていました(図3C)。どちらも、RICTORが関連付けるAKT2およびmTORの阻害剤が利用可能であり、現在臨床試験中であるとして、治療的な観点から大きな関心を持っていました。いずれの遺伝子の近傍に及ぶ合致ペアの読み取りもなかったので、MPseqによって検出されたゲインの単純なPCR検証は不可能であった。そこで、免疫ブロッティングにより対応するタンパク質の発現レベルを試験した。高レベルのAKTおよびRICTORが観察された(図3D)は、標的薬物による治療が保証されることを示唆している。
AKTおよびmTORの阻害剤に対するこの腫瘍の感受性を試験するために、腹腔内移植T14腫瘍を有するPDXマウスを拡大し、化学療法(カルボプラチン/パクリタキセル)または汎AKT阻害剤MK-220641またはmTOR阻害剤MK-866942との化学療法の組み合わせを受けるために無作為化した。併用アームのマウスに対して、標的療法の追加前に2週間化学療法を行った(図4)。超音波測定は、腫瘍の退縮/成長を監視するために毎週行われました。
各治療アームには、7匹以上のマウスが含まれていた。この数は、研究のコストをかなり低いマークに保ちながら、グループ間の応答の違いを観察するのに十分でした。腫瘍の増殖速度の個々の変動はごくわずかであり、成長は他の腕の治療が始まる腫瘍サイズに正規化されるため、対照未治療群で使用できるマウス(3~4匹)は少ない。
観察の最初の3週間で化学処理群と未治療群の間に差は認められなかった(図示しない)。腫瘍負担の有意な減少(中央値58%)は、第6週末までに化学療法処置群において観察された。化学療法と標的療法の組み合わせを受けたグループでは、化学療法に対する余分な利益が単独で観察された。MK-8669 (図4A)とMK-2206(図4B)の第4週と第3週でそれぞれ違いが明らかになりました。
動物を安楽死させ、腫瘍組織を採取し、治療試験の終わりに第7週の治療応答の分子分析を行った。その目的のために、合計およびリン酸化S6キナーゼ(図5A、B)、AKTBおよびmTOR(図5C、D)の量Dを免疫ブロットを用いて決定した。Figure 5Aリボソームタンパク質S6キナーゼは、AKT-mTOR経路の下流のメッセンジャーであり、細胞の生存および成長を促進する成長因子によってAKT-mTOR軸の刺激時にアップレギュレートおよびリン酸化されることが知られている。未治療または化学療法PDX腫瘍で治療されたこれらのタンパク質のレベルと、AKTまたはmTOR阻害剤を受けたマウスとの比較は、後者の2つ(図5)において顕著な減少を示し、分子レベルに対する標的療法の有効性を示した。治療連隊への調整は、併用薬物および治療期間の適用時期に関して、より良い応答を達成するために行われ、テストされるべきである。
| プライマー名 | シーケンス | プライマーミックス | プライマーの組み合わせ | ||
| OC101 17a-17b R1 | CTGGTCCGGGGガーアタガタカタタータートカッカキャット | 1 | OC101 F1 および R1 | ||
| OC101 17a-17b R2 | GCTCAAGAGTAACCACCタグッタッグッタクトクトクティク | 2 | OC101 F1 および R2 | ||
| OC101 17b-17a F1 | ガッタッグガーックグクタクトクト | 3 | OC101 F2 および R1 | ||
| OC101 17b-17a F2 | アトグクタグカクトクトクチャクアクティクト | 4 | OC101 F2 および R2 | ||
表1:OC101染色体17の改変の検証に使用されるプライマー。
| 試薬 | 1反応(μL)に追加する量 | 4つの反応(μL)のために追加する量。[プライマーミックスごとに十分に作るために4.3を掛ける(4)] |
| ヌクレアーゼフリー水 | 20.45 | 89.94 |
| 10xバッファ(簡単A) | 2.5 | 10.75 |
| dNT10 mM | 0.5 | 2.15 |
| テンプレートDNA (濃度 >10 ng/μL) | 0.3 | 1.29 |
| タク・ポリメラーゼ | 0.25 | 1.08 |
表 2: 接合を検証するための PCR セットアップ
| 一時 (C) | 時間 | |
| 94 | 5分 | |
| 94 | 40 s | 35サイクル |
| 59 | 40 s | |
| 72 | 2分 | |
| 72 | 5分 | |
| 4 | 保持 |
表 3: 結合を検証する PCR のサイクル条件
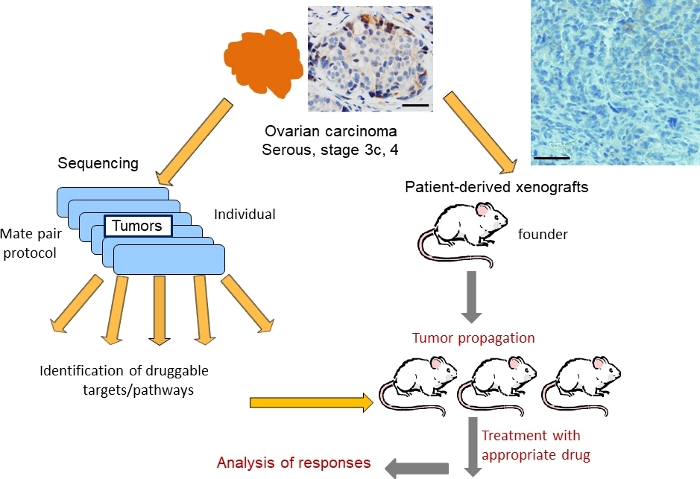
図1:漿液性卵巣癌のPDXモデルを用いた、ジェノミカル誘導療法試験の戦略の概略的表現H&E卵巣腫瘍の染色が示されている(上)。スケールバー=100 mm.この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:MPEqを用いた卵巣腫瘍のゲノム特性解析MPseqによって検出された構造変化とコピー数の変化の風景を示すゲノムプロット。X軸は、染色体の位置番号を持つ染色体の長さにまたがっています。各染色体は、右と左のY軸に示されています。各染色体の水平トレースの高さは、30k ベースペアウィンドウで検出された読み取りの数を示します。DNAコピー番号は色で示され、グレーは通常の2Nコピー状態を表し、赤は欠失に対応し、青から先のゲインを表します。黒い線を接続することは染色体の再配置に対応します。ERBB2遺伝子座での変更が描かれています。この図の大きなバージョンを表示するには、ここをクリックしてください。
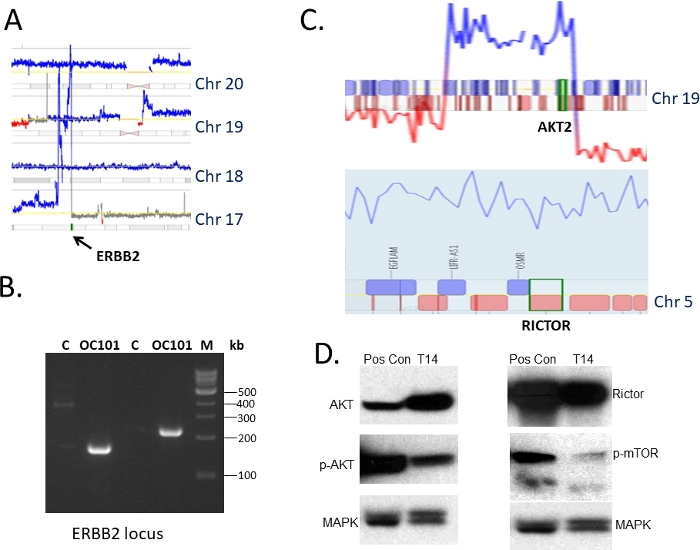
図3:ターゲット可能な変更とその検証の選択(図1に示すゲノムプロットのクローズアップセグメントで、染色体17(青色)上のERBB2遺伝子の増幅を示す。染色体数は示すとおりである。(B) PCR 増幅を用いた MPEq で同定された ERBB2 軌跡のブレークポイントの検証分析。Cは、プールされたゲノムDNA制御であり、OC101は患者腫瘍からのDNAであり、MはDNAラダーである。(C) AKT遺伝子(上)およびRICTOR遺伝子(下)での利益(青線で示される)を示す別の卵巣腫瘍のゲノムプロットのセグメントのクローズアップ。染色体は示されたとおりである。(D)PDX(T14)から腫瘍組織を用いた免疫ブロット法によるAKT/mTOR経路のタンパク質発現の検証解析、AKT、RICTOR、p-mTORに対する全タンパク質および特異的抗体のC.30mgに描かれているゲノム変化が用いられた。MAPK は、読み込み制御として使用されます。Pos conは、陽性対照として使用される独立した腫瘍である。この図の大きなバージョンを表示するには、ここをクリックしてください。
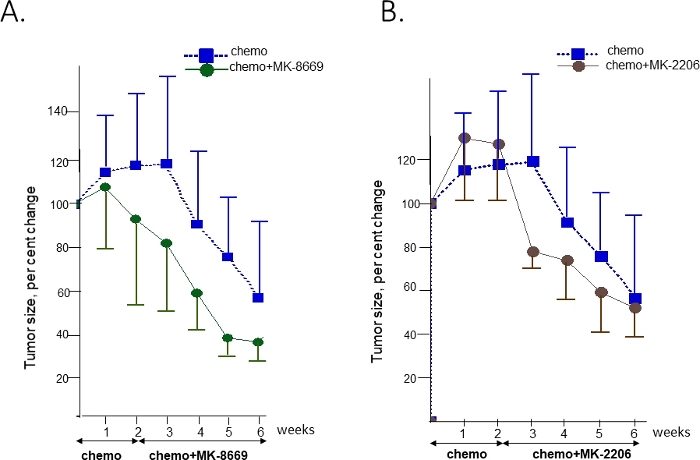
図4:化学療法単独に対する応答の比較と、AKT2およびRICTOR遺伝子における腫瘍収容の標的治療と対応する薬物との併用。化学療法と抗mTOR薬MK-8669(A)または汎AKT MK2206の阻害剤(B)対化学療法単独の併用療法に対する治療応答。A各治療の投与時間および持続時間は矢印で示される。容積は、治療開始時の初期体積の割合として、平均+/- SDとして表され、化学療法である。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:免疫ブロッティング解析で求める各治療によって引き出される分子変化の比較。(A)S6およびホスホ-S6のレベルは、AKT-mTOR経路の下流エフェクターを示す。AS6およびp-S6に対する全タンパク質および特異的抗体の30mgを使用した。GAPDH は、負荷制御として使用されました。GAPDHレベルに正規化されたタンパク質レベルの定量は、免疫ブロッティングによって検出されたCmTOR、p-mTOR、AKTおよびp-AKTの(B)(C)レベルで示されている。GAPDH は、負荷制御として使用されました。(D) GAPDHレベルに正規化したタンパク質レベルの定量化。NTは治療されず、化学療法である化学療法である。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
我々は、検査のための最良の選択薬を決定するためにゲノムプロファイリングによって得られる腫瘍の分子特性を利用するPDXモデルで「臨床試験」を行うために使用したアプローチとプロトコルを説明する。現在、全ゲノムシーケンシング、RNAseq、カスタマイズされた遺伝子パネルを含む原発性腫瘍のゲノム特性解析には、複数のシーケンシングプラットフォームが使用されています。高品位の漿液性卵巣癌の場合、MPPeqは構造変化、DNA再構成およびコピー数の変化を同定し、このタイプの腫瘍において観察されるゲノム不安定性の高さのために特に有用である。MPseqプラットフォームの2つ目の利点は、ゲノム全体をカバーしていますが、他の包括的なシーケンシング技術よりも大幅にコストが低いということです。しかし、MPeqは、塩基性被覆率が十分ではなく、8〜10倍に達するため、点突然変異検出には適していない。腫瘍のゲノム特性解析に対してMpPeq単独を使用する限界の1つは、複雑なクラスター化染色体再調整の存在であり、その分析は、影響を受けた対象遺伝子の発現を予測しない。MPEqによって検出されたジャンクションは、フレームシフトまたはプロモーター領域の小さな欠失および挿入のために、PCRによってDNA内で検証する推定融合遺伝子を作成すると予測された。同様に、潜在的な治療標的に対する染色体の利益および増幅は、RNAまたはタンパク質レベルで慎重に評価し、検証し、目的の遺伝子の発現を確実にする必要があります。
腫瘍の分子構成は、マウスでの増殖後に何世代にもわたって大部分が保存されるが、腫瘍の進化、クローン選択、またはマウス環境に対する適応応答を反映して、重要な遺伝子の発現レベルの変化が経時的に起こり得る。したがって、元のドナー腫瘍およびPDX腫瘍の両方における治療介入を意図した変化の検証が重要である。PDXモデルから分離された腫瘍については、RNAとタンパク質の両方が、物質が豊富であるように発現量を問い合わすために使用することができる。いずれかの方法は、保存された組織の入手可能性と種類、および対応するタンパク質検出のための抗体の入手可能性に応じて、元の腫瘍における発現をクロスチェックするように選択することができる。PDXモデルは、インビボ設定が副作用のモニタリング、ならびに治療レジメンにおける投与量または持続時間調整を可能にするので、併用療法をテストする上で特に貴重である。
異形性と皮下の生着の間の選択は、研究で取り組まれている特定の質問に応じて行うことができます。しかしながら、異種移植腫瘍の治療に対する感受性は、移植46の部位によって変調され得ることを念頭に置いておく必要がある。一方、直交性モデルにおける治療的反応を示す薬剤の発見に関する証拠はまだ報告されていないが、皮下に移植されたPDX9には存在しない。
開示事項
著者らは、利益相反はないと宣言している。
謝辞
メイヨークリニック個人医学センター(CIM)のリン・ヤン博士とフェイ・R・ハリスさん(MS)のメンバーに、実験の支援をいただきありがとうございます。この作品は、ニール・E・エックルズ夫妻のメイヨー個別医療センターへの贈り物によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| 3M Vetbond | 3M, Co. | 1469SB | |
| anti-AKT antibody | Cell Signaling Technologies, Inc. | 9272 | |
| Anti-GAPDH antibody(G-9) | Santa Cruz Biotech. Inc. | sc-365062 | |
| Anti-MAPK antibody | Cell Signaling Technologies, Inc. | 9926 | |
| Anti-phospho-AKT antibody | Cell Signaling Technologies, Inc. | 9271 | |
| Anti-mTOR antibody | Cell Signaling Technologies, Inc. | 2972 | |
| Anti-Phospho-mTOR antibody | Cell Signaling Technologies, Inc. | 2971 | |
| Anti-Phospho-S6 antibody | Cell Signaling Technologies, Inc. | 4858 | |
| Anti-Rictor antibody | Cell Signaling Technologies, Inc. | 2114 | |
| Anti-S6 antibody | Cell Signaling Technologies, Inc. | 2217 | |
| Captisol | ChemScene, Inc. | cs-0731 | |
| Carboplatin | NOVAPLUS, Inc. | 61703-360-18 | |
| DMEM | Mediatech, Inc. | 10-013-CV | |
| Easy-A Hi-Fi PCR Cloning Enzyme | Agilent, Inc. | 600404-51 | |
| Lubricant | Cardinal Healthcare | 82-280 | |
| Matrigel | Corning, Inc. | 356234 | |
| McCoy's media | Mediatech, Inc. | 10-050-CV | |
| MK-2206 | ApexBio, Inc. | A3010 | |
| MK-8669 | ARIAD Pharmaceuticals, Inc. | AP23573 | |
| Nair Sensitive Skin | Church & Dwight Co. | Nair Hair Remover Shower Power Sensitive | |
| NOD/SCID mice | Charles River, Inc. | NOD.CB17-Prkdcscid/NCrCrl | |
| Paclitaxel | NOVAPLUS, Inc. | 55390-304-05 | |
| PEG400 | Millipore Sigma, Inc. | 88440-250ML-F | |
| Perjeta | Genetech, Co. | Pertuzumab | |
| Rituximab | Genetech, Co. | Rituxan | |
| RPMI1640 | Mediatech, Inc. | 10-040-CV | |
| SCID mice | Harlan Laboratories, Inc. | C.B.-17/IcrHsd-PrkdcscidLystbg | |
| SLAx 13-6MHz linear transducer | FUJIFILM SonoSite, Inc | HFL38xp | |
| SonoSite S-series Ultrasound machine | FUJIFILM SonoSite, Inc | SonoSite SII | |
| Tween 80 | Millipore Sigma, Inc. | P4780-100ML |
参考文献
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nature Reviews Clinical Oncology. 9, 338-350 (2012).
- Marangoni, E., et al. A new model of patient tumor-derived breast cancer xenografts for preclinical assays. Clinical Cancer Research. 13, 3989-3998 (2007).
- Zhang, X., et al. A renewable tissue resource of phenotypically stable, biologically and ethnically diverse, patient-derived human breast cancer xenograft models. Cancer Research. 73, 4885-4897 (2013).
- Hidalgo, M., et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discovery. 4, 998-1013 (2014).
- Weroha, S. J., et al. Tumorgrafts as in vivo surrogates for women with ovarian cancer. Clinical Cancer Research. 20, 1288-1297 (2014).
- Rubio-Viqueira, B., et al. Optimizing the development of targeted agents in pancreatic cancer: tumor fine-needle aspiration biopsy as a platform for novel prospective ex vivo drug sensitivity assays. Molecular Cancer Therapeutics. 6, 1079-1088 (2007).
- Rubio-Viqueira, B., Hidalgo, M. Direct in vivo xenograft tumor model for predicting chemotherapeutic drug response in cancer patients. Clinical Pharmacology and Therapeutics. 85, 217-221 (2009).
- Ricci, F., et al. Patient-derived ovarian tumor xenografts recapitulate human clinicopathology and genetic alterations. Cancer Research. 74, 6980-6990 (2014).
- Fleming, J. M., et al. Local regulation of human breast xenograft models. Journal of Cellular Physiology. 224, 795-806 (2010).
- Hoffman, R. M. Patient-derived orthotopic xenografts: better mimic of metastasis than subcutaneous xenografts. Nature Reviews Cancer. 15, 451-452 (2015).
- Jung, J., Seol, H. S., Chang, S. The Generation and Application of Patient-Derived Xenograft Model for Cancer Research. Cancer Research and Treatment. 50, 1-10 (2018).
- Sivanand, S., et al. A validated tumorgraft model reveals activity of dovitinib against renal cell carcinoma. Science Translational Medicine. 4, 137-152 (2012).
- Pavía-Jiménez, A., Tcheuyap, V. T., Brugarolas, J. Establishing a human renal cell carcinoma tumorgraft platform for preclinical drug testing. Nature Protocols. 9, 1848-1859 (2014).
- Fridman, R., Benton, G., Aranoutova, I., Kleinman, H. K., Bonfil, R. D. Increased initiation and growth of tumor cell lines, cancer stem cells and biopsy material in mice using basement membrane matrix protein (Cultrex or Matrigel) co-injection. Nature Protocols. 7, 1138-1144 (2012).
- Cutz, J. C., et al. Establishment in severe combined immunodeficiency mice of subrenal capsule xenografts and transplantable tumor lines from a variety of primary human lung cancers: potential models for studying tumor progression-related changes. Clinical Cancer Research. 12, 4043-4054 (2006).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Research. 73, 5315-5319 (2013).
- Butler, K. A., et al. Prevention of Human Lymphoproliferative Tumor Formation in Ovarian Cancer Patient-Derived Xenografts. Neoplasia. 19, 628-636 (2017).
- Cao, X., et al. Defective lymphoid development in mice lacking expression of the common cytokine receptor gamma chain. Immunity. 2, 223-238 (1995).
- Dobbin, Z. C., et al. Using heterogeneity of the patient-derived xenograft model to identify the chemoresistant population in ovarian cancer. Oncotarget. 5, 8750-8764 (2014).
- Choi, Y. Y., et al. Establishment and characterisation of patient-derived xenografts as paraclinical models for gastric cancer. Scientific Reports. 6, 22172 (2016).
- Malaney, P., Nicosia, S. V., Davé, V. One mouse, one patient paradigm: New avatars of personalized cancer therapy. Cancer Letters. 344, 1-12 (2014).
- Rosfjord, E., Lucas, J., Li, G., Gerber, H. P. Advances in patient-derived tumor xenografts: from target identification to predicting clinical response rates in oncology. Biochemical Pharmacology. 91, 135-143 (2014).
- Braekeveldt, N., Bexell, D. Patient-derived xenografts as preclinical neuroblastoma models. Cell and Tissue Research. 372, 233-243 (2018).
- 'Perez-Soler, R., et al. Response and determinants of sensitivity to paclitaxel in human non-small cell lung cancer tumors heterotransplanted in nude mice. Clinical Cancer Research. 6, 4932-4938 (2000).
- Fichtner, I., et al. Anticancer drug response and expression of molecular markers in early-passage xenotransplanted colon carcinomas. European Journal of Cancer. 40, 298-307 (2004).
- Gao, H., et al. High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response. Nature Medicine. 21, 1318-1325 (2015).
- Izumchenko, E., et al. Patient-derived xenografts effectively capture responses to oncology therapy in a heterogeneous cohort of patients with solid tumors. Annals of Oncology. 28, 2595-2605 (2017).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discovery. 1, 508-523 (2011).
- Mengelbier, L. H., et al. Intratumoral genome diversity parallels progression and predicts outcome in pediatric cancer. Nature Communications. 27, 6125 (2015).
- McGranahan, N., Swanton, C. Clonal Heterogeneity and Tumor Evolution: Past, Present, and the Future. Cell. 168, 613-628 (2017).
- Marusyk, A., et al. Non-cell-autonomous driving of tumour growth supports sub-clonal heterogeneity. Nature. 514, 54-58 (2014).
- Braekeveldt, N., et al. Neuroblastoma patient-derived orthotopic xenografts reflect the microenvironmental hallmarks of aggressive patient tumours. Cancer Letters. 375, 384-389 (2016).
- DeRose, Y. S., et al. Tumor grafts derived from women with breast cancer authentically reflect tumor pathology, growth, metastasis and disease outcomes. Nature Medicine. 17, 1514-1520 (2011).
- Das Thakur, M., et al. Modelling vemurafenib resistance in melanoma reveals a strategy to forestall drug resistance. Nature. 494, 251-255 (2013).
- Girotti, M. R., et al. Application of Sequencing, Liquid Biopsies, and Patient-Derived Xenografts for Personalized Medicine in Melanoma. Cancer Discovery. 6, 286-299 (2016).
- Murphy, S. J., et al. Mate pair sequencing of whole-genome-amplified DNA following laser capture microdissection of prostate cancer. DNA Research. 19, 395-406 (2012).
- Smadbeck, J. B., et al. Copy number variant analysis using genome-wide mate-pair sequencing. Genes Chromosomes and Cancer. 57, 459-470 (2018).
- Kovtun, I. V., et al. Lineage relationship of Gleason patterns in Gleason score 7 prostate cancer. Cancer Research. 73, 3275-3284 (2013).
- Paster, E. V., Villines, K. A., Hickman, D. L. Endpoints for mouse abdominal tumor models: refinement of current criteria. Comparative Medicine. 59, 234-241 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9, 671-675 (2012).
- Cheng, Y., et al. MK-2206, a novel allosteric inhibitor of Akt, synergizes with gefitinib against malignant glioma via modulating both autophagy and apoptosis. Molecular Cancer Therapeutics. 11, 154-164 (2012).
- Rivera, V. M., et al. Ridaforolimus (AP23573; MK-8669), a potent mTOR inhibitor, has broad antitumor activity and can be optimally administered using intermittent dosing regimens. Molecular Cancer Therapeutics. 10, 1059-1071 (2011).
- Heitjan, D. F., Manni, A., Santen, R. J. Statistical analysis of in vivo tumor growth experiments. Cancer Research. 53, 6042-6050 (1993).
- Vargas, R., et al. Case study: patient-derived clear cell adenocarcinoma xenograft model longitudinally predicts treatment response. NPJ Precision Oncology. 2, 14 (2018).
- Harris, F. R., et al. Targeting HER2 in patient-derived xenograft ovarian cancer models sensitizes tumors to chemotherapy. Molecular Oncology. 13, 132-152 (2019).
- Fidler, I. J., et al. Modulation of tumor cell response to chemotherapy by the organ environment. Cancer and Metastasis Reviews. 13, 209-222 (1994).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved