Method Article
Testando terapias-alvo em câncer usando análise estrutural de alteração de DNA e xenoenxertos derivados do paciente
Neste Artigo
Resumo
Aqui apresentamos um protocolo para testar a eficácia de terapias-alvo selecionadas com base na composição genômica de um tumor. O protocolo descreve a identificação e validação de rearranjos estruturais de DNA, o enxerto dos tumores dos pacientes em camundongos e as respostas de teste a medicamentos correspondentes.
Resumo
Apresentamos aqui uma abordagem integrativa para testar a eficácia de terapias-alvo que combina a próxima geração de sequenciamento technolo-gies, análises de alvos terapêuticos e monitoramento de resposta a medicamentos usando xenoenxertos derivados do paciente (PDX). Essa estratégia foi validada usando tumores ovarianos como exemplo. O protocolo de sequenciamento de próxima geração (MPseq) foi utilizado para identificar alterações estruturais e seguido pela análise de alterações potencialmente direcionadas. Tumores humanos cultivados em camundongos imunocomprometidos foram tratados com drogas selecionadas com base nas análises genômicas. Os resultados demonstraram uma boa correlação entre as respostas previstas e as observadas no modelo PDX. A abordagem apresentada pode ser utilizada para testar a eficácia de tratamentos combinados e auxiliar o tratamento personalizado para pacientes com câncer recorrente, especificamente nos casos em que a terapia padrão falha e há a necessidade de usar medicamentos fora do rótulo.
Introdução
Os xenoenxertos derivados do paciente (PDXs), gerados a partir da implantação de pedaços de tumores de pacientes em camundongos imunodeficientes, emergiram como um poderoso modelo pré-clínico para ajudar o cuidado anticâncológico personalizado. Modelos PDX foram desenvolvidos com sucesso para uma variedade de malignidades humanas. Estes incluem câncer de mama e ovário, melanoma maligno, câncer colorretal, adenocarcinoma pancreático e câncer de pulmão de células não pequenas1,,2,3,,4,5. O tecido tumoral pode ser implantado ortotopicamente ou heterototopicamente. O primeiro, considerado mais preciso, mas tecnicamente difícil, envolve transplante diretamente no órgão de origem tumoral. Acredita-se que esses tipos de modelos imitam precisamente a histologia do tumor original devido ao microambiente "natural" para o tumor6,,7. Por exemplo, o transplante ortotópico na bursa do ovário do camundongo resultou na disseminação do tumor na cavidade peritoneal e na produção de ascites, típicas do câncer de ovário8. Da mesma forma, a injeção de tumores mamários no torácico em vez da glândula mamária abdominal afetou a taxa de sucesso do PDX e o comportamento9. No entanto, modelos ortotópicos requerem sistemas de imagem sofisticados para monitorar o crescimento do tumor. A implantação heterotópica do tumor sólido é tipicamente realizada implantando tecido no flanco subcutâneo de um camundongo que permite um monitoramento mais fácil do crescimento do tumor e é menos caro e demorado7. No entanto, os tumores cultivados subcutânea raramente metástases ao contrário do observado no caso da implantação ortotópica10.
A taxa de sucesso do enxerto tem sido demonstrada para variar e depende muito do tipo de tumor. Tumores mais agressivos e amostras de tecidos contendo um maior percentual de células tumorais foram relatados com melhores taxas de sucesso12,13. Consistente com isso, tumores derivados de sítios metastáticos mostraram-se engrafados em frequências de 50 a 80%, enquanto os de locais primários engrafam em frequências tão baixas quanto 14%12. Em contraste, tecidos contendo células necrosas e menos células tumorais viáveis se inerverem mal. O crescimento tumoral também pode ser promovido pela adição de proteínas da matriz de membrana do porão na mistura tecidual no momento da injeção em camundongos14 sem comprometer as propriedades do tumor original. O tamanho e o número de peças de tecido destinadas à implantação também foram encontrados para afetar a taxa de sucesso do enxerto. Maiores taxas de acolhimento de tumores foram relatadas para implantação na cápsula sub-renal em comparação com a implantação subcutânea devido à capacidade da cápsula sub-renal de manter o estroma tumoral original e fornecer as células estromais hospedeiras, bem como15.
A maioria dos estudos usa camundongos imunodeficientes NOD/SCID, que não possuem células assassinas naturais16 e têm sido mostrados para aumentar o enenxerto tumoral, crescimento e metástase em comparação com outras cepas14. No entanto, é necessário um monitoramento adicional, pois eles podem desenvolver linfomas tímicos entre 3 e 4 meses de idadeaos 13 anos. Em transplantes de tumores ovarianos cultivados em camundongos SCID, o crescimento das células B foi inibido com sucesso pelo rituximabe, impedindo o desenvolvimento de linfomas, mas sem impactar o enxerto de tumores ovarianos17.
Mais recentemente, NSG (NOD. CamundongosCG-Prkdcscid Il2rgtm1Wjl/SzJ, carregando uma mutação nula no gene que codifica a cadeia gama de receptores 2 interleucina2,tornou-se uma cepa frequentemente usada para a geração de modelos PDX. Tumores de modelos PDX estabelecidos passagens para as gerações futuras de camundongos são relatados para reter propriedades histológicas e moleculares por 3 a 6 gerações19,20. Inúmeros estudos têm demonstrado que os desfechos do tratamento em modelos PDX imitam os de seus pacientes correspondentes2,3,4,21,22,23. A taxa de resposta à quimioterapia em modelos PDX para câncer de pulmão não pequeno e carcinomas colorretais foi semelhante à dos ensaios clínicos para os mesmos fármacos24,25. Estudos realizados em modelos PDX, desenvolvidos para pacientes matriculados em ensaios clínicos, demonstraram respostas a medicamentos testados semelhantes aos observados clinicamente em pacientes correspondentes2,,3,4.
Análises genômicas de alto rendimento de um tumor paciente em conjunto com modelos PDX fornecem uma ferramenta poderosa para estudar correlações entre alterações genômicas específicas e uma resposta terapêutica. Estes foram descritos em algumas publicações26,27. Por exemplo, respostas terapêuticas ao inibidor de EGFR cetuximab em um conjunto de modelos PDX colorretal que carregam amplificação EGFR, respostas clínicas paralelas ao cetuximabe em pacientes28.
Existem alguns desafios associados ao desenvolvimento e aplicação de modelos PDX. Entre eles está a heterogeneidade tumoral29,30 que pode comprometer a precisão da interpretação da resposta ao tratamento como um único clone celular com maior capacidade proliferativa dentro de um PDX pode superar os outros31,resultando assim em uma perda de heterogeneidade. Além disso, quando biópsias de tumores individuais são usadas para desenvolver PDX, algumas das populações celulares podem ser perdidas e não serão representadas no enxerto final. Várias amostras do mesmo tumor são recomendadas para implantação para resolver este problema. Embora os tumores PDX tendem a conter todos os tipos celulares do tumor doador original, essas células são gradualmente substituídas pelas de origem murina3. A interação entre as células murinas e tumorais humanas em modelos PDX não é bem compreendida. No entanto, as células estromas foram mostradas para recapitular o microambiente tumoral33.
Apesar dessas limitações, os modelos PDX permanecem entre as ferramentas mais valiosas para pesquisa translacional, bem como medicamentos personalizados para a seleção de terapias de pacientes. As principais aplicações de PDXs incluem a descoberta de biomarcadores e testes de drogas. Os modelos PDX também são usados com sucesso para estudar mecanismos de resistência a medicamentos e identificar estratégias para superar a resistência a medicamentos34,35. A abordagem descrita no presente manuscrito permite ao pesquisador identificar potenciais alvos terapêuticos em tumores humanos e avaliar a eficácia de medicamentos correspondentes invivo, em camundongos que abrigam tumores engrafados que inicialmente foram caracterizados genomicamente. O protocolo usa tumores ovarianos engrafados intraperitoneally, mas é aplicável a qualquer tipo de tumor suficientemente agressivo para crescer em camundongos2,,3,12.
Protocolo
Tecidos frescos de pacientes com câncer de ovário foram coletados no momento da cirurgia de debulking de acordo com um protocolo aprovado pelo Mayo Clinic Institutional Review Board (IRB). Todos os procedimentos e tratamentos animais utilizados neste protocolo foram aprovados pelo Comitê Institucional de Atenção e Uso de Animais da Clínica Mayo (IACUC) e seguiram as orientações de cuidados com animais.
1. Sequenciamento e análises do par mate
NOTA: O tecido congelado fresco ou flash deve ser usado para o sequenciamento do par de mate (MPseq). O material incorporado à parafina não é adequado porque contém DNA fragmentado.
- Isolar DNA do tecido tumoral congelado. Utilizar amostra humana original obtida a partir de material cirúrgico ou biópsia36.
- Use 1000 ng de DNA para fazer bibliotecas MPseq e sequência como 2 amostras por pista no sequenciador de próxima geração (ver Tabela de Materiais)36.
- Analise os dados usando um conjunto de algoritmos para detectar grandes aberrações cromossômicas (exclusões, inserções, amplificações, inversões e translocações) conforme descrito anteriormente36,37.
2. Seleção de alvos terapêuticos
- Use a ferramenta Panda de acesso aberto (Pathway and Anotação) ou uma ferramenta análoga para identificar alterações direcionadas (http://bioinformaticstools.mayo.edu/Panda).
- Faça uma lista de genes que são identificados pelo MSeq como alterados, como um simples arquivo delimitado por guias, usando símbolos genéticos aceitos padrão.
NOTA: O exemplo incluído apresenta a análise de amplificações e ganhos. - Adicione um sinal "#" à linha de cabeçalho da lista para garantir que o cabeçalho da tabela seja transferido para a visualização do nível de caminho do software.
- Carregue o arquivo clicando na guia de navegação Configuração de anotação upload.
- Atribua um único ícone ao menu para representar os dados subjacentes clicando no ícone de escolha e, em seguida, clicando na guia Finalizar.
- Após o upload dos arquivos de anotação, identifique uma coluna que exibe o número de genes anotados por caminho. Esta é a última coluna à direita.
- Use o Filtro de Caminho no canto superior esquerdo da janela principal para mostrar caminhos que contenham genes de interesse.
- Identifique caminhos que tenham genes mais anotados do que o esperado por acaso. Use a função localizada sob a guia Enriquecimento.
- Selecione um banco de dados para exibir genes potencialmente drogados da Anotação Preset, verificando um ícone apropriado à esquerda da janela principal (por exemplo, DGIdb, PharmGKB).
- Selecione caminho para visualização clicando em seu nome exibido na página Visualização do Caminho.
NOTA: Ícones que representam cada conjunto de anotações são mostrados ao lado do gene associado. Clique no gene de interesse para abrir a página correspondente do GeneCards. - Selecione as vias que mostraram os genes de interesse anotados (ou seja, alterados em um determinado tumor) e "hits" para potenciais medicamentos para análise posterior.
- Faça uma lista de genes que são identificados pelo MSeq como alterados, como um simples arquivo delimitado por guias, usando símbolos genéticos aceitos padrão.
- Use um banco de dados contendo medicamentos aprovados para aplicação clínica (https://clinicaltrials.gov/) para cruzar os alvos identificados.
- Priorizar alterações direcionadas para novos testes em modelos PDX realizando uma revisão de literatura (por exemplo, PubMed) para confirmar relevância para a biologia de um determinado tipo de tumor.
3. Validação de rearranjos genômicos por sequenciamento PCR e Sanger
- Primers de design usando leituras de sequenciamento obtidas a partir de dados MPseq.
- Selecione uma junção de interesse para a validação (ou seja, potencial alvo terapêutico) com base nas análises do MPseq.
- Projete primers direcionalmente para que o amplicon contenha a junção. Projete 2 primers em cada lado da junção, para um total de 4, para aumentar as chances de amplificar a junção.
NOTA: Primers de nome de acordo com a localização do caso e do cromossomo. - Use parâmetros PCR padrão para o design primer e um software de escolha. Selecione a temperatura de fusão (60-62 °C) e o teor de GC (40-60%). Certifique-se de que a sequência de primer não forma primer dimers, palíndromos ou laços de grampo de cabelo.
- Confirme que a sequência de primer carece de homologia para outras áreas do genoma humano, verificando-o usando BLAT (http://genome.ucsc.edu/cgi-bin/hgBlat?command=start).
- Execute um PCR para amplificar a junção de juros.
- Diluir primers com água a 10 mM e combinar 10 mL de cada primer para que cada primer dianteiro seja emparelhado com cada primer reverso em uma mistura de primer.
NOTA: As sequências dos primers para o exemplo selecionado são mostradas na Tabela 1. - Rotular tubos de tira de 0,2 mL como: C1, T1, C2, T2, C3, T3, C4 e T4 onde C=controlam DNA genômico humano (comercial), DNA T=Tumor, isolado do paciente ou tumor PDX, e o número indica a mistura de primer.
- Adicione 1 mL de cada mistura de primer em seus tubos rotulados.
- Prepare o mastermix Taq combinando reagentes listados na Tabela 2, deixando a enzima no congelador até que seja necessário, adicionando-a à mistura na extremidade.
- Faça 2 misturas mestras, uma para cada modelo de DNA, controle DNA humano e DNA tumoral. Adicione 24 mL de cada mistura mestre Taq ao seu respectivo tubo de tira. O volume total de reação é de 25 mL. Vórtice muito brevemente e, em seguida, girar o tubo de tira para baixo.
- Execute um PCR em um termociclador. Use os parâmetros mostrados na Tabela 3. Ajuste a temperatura de ressarcial para que seja pelo menos 1 °C mais fria do que a temperatura de fusão dos primers.
- Armazene o produto PCR completo a -20 °C (longo prazo) ou refrigerado a 4 °C (curto prazo) até que seja necessário.
- Realize a eletroforese a 1-5 V/cm para visualizar o produto PCR usando um gel de 1,5% de agarose. Deixe 2 mL aliquot do produto a ser usado para sequenciamento Sanger.
- Diluir primers com água a 10 mM e combinar 10 mL de cada primer para que cada primer dianteiro seja emparelhado com cada primer reverso em uma mistura de primer.
- Realize o sequenciamento de Sanger para confirmar a junção e identificar o ponto de ruptura exato38.
- Use o produto PCR se o PCR gerar um único produto (banda). Alternativamente, corte a banda de gel, purifique e submeta para sequenciamento Sanger junto com o primer usado para amplificação.
NOTA: Os tumores para os quais foram realizadas análises genômicas são utilizados para implantação em camundongos.
- Use o produto PCR se o PCR gerar um único produto (banda). Alternativamente, corte a banda de gel, purifique e submeta para sequenciamento Sanger junto com o primer usado para amplificação.
4. Enxerto e manutenção de tumores
- Configure os preparativos para engrafar tumores em modelos de mouse PDX. Selecione para tumores de engrafamento para os quais as análises genômicas serão ou foram realizadas.
- Certifique-se de que uma infraestrutura de suporte esteja em vigor no momento do início do desenvolvimento de quaisquer modelos PDX, incluindo instalações de laboratório e animais dedicadas, equipe técnica qualificada e procedimentos operacionais padrão detalhados.
- Garantir o transporte rápido e o processamento dos espécimes como velocidade é crucial para a viabilidade celular e o enxerto bem-sucedido.
- Use um ambiente estéril para reduzir a contaminação bacteriana e fúngica para processamento e engrafia amostras.
- Manuseie os espécimes humanos com cautela, de acordo com as políticas institucionais relativas a materiais potencialmente de risco biológico, pois podem abrigar patógenos transportados pelo sangue.
- Prepare o tecido (0,5-0,7 cm3 de tamanho) para enxerto, colocando a amostra cirúrgica em um tubo pré-refrigerado de 50 mL com 20 mL de mídia de cultura tecidual.
NOTA: O tecido tumoral pode ser fresco ou recuperado de material previamente criopreservado5. - Confirme o conteúdo do tumor na amostra consultando um patologista.
- Coloque o tecido tumoral em um prato contendo 10-15 mL de PBS frio, ou meios de cultura tecidual como RPMI 1640 ou DMEM contendo antibióticos (1% penicilina e estreptomicina).
- Identificar e isolar material tumoral viável do tecido normal e necrosado adjacente com a ajuda de um patologista. Use fórceps e bisturi estéreis para remover material necrosado apontado por um patologista.
NOTA: O tumor pode ser implantado intraperitonealmente ou subcutâneamente nos camundongos. Siga o passo 4.2 para realizar uma implantação intraperitoneal ou pule para a etapa 4.3 para realizar um enxerto subcutâneo. Neste estudo, as terapias-alvo selecionadas com base em análises genômicas foram testadas em uma série de modelos de PDX para câncer de ovário soros de alto grau com implantação intraperitoneal.
- Prepare o tecido para implantação intraperitoneal (IP) que picar o tecido com fórceps estéreis e um bisturi no gelo para fazer peças de aproximadamente 1-1,5 mm3 de tamanho e misturando-se com meio de cultura fria. Injete 0,3-0,5 mL de chorume tumoral usando uma agulha de calibre 16-17.
NOTA: Todos os procedimentos cirúrgicos são realizados utilizando técnicas assépticas. Luvas estéreis, instrumentos estéreis, suprimentos e materiais implantados foram usados para reduzir a probabilidade de infecção.- Misture as peças 1:1 com o meio de cultura gelada e injete 100 mL intraperitoneally em pelo menos três camundongos SCID femininos.
- Corte o tecido tumoral para enxerto subcutâneo usando fórceps estéreis, bisturi ou tesoura cirúrgica em pequenos fragmentos, aproximadamente 2 x 2 x 2 mm de tamanho, e transfira os tecidos fragmentados para uma placa de Petri pré-refrigerada no gelo.
- Adicione a matriz de membrana fria do porão no prato com o tecido fragmentado (aproximadamente 200 mL por 10 pedaços de tecido), misture bem e deixe os fragmentos de tecido absorverem a matriz de membrana fria por 10 minutos.
- Anestesiar 5 camundongos NOD/SCID femininos para prepará-los para enxerto.
- Injete a cada rato intraperitonealmente com cetamina (150 mg/kg) e combinação de xilazina (10 mg/kg).
- Confirme se o mouse está devidamente anestesiado beliscando a ponta da cauda com fórceps atraumáticas.
- Remova suavemente o mouse anestesiado da câmara e coloque no mouse um cone de nariz que tenha entrada do vaporizador e saída do sistema de limpeza de gás residuais.
- Coloque pomada veterinária nos olhos do rato para evitar o ressecamento enquanto estiver sob anestesia. Prepare a área onde a cirurgia será realizada. Use técnica asséptica para realizar a cirurgia.
- Certifique-se de que a superfície em que a cirurgia vai tomar não é porosa, selada e é desinfetada antes da cirurgia.
- Iniciar a cirurgia com instrumentos estéreis (por autoclave, gás ou esterilização química).
- Use luvas para manusear instrumentos e manter a esterilidade das pontas do instrumento durante todo o procedimento, submergindo-as no etanol entre as etapas da cirurgia.
- Esterilize o local cirúrgico aplicando 3 esfoliantes alternados de iodo e álcool. Use uma tesoura cirúrgica estéril e fórceps para fazer uma incisão vertical de pele de 5-10 mm em ambos os flancos de um rato.
- Insira fórceps retos suavemente no espaço subcutâneo para criar um bolso grande o suficiente para que um fragmento de tumor seja colocado sob a almofada de gordura.
- Use as fórceps retas estéreis para inserir fragmentos de tumor no bolso previamente preparado em cada um dos 5 camundongos.
NOTA: Coloque 3-4 pedaços de tecido tumoral em um bolso. - Feche as incisões da pele usando cola tecidual.
- Injete intraperitonealmente cada camundongo com 100 mL de Rituximabe após a implantação para inibir a proliferação de linfócitos.
- Coloque o rato em uma gaiola sob uma lâmpada de calor por aproximadamente 20 minutos até se recuperar da anestesia. Monitore os sinais vitais do mouse e garanta sua hidratação suficiente.
- Devolva o rato para a companhia de outros ratos depois que ele se recuperou da anestesia e começou a ter comida e água. Prestar assistência pós-operatória e monitoramento de acordo com as diretrizes institucionais. Verifique se há sinais de dor e angústia diariamente por 3 dias consecutivos após a cirurgia.
NOTA: Os critérios para dor ou angústia incluem necrose ou ulceração, perda de peso/pontuação da condição corporal, sinais comportamentais como nível de atividade, função motora e postura. - Verifique rotineiramente os camundongos quanto à formação de tumores quinzenalmente até que os tumores atinjam o tamanho de 0,5 cm de diâmetro, medido por uma pinça.
- Avalie o escore de saúde de cada camundongo derivado da aparência, comportamento e condição corporal39. Use pontuações de ≤6 como critério para que camundongos moribundos sejam sacrificados pela inalação de dióxido de carbono.
5. Testar respostas a alvos genomicamente identificados em modelos PDX
- Inicie os tratamentos direcionados selecionados quando os tumores são palpáveis e atingem 0,5 cm3, medidos por um ultrassom.
- Antes de realizar uma ultrassonografia do abdômen, remova a pele abdominal do rato e aplique lubrificante de geleia estéril.
- Use uma máquina de ultrassom com um transdutor para obter imagens com o tumor posicionado em seção transversal. Faça 3 medições por sessão para cada animal e faça uma média do valor para uma avaliação mais precisa do tamanho do tumor.
- Analise as imagens usando o software disponível40.
- Administrar quimioterapia consistindo de uma mistura de carboplatina a 51 mg/kg e paclitaxel a 15 mg/kg intraperitoneal (IP) uma vez por semana para uma duração total do tratamento de 4-6 semanas. Certifique-se de que o volume total de injeção não exceda 0,2 mL.
- Faça uma solução de estoque MK-220641 em 30% de ciclodextrina (por exemplo, Captisol) e entregue via gavage oral a 120 mg/kg diariamente por 4 semanas consecutivas.
- Prepare o rato para gavage oral, prendendo-o beliscando a pele das costas e prendendo-o para trás, para que a cabeça e os membros do rato sejam imobilizados.
- Insira a sonda gavage na parte de trás da garganta do mouse até que a sonda atinja o esôfago. Certifique-se de que a sonda não está inserida muito longe, pois os pulmões do rato podem perfurar, causando a morte.
- Faça uma solução de estoque MK-866942 em etanol a 25 mg/mL. Dilui-o em um veículo contendo 5,2% Tween 80, 5,2% PEG400 em água estéril para injeções de IP a 10 mg/kg por 5 dias a cada duas semanas, com duração total do tratamento de 4 semanas.
NOTA: O volume injetado em camundongos deve ser de 50-120 mL, dependendo do peso do animal. - Use 7-8 camundongos por grupo de tratamento para ter poder estatístico suficiente para detectar diferenças43,44.
- Avalie o peso corporal e a condição geral dos camundongos na terapia diariamente. Reter drogas se o peso de um animal cair 20% ou mais do peso inicial.
- Avalie o tamanho do tumor semanalmente usando ultrassom. Certifique-se de que o indivíduo que realiza o monitoramento do crescimento do tumor está cego ao tratamento para garantir a pontuação imparcial das respostas.
NOTA: Laboratórios menores podem empregar 2 pessoas diferentes para administrar o tratamento e o monitoramento por ultrassom.
Resultados
Tecidos de tumores ovarianos ressecados no momento das cirurgias de debulking foram coletados de acordo com a orientação do IRB e utilizados para 1) caracterização genômica e 2) enenerxerto em camundongos imunocomprometidos(Figura 1). O protocolo de sequenciamento de pares de mate36,37 foi usado para identificar alterações estruturais no DNA, incluindo perdas, ganhos e amplificações. Uma trama representativa do genoma ilustrando uma paisagem de alterações genômicas em um tumor (designado como OC101) é mostrada na Figura 2. Típicos de tumores de subtipos soros de alto grau, foram observados ganhos múltiplos (linhas azuis) e supressões (linhas vermelhas), indicando altos níveis de instabilidade genômica, bem como perdas e ganhos cromossômicos, indicativos de aneuploidia. Em média, 300-700 alterações são identificadas em tumores de subtipo séricos de alto grau45. Análises subsequentes revelaram algumas alterações de DNA que eram potencialmente direcionadas com drogas clinicamente relevantes. A alteração mais bem classificada para intervenção terapêutica no tumor OC101 foi uma amplificação no cromossomo 17 envolvendo ERBB2 (Figura 2 e Figura 3A). ERBB2 é um gene que codifica o receptor HER2 que é conhecido por dimerização com EGFR, HER3 ou HER4 para ativar vias de sinalização RAS/ERK e PI3K/AKT e promover o crescimento celular, migração celular e invasão. Os inibidores her2 (por exemplo, anticorpos monoclonais pertuzumabe e trastuzumab) são eficazes no tratamento de pacientes com câncer de mama quando tumores superexpressam a proteína HER2. A terapia anti-HER2 para câncer de ovário, no entanto, não é aprovada pela FDA.
A comparação do perfil genômico do tumor dos pacientes doadores(Figura 1)com o de um modelo PDX correspondente (não mostrado) revelou uma semelhança impressionante, consistente com todos os estudos anteriores relatando a proximidade molecular dos tumores originais com seus derivados PDX.
Para validar os resultados do MPseq no nível do DNA, vários conjuntos de primers específicos foram projetados para as bordas da região amplificada contendo o gene ERBB2, e o PCR foi realizado usando DNA isolado do tumor original, bem como de um tumor propagado por várias gerações nos camundongos. Uma imagem de gel representativa de produtos amplificados usando dois conjuntos diferentes de primers é mostrada na Figura 3B. Nenhuma banda foi detectada quando o DNA genômico normal agrupado (designado como C), que não continha amplificação do lócus ERBB, foi amplificado. A purificação dos produtos do sequenciamento de gel e Sanger (não mostrado) confirmou ainda mais a alteração prevista pelo MPseq. Outra validação foi realizada examinando a expressão da proteína HER2 no tumor PDX correspondente utilizando imunoblotação. A análise revelou um alto nível de proteína HER2 (o resultado não é mostrado), consistente com a amplificação observada do gene ERBB2.
No DNA de um tumor ovariano diferente (designado T14) foram observados inúmeros ganhos regionais. Entre eles estão os genes AKT2 e RICTOR(Figura 3C). Ambos eram de grande interesse do ponto de vista terapêutico como inibidores da AKT2 e mTOR, com as quais a RICTOR associa, estão disponíveis e atualmente em ensaios clínicos. Como não havia leituras de pares de mate que abrangem as proximidades de qualquer gene, a simples validação do PCR do ganho detectado pelo MPseq não foi possível. Testamos, portanto, o nível de expressão das proteínas correspondentes por imunoblotação. Elevados níveis de AKT e RICTOR(Figura 3D)sugerindo que o tratamento com drogas-alvo é justificado.
Para testar a sensibilidade deste tumor aos inibidores de AKT e mTOR, os camundongos PDX com tumor T14 implantado intraperitoneal foram expandidos e randomizados para receber apenas quimioterapia (carboplatina/paclitaxel) ou uma combinação de quimioterapia com inibidor pan-AKT MK-220641 ou inibidor mTOR MK-866942. A quimioterapia foi dada aos camundongos no braço de combinação durante 2 semanas antes da adição da terapia-alvo(Figura 4). As medições de ultrassom foram feitas semanalmente para monitorar a regressão/crescimento do tumor.
Cada braço de tratamento continha nada menos que 7 ratos. Esse número foi suficiente para observar diferenças nas respostas entre os grupos, mantendo os custos do estudo em uma marca consideravelmente menor. Menos camundongos (três a quatro) podem ser usados no grupo controle não tratado, uma vez que variações individuais na taxa de crescimento do tumor são insignificantes e o crescimento é normalizado para um tamanho tumoral no qual o tratamento em outros braços começa.
Não foi observada diferença entre grupos tratados com quimioterapia e não tratados nas primeiras 3 semanas de observação (não mostrados). Observou-se redução significativa da carga tumoral (mediana de 58%) no grupo tratado de quimioterapia até o final da semana 6. Um benefício extra apenas sobre a quimioterapia foi observado em grupos que receberam uma combinação de quimioterapia com terapias-alvo. A diferença tornou-se evidente nas semanas 4 e 3 para MK-8669 (Figura 4A) e MK-2206 (Figura 4B), respectivamente.
Os animais foram eutanizados e o tecido tumoral foi coletado para análises moleculares da resposta ao tratamento no final do ensaio de tratamento na semana 7. Para isso, foram determinadas as quantidades de S6 quinase total e fosforilada (Figura 5A,B),AKT e mTOR(Figura 5C,D) por meio da imunoblotação. A proteína ribossômica S6 quinase é um mensageiro a jusante da via AKT-mTOR, conhecida por ser regulada e fosfoilada após a estimulação do eixo AKT-mTOR por fatores de crescimento para promover a sobrevivência e o crescimento das células. A comparação dos níveis dessas proteínas em tumores PDX não tratados ou tratados com quimioterapia com camundongos que receberam inibidores de AKT ou mTOR mostrou uma diminuição acentuada nos dois últimos(Figura 5),indicando eficácia da terapia-alvo no nível molecular. Ajustes no regimento de tratamento, no que diz respeito ao tempo de aplicação para os medicamentos combinados e duração da terapia, devem ser feitos e testados para obter melhores respostas.
| Nome do Primer | Seqüência | Primer Mix | Primers combinados | ||
| OC101 17a-17b R1 | CTGGTCCTGGGAAATAGACACACAATCATC | 1 | OC101 F1 e R1 | ||
| OC101 17a-17b R2 | GCTCAAGACAGTAACACCTAGTTGATTCTGC | 2 | OC101 F1 e R2 | ||
| OC101 17b-17a F1 | GGATTACGGGAACGTGCTACCTTG | 3 | OC101 F2 e R1 | ||
| OC101 17b-17a F2 | AATGCCCTAGCAGTTCTATCCCCACTG | 4 | OC101 F2 e R2 | ||
Tabela 1: Primers utilizados para a validação da alteração OC101chromosome 17.
| Reagente | Quantidade para adicionar para 1 reação (μL) | Quantidade para adicionar para 4 reações (μL). [Multiplique por 4.3 para fazer o suficiente para cada mix de primer (4)] |
| Água sem nuclease | 20.45 | 89.94 |
| Tampão de 10x (Easy A) | 2.5 | 10.75 |
| dNTPs 10 mM | 0.5 | 2.15 |
| DNA do modelo (concentração >10 ng/μL) | 0.3 | 1.29 |
| Polimerase Taq | 0.25 | 1.08 |
Tabela 2: Configuração pcr para validar uma junção.
| Temperatura (C) | Hora | |
| 94 | 5 min. | |
| 94 | 40 s | 35 ciclos |
| 59 | 40 s | |
| 72 | 2 min. | |
| 72 | 5 min. | |
| 4 | Segurar |
Tabela 3: Condições de ciclismo para PCR para validar uma junção.
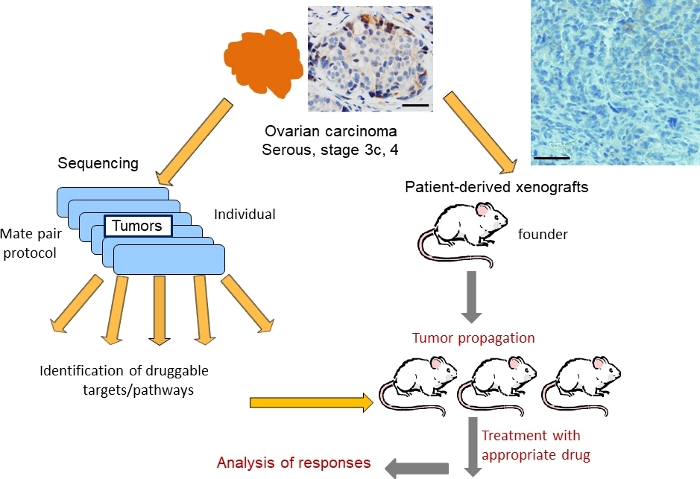
Figura 1: Representação esquemática da estratégia para testes de terapia genomicamente guiados usando modelos PDX para carcinoma ovariano sérico. A coloração de H&E do tumor ovariano é mostrada (topo). Escala barra=100 mm. Clique aqui para ver uma versão maior desta figura.

Figura 2: Caracterização genômica de tumores ovarianos usando MPseq. Enredo de genoma mostrando a paisagem de alterações estruturais e alterações numébios de cópia, conforme detectado pelo MPseq. O eixo X abrange o comprimento do cromossomo com o número de posição cromossomo mostrado. Cada cromossomo é indicado no eixo Y direito e esquerdo. A altura dos traços horizontais para cada cromossomo indica o número de leituras detectadas para janelas de par de base de 30k. Os números de cópias de DNA são indicados por cor, com cinza representando o estado de cópia normal de 2N, vermelho correspondente a exclusões e ganhos azuis. A conexão de linhas pretas corresponde a rearranjos cromossômicos. Alterações no lócus ERBB2 são retratadas. Clique aqui para ver uma versão maior desta figura.
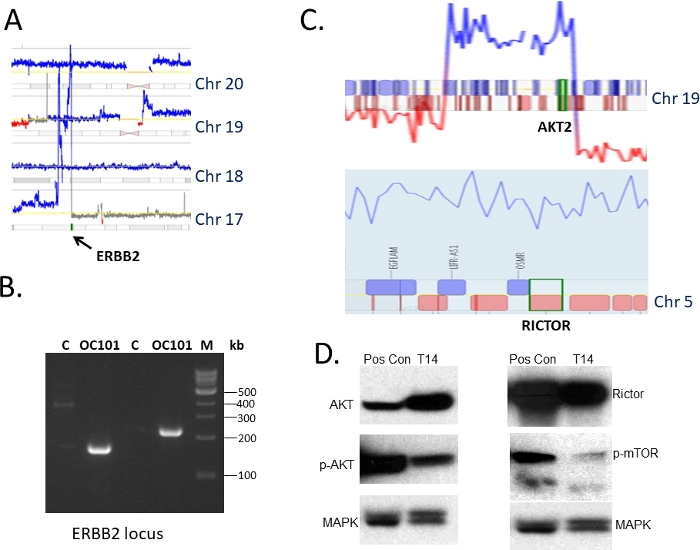
Figura 3: Seleção de alterações direcionadas e sua validação. (A) Um segmento de close-up da trama do genoma mostrado em Fig.1 ilustrando uma amplificação do gene ERBB2 no cromossomo 17 (em azul). Os números dos cromossomos são como indicado. (B) Análise de validação de pontos de interrupção no lócus ERBB2 identificado por MPseq utilizando amplificação PCR. C é um controle de DNA genômico agrupado, OC101 é DNA do tumor do paciente, M é uma escada de DNA. (C) Um close-up de segmentos da trama do genoma para outro tumor ovariano mostrando ganhos (indicados por linha azul) no lócus AKT (superior) e no gene RICTOR (inferior). Cromossomos são como indicado. (D) Análise de validação da expressão de proteínas da via AKT/mTOR por imunoblotação utilizando tecido tumoral de PDX (T14), foram utilizadas alterações genômicas para as quais são retratadas em C. 30 mg de proteína total e anticorpos específicos para AKT, RICTOR, p-mTOR. MAPK serviu como um controle de carregamento. Pos con é um tumor independente usado como controle positivo. Clique aqui para ver uma versão maior desta figura.
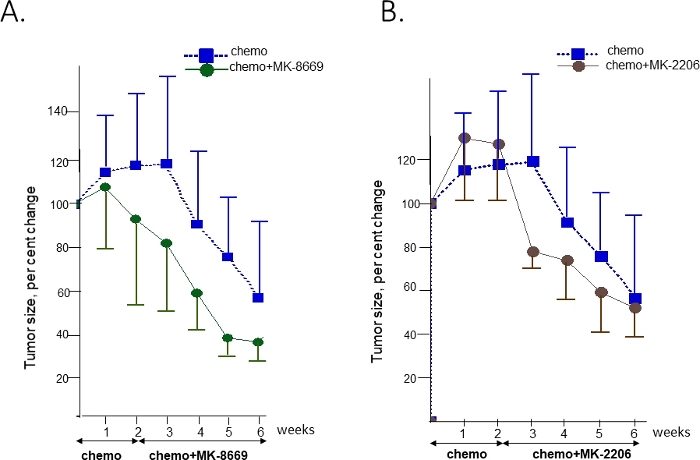
Figura 4: A comparação das respostas apenas à quimioterapia e combinada com a terapia-alvo em tumores que abrigam ganhos em genes AKT2 e RICTOR com drogas correspondentes. Respostas de tratamento a uma combinação de quimioterapia e anti-mTOR droga MK-8669 (A) ou inibidor de pan-AKT MK2206 (B) versus quimioterapia sozinho. O tempo de administração para cada tratamento e a duração são mostrados pelas setas. Os volumes são expressos como percentual do volume inicial no início do tratamento como média +/- SD. Quimioterapia é quimioterapia. Clique aqui para ver uma versão maior desta figura.

Figura 5: Comparação das alterações moleculares provocadas por cada tratamento conforme determinado pela análise de imunoblotação. (A) Os níveis de S6 e phospho-S6, o efeito a jusante da via AKT-mTOR são mostrados. Foram utilizados 30 mg de proteína total e anticorpo específico para S6 e p-S6. GAPDH foi usado como controle de carga. Quantificação dos níveis de proteína normalizados ao nível GAPDH é mostrada em (B) (C) Níveis de mTOR, p-mTOR, AKT e p-AKT detectados pela imunoblotação. GAPDH foi usado como controle de carga. (D) Quantificação dos níveis de proteína normalizados para o nível GAPDH. NT não é tratada, quimioterapia é quimioterapia. Clique aqui para ver uma versão maior desta figura.
Discussão
Descrevemos a abordagem e os protocolos que usamos para realizar um "ensaio clínico" em modelos PDX que se aproveita das características moleculares do tumor obtidas pelo perfil genômico para determinar a melhor escolha de medicamentos para testes. Várias plataformas de sequenciamento são atualmente usadas para caracterização genômica de tumores primários, incluindo sequenciamento de genoma inteiro, RNAseq e painéis genéticos personalizados. Para carcinoma ovariano de alto grau, mPseq para identificar alterações estruturais, rearranjos de DNA e alterações numécles de número de cópia, é particularmente útil devido ao alto grau de instabilidade genômica observado neste tipo de tumor. A segunda vantagem da plataforma MPseq é que ela cobre todo o genoma, mas custa significativamente menos do que outras tecnologias abrangentes de sequenciamento. O MPseq, no entanto, não é adequado para detecção de mutação de pontos, pois a cobertura base não é suficiente, atingindo apenas 8-10x. Uma das limitações do uso do MPseq sozinho para caracterização genômica de um tumor é a presença de complexos rearranjos cromossômicos agrupados, análises que não predizem a expressão de genes impactados de interesse. Uma junção detectada pelo MPseq prevista para criar um gene putativo de fusão que valida no DNA pelo PCR pode não ser expressa por causa de uma mudança de quadro ou pequenas exclusões e inserções na região do promotor. Da mesma forma, os ganhos cromossômicos e amplificações para potenciais alvos terapêuticos devem ser cuidadosamente avaliados e validados no nível de RNA ou proteína para garantir a expressão do gene de interesse.
Embora, a composição molecular do tumor seja amplamente preservada após a propagação em camundongos por várias gerações, mudanças nos níveis de expressão de genes-chave podem ocorrer ao longo do tempo, refletindo a evolução do tumor, seleção clonal ou resposta adaptativa ao ambiente murino. Assim, a validação de uma alteração destinada à intervenção terapêutica tanto no tumor doador original quanto no tumor PDX é fundamental. Para tumores isolados de modelos PDX tanto RNA quanto proteína podem ser usados para interrogar o nível de expressão, pois o material é abundante. Qualquer um pode ser escolhido para cruzar a expressão no tumor original, dependendo da disponibilidade e tipo do tecido armazenado, e disponibilidade de anticorpos para a detecção de proteína correspondente. O modelo PDX é especificamente inestimável em terapias de combinação de testes, pois o ajuste in vivo permite o monitoramento de efeitos adversos, bem como ajustes de dosagem ou duração no regime de tratamento.
A escolha entre enxerto ortotópico e subcutâneo pode ser feita dependendo das questões específicas abordadas no estudo. No entanto, é importante ter em mente que a sensibilidade dos tumores xenoengrafados à terapêutica pode ser modulada pelo local da implantação46. Por outro lado, ainda não foram relatadas evidências sobre a descoberta de medicamentos que mostram uma resposta terapêutica em modelos ortotópicos, mas ausentes em PDX9subcutâneamente implantado .
Divulgações
Os autores declaram que não têm conflito de interesses.
Agradecimentos
Agradecemos aos membros do Mayo Clinic Center for Individualized Medicine (CIM) Dr. Lin Yang e Faye R. Harris, MS, pela ajuda na realização de experimentos. Este trabalho foi apoiado pelo Presente do Sr. e Sra. Neil E. Eckles para o Mayo Clinic Center for Individualized Medicine (CIM).
Materiais
| Name | Company | Catalog Number | Comments |
| 3M Vetbond | 3M, Co. | 1469SB | |
| anti-AKT antibody | Cell Signaling Technologies, Inc. | 9272 | |
| Anti-GAPDH antibody(G-9) | Santa Cruz Biotech. Inc. | sc-365062 | |
| Anti-MAPK antibody | Cell Signaling Technologies, Inc. | 9926 | |
| Anti-phospho-AKT antibody | Cell Signaling Technologies, Inc. | 9271 | |
| Anti-mTOR antibody | Cell Signaling Technologies, Inc. | 2972 | |
| Anti-Phospho-mTOR antibody | Cell Signaling Technologies, Inc. | 2971 | |
| Anti-Phospho-S6 antibody | Cell Signaling Technologies, Inc. | 4858 | |
| Anti-Rictor antibody | Cell Signaling Technologies, Inc. | 2114 | |
| Anti-S6 antibody | Cell Signaling Technologies, Inc. | 2217 | |
| Captisol | ChemScene, Inc. | cs-0731 | |
| Carboplatin | NOVAPLUS, Inc. | 61703-360-18 | |
| DMEM | Mediatech, Inc. | 10-013-CV | |
| Easy-A Hi-Fi PCR Cloning Enzyme | Agilent, Inc. | 600404-51 | |
| Lubricant | Cardinal Healthcare | 82-280 | |
| Matrigel | Corning, Inc. | 356234 | |
| McCoy's media | Mediatech, Inc. | 10-050-CV | |
| MK-2206 | ApexBio, Inc. | A3010 | |
| MK-8669 | ARIAD Pharmaceuticals, Inc. | AP23573 | |
| Nair Sensitive Skin | Church & Dwight Co. | Nair Hair Remover Shower Power Sensitive | |
| NOD/SCID mice | Charles River, Inc. | NOD.CB17-Prkdcscid/NCrCrl | |
| Paclitaxel | NOVAPLUS, Inc. | 55390-304-05 | |
| PEG400 | Millipore Sigma, Inc. | 88440-250ML-F | |
| Perjeta | Genetech, Co. | Pertuzumab | |
| Rituximab | Genetech, Co. | Rituxan | |
| RPMI1640 | Mediatech, Inc. | 10-040-CV | |
| SCID mice | Harlan Laboratories, Inc. | C.B.-17/IcrHsd-PrkdcscidLystbg | |
| SLAx 13-6MHz linear transducer | FUJIFILM SonoSite, Inc | HFL38xp | |
| SonoSite S-series Ultrasound machine | FUJIFILM SonoSite, Inc | SonoSite SII | |
| Tween 80 | Millipore Sigma, Inc. | P4780-100ML |
Referências
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nature Reviews Clinical Oncology. 9, 338-350 (2012).
- Marangoni, E., et al. A new model of patient tumor-derived breast cancer xenografts for preclinical assays. Clinical Cancer Research. 13, 3989-3998 (2007).
- Zhang, X., et al. A renewable tissue resource of phenotypically stable, biologically and ethnically diverse, patient-derived human breast cancer xenograft models. Cancer Research. 73, 4885-4897 (2013).
- Hidalgo, M., et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discovery. 4, 998-1013 (2014).
- Weroha, S. J., et al. Tumorgrafts as in vivo surrogates for women with ovarian cancer. Clinical Cancer Research. 20, 1288-1297 (2014).
- Rubio-Viqueira, B., et al. Optimizing the development of targeted agents in pancreatic cancer: tumor fine-needle aspiration biopsy as a platform for novel prospective ex vivo drug sensitivity assays. Molecular Cancer Therapeutics. 6, 1079-1088 (2007).
- Rubio-Viqueira, B., Hidalgo, M. Direct in vivo xenograft tumor model for predicting chemotherapeutic drug response in cancer patients. Clinical Pharmacology and Therapeutics. 85, 217-221 (2009).
- Ricci, F., et al. Patient-derived ovarian tumor xenografts recapitulate human clinicopathology and genetic alterations. Cancer Research. 74, 6980-6990 (2014).
- Fleming, J. M., et al. Local regulation of human breast xenograft models. Journal of Cellular Physiology. 224, 795-806 (2010).
- Hoffman, R. M. Patient-derived orthotopic xenografts: better mimic of metastasis than subcutaneous xenografts. Nature Reviews Cancer. 15, 451-452 (2015).
- Jung, J., Seol, H. S., Chang, S. The Generation and Application of Patient-Derived Xenograft Model for Cancer Research. Cancer Research and Treatment. 50, 1-10 (2018).
- Sivanand, S., et al. A validated tumorgraft model reveals activity of dovitinib against renal cell carcinoma. Science Translational Medicine. 4, 137-152 (2012).
- Pavía-Jiménez, A., Tcheuyap, V. T., Brugarolas, J. Establishing a human renal cell carcinoma tumorgraft platform for preclinical drug testing. Nature Protocols. 9, 1848-1859 (2014).
- Fridman, R., Benton, G., Aranoutova, I., Kleinman, H. K., Bonfil, R. D. Increased initiation and growth of tumor cell lines, cancer stem cells and biopsy material in mice using basement membrane matrix protein (Cultrex or Matrigel) co-injection. Nature Protocols. 7, 1138-1144 (2012).
- Cutz, J. C., et al. Establishment in severe combined immunodeficiency mice of subrenal capsule xenografts and transplantable tumor lines from a variety of primary human lung cancers: potential models for studying tumor progression-related changes. Clinical Cancer Research. 12, 4043-4054 (2006).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Research. 73, 5315-5319 (2013).
- Butler, K. A., et al. Prevention of Human Lymphoproliferative Tumor Formation in Ovarian Cancer Patient-Derived Xenografts. Neoplasia. 19, 628-636 (2017).
- Cao, X., et al. Defective lymphoid development in mice lacking expression of the common cytokine receptor gamma chain. Immunity. 2, 223-238 (1995).
- Dobbin, Z. C., et al. Using heterogeneity of the patient-derived xenograft model to identify the chemoresistant population in ovarian cancer. Oncotarget. 5, 8750-8764 (2014).
- Choi, Y. Y., et al. Establishment and characterisation of patient-derived xenografts as paraclinical models for gastric cancer. Scientific Reports. 6, 22172(2016).
- Malaney, P., Nicosia, S. V., Davé, V. One mouse, one patient paradigm: New avatars of personalized cancer therapy. Cancer Letters. 344, 1-12 (2014).
- Rosfjord, E., Lucas, J., Li, G., Gerber, H. P. Advances in patient-derived tumor xenografts: from target identification to predicting clinical response rates in oncology. Biochemical Pharmacology. 91, 135-143 (2014).
- Braekeveldt, N., Bexell, D. Patient-derived xenografts as preclinical neuroblastoma models. Cell and Tissue Research. 372, 233-243 (2018).
- 'Perez-Soler, R., et al. Response and determinants of sensitivity to paclitaxel in human non-small cell lung cancer tumors heterotransplanted in nude mice. Clinical Cancer Research. 6, 4932-4938 (2000).
- Fichtner, I., et al. Anticancer drug response and expression of molecular markers in early-passage xenotransplanted colon carcinomas. European Journal of Cancer. 40, 298-307 (2004).
- Gao, H., et al. High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response. Nature Medicine. 21, 1318-1325 (2015).
- Izumchenko, E., et al. Patient-derived xenografts effectively capture responses to oncology therapy in a heterogeneous cohort of patients with solid tumors. Annals of Oncology. 28, 2595-2605 (2017).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discovery. 1, 508-523 (2011).
- Mengelbier, L. H., et al. Intratumoral genome diversity parallels progression and predicts outcome in pediatric cancer. Nature Communications. 27, 6125(2015).
- McGranahan, N., Swanton, C. Clonal Heterogeneity and Tumor Evolution: Past, Present, and the Future. Cell. 168, 613-628 (2017).
- Marusyk, A., et al. Non-cell-autonomous driving of tumour growth supports sub-clonal heterogeneity. Nature. 514, 54-58 (2014).
- Braekeveldt, N., et al. Neuroblastoma patient-derived orthotopic xenografts reflect the microenvironmental hallmarks of aggressive patient tumours. Cancer Letters. 375, 384-389 (2016).
- DeRose, Y. S., et al. Tumor grafts derived from women with breast cancer authentically reflect tumor pathology, growth, metastasis and disease outcomes. Nature Medicine. 17, 1514-1520 (2011).
- Das Thakur, M., et al. Modelling vemurafenib resistance in melanoma reveals a strategy to forestall drug resistance. Nature. 494, 251-255 (2013).
- Girotti, M. R., et al. Application of Sequencing, Liquid Biopsies, and Patient-Derived Xenografts for Personalized Medicine in Melanoma. Cancer Discovery. 6, 286-299 (2016).
- Murphy, S. J., et al. Mate pair sequencing of whole-genome-amplified DNA following laser capture microdissection of prostate cancer. DNA Research. 19, 395-406 (2012).
- Smadbeck, J. B., et al. Copy number variant analysis using genome-wide mate-pair sequencing. Genes Chromosomes and Cancer. 57, 459-470 (2018).
- Kovtun, I. V., et al. Lineage relationship of Gleason patterns in Gleason score 7 prostate cancer. Cancer Research. 73, 3275-3284 (2013).
- Paster, E. V., Villines, K. A., Hickman, D. L. Endpoints for mouse abdominal tumor models: refinement of current criteria. Comparative Medicine. 59, 234-241 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9, 671-675 (2012).
- Cheng, Y., et al. MK-2206, a novel allosteric inhibitor of Akt, synergizes with gefitinib against malignant glioma via modulating both autophagy and apoptosis. Molecular Cancer Therapeutics. 11, 154-164 (2012).
- Rivera, V. M., et al. Ridaforolimus (AP23573; MK-8669), a potent mTOR inhibitor, has broad antitumor activity and can be optimally administered using intermittent dosing regimens. Molecular Cancer Therapeutics. 10, 1059-1071 (2011).
- Heitjan, D. F., Manni, A., Santen, R. J. Statistical analysis of in vivo tumor growth experiments. Cancer Research. 53, 6042-6050 (1993).
- Vargas, R., et al. Case study: patient-derived clear cell adenocarcinoma xenograft model longitudinally predicts treatment response. NPJ Precision Oncology. 2, 14(2018).
- Harris, F. R., et al. Targeting HER2 in patient-derived xenograft ovarian cancer models sensitizes tumors to chemotherapy. Molecular Oncology. 13, 132-152 (2019).
- Fidler, I. J., et al. Modulation of tumor cell response to chemotherapy by the organ environment. Cancer and Metastasis Reviews. 13, 209-222 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados