Method Article
Внутритековая доставка антисмысловых олигонуклеотидов в центральной нервной системе Крысы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы описываем метод доставки лекарств в центральную нервную систему крыс путем имплантации катетера в поясничное внутричебное пространство позвоночника. Мы ориентируемся на доставку антисмысловых олигонуклеотидов, хотя этот метод подходит и для доставки других терапевтических способов.
Аннотация
Гематоэнцефалический барьер (BBB) является важной защитой от входа потенциально токсичных или патогенных агентов из крови в центральную нервную систему (ЦНС). Однако его существование также значительно снижает доступность системно управляемых терапевтических агентов для ЦНС. Один из способов преодоления этого, заключается в том, чтобы вводить эти агенты непосредственно в спинномозговой жидкости (CSF), таким образом, в обход BBB. Это может быть сделано путем имплантации катетера либо для непрерывного вливания с помощью осмотического насоса, или для одной доставки болюса. В этой статье мы описываем хирургический протокол для доставки CNS-таргетинга антисмысловых олигонуклеотидов (ASOs) через катетер имплантированных непосредственно в cauda equina пространство взрослого позвоночника крысы. В качестве репрезентативного результата мы показываем эффективность одной инъекции болюса ASO внутритековой (ИТ) через эту систему катетеризации в сбивании целевой РНК в различных регионах крысы ЦНС. Процедура безопасна, эффективна и не требует дорогостоящего оборудования или хирургических инструментов. Описанный здесь метод может быть адаптирован для доставки наркотиков в других условиях.
Введение
Сосудистая система центральной нервной системы (ЦНС) превратилась в критический регулятор гомеостаза, контролирующий движение молекул, снабжающий питательными веществами и избавляющийся от отходов. Эта система также является первой линией защиты от атак внешних патогенов, благодаря плотному распределению плотных узлов вдоль стен эндотелиальных клеток. Эти плотные соединения составляют один аспект гематоэнцефалического барьера (BBB). В то время как BBB позволяет транспортировать молекулы, необходимые для удовлетворения потребностей в питательных веществах и энергии (например, ионы, глюкоза), он также избирательно ограничивает прохождение патогенных микроорганизмов, а также токсичных химических веществ1,2,3.
По иронии судьбы, та же защитная функция BBB, что ограничивает прохождение патогенных микроорганизмов и токсичных химических веществ также является основным препятствием для нашей способности легко получить доступ к ЦНС с терапевтическим лечением после системного введения в организм2, 4,5. Эта роль BBB побудила развитие множества новых технологий распределения наркотиков и подходов6.
Один из способов преодолеть это препятствие заключается в том, чтобы вводить наркотики непосредственно в спинномозговой жидкости (CSF), которая постоянно пронизывает как головной и спинной мозг7,8,9,10. В этой статье мы описываем метод успешной доставки агентов в пояснично-поясничное внутреннее пространство, поместив внутренний конец катетера полностью в cauda equina пространстве крысиного позвоночника. Описание этой процедуры было ранее опубликовано Mazur et al. в другом месте11.
Протокол является очень эффективным и производит более 90% успеха антисмысловых олигонуклеотидов (ASO) доставки в ЦНС при оценке количественной полимеразы цепной реакции (qPCR) анализ целевого гена нокдаун8. Процедура вызывает минимальный дискомфорт для животных, так как 100% крыс выживают в хирургии и показывают минимальный отек вокруг хирургической раны и никаких признаков бедствия (например, гиперактивность, обезвоживание, кружение, потеря равновесия, снижение приема пищи, и обезвоживание) во время послеоперационного наблюдения. Еще одним преимуществом описанного здесь метода является то, что он не требует ни дорогостоящего оборудования, ни каких-либо специальных инструментов.
протокол
Все процедуры in vivo были выполнены в соответствии с утвержденными протоколами Biogen Institutional Animal Use and Care Committee (IACUC), которые соответствуют руководящим принципам, изложенным в руководстве Национальных институтов здравоохранения Соединенных Штатов по уходу и использованию лабораторных животных.
1. Подготовка материалов и инструментов
- Подготовьте специальные направляющие канюли.
- Используйте роторный инструмент с отрезанным колесом (или острой пилой), чтобы отрезать два конца иглы 19 G, в результате чего направляющая канюля длиной 1,5-2 см(рисунок 1Aiii). Используйте шлифовающее колесо вращающегося инструмента, чтобы сгладить два конца.
ПРИМЕЧАНИЕ: Кроме того, предварительно изготовленные и стерильные консервы руководства могут быть приобретены у коммерческого поставщика (Таблица материалов).
- Используйте роторный инструмент с отрезанным колесом (или острой пилой), чтобы отрезать два конца иглы 19 G, в результате чего направляющая канюля длиной 1,5-2 см(рисунок 1Aiii). Используйте шлифовающее колесо вращающегося инструмента, чтобы сгладить два конца.
- Подготовьте сборку катетера/провода.
- Вырезать 8 см длиной кусок PE-10 трубки (полиэтиленовые трубки, диаметр 0,011 дюйма), чтобы служить в качестве интратекального катетера. Сделайте отметку 2 см с одного конца с помощью этанола устойчивостью маркерпер. Вырезать 11 см длиной стиль проволоки из политетрафторетилена покрытием из нержавеющей стали провода. Вставьте провод stylet(Рисунок 1Aii) в просвет катетера PE-10(рисунок 1Ай).
ПРИМЕЧАНИЕ: Один катетер / провод сборки набор(Рисунок 1Av) необходимо для каждого животного. Кроме того, катетеры и провода stylet могут быть приобретены у коммерческого поставщика(Таблица материалов).
- Вырезать 8 см длиной кусок PE-10 трубки (полиэтиленовые трубки, диаметр 0,011 дюйма), чтобы служить в качестве интратекального катетера. Сделайте отметку 2 см с одного конца с помощью этанола устойчивостью маркерпер. Вырезать 11 см длиной стиль проволоки из политетрафторетилена покрытием из нержавеющей стали провода. Вставьте провод stylet(Рисунок 1Aii) в просвет катетера PE-10(рисунок 1Ай).
- Подготовьте сборку катетера доставки.
- Вырезать кусок катетера PE-50 (5-10 см, полиэтиленовые трубки, диаметр 0,023 дюйма)(рисунок 1Bi). На один конец катетера PE50 вставьте 23 G трубный адаптер(рисунок 1Biv). Этот конец будет соединен со шприцем 100 л(Таблица материалов) во время операции. Вставьте модифицированную иглу 30 G с отсеченным концентратором(рисунок 1Biii) в кусок PE-10(рисунок 1Bii)и соедините трубку PE-10 с другим концом катетера.
- 30 G иглы конце доставки катетер сборки(Рисунок 1Bv) будет подключен к дистальный конец имплантированного PE-10 катетер в крысы во время операции.
ПРИМЕЧАНИЕ: Кроме того, сборка катетера доставки(рисунок 1Bv)может быть приобретена у коммерческого поставщика(Таблица материалов).
- Подготовьте направляющий cannula-иглы сборки (Рисунок 1Ави) путем размещения направляющей канюли (Рисунок 1Aiii) в конце 23 G иглы.
- Стерилизовать все хирургические инструменты, включая направляющий канюлю и наборы провода/катетера с помощью стерилизатора оксида этилена на 12 ч.
ПРИМЕЧАНИЕ: Все хирургические инструменты, кроме катетера, могут быть аутоклавированы; катетер растает при высокой температуре.
2. Хирургическая подготовка
ПРИМЕЧАНИЕ: Эта процедура обычно выполняется на мужчин и женщин Sprague Dawley крыс с массой тела между 200 г и 400 г. Две крысы размещаются в клетке под 12 ч свет / темный цикл с бесплатным доступом к пище и воде.
- Вес крысы и поместить его в изофларанкамеру, чтобы вызвать анестезию (1'5% изолюран в O2, титр для эффекта).
ПРИМЕЧАНИЕ: Крыса затем постоянно анестезируется с изофлюраном для поддержания глубокой анестезии через носовой конус на протяжении всей процедуры. Альтернативный метод анестезии (например, введение кетамина 100 мг/кг и ксилазина 10 мг/кг) может быть использован в соответствии с одобренным IACUC. - Когда крыса не в состоянии реагировать на щепотку ног, брить спиной от хвоста к хвостовой грудной отдел позвоночника и место бритая крыса на стерильный лист положил на верхней части грелки.
- Позиция 50 мл конической центрифуги трубки под брюшной полостью крысы, чтобы сгибать позвоночник в поясничной области(рисунок2)и применять офтальмологическую мазь для глаз.
- Вводят устойчивый высвобождение бупренорфин (1,0 мг/кг; Таблица материалов) подкожно в крысы. Очистите обнажённую кожу с чередующимися скрабы и алкоголем и повторите это три раза.
ПРИМЕЧАНИЕ: Альтернативное обезболивание может быть использовано в порядке, утвержденном протоколом IACUC. - Drape животное с стерильной прозрачной драпировки, которая была fenestrated над хирургическим сайтом.
3. Хирургия
- С крысой поддерживается 50 мл конической трубки, определить две естественные ямы между мышцами выше таза (стрелки на рисунке 2A). С одной стороны, держа эти ямы, использовать другую руку, чтобы мягко нажмите и почувствовать позвоночник от каудаля до рострального направления и найти первый крупный отступ между позвонками, и это межпозвонковое пространство между S1 и L6 позвонков (Рисунок 2B ).
- Перемещение немного промежутке, чтобы определить следующий отступ, межпозвонковое пространство между l5 и L6 позвонков и инъекций (к рисунку 2A). Используйте скальпель, чтобы сделать разрез не более 2 см в длину в кожу вдоль средней линии от ростральной до каудальной так, что место инъекции находится в центре разреза (пунктирная линия на рисунке 2А).
- Используйте ножницы для вскрытия, чтобы вскрыть соединительную ткань, чтобы визуализировать мышечный слой. Затем сделайте 1 см разрез в мышечной капсуле сразу боковой спинной спинной процесс поясничного позвонка L6.
ПРИМЕЧАНИЕ: Кости поясничного позвонка L6 могут быть визуализированы в этой точке. - Расположите направляющий канюля-иглы сборки вблизи передней аспект 6-го поясничного позвонка и нажмите его в межпозвонковом пространстве вдоль передней аспект 6-го позвонка так, что конец иглы проникает в позвоночный канал. Нажмите направляющей канюли на месте вдоль иглы и удалите 23 G иглы оставляя только направляющий канюли на месте.
ПРИМЕЧАНИЕ: Полезно использовать тупые щипцы, чтобы найти процесс дозалока поясничного позвонка L6 перед вставкой иглы. Как правило, жидкость CSF можно увидеть ввода иглы концентратор (эта жидкость может быть оттенком с намеком крови, но это не означает, что вред был нанесен или что игла не помещается правильно). Авторы не видели большое количество крови или сильное кровотечение во время этой процедуры. Если любое происходит, ветеринар должен связаться, чтобы определить соответствующее лечение и если животные должны быть усыплены. - Вставьте катетер-проводсборки в направляющий канюли. Угол вниз катетер-провод сборки примерно на 45 "угол спинного канала и силы конца примерно 0,3 см в позвоночного канала.
- Удалите направляющий канюли, оставив катетер со стилю провода на месте. Удалите провод стиле примерно 2,5 см от внутритековой кончик катетера и заранее катетер в позвоночный канал, пока 2 см знак находится на входе в канал (просто видимый ниже мышц), как показано на рисунке 1Bvi.
ПРИМЕЧАНИЕ: Вставленный катетер должен распространяться на субарахноида. Успешное размещение должно обеспечить свободное движение катетера в этом пространстве. - Полностью снять стилизованный провод, и CSF можно увидеть ввод имплантированного катетера.
- Подключите сборку катетера доставки к дистальной концу имплантированного катетера через конец иглы 30 G(рисунок 1Bv,vi).
- Загрузите 60 л стерильного солей в шприц объемом 100 л (флешинг шприц). Загрузите болюс в 30 л испытательного соединения (например, раствор ASO) во второй шприц (инъекционный шприц).
- Подключите шприц (загруженный сольником) к концу адаптера трубопровода доставки(рисунок 1Bv). Вводят 20 л стерильного солья в внутритекальное пространство (прединъекционная промывка).
- Подключите инъекционный шприц (загруженный испытательным соединением) к концу адаптера трубопровода доставки(рисунок 1Bv). Впрысните 30 л испытательного соединения в внутритекатое пространство более 30 с.
ПРИМЕЧАНИЕ: Обычный объем инъекций ASO составляет 30 Зл для достижения хорошего нокдауна в спинном мозге и в коре головного мозга. Было сообщено, что объемы инъекций может повлиять на соединение распределения12, хотя различные объемы инъекций не были протестированы. Если используется другое соединение или объем, безопасность и эффективность должны быть эмпирически определены. - Повторите шаг 3.10 и промойте катетер еще с 40 зл и сытости солей (после инъекции промывки). Затем отсоедините сборку катетера доставки от имплантированного катетера.
ПРИМЕЧАНИЕ: До и после инъекции флеш, как полагают, уменьшить локальное секвестр соединений и улучшить их распределение в ростральных структур12. - Асептические вырезать и тепла печать имплантированного катетера: Поместите пару стерильных щиптов рассечения в стерилизатор абий, пока они не очень жарко, а затем зажать вниз на трубку с горячим концом щиптем.
ПРИМЕЧАНИЕ: Это действие расплавит катетер. Таким образом, отверстие в трубке разрушается и все стороны прилипают друг к другу, уплотнение труб в асептической моды, а затем он помещается в подкожное пространство. - Используйте абсорбируемые швы монофиплата для обеспечения оставшегося теплозащитного катетера в соединительной ткани. Затем используйте неабсорбируемые швы монофилом, чтобы закрыть кожу над защищенным тепло-запечатанным катетером.
ПРИМЕЧАНИЕ: Зажимы для ран также могут быть использованы в порядке, утвержденном протоколом IACUC. Техника совместима с повторными инъекциями, хотя она используется только для одноразовых инъекций в наших руках. Осуществимость повторных инъекций должна быть эмпирически оценена с одобрения МАКУК. - Используйте марлю и солевой раствор для мытья крови из кожи и позволяют животному оправиться от наркоза в нагретом инкубаторе до мобильного, после чего оно возвращается в домашнюю клетку (две крысы на клетку).
ПРИМЕЧАНИЕ: При выполнении операций на нескольких крысах в тот же день, чистые инструменты с использованием воды для удаления крови и повторной стерилизации с помощью нагретого сухого стерилизатора биса (по крайней мере 20 с, со временем, чтобы охладить) между животными. Каждые 5 животных используется новый набор инструментов. - Мониторинг животных ежедневно, по крайней мере 3 дня после операции и продолжать следить за животными еженедельно после восстановления после операции в соответствии с протоколом IACUC.
ПРИМЕЧАНИЕ: Если какие-либо осложнения происходят (задержка мочи, разрез инфекций, неврологические расстройства, такие как захват или паралич), ветеринар должен связаться, чтобы определить соответствующее лечение и если животные должны быть усыплены. Если устойчивое высвобождение бупренорфин не используется, обезболивание должно быть дано ежедневно после операции в соответствии с протоколом IACUC.
4. Оценка ткани специфического нокдауна после инъекции ИТ
- Через две недели после инъекции ИТ-болуса АСО собирают различные участки мозга (т.е. коры головного мозга, стриатум и мозжечок), а также различные сегменты спинного мозга (т.е. шейки матки, грудной и поясничной). Извлекайте полную РНК ткани с помощью коммерческого комплекта экстракции РНК и выполняйте реакцию синтеза кДНК, как описано ранее13.
ПРИМЕЧАНИЕ: Стандартные реагенты были использованы для qPCR со следующими анализами: крыса Malat1 и крыса GAPDH. Относительные уровни стенограммы были рассчитаны с использованием метода 2-ЗКТ (КТ и порогового цикла).
Результаты
Используя описанный здесь метод, мы ввели две группы взрослых самок крыс (250-300 г; n - 10/группы) либо одним болюсом фосфатно-буферного солевой PBS, либо 300 мкг АСО, нацеленным на длинную некодирующую (linc) РНК Malat1; в нашей лаборатории мы регулярно используем Malat1 ASO в качестве инструмента соединения, потому что Malat1 выражается повсеместно и на высоком уровне во всех тканях14, включая мозг и спинной мозг. Malat1 ASO работает через механизм, опосредованный RNasH115, который ухудшает РНК, что приводит к нокдауну (KD). В описанном здесь эксперименте мы собрали различные участки мозга (т.е. кору головного мозга, стриатум и мозжечок), а также поясничный сегмент спинного мозга через две недели после родов АСО. РНК из каждого из собранных регионов была затем извлечена и проанализирована с помощью qPCR, чтобы оценить уровни экспрессии РНК Malat1.
Когда испытанный агент является ASO, мы рекомендуем: 1) всегда собирать несколько регионов ЦНС, для того, чтобы сравнить эффективность ASO; 2) учитывая техническую сложность хирургического метода, мы рекомендуем включить положительную контрольную группу, где параллельно тестируемому агенту тестируется соединение с хорошо зарекомендовавшими себя фармакокинетические и фармакодинамические свойства (т.е. Malat1 ASO в нашей лаборатории) это даст информацию об эффективности операций, если будут получены неожиданные или необъяснимые результаты (например, отсутствие или недостаточное регулирование РНК).
В эксперименте, описанном здесь, мы получили очень хороший KD во всех регионах собраны, как показано на рисунке 3. Тем не менее, мы наблюдали некоторую степень региональной изменчивости спинного мозга, показывающий самый высокий процент КД (кора головного мозга - 87% КД, стриатум - 77% КД, мозжечок - 74% КД, спинной мозг - 94% КД). Мы не получили доступ к in vivo нокдаун эффективности более чем на 2 недели после операции. В нашем опыте с несколькими ASOs, мы обнаружили значительный нокдаун целевых генов до 6-8 недель после операции (данные не показаны). Следует проводить исследование временных курсов, если интереспредставляет точная зависящая от времени эффективность данного АСО.
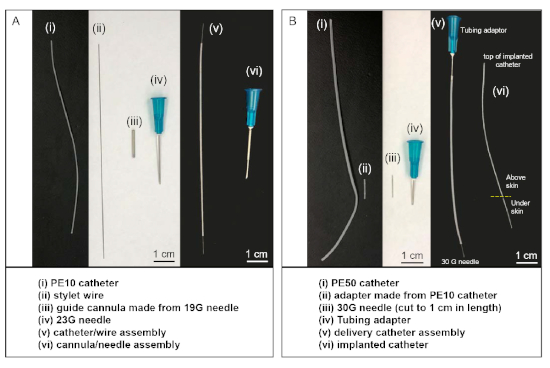
Рисунок 1: Индивидуальный материал и наборы катетеров, используемые в внутритековых инъекциях. (A) Катетер / провод сборки (v) производится путем вставки провода стиле (ii) в просвет PE-10 катетер (i). Канюла / игла сборки (vi) производится путем вставки 23 G иглы в просвет направляющей канюли (iii). (B) Сборка катетера доставки (v) производится путем подключения адаптера труб к одному концу катетера PE-50 и подключения разреза 30 G иглы в другой конец с помощью части катетера PE-10 (ii) в качестве адаптера. Во время операции, 30 G иглы конце доставки катетер сборки (v) подключен к верхней части имплантированного катетера (vi), после того, как другой конец имплантированного катетера вставляется в внутритекальное пространство животного. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Определение места инъекций и линии разреза. (A) С брюшной полости крысы поддерживается 50 мл конической трубки, две ямы между мышцами выше таза легко увидеть (стрелки). (B) С одной стороны, держа ямы, использовать другую руку, чтобы мягко нажмите и почувствовать позвоночник и найти межпозвонкового пространства между L5 и L6 позвонков, т.е. место инъекции (в панели А). Пунктирная линия в панели А показывает линию разреза с местом впрыска в ее центре. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Один болюс ИТ инъекции ASOs уменьшает крысы Malat1 in vivo. Мы ввели один болюс pbS или 300 мкг Malat1 ASO; через две недели после операции мы собрали различные области ЦНС и количественно уровни экспрессии РНК Malat1. Мы получили хорошую KD РНК Malat1 во всех проанализированных регионах, с некоторой изменчивостью между регионами (кора головного мозга , 87% KD, striatum 77% KD, мозжечок 74% KD, спинной мозг 94% KD; бары ошибок - SEM). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
В настоящей статье показан мощный метод доставки терапевтических агентов непосредственно в крысу ЦНС. В теории, аналогичный метод может быть выполнена и у мышей, хотя из-за меньшего размера, метод может быть более сложным. Таким образом, наша группа выполняет инъекции инtracerebroventricular (ICV) у мышей для доставки препарата ЦНС, которые достигают тех же целей через другой маршрут управления. Этот метод был описан в другом исследовании16.
Преимущество описанного здесь метода заключается в том, что он не требует ни дорогостоящего оборудования, ни каких-либо специальных инструментов. Мы рекомендуем заранее подготовить катетер/проводную сборку, показанную на рисунке 1А. Следует подготовить по крайней мере столько катетер / провод сборки, как Есть крысы в исследовании, хотя мы предлагаем подготовить некоторые дополнительные катетер / провод сборки в случае, если некоторые из них повреждены или должны быть заменены во время операции.
После того, как техника освоена, вся описанная процедура требует около 25 минут на крысу, что позволяет лечение многих крыс в течение одного дня. Если один человек выполняет операцию на первой крысы, а второй человек делает хирургическую подготовку на следующей крысы, две крысы могут быть обработаны в то же время, чтобы уменьшить время на животное. Для опытного оператора, есть еще небольшой шанс для иглы достичь эпидурального пространства вместо субарахноида. Наблюдение за обратным потоком CSF является хорошим показателем правильного положения иглы, но оно не является совершенным. Мы рекомендуем, чтобы целевой анализ участия, как анализ НОкдауна РНК, описанный в сессии результатов, должен быть выполнен для подтверждения правильной доставки испытательного соединения.
Создание методов, таких, как один описан здесь, имеет решающее значение для разработки надежного доклинического научно-исследовательского трубопровода, который может способствовать ЦНС-таргетинга терапии. Действительно, ИТ доставки AsOs в качестве терапевтического вмешательства является методом, который в настоящее время изучается для лечения многих расстройств ЦНС17,18,19,20. Nusinersen, ASO основе лечения спинальной мышечной атрофии (SMA) пациентов, недавно был одобрен на нескольких рынках по всему миру, демонстрируя применимость этого метода также для педиатрических пациентов21,22, 23.
Раскрытие информации
Авторами являются все сотрудники Biogen, Inc. или Ionis Pharmaceuticals. Авторы получают антисмысловые олигонуклеотиды, описанные в статье от Ionis Pharmaceuticals.
Благодарности
Мы хотели бы поблагодарить Ionis Pharmaceuticals за поставку АСО, описанных в статье.
Материалы
| Name | Company | Catalog Number | Comments |
| 3M Steri-Drape Small Drape with Adhesive Aperture | 3M | 1020 | |
| 70% ethanol | Decon Laboratories, Inc | 8416-160Z | |
| Alcohol swab sticks | Dynarex | NO 1204 | |
| BD General Use Syringes 1 mL Luer-Lok tip | BD | 1ml TB Luer-Lok tip | BD 302830 |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE50 Diameter 0.023 in | BD 427400 (10ft, Fischer Scientific 22-204008) or 427401 (100ft, Fischer Scientific 14-170-12P) |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE10 Diameter 0.011 in | BD 427410 (10ft, Fischer Scientific 14-170-11B) or 4274011 (100ft, Fischer Scientific 14-170-12B) |
| BD Intramedic PE Tubing Adapters | BD | 23 gauge intramedic luer stub adaper | BD 427565 or Fisher Scientific 14-826-19E |
| BD PrecisionGlide Single-use Needles 30G | BD | BD 305128 | |
| Buprenorphine Sustained Release-lab | ZooPharm | Prescription required | |
| Ethylene oxide sterilizer | Andersen Sterilizer INC. | AN 74i, gas sterilizer | AN 74i |
| Guide cannula | BD | 19G x 1 WT (1.1 mm x 25mm) needle | BD 305186 |
| Hamilton syringe 100ul | Hamilton company | Hamilton syringe 100ul | |
| Hot bead Sterilizer | Fine Science Tools | STERILIZER MODELNO FST 250 | |
| Ophthalmic ointment | Dechra veterranery product | 17033-211-38 | |
| Pocket Pro Pet Trimmer | Braintree Scientific | CLP-9931 B | |
| Povidone scrub | PDI | S48050 | |
| Saline | Baxter | Sodium Chloride 0.9% Intravenous Infusion BP 50ml | FE1306G |
| Scalpel | Feather | disposable scalpel | No. 10 |
| Small animal heating pad | K&H Manufacturing | Model # 1060 | |
| Stylet Wire | McMaster-Carr | 1749T14 | LH-36233780 |
| Surgery Towel drape | Dynarex | 4410 | |
| Surgical scissors and forceps | FST and Fisher Scientific | ||
| Sutures | Ethicon | 4-0 or 5-0 | |
| Tool to make the Guide cannular | Grainger | Rotary tool (Dremel) | 14H446 (Mfr: EZ456) |
| EZ lock cut off Wheel | 1PKX5 (Mfr: 3000-1/24) | ||
| Grinding Wheel, Aluminum Oxide | 38EY44 (Mfr: EZ541GR) | ||
| EZ lock Mandrel | 1PKX8 (Mfr: EZ402-01) | ||
| Diamond wheel floor Tile | 3DRN4 (Mfr: EZ545) | ||
| Alternative source for pre-made and sterilized materials for this procedure | |||
| Dosing catheter system | SAI Infusion Systems | RIDC-01 | |
| Guide cannula | SAI Infusion Systems | RIDC-GCA | |
| Internal Catheters | SAI Infusion Systems | RIDC-INC | |
| Stylet Wire | SAI Infusion Systems | RIDC-STY |
Ссылки
- Abbott, N. J. Dynamics of CNS barriers: evolution, differentiation, and modulation. Cellular and Molecular Neurobiology. 25 (1), 5-23 (2005).
- Greene, C., Campbell, M. Tight junction modulation of the blood brain barrier: CNS delivery of small molecules. Tissue Barriers. 4 (1), e1138017 (2016).
- Daneman, R., Engelhardt, B. Brain barriers in health and disease. Neurobiology of Disease. 107, 1-3 (2017).
- Ballabh, P., Braun, A., Nedergaard, M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiology of Disease. 16 (1), 1-13 (2004).
- Cardoso, F. L., Brites, D., Brito, M. A. Looking at the blood-brain barrier: molecular anatomy and possible investigation approaches. Brain Research Reviews. 64 (2), 328-363 (2010).
- Larsen, J. M., Martin, D. R., Byrne, M. E. Recent advances in delivery through the blood-brain barrier. Current Topics in Medicinal Chemistry. 14 (9), 1148-1160 (2014).
- Brinker, T., Stopa, E., Morrison, J., Klinge, P. A new look at cerebrospinal fluid circulation. Fluids Barriers CNS. 11, 10 (2014).
- Standifer, K. M., Chien, C. C., Wahlestedt, C., Brown, G. P., Pasternak, G. W. Selective loss of delta opioid analgesia and binding by antisense oligodeoxynucleotides to a delta opioid receptor. Neuron. 12 (4), 805-810 (1994).
- Wahlestedt, C., et al. Antisense oligodeoxynucleotides to NMDA-R1 receptor channel protect cortical neurons from excitotoxicity and reduce focal ischaemic infarctions. Nature. 363 (6426), 260-263 (1993).
- Wahlestedt, C., Pich, E. M., Koob, G. F., Yee, F., Heilig, M. Modulation of anxiety and neuropeptide Y-Y1 receptors by antisense oligodeoxynucleotides. Science. 259 (5094), 528-531 (1993).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. Journal of Neuroscience Methods. 280, 36-46 (2017).
- Wolf, D. A., et al. Dynamic dual-isotope molecular imaging elucidates principles for optimizing intrathecal drug delivery. Journal of Clinical Investigation Insight. 1 (2), e85311 (2016).
- Becker, L. A., et al. Therapeutic reduction of ataxin-2 extends lifespan and reduces pathology in TDP-43 mice. Nature. 544 (7650), 367-371 (2017).
- Zhang, X., Hamblin, M. H., Yin, K. J. The long noncoding RNA Malat1: Its physiological and pathophysiological functions. RNA Biology. 14 (12), 1705-1714 (2017).
- Crooke, S. T., Witztum, J. L., Bennett, C. F., Baker, B. F. RNA-Targeted Therapeutics. Cell Metabolism. 27 (4), 714-739 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326 (2013).
- McCampbell, A., et al. Antisense oligonucleotides extend survival and reverse decrement in muscle response in ALS models. Journal of Clinical Investigation. 128 (8), 3558-3567 (2018).
- Schoch, K. M., Miller, T. M. Antisense Oligonucleotides: Translation from Mouse Models to Human Neurodegenerative Diseases. Neuron. 94 (6), 1056-1070 (2017).
- Lane, R. M., et al. Translating Antisense Technology into a Treatment for Huntington's Disease. Methods in Molecular Biology. 1780, 497-523 (2018).
- Wurster, C. D., Ludolph, A. C. Antisense oligonucleotides in neurological disorders. Therapeutic Advances in Neurological Disorders. 11, (2018).
- Haché, M., et al. Intrathecal Injections in Children With Spinal Muscular Atrophy: Nusinersen Clinical Trial Experience. Journal of Child Neurology. 31 (7), 899-906 (2016).
- Goodkey, K., Aslesh, T., Maruyama, R., Yokota, T. Nusinersen in the Treatment of Spinal Muscular Atrophy. Methods in Molecular Biology. 1828, 69-76 (2018).
- Wurster, C. D., Ludolph, A. C. Nusinersen for spinal muscular atrophy. Therapeutic Advances in Neurological Disorders. 11, (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены