Method Article
Entrega intrathecal de oligonucleotides do antisense no sistema nervoso central do rato
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, descrevemos um método para entregar drogas ao sistema nervoso central do rato implantando um cateter no espaço intrathecal lombar da espinha. Nós nos concentramos na entrega de oligonucleotídeos antisenso, embora este método seja adequado para a entrega de outras modalidades terapêuticas também.
Resumo
A barreira hematola (BBB) é uma defesa importante contra a entrada de agentes potencialmente tóxicos ou patogênicos do sangue para o sistema nervoso central (SNC). No entanto, sua existência também reduz drasticamente a acessibilidade dos agentes terapêuticos administrados sistemicamente ao SNC. Um método para superar isso, é injetar esses agentes diretamente no líquido cefalorraquidiano (CSF), ignorando assim o BBB. Isso pode ser feito através da implantação de um cateter para infusão contínua usando uma bomba osmótica, ou para entrega única bolus. Neste artigo, descrevemos um protocolo cirúrgico para a entrega de oligonucleotídeos antisenso (ASOs) através de um cateter implantado diretamente no espaço cauda equina da coluna de ratos adulta. Como resultados representativos, mostramos a eficácia de uma única injeção intrathecal (TI) de ASO através deste sistema de cateterismo em derrubar o RNA alvo em diferentes regiões do CNS de ratos. O procedimento é seguro, eficaz e não requer equipamentos caros ou ferramentas cirúrgicas. A técnica descrita aqui pode ser adaptada para entregar drogas em outras modalidades também.
Introdução
O sistema vascular do sistema nervoso central (SNC) evoluiu como um regulador crítico da homeostase, controlando o tráfego de moléculas, fornecendo nutrientes e livrando-se do desperdício. Este sistema é também a primeira linha de defesa de ataques de patógenos externos, graças a uma densa distribuição de junções apertadas ao longo das paredes das células endotélias. Estas junções apertadas compõem um aspecto da barreira cerebral do sangue (BBB). Enquanto o BBB permite o transporte de moléculas necessárias para atender demandas de nutrientes e energia (por exemplo, íons, glicose), também limita seletivamente a passagem de patógenos, bem como produtos químicos tóxicos1,2,3.
Ironicamente, a mesma função protetora do BBB que limita a passagem de patógenos e produtos químicos tóxicos também é o principal obstáculo à nossa capacidade de acessar facilmente o SNC com tratamentos terapêuticos após a administração sistêmica para o organismo2, 4,5. Esse papel do BBB levou ao desenvolvimento de uma infinidade de novas tecnologias de distribuição de medicamentos e abordagens6.
Uma maneira de superar esse obstáculo é injetar as drogas diretamente no líquido cefalorraquidiano (CSF) que continuamente perfunde tanto o cérebro quanto a medula espinhal7,8,9,10. Neste artigo, descrevemos um método para entregar com sucesso os agentes para o espaço intratelal lombar, colocando a extremidade interna do cateter completamente no espaço cauda equina da coluna vertebral do rato. Uma descrição deste procedimento foi publicada previamente por Mazur et al. em outra parte11.
O protocolo é muito eficaz e produz uma taxa de sucesso superior a 90% de entrega de oligonucleotídeos antisenso (ASO) ao SNC quando avaliada pela análise quantitativa de reação em cadeia de polimerase (qPCR) do knockdown de genes-alvo8. O procedimento causa desconforto mínimo para os animais, já que 100% dos ratos sobrevivem à cirurgia e mostram inchaço mínimo em torno da ferida cirúrgica e sem sinais de angústia (por exemplo, hiperatividade, desidratação, circulando, perda de equilíbrio, diminuição da ingestão de alimentos e desidratação) durante a observação pós-operatório. Outra vantagem do método descrito aqui é que ele não requer equipamentos caros, nem quaisquer ferramentas especiais.
Protocolo
Todos os procedimentos in vivo foram realizados no âmbito do Biogen Institutional Animal Use and Care Committee (IACUC) protocolos aprovados que seguem as diretrizes estabelecidas pelo Guia dos Institutos Nacionais de Saúde dos Estados Unidos para o cuidado e uso de animais de laboratório.
1. Preparação de materiais e instrumentos
- Prepare as cânulas guia especial.
- Use uma ferramenta rotativa com roda de corte (ou uma serra afiada) para cortar as duas extremidades de uma agulha de 19 G, resultando em uma cânula guia de ~ 1,5-2 cm de comprimento (Figura 1Aiii). Use a roda de moagem da ferramenta rotativa para suavizar as duas extremidades.
NOTA: Alternativamente, cânulas guia pré-fabricados e estéreis podem ser comprados a partir de um fornecedor comercial(Mesa de Materiais).
- Use uma ferramenta rotativa com roda de corte (ou uma serra afiada) para cortar as duas extremidades de uma agulha de 19 G, resultando em uma cânula guia de ~ 1,5-2 cm de comprimento (Figura 1Aiii). Use a roda de moagem da ferramenta rotativa para suavizar as duas extremidades.
- Prepare a montagem do cateter/fio.
- Corte um pedaço de 8 cm de comprimento de tubos PE-10 (tubos de polietileno, diâmetro 0,011 polegada) para servir como cateter intratário. Faça uma marca de 2 cm de uma extremidade com uma caneta marcador resistente ao etanol. Corte um fio de estilo de 11 cm de comprimento de fio de aço inoxidável revestido de politetrafluoroetileno. Insira o fio stylet(Figura 1Aii)no lumen do cateter PE-10 (Figura 1Ai).
NOTA: Um cateter / conjunto de montagem de fio(Figura 1Av) é necessário para cada animal. Alternativamente, cateteres e fios stylet podem ser comprados de um fornecedor comercial(Mesa de Materiais).
- Corte um pedaço de 8 cm de comprimento de tubos PE-10 (tubos de polietileno, diâmetro 0,011 polegada) para servir como cateter intratário. Faça uma marca de 2 cm de uma extremidade com uma caneta marcador resistente ao etanol. Corte um fio de estilo de 11 cm de comprimento de fio de aço inoxidável revestido de politetrafluoroetileno. Insira o fio stylet(Figura 1Aii)no lumen do cateter PE-10 (Figura 1Ai).
- Prepare a montagem do cateter de entrega.
- Corte um pedaço de cateter PE-50 (5 a 10 cm, tubos de polietileno, diâmetro de 0,023 polegadas) (Figura 1Bi). Para uma extremidade do cateter PE50 inserir um adaptador de tubos 23 G(Figura 1Biv). Esta extremidade será conectada a uma seringa de 100 μL(Tabela de Materiais)durante a cirurgia. Insira uma agulha de 30 G modificada com o cubo cortado(Figura 1Biii)em um pedaço de aproximadamente 0,5 cm de tubos PE-10(Figura 1Bii)e conecte a tubulação PE-10 à outra extremidade do cateter.
- O final da agulha de 30 G da montagem do cateter de entrega(Figura 1Bv)estará ligado à extremidade distal do cateter PE-10 implantado no rato durante a cirurgia.
NOTA: Alternativamente, a montagem do cateter de entrega(Figura 1Bv)pode ser comprada de um fornecedor comercial(Tabela de Materiais).
- Prepare o guia de montagem de cânula-agulha (Figura 1Avi),colocando uma cânula guia(Figura 1Aiii)ao longo do final de uma agulha de 23 G.
- Esterilizar todos os instrumentos cirúrgicos, incluindo a cânula guia e os conjuntos de fio / cateter usando um esterilizador de óxido de etileno para 12 h.
NOTA: Todos os instrumentos cirúrgicos, exceto o cateter pode ser autocllaved; Cateter vai derreter em alta temperatura.
2. Preparação para a cirurgia
NOTA: Este procedimento é rotineiramente realizado em ratos Sprague Dawley masculinos e femininos com pesos corporais entre 200 g e 400 g. Dois ratos são alojados por gaiola um ciclo de luz /escuridão de 12 h com acesso gratuito a comida e água.
- Peso de um rato e colocá-lo em uma câmara de isoflurane para induzir anestesia (1-5% isoflurano em O2, titrated ao efeito).
NOTA: O rato é então continuamente anestesiado com isoflurano para manter anestesia profunda através de um cone de nariz durante todo o procedimento. Um método alternativo de anestesia (por exemplo, administração de cetamina 100 mg/kg e xilamina 10 mg/kg) pode ser usado conforme aprovado pela IACUC. - Quando o rato não responde a uma pitada do dedo do pé, raspe suas costas da cauda para a coluna torácica caudal e coloque o rato raspado no uma folha estéril colocada em cima de uma almofada de aquecimento.
- Posicione um tubo cônico de centrífuga de 50 ml o abdômen do rato para flexionar a coluna vertebral na região lombar(Figura 2A)e aplique pomada oftalmológica nos olhos.
- Injetar buprenorfina de liberação sustentada (1,0 mg/kg; Tabela de Materiais) subcutâneamente no rato. Limpe a pele exposta com povidona alternada e esfoliação de álcool e repita isso três vezes.
NOTA: Um alívio alternativo da dor pode ser usado como aprovado pelo protocolo IACUC. - Arque o animal com uma cortina transparente estéril que foi fenestrated sobre o local cirúrgico.
3. Cirurgia
- Com o rato suportado pelo tubo cônico de 50 mL, identifique os dois poços naturais entre os músculos acima da pelve (setas na Figura 2A). Com uma mão segurando esses poços, use a outra mão para pressionar suavemente e sentir a coluna vertebral da direção caudal à rostral e encontre o primeiro grande recuo entre vértebras e este é o espaço intervertebral entre vértebras S1 e L6 (Figura 2B ).
- Mova-se ligeiramente rosado para identificar o próximo recuo, o espaço intervertebral entre as vértebras L5 e L6 e o local da injeção (* na Figura 2A). Use um bisturi para fazer uma incisão não mais do que 2 cm de comprimento na pele ao longo da linha média de rostral para caudal para que o local da injeção está no centro da incisão (linha pontilhada na Figura 2A).
- Use tesouras de dissecação para dissecar o tecido conjuntivo, a fim de visualizar a camada muscular. Em seguida, faça uma incisão de 1 cm na cápsula muscular imediatamente lateral para o processo dorsal espinhal da vértebra lombar L6.
NOTA: Os ossos da vértebra lombar L6 podem ser visualizados neste momento. - Posicione o guia de montagem de cânula-agulha perto do aspecto anterior da vértebra lombar 6 e empurrá-lo para o espaço intervertebral ao longo do aspecto anterior da vértebra 6 para que a extremidade da agulha penetra no canal espinhal. Empurre a cânula guia no lugar ao longo da agulha e retire a agulha 23 G deixando apenas a cânula guia no lugar.
NOTA: É útil usar fórceps contundentes para localizar o processo dorsal da vértebra lombar L6 antes de inserir a agulha. Geralmente, o fluido CSF pode ser visto entrando no centro da agulha (este fluido pode ser tingido com uma pitada de sangue, mas isso não indica que o dano tenha sido feito ou que a agulha não seja colocada corretamente). Os autores não viram a grande quantidade de sangue ou de sangramento severo durante este procedimento. Se ocorrer, um veterinário deve ser contatado para determinar o tratamento adequado e se os animais devem ser sacrificados. - Insira a montagem do cateter-fio na cânula guia. Anule para baixo o conjunto do cateter-fio em aproximadamente um ângulo de 45° ao canal espinal e force a extremidade aproximadamente 0.3 cm no canal espinal.
- Retire a cânula guia, deixando o cateter com o fio stylet no lugar. Retire o fio stylet aproximadamente 2,5 cm da ponta intrateral do cateter e avançar o cateter para o canal espinhal até que a marca de 2 cm está na entrada do canal (apenas visível abaixo do músculo), como mostrado na Figura 1Bvi.
NOTA: O cateter inserido deve estender-se rosatrally no espaço subaracnoide. A colocação bem sucedida deve permitir a livre circulação do cateter nesse espaço. - Retire completamente o fio stylet, e CSF pode ser visto entrando no cateter implantado.
- Conecte a montagem do cateter de entrega à extremidade distal do cateter implantado através da extremidade da agulha de 30 G(Figura 1Bv,vi).
- Carregue 60 μL de soro soro para isela estéril em uma seringa de 100 μL (seringa de rubor). Carregue um bolus de 30 μL do composto de teste (por exemplo, solução ASO) em uma segunda seringa (seringa de injeção).
- Conecte a seringa de descarga (carregada com soro soro) ao adaptador de tubos final da montagem do cateter de entrega (Figura 1Bv). Injete 20 μL de soro lógico estéril no espaço intratésico (rubor pré-injeção).
- Conecte a seringa de injeção (carregada com composto de teste) ao adaptador de tubos final da montagem do cateter de entrega(Figura 1Bv). Injete 30 μL de composto de teste no espaço intratário acima de 30 s.
NOTA: O volume de injeção de rotina de ASO é de 30 μL para alcançar um bom knockdown na medula espinhal e no córtex. Tem sido relatado que os volumes de injeção podem afetar a distribuição composta12,embora diferentes volumes de injeção não tenham sido testados. Se outros compostos ou volumes forem usados, a segurança e a eficácia precisam ser determinadas empiricamente. - Repita o passo 3.10 e lave o cateter com outros 40 μL de soro soro estéril (rubor pós-injeção). Em seguida, retire a montagem do cateter de entrega do cateter implantado.
NOTA: O flush pré e pós-injeção é pensado para reduzir o sequestro local dos compostos e melhorar a sua distribuição para as estruturas rostrais12. - Séptico corte e calor selar o cateter implantado: Coloque um par de fórceps dissecação estéril em um esterilizante de contas até que estejam muito quentes, em seguida, reprimir a tubulação com a extremidade quente dos fórceps.
NOTA: Esta ação derrete o cateter. Assim, o buraco no tubo é desmoronado e todos os lados se ater uns aos outros, selando a tubulação de uma forma asséptica e, em seguida, ele é colocado no espaço subcutâneo. - Use suturas monofilamento absorvíveis para proteger o cateter selado pelo calor restante para o tecido conjuntivo. Em seguida, use suturas monofilamento não absorvíveis para fechar a pele sobre o cateter garantido selado pelo calor.
NOTA: Clipes de feridas também podem ser usados como aprovados pelo protocolo IACUC. A técnica é compatível com injeções repetidas, embora tenha sido usada apenas para injeções únicas em nossas mãos. A viabilidade de injeções repetidas deve ser avaliada empiricamente com a aprovação da IACUC. - Use gaze e soro para lavar qualquer sangue da pele e permitir que o animal se recupere da anestesia em uma incubadora aquecida até ser móvel, momento em que é devolvido à sua gaiola doméstica (dois ratos por gaiola).
NOTA: Ao realizar cirurgias em vários ratos no mesmo dia, ferramentas limpas usando água para remover o sangue e reesterilizar usando um esterilizador de contas secas aquecida (por pelo menos 20 s, com tempo para esfriar) entre os animais. Um novo conjunto de instrumentos é usado a cada 5 animais. - Monitore os animais diariamente por pelo menos 3 dias após a cirurgia e continue monitorando os animais semanalmente após a recuperação da cirurgia de acordo com o protocolo da IACUC.
NOTA: Se ocorrerem complicações de urina (retenção de urina, infecções por incisão, distúrbios neurológicos como convulsão ou paralisia), um veterinário deve ser contatado para determinar o tratamento adequado e se os animais devem ser sacrificados. Se a buprenorfina de liberação sustentada não for usada, o alívio da dor deve ser administrado diariamente após a cirurgia de acordo com o protocolo da IACUC.
4. Avaliação de tecido específico knockdown após injeção de TI
- Duas semanas após a injeção de IT bolus de ASOs, coletar diferentes regiões do cérebro (ou seja, córtex cerebral, estriado e cerebelo), bem como diferentes segmentos da medula espinhal (ou seja, cervical, torácico e lombar). Extraia rna total do tecido usando um kit de extração de RNA comercial e execute reação de síntese de CDNA, conforme descrito anteriormente13.
NOTA: Reagentes padrão foram usados para qPCR com os seguintes ensaios: rato Malat1 e rat GAPDH. Os níveis relativos de transcrição foram calculados através do método CT 2-ΔΔ (CT = ciclo limiar).
Resultados
Usando o método descrito aqui, injetamos dois grupos de ratos fêmeas adultos (250-300 g; n = 10/group) com um único bolus de PBS salina tampão de fosfato ou 300 μg de ASO visando o longo não codificação (linc) RNA Malat1; em nosso laboratório, usamos rotineiramente o Malat1 ASO como um composto de ferramenta, porque Malat1 é expressa onipresente e em altos níveis em todos os tecidos14, incluindo cérebro e medula espinhal. O Malat1 ASO funciona através de um mecanismo mediado pelo RNaseH115 que degrada o RNA, levando ao knockdown (KD). No experimento descrito aqui, coletamos diferentes regiões do cérebro (ou seja, córtex cerebral, estriado e cerebelo), bem como o segmento lombar da medula espinhal, duas semanas após o parto da ASO. O RNA de cada uma das regiões coletadas foi então extraído e analisado via qPCR, para avaliar os níveis de expressão do RNA Malat1.
Quando o agente testado é um ASO, recomendamos: 1) sempre coletar várias regiões do SNC, a fim de comparar a eficácia da ASO; 2) dada a complexidade técnica do método cirúrgico, recomendamos incluir um grupo controle positivo, onde um composto com propriedades farmacocinéticas e farmacodinâmicas bem estabelecidas (ou seja, Malat1 ASO em nosso laboratório) é testado em paralelo ao agente de teste; isso fornecerá informações sobre a eficácia das cirurgias, caso sejam obtidos resultados inesperados ou inexplicáveis (por exemplo, falta ou regulamentação insuficiente de RNA).
No experimento aqui descrito, obtivemos kd muito bom em todas as regiões coletadas, como mostrado na Figura 3. No entanto, observamos algum grau de variabilidade regional com a medula espinhal mostrando a maior porcentagem de DK (córtex cerebral = 87% KD, estriado = 77% KD, cerebelo = 74% KD, medula espinhal = 94% KD). Nós não temos acessado in vivo eficiência knockdown mais cedo do que 2 semanas após a cirurgia. Em nossas experiências com várias ASOs, detectamos redução significativa dos genes-alvo até 6 a 8 semanas após a cirurgia (dados não mostrados). Um estudo de curso de tempo deve ser realizado se a eficiência exata de knockdown dependente do tempo de uma DETERMINADA ASO for de interesse.
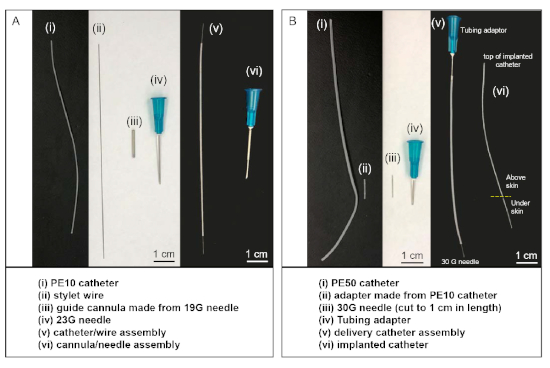
Figura 1: Conjuntos de materiais personalizados e cateter usados em injeções intratéis. (A) O cateter / montagem de arame (v) é feita através da inserção de fio stylet (ii) no lumen de PE-10 cateter (i). A montagem da cânula/agulha (vi) é feita inserindo uma agulha de 23 G no lumen da cânula guia (iii). (B) A montagem do cateter de entrega (v) é feita conectando adaptador de tubos a uma extremidade do cateter PE-50 e conectando a agulha cortada de 30 G na outra extremidade usando um pedaço de cateter PE-10 (ii) como adaptador. Durante a cirurgia, a borda de 30 G final da montagem do cateter de entrega (v) está ligada à parte superior do cateter implantado (vi), após a outra extremidade do cateter implantado ser inserido no espaço intrathecal do animal. Clique aqui para ver uma versão maior deste número.

Figura 2: Identificação do local da injeção e da linha da incisão. (A)Com o abdominal do rato suportado por um tubo cônico de 50 mL, os dois poços entre os músculos acima da pelve são facilmente vistos (flechas). (B)Com uma mão segurando os poços, use a outra mão para pressionar suavemente e sentir a coluna vertebral e encontrar o espaço intervertebral entre as vértebras L5 e L6, ou seja, o local da injeção (* no painel A). A linha pontilhada no painel A mostra a linha de incisão com o local da injeção em seu centro. Clique aqui para ver uma versão maior deste número.

Figura 3: Uma única injeção de TI bolus de ASOs reduz rato Malat1 in vivo. Injetamos um único bolus de PBS ou 300 μg de Malat1 ASO; duas semanas após a cirurgia, coletamos diferentes regiões do SNC e quantificamos os níveis de expressão do RNA Malat1. Obtivemos bom KD de RNA Malat1 em todas as regiões analisadas, com alguma variabilidade entre regiões (córtex cerebral = 87% KD, estriado = 77% KD, cerebelo = 74% KD, medula espinhal = 94% KD; barras de erro = ± SEM). Clique aqui para ver uma versão maior deste número.
Discussão
O artigo atual mostra um método poderoso para entregar agentes terapêuticos diretamente no CNS do rato. Em teoria, uma técnica semelhante também pode ser realizada em camundongos, embora devido ao tamanho menor, o método pode ser mais desafiador. Portanto, nosso grupo realiza injeções intracerebroventriculares (ICV) em camundongos para entrega de medicamentos do SNC, que atingem os mesmos objetivos por meio de uma rota de administração diferente. Esse método foi descrito em outro estudo16.
A vantagem do método descrito aqui é que ele não requer equipamentos caros, nem quaisquer ferramentas especiais. Recomendamos preparar a montagem de cateter/fio mostrada na Figura 1A antes do tempo. Deve-se preparar pelo menos tantos cateter / montagem de fio como há ratos no estudo, embora sugerimos a preparação de alguns cateter extra / montagem de fio no caso de alguns estão danificados ou precisam ser substituídos durante a cirurgia.
Uma vez que a técnica é dominada, todo o procedimento descrito requer cerca de 25 minutos por rato, permitindo assim o tratamento de muitos ratos dentro de um dia. Se uma pessoa realiza a cirurgia no primeiro rato, e uma segunda pessoa faz a preparação cirúrgica no rato seguinte, dois ratos podem ser processados ao mesmo tempo reduzir por o tempo animal. Para um operador proficiente, ainda há uma pequena chance de agulha para chegar ao espaço epidural em vez de espaço subaracnoide. A observação do refluxo de CSF é um bom indicador da posição correta da agulha mas não é perfeita. Recomendamos que um ensaio de engajamento de destino como a análise de knockdown de RNA descrita na sessão de resultado seja realizado para confirmar a entrega correta do composto de teste.
Estabelecer técnicas como a descrita aqui, é crucial para o desenvolvimento de um robusto pipeline de pesquisa pré-clínica que pode avançar as terapias de segmentação do SNC. De fato, a entrega de TI de ASOs como intervenção terapêutica é um método que está sendo explorado atualmente para o tratamento de muitas doenças do SNC17,18,19,20. Nusinersen, um tratamento baseado em ASO para pacientes com atrofia muscular espinhal (SMA), foi recentemente aprovado em vários mercados do mundo, demonstrando a aplicabilidade deste método também para pacientes pediátricos21,22, 23.
Divulgações
Os autores são todos funcionários da Biogen, Inc. ou Ionis Pharmaceuticals. Os autores recebem os oligonucleotídeos antisenso descritos no artigo da Ionis Pharmaceuticals.
Agradecimentos
Gostaríamos de agradecer à Ionis Pharmaceuticals por fornecer os ASOs descritos no artigo.
Materiais
| Name | Company | Catalog Number | Comments |
| 3M Steri-Drape Small Drape with Adhesive Aperture | 3M | 1020 | |
| 70% ethanol | Decon Laboratories, Inc | 8416-160Z | |
| Alcohol swab sticks | Dynarex | NO 1204 | |
| BD General Use Syringes 1 mL Luer-Lok tip | BD | 1ml TB Luer-Lok tip | BD 302830 |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE50 Diameter 0.023 in | BD 427400 (10ft, Fischer Scientific 22-204008) or 427401 (100ft, Fischer Scientific 14-170-12P) |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE10 Diameter 0.011 in | BD 427410 (10ft, Fischer Scientific 14-170-11B) or 4274011 (100ft, Fischer Scientific 14-170-12B) |
| BD Intramedic PE Tubing Adapters | BD | 23 gauge intramedic luer stub adaper | BD 427565 or Fisher Scientific 14-826-19E |
| BD PrecisionGlide Single-use Needles 30G | BD | BD 305128 | |
| Buprenorphine Sustained Release-lab | ZooPharm | Prescription required | |
| Ethylene oxide sterilizer | Andersen Sterilizer INC. | AN 74i, gas sterilizer | AN 74i |
| Guide cannula | BD | 19G x 1 WT (1.1 mm x 25mm) needle | BD 305186 |
| Hamilton syringe 100ul | Hamilton company | Hamilton syringe 100ul | |
| Hot bead Sterilizer | Fine Science Tools | STERILIZER MODELNO FST 250 | |
| Ophthalmic ointment | Dechra veterranery product | 17033-211-38 | |
| Pocket Pro Pet Trimmer | Braintree Scientific | CLP-9931 B | |
| Povidone scrub | PDI | S48050 | |
| Saline | Baxter | Sodium Chloride 0.9% Intravenous Infusion BP 50ml | FE1306G |
| Scalpel | Feather | disposable scalpel | No. 10 |
| Small animal heating pad | K&H Manufacturing | Model # 1060 | |
| Stylet Wire | McMaster-Carr | 1749T14 | LH-36233780 |
| Surgery Towel drape | Dynarex | 4410 | |
| Surgical scissors and forceps | FST and Fisher Scientific | ||
| Sutures | Ethicon | 4-0 or 5-0 | |
| Tool to make the Guide cannular | Grainger | Rotary tool (Dremel) | 14H446 (Mfr: EZ456) |
| EZ lock cut off Wheel | 1PKX5 (Mfr: 3000-1/24) | ||
| Grinding Wheel, Aluminum Oxide | 38EY44 (Mfr: EZ541GR) | ||
| EZ lock Mandrel | 1PKX8 (Mfr: EZ402-01) | ||
| Diamond wheel floor Tile | 3DRN4 (Mfr: EZ545) | ||
| Alternative source for pre-made and sterilized materials for this procedure | |||
| Dosing catheter system | SAI Infusion Systems | RIDC-01 | |
| Guide cannula | SAI Infusion Systems | RIDC-GCA | |
| Internal Catheters | SAI Infusion Systems | RIDC-INC | |
| Stylet Wire | SAI Infusion Systems | RIDC-STY |
Referências
- Abbott, N. J. Dynamics of CNS barriers: evolution, differentiation, and modulation. Cellular and Molecular Neurobiology. 25 (1), 5-23 (2005).
- Greene, C., Campbell, M. Tight junction modulation of the blood brain barrier: CNS delivery of small molecules. Tissue Barriers. 4 (1), e1138017 (2016).
- Daneman, R., Engelhardt, B. Brain barriers in health and disease. Neurobiology of Disease. 107, 1-3 (2017).
- Ballabh, P., Braun, A., Nedergaard, M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiology of Disease. 16 (1), 1-13 (2004).
- Cardoso, F. L., Brites, D., Brito, M. A. Looking at the blood-brain barrier: molecular anatomy and possible investigation approaches. Brain Research Reviews. 64 (2), 328-363 (2010).
- Larsen, J. M., Martin, D. R., Byrne, M. E. Recent advances in delivery through the blood-brain barrier. Current Topics in Medicinal Chemistry. 14 (9), 1148-1160 (2014).
- Brinker, T., Stopa, E., Morrison, J., Klinge, P. A new look at cerebrospinal fluid circulation. Fluids Barriers CNS. 11, 10 (2014).
- Standifer, K. M., Chien, C. C., Wahlestedt, C., Brown, G. P., Pasternak, G. W. Selective loss of delta opioid analgesia and binding by antisense oligodeoxynucleotides to a delta opioid receptor. Neuron. 12 (4), 805-810 (1994).
- Wahlestedt, C., et al. Antisense oligodeoxynucleotides to NMDA-R1 receptor channel protect cortical neurons from excitotoxicity and reduce focal ischaemic infarctions. Nature. 363 (6426), 260-263 (1993).
- Wahlestedt, C., Pich, E. M., Koob, G. F., Yee, F., Heilig, M. Modulation of anxiety and neuropeptide Y-Y1 receptors by antisense oligodeoxynucleotides. Science. 259 (5094), 528-531 (1993).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. Journal of Neuroscience Methods. 280, 36-46 (2017).
- Wolf, D. A., et al. Dynamic dual-isotope molecular imaging elucidates principles for optimizing intrathecal drug delivery. Journal of Clinical Investigation Insight. 1 (2), e85311 (2016).
- Becker, L. A., et al. Therapeutic reduction of ataxin-2 extends lifespan and reduces pathology in TDP-43 mice. Nature. 544 (7650), 367-371 (2017).
- Zhang, X., Hamblin, M. H., Yin, K. J. The long noncoding RNA Malat1: Its physiological and pathophysiological functions. RNA Biology. 14 (12), 1705-1714 (2017).
- Crooke, S. T., Witztum, J. L., Bennett, C. F., Baker, B. F. RNA-Targeted Therapeutics. Cell Metabolism. 27 (4), 714-739 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326 (2013).
- McCampbell, A., et al. Antisense oligonucleotides extend survival and reverse decrement in muscle response in ALS models. Journal of Clinical Investigation. 128 (8), 3558-3567 (2018).
- Schoch, K. M., Miller, T. M. Antisense Oligonucleotides: Translation from Mouse Models to Human Neurodegenerative Diseases. Neuron. 94 (6), 1056-1070 (2017).
- Lane, R. M., et al. Translating Antisense Technology into a Treatment for Huntington's Disease. Methods in Molecular Biology. 1780, 497-523 (2018).
- Wurster, C. D., Ludolph, A. C. Antisense oligonucleotides in neurological disorders. Therapeutic Advances in Neurological Disorders. 11, (2018).
- Haché, M., et al. Intrathecal Injections in Children With Spinal Muscular Atrophy: Nusinersen Clinical Trial Experience. Journal of Child Neurology. 31 (7), 899-906 (2016).
- Goodkey, K., Aslesh, T., Maruyama, R., Yokota, T. Nusinersen in the Treatment of Spinal Muscular Atrophy. Methods in Molecular Biology. 1828, 69-76 (2018).
- Wurster, C. D., Ludolph, A. C. Nusinersen for spinal muscular atrophy. Therapeutic Advances in Neurological Disorders. 11, (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados