Method Article
Entrega intratecal de oligonucleótidos antisentido en el sistema nervioso central de Rata
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, describimos un método para suministrar medicamentos al sistema nervioso central de la rata mediante la implantación de un catéter en el espacio intratecal lumbar de la columna vertebral. Nos centramos en la entrega de oligonucleótidos antisentido, aunque este método es adecuado para la entrega de otras modalidades terapéuticas también.
Resumen
La barrera hematoencefálica (BBB) es una defensa importante contra la entrada de agentes potencialmente tóxicos o patógenos de la sangre en el sistema nervioso central (SNC). Sin embargo, su existencia también reduce drásticamente la accesibilidad de los agentes terapéuticos administrados sistémicamente al SNC. Un método para superar esto, es inyectar esos agentes directamente en el líquido cefalorraquídeo (LCR), evitando así el BBB. Esto se puede hacer a través de la implantación de un catéter para perfusión continua utilizando una bomba osmótica, o para la administración de bolo único. En este artículo, describimos un protocolo quirúrgico para la entrega de oligonucleótidos antisentidos dirigidos al SNC (ASO) a través de un catéter implantado directamente en el espacio de cauda equina de la columna adulta de rata. Como resultados representativos, mostramos la eficacia de una única inyección intratecal de ASO de bolo a través de este sistema de cateterismo para derribar el ARN objetivo en diferentes regiones del SNC de rata. El procedimiento es seguro, eficaz y no requiere costosos equipos o herramientas quirúrgicas. La técnica descrita aquí también se puede adaptar para suministrar medicamentos en otras modalidades.
Introducción
El sistema vascular del sistema nervioso central (SNC) ha evolucionado como un regulador crítico de la homeostasis, controlando el tráfico de moléculas, suministrando nutrientes y eliminando los residuos. Este sistema es también la primera línea de defensa de los ataques de patógenos externos, gracias a una densa distribución de uniones estrechas a lo largo de las paredes de las células endoteliales. Estas uniones estrechas conforman un aspecto de la barrera hematoencefálica (BBB). Mientras que el BBB permite el transporte de moléculas necesarias para satisfacer las demandas de nutrientes y energía (por ejemplo, iones, glucosa), también limita selectivamente el paso de patógenos, así como sustancias químicas tóxicas1,2,3.
Irónicamente, la misma función protectora del BBB que limita el paso de patógenos y sustancias químicas tóxicas también es el principal obstáculo para nuestra capacidad de acceder fácilmente al SNC con tratamientos terapéuticos después de la administración sistémica al organismo2, 4,5. Este papel del BBB ha impulsado el desarrollo de una plétora de nuevas tecnologías y enfoques de distribución de medicamentos6.
Una forma de superar este obstáculo es inyectar los fármacos directamente en el líquido cefalorraquídeo (LCR) que persigue continuamente tanto el cerebro como la médula espinal7,8,9,10. En este artículo, describimos un método para entregar con éxito agentes en el espacio intratecal lumbar colocando el extremo interno del catéter completamente en el espacio de la quinquina cauda de la columna vertebral de la rata. Mazur et al. en otros lugares11publicaron previamente una descripción de este procedimiento.
El protocolo es muy eficaz y produce una tasa de éxito superior al 90% de la entrega de oligonucleótidos antisentido (ASO) al SNC cuando se evalúa mediante un análisis cuantitativo de reacción en cadena de la polimerasa (qPCR) del desenlace del gen objetivo8. El procedimiento causa un mínimo de malestar a los animales, ya que el 100% de las ratas sobreviven a la cirugía y muestran una hinchazón mínima alrededor de la herida quirúrgica y no hay signos de angustia (por ejemplo, hiperactividad, deshidratación, círculos, pérdida de equilibrio, disminución de la ingesta de alimentos y deshidratación) durante la observación postoperatoria. Otra ventaja del método descrito aquí es que no requiere equipos caros, ni herramientas especiales.
Protocolo
Todos los procedimientos in vivo se realizaron bajo protocolos aprobados por el Comité Institucional de Uso y Cuidado de Animales (IACUC, por sus cuales) del Comité Institucional de Uso y Cuidado de Animales (IACUC, por sus cuales) siguen las directrices establecidas por la guía de los Institutos Nacionales de Salud de los Estados Unidos para el cuidado y uso de animales de laboratorio.
1. Preparación de materiales e instrumentos
- Prepare las cánulas de guía especiales.
- Utilice una herramienta giratoria con rueda de corte (o una sierra afilada) para cortar los dos extremos de una aguja de 19 G, lo que resulta en una cánula guía de 1,5 x 2 cm de largo(Figura 1Aiii). Utilice la rueda de rectificación de la herramienta giratoria para suavizar los dos extremos.
NOTA: Alternativamente, las cánulas guía prefabricadas y estériles se pueden comprar a un proveedor comercial(Tabla de materiales).
- Utilice una herramienta giratoria con rueda de corte (o una sierra afilada) para cortar los dos extremos de una aguja de 19 G, lo que resulta en una cánula guía de 1,5 x 2 cm de largo(Figura 1Aiii). Utilice la rueda de rectificación de la herramienta giratoria para suavizar los dos extremos.
- Prepare el conjunto de catéter/alambre.
- Corte una pieza de 8 cm de largo de tubo PE-10 (tubo de polietileno, diámetro 0.011 pulgadas) para servir como catéter intratecal. Haga una marca a 2 cm de un extremo con un rotulador resistente al etanol. Corte un alambre de estilo de 11 cm de largo de alambre de acero inoxidable recubierto de politetrafluoroetileno. Inserte el alambre de estilización(Figura 1Aii) en el lumen del catéter PE-10 (Figura 1Ai).
NOTA: Se necesita un conjunto de conjunto de catéter/alambre(Figura 1Av) para cada animal. Alternativamente, los catéteres y alambres de estilo se pueden comprar a un proveedor comercial(Tabla de materiales).
- Corte una pieza de 8 cm de largo de tubo PE-10 (tubo de polietileno, diámetro 0.011 pulgadas) para servir como catéter intratecal. Haga una marca a 2 cm de un extremo con un rotulador resistente al etanol. Corte un alambre de estilo de 11 cm de largo de alambre de acero inoxidable recubierto de politetrafluoroetileno. Inserte el alambre de estilización(Figura 1Aii) en el lumen del catéter PE-10 (Figura 1Ai).
- Prepare el conjunto del catéter de entrega.
- Cortar un trozo de catéter PE-50 (5 x 10 cm, tubo de polietileno, diámetro 0,023 pulgadas)(Figura 1Bi). A un extremo del catéter PE50 inserte un adaptador de tubo de 23 G(Figura 1Biv). Este extremo se conectará a una jeringa de 100 ml(Tabla de materiales)durante la cirugía. Inserte una aguja modificada de 30 G con el cubo cortado(Figura 1Biii) en una pieza de aproximadamente 0,5 cm de tubo PE-10(Figura 1Bii)y conecte el tubo PE-10 al otro extremo del catéter.
- El extremo de la aguja de 30 G del conjunto del catéter de entrega(Figura 1Bv) se conectará al extremo distal del catéter PE-10 implantado en la rata durante la cirugía.
NOTA: Alternativamente, el conjunto del catéter de entrega(Figura 1Bv) se puede comprar a un proveedor comercial(Tabla de materiales).
- Prepare el conjunto de la cannula-aguja guía(Figura 1Avi)colocando una cánula guía(Figura 1Aiii)sobre el extremo de una aguja de 23 G.
- Esterilice todos los instrumentos quirúrgicos, incluida la cánula guía y los conjuntos de alambre/catéter utilizando un esterilizador de óxido de etileno durante 12 h.
NOTA: Todos los instrumentos quirúrgicos excepto el catéter pueden ser autoclavedos; catéter se derretirá a alta temperatura.
2. Preparación de la cirugía
NOTA: Este procedimiento se realiza rutinariamente en ratas Sprague Dawley machos y hembras con pesos corporales entre 200 g y 400 g. Dos ratas se alojan por jaula bajo un ciclo de luz/oscuridad de 12 h con acceso gratuito a alimentos y agua.
- Peso de una rata y colóquela en una cámara de isoflurano para inducir anestesia (1-5% de isoflurano en O2,valorado a efecto).
NOTA: La rata se anestesia continuamente con isoflurano para mantener la anestesia profunda a través de un cono nasal durante todo el procedimiento. Se puede utilizar un método de anestesia alternativo (por ejemplo, administración de ketamina 100 mg/kg y xilazina 10 mg/kg) según lo aprobado por la IACUC. - Cuando la rata no responda a un pellizco de dedo del pie, afitúe la espalda de la cola a la columna torácica caudal y coloque la rata arasda en la sábana estéril colocada encima de una almohadilla de calentamiento.
- Coloque un tubo centrífugo cónico de 50 ml debajo del abdomen de la rata para flexionar la columna vertebral en la región lumbar(Figura 2A)y aplicar un pomada oftálmica a los ojos.
- Inyectar buprenorfina de liberación sostenida (1,0 mg/kg; Tabla de Materiales) por vía subcutánea en la rata. Limpie la piel expuesta con povidona alterna y exfoliantes de alcohol y repita esto tres veces.
NOTA: Un alivio alternativo del dolor se puede utilizar según lo aprobado por el protocolo IACUC. - Cubra al animal con una cortina transparente estéril que ha sido fenesada sobre el sitio quirúrgico.
3. Cirugía
- Con la rata apoyada por el tubo cónico de 50 ml, identifique los dos pozos naturales entre los músculos por encima de la pelvis (flechas en la Figura 2A). Con una mano sosteniendo esos hoyos, utilice la otra mano para presionar suavemente y sentir la columna vertebral de la dirección caudal a rostral y encontrar la primera sangría importante entre las vértebras y este es el espacio intervertebral entre las vértebras S1 y L6(Figura 2B ).
- Muévase ligeramente rostrally para identificar la siguiente sangría, el espacio intervertebral entre las vértebras L5 y L6 y el lugar de inyección (* en la Figura 2A). Utilice un bisturí para hacer una incisión de no más de 2 cm de largo en la piel a lo largo de la línea media de rostral a caudal para que el lugar de inyección esté en el centro de la incisión (línea punteada en la Figura 2A).
- Utilice tijeras de disección para diseccionar el tejido conectivo con el fin de visualizar la capa muscular. Luego haga una incisión de 1 cm en la cápsula muscular inmediatamente lateral al proceso espinal dorsal de la vértebra lumbar L6.
NOTA: Los huesos de la vértebra lumbar L6 se pueden visualizar en este punto. - Coloque el conjunto de la cánula-aguja guía cerca del aspecto anterior de la 6a vértebra lumbar y empújelo hacia el espacio intervertebral a lo largo del aspecto anterior de la 6a vértebra para que el extremo de la aguja penetre en el canal espinal. Empuje la cánula guía en su lugar a lo largo de la aguja y retire la aguja de 23 G dejando sólo la cánula guía en su lugar.
NOTA: Es útil utilizar fórceps contundentes para localizar el proceso dorsal de la vértebra lumbar L6 antes de insertar la aguja. Generalmente, se puede ver líquido del lDI entrando en el cubo de la aguja (este líquido puede estar temtulado con un toque de sangre, pero esto no indica que se haya hecho daño o que la aguja no esté colocada correctamente). Los autores no han visto una gran cantidad de sangre o sangrado severo durante este procedimiento. Si se produce alguno de los dos casos, se debe contactar a un veterinario para determinar el tratamiento adecuado y si se deben eutanasiar a los animales. - Inserte el conjunto catéter-alambre en la cánula guía. Angulo hacia abajo el conjunto catéter-alambre en aproximadamente un ángulo de 45o hasta el canal espinal y forzar el extremo aproximadamente 0,3 cm en el canal espinal.
- Retire la cánula guía, dejando el catéter con el alambre de estilo en su lugar. Retire el alambre de estilización aproximadamente 2,5 cm de la punta intratecal del catéter y avance el catéter hacia el canal espinal hasta que la marca de 2 cm esté en la entrada del canal (sólo visible debajo del músculo) como se muestra en la Figura 1Bvi.
NOTA: El catéter insertado debe extenderse rostrally en el espacio subaracnoideo. La colocación exitosa debe permitir el libre movimiento del catéter en ese espacio. - Retire completamente el alambre de estilo, y se puede ver el CSF entrando en el catéter implantado.
- Conecte el conjunto del catéter de entrega al extremo distal del catéter implantado a través del extremo de la aguja de 30 G(Figura 1Bv,vi).
- Cargue 60 ml de solución salina estéril en una jeringa de 100 l (jeringa de lavado). Cargue un bolo de 30 ml del compuesto de ensayo (p. ej., solución de ASO) en una segunda jeringa (jeringa de inyección).
- Conecte la jeringa de lavado (cargada con solución salina) al extremo del adaptador de tubo del conjunto del catéter de entrega(Figura 1Bv). Inyectar 20 ml de solución salina estéril en el espacio intratecal (lavado previo a la inyección).
- Conecte la jeringa de inyección (cargada con compuesto de prueba) al extremo del adaptador de tubo del conjunto del catéter de entrega(Figura 1Bv). Inyectar 30 s de compuesto de ensayo en el espacio intratecal durante 30 s.
NOTA: El volumen de inyección de rutina de ASO es de 30 s para lograr un buen derribo en la médula espinal y en la corteza. Se ha informado que los volúmenes de inyección pueden afectar a la distribución compuesta12,aunque no se han probado diferentes volúmenes de inyección. Si se utiliza otro compuesto o volumen, es necesario determinar empíricamente la seguridad y la eficacia. - Repita el paso 3.10 y enjuague el catéter con otros 40 ml de solución salina estéril (lavado posterior a la inyección). A continuación, desconecte el conjunto del catéter de entrega del catéter implantado.
NOTA: Se piensa que el lavado previo y post-inyección reduce el secuestro local de los compuestos y mejora su distribución a las estructurasrostral12. - Cortar y sellar asépticamente el catéter implantado: Coloque un par de fórceps de disección estéril en un esterilizador de cuentas hasta que estén muy calientes, luego apriételos en el tubo con el extremo caliente de los fórceps.
NOTA: Esta acción derrite el catéter. Por lo tanto, el agujero en el tubo se derrumba y todos los lados se pegan entre sí, sellando el tubo de una manera aséptica y luego se coloca en el espacio subcutáneo. - Utilice suturas monofilamento absorbibles para fijar el catéter termosellado restante al tejido conectivo. A continuación, utilice suturas monofilamento no absorbibles para cerrar la piel sobre el catéter sellado térmicamente.
NOTA: Los clips de herida también se pueden utilizar según lo aprobado por el protocolo IACUC. La técnica es compatible con inyecciones repetidas, aunque sólo se ha utilizado para inyecciones de una sola vez en nuestras manos. La viabilidad de las inyecciones repetidas debe evaluarse empíricamente con la aprobación de la IACUC. - Use gasa y salina para lavar cualquier sangre de la piel y permitir que el animal se recupere de la anestesia en una incubadora calentada hasta que esté móvil, momento en el que se devuelve a su jaula de origen (dos ratas por jaula).
NOTA: Cuando realice cirugías en varias ratas en el mismo día, limpie las herramientas con agua para eliminar la sangre y vuelva a esterilizar con un esterilizador de perlas secas calentada (durante al menos 20 s, con tiempo para enfriarse) entre animales. Se utiliza un nuevo conjunto de instrumentos cada 5 animales. - Monitoree a los animales diariamente durante al menos 3 días después de la cirugía y continúe monitoreando a los animales semanalmente después de recuperarse de la cirugía de acuerdo con el protocolo IACUC.
NOTA: Si se produce alguna complicación (retención de orina, infecciones por incisión, trastorno neurológico como convulsiones o parálisis), se debe contactar a un veterinario para determinar el tratamiento adecuado y si se deben eutanasiar animales. Si no se utiliza buprenorfina de liberación sostenida, el alivio del dolor debe administrarse diariamente después de la cirugía de acuerdo con el protocolo IACUC.
4. Evaluación de la desconexión específica del tejido después de la inyección de TI
- Dos semanas después de la inyección de bolus de TI de los ASO, recoger diferentes regiones del cerebro (es decir, corteza cerebral, estriado y cerebelo) así como diferentes segmentos de la médula espinal (es decir, cervical, torácica y lumbar). Extraiga el ARN tisular total utilizando un kit de extracción de ARN comercial y realice la reacción de síntesis de ADNr como se describió anteriormente13.
NOTA: Se utilizaron reactivos estándar para qPCR con los siguientes ensayos: rata Malat1 y rata GAPDH. Los niveles de transcripción relativos se calcularon utilizando el método deTC de 2 - -(CT - ciclo de umbral).
Resultados
Usando el método descrito aquí, inyectamos dos grupos de ratas hembra adultas (250-300 g; n a 10/grupo) con un solo bolo de PBS salino con búfer de fosfato o 300 g de ASO dirigidos al ARN Malat1 largo no codificante (linc); en nuestro laboratorio utilizamos rutinariamente el Malat1 ASO como un compuesto de herramienta, porque Malat1 se expresa ubicuamente y a niveles altos en todos los tejidos14,incluyendo el cerebro y la médula espinal. El Malat1 ASO funciona a través de un mecanismo mediado por RNaseH115 que degrada el ARN, lo que conduce al derribo (KD). En el experimento descrito aquí, recopilamos diferentes regiones del cerebro (es decir, corteza cerebral, estriado y cerebelo) así como el segmento lumbar de la médula espinal, dos semanas después del parto de la ASO. El ARN de cada una de las regiones recogidas se extrajo y analizó a través de qPCR, para evaluar los niveles de expresión del ARN Malat1.
Cuando el agente probado es un ASO, recomendamos: 1) recoger siempre varias regiones del SNC, con el fin de comparar la eficacia de La ASO; 2) dada la complejidad técnica del método quirúrgico, se recomienda incluir un grupo de control positivo, donde un compuesto con propiedades farmacocinéticas y farmacodinámicas bien establecidas (es decir, Malat1 ASO en nuestro laboratorio) se prueba en paralelo al agente de ensayo; esto proporcionará información sobre la eficacia de las cirugías, en caso de que se obtengan resultados inesperados o inexplicables (por ejemplo, falta o regulación insuficiente del ARN).
En el experimento descrito aquí, obtuvimos muy buen KD en todas las regiones recopiladas, como se muestra en la Figura 3. Sin embargo, observamos cierto grado de variabilidad regional con la médula espinal mostrando el porcentaje más alto de KD (córtex cerebral a 87% de KD, estriado a 77% de KD, cerebelo a 74% de KD, médula espinal a 94% de KD). No hemos accedido a la eficiencia de derribo in vivo antes de 2 semanas después de la cirugía. En nuestras experiencias con varios ASO, detectamos un derribo significativo de los genes diana hasta 6 o 8 semanas después de la cirugía (datos no mostrados). Se debe llevar a cabo un estudio de curso de tiempo si la eficiencia precisa de derribo dependiente del tiempo de un ASO determinado es de interés.
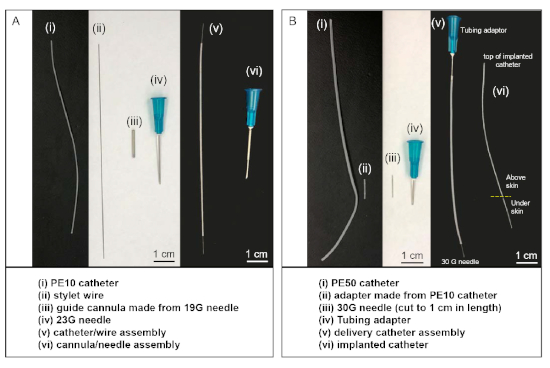
Figura 1: Conjuntos de materiales y catéteres personalizados utilizados en inyecciones intratecales. (A) El conjunto de catéter/alambre (v) se realiza insertando alambre de estilo (ii) en el lumen del catéter PE-10 (i). El conjunto de cánulas/agujas (vi) se realiza insertando una aguja de 23 G en el lumen de la cánula guía (iii). (B) El conjunto del catéter de entrega (v) se realiza conectando el adaptador de tubo a un extremo del catéter PE-50 y conectando la aguja de corte de 30 G en el otro extremo utilizando un pedazo de catéter PE-10 (ii) como adaptador. Durante la cirugía, el extremo de la aguja de 30 G del conjunto del catéter de entrega (v) se conecta a la parte superior del catéter implantado (vi), después de insertar el otro extremo del catéter implantado en el espacio intratecal del animal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Identificación del lugar de inyección y la línea de incisión. (A) Con el abdomen de la rata apoyado por un tubo cónico de 50 ml, los dos hoyos entre los músculos por encima de la pelvis se ven fácilmente (flechas). (B) Con una mano sosteniendo los hoyos, utilice la otra mano para presionar y sentir suavemente la columna vertebral y encontrar el espacio intervertebral entre las vértebras L5 y L6, es decir, el lugar de inyección (* en el panel A). La línea punteada en el panel A muestra la línea de incisión con el lugar de inyección en su centro. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Una sola inyección de TI de bolo de ASO reduce la rata Malat1 in vivo. Inyectamos un solo bolo de PBS o 300 g de Malat1 ASO; dos semanas después de la cirugía recogimos diferentes regiones del SNC y cuantificamos los niveles de expresión del ARN Malat1. Obtuvimos un buen KD de ARN Malat1 en todas las regiones analizadas, con cierta variabilidad entre regiones (córtex cerebral, 87% KD, estriado a 77% de KD, cerebelo a 74% de KD, médula espinal a 94% de KD; barras de error - SEM). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El presente artículo muestra un método potente para administrar agentes terapéuticos directamente en el SNC de rata. En teoría, una técnica similar también se puede realizar en ratones, aunque debido al tamaño más pequeño, el método puede ser más difícil. Por lo tanto, nuestro grupo realiza inyecciones intracerebroventriculares (ICV) en ratones para la administración de fármacos del SNC, que alcanzan los mismos objetivos a través de una vía diferente de administración. Este método se ha descrito en otro estudio16.
La ventaja del método descrito aquí es que no requiere equipos caros, ni herramientas especiales. Recomendamos preparar el conjunto de catéter/alambre que se muestra en la Figura 1A con antelación. Uno debe preparar al menos tantos conjuntos de catéteres/cables como ratas en el estudio, aunque sugerimos preparar algunos conjuntos adicionales de catéter/alambre en caso de que algunos estén dañados o necesiten ser reemplazados durante la cirugía.
Una vez masterizada la técnica, todo el procedimiento descrito requiere unos 25 minutos por rata, permitiendo así el tratamiento de muchas ratas en un día. Si una persona realiza la cirugía en la primera rata, y una segunda persona realiza la preparación quirúrgica en la siguiente rata, dos ratas pueden ser procesadas al mismo tiempo para reducir por tiempo animal. Para un operador competente, todavía hay una pequeña posibilidad de que la aguja alcance el espacio epidural en lugar del espacio subaracnoideo. La observación del flujo de retroceso del LIF es un buen indicador de la posición correcta de la aguja, pero no es perfecto. Recomendamos que se realice un ensayo de participación objetivo como el análisis de derribo de ARN descrito en la sesión de resultados para confirmar la correcta entrega del compuesto de prueba.
Establecer técnicas como la que se describe aquí, es crucial para el desarrollo de una sólida cartera de investigación preclínica que pueda avanzar en las terapias dirigidas al SNC. De hecho, la entrega de OAO de TI como intervención terapéutica es un método que actualmente se está explorando para el tratamiento de muchos trastornos del SNC17,18,19,20. Nusinersen, un tratamiento basado en SOO para pacientes con atrofia muscular espinal (SMA), fue aprobado recientemente en varios mercados de todo el mundo, demostrando la aplicabilidad de este método también a pacientes pediátricos21,22, 23.
Divulgaciones
Los autores son todos empleados de Biogen, Inc. o Ionis Pharmaceuticals. Los autores reciben los oligonucleótidos antisentido descritos en el artículo de Ionis Pharmaceuticals.
Agradecimientos
Nos gustaría dar las gracias a Ionis Pharmaceuticals por suministrar las ASOs descritas en el artículo.
Materiales
| Name | Company | Catalog Number | Comments |
| 3M Steri-Drape Small Drape with Adhesive Aperture | 3M | 1020 | |
| 70% ethanol | Decon Laboratories, Inc | 8416-160Z | |
| Alcohol swab sticks | Dynarex | NO 1204 | |
| BD General Use Syringes 1 mL Luer-Lok tip | BD | 1ml TB Luer-Lok tip | BD 302830 |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE50 Diameter 0.023 in | BD 427400 (10ft, Fischer Scientific 22-204008) or 427401 (100ft, Fischer Scientific 14-170-12P) |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE10 Diameter 0.011 in | BD 427410 (10ft, Fischer Scientific 14-170-11B) or 4274011 (100ft, Fischer Scientific 14-170-12B) |
| BD Intramedic PE Tubing Adapters | BD | 23 gauge intramedic luer stub adaper | BD 427565 or Fisher Scientific 14-826-19E |
| BD PrecisionGlide Single-use Needles 30G | BD | BD 305128 | |
| Buprenorphine Sustained Release-lab | ZooPharm | Prescription required | |
| Ethylene oxide sterilizer | Andersen Sterilizer INC. | AN 74i, gas sterilizer | AN 74i |
| Guide cannula | BD | 19G x 1 WT (1.1 mm x 25mm) needle | BD 305186 |
| Hamilton syringe 100ul | Hamilton company | Hamilton syringe 100ul | |
| Hot bead Sterilizer | Fine Science Tools | STERILIZER MODELNO FST 250 | |
| Ophthalmic ointment | Dechra veterranery product | 17033-211-38 | |
| Pocket Pro Pet Trimmer | Braintree Scientific | CLP-9931 B | |
| Povidone scrub | PDI | S48050 | |
| Saline | Baxter | Sodium Chloride 0.9% Intravenous Infusion BP 50ml | FE1306G |
| Scalpel | Feather | disposable scalpel | No. 10 |
| Small animal heating pad | K&H Manufacturing | Model # 1060 | |
| Stylet Wire | McMaster-Carr | 1749T14 | LH-36233780 |
| Surgery Towel drape | Dynarex | 4410 | |
| Surgical scissors and forceps | FST and Fisher Scientific | ||
| Sutures | Ethicon | 4-0 or 5-0 | |
| Tool to make the Guide cannular | Grainger | Rotary tool (Dremel) | 14H446 (Mfr: EZ456) |
| EZ lock cut off Wheel | 1PKX5 (Mfr: 3000-1/24) | ||
| Grinding Wheel, Aluminum Oxide | 38EY44 (Mfr: EZ541GR) | ||
| EZ lock Mandrel | 1PKX8 (Mfr: EZ402-01) | ||
| Diamond wheel floor Tile | 3DRN4 (Mfr: EZ545) | ||
| Alternative source for pre-made and sterilized materials for this procedure | |||
| Dosing catheter system | SAI Infusion Systems | RIDC-01 | |
| Guide cannula | SAI Infusion Systems | RIDC-GCA | |
| Internal Catheters | SAI Infusion Systems | RIDC-INC | |
| Stylet Wire | SAI Infusion Systems | RIDC-STY |
Referencias
- Abbott, N. J. Dynamics of CNS barriers: evolution, differentiation, and modulation. Cellular and Molecular Neurobiology. 25 (1), 5-23 (2005).
- Greene, C., Campbell, M. Tight junction modulation of the blood brain barrier: CNS delivery of small molecules. Tissue Barriers. 4 (1), e1138017 (2016).
- Daneman, R., Engelhardt, B. Brain barriers in health and disease. Neurobiology of Disease. 107, 1-3 (2017).
- Ballabh, P., Braun, A., Nedergaard, M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiology of Disease. 16 (1), 1-13 (2004).
- Cardoso, F. L., Brites, D., Brito, M. A. Looking at the blood-brain barrier: molecular anatomy and possible investigation approaches. Brain Research Reviews. 64 (2), 328-363 (2010).
- Larsen, J. M., Martin, D. R., Byrne, M. E. Recent advances in delivery through the blood-brain barrier. Current Topics in Medicinal Chemistry. 14 (9), 1148-1160 (2014).
- Brinker, T., Stopa, E., Morrison, J., Klinge, P. A new look at cerebrospinal fluid circulation. Fluids Barriers CNS. 11, 10 (2014).
- Standifer, K. M., Chien, C. C., Wahlestedt, C., Brown, G. P., Pasternak, G. W. Selective loss of delta opioid analgesia and binding by antisense oligodeoxynucleotides to a delta opioid receptor. Neuron. 12 (4), 805-810 (1994).
- Wahlestedt, C., et al. Antisense oligodeoxynucleotides to NMDA-R1 receptor channel protect cortical neurons from excitotoxicity and reduce focal ischaemic infarctions. Nature. 363 (6426), 260-263 (1993).
- Wahlestedt, C., Pich, E. M., Koob, G. F., Yee, F., Heilig, M. Modulation of anxiety and neuropeptide Y-Y1 receptors by antisense oligodeoxynucleotides. Science. 259 (5094), 528-531 (1993).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. Journal of Neuroscience Methods. 280, 36-46 (2017).
- Wolf, D. A., et al. Dynamic dual-isotope molecular imaging elucidates principles for optimizing intrathecal drug delivery. Journal of Clinical Investigation Insight. 1 (2), e85311 (2016).
- Becker, L. A., et al. Therapeutic reduction of ataxin-2 extends lifespan and reduces pathology in TDP-43 mice. Nature. 544 (7650), 367-371 (2017).
- Zhang, X., Hamblin, M. H., Yin, K. J. The long noncoding RNA Malat1: Its physiological and pathophysiological functions. RNA Biology. 14 (12), 1705-1714 (2017).
- Crooke, S. T., Witztum, J. L., Bennett, C. F., Baker, B. F. RNA-Targeted Therapeutics. Cell Metabolism. 27 (4), 714-739 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326 (2013).
- McCampbell, A., et al. Antisense oligonucleotides extend survival and reverse decrement in muscle response in ALS models. Journal of Clinical Investigation. 128 (8), 3558-3567 (2018).
- Schoch, K. M., Miller, T. M. Antisense Oligonucleotides: Translation from Mouse Models to Human Neurodegenerative Diseases. Neuron. 94 (6), 1056-1070 (2017).
- Lane, R. M., et al. Translating Antisense Technology into a Treatment for Huntington's Disease. Methods in Molecular Biology. 1780, 497-523 (2018).
- Wurster, C. D., Ludolph, A. C. Antisense oligonucleotides in neurological disorders. Therapeutic Advances in Neurological Disorders. 11, (2018).
- Haché, M., et al. Intrathecal Injections in Children With Spinal Muscular Atrophy: Nusinersen Clinical Trial Experience. Journal of Child Neurology. 31 (7), 899-906 (2016).
- Goodkey, K., Aslesh, T., Maruyama, R., Yokota, T. Nusinersen in the Treatment of Spinal Muscular Atrophy. Methods in Molecular Biology. 1828, 69-76 (2018).
- Wurster, C. D., Ludolph, A. C. Nusinersen for spinal muscular atrophy. Therapeutic Advances in Neurological Disorders. 11, (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados