Method Article
Intrathekale Lieferung von Antisense Oligonukleotiden im Zentralen Nervensystem der Ratte
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Methode zur Abgabe von Medikamenten an das zentrale Nervensystem der Ratte, indem wir einen Katheter in den lendenintrathekalen Raum der Wirbelsäule implantieren. Wir konzentrieren uns auf die Lieferung von Antisense-Oligonukleotiden, obwohl diese Methode auch für die Lieferung anderer therapeutischer Modalitäten geeignet ist.
Zusammenfassung
Die Blut-Hirn-Schranke (BBB) ist eine wichtige Abwehr gegen den Eintritt potenziell toxischer oder pathogener Wirkstoffe aus dem Blut in das Zentralnervensystem (ZNS). Seine Existenz verringert jedoch auch die Zugänglichkeit systemisch verabreichter therapeutischer Wirkstoffe zum ZNS drastisch. Eine Methode, dies zu überwinden, besteht darin, diese Wirkstoffe direkt in die Zerebrospinalflüssigkeit (CSF) zu injizieren und damit die BBB zu umgehen. Dies kann durch Implantation eines Katheters zur kontinuierlichen Infusion mit einer osmotischen Pumpe oder zur Einzelbolusabgabe erfolgen. In diesem Artikel beschreiben wir ein chirurgisches Protokoll zur Abgabe von CNS-targeting Antisense Oligonukleotiden (ASOs) über einen Katheter, der direkt in den Cauda-Equina-Raum der erwachsenen Rattenwirbelsäule implantiert wird. Als repräsentative Ergebnisse zeigen wir die Wirksamkeit einer einzelnen Bolus-ASO-Intrathekalinjektion (IT) über dieses Katheterisierungssystem bei der Abschlagsmenge der Ziel-RNA in verschiedenen Regionen des Ratten-ZNS. Das Verfahren ist sicher, effektiv und erfordert keine teure Ausrüstung oder chirurgische Werkzeuge. Die hier beschriebene Technik kann angepasst werden, um Medikamente auch in anderen Modalitäten zu liefern.
Einleitung
Das Gefäßsystem des Zentralnervensystems (ZNS) hat sich zu einem kritischen Regulator der Homöostase entwickelt, der den Handel mit Molekülen steuert, Nährstoffe liefert und Abfall loswird. Dieses System ist auch die erste Verteidigungslinie gegen Angriffe von externen Krankheitserregern, dank einer dichten Verteilung von engen Kreuzungen entlang der Wände der Endothelzellen. Diese engen Kreuzungen bilden einen Aspekt der Blut-Hirn-Schranke (BBB). Während das BBB den Transport von Molekülen ermöglicht, die zur Erfüllung des Nährstoff- und Energiebedarfs (z.B. Ionen, Glukose) erforderlich sind, begrenzt es auch selektiv den Durchgang von Krankheitserregern sowie toxischen Chemikalien1,2,3.
Ironischerweise ist die gleiche Schutzfunktion des BBB, die den Durchgang von Krankheitserregern und toxischen Chemikalien begrenzt, auch das Haupthindernis für unsere Fähigkeit, mit therapeutischen Behandlungen nach systemischer Verabreichung an den Organismus leicht auf das ZNS zuzugreifen2, 4,5. Diese Rolle des BBB hat zur Entwicklung einer Vielzahl neuer Technologien und Ansätze für den Vertrieb von Arzneimitteln geführt6.
Eine Möglichkeit, dieses Hindernis zu überwinden, ist die Injektion der Medikamente direkt in die Zerebrospinalflüssigkeit (CSF), die kontinuierlich durchdringt sowohl das Gehirn und Rückenmark7,8,9,10. In diesem Artikel beschreiben wir eine Methode, um Agenten erfolgreich in den lendenintrathekalen Raum zu liefern, indem das innere Ende des Katheters vollständig in den Cauda-Equina-Raum der Rattenwirbelsäule gestellt wird. Eine Beschreibung dieses Verfahrens wurde zuvor von Mazur et al. andernorts veröffentlicht11.
Das Protokoll ist sehr effektiv und erzeugt eine Erfolgsrate von mehr als 90% der Antisense-Oligonukleotid (ASO)-Abgabe an das ZNS, wenn es durch quantitative Polymerase-Kettenreaktion (qPCR) Analyse des Zielgenknockdowns8bewertet wird. Das Verfahren verursacht minimale Beschwerden bei den Tieren, da 100% der Ratten die Operation überleben und minimale Schwellungen um die chirurgische Wunde zeigen und keine Anzeichen von Not zeigen (z. B. Hyperaktivität, Dehydrierung, Kreisen, Gleichgewichtsverlust, verminderte Nahrungsaufnahme und Dehydrierung) während der Post-Op-Beobachtung. Ein weiterer Vorteil der hier beschriebenen Methode ist, dass sie weder teure Ausrüstung noch Spezialwerkzeuge benötigt.
Protokoll
Alle In-vivo-Verfahren wurden im Rahmen des vom Biogen Institutional Animal Use and Care Committee (IACUC) genehmigten Protokollen durchgeführt, die den Richtlinien des United States National Institutes of Health Guide für die Pflege und Verwendung von Labortieren entsprechen.
1. Material- und Instrumentenvorbereitung
- Bereiten Sie die speziellen Führungskanülen vor.
- Verwenden Sie ein Drehwerkzeug mit Trennrad (oder einer scharfen Säge), um die beiden Enden einer 19 G Nadel abzuschneiden, was zu einer 1,5 x 2 cm langen Führungskanüle führt(Abbildung 1Aiii). Verwenden Sie die Schleifscheibe des Drehwerkzeugs, um die beiden Enden zu glätten.
HINWEIS: Alternativ können vorgefertigte und sterile Führungskanülen bei einem kommerziellen Anbieter(Materialtabelle)erworben werden.
- Verwenden Sie ein Drehwerkzeug mit Trennrad (oder einer scharfen Säge), um die beiden Enden einer 19 G Nadel abzuschneiden, was zu einer 1,5 x 2 cm langen Führungskanüle führt(Abbildung 1Aiii). Verwenden Sie die Schleifscheibe des Drehwerkzeugs, um die beiden Enden zu glätten.
- Bereiten Sie die Katheter-/Drahtbaugruppe vor.
- Schneiden Sie ein 8 cm langes Stück PE-10-Schläuche (Polyethylenschläuche, Durchmesser 0,011 Zoll) als intrathekalen Katheter. Machen Sie eine Markierung 2 cm von einem Ende mit einem Ethanol-resistenten Marker-Stift. Schneiden Sie einen 11 cm langen Stylet-Draht aus Polytetrafluorethylen-beschichtetem Edelstahldraht. Legen Sie den Stylet-Draht (Abbildung 1Aii) in das Lumen des PE-10-Katheters ein ( Abbildung1Ai).
HINWEIS: Für jedes Tier wird ein Katheter-/Drahtbausatz benötigt (Abbildung 1Av). Alternativ können Katheter und Styletdrähte bei einem kommerziellen Anbieter(Tabelle der Materialien )erworben werden.
- Schneiden Sie ein 8 cm langes Stück PE-10-Schläuche (Polyethylenschläuche, Durchmesser 0,011 Zoll) als intrathekalen Katheter. Machen Sie eine Markierung 2 cm von einem Ende mit einem Ethanol-resistenten Marker-Stift. Schneiden Sie einen 11 cm langen Stylet-Draht aus Polytetrafluorethylen-beschichtetem Edelstahldraht. Legen Sie den Stylet-Draht (Abbildung 1Aii) in das Lumen des PE-10-Katheters ein ( Abbildung1Ai).
- Vorbereiten der Lieferkathetermontage.
- Schneiden Sie ein Stück PE-50 Katheter (5 x 10 cm, Polyethylen-Schläuche, Durchmesser 0,023 Zoll)(Abbildung 1Bi). An einem Ende des PE50 Katheters einen 23 G Schlauchadapter einsetzen (Abbildung 1Biv). Dieses Ende wird während der Operation mit einer 100-L-Spritze(Materialtabelle)verbunden. Legen Sie eine modifizierte 30 G Nadel mit abgeschnittener Nabe (Abbildung 1Biii) in einen ca. 0,5 cm großen PE-10-Schlauch (Abbildung 1Bii) ein und verbinden Sie den PE-10-Schlauch mit dem anderen Ende des Katheters.
- Das 30 G Nadelende der Entbindungskatheterbaugruppe (Abbildung 1Bv) wird während der Operation an das distale Ende des implantierten PE-10 Katheters in der Ratte angeschlossen.
HINWEIS: Alternativ kann die Lieferkatheterbaugruppe (Abbildung 1Bv) bei einem gewerblichen Anbieter (Materialtabelle )erworben werden.
- Bereiten Sie die Führungskanülennadel-Baugruppe vor (Abbildung 1Avi), indem Sie eine Führungskanüle (Abbildung 1Aiii) über das Ende einer 23 G Nadel legen.
- Sterilisieren Sie alle chirurgischen Instrumente einschließlich der Führungskanüle und der Draht-/Kathetersets mit einem Ethylenoxid-Sterilisator für 12 h.
HINWEIS: Alle chirurgischen Instrumente mit Ausnahme des Katheters können autoklaviert werden; Katheter bei hoher Temperatur schmelzen.
2. Chirurgische Vorbereitung
HINWEIS: Dieses Verfahren wird routinemäßig an männlichen und weiblichen Sprague Dawley Ratten mit Körpergewichten zwischen 200 g und 400 g durchgeführt. Zwei Ratten sind pro Käfig unter einem 12 h Licht/Dunkel-Zyklus mit freiem Zugang zu Nahrung und Wasser untergebracht.
- Gewichteine Ratte und legen Sie sie in eine Isoflurankammer, um Anästhesie zu induzieren (1-5% Isofluran in O2, titriert, um wirkungsgemäß zu sein).
HINWEIS: Die Ratte wird dann kontinuierlich mit Isofluran anbestheitet, um eine tiefe Anästhesie über einen Nasenkegel während des gesamten Verfahrens aufrechtzuerhalten. Eine alternative Anästhesiemethode (z. B. Verabreichung von Ketamin 100 mg/kg und Xylazin 10 mg/kg) kann gemäß der Von der IACUC zugelassenen Methode verwendet werden. - Wenn die Ratte nicht auf eine Zehenprise reagiert, rasieren Sie ihren Rücken vom Schwanz bis zur kaudalen Brustwirbelsäule und legen Sie die rasierte Ratte auf die sterile Platte, die auf ein Heizkissen gelegt ist.
- Positionieren Sie ein 50 ml konisches Zentrifugenrohr unter dem Bauch der Ratte, um die Wirbelsäule im Lendenbereich zu biegen (Abbildung 2A) und tragen Sie eine ophthalmologische Salbe auf die Augen auf.
- Injektion von Buprenorphin (1,0 mg/kg; Materialtabelle) subkutan in der Ratte. Reinigen Sie die exponierte Haut mit abwechselnden Povidon und Alkohol peelings und wiederholen Sie dies dreimal.
HINWEIS: Eine alternative Schmerzlinderung kann gemäß der Genehmigung des IACUC-Protokolls verwendet werden. - Drape das Tier mit einem sterilen transparenten Vorhang, der über der chirurgischen Stelle fenestrated wurde.
3. Chirurgie
- Mit der Ratte, die von der 50 ml konischen Röhre unterstützt wird, identifizieren Sie die beiden natürlichen Gruben zwischen den Muskeln über dem Becken (Pfeile in Abbildung 2A). Mit einer Hand, die diese Gruben hält, verwenden Sie die andere Hand, um sanft zu drücken und fühlen Sie die Wirbelsäule von kaudalen zu rostralen Richtung und finden Sie die erste große Einbuchtung zwischen den Wirbeln und dies ist der Intervertebral-Raum zwischen S1 und L6 Wirbel(Abbildung 2B ).
- Bewegen Sie sich leicht rostral, um den nächsten Einzug, den Intervertebralraum zwischen den Wirbeln L5 und L6 und die Injektionsstelle zu identifizieren (* in Abbildung 2A). Verwenden Sie ein Skalpell, um einen Schnitt nicht mehr als 2 cm lang in der Haut entlang der Mittellinie von rostral zu kaudal zu machen, so dass die Injektionsstelle in der Mitte des Einschnitts ist (gepunktete Linie in Abbildung 2A).
- Verwenden Sie Eine Sezierschere, um das Bindegewebe zu sezieren, um die Muskelschicht zu visualisieren. Dann machen Sie einen 1 cm Schnitt in der Muskelkapsel sofort seitlich zum dorsalen Wirbelsäulenprozess des L6 Lendenwirbels.
HINWEIS: Die Knochen des L6 Lendenwirbels konnten an dieser Stelle visualisiert werden. - Positionieren Sie die Führungskanülennadelbaugruppe in der Nähe des vorderen Aspekts des 6. Lendenwirbels und schieben Sie sie entlang des vorderen Aspekts des 6. Wirbels in den Intervertebralen Raum, so dass das Ende der Nadel in den Spinalkanal eindringt. Drücken Sie die Führungskanüle entlang der Nadel und entfernen Sie die 23 G Nadel, so dass nur die Führungskanüle an Ort und Stelle bleibt.
HINWEIS: Es ist hilfreich, stumpfe Zangen zu verwenden, um den dorsalen Prozess des L6 Lendenwirbels vor dem Einsetzen der Nadel zu lokalisieren. Im Allgemeinen kann CSF-Flüssigkeit in die Nadelnbenabe eindringen gesehen werden (diese Flüssigkeit kann mit einem Hauch von Blut gefärbt werden, aber dies deutet nicht darauf hin, dass Schaden angerichtet wurde oder dass die Nadel nicht richtig platziert wurde). Die Autoren haben während dieses Verfahrens keine große Menge an Blut oder schwere Blutungen gesehen. Wenn beides auftritt, sollte ein Tierarzt kontaktiert werden, um die geeignete Behandlung zu bestimmen und ob Tiere eingeschläfert werden sollten. - Setzen Sie die Katheter-Draht-Baugruppe in die Führungskanüle ein. Winkeln Sie die Katheter-Draht-Baugruppe in etwa einem Winkel von 45° zum Spinalkanal ab und zwingen Sie das Ende ca. 0,3 cm in den Spinalkanal.
- Entfernen Sie die Führungskanüle, so dass der Katheter mit dem Stylet-Draht an Ort und Stelle bleibt. Entfernen Sie den Stylet-Draht ca. 2,5 cm von der intrathekalen Spitze des Katheters und leiten Sie den Katheter in den Spinalkanal, bis sich die 2-cm-Marke am Eingang des Kanals befindet (nur sichtbar unter dem Muskel), wie in Abbildung 1Bvidargestellt.
HINWEIS: Der eingelegte Katheter sollte sich rostral in den Subarachnoidenraum ausdehnen. Eine erfolgreiche Platzierung sollte die freie Bewegung des Katheters in diesem Raum ermöglichen. - Ziehen Sie den Stylet-Draht vollständig zurück, und CSF kann gesehen werden, wie sie den implantierten Katheter betritt.
- Schließen Sie die Entbindungskatheterbaugruppe über das 30 G Nadelende an das distale Ende des implantierten Katheters an (Abbildung 1Bv,vi).
- Laden Sie 60 l sterile Saline in eine 100-L-Spritze (Spülspritze). Laden Sie einen Bolus von 30 l der Prüfmasse (z. B. ASO-Lösung) in eine zweite Spritze (Injektionsspritze).
- Schließen Sie die Spülspritze (mit Saline beladen) an das Rohradapterende der Förderkatheterbaugruppe an (Abbildung 1Bv). Injizieren Sie 20 l sterile Saline in den intrathekalen Raum (Vorinjektionsspülung).
- Schließen Sie die Injektionsspritze (beladen mit Testmasse) an das Rohradapterende der Förderkatheterbaugruppe an (Abbildung 1Bv). Injizieren Sie 30 l Testmasse in den intrathekalen Raum über 30 s.
HINWEIS: Das routinemäßige Injektionsvolumen von ASO beträgt 30 l, um einen guten Knockdown im Rückenmark und im Kortex zu erreichen. Es wurde berichtet, dass die Injektionsvolumina die Zusammengesetztenverteilung12beeinflussen können, obwohl verschiedene Injektionsvolumina nicht getestet wurden. Wenn andere Verbindung oder Volumen verwendet werden, müssen die Sicherheit und Wirksamkeit empirisch bestimmt werden. - Wiederholen Sie Schritt 3.10 und spülen Sie den Katheter mit weiteren 40 l steriler Saline (Nachinjektionsspülung). Lösen Sie dann die Entbindungskatheterbaugruppe vom implantierten Katheter.
HINWEIS: Die Pre- und Post-Injektion Flush wird gedacht, um lokale Sequestrierung der Verbindungen zu reduzieren und ihre Verteilung zu den rostralen Strukturen zu verbessern12. - Aseptisch geschnitten und erhitzen Sie den implantierten Katheter: Legen Sie ein Paar sterile Sezierzangen in einen Perlensterilisator, bis sie sehr heiß sind, und klemmen Sie dann mit dem heißen Ende der Zange auf den Schlauch ein.
HINWEIS: Diese Aktion schmilzt den Katheter. So wird das Loch im Rohr zusammengebrochen und alle Seiten kleben aneinander, versiegeln die Schläuche in einer aseptischen Art und Weise und dann wird es in den subkutanen Raum gelegt. - Verwenden Sie resorbierbare Monofilament-Nähte, um den verbleibenden wärmeversiegelten Katheter am Bindegewebe zu sichern. Verwenden Sie dann nicht resorbierbare Monofilament-Nähte, um die Haut über dem gesicherten wärmeversiegelten Katheter zu schließen.
HINWEIS: Wundclips können auch als vom IACUC-Protokoll zugelassen verwendet werden. Die Technik ist kompatibel mit wiederholten Injektionen, obwohl es nur für einmalige Injektionen in unseren Händen verwendet wurde. Die Durchführbarkeit wiederholter Injektionen sollte mit Zustimmung des IACUC empirisch bewertet werden. - Verwenden Sie Gaze und Saline, um Blut von der Haut zu waschen und lassen Sie das Tier von der Anästhesie in einem beheizten Inkubator bis zum Mobilen erholen, an dem Punkt wird es in seinen Hauskäfig (zwei Ratten pro Käfig) zurückgebracht.
HINWEIS: Wenn Sie operationen an mehreren Ratten am selben Tag durchführen, reinigen Sie Werkzeuge mit Wasser, um Blut zu entfernen und mit einem erhitzten Trockenperlensterilisator (für mindestens 20 s, mit Zeit zum Abkühlen) zwischen den Tieren erneut zu sterilisieren. Alle 5 Tiere wird ein neues Instrumentarium verwendet. - Überwachen Sie die Tiere täglich für mindestens 3 Tage nach der Operation und überwachen Sie die Tiere wöchentlich, nachdem sie sich nach dem IACUC-Protokoll von einer Operation erholt haben.
HINWEIS: Wenn Komplikationen auftreten (Urinretention, Inzisionsinfektionen, neurologische Störungen wie Anfall oder Lähmung), sollte ein Tierarzt kontaktiert werden, um die geeignete Behandlung zu bestimmen und ob Tiere eingeschläfert werden sollten. Wenn ein anhaltendes Freisetzungsbuprenorphin nicht angewendet wird, sollte die Schmerzlinderung nach der Operation gemäß dem IACUC-Protokoll täglich erfolgen.
4. Bewertung des gewebespezifischen Knockdowns nach DER IT-Injektion
- Zwei Wochen nach der IT-Bolus-Injektion von ASOs, sammeln verschiedene Regionen des Gehirns (d.h. Großhirnrinde, Striatum und Kleinhirn) sowie verschiedene Segmente des Rückenmarks (d. h. Zervix, Brustund und Lenden). Extrahieren Sie die gesamte Gewebe-RNA mit einem kommerziellen RNA-Extraktionskit und führen Sie eine cDNA-Synthesereaktion durch, wie zuvor beschrieben13.
HINWEIS: Für qPCR wurden Standardreagenzien mit folgenden Tests verwendet: Ratte Malat1 und Ratte GAPDH. Die relativen Transkriptsebenen wurden mit der Methode 2-CT (CT = Schwellenwertzyklus) berechnet.
Ergebnisse
Mit der hier beschriebenen Methode injizierten wir zwei Gruppen erwachsener weiblicher Ratten (250-300 g; n = 10/Gruppe) entweder mit einem einzigen Bolus phosphatgepufferter Saline-PBS oder 300 g ASO, die auf die lange nicht-kodierende (linc) RNA Malat1 abzielten; in unserem Labor verwenden wir routinemäßig die Malat1 ASO als Werkzeugverbindung, weil Malat1 allgegenwärtig und auf hohen Ebenen in allen Geweben14ausgedrückt wird, einschließlich Gehirn und Rückenmark. Das Malat1 ASO arbeitet über einen RNaseH1-vermittelten Mechanismus15, der die RNA herabsetzt, was zu Knockdown (KD) führt. In dem hier beschriebenen Experiment haben wir zwei Wochen nach der Verabreichung des ASO verschiedene Regionen des Gehirns (z.B. Großhirnrinde, Striatum und Kleinhirn) sowie das Lendensegment des Rückenmarks gesammelt. RNA aus jeder der gesammelten Regionen wurde dann extrahiert und über qPCR analysiert, um die Expressionsniveaus der Malat1-RNA zu bewerten.
Wenn es sich bei dem getesteten Wirkstoff um ein ASO handelt, empfehlen wir: 1) immer mehrere Regionen des ZNS zu sammeln, um die Wirksamkeit von ASO zu vergleichen; 2) Angesichts der technischen Komplexität des chirurgischen Verfahrens empfehlen wir, eine positive Kontrollgruppe einzubeziehen, bei der eine Verbindung mit etablierten pharmakokinetischen und pharmakodynamischen Eigenschaften (d. h. Malat1 ASO in unserem Labor) parallel zum Testmittel getestet wird; Dies wird Informationen über die Wirksamkeit der Operationen liefern, falls unerwartete oder unerklärliche Ergebnisse erzielt werden (z. B. fehlende oder unzureichende RNA-Regulierung).
In dem hier beschriebenen Experiment haben wir in allen gesammelten Regionen sehr gute KD erhalten, wie in Abbildung 3dargestellt. Wir beobachteten jedoch einen gewissen Grad an regionaler Variabilität, wobei das Rückenmark den höchsten KD-Anteil zeigte (Großhirnrinde = 87% KD, Striatum = 77% KD, Kleinhirn = 74% KD, Rückenmark = 94% KD). Wir haben nicht auf in vivo Knockdown Effizienz früher als 2 Wochen nach der Operation zugegriffen. In unseren Erfahrungen mit mehreren ASOs haben wir einen signifikanten Knockdown der Zielgene bis zu 6-8 Wochen nach der Operation festgestellt (Daten werden nicht angezeigt). Eine Zeit-Kurs-Studie sollte durchgeführt werden, wenn die genaue zeitabhängige Knockdown-Effizienz eines bestimmten ASO von Interesse ist.
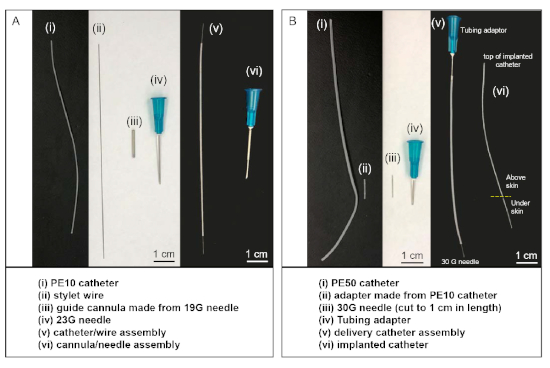
Abbildung 1: Kundenspezifische Material- und Kathetersätze, die in intrathekalen Injektionen verwendet werden. (A) Die Katheter-/Drahtbaugruppe (v) wird durch Einsetzen von Stylet-Draht (ii) in das Lumen des PE-10-Katheters (i) hergestellt. Die Kanülen-/Nadelbaugruppe (vi) wird durch Einsetzen einer 23 G Nadel in das Lumen der Führungskanüle (iii) hergestellt. (B) Die Lieferkatheterbaugruppe (v) erfolgt durch Anschluss des Schlauchadapters an ein Ende des PE-50-Katheters und Anschließen der geschnittenen 30 G Nadel an das andere Ende mit einem Stück PE-10-Katheter (ii) als Adapter. Während der Operation wird das 30 G Nadelende der Entbindungskatheter-Baugruppe (v) mit der Oberseite des implantierten Katheters (vi) verbunden, nachdem das andere Ende des implantierten Katheters in den intrathekalen Raum des Tieres eingeführt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Identifizierung der Injektionsstelle und der Einschnittleitung. (A) Mit dem Bauch der Ratte, der durch ein 50 ml kegelförmiges Rohr gestützt wird, sind die beiden Gruben zwischen den Muskeln über dem Becken leicht zu sehen (Pfeile). (B) Mit einer Hand, die die Gruben hält, verwenden Sie die andere Hand, um die Wirbelsäule sanft zu drücken und zu fühlen und den Intervertebral-Raum zwischen den Wirbeln L5 und L6, d. h. die Injektionsstelle (* in Panel A), zu finden. Die gepunktete Linie in Panel A zeigt die Einschnittlinie mit der Injektionsstelle in der Mitte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Eine einzige Bolus-IT-Injektion von ASOs reduziert Ratte Malat1 in vivo. Wir injizierten einen einzelnen Bolus von PBS oder 300 g Malat1 ASO; zwei Wochen nach der Operation sammelten wir verschiedene Regionen des ZNS und quantifizierten die Expressionsniveaus von Malat1-RNA. Wir erhielten gute KD von Malat1-RNA in allen analysierten Regionen, mit einer gewissen Variabilität zwischen den Regionen (Großhirnrinde = 87% KD, Striatum = 77% KD, Kleinhirn = 74% KD, Rückenmark = 94% KD; Fehlerbalken = SEM). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Der vorliegende Artikel zeigt eine leistungsfähige Methode, um therapeutische Wirkstoffe direkt in das CNS der Ratte zu liefern. Theoretisch kann eine ähnliche Technik auch bei Mäusen durchgeführt werden, obwohl aufgrund der kleineren Größe die Methode anspruchsvoller sein kann. Daher führt unsere Gruppe intracerebroventricular (ICV) Injektionen bei Mäusen für die CNS-Medikamentenabgabe durch, die die gleichen Ziele über einen anderen Verabreichungsweg erreichen. Diese Methode wurde in einer anderen Studie beschrieben16.
Der Vorteil der hier beschriebenen Methode ist, dass sie weder teure Ausrüstung noch Spezialwerkzeuge benötigt. Wir empfehlen, die in Abbildung 1 A gezeigte Katheter-/Drahtbaugruppe im Voraus vorzubereiten. Man sollte mindestens so viele Katheter-/Drahtbaugruppen vorbereiten, wie ratten in der Studie sind, obwohl wir vorschlagen, einige zusätzliche Katheter-/Drahtbaugruppen vorzubereiten, falls einige beschädigt sind oder während der Operation ersetzt werden müssen.
Sobald die Technik gemeistert ist, erfordert das gesamte beschriebene Verfahren etwa 25 min pro Ratte, so dass die Behandlung vieler Ratten innerhalb eines Tages möglich ist. Wenn eine Person die Operation an der ersten Ratte durchführt und eine zweite Person eine chirurgische Vorbereitung an der nächsten Ratte durchführt, können zwei Ratten gleichzeitig verarbeitet werden, um die Zeit pro Tier zu reduzieren. Für einen kompetenten Bediener gibt es immer noch eine kleine Chance für Nadel, epiduralen Raum anstelle von subarachnoiden Raum zu erreichen. Die Beobachtung des CSF-Rückflusses ist ein guter Indikator für die richtige Nadelposition, aber es ist nicht perfekt. Wir empfehlen, dass ein Ziel-Engagement-Assay wie die in der Ergebnissitzung beschriebene RNA-Knockdown-Analyse durchgeführt werden sollte, um die korrekte Abgabe der Testverbindung zu bestätigen.
Die Etablierung von Techniken wie der hier beschriebenen ist entscheidend für die Entwicklung einer robusten präklinischen Forschungspipeline, die ZNS-Targeting-Therapien voranbringen kann. Tatsächlich ist die IT-Bereitstellung von ASOs als therapeutische Intervention eine Methode, die derzeit zur Behandlung vieler Erkrankungen des ZNS17,18,19,20erforscht wird. Nusinersen, eine ASO-basierte Behandlung von Patienten mit spinaler Muskelatrophie (SMA), wurde kürzlich in mehreren Märkten weltweit zugelassen, was die Anwendbarkeit dieser Methode auch auf pädiatrische Patientenzeigt 21,22, 23.
Offenlegungen
Die Autoren sind alle Mitarbeiter von Biogen, Inc. oder Ionis Pharmaceuticals. Die Autoren erhalten die Antisense-Oligonukleotide, die in dem Artikel von Ionis Pharmaceuticals beschrieben werden.
Danksagungen
Wir danken Ionis Pharmaceuticals für die Lieferung der in dem Artikel beschriebenen ASOs.
Materialien
| Name | Company | Catalog Number | Comments |
| 3M Steri-Drape Small Drape with Adhesive Aperture | 3M | 1020 | |
| 70% ethanol | Decon Laboratories, Inc | 8416-160Z | |
| Alcohol swab sticks | Dynarex | NO 1204 | |
| BD General Use Syringes 1 mL Luer-Lok tip | BD | 1ml TB Luer-Lok tip | BD 302830 |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE50 Diameter 0.023 in | BD 427400 (10ft, Fischer Scientific 22-204008) or 427401 (100ft, Fischer Scientific 14-170-12P) |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE10 Diameter 0.011 in | BD 427410 (10ft, Fischer Scientific 14-170-11B) or 4274011 (100ft, Fischer Scientific 14-170-12B) |
| BD Intramedic PE Tubing Adapters | BD | 23 gauge intramedic luer stub adaper | BD 427565 or Fisher Scientific 14-826-19E |
| BD PrecisionGlide Single-use Needles 30G | BD | BD 305128 | |
| Buprenorphine Sustained Release-lab | ZooPharm | Prescription required | |
| Ethylene oxide sterilizer | Andersen Sterilizer INC. | AN 74i, gas sterilizer | AN 74i |
| Guide cannula | BD | 19G x 1 WT (1.1 mm x 25mm) needle | BD 305186 |
| Hamilton syringe 100ul | Hamilton company | Hamilton syringe 100ul | |
| Hot bead Sterilizer | Fine Science Tools | STERILIZER MODELNO FST 250 | |
| Ophthalmic ointment | Dechra veterranery product | 17033-211-38 | |
| Pocket Pro Pet Trimmer | Braintree Scientific | CLP-9931 B | |
| Povidone scrub | PDI | S48050 | |
| Saline | Baxter | Sodium Chloride 0.9% Intravenous Infusion BP 50ml | FE1306G |
| Scalpel | Feather | disposable scalpel | No. 10 |
| Small animal heating pad | K&H Manufacturing | Model # 1060 | |
| Stylet Wire | McMaster-Carr | 1749T14 | LH-36233780 |
| Surgery Towel drape | Dynarex | 4410 | |
| Surgical scissors and forceps | FST and Fisher Scientific | ||
| Sutures | Ethicon | 4-0 or 5-0 | |
| Tool to make the Guide cannular | Grainger | Rotary tool (Dremel) | 14H446 (Mfr: EZ456) |
| EZ lock cut off Wheel | 1PKX5 (Mfr: 3000-1/24) | ||
| Grinding Wheel, Aluminum Oxide | 38EY44 (Mfr: EZ541GR) | ||
| EZ lock Mandrel | 1PKX8 (Mfr: EZ402-01) | ||
| Diamond wheel floor Tile | 3DRN4 (Mfr: EZ545) | ||
| Alternative source for pre-made and sterilized materials for this procedure | |||
| Dosing catheter system | SAI Infusion Systems | RIDC-01 | |
| Guide cannula | SAI Infusion Systems | RIDC-GCA | |
| Internal Catheters | SAI Infusion Systems | RIDC-INC | |
| Stylet Wire | SAI Infusion Systems | RIDC-STY |
Referenzen
- Abbott, N. J. Dynamics of CNS barriers: evolution, differentiation, and modulation. Cellular and Molecular Neurobiology. 25 (1), 5-23 (2005).
- Greene, C., Campbell, M. Tight junction modulation of the blood brain barrier: CNS delivery of small molecules. Tissue Barriers. 4 (1), e1138017 (2016).
- Daneman, R., Engelhardt, B. Brain barriers in health and disease. Neurobiology of Disease. 107, 1-3 (2017).
- Ballabh, P., Braun, A., Nedergaard, M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiology of Disease. 16 (1), 1-13 (2004).
- Cardoso, F. L., Brites, D., Brito, M. A. Looking at the blood-brain barrier: molecular anatomy and possible investigation approaches. Brain Research Reviews. 64 (2), 328-363 (2010).
- Larsen, J. M., Martin, D. R., Byrne, M. E. Recent advances in delivery through the blood-brain barrier. Current Topics in Medicinal Chemistry. 14 (9), 1148-1160 (2014).
- Brinker, T., Stopa, E., Morrison, J., Klinge, P. A new look at cerebrospinal fluid circulation. Fluids Barriers CNS. 11, 10 (2014).
- Standifer, K. M., Chien, C. C., Wahlestedt, C., Brown, G. P., Pasternak, G. W. Selective loss of delta opioid analgesia and binding by antisense oligodeoxynucleotides to a delta opioid receptor. Neuron. 12 (4), 805-810 (1994).
- Wahlestedt, C., et al. Antisense oligodeoxynucleotides to NMDA-R1 receptor channel protect cortical neurons from excitotoxicity and reduce focal ischaemic infarctions. Nature. 363 (6426), 260-263 (1993).
- Wahlestedt, C., Pich, E. M., Koob, G. F., Yee, F., Heilig, M. Modulation of anxiety and neuropeptide Y-Y1 receptors by antisense oligodeoxynucleotides. Science. 259 (5094), 528-531 (1993).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. Journal of Neuroscience Methods. 280, 36-46 (2017).
- Wolf, D. A., et al. Dynamic dual-isotope molecular imaging elucidates principles for optimizing intrathecal drug delivery. Journal of Clinical Investigation Insight. 1 (2), e85311 (2016).
- Becker, L. A., et al. Therapeutic reduction of ataxin-2 extends lifespan and reduces pathology in TDP-43 mice. Nature. 544 (7650), 367-371 (2017).
- Zhang, X., Hamblin, M. H., Yin, K. J. The long noncoding RNA Malat1: Its physiological and pathophysiological functions. RNA Biology. 14 (12), 1705-1714 (2017).
- Crooke, S. T., Witztum, J. L., Bennett, C. F., Baker, B. F. RNA-Targeted Therapeutics. Cell Metabolism. 27 (4), 714-739 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326 (2013).
- McCampbell, A., et al. Antisense oligonucleotides extend survival and reverse decrement in muscle response in ALS models. Journal of Clinical Investigation. 128 (8), 3558-3567 (2018).
- Schoch, K. M., Miller, T. M. Antisense Oligonucleotides: Translation from Mouse Models to Human Neurodegenerative Diseases. Neuron. 94 (6), 1056-1070 (2017).
- Lane, R. M., et al. Translating Antisense Technology into a Treatment for Huntington's Disease. Methods in Molecular Biology. 1780, 497-523 (2018).
- Wurster, C. D., Ludolph, A. C. Antisense oligonucleotides in neurological disorders. Therapeutic Advances in Neurological Disorders. 11, (2018).
- Haché, M., et al. Intrathecal Injections in Children With Spinal Muscular Atrophy: Nusinersen Clinical Trial Experience. Journal of Child Neurology. 31 (7), 899-906 (2016).
- Goodkey, K., Aslesh, T., Maruyama, R., Yokota, T. Nusinersen in the Treatment of Spinal Muscular Atrophy. Methods in Molecular Biology. 1828, 69-76 (2018).
- Wurster, C. D., Ludolph, A. C. Nusinersen for spinal muscular atrophy. Therapeutic Advances in Neurological Disorders. 11, (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten