Method Article
쥐 중추 신경계에서 안티 센스 올리고 뉴클레오티드의 내 전달
요약
여기서, 우리는 척추의 요추 내 공간에 카테터를 이식하여 쥐 중추 신경계에 약물을 전달하는 방법을 설명합니다. 우리는 안티 센스 올리고 뉴클레오티드의 전달에 초점을 맞추고, 이 방법은 뿐만 아니라 다른 치료 양식의 전달에 적합 하지만.
초록
혈액 뇌 장벽 (BBB) 중추 신 경계에 혈액에서 잠재적으로 독성 또는 병원 성 에이전트의 입구에 대 한 중요 한 방어 (CNS). 그러나, 그것의 존재는 또한 극적으로 CNS에 체계적으로 관리된 치료에이전트의 접근성을 낮춥시다. 이를 극복하는 한 가지 방법은, 이러한 제제를 뇌척수액(CSF)에 직접 주입하여 BBB를 우회하는 것이다. 이것은 삼투성 펌프를 사용하여 연속 주입을 위해 카테터를 이식하거나 단일 볼러스 전달을 위해 수행 할 수 있습니다. 본 문서에서는, 우리는 성인 쥐 척추의 카우다 에퀴나 공간에 직접 이식된 카테터를 통해 CNS 표적화 안티센스 올리고뉴클레오티드(ASO)의 전달을 위한 외과 프로토콜을 기술한다. 대표적인 결과로서, 우리는 쥐 CNS의 다른 지구에 있는 표적 RNA를 쓰러뜨리는 이 카테터 삽입 시스템을 통해 단일 볼루스 ASO 내(IT) 주입의 효능을 보여준다. 절차는 안전하고 효과적이며 고가의 장비 또는 수술 도구가 필요하지 않습니다. 여기에 설명 된 기술은 뿐만 아니라 다른 양식에 약물을 제공 하도록 적응 될 수 있다.
서문
중추 신경계 (CNS)의 혈관 시스템은 항상성의 중요한 레귤레이터로 진화하여 분자의 트래픽을 제어하고 영양소를 공급하고 폐기물을 제거합니다. 이 시스템은 또한 내피 세포의 벽을 따라 단단한 접합부가 조밀하게 분포되어 있기 때문에 외부 병원균의 공격으로부터 첫 번째 방어선입니다. 이 단단한 접합은 혈액 두뇌 방벽의 1개의 양상을 구성합니다 (BBB). BBB는 영양소 및 에너지 요구(예를 들어, 이온, 포도당)를 충족시키는 데 필요한 분자의 수송을 허용하지만, 또한 독성 화학물질뿐만 아니라 병원체의 통과를 선택적으로 제한한다1,2,3.
아이러니하게도, 병원균과 독성 화학물질의 통과를 제한하는 BBB의 동일한 보호 기능은유기체에대한 전신 투여 후 치료적 치료로 CNS에 쉽게 접근할 수 있는 우리의 능력에 큰 장애가 된다2. 4,5. BBB의 이러한 역할은 신약 유통 기술의 과다한 개발을 촉발시켰으며6.
이러한 장애를 극복하는 한 가지 방법은뇌와 척수7,8,9,10을지속적으로 투과시키는 뇌척수액(CSF)에 약물을 직접 주입하는 것이다. 이 기사에서는, 우리는 쥐 척추의 카우다 에퀴나 공간에 카테터의 내부 단부를 완전히 배치하여 요추 내 공간으로 에이전트를 성공적으로 전달하는 방법을 설명합니다. 이 절차에 대한 설명은 이전에 Mazur 외11.
이 프로토콜은 표적 유전자의 정량적 중합효소 연쇄 반응(qPCR) 분석에 의해 평가될 때 CNS에 대한 안티센스 올리고뉴클레오티드(ASO) 전달의 90% 이상의 성공률을 매우 발휘한다8. 이 절차는 쥐의 100 %가 수술에서 생존하고 수술 상처 주위에 최소한의 붓기와 고통의 흔적을 보이지 않는 것처럼 동물에게 최소한의 불편 을 초래합니다 (예 : 과잉 행동, 탈수, 순환, 균형 상실, 음식 섭취 감소, 및 탈수) 수술 후 관찰 중. 여기에 설명된 방법의 또 다른 장점은 고가의 장비나 특수 공구가 필요하지 않다는 것입니다.
프로토콜
모든 생체 내 절차는 실험실 동물의 관리 및 사용에 대한 미국 국립 보건원 가이드에 의해 명시된 지침을 따르는 Biogen 기관 동물 사용 및 관리 위원회 (IACUC) 승인 된 프로토콜에 따라 수행되었습니다.
1. 재료 및 악기 준비
- 특별 가이드 캐뉼라를 준비합니다.
- 컷 오프 휠 (또는 날카로운 톱)이있는 회전 도구를 사용하여 19G 바늘의 두 끝을 잘라내어 ~ 1.5-2cm 길이의 가이드 캐뉼라(그림 1Aiii)를생성합니다. 회전 공구의 연삭 휠을 사용하여 두 끝을 부드럽게 합니다.
참고 : 또는, 사전 제작 및 멸균 가이드 캐뉼라 상업 공급 업체(재료표)에서구입할 수 있습니다.
- 컷 오프 휠 (또는 날카로운 톱)이있는 회전 도구를 사용하여 19G 바늘의 두 끝을 잘라내어 ~ 1.5-2cm 길이의 가이드 캐뉼라(그림 1Aiii)를생성합니다. 회전 공구의 연삭 휠을 사용하여 두 끝을 부드럽게 합니다.
- 카테터/와이어 어셈블리를 준비합니다.
- PE-10 튜브 (폴리에틸렌 튜브, 직경 0.011 인치)의 8cm 긴 조각을 잘라 경내 카테터 역할을합니다. 에탄올 내성 마커 펜으로 한쪽 끝에서 2cm 를 표시합니다. 폴리테트라플루오로에틸렌 코팅 스테인레스 스틸 와이어에서 11cm 길이의 스타일 와이어를 잘라. 스타일 와이어(그림1Aii)를PE-10 카테터의 내루에 삽입합니다(그림1Ai).
참고: 각 동물에 대해 카테터/와이어 어셈블리세트(그림 1Av)가필요합니다. 대안적으로, 카테터 및 스타일 와이어는 상용 공급 업체(재료표)에서구입할 수 있습니다.
- PE-10 튜브 (폴리에틸렌 튜브, 직경 0.011 인치)의 8cm 긴 조각을 잘라 경내 카테터 역할을합니다. 에탄올 내성 마커 펜으로 한쪽 끝에서 2cm 를 표시합니다. 폴리테트라플루오로에틸렌 코팅 스테인레스 스틸 와이어에서 11cm 길이의 스타일 와이어를 잘라. 스타일 와이어(그림1Aii)를PE-10 카테터의 내루에 삽입합니다(그림1Ai).
- 전달 카테터 어셈블리를 준비합니다.
- PE-50 카테터 (5−10cm, 폴리에틸렌 튜브, 직경 0.023 인치)의 조각을 잘라(그림 1Bi). PE50 카테터의 한쪽 끝에 23G 튜빙 어댑터를 삽입한다(도1Biv). 이 쪽의 끝은 수술 시 100 μL주사기(물자 표)에연결될 것이다. 허브가 잘리는 수정된 30G 바늘을삽입(그림 1Biii)을약 0.5 cm의 PE-10 튜브(그림1Bii)에넣고 PE-10 튜브를 카테터의 다른 쪽 끝에 연결합니다.
- 전달 카테터 어셈블리의 30 G 바늘 말단(도1Bv)은수술 시 랫트에 이식된 PE-10 카테터의 말단에 연결될 것이다.
참고: 대안적으로, 전달 카테터 어셈블리(그림1Bv)는상용 공급업체로부터 구입할 수 있다(재료표).
- 가이드 캐뉼라-바늘 조립체(그림1Avi)를23 G 바늘 끝에 가이드 캐뉼라(그림1Aiii)를놓음으로써 준비한다.
- 12시간 동안 에틸렌 옥사이드 멸균기를 사용하여 가이드 캐뉼러 및 와이어/카테터 세트를 포함한 모든 수술 기구를 멸균합니다.
참고 : 카테터를 제외한 모든 수술 기구는 오토 클레이브 할 수 있습니다. 카테터는 고온에서 녹습니다.
2. 수술 준비
참고: 이 절차는 200 g과 400 g 사이 체중을 가진 남성과 여성 Sprague Dawley 쥐에 일상적으로 수행됩니다. 두 마리의 쥐는 음식과 물에 무료로 접근 할 수있는 12 시간 빛 / 어두운 주기에서 케이지 당 보관됩니다.
- 쥐의 무게와 마취를 유도하기 위해 이소플루란 챔버에 배치 (O2에서1-5 % 이소플루란, 효과에 적정).
참고 : 쥐는 절차 전반에 걸쳐 코 콘을 통해 깊은 마취를 유지하기 위해 이소플루란으로 지속적으로 마취됩니다. 대체 마취 방법(예를 들어, 케타민 100 mg/kg 및 자일라진 10 mg/kg의 투여)은 IACUC의 승인을 받아 사용될 수 있다. - 쥐가 발가락 핀치에 반응하지 않을 때 꼬리에서 꼬리 흉부 척추로 등을 면도하고 면도 한 쥐를 가열 패드 위에 놓은 멸균 시트에 놓습니다.
- 요추 부위의 척추를 구부리기 위해 쥐의 복부 아래에 50 ml원추형 원심분리튜브를 배치하고(그림2A)안과 연고를 눈에 바릅니다.
- 지속적인 방출 buprenorphine 주입 (1.0 mg/kg; 재료 표) 쥐에 피하. 노출된 피부를 교대로 포비톤과 알코올 스크럽으로 닦고 이 것을 세 번 반복합니다.
참고: 다른 통증 완화는 IACUC 프로토콜에 의해 승인된 대로 사용될 수 있습니다. - 수술 부위에 페네스트레이션된 멸균 투명 드레이프로 동물을 드레이프합니다.
3. 수술
- 50 mL 원추형 튜브에 의해 지지되는 쥐를 사용하면 골반 위의 근육 사이의 두 가지 자연적인 구덩이를 식별합니다 (그림 2A의화살표). 한 손으로 는 그 구덩이를 들고, 부드럽게 누르고 로스트랄 방향으로 척추를 느끼고 척추 사이의 첫 번째 주요 들여 쓰기를 찾아 다른 손을 사용하여 이것은 S1과 L6 척추 사이의 추간판 공간입니다(그림 2B ).
- L5와 L6 척추와 사출 부위 사이의 다음 들여쓰기, 추간판 공간을 식별하기 위해 약간 장밋빛으로 이동합니다(그림 2A에서*). 주사 부위가 절개 부위의 중심에 있도록 주사 부위가 절개 의 중심에 있도록 로스트랄에서 꼬리까지 중간선을 따라 피부에 2cm 이하의 길이를 만들기 위해 메스를 사용합니다 (그림 2A의점선).
- 근육 층을 시각화하기 위해 결합 조직을 해부하기 위해 해부 가위를 사용합니다. 그런 다음 L6 요추 척추의 등쪽 척추 과정을 즉시 측면으로 근육 캡슐에 1cm 절개를합니다.
참고: 이 시점에서 L6 요추의 뼈를 시각화할 수 있습니다. - 가이드 캐뉼라-니들 어셈블리를 6차 요추의 앞쪽 측면에 위치시키고 바늘의 끝이 척추관에 침투할 수 있도록 6척추의 앞쪽 측면을 따라 추간판 공간으로 밀어 넣습니다. 바늘을 따라 가이드 캐뉼라를 밀어 내고 가이드 캐뉼라만 남기고 23G 바늘을 제거합니다.
참고: 바늘을 삽입하기 전에 무딘 집게를 사용하여 L6 요추의 등쪽 과정을 찾는 것이 좋습니다. 일반적으로 CSF 유체는 바늘 허브에 들어가는 것을 볼 수 있습니다 (이 액체는 혈액의 힌트로 칠해질 수 있지만 해가 수행되었거나 바늘이 올바르게 배치되지 않았다는 것을 나타내지는 않습니다). 저자는이 절차 동안 많은 양의 혈액이나 심한 출혈을 본 적이 없습니다. 어느 쪽이든 발생하면 수의사에게 연락하여 적절한 치료를 결정하고 동물을 안락사시켜야하는지 확인해야합니다. - 카테터 와이어 어셈블리를 가이드 캐뉼라에 삽입합니다. 카테터 와이어 어셈블리를 척추 운하까지 약 45° 각도로 각도를 조정하고 끝을 척추 관으로 약 0.3cm 강제로 넣습니다.
- 가이드 캐뉼라를 제거하고 카테터를 스타일 와이어로 제자리에 둡습니다. 그림 1Bvi와같이 카테터의 경막 외 끝에서 약 2.5 cm의 스타일 와이어를 제거하고 2cm 마크가 운하 입구 (근육 아래 보이는)가 될 때까지 카테터를 척추 관으로 진행합니다.
참고 : 삽입 된 카테터는 지주막 공간으로 장전되어야합니다. 성공적인 배치는 그 공간에서 카테터를 자유롭게 움직일 수 있어야합니다. - 스타일 와이어를 완전히 철회하고 CSF가 이식된 카테터에 들어가는 것을 볼 수 있다.
- 30 G 바늘 단부를 통해 이식된 카테터의 말단에 전달 카테터 어셈블리를 연결합니다(그림1Bv, vi).
- 멸균 식염수 60 μL을 100 μL 주사기(플러싱 주사기)에 적재합니다. 시험 화합물(예를 들어, ASO 용액)의 30 μL의 볼루스를 제2 주사기(주입 주사기)에 로드한다.
- 플러싱 주사기(식염수로 로드됨)를 전달 카테터 어셈블리의 튜브 어댑터 끝에 연결합니다(그림1Bv). 20 μL의 멸균 식염수를 경내 공간에 주입하십시오 (주입 전 홍조).
- 주사주사기(테스트 화합물로 로드됨)를 전달 카테터 어셈블리의 튜브 어댑터 끝에 연결합니다(그림1Bv). 30 μL의 시험 화합물을 30s 이상의 내 공간에 주입하십시오.
참고 : ASO의 일상적인 주입 량은 척수와 피질에서 좋은 녹다운을 달성하기 위해 30 μL입니다. 그것은 사출 볼륨 화합물 분포에 영향을 미칠 수 있습니다 보고 되었습니다12,비록 다른 주입 볼륨 테스트 되지 않은. 다른 화합물 이나 부피를 사용 하는 경우, 안전 및 효과 경험적으로 결정 될 필요가. - 3.10단계를 반복하고 카테터를 40 μL의 멸균 식염수(주입 후 플러싱)로 세척합니다. 그런 다음 이식 된 카테터에서 전달 카테터 어셈블리를 분리합니다.
참고: 주입 전 및 사후 플러시는 화합물의 국소 격리를 감소시키고 로스트랄구조(12)로의분포를 개선하는 것으로 생각된다. - 무균 절단 및 열 밀봉 이식 카테터: 비드 멸균기에 한 쌍의 멸균 해부 포셉을 넣고 매우 뜨거울 때까지 놓고 집게의 뜨거운 끝으로 튜브를 고정합니다.
참고: 이 작용은 카테터를 녹입니다. 따라서 튜브의 구멍이 붕괴되고 모든 면이 서로 달라붙어 무균 방식으로 튜브를 밀봉한 다음 피하 공간에 배치됩니다. - 흡수성 모노필라멘트 봉합사를 사용하여 남은 열 밀봉 카테터를 결합 조직에 고정합니다. 그런 다음 흡수할 수 없는 모노필라멘트 봉합사를 사용하여 고정된 열 밀봉 카테터 위로 피부를 닫습니다.
참고: 상처 클립은 IACUC 프로토콜의 승인을 받은 대로 사용할 수도 있습니다. 이 기술은 우리의 손에 일회성 주사에 사용되었지만 반복 주사와 호환됩니다. 반복 주사의 타당성은 IACUC의 승인을 통해 경험적으로 평가되어야합니다. - 거즈와 식염수를 사용하여 피부에서 혈액을 씻고 동물이 가열 된 인큐베이터에서 마취에서 회복 될 때까지 이동하여 홈 케이지 (케이지 당 2 마리의 쥐)로 돌아갑니다.
참고: 같은 날 여러 쥐에 대한 수술을 수행할 때, 물을 사용하여 혈액을 제거하고 동물 들 사이에 가열 된 건조 비드 멸균기 (적어도 20 s, 식히는 시간)를 사용하여 다시 살균하는 도구를 청소하십시오. 새로운 악기 세트는 5 마리의 동물마다 사용됩니다. - 수술 후 적어도 3일 동안 매일 동물을 모니터링하고 IACUC 프로토콜에 따라 수술 후 매주 동물을 계속 모니터링합니다.
참고: 합병증(소변 보존, 절개 감염, 발작 또는 마비와 같은 신경 장애)이 발생하는 경우, 수의사에게 연락하여 적절한 치료를 결정하고 동물을 안락사시켜야 하는지 확인해야 합니다. 서방성 부프레노르핀이 사용되지 않는 경우, 통증 완화는 IACUC 프로토콜에 따라 수술 후 매일 주어져야 한다.
4. IT 주입 후 조직 별 녹다운 평가
- ASO의 IT bolus 주입 후 2 주, 뇌의 다른 영역을 수집 (즉, 대뇌 피질, 줄무늬와 소뇌) 척수의 다른 세그먼트뿐만 아니라 (즉, 자궁 경부, 흉부, 요추). 상서항 RNA 추출 키트를 이용하여 총 조직 RNA를 추출하고 앞서13일설명한 바와 같이 cDNA 합성 반응을 수행한다.
참고: 표준 시약은 다음 의 아그라피와 함께 qPCR에 사용되었다: 랫 말랏1 및 랫트 GAPDH. 상대적인 전사체 수준은2-ΔΔCT 방법(CT=임계값 사이클)을 사용하여 계산하였다.
결과
여기에 기재된 방법을 사용하여, 우리는 긴 비코딩(linc) RNA Malat1을 표적으로 하는 인산완충 식염수 PBS 또는 300 μg의 단일 볼루스와 함께 성인 암컷 쥐(250-300 g; n=10/군)의 두 그룹을 주입하였다; 우리 실험실에서 우리는 Malat1이 뇌와 척수를 포함한 모든 조직14에서유비쿼터스로 그리고 높은 수준으로 표현되었기 때문에 Malat1 ASO를 도구 화합물로 일상적으로 사용합니다. Malat1 ASO는 RNA를 저하시키는 RNaseH1 매개 메커니즘15를 통해 작동하여 녹다운(KD)을 초래합니다. 여기에서 기술된 실험에서, 우리는 ASO의 납품 후에 2 주, 척수의 요추 세그먼트 뿐만 아니라 두뇌의 다른 지구 (즉, 대뇌 피질, striatum 및 소뇌)를 수집했습니다. 수집된 각 영역으로부터의 RNA를 qPCR을 통해 추출 및 분석하여 Malat1 RNA의 발현 수준을 평가하였습니다.
테스트 된 에이전트가 ASO인 경우 1) ASO 효능을 비교하기 위해 항상 CNS의 여러 영역을 수집하는 것이 좋습니다. 2) 외과 적 방법의 기술적 복잡성을 감안할 때, 우리는 양성 대조군을 포함하는 것이 좋습니다, 여기서 잘 확립 된 약동학 및 약력 학적 특성 (즉, 우리 실험실에서 Malat1 ASO)는 시험 에이전트와 병렬로 테스트; 이것은 수술의 효과에 대한 정보를 제공 할 것입니다, 예기치 않거나 설명 할 수없는 결과를 얻을 경우 (예를 들어, 부족 또는 부족한 RNA 조절).
여기서 설명한 실험에서, 우리는 도 3에도시된 바와 같이 수집된 모든 지역에서 매우 양호한 KD를 얻었다. 그러나, 우리는 KD의 가장 높은 비율을 보여주는 척수와 지역 가변성의 어느 정도를 관찰 않았다 (대뇌 피질 = 87% KD, 줄무늬 = 77% KD, 소뇌 = 74% KD, 척수 = 94% KD). 우리는 수술 후 2 주 이전에 생체 내 녹다운 효율에 액세스하지 않았습니다. 몇몇 ASO를 가진 우리의 경험에서, 우리는 6-8 주 수술 후 까지 표적 유전자의 중요한 녹다운을 검출했습니다 (데이터는 도시되지 않음). 주어진 ASO의 정확한 시간 의존적 녹다운 효율이 관심있는 경우 시간 코스 연구가 수행되어야합니다.
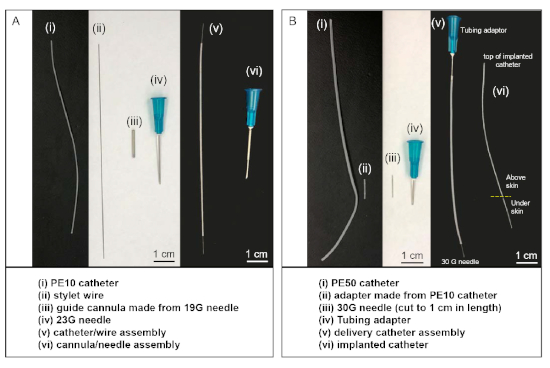
그림 1: 경내 주사에 사용되는 맞춤형 재료 및 카테터 세트. (A)카테터/와이어 어셈블리(v)는 스타일와이어(ii)를 PE-10 카테터(i)의 내루에 삽입하여 이루어진다. 캐뉼라/바늘 조립체(vi)는 가이드 캐뉼라(iii)의 내강내황에 23G 바늘을 삽입하여 이루어진다. (B)전달 카테터 어셈블리 (v)는 튜빙 어댑터를 PE-50 카테터의 한쪽 끝에 연결하고 컷 30G 바늘을 다른 쪽 끝에 연결하여 PE-10 카테터(ii)를 어댑터로 사용하여 이루어진다. 수술 동안, 전달 카테터 어셈블리(v)의 30 G 바늘 말단은 이식된 카테터(vi)의 상부에 연결되고, 이식된 카테터의 다른 쪽 끝이 동물의 경막 내 공간에 삽입된 후. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 사출 부위 및 절개선의 식별. (A)50 mL 원엽 튜브에 의해 지지되는 쥐의 복부와 함께 골반 위의 근육 사이의 두 구덩이가 쉽게 보입니다 (화살표). (B)한 손으로 구덩이를 잡고 다른 손으로 척추를 부드럽게 누르고 느끼고 L5와 L6 척추 사이의 추간판 공간을 찾으십시오. 패널 A의 점선은 사출 부위가 가운데에 있는 절개선을 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: ASO의 단일 볼러스 IT 주사는 생체 내에서 랫트 Malat1을 감소시킨다. 우리는 PBS 또는 Malat1 ASO의 300 μg의 단일 볼루스를 주입했습니다. 수술 2 주 후 우리는 CNS의 다른 영역을 수집하고 Malat1 RNA의 발현 수준을 정량화. 우리는 분석된 모든 지역에서 Malat1 RNA의 양호한 KD를 얻었으며, 지역 간 일부 가변성(대뇌 피질 = 87% KD, 줄무늬 = 77% KD, 소뇌 = 74% KD, 척수 = 94% KD; 오차 바 = ± SEM). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 문서는 쥐 CNS내로 직접 치료제를 전달하는 강력한 방법을 보여준다. 이론적으로, 유사한 기술은 더 작은 크기 때문에, 방법이 더 도전적 일 수 있더라도, 마우스에서 또한 수행될 수 있습니다. 따라서, 우리 그룹은 다른 투여 경로를 통해 동일한 목표에 도달하는 CNS 약물 전달을 위해 마우스에서 intracerebroincular (ICV) 주사를 수행합니다. 이 방법은 또 다른 연구16에기재되어 있다.
여기에 설명된 방법의 장점은 고가의 장비나 특수 공구가 필요하지 않다는 것입니다. 그림1A에 표시된 카테터/와이어 어셈블리를 미리 준비하는 것이 좋습니다. 연구에 쥐가 있는 만큼 적어도 많은 카테터/와이어 어셈블리를 준비해야 하지만, 수술 중에 일부 카테터/와이어 어셈블리가 손상되거나 교체될 경우를 대비하는 것이 좋습니다.
일단 기술이 숙달되면, 기술된 전체 절차는 쥐 당 대략 25 분 필요, 그러므로 1 일 안에 많은 쥐의 처리를 허용하. 한 사람이 첫 번째 쥐에 수술을 수행하고 두 번째 사람이 다음 쥐에 수술 준비를 수행하는 경우, 두 마리의 쥐는 동물 당 시간을 줄이기 위해 동시에 처리 될 수있다. 능숙한 작업자의 경우 지주막이 아닌 경막외 공간에 바늘이 도달할 가능성은 여전히 적습니다. CSF 역류의 관찰은 올바른 바늘 위치의 좋은 지표이지만 완벽하지 않습니다. 결과 세션에 기재된 RNA 녹다운 분석과 같은 표적 교전 분석이 시험 화합물의 정확한 전달을 확인하기 위해 수행되어야 하는 것이 좋습니다.
여기에 설명된 것과 같은 기술을 확립하는 것은 CNS 표적 치료를 발전시킬 수 있는 강력한 전임상 연구 파이프라인의 개발에 매우 중요합니다. 실제로, 치료적 개입으로서 ASO의 IT 전달은 현재 CNS17,18, 19,20의많은 장애의 치료를 위해 탐구되고 있는 방법이다. Nusinersen, 척추 근육 위축에 대 한 ASO 기반 치료 (SMA) 환자, 최근 여러 시장에서 승인 되었다, 또한 소아 환자에 게이 방법의 적용성을 입증21,22, 23.
공개
저자는 바이오젠, 주식회사 또는 아이오니스 제약의 모든 직원입니다. 저자는 Ionis 제약에서 기사에 설명 된 안티 센스 올리고 뉴클레오티드를받을 수 있습니다.
감사의 말
이 기사에 설명된 ASO를 공급해 주신 Ionis 제약에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 3M Steri-Drape Small Drape with Adhesive Aperture | 3M | 1020 | |
| 70% ethanol | Decon Laboratories, Inc | 8416-160Z | |
| Alcohol swab sticks | Dynarex | NO 1204 | |
| BD General Use Syringes 1 mL Luer-Lok tip | BD | 1ml TB Luer-Lok tip | BD 302830 |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE50 Diameter 0.023 in | BD 427400 (10ft, Fischer Scientific 22-204008) or 427401 (100ft, Fischer Scientific 14-170-12P) |
| BD Intramedic PE Tubing | BD | Polyethylene tubing PE10 Diameter 0.011 in | BD 427410 (10ft, Fischer Scientific 14-170-11B) or 4274011 (100ft, Fischer Scientific 14-170-12B) |
| BD Intramedic PE Tubing Adapters | BD | 23 gauge intramedic luer stub adaper | BD 427565 or Fisher Scientific 14-826-19E |
| BD PrecisionGlide Single-use Needles 30G | BD | BD 305128 | |
| Buprenorphine Sustained Release-lab | ZooPharm | Prescription required | |
| Ethylene oxide sterilizer | Andersen Sterilizer INC. | AN 74i, gas sterilizer | AN 74i |
| Guide cannula | BD | 19G x 1 WT (1.1 mm x 25mm) needle | BD 305186 |
| Hamilton syringe 100ul | Hamilton company | Hamilton syringe 100ul | |
| Hot bead Sterilizer | Fine Science Tools | STERILIZER MODELNO FST 250 | |
| Ophthalmic ointment | Dechra veterranery product | 17033-211-38 | |
| Pocket Pro Pet Trimmer | Braintree Scientific | CLP-9931 B | |
| Povidone scrub | PDI | S48050 | |
| Saline | Baxter | Sodium Chloride 0.9% Intravenous Infusion BP 50ml | FE1306G |
| Scalpel | Feather | disposable scalpel | No. 10 |
| Small animal heating pad | K&H Manufacturing | Model # 1060 | |
| Stylet Wire | McMaster-Carr | 1749T14 | LH-36233780 |
| Surgery Towel drape | Dynarex | 4410 | |
| Surgical scissors and forceps | FST and Fisher Scientific | ||
| Sutures | Ethicon | 4-0 or 5-0 | |
| Tool to make the Guide cannular | Grainger | Rotary tool (Dremel) | 14H446 (Mfr: EZ456) |
| EZ lock cut off Wheel | 1PKX5 (Mfr: 3000-1/24) | ||
| Grinding Wheel, Aluminum Oxide | 38EY44 (Mfr: EZ541GR) | ||
| EZ lock Mandrel | 1PKX8 (Mfr: EZ402-01) | ||
| Diamond wheel floor Tile | 3DRN4 (Mfr: EZ545) | ||
| Alternative source for pre-made and sterilized materials for this procedure | |||
| Dosing catheter system | SAI Infusion Systems | RIDC-01 | |
| Guide cannula | SAI Infusion Systems | RIDC-GCA | |
| Internal Catheters | SAI Infusion Systems | RIDC-INC | |
| Stylet Wire | SAI Infusion Systems | RIDC-STY |
참고문헌
- Abbott, N. J. Dynamics of CNS barriers: evolution, differentiation, and modulation. Cellular and Molecular Neurobiology. 25 (1), 5-23 (2005).
- Greene, C., Campbell, M. Tight junction modulation of the blood brain barrier: CNS delivery of small molecules. Tissue Barriers. 4 (1), e1138017(2016).
- Daneman, R., Engelhardt, B. Brain barriers in health and disease. Neurobiology of Disease. 107, 1-3 (2017).
- Ballabh, P., Braun, A., Nedergaard, M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiology of Disease. 16 (1), 1-13 (2004).
- Cardoso, F. L., Brites, D., Brito, M. A. Looking at the blood-brain barrier: molecular anatomy and possible investigation approaches. Brain Research Reviews. 64 (2), 328-363 (2010).
- Larsen, J. M., Martin, D. R., Byrne, M. E. Recent advances in delivery through the blood-brain barrier. Current Topics in Medicinal Chemistry. 14 (9), 1148-1160 (2014).
- Brinker, T., Stopa, E., Morrison, J., Klinge, P. A new look at cerebrospinal fluid circulation. Fluids Barriers CNS. 11, 10(2014).
- Standifer, K. M., Chien, C. C., Wahlestedt, C., Brown, G. P., Pasternak, G. W. Selective loss of delta opioid analgesia and binding by antisense oligodeoxynucleotides to a delta opioid receptor. Neuron. 12 (4), 805-810 (1994).
- Wahlestedt, C., et al. Antisense oligodeoxynucleotides to NMDA-R1 receptor channel protect cortical neurons from excitotoxicity and reduce focal ischaemic infarctions. Nature. 363 (6426), 260-263 (1993).
- Wahlestedt, C., Pich, E. M., Koob, G. F., Yee, F., Heilig, M. Modulation of anxiety and neuropeptide Y-Y1 receptors by antisense oligodeoxynucleotides. Science. 259 (5094), 528-531 (1993).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. Journal of Neuroscience Methods. 280, 36-46 (2017).
- Wolf, D. A., et al. Dynamic dual-isotope molecular imaging elucidates principles for optimizing intrathecal drug delivery. Journal of Clinical Investigation Insight. 1 (2), e85311(2016).
- Becker, L. A., et al. Therapeutic reduction of ataxin-2 extends lifespan and reduces pathology in TDP-43 mice. Nature. 544 (7650), 367-371 (2017).
- Zhang, X., Hamblin, M. H., Yin, K. J. The long noncoding RNA Malat1: Its physiological and pathophysiological functions. RNA Biology. 14 (12), 1705-1714 (2017).
- Crooke, S. T., Witztum, J. L., Bennett, C. F., Baker, B. F. RNA-Targeted Therapeutics. Cell Metabolism. 27 (4), 714-739 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326(2013).
- McCampbell, A., et al. Antisense oligonucleotides extend survival and reverse decrement in muscle response in ALS models. Journal of Clinical Investigation. 128 (8), 3558-3567 (2018).
- Schoch, K. M., Miller, T. M. Antisense Oligonucleotides: Translation from Mouse Models to Human Neurodegenerative Diseases. Neuron. 94 (6), 1056-1070 (2017).
- Lane, R. M., et al. Translating Antisense Technology into a Treatment for Huntington's Disease. Methods in Molecular Biology. 1780, 497-523 (2018).
- Wurster, C. D., Ludolph, A. C. Antisense oligonucleotides in neurological disorders. Therapeutic Advances in Neurological Disorders. 11, (2018).
- Haché, M., et al. Intrathecal Injections in Children With Spinal Muscular Atrophy: Nusinersen Clinical Trial Experience. Journal of Child Neurology. 31 (7), 899-906 (2016).
- Goodkey, K., Aslesh, T., Maruyama, R., Yokota, T. Nusinersen in the Treatment of Spinal Muscular Atrophy. Methods in Molecular Biology. 1828, 69-76 (2018).
- Wurster, C. D., Ludolph, A. C. Nusinersen for spinal muscular atrophy. Therapeutic Advances in Neurological Disorders. 11, (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유