Method Article
Прямой, реджоселективный и атомно-экономический синтез 3-ауроилов-N-гидрокси-5-нитроиндолы цикловуда 4-нитронитрособензена с алкиноном
В этой статье
Резюме
3-Aroyl-N-hydroxy-5-nitroindoles были синтезированы цикловдум 4-нитронитробензена с конъюгированным аклиноном терминала в одноступенчатой тепловой процедуре. Препарат нитросоарена и алкинона были надлежащим образом зарегистрированы и, соответственно, через процедуры окисления на соответствующем анилине и на алкинол.
Аннотация
Мы ввели режиоселекционную и атомо-экономическую процедуру синтеза 3-заменителей путем аннуляции нитросоарен с этиниловыми кетонами. Реакции были проведены достижения индолов без каких-либо катализаторов и с отличной regioselectivity. Следов 2-аройлиндола не обнаружено. Работая с 4-нитронитробензенженом в качестве исходного материала, 3-арозил-N-гидрокси-5-нитроиндола продукты осаждается из реакционных смесей и были выделены фильтрацией без какой-либо дальнейшей техники очистки. В отличие от соответствующих N-гидрокси-3-ариловых индолов, которые, спонтанно в растворе, дают продукты дегидродимеризации, N-гидрокси-3-ароариловые индолы стабильны и не наблюдается димеризации соединений.
Введение
Ароматические соединения C-нитросо 1 и алкиноны 2 являются универсальными регулянтами, которые постоянно и глубоко используются и изучаются в качестве исходных материалов для приготовления высокоценных соединений. Нитросоарины играют постоянно растущую роль в органическом синтезе. Они используются для различных целей (например, гетеро Diels-Alder реакции3,4, Нитросо-Aldol реакции5,6, Нитрозо-Ene реакции7, синтез azocompounds8,9,10). Совсем недавно они даже были использованы в качестве исходных материалов, чтобы позволить себе различные гетерокикловые соединения11,12,13. В последние десятилетия, конъюгированные ynones были исследованы за их роль, как очень интересные и полезные леса в достижении многих высоких ценных производных и гетероциклических продуктов14,15,16,17,18. C-Nitrosoaromatics может быть предоставлена реакциями окисления соответствующих и коммерчески доступных анилинов с использованием различных окислительных агентов в виде пероксимоносульфата калия (KHSO50,5KHSO40,5K2SO4)19, Na2WO4/H220, Mo(VI)-комплексы/H2O21,222 24. Alkynones легко подготовлены окисления соответствующих алкинолы с использованием различных окислителей (CrO325 даже известный как реагент Джонса или мягкий реагенты, как MnO226 и Dess-Martin periodinane27). Алкинолы могут быть достигнуты путем прямой реакции этинилмагемания бромистого с коммерчески доступными арилальдегидами или гетехарилальдегидами28.
Индол, вероятно, наиболее изученный гетероциклическое соединение и производные индола имеют широкое и различное применение во многих различных областях исследований. Как медицинские химики, так и ученые-материалоизующие ученые произвели множество индолей-продуктов, которые охватывают различные функции и потенциальную деятельность. Индоле соединения были исследованы многими исследовательскими группами и как естественные продукты и синтетические производные, содержащие indole рамки показывают соответствующие и своеобразные свойства29,30,31,32. Среди множества индоле соединений, 3-aroylindoles имеют соответствующую роль среди молекул, которые показывают биологическую деятельность (Рисунок 1). Различные индиле продукты принадлежат к различным классам фармацевтических кандидатов, чтобы стать потенциальными новыми препаратами33. Синтетические и естественные 3-аройлиндолы, как известно, играют роль как антибактериальные, антимитотические, обезболивающие, противовирусные, противовоспалительные, антиноцицепные, антидиабетические и противораковые34,35. "1-гидроксииндол гипотеза" был провокационно введен Somei и коллег в качестве интересного и стимулирующего предположения для поддержки биологической роли N-гидроксииндолов в биосинтезе и функционализации индоле алкалоиды36,37, 38,39. Это предположение было недавно подкрепляется наблюдением многих эндогенных N-гидрокси гетероциклических соединений, которые показывают соответствующую биологическую деятельность и интересную роль для многих целей, как про-наркотики40. В последние годы поиск новых активных фармацевтических ингредиентов показал, что различныеn-гидроксииндола фрагменты были обнаружены и обнаружены в натуральных продуктах и биологически активных соединений (Рисунок 2): Стефацидин B41 и Копроводин42 известны как противоопухолевые алкалоиды, Тиазомицины43 (A и D), Нотоамид G44 и Nocathacins45,46,47 (I, III и IV) глубоко изучены антибиотики, Opacaline B48 является естественным алкалоид из ascidian Pseudodistoma opacum и Бирнбаумин A и B два пигмента от Leucoprinus birnbaumii49. Новые и эффективные N-гидроксииндоле-ингибиторы LDH-A (Lactate DeHydrogenasa-A) и их способность снижать глюкозу для преобразования лактата внутри клетки были разработаны 50,51,52,53,54,55,56. Другие исследователи повторили, что индоле соединения, которые не показывают биологической деятельности, стал полезным про-наркотики после вставки N-гидрокси группы57.
Мотивом дискуссии была стабильность N-гидроксииндолов, и некоторые из этих соединений легко дали реакцию дегидродимеризации, которая приводит к образованию класса новых соединений, впоследствии переименованных в кабутане58,59, 60,61, путем формирования нового c-C облигаций и двух новых облигаций C-O. В связи с важностью стабильных N-гидроксииндолов изучение различных синтетических подходов для легкой подготовки таких соединений становится фундаментальной темой. В предыдущем исследовании, проведенном некоторыми из нас, внутримолекулярной циклизации Кадоган-Сундберг типа реакции было сообщено с использованием нитрростиранов и нитростильбен в качестве исходных материалов62. В последние десятилетия мы разработали новый циклодугвации между нитро- и нитросоаренов с различными алкининами в межмолекулярной моды предоставления индолов, N-гидрокси- и N-alkoxyindoles в качестве основных продуктов (Рисунок 3).
В начале, используя ароматические и алифатические алкины63,64,65,66,67 реакции были проведены в большом избытке алкина (10 или 12 раз), а иногда и в алкилятивных условиях, чтобы избежать образования кабутанов. 3-заменяемые индоле продукты были достигнуты реджоизбирательно в умеренной до хорошей урожайности. Использование электронного бедного алкиненов, как 4-этинилпиримидин производных в качестве привилегированных субстратов мы могли бы осуществлять реакции на этот один горшок синтетического протокола с помощью 1/1 нитросоарена / алкина молярное соотношение68. С помощью этого протокола, интересный класс ингибиторов киназы, как меридианины, морские алкалоиды, изолированные от Aplidium meridianum69, был подготовлен, показывая другой подход к меридианинов через процедуру индоления (Рисунок 4)68. Meridianins вообще были произведены до тех пор с синтетическими инструментами starting from preformed реагенты indole. Насколько нам известно, только несколько методологий сообщили о полном синтезе меридианинов или производных меридианина через процедуру индоления68,70.
В более поздних разработок по использованию электронных бедных алкининов было целесообразно проверить использование терминала алкинонов в качестве субстратов для процедуры индолизации, и это привело нас к раскрытию межмолекулярной синтетической техники, чтобы позволить себе 3-aroyl-N-hydroxyindole продукты71,72. Аналогично процессу, изученным для приготовления меридианинов, с использованием терминальных соединений арилакинона использовалось 1/1 ар-НЗО/Ар-(КЗО)-C-C- CH молярное соотношение(рисунок 5). Работая с алкинонами в качестве привилегированных исходных материалов, общий синтез индила был выполнен с различными реактивантами, исследующими широкое исследование субстрата и изменяя характер заменяющих как нитросоаренов, так и на ароматических ynones. Группы электрон-снятия на C-нитрозароматических соединения привели нас к наблюдать улучшение как во времени реакции и в продуктах урожайности. Интересный синтетический подход, который делает легко доступны стабильную библиотеку этих соединений может быть очень полезным, и после предварительного исследования, мы оптимизировали наш синтетический протокол, используя этот stoichiometric реакции между алкинонов и 4-нитронитрособензен, чтобы позволить себе стабильные 3-aroyl-N-гидрокси-5-нитроиндолы. В принципе, этот легкий доступ к N-гидроксииндолы привел нас к доказательствам, как циклоaddition реакции между нитросоарен и алкинон является очень атом-экономический процесс.
протокол
1. Предварительная подготовка реагента Джонса
- Добавьте 25 г (0,25 моль) триоксида хрома с помощью шпателя в стакане 500 мл, который содержит магнитный перемешивание.
- Добавьте 75 мл воды и держите раствор под магнитным перемешиванием.
- Добавить медленно 25 мл концентрированной серной кислоты с осторожным перемешиванием и охлаждением в ледяной водяной бане.
ПРИМЕЧАНИЕ: Теперь решение готово и является стабильным и пригодным для многих процедур окисления; концентрация раствора, подготовленного этой процедурой, составляет 2,5 м.
2. Синтез 1-фенил-2-пропен-1-один
- Добавьте 75 мл ацетона в круглую нижнюю колбу под открытым небом, которая содержит магнитную перемешивание.
- Добавьте 2,0 г (15,13 ммоль) 1-фенил-2-пропен-1-ол через стеклянную пипетку Pasteur.
- Держите реакционную смесь при 0 градусах цельсия и под магнитным перемешиванием.
- Добавьте раствор реагента Jones dropwise до присутствия стойкого оранжевого цвета.
- Добавить 2-пропанол dropwise до избытка Cr (VI) реактивант потребляется до точки зеленого цвета.
- Фильтр раствора через площадку диатомовой земли.
- Концентрируйте промывки путем роторного испарения получения масла.
- Растворите масло в 100 мл CH2Cl2 и положите в сепараторную воронку.
- Вымойте эту органическую фазу насыщенным раствором NaHCO3 (2 x 125 мл).
- Вымойте органический слой рассолом (125 мл).
- Высушите органический раствор над anhydrous Na2SO SO4 и отфильтруйте его.
- Испарите раствор, получая 1,77 г 1-фенил-2-пропина-1 в виде желтого твердого (количественного урожая).
- Оставьте твердые высохнуть в вакууме.
- Анализируйте и характеризуйсь 1H-NMR.
3. Приготовление 4-нитронитробензена
- Добавьте 16 г пероксимоносульфата калия (2KHSO5) ХСО4 K2SO4) (26 ммоль) с помощью шпателя в стакане, открытом воздухе, который содержит магнитный перемешивание бар.
- Добавьте 150 мл воды и держите раствор при 0 градусах Цельсия при магнитном перемешивании.
- Добавьте 3,6 г 4-нитроанилина (26 моль) с помощью шпателя.
- Перемешать подвеску при комнатной температуре.
- Проверьте реакцию TLC до полного преобразования 4-нитроанилин (Rf4-нитроанилин 0,44, Rf4-Nitronrorosobenzene 0,77; CH2Cl2 как eluent).
- Фильтр сырой реакции смеси на Buchner после 48 ч.
- Положите твердые в одну шею круглой нижней колбе.
- Recrystallize твердых в метаноле (50 мл).
- Разогрейте подвеску с помощью тепловой пушки до точки кипения метанола и сразу процедите горячую подвеску.
- Отбросьте твердый и повторно использовать его в конечном итоге для другой рекристаллизации.
- Фильтр второй осадок, образуется в колбе Erlenmeyer, когда раствор достигает комнатной температуры.
- Оставьте твердые высохнуть в вакууме на воронке Бухнера.
- Характеризуй твердый по 1H-NMR.
4. Синтез 3-бензоила-1-гидрокси-5-нитроиндола
- Соедините всю запеченную стеклянную посуду (250 мл двухголой нижней колбы, содержащей магнитную перемешивание, стопкок, хладагент и сустав для подключения к вакуумной/азотной системе) и поставьте под вакуум в течение 30 мин.
- При комнатной температуре, после некоторых циклов вакуума/азота, промойте всю стеклянную посуду азотом и оставьте ее под инертной атмосферой.
- Добавьте 1,52 г (10 ммоль) 4-нитронитрособензена под инертную атмосферу.
- Добавьте 1,30 г (10 ммоль) 1-фенил-2-пропина-1-один.
- Добавьте 80 мл толуола через шприц и держите реакционную смесь при магнитном перемешивании при 80 градусах Цельсия.
- Через несколько минут проверьте полную растворимизацию реагентов.
- Проверьте образование оранжевого осадка примерно через 30-40 мин при 80 градусах Цельсия.
- После полного выпадения оранжевого твердого вещества (около 2,5 ч) выключите отопление и оставьте реакцию достичь комнатной температуры.
- Фильтр смеси и собирать 3-бензоил-1-гидрокси-5-нитроиндол, как оранжевый твердый на воронке Бухнера.
- Держите под вакуумом к сухости.
- Проанализируйте и охарактеризируйте твердый продукт по 1H- и 13C-NMR, FT-IR и HRMS.
Результаты
Препарат 4-нитронитрособензена 2 был достигнут путем окисления 4-нитроанилин 1 путем реакции с пероксимоносульфатом калия, как сообщается на рисунке 6. Продукт 2 был получен в 64% урожайности после рекристаллизации в MeOH (дважды) с 3-5% загрязнения 4,4'-бис-нитро-азоксибензен 6. Структура продукта 2 была подтверждена 1H-NMR(рисунок 7). 1 H-NMR (400 МГц, CDCl3): 8,53 (d, J 8,8 Гц, 2H), 8,07 (d, J 8,8 Гц, 2H).
Препарат 1-фенил-2-пропин-1-один 4 был предоставлен путем окисления 1-фенил-2-пропин-1-ол 3 с реагентом Джонса, как сообщается на рисунке 8. Продукт 4 был изолирован как желтый твердый в 90% урожайности и структура была подтверждена 1H-NMR(рисунок 9). 1 H-NMR (400 МГц, CDCl3): 8,10 (d, J - 7,4 Гц, 2H), 7,57 (т, J 7,4 Гц, 1 Hz), 7,43 (т, J 7,4 Гц, 2H), 3,36 (ы, 1H).
Синтез 3-бензоила-1-гидрокси-5-нитроиндола был осуществлен тепловой реакцией 4-нитронитрособензена 2 и 1-фенил-2-пропин-1 4 в толуол при 80 градусах По Цельсию, как уверялось на рисунке 10. Индоле соединение 5 был изолирован в 58% урожайности фильтрации после 2,5 ч. Азокси производные 6 был изолирован в 22% урожайности в качестве основного продукта материнского ликера после хроматографии (Rf 0,36) с использованием CH2Cl2/гексана 6/4 как eluent. Структура продукта 6 была подтверждена 1H-NMR(рисунок 11). 1 H-NMR (400 МГц, CDCl3): 8,47 (d, J - 9,2 Гц, 2H), 8,35 (д, J 9,2 Гц, 2H), 8,30 (д, J 9,2 Гц, 2H), 8,23 (d, J 9,2 Гц, 2H). Структура соединения 5 была определена FT-IR, 1H-NMR(рисунок 12), 13C-NMR(рисунок 13) и HRMS(рисунок 14 и рисунок 15).
FT-IR (диск KBr): 1619, 1560, 1518, 1336, 850, 817, 740, 700 см-1. 1 H-NMR (400 МГц, DMSO-d6): 12,68 (с, 1H, bs), 9,16 (d, J 2,3 Гц, 1 Hz), 8,38 (с, 1H), 8.22 (dd, J - 9.0 Гц, J 2.3 Гц, 1H), 7.85 (d, J 7.2 Hz, 2H), 7.74 (d, J 9.0 Hz, 1H), 7.66 (t, J q 7.2 Hz, 1H), 7.58 (t, J q 7Hz), 2 Hz). 13 Год C-NMR (400 МГц, DMSO-d6: 188.94, 143.24, 139.19, 136.58, 136.40, 131.81, 128.53, 122.05, 118.81, 118.25, 110.96, 110.96. HRMS (ESI-) calcd для C15H10N2O4: 281.0562 (М-1); найдено: 281.0565. HRMS (ESI)calcd для C15H10N2O4: 283.0719 (МЗ1), 305.0538 «МЗНа»; найдено: 283.0713, 305.0532.
1 H-NMR спектры были получены для соединений 2, 4, 5 и 6; 13 Год C-NMR были получены для соединения 5. Если иначе указано, все спектры были собраны при комнатной температуре. Масс-спектры высокого разрешения были получены для соединения 5 с ионизизацией ESI (положительной и отрицательной). ИК спектр был получен для соединения 5.
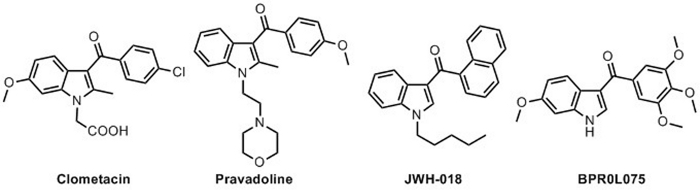
Рисунок 1: Различные 3-аройлиндольные соединения, показывающие биологическую активность. Клометацин (противовоспалительный препарат), правадолин (анальгетик), JWH-018 (агонист рецепторов CB1 и CB2) и BPR0L075 (антимитотический и противососудистое средство). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Некоторые примеры природных и синтетических N-гидрокси индолов. Бирнбамины А и В являются двумя токсичными желтыми пигментными соединениями, ингибиторами Lactate DeHydrogenase, Coproverdine a cytotoxic морской алкалоид из новозеландского асцидиана, Stephacidin B противоопухолевый алкалоид, изолированный от грибка Aspergillus ochraceus.

Рисунок 3: Предыдущие результаты исследований в процедуре межмолекулярной индолизации. Синтез индолов, N-гидроксииндолов и N-алкоксииндолов циклодугвинцией нитро- и нитросоаренов с алкининами Пожалуйста, нажмите здесь, чтобы посмотреть более крупную версию этой фигуры.

Рисунок 4: Применение синтетического подхода к приготовлению натуральных продуктов. Синтез меридианинов и аналогов через аннуляцию С-нитрозоаматики с этинилпиримидином соединениями. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
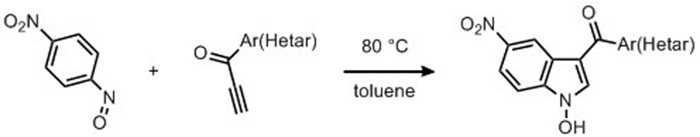
Рисунок 5: Последние события с использованием алкинона. Синтез 3-арозил-1-гидрокси-5-нитроиндолов путем циклизации 4-нитронитрособензена с конъюгированными ynones. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
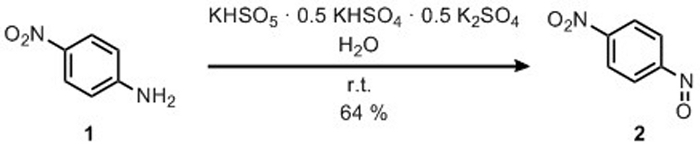
Рисунок 6: Препарат 4-нитро-нитрозобензена путем окисления 4-нитроанилин. Селективное окисление группы аминокислот в группу нитрозо. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
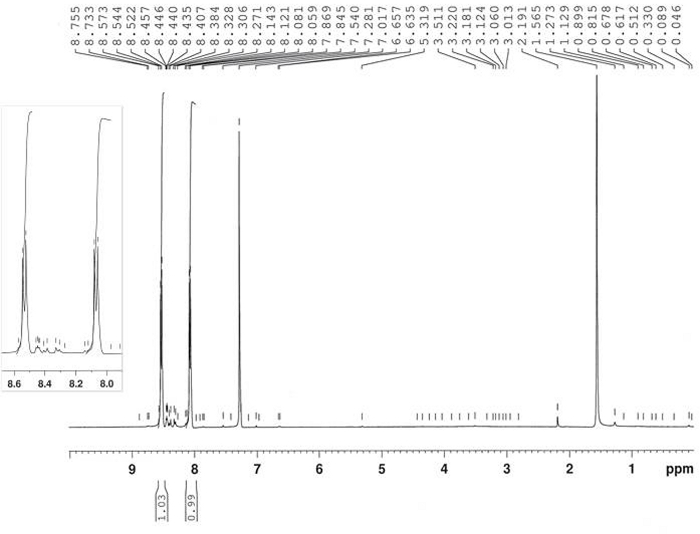
Рисунок 7: 1H-NMR спектр 4-нитронитрособензен (2). Типичный шаблон расщепления AA'BB показан здесь. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
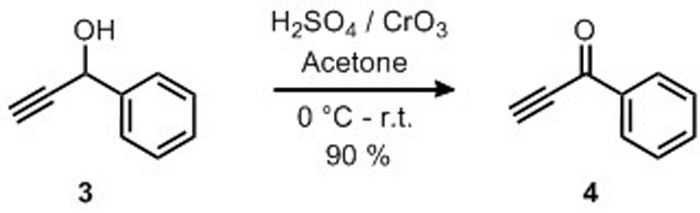
Рисунок 8: Приготовление 1-фенил-2-пропина-1 путем окисления 1-фенил-2-пропина-1-ол. Селективное окисление алкоголя в кетон. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
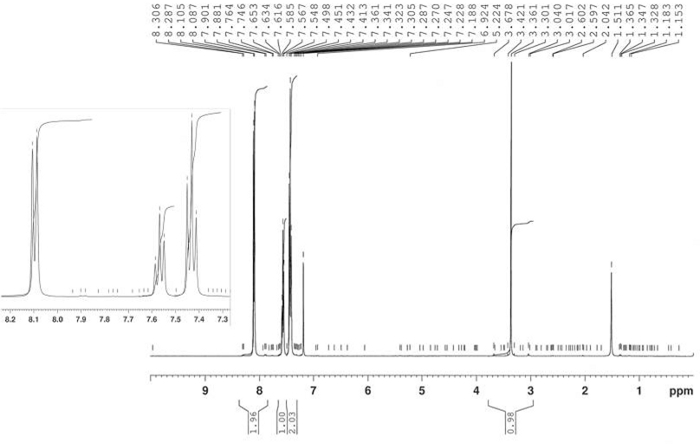
Рисунок 9: 1H-NMR спектр 1-фенил-2-пропен-1-один (4). Спектр монозамененного ароматического соединения с одним из терминального алкина. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 10: Синтез 3-бензоила-1-гидрокси-5-нитроиндола (5) циклодуговством 2 и 4. Режиоселективный синтез индолов, начиная с терминального ynone и нитросоарена. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
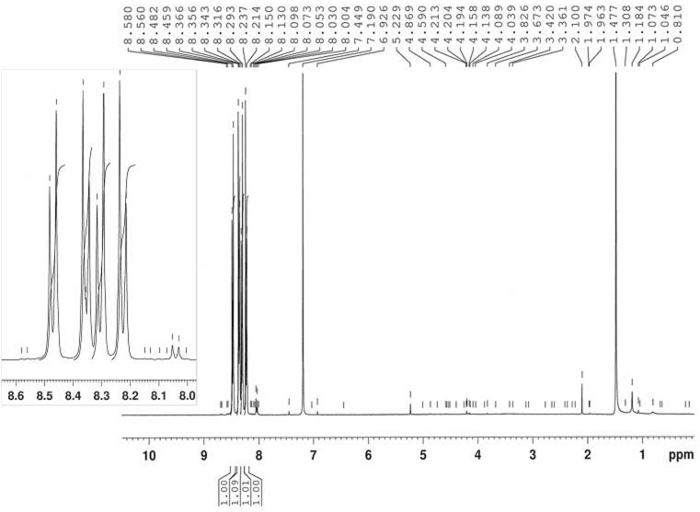
Рисунок 11: 1Спектр H-NMR 4,4'-бис-нитроазоксибензен (6). Типичный двойной AA'BB'bb'расщепления картина показана здесь для основных побочный продукт. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
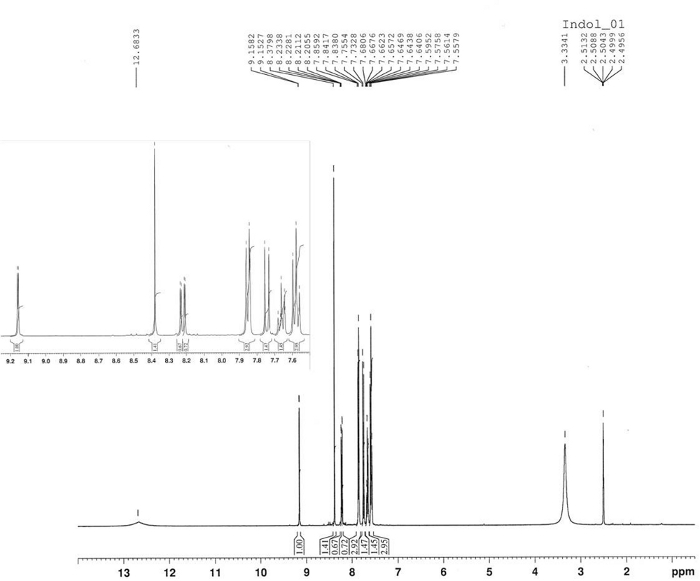
Рисунок 12: 1Спектр H-NMR 3-бензоил-1-гидрокси-5-нитроиндол (5). Спектр показывает ароматическую модель замены 3,5-дисунитного - N-гидоксииндола. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
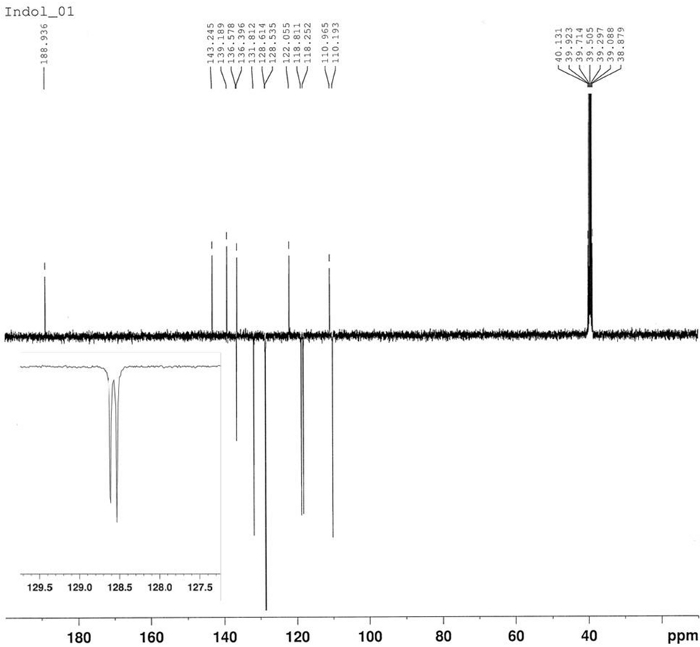
Рисунок 13: 13C-NMR спектр 3-бензоил-1-гидрокси-5-нитроиндол (5). Шесть сигналов для четырехместных атомов углерода и семь сигналов для атомов третичного углерода. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 14: HRMS (ESI- )спектр 3-бензоил-1-гидрокси-5-нитроиндол (5). Режим отрицательной ионизации масс-спектрометрии целевого соединения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 15: HRMS (ESI)спектр 3-бензоил-1-гидрокси-5-нитроиндол (5). Режим позитивной ионизации масс-спектрометрии целевого соединения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Реакция на синтез индола между нитросоаренами и алкинонами показывает очень высокую универсальность и сильное и широкое применение. В предыдущем докладе, мы могли бы обобщить наш синтетический протокол работы с различными C-нитрозоароматики и заменить терминал arylalkynones или heteroarylalkyones72. Процедура показывает глубокое обследование субстрата и высокую функциональную групповой толерантность, и как группы электрон-снятия, так и группы доноров электрон присутствовали как в нитросоарене, так и в алкиноне.
В качестве представительной реакции была зарегистрирована единая процедура индолаза циклоуговым циниро-нитрозбензеном с 1-фенил-2-пропин-1-один. После частичного обследования, толуол, был найден в качестве лучшего растворителя. Выполняя наш протокол, 3-бензоил-1-гидрокси-5-нитроиндол 5 высечен из реакционной смеси. Индоле продукт был единственным соединением, найденным в твердом веществе, которое было изолировано фильтрацией без какой-либо дальнейшей очистки. Анализ материнской ликеры привели нас к поиску и обнаружению единственного присутствия 4,4'-динитроазоксибензен 6 в качестве основного азотосодержащего побочного продукта вместе с неотреагированным алкиноном 4, а продукты были изолированы и очищены хроматографией (Rfazoxyarene 0.36 и Rfalkynone 0.30, используя CH2Cl2 / Hexane 6/elu). Азоксибензены являются типичными побочными продуктами реакций с нитросоаренами в качестве исходных материалов. Совсем недавно сообщалось, что этот класс соединений можно выборочно получить в качестве основных продуктов тепловых реакций, проводимых в широком спектре органических растворителей через редуктивное дезоксигенативное соединение С-нитрозоароматики73. В введенной нами процедуре72,с использованием 4-нитронитрозонзена с различными алкиненами осадки 3-ароил (гетероароил)-N-гидрокси-5-нитроиндолы всегда наблюдалось получение более десятка соединений. Другие C-нитрозоароматики, показывающие сильные замедляющие электрон, давали преимущественно образование 3-арозил-1-гидроксииндолов и/или 3-аройлиндола. Используя электрон богатых нитросоаренов, только 3-aroylindoles были обнаружены. Все индолы были произведены в умеренной до хорошей урожайности. Параллельное исследование недавно началось в нашей лаборатории, посвященное исследованию механизма реакции и оптимизации условий, пытающихся позволить себе целевые соединения с более высокими урожаями. Можно было бы поднять урожайность продукта, после фильтрации первого осадка, и добавить еще один эквивалент 4-нитронитрособензена к матери ликеры реакции и нагрева смеси. Это добавление и второй запуск приводят к образованию дальнейших осадков, достигая еще одного аликцитаты индиле продукта. Хорошо известно, что нитросоарины, как в растворе, так и даже в виде твердых веществ, могут присутствовать в качестве dimers74. Это, вероятно, способ, который способствует формированию азоксиаренов. Формирование этого бокового продукта вычитает два эквивалента нитросоарена циклоугу с алкиноном. Механистической гипотезы для подготовки соединений азокси была предложена Чуанг и его коллеги73. В принципе, процедура индолизации работает, вероятно, лучше при высоком разбавлении нитрозоаматического соединения. Высокая концентрация может быть пяткой Ахилла для конкурентной димеризации, которая тесно связана с образованием соединения азокси. На эту тему мы планируем попытаться запустить реакцию с медленным добавлением нитросоанена и было бы полезно установить аппарат для экспериментального выполнения процедуры реакции потока. В ближайшем будущем будут проведены дальнейшие эксперименты. Мы еще не построили твердую механистические гипотезы, чтобы объяснить образование 3-аройлиндолов. Тем не менее, в предыдущем докладе, работая с arylacetylenes, мы могли бы изучить механизм формирования 3-arylindoles определения того, что наиболее правдоподобным промежуточным, вероятно, дирадикальный specie67. Углеродно-азотная связь формируется во-первых, а затем циклизации путем формирования углеродно-углеродной связи.
Использование алкинона является ключевым моментом для нашего текущего исследования и подготовка терминала ynones является легкой процедурой. 1-Фенил-2-пропен-1-ол является единственным коммерчески доступным arylalkynol. Приготовление различных арилалкинонов и гетехаразилалкинонов было легко осуществлено, начиная с различных коммерчески доступных ароматических и гетероароматических альдегидов. Эти последние соединения были обработаны бромистом магния этинила для того чтобы произвести алкинолы реакциями часто унесенными на -78 C. Полученные вторичные алчохолы протаргила окисляются при реакции с различными агентами25,26,27. Эта процедура привела нас к тому, что терминалы ynones являются стабильными и твердыми соединениями. Нитросоаренены, в отличие от соответствующих нитроароматических и анилин, не легко коммерчески доступны и были подготовлены путем окисления соответствующих анилин19,20,21,22,23,24. Это может быть полезно для изучения нашего синтетического подхода путем формирования на месте нитрозосоединений путем окисления или сокращения. Недавние исследования Ragaini и его коллег сообщили о образовании C-нитрозоароматики, начиная с нитроароматических прекурсоров75, 76,77,78. Открытие, введение, изучение и применение новых протоколов индолизации, которые могли бы производить индолы режиоклеизбирательно и с очень высокой атомной экономии, являются актуальными темами в синтетической органической химии, и мы уверены, что эта методология через циклизацию между нитросоаренами и алкинонами может быть полезна для различных исследовательских групп.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Д-р Энрика Альберти и д-р Марта Брука признаны за сбор и регистрацию спектра ЯМР. Мы благодарим д-ра Франческо Тибилетти и д-ра Габриэллу Иеронимо за полезные обсуждения и экспериментальную помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| 4-Nitroaniline | TCI Chemicals | N0119 | |
| Acetone | TCI Chemicals | A0054 | |
| 1-Phenyl-2-propyne-1-ol | TCI Chemicals | P0220 | |
| Celite 535 | Fluorochem | 44931 | |
| Dichloromethane | TCI Chemicals | D3478 | |
| Sodium hydrogen carbonate | Sigma Aldrich | S5761 | |
| Sodium chloride | Sigma Aldrich | 746398 | |
| Sodium sulfate anhydrous | Sigma Aldrich | 239313 | |
| Oxone | TCI Chemicals | O0310 | |
| Methanol | TCI Chemicals | M0628 | |
| Toluene | TCI Chemicals | T0260 | |
| Chromium Trioxide | Sigma Aldrich | 236470 | |
| Dichloromethane anhydrous | TCI Chemicals | D3478 | |
| Hexane anhydrous | TCI Chemicals | H1197 |
Ссылки
- Vančik, H. Aromatic C-nitroso Compounds. , Springer. Dordrecht. (2013).
- Whittaker, R. E., Dermenci, A., Dong, G. Synthesis of Ynones and Recent Application in Transition-Metal-Catalyzed Reactions. Synthesis. 48 (2), 161-183 (2016).
- Carosso, S., Miller, M. J. Nitroso Diels-Alder (NDA) reaction as an efficient tool for the functionalization of diene-containing natural products. Organic Biomolecular Chemistry. 12 (38), 7445-7468 (2014).
- Maji, B., Yamamoto, H. Catalytic Enantioselective Nitroso Diels-Alder Reaction. Journal of the American Chemical Society. 137 (50), 15957-15963 (2015).
- Momiyama, N., Yamamoto, H. Enantioselective O- and N-Nitroso Aldol Synthesis of Tin Enolates. Isolation of Three BINAP-Silver Complexes and Their Role in Regio- and Enantioselectivity. Journal of the American Chemical Society. 126 (17), 5360-5361 (2004).
- Hayashi, Y., Yamaguchi, J., Sumiya, T., Shoji, M. Direct proline-catalyzed asymmetric alpha-aminoxylation of ketones. Angewandte Chemie International Edition. 43 (9), 1112-1115 (2004).
- Adam, W., Krebs, O. The Nitroso Ene Reaction: A Regioselective and Stereoselective Allylic Nitrogen Functionalization of Mechanistic Delight and Synthetic Potential. Chemical Reviews. 103 (10), 4131-4146 (2003).
- Merino, E. Synthesis of azobenzenes: the coloured pieces of molecular materials. Chemical Society Reviews. 40 (7), 3835-3853 (2011).
- Yu, B. C., Shirai, Y., Tour, J. M. Syntheses of new functionalized azobenzenes for potential molecular electronic devices. Tetrahedron. 62 (44), 10303-10310 (2006).
- Priewisch, B., Rück-Braun, K. Efficient Preparation of Nitrosoarenes for the Synthesis of Azobenzenes. The Journal of Organic Chemistry. 70 (6), 2350-2352 (2005).
- Wu, M. Y., He, W. W., Liu, X. Y., Tan, B. Asymmetric Construction of Spirooxindoles by Organocatalytic Multicomponent Reactions Using Diazooxindoles. Angewandte Chemie International Edition. 54 (32), 9409-9413 (2015).
- Sharma, P., Liu, R. S. [3+2]-Annulations of N-Hydroxy Allenylamines with Nitrosoarenes: One-Pot Synthesis of Substituted Indole Products. Organic Letters. 18 (3), 412-415 (2016).
- Wróbel, Z., Stachowska, K., Grudzień, K., Kwast, A. N-Aryl-2-nitrosoanilines as Intermediates in the Two-Step Synthesis of Substituted 1,2-Diarylbenzimidazoles from Simple Nitroarenes. Synlett. 22 (10), 1439-1443 (2011).
- Oakdale, J. S., Sit, R. K., Fokin, V. V. Ruthenium-Catalyzed Cycloadditions of 1-Haloalkynes with Nitrile Oxides and Organic Azides: Synthesis of 4-Haloisoxazoles and 5-Halotriazoles. Chemistry a European Journal. 20 (35), 11101-11110 (2014).
- Abbiati, G., Arcadi, A., Marinelli, F., Rossi, E. Sequential Addition and Cyclization Processes of α,β-Ynones and α,β-Ynoates Containing Proximate Nucleophiles. Synthesis. 46 (6), 687-721 (2014).
- Zhang, Z., et al. Chiral Co(II) complex catalyzed asymmetric Michael reactions of β-ketoamides to nitroolefins and alkynones. Tetrahedron Letters. 55 (28), 3797-3801 (2014).
- Bella, M., Jørgensen, K. A. Organocatalytic Enantioselective Conjugate Addition to Alkynones. Journal of the American Chemical Society. 126 (18), 5672-5673 (2004).
- Karpov, A. S., Merkul, E., Rominger, F., Müller, T. J. J. Concise Syntheses of Meridianins by Carbonylative Alkynylation and a Four-Component Pyrimidine Synthesis. Angewandte Chemie Internationa Edition. 44 (42), 6951-6956 (2005).
- Krebs, O. Dissertation, Wurzburg. , Wurzburg. available at http://www.bibliothek.uni-wuerzburg.de from the OPUS server (2002).
- Mel'nikov, E. B., Suboch, G. A., Belyaev, E. Y. Oxidation of Primary Aromatic Amines, Catalyzed by Tungsten Compounds. Russian Journal of Organic Chemistry. 31 (12), 1640-1642 (1995).
- Porta, F., Prati, L. Catalytic synthesis of C-nitroso compounds by cis-Mo(O)2(acac)2. Journal of Molecular Catalysis. A: Chemical. 157 (1-2), 123-129 (2000).
- Biradar, A. V., Kotbagi, T. V., Dongare, M. K., Umbarkar, S. B. Selective N-oxidation of aromatic amines to nitroso derivatives using a molybdenum acetylide oxo-peroxo complex as catalyst. Tetrahedron Letters. 49 (22), 3616-3619 (2008).
- Defoin, A. Simple Preparation of Nitroso Benzenes and Nitro Benzenes by Oxidation of Anilines with H2O2 Catalysed with Molybdenum Salts. Synthesis. 36 (5), 706-710 (2004).
- Zhao, D., Johansson, M., Bäckvall, J. E. In Situ Generation of Nitroso Compounds from Catalytic Hydrogen Peroxide Oxidation of Primary Aromatic Amines and Their One-Pot Use in Hetero-Diels-Alder Reactions. European Journal of Organic Chemistry. (26), 4431-4436 (2007).
- Pigge, F. C., et al. Structural characterization of crystalline inclusion complexes formed from 1,3,5-triaroylbenzene derivatives-a new family of inclusion hosts. Journal of Chemical Society, Perkin Transactions 2. (12), 2458-2464 (2000).
- Scansetti, M., Hu, X., McDermott, B., Lam, H. W. Synthesis of Pyroglutamic Acid Derivatives via Double Michael Reactions of Alkynones. Organic Letters. 9 (11), 2159-2162 (2007).
- Ge, G. C., Mo, D. L., Ding, C. H., Dai, L. X., Hou, X. L. Palladacycle-Catalyzed Reaction of Bicyclic Alkenes with Terminal Ynones: Regiospecific Synthesis of Polysubstituted Furans. Organic Letters. 14 (22), 5756-5759 (2012).
- Maeda, Y., et al. Oxovanadium Complex-Catalyzed Aerobic Oxidation of Propargylic Alcohols. The Journal of Organic Chemistry. 67 (19), 6718-6724 (2002).
- Gribble, G. W. Indole Ring Synthesis: from Natural Products to Drug Discovery. , Wiley & Sons Ltd. Chichester. (2016).
- Palmisano, G., et al. Synthesis of Indole Derivatives with Biological Activity by Reactions Between Unsaturated Hydrocarbons and N-Aromatic Precursors. Current Organic Chemistry. 14 (20), 2409-2441 (2010).
- Youn, S. W., Ko, T. Y. Metal-Catalyzed Synthesis of Substituted Indoles. Asian Journal of Organic Chemistry. 7 (8), 1467-1487 (2018).
- Bugaenko, D. I., Karchava, A. V., Yurovskaya, M. A. Synthesis of indoles: recent advances. Russian Chemical Reviews. 88 (2), 99-159 (2019).
- Kuo, C. C., et al. BPR0L075, a Novel Synthetic Indole Compound with Antimitotic Activity in Human Cancer Cells, Exerts Effective Antitumoral Activity in Vivo. Cancer Research. 64 (13), 4621-4628 (2004).
- Kaushik, N. K., et al. Biomedical Importance of Indoles. Molecules. 18 (6), 6620-6662 (2013).
- El Sayed, M. T., Hamdy, N. A., Osman, D. A., Ahmed, K. M. Indoles as anti-cancer agents. Advances in Modern Oncology Research. 1 (1), 20-35 (2015).
- Somei, M., et al. The Chemistry of 1-Hydroxyindole Derivatives: Nucleophilic Substitution Reactions on Indole Nucleus. Heterocycles. 34 (10), 1877-1884 (1992).
- Somei, M., Fukui, Y. Nucleophilic Substitution Reaction of 1-Hydroxytryptophan and 1-Hydroxytryptamine Derivatives (Regioselective Syntheses of 5-Substituted Derivatives of Tryptophane and Tryptamine. Heterocycles. 36 (8), 1859-1866 (1993).
- Somei, M., Fukui, Y., Hasegawa, M. Preparations of Tryptamine-4,5-dinones, and Their Diels-Alder and Nucleophilic Addition Reactions. Heterocycles. 41 (10), 2157-2160 (1995).
- Somei, M. The Chemistry of 1-Hydroxyindoles and Their Derivatives. Journal of Synthetic Organic Chemistry (Japan). 49 (3), 205-217 (1991).
- Rani, R., Granchi, C. Bioactive heterocycles containing endocyclic N-hydroxy groups. European Journal of Medicinal Chemistry. 97, 505-524 (2015).
- Escolano, C. Stephacidin B, the avrainvillamide dimer: a formidable synthetic challenge. Angewandte Chemie, International Edition. 44 (47), 7670-7673 (2005).
- Blunt, J. W., Munro, M. H. G. Coproverdine, a Novel, Cytotoxic Marine Alkaloid from a New Zealand Ascidian Sylvia Urban. Journal of Natural Products. 65 (9), 1371-1373 (2002).
- Li, W., Huang, S., Liu, X., Leet, J. E., Cantone, J., Lam, K. S. N-Demethylation of nocathiacin I via photo-oxidation. Bioorganic and Medicinal Chemistry Letters. 18 (14), 4051-4053 (2008).
- Tsukamoto, S., et al. Notoamides F-K, Prenylated Indole Alkaloids Isolated from a Marine-Derived Aspergillus sp. Journal of Natural Products. 71 (12), 2064-2067 (2008).
- Nicolaou, K. C., Lee, S. H., Estrada, A. A., Zak, M. Construction of Substituted N-Hydroxyindoles: Synthesis of a Nocathiacin I Model System. Angewandte Chemie, International Edition. 44 (24), 3736-3740 (2005).
- Nicolaou, K. C., Estrada, A. A., Lee, S. H., Freestone, G. C. Synthesis of Highly Substituted N-Hydroxyindoles through 1,5-Addition of Carbon Nucleophiles to In Situ Generated Unsaturated Nitrones. Angewandte Chemie, International Edition. 45 (32), 5364-5368 (2006).
- Nicolaou, K. C., Estrada, A. A., Freestone, G. C., Lee, S. H., Alvarez-Mico, X. New synthetic technology for the construction of N-hydroxyindoles and synthesis of nocathiacin I model systems. Tetrahedron. 63 (27), 6088-6114 (2007).
- Chan, S. T. S., Norrie Pearce, A., Page, M. J., Kaiser, M., Copp, B. R. Antimalarial β-Carbolines from the New Zealand Ascidian Pseudodistoma opacum. Journal of Natural Products. 74 (9), 1972-1979 (2011).
- Bartsch, A., Bross, M., Spiteller, P., Spiteller, M., Steglich, W. Birnbaumin A and B: Two Unusual 1-Hydroxyindole Pigments from the "Flower Pot Parasol" Leucocoprinus birnbaumii. Angewandte Chemie., International Edition. 44 (19), 2957-2959 (2005).
- Di Bussolo, V., et al. Synthesis and biological evaluation of non-glucose glycoconjugated N-hydroyxindole class LDH inhibitors as anticancer agents. RSC Advances. 5 (26), 19944-19954 (2015).
- Granchi, C., et al. Discovery of N-Hydroxyindole-Based Inhibitors of Human Lactate Dehydrogenase Isoform A (LDH-A) as Starvation Agents against Cancer Cells. Journal of Medicinal Chemistry. 54 (6), 1599-1612 (2011).
- Granchi, C., et al. N-Hydroxyindole-based inhibitors of lactate dehydrogenase against cancer cell proliferation. European Journal of Medicinal Chemistry. 46 (11), 5398-5407 (2011).
- Granchi, C., et al. Synthesis of sulfonamide-containing N-hydroxyindole-2-carboxylates as inhibitors of human lactate dehydrogenase-isoform 5. Bioorganic Medicinal Chemistry Letters. 21 (24), 7331-7336 (2011).
- Granchi, C., et al. Assessing the differential action on cancer cells of LDH-A inhibitors based on the N-hydroxyindole-2-carboxylate (NHI) and malonic (Mal) scaffolds. Organic Biomolecular Chemistry. 11 (38), 6588-6596 (2013).
- Minutolo, F., et al. Compounds Inhibitors of Enzyme Lactate Dehydrogenase (LDH) and Pharmaceutical Compositions Containing These Compounds. Chemical Abstracts. , WO 2011054525 154(2011).
- Granchi, C., et al. Triazole-substituted N-hydroxyindol-2-carboxylates as inhibitors of isoform 5 of human lactate dehydrogenase (hLDH5). Medicinal Chemistry Communications. 2 (7), 638-643 (2011).
- Kuethe, J. T. A General Approach to Indoles: Practical Applications for the Synthesis of Highly Functionalized Pharmacophores. Chimia. 60 (9), 543-553 (2006).
- Somei, M. 1-Hydroxyindoles. Heterocycles. 50 (2), 1157-1211 (1999).
- Belley, M., Beaudoin, D., Duspara, P., Sauer, E., St-Pierre, G., Trimble, L. A. Synthesis and Reactivity of N-Hydroxy-2-Amino-3-Arylindoles. Synlett. 18 (19), 2991-2994 (2007).
- Belley, M., Sauer, E., Beaudoin, D., Duspara, P., Trimble, L. A., Dubé, P. Synthesis and reactivity of N-hydroxy-2-aminoindoles. Tetrahedron Letters. 47 (2), 159-162 (2006).
- Hasegawa, M., Tabata, M., Satoh, K., Yamada, F., Somei, M. A Novel Dimerization of 1-Hydroxyindoles. Heterocycles. 43 (11), 2333-2336 (1996).
- Tollari, S., Penoni, A., Cenini, S. The unprecedented detection of the intermediate formation of N-hydroxy derivatives during the carbonylation of 2'-nitrochalcones and 2-nitrostyrenes catalysed by palladium. Journal of Molecular Catalysis A: Chemical. 152 (1-2), 47-54 (2000).
- Penoni, A., Nicholas, K. M. A novel and direct synthesis of indoles via catalytic reductive annulation of nitroaromatics with alkynes. Chemical Communication. 38 (5), 484-485 (2002).
- Penoni, A., Volkman, J., Nicholas, K. M. Regioselective Synthesis of Indoles via Reductive Annulation of Nitrosoaromatics with Alkynes. Organic Letters. 4 (5), 699-701 (2002).
- Penoni, A., Palmisano, G., Broggini, G., Kadowaki, A., Nicholas, K. M. Efficient Synthesis of N-Methoxyindoles via Alkylative Cycloaddition of Nitrosoarenes with Alkynes. The Journal of Organic Chemistry. 71 (2), 823-825 (2006).
- Ieronimo, G., et al. A simple, efficient, regioselective and one-pot preparation of N-hydroxy- and N-O-protected hydroxyindoles via cycloaddition of nitrosoarenes with alkynes. Synthetic scope, applications and novel by-products. Tetrahedron. 69 (51), 10906-10920 (2013).
- Penoni, A., Palmisano, G., Zhao, Y. L., Houk, K. N., Volkman, J., Nicholas, K. M. On the Mechanism of Nitrosoarene-Alkyne Cycloaddition. Journal of the American Chemical Society. 131 (2), 653-661 (2009).
- Tibiletti, F., et al. One-pot synthesis of meridianins and meridianin analogues via indolization of nitrosoarenes. Tetrahedron. 66 (6), 1280-1288 (2010).
- Walker, S. R., Carter, E. J., Huff, B. C., Morris, J. C. Variolins and Related Alkaloids. Chemical Reviews. 109 (7), 3080-3098 (2009).
- Walker, S. R., Czyz, M. L., Morris, J. C. Concise Syntheses of Meridianins and Meriolins Using a Catalytic Domino Amino-Palladation Reaction. Organic Letters. 16 (3), 708-711 (2014).
- Tibiletti, F., Penoni, A., Palmisano, G., Maspero, A., Nicholas, K. M., Vaghi, L. (1H-Benzo[d][1,2,3]triazol=1-yl)(5-bromo-1-hydroxy-1H-indol-3-yl)methanone. Molbank. 2014 (3), 829(2014).
- Ieronimo, G., et al. A novel synthesis of N-hydroxy-3-aroylindoles and 3-aroylindoles. Organic Biomolecular Chemistry. 16 (38), 6853-6859 (2018).
- Chen, Y. F., Chen, J., Lin, L. J., Chuang, G. J. Synthesis of Azoxybenzenes by Reductive Dimerization of Nitrosobenzene. The Journal of Organic Chemistry. 82 (21), 11626-11630 (2017).
- Beaudoin, D., Wuest, J. D. Dimerization of Aromatic C-Nitroso Compounds. Chemical Reviews. 116 (1), 258-286 (2016).
- EL-Atawy, M. A., Formenti, D., Ferretti, F., Ragaini, F. Synthesis of 3,6-Dihydro-2H-[1, 2]-Oxazines from Nitroarenes and Conjugated Dienes, Catalyzed by Palladium/Phenanthroline Complexes and Employing Phenyl Formate as a CO Surrogate. ChemCatChem. 10 (20), 4707-4717 (2018).
- Formenti, D., Ferretti, F., Ragaini, F. Synthesis of N-Heterocycles by Reductive Cyclization of Nitro Compounds using Formate Esters as Carbon Monoxide Surrogates. ChemCatChem. 10 (1), 148-152 (2018).
- EL-Atawy, M. A., Ferretti, F., Ragaini, F. A Synthetic Methodology for Pyrroles from Nitrodienes. European Journal of Organic Chemistry. (34), 4818-4825 (2018).
- Ragaini, F., Cenini, S., Brignoli, D., Gasperini, M., Gallo, E. Synthesis of oxazines and N-arylpyrroles by reaction of unfunctionalized dienes with nitroarenes and carbon monoxide, catalyzed by palladium-phenanthroline complexes. The Journal of Organic Chemistry. 68 (2), 460-466 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены