Method Article
Eine direkte, regioselektive und atomökonomische Synthesevon 3-Aroyl-N-Hydroxy-5-Nitroindolen durch Cycloaddition von 4-Nitronitrosobenzol mit Alkynonen
In diesem Artikel
Zusammenfassung
3-Aroyl-N-Hydroxy-5-Nitroindole wurden durch Cycloaddition von 4-Nitronitrosobenzol mit einem konjugierten terminalen Alkyn in einem einstufigen thermischen Verfahren synthetisiert. Die Vorbereitung des Nitrosarens und der Alkynone wurde angemessen und jeweils durch Oxidationsverfahren an der entsprechenden Aniline und am Alkyno berichtet.
Zusammenfassung
Wir führten ein regioselektives und atomökonomisches Verfahren zur Synthese von 3-substituierten Indolen durch Annulation von Nitrosoarenen mit Ethynylketonen ein. Die Reaktionen wurden durchgeführt und erreichten Indole ohne Katalysator und mit ausgezeichneter Regioselektivität. Es wurden keine Spuren von 2-Aroylindol-Produkten festgestellt. Die 3-Aroyl-N-Hydroxy-5-Nitroindole-Produkte,die mit 4-Nitronitrosobenzol als Ausgangsmaterial arbeiten, sind aus den Reaktionsgemischen ausgegleitet und durch Filtration ohne weitere Reinigungstechnik isoliert. Im Gegensatz zu den entsprechenden N-Hydroxy-3-Aryl-Indolen, die spontan in Lösung Dehydrodimerisierungsprodukte geben, sind die N-Hydroxy-3-Aroyl-Indole stabil und es wurden keine Dimerisierungsverbindungen beobachtet.
Einleitung
Aromatische C-Nitroso-Verbindungen1 und Alkynone2 sind vielseitige Reaktanten, die kontinuierlich und tief verwendet und als Ausgangsstoffe für die Herstellung von hochwertig verwendeten Verbindungen untersucht werden. Nitrosoarene spielen eine ständig wachsende Rolle in der organischen Synthese. Sie werden für viele verschiedene Zwecke verwendet (z.B. Hetero-Diels-Alder-Reaktion3,4, Nitroso-Aldol-Reaktion5,6, Nitroso-Ene-Reaktion7, Synthese von Azocompounds8,9,10). Erst vor kurzem wurden sie sogar als Ausgangsstoffe verwendet, um sich verschiedene heterozyklische Verbindungen zu leisten11,12,13. In den letzten Jahrzehnten wurden konjugierte Ynones auf ihre Rolle als sehr interessante und nützliche Gerüste bei der Erzielung vieler wertvoller Derivate und heterozyklischer Produkte14,15,16,17,18untersucht. C-Nitrosoaromatik kann durch Oxidationsreaktionen der entsprechenden und handelsüblichen Aniline mit verschiedenen Oxidationsmitteln wie Kaliumperoxymonosulfat (KHSO50,5KHSO40,5K2SO4)19, Na2WO4/H2O220, Mo(VI)-komplexe/H2O221,22,23, Selenderivate 24. Alkynone lassen sich durch Oxidation der entsprechenden Alkynoe mit verschiedenen Oxidationsmitteln leicht herstellen (CrO325 auch als Jones'-Reagenz oder milde Reaktanzien als MnO226 und Dess-Martin Periodinane27bekannt). Die Alkynoe können durch direkte Reaktion von Ethynylmagnesiumbromid mit handelsüblichen Arylaldehyden oder Heteroarylaldehyden28erreicht werden.
Indole ist wahrscheinlich die am meisten untersuchte heterozyklische Verbindung und Indolederivate haben breite und verschiedene Anwendungen in vielen verschiedenen Forschungsbereichen. Sowohl medizinische Chemiker als auch Materialwissenschaftler produzierten viele Produkte auf Indole-Basis, die verschiedene Funktionen und potenzielle Aktivitäten abdecken. Indole-Verbindungen wurden von vielen Forschungsgruppen untersucht und sowohl natürlich vorkommende Produkte als auch synthetische Derivate, die das Indole-Framework enthalten, weisen relevante und eigenartige Eigenschaften29,30,31,32. Unter den vielen Indolenverbindungen spielen die 3-Aroylindole eine relevante Rolle unter Molekülen, die biologische Aktivitäten aufweisen (Abbildung 1). Verschiedene Indole-Produkte gehören zu verschiedenen Klassen von pharmazeutischen Kandidaten, um potenzielle neuartige Medikamente zu werden33. Synthetische und natürlich vorkommende 3-Aroylindole sind dafür bekannt, eine Rolle als antibakterielle, antimittische, schmerzlindernde, antivirale, entzündungshemmende, antinociceptic, Antidiabetika und Anti-Krebs34,35. Die "1-Hydroxyindol-Hypothese" wurde provokativ von Somei und Kollegen als interessante und stimulierende Vermutung eingeführt, um die biologische Rolle von N-Hydroxyindoden bei der Biosynthese und Funktionalisierung von Indolalkaloiden36,37, 38,39zu unterstützen. Diese Annahme wurde vor kurzem durch die Beobachtung vieler endogener n-hydroxy-heterozyklischer Verbindungen verstärkt, die relevante biologische Aktivitäten und eine interessante Rolle für viele Zwecke als Pro-Drogen40zeigen. In den letzten Jahren ergab die Suche nach neuartigen pharmazeutischen Wirkstoffen, dass verschiedene N-Hydroxyindole-Fragmente in natürlichen Produkten und bioaktiven Verbindungen nachgewiesen und entdeckt wurden (Abbildung 2): Stephacidin B41 und Coproverdine42 sind als Antitumoralkaloide bekannt, Thiazomycine43 (A und D), Notoamid G44 und Nocathacins45,46,47 (I, III, IV) sind tief untersucht Antibiotika, Opacaline B48 ist ein natürliches Alkaloid aus ascidian Pseudodistoma Opacum und Birnbaumin A und B sind zwei Pigmente aus Leucocoprinus birnbaumii49. Neue und effiziente N-Hydroxyindole-basierte Inhibitoren von LDH-A (Lactat DeHydrogenase-A) und ihre Fähigkeit, die Glukose-zu-Laktat-Umwandlung innerhalb der Zelle zu reduzieren, wurden 50,51,52,53,54,55,56entwickelt. Andere Forscher wiederholten, dass Indole-Verbindungen, die keine biologischen Aktivitäten zeigten, nach dem Einsetzen einer N-Hydroxy-Gruppe57zu nützlichen Pro-Medikamenten wurden.
Ein Motiv der Debatte war die Stabilität von N-Hydroxyindoden und einige dieser Verbindungen gaben leicht eine Enthydrodimerisierungsreaktion, die zur Bildung einer Klasse neuartiger Verbindungen führt, die später in Kabutane58,59, 60,61umbenannt werden, durch die Bildung einer neuen C-C-Bindung und zweier neuer C-O-Bindungen. Aufgrund der Bedeutung stabiler N-Hydroxyindole wird die Untersuchung verschiedener synthetischer Ansätze zur einfachen Herstellung solcher Verbindungen zu einem grundistischen Thema. In einer früheren Forschung von einigen von uns wurde eine intramolekulare Cyclisierung durch eine Cadogan-Sundberg-Typ-Reaktion mit Nitrostyren und Nitrostilbene als Ausgangsmaterialien62berichtet. In den letzten Jahrzehnten haben wir eine neuartige Cycloaddition zwischen Nitro- und Nitrosoarenen mit verschiedenen Alkynen in intermolekularer Weise entwickelt, die Indole, N-Hydroxy-und N-Alkoxyindole als Hauptprodukte ermöglicht (Abbildung 3).
Am Anfang wurden die Reaktionen mit aromatischen und aliphatischen Alkyne63,64,65,66,67 in großem Alkynüberschuss (10- oder 12-fach) und manchmal unter alkylativen Bedingungen durchgeführt, um die Bildung von Kabutanen zu vermeiden. 3-Substituierte Indoleprodukte wurden regioselektiv in moderaten bis guten Erträgen erzielt. Mit elektronenarmen Alkyne, wie 4-Ethynylpyrimidin-Derivaten als privilegierte Substrate, konnten wir die Reaktionen für dieses synthetische Ein-Topf-Protokoll mit einem 1/1 Nitrosoaren/Alkynmolverhältnis68durchführen. Mit diesem Protokoll wurde eine interessante Klasse von Kinase-Inhibitoren als Meridianine, marine Alkaloide isoliert aus Aplidium meridianum69, vorbereitet, die einen anderen Ansatz für Meridianine durch ein Indolisationsverfahren zeigen (Abbildung 4)68. Meridianine wurden in der Regel bisher mit synthetischen Werkzeugen hergestellt, beginnend mit vorgeformten Indole-Reaktanten. Nach bestem Wissen und Gewissen berichteten nur einige Methoden über die Gesamtsynthese von Meridianinen oder Meridianinderivaten durch ein Indolisationsverfahren68,70.
In einer neueren Entwicklung über den Einsatz von elektronenarmen Alkynen hat es sich gelohnt, die Verwendung von terminalen Alkynonen als Substrate für das Indolisationsverfahren zu testen, was uns dazu veranlasste, eine intermolekulare synthetische Technik offenzulegen, um sich 3-Aroyl-N-Hydroxyindole-Produkte71,72zu leisten. Analog zu dem verfahren, das für die Herstellung von Meridianinen untersucht wurde, wurde unter Verwendung von terminalen Arylalkynverbindungen das 1/1 Ar-N=O/Ar-(C=O)-C-CH-Molarenverhältnis verwendet (Abbildung 5). Die allgemeine Indolesynthese wurde mit Alkynonen als privilegierten Ausgangsstoffen durchgeführt, wobei verschiedene Reaktanten eine breite Substratuntersuchung untersuchten und die Art der Substituenten sowohl auf Nitrosoarenen als auch auf den aromatischen Ynonen veränderten. Elektronenzurückziehende Gruppen auf der C-nitrosaromatischen Verbindung führten dazu, dass wir sowohl in den Reaktionszeiten als auch bei den Produkterträgen eine Verbesserung beobachteten. Ein interessanter synthetischer Ansatz, der eine stabile Bibliothek dieser Verbindungen leicht verfügbar macht, könnte sehr nützlich sein und nach einer Vorstudie haben wir unser synthetisches Protokoll mit dieserstoichiometrischen Reaktion zwischen Alkynonen und 4-Nitronitrosobenzol optimiert, um stabile 3-Aroyl-N-Hydroxy-5-Nitroindole zu leisten. Grundsätzlich führte uns dieser einfache Zugang zu N-Hydroxyindoden zu Beweisen, da die Cycloadditionsreaktion zwischen Nitrosoaren und Alkynein ein sehr atomökonomischer Prozess ist.
Protokoll
1. Vorvorbereitung des Jones Reagenz
- Fügen Sie 25 g (0,25 mol) Chromtrioxid mit einem Spachtel in einem 500 ml Becher hinzu, der einen magnetischen Rührstab enthält.
- 75 ml Wasser hinzufügen und die Lösung unter magnetischem Rühren aufbewahren.
- 25 ml konzentrierte Schwefelsäure mit sorgfältigem Rühren und Abkühlen in einem Eiswasserbad langsam hinzufügen.
HINWEIS: Jetzt ist die Lösung fertig und stabil und für viele Oxidationsverfahren nutzbar; die Konzentration der durch dieses Verfahren hergestellten Lösung beträgt 2,5 Mio. M.
2. Synthese von 1-Phenyl-2-Propyne-1-eins
- Fügen Sie 75 ml Aceton in einen offenen runden Bodenkolben, der einen magnetischen Rührstab enthält.
- 2,0 g (15,13 mmol) 1-Phenyl-2-Propyne-1-ol über eine glasige Pasteurpipette hinzufügen.
- Halten Sie das Reaktionsgemisch bei 0 °C und unter magnetischem Rühren.
- Fügen Sie eine Lösung von Jones Reagenz tropfenweise bis zum Vorhandensein einer persistenten orange Farbe.
- Fügen Sie 2-Propanol tropfenweise, bis der Überschuss von Cr(VI) Reaktanten bis zu einem Punkt einer grünen Farbe verbraucht wird.
- Filtern Sie die Lösung durch ein Pad aus diatomacer Erde.
- Konzentrieren Sie die Waschungen durch Rotationsverdunstung, wodurch ein Öl erhalten wird.
- Das Öl in 100 ml CH2Cl2 auflösen und in einen Trenntrichter legen.
- Waschen Sie diese organische Phase mit einer gesättigten Lösung von NaHCO3 (2 x 125 ml).
- Waschen Sie die organische Schicht mit Salzlake (125 ml).
- Trocknen Sie die organische Lösung über wasserfreie Na2SO4 und filtern Sie sie.
- Verdampfen Sie die Lösung, die 1,77 g 1-Phenyl-2-Propyne-1-one als gelben Feststoff erhält (quantitative Ausbeute).
- Lassen Sie den Feststoff im Vakuum trocknen.
- Analysieren und charakterisieren Sie durch 1H-NMR.
3. Zubereitung von 4-Nitronitrosobenzol
- 16 g Kaliumperoxymonosulfat hinzufügen (2KHSO5 KHSO4 K2SO4) (26 mmol) mit einem Spachtel in einem Becher, offen für Luft, die einen magnetischen Rührstab enthält.
- 150 ml Wasser hinzufügen und die Lösung unter magnetischem Rühren bei 0 °C halten.
- 3,6 g 4-Nitroaniin (26 mol) mit einem Spachtel hinzufügen.
- Rühren Sie die Aufhängung bei Raumtemperatur.
- Überprüfen Sie die Reaktion von TLC bis zur vollständigen Umwandlung von 4-Nitroaniline (Rf4-Nitroaniline = 0,44, Rf4-Nitronitrosobenzol = 0,77; CH2Cl2 als Eluent).
- Filtern Sie das rohe Reaktionsgemisch auf einem Buchner nach 48 h.
- Legen Sie den Feststoff in einen einhalsigen runden Bodenkolben.
- Rekristallisieren Sie den Feststoff in Methanol (50 ml).
- Die Suspension mit einer Wärmepistole bis zum Siedepunkt von Methanol erwärmen und sofort die heiße Suspension filtern.
- Entsorgen Sie den Festkörper und verwenden Sie ihn schließlich für eine weitere Rekristallisation.
- Filtern Sie den zweiten Niederschlag, der im Erlenmeyerkolben gebildet wird, wenn die Lösung Raumtemperatur erreicht.
- Lassen Sie den Feststoff im Vakuum auf einem Buchner Trichter trocknen.
- Charakterisieren Sie den Volumenkörper durch 1H-NMR.
4. Synthese von 3-Benzoyl-1-Hydroxy-5-Nitroindole
- Schließen Sie alle getrockneten Ofenglaswaren (ein 250 ml zwei Hals runder Bodenkolben mit einem magnetischen Rührstab, einem Stopphahn, einem Kältemittel und einem Gelenk zum Anschluss an Vakuum/Stickstoffsystem) an und stellen Sie 30 min unter Vakuum.
- Bei Raumtemperatur, nach einigen Zyklen von Vakuum/Stickstoff, spülen Sie alle Gläser mit Stickstoff und lassen Sie es unter inerte Atmosphäre.
- 1,52 g (10 mmol) 4-Nitronitrosobenzol unter inerierter Atmosphäre hinzufügen.
- 1,30 g (10 mmol) 1-Phenyl-2-Propyne-1-eins hinzufügen.
- 80 ml Toluin über eine Spritze hinzufügen und das Reaktionsgemisch unter magnetischem Rühren bei 80 °C halten.
- Überprüfen Sie nach wenigen Minuten die vollständige Löslichkeit der Reaktanten.
- Überprüfen Sie die Bildung eines orangen Niederschlags nach ca. 30-40 min bei 80 °C.
- Nach dem vollständigen Niederschlag eines orangen Festkörpers (ca. 2,5 h) die Heizung ausschalten und die Reaktion auf Raumtemperatur verlassen.
- Filtern Sie das Gemisch und sammeln Sie 3-Benzoyl-1-Hydroxy-5-Nitroindole als Orange fest auf einem Buchner-Trichter.
- Unter Vakuum bis zur Trockenheit aufbewahren.
- Analysieren und charakterisieren Sie das feste Produkt durch 1H- und 13C-NMR, FT-IR und HRMS.
Ergebnisse
Die Herstellung von 4-Nitronitrosobenzol 2 wurde durch Oxidation von 4-Nitroaniin 1 durch Reaktion mit Kaliumperoxymonosulfat erreicht, wie in Abbildung 6berichtet. Das Produkt 2 wurde in 64% Ausbeute nach Rekristallisation in MeOH (zweimal) mit 3-5% Kontamination von 4,4'-bis-Nitro-Azoxybenzol 6erhalten. Die Struktur von Produkt 2 wurde durch 1H-NMR bestätigt (Abbildung 7). 1 H-NMR (400 MHz, CDCl3): n = 8,53 (d, J = 8,8 Hz, 2H), 8,07 (d, J = 8,8 Hz, 2H).
Die Herstellung von 1-Phenyl-2-Propyne-1-ein4 wurde durch Oxidation von 1-Phenyl-2-Propyne-1-ol 3 mit Jones-Reagenz wie in Abbildung 8berichtet ermöglicht. Das Produkt 4 wurde als gelber Feststoff mit 90% Ausbeute isoliert und die Struktur wurde durch 1H-NMR bestätigt (Abbildung 9). 1 H-NMR (400 MHz, CDCl3): n = 8,10 (d, J = 7,4 Hz, 2H), 7,57 (t, J = 7,4 Hz, 1H), 7,43 (t, J = 7,4 Hz, 2H), 3,36 (s, 1H).
Die Synthese von 3-Benzoyl-1-Hydroxy-5-Nitroindole wurde durch thermische Reaktion von 4-Nitronitrosobenzol 2 und 1-Phenyl-2-Propyne-1-ein4 in Toluol bei 80 °C erreicht, wie in Abbildung 10berichtet. Indole-Verbindung 5 wurde in 58% Ausbeute durch Filtration nach 2,5 h isoliert. Das Azoxyderiv6 wurde in 22% Ausbeute als Hauptprodukt der Mutterlikör nach Chromatographie (Rf = 0,36) unter Verwendung von CH2Cl2/hexan = 6/4 als Eluent isoliert. Die Struktur von Produkt 6 wurde durch 1H-NMR bestätigt (Abbildung 11). 1 H-NMR (400 MHz, CDCl3): n = 8,47 (d, J = 9,2 Hz, 2H), 8,35 (d, J = 9,2 Hz, 2H), 8,30 (d, J = 9,2 Hz, 2H), 8,23 (d, J = 9,2 Hz, 2H). Die Struktur der Verbindung 5 wurde durch FT-IR, 1H-NMR (Abbildung 12), 13C-NMR (Abbildung 13) und HRMS (Abbildung 14 und Abbildung 15) bestimmt.
FT-IR (KBr-Scheibe): 1619, 1560, 1518, 1336, 850, 817, 740, 700 cm-1. 1 H-NMR (400 MHz, DMSO-d6): n = 12,68 (s, 1H, bs), 9,16 (d, J = 2,3 Hz, 1H), 8,38 (s, 1H), 8,22 (dd, J = 9,0 Hz, J = 2,3 Hz, 1H), 7,85 (d, J = 7,2 Hz, 2H), 7,74 (d, J = 9,0 Hz, 1H), 7,66 (t, J = 7,2 Hz, 1H), 7,58 (t, J = 7,2 Hz, 2H). 13 C-NMR (400 MHz, DMSO-d6): n = 188,94, 143,24, 139,19, 136,58, 136,40, 131,81, 128,61, 128,53, 122,05, 118,81, 118,25, 110,96, 110,19. HRMS (ESI-) berechnet für C15H10N2 O4: 281.0562 ([M-1]); gefunden: 281.0565. HRMS (ESI+) berechnet für C15H10N2 O4: 283.0719 ([M+1]), 305.0538 [M+Na]; gefunden: 283.0713, 305.0532.
1 H-NMR-Spektren wurden für die Verbindungen 2, 4, 5 und 6gewonnen; 13 C-NMR wurden für Verbindung 5erhalten. Sofern nicht anders angegeben, wurden alle Spektren bei Raumtemperatur gesammelt. Für Verbindung 5 mit ESI-Ionisation (positiv und negativ) wurden Massenspektren mit hoher Auflösung erhalten. IR-Spektrum wurde für Verbindung 5erhalten.
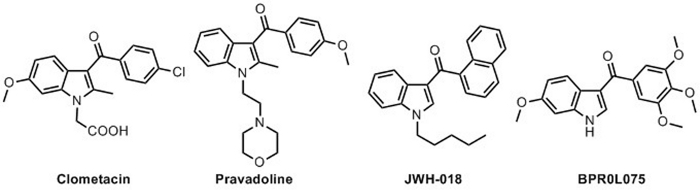
Abbildung 1: Verschiedene 3-Aroylindol-Verbindungen, die biologische Aktivitäten zeigen. Clometacin (entzündungshemmendes Medikament), Pravadoline (analgetisch), JWH-018 (Agonist der CB1- und CB2-Rezeptoren) und BPR0L075 (antimitotische und antivaskuläre Mittel). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Einige Beispiele für natürliche und synthetische N-Hydroxy-Indole. Birnbaumins A und B sind zwei toxische gelbe Pigmentverbindungen, Lactat DeHydrogenase-Inhibitoren, Coproverdine ein zytotoxisches Marinealkaloid von einem neuseeländischen Ascidian, Stephacidin B ein Antitumor-Alkaloid aus dem Pilz Aspergillus ochraceus isoliert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Frühere Forschungsergebnisse im intermolekularen Indolisationsverfahren. Synthese von Indoden, N-Hydroxyindoden und N-Alkoxyindodendurch Cycloaddition von Nitro- und Nitrosoarenen mit Alkynen Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Anwendung des synthetischen Ansatzes bei der Herstellung natürlicher Produkte. Synthese von Meridianinen und Analoga durch die Annulation von C-Nitrosoaromatik mit Ethynylpyrimidin-Verbindungen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
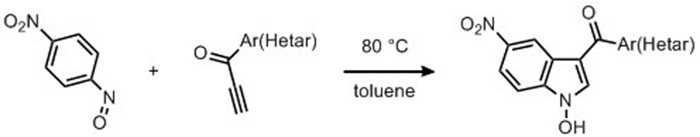
Abbildung 5: Jüngste Entwicklungen mit Alkynonen. Synthese von 3-Aroyl-1-Hydroxy-5-Nitroindoden durch Cyclisierung von 4-Nitronitrosobenzol mit konjugierten Ynonen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
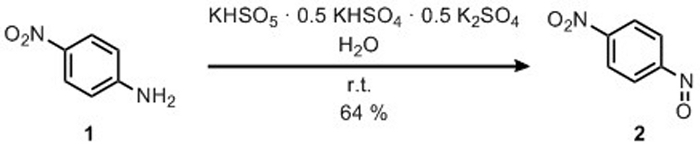
Abbildung 6: Herstellung von 4-Nitro-Nitrosobenzol durch Oxidation von 4-Nitroaniline. Eine selektive Oxidation der Aminogruppe zur Nitrosogruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
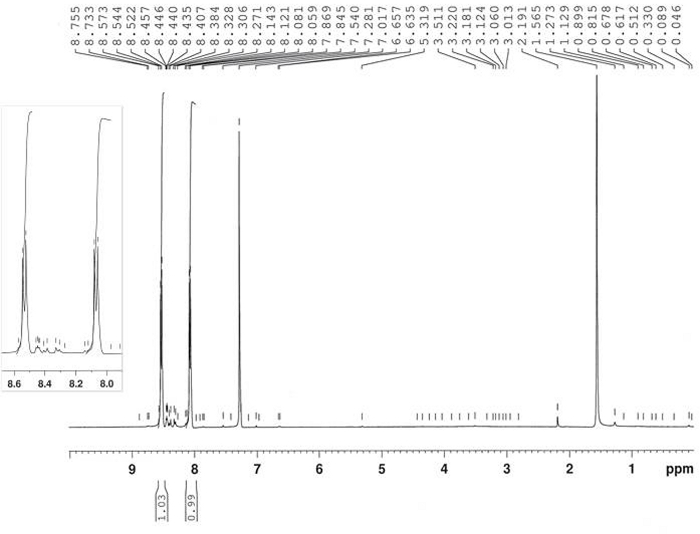
Abbildung 7: 1H-NMR-Spektrum von 4-Nitronitrosobenzol (2). Ein typisches AA'BB'-Splittingmuster wird hier gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
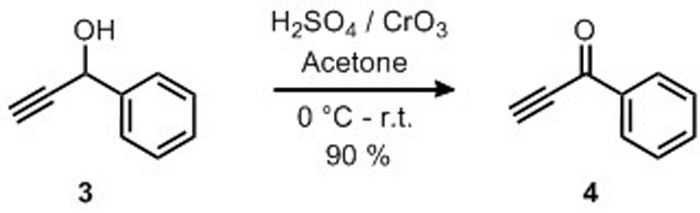
Abbildung 8: Herstellung von 1-Phenyl-2-Propyne-1-eins durch Oxidation von 1-Phenyl-2-Propyne-1-ol. Eine selektive Oxidation des Alkohols zu einem Keton. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
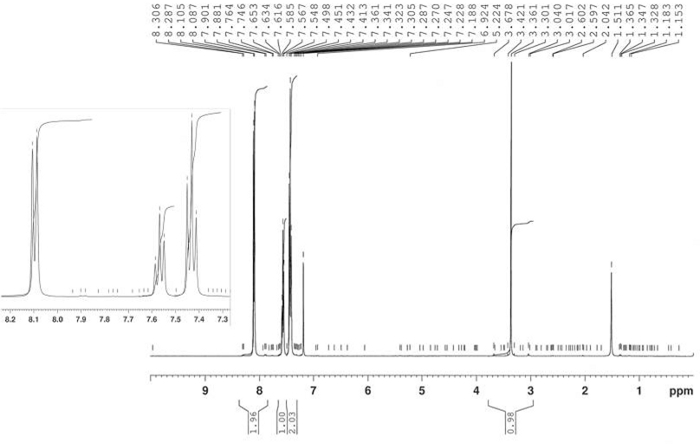
Abbildung 9: 1H-NMR-Spektrum von 1-Phenyl-2-Propyne-1-eins (4). Ein Spektrum einer monosubstituierten aromatischen Verbindung mit einem einzigen terminalen Alkyn. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 10: Synthese von 3-Benzoyl-1-Hydroxy-5-Nitroindole (5) durch Cycloaddition von 2 und 4. Die regioselektive Synthese von Indolen ausgehend von einem Terminal-Ynon und einem Nitrosoaren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
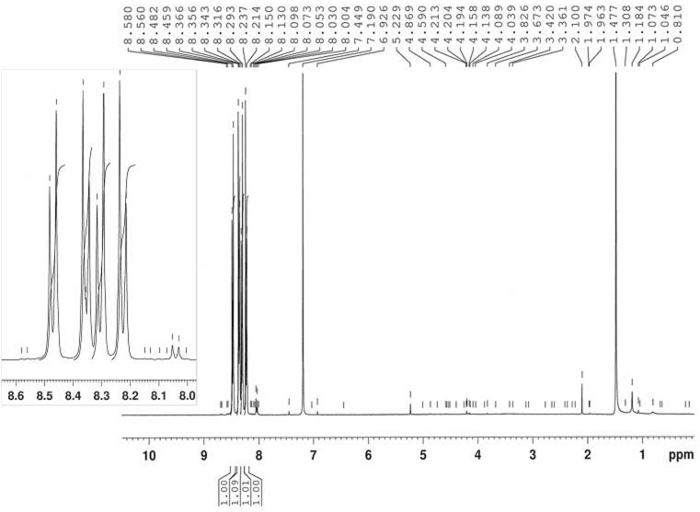
Abbildung 11: 1H-NMR-Spektrum von 4,4'-bis-Nitroazoxybenzol (6). Für das Hauptnebenprodukt wird hier ein typisches doppeltes AA'BB'-Splittingmuster angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
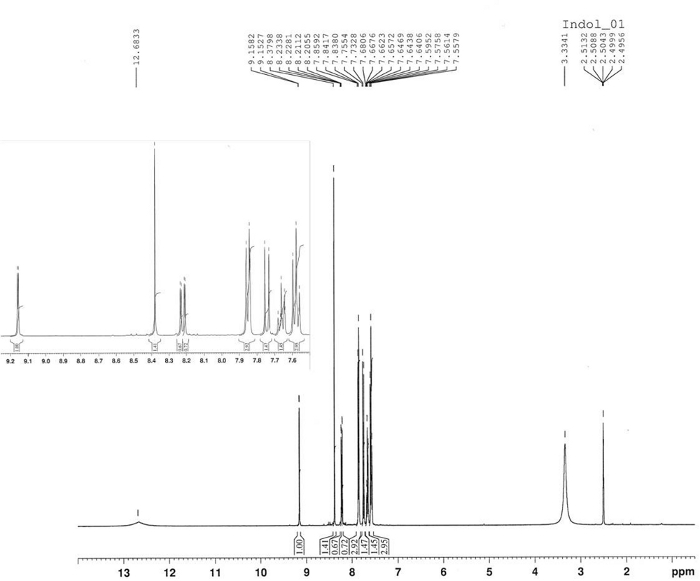
Abbildung 12: 1H-NMR-Spektrum von 3-Benzoyl-1-Hydroxy-5-Nitroindole (5). Das Spektrum zeigt das aromatische Substitutionsmuster eines 3,5-disubstituierten-N-Hydoxyindole. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
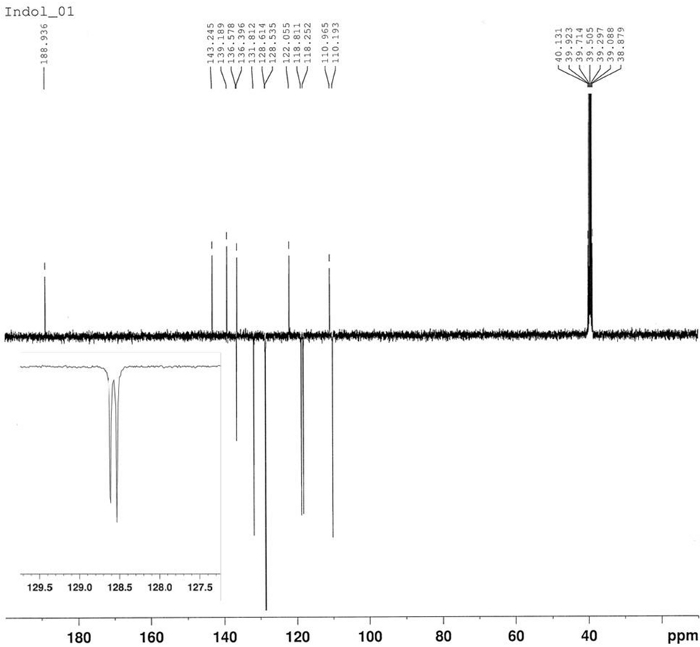
Abbildung 13: 13C-NMR-Spektrum von 3-Benzoyl-1-Hydroxy-5-Nitroindole (5). Sechs Signale für quartäre Kohlenstoffatome und sieben Signale für tertiäre Kohlenstoffatome. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 14: HRMS (ESI-) Spektrum von 3-Benzoyl-1-hydroxy-5-nitroindole (5). Negative Ionisationsmodus Massenspektrometrie der Zielverbindung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 15: HRMS (ESI+) Spektrum von 3-Benzoyl-1-hydroxy-5-nitroindole (5). Positive Ionisationsmodus Massenspektrometrie der Zielverbindung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Reaktion für die Indole-Synthese zwischen Nitrosoarenen und Alkynonen zeigt eine sehr hohe Vielseitigkeit und eine starke und breite Anwendung. In einem früheren Bericht konnten wir unser synthetisches Protokoll verallgemeinern, das mit verschiedenen C-Nitrosoaromaticikern und substituierten terminalen Arylalkynonen oder Heteroarylalkyonen72arbeitet. Das Verfahren zeigt eine tiefe Substratuntersuchung und eine hohe funktionelle Gruppentoleranz und sowohl Elektronen-Rückzugsgruppen als auch Elektronenspendergruppen waren sowohl in Nitrosoaren als auch im Alkynon vorhanden.
Ein einziges Verfahren zur Indolisation durch Cycloaddition von 4-Nitro-Nitrosobenzol mit 1-Phenyl-2-Propyne-1-eins wurde hier als repräsentative Reaktion berichtet. Nach einer Teiluntersuchung wurde Toluen als bestes Lösungsmittel gefunden. Durchführung unseres Protokolls, 3-Benzoyl-1-Hydroxy-5-Nitroindole 5 aus dem Reaktionsgemisch ausgefällt. Das Inderprodukt war die einzige Verbindung, die im Feststoff gefunden wurde und durch Filtration ohne weitere Reinigung isoliert wurde. Die Analyse der Mutterlaugen führte dazu, dass wir das einzige Vorhandensein von 4,4'-Dinitroazoxybenzol 6 als wichtiges stickstoffhaltiges Nebenprodukt zusammen mit dem unreagierten Alkynon 4 fanden und aufdeckten und die Produkte durch Chromatographie isoliert und gereinigt wurden (RfAzoxyaren = 0,36 und Rfalkynon = 0,30 mit CH2Cl2 / Hexan = 6/4 als Eluent). Azoxybenzole sind typische Nebenprodukte der Reaktionen mit Nitrosoarenen als Ausgangsstoffe. Erst vor kurzem wurde berichtet, dass diese Klasse von Verbindungen selektiv als die wichtigsten Produkte der thermischen Reaktionen in einer Vielzahl von organischen Lösungsmitteln durch eine reduktive deoxygenative Kopplung von C-Nitrosoaromatics73durchgeführt werden kann. In dem von uns eingeführten Verfahren72wurde unter Verwendung von 4-Nitronitrosobenzol mit verschiedenen Alkynonen die Ausfällung von 3-Aroyl(Heteroaroyl)- N-Hydroxy-5-Nitroindolen immer beobachtet, die mehr als ein Dutzend Verbindungen erhielten. Andere C-Nitrosoaromatiken, die starke Elektronen zurückziehende Substituenten zeigten, ergaben überwiegend die Bildung von 3-Aroyl-1-Hydroxyindoden und/oder 3-Aroylindol-Produkten. Unter Verwendung elektronenreicher Nitrosoaren wurden nur 3-Aroylindole nachgewiesen. Alle Indoles wurden in moderaten bis guten Erträgen produziert. Eine parallele Studie begann vor kurzem in unserem Labor zur Untersuchung des Reaktionsmechanismus und zur Optimierung der Bedingungen, die versuchen, Zielverbindungen in höheren Erträgen zu leisten. Es könnte möglich sein, die Produkterträge nach der Filtration des ersten Niederschlags zu erhöhen und den Mutterlikören der Reaktion ein weiteres Äquivalent von 4-Nitronitrosobenzol hinzuzufügen und das Gemisch zu erhitzen. Diese Zugabe und ein zweiter Durchlauf führen zur Bildung weiterer Niederschläge, wodurch ein weiteres Aliquote des Indoleprodukts erreicht wird. Es ist allgemein bekannt, dass Nitrosoaren, sowohl in Lösung als auch als Feststoffe, als Dicher74vorhanden sein könnten. Dies ist wahrscheinlich der Weg, der die Bildung von Azoxyarenen begünstigt. Die Bildung dieses Seitenprodukts subtrahiert zwei Äquivalente von Nitrosoaren zur Cycloaddition mit dem Alkynon. Eine mechanistische Hypothese zur Herstellung von Azoxyverbindungen wurde von Chuang und Kollegenvorgeschlagen 73. Grundsätzlich funktioniert das Indolisationsverfahren bei hoher Verdünnung nitrosoaromatischer Verbindung wahrscheinlich besser. Die hohe Konzentration könnte eine Achille Ferse für die wettbewerbsfähige Dimerisierung sein, die stark mit der Bildung der Azoxy-Verbindung verbunden ist. Zu diesem Thema planen wir, die Reaktion mit langsamer Zugabe von Nitrosoaren auszuführen, und es könnte nützlich sein, ein Gerät zu setzen, um experimentell ein Strömungsreaktionsverfahren durchzuführen. Weitere Experimente werden in naher Zukunft durchgeführt. Wir haben noch keine solide mechanistische Vermutung gebaut, um die Bildung von 3-Aroylindolen zu erklären. In einem früheren Bericht, in Dem mit Arylacetylen gearbeitet, konnten wir jedoch den Mechanismus der Bildung von 3-Arylindolen untersuchen, der feststellte, daß das plausibelste Zwischenprodukt wahrscheinlich eine diradical specie67ist. Die Kohlenstoff-Stickstoff-Bindung bildet sich zuerst, gefolgt von der Cyclisierung durch die Bildung einer Kohlenstoff-Kohlenstoff-Bindung.
Die Verwendung der Alkynone ist ein wichtiger Punkt für unsere aktuelle Studie und die Vorbereitung von Terminal-Ynonen ist ein einfaches Verfahren. 1-Phenyl-2-propyne-1-ol ist das einzige kommerziell erhältliche Arylalkynol. Die Herstellung verschiedener Arylalkynone und Heteroarylalkynone wurde leicht ausgehend von verschiedenen kommerziell erhältlichen aromatischen und heteroaromatischen Aldehyden durchgeführt. Diese letzten Verbindungen wurden mit Ethynyl-Magnesiumbromid behandelt, um Alkynoe durch Reaktionen zu erzeugen, die häufig bei -78 °C durchgeführt wurden. Die erhaltenen sekundären Propargylalchohols wurden durch Reaktion mit verschiedenen Wirkstoffen25,26,27oxidiert. Dieses Verfahren führte dazu, dass wir uns Terminal-Synonen als stabile und feste Verbindungen leisten. Nitrosoaren, anders als die entsprechenden Nitroaromatika und Aniline, sind nicht leicht kommerziell erhältlich und wurden durch oxidation der entsprechenden Aniline19,20,21,22,23,24hergestellt. Es könnte nützlich sein, unseren synthetischen Ansatz durch eine In-situ-Bildung von Nitrosoverbindungen durch Oxidation oder Reduktion zu untersuchen. Neuere Studien von Ragaini und Kollegen berichteten über die Bildung von C-Nitrosoaromatics ausgehend von nitroaromatischen Vorläuferstoffen75,76, 77,78. Die Entdeckung, Einführung, Erforschung und Anwendung neuartiger Indolisationsprotokolle, die indoles regioselektiv und mit sehr hoher Atomökonomie produzieren könnten, sind relevante Themen in der synthetischen organischen Chemie und wir sind zuversichtlich, dass diese Methodik durch Cyclisierung zwischen Nitrosoarenen und Alkynonen für verschiedene Forschungsgruppen nützlich sein könnte.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Dr. Enrica Alberti und Dr. Marta Brucka sind für die Sammlung und Registrierung der NMR-Spektren bekannt. Wir danken Dr. Francesco Tibiletti und Dr. Gabriella Ieronimo für die hilfreichen Diskussionen und experimentelle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 4-Nitroaniline | TCI Chemicals | N0119 | |
| Acetone | TCI Chemicals | A0054 | |
| 1-Phenyl-2-propyne-1-ol | TCI Chemicals | P0220 | |
| Celite 535 | Fluorochem | 44931 | |
| Dichloromethane | TCI Chemicals | D3478 | |
| Sodium hydrogen carbonate | Sigma Aldrich | S5761 | |
| Sodium chloride | Sigma Aldrich | 746398 | |
| Sodium sulfate anhydrous | Sigma Aldrich | 239313 | |
| Oxone | TCI Chemicals | O0310 | |
| Methanol | TCI Chemicals | M0628 | |
| Toluene | TCI Chemicals | T0260 | |
| Chromium Trioxide | Sigma Aldrich | 236470 | |
| Dichloromethane anhydrous | TCI Chemicals | D3478 | |
| Hexane anhydrous | TCI Chemicals | H1197 |
Referenzen
- Vančik, H. Aromatic C-nitroso Compounds. , Springer. Dordrecht. (2013).
- Whittaker, R. E., Dermenci, A., Dong, G. Synthesis of Ynones and Recent Application in Transition-Metal-Catalyzed Reactions. Synthesis. 48 (2), 161-183 (2016).
- Carosso, S., Miller, M. J. Nitroso Diels-Alder (NDA) reaction as an efficient tool for the functionalization of diene-containing natural products. Organic Biomolecular Chemistry. 12 (38), 7445-7468 (2014).
- Maji, B., Yamamoto, H. Catalytic Enantioselective Nitroso Diels-Alder Reaction. Journal of the American Chemical Society. 137 (50), 15957-15963 (2015).
- Momiyama, N., Yamamoto, H. Enantioselective O- and N-Nitroso Aldol Synthesis of Tin Enolates. Isolation of Three BINAP-Silver Complexes and Their Role in Regio- and Enantioselectivity. Journal of the American Chemical Society. 126 (17), 5360-5361 (2004).
- Hayashi, Y., Yamaguchi, J., Sumiya, T., Shoji, M. Direct proline-catalyzed asymmetric alpha-aminoxylation of ketones. Angewandte Chemie International Edition. 43 (9), 1112-1115 (2004).
- Adam, W., Krebs, O. The Nitroso Ene Reaction: A Regioselective and Stereoselective Allylic Nitrogen Functionalization of Mechanistic Delight and Synthetic Potential. Chemical Reviews. 103 (10), 4131-4146 (2003).
- Merino, E. Synthesis of azobenzenes: the coloured pieces of molecular materials. Chemical Society Reviews. 40 (7), 3835-3853 (2011).
- Yu, B. C., Shirai, Y., Tour, J. M. Syntheses of new functionalized azobenzenes for potential molecular electronic devices. Tetrahedron. 62 (44), 10303-10310 (2006).
- Priewisch, B., Rück-Braun, K. Efficient Preparation of Nitrosoarenes for the Synthesis of Azobenzenes. The Journal of Organic Chemistry. 70 (6), 2350-2352 (2005).
- Wu, M. Y., He, W. W., Liu, X. Y., Tan, B. Asymmetric Construction of Spirooxindoles by Organocatalytic Multicomponent Reactions Using Diazooxindoles. Angewandte Chemie International Edition. 54 (32), 9409-9413 (2015).
- Sharma, P., Liu, R. S. [3+2]-Annulations of N-Hydroxy Allenylamines with Nitrosoarenes: One-Pot Synthesis of Substituted Indole Products. Organic Letters. 18 (3), 412-415 (2016).
- Wróbel, Z., Stachowska, K., Grudzień, K., Kwast, A. N-Aryl-2-nitrosoanilines as Intermediates in the Two-Step Synthesis of Substituted 1,2-Diarylbenzimidazoles from Simple Nitroarenes. Synlett. 22 (10), 1439-1443 (2011).
- Oakdale, J. S., Sit, R. K., Fokin, V. V. Ruthenium-Catalyzed Cycloadditions of 1-Haloalkynes with Nitrile Oxides and Organic Azides: Synthesis of 4-Haloisoxazoles and 5-Halotriazoles. Chemistry a European Journal. 20 (35), 11101-11110 (2014).
- Abbiati, G., Arcadi, A., Marinelli, F., Rossi, E. Sequential Addition and Cyclization Processes of α,β-Ynones and α,β-Ynoates Containing Proximate Nucleophiles. Synthesis. 46 (6), 687-721 (2014).
- Zhang, Z., et al. Chiral Co(II) complex catalyzed asymmetric Michael reactions of β-ketoamides to nitroolefins and alkynones. Tetrahedron Letters. 55 (28), 3797-3801 (2014).
- Bella, M., Jørgensen, K. A. Organocatalytic Enantioselective Conjugate Addition to Alkynones. Journal of the American Chemical Society. 126 (18), 5672-5673 (2004).
- Karpov, A. S., Merkul, E., Rominger, F., Müller, T. J. J. Concise Syntheses of Meridianins by Carbonylative Alkynylation and a Four-Component Pyrimidine Synthesis. Angewandte Chemie Internationa Edition. 44 (42), 6951-6956 (2005).
- Krebs, O. Dissertation, Wurzburg. , Wurzburg. available at http://www.bibliothek.uni-wuerzburg.de from the OPUS server (2002).
- Mel'nikov, E. B., Suboch, G. A., Belyaev, E. Y. Oxidation of Primary Aromatic Amines, Catalyzed by Tungsten Compounds. Russian Journal of Organic Chemistry. 31 (12), 1640-1642 (1995).
- Porta, F., Prati, L. Catalytic synthesis of C-nitroso compounds by cis-Mo(O)2(acac)2. Journal of Molecular Catalysis. A: Chemical. 157 (1-2), 123-129 (2000).
- Biradar, A. V., Kotbagi, T. V., Dongare, M. K., Umbarkar, S. B. Selective N-oxidation of aromatic amines to nitroso derivatives using a molybdenum acetylide oxo-peroxo complex as catalyst. Tetrahedron Letters. 49 (22), 3616-3619 (2008).
- Defoin, A. Simple Preparation of Nitroso Benzenes and Nitro Benzenes by Oxidation of Anilines with H2O2 Catalysed with Molybdenum Salts. Synthesis. 36 (5), 706-710 (2004).
- Zhao, D., Johansson, M., Bäckvall, J. E. In Situ Generation of Nitroso Compounds from Catalytic Hydrogen Peroxide Oxidation of Primary Aromatic Amines and Their One-Pot Use in Hetero-Diels-Alder Reactions. European Journal of Organic Chemistry. (26), 4431-4436 (2007).
- Pigge, F. C., et al. Structural characterization of crystalline inclusion complexes formed from 1,3,5-triaroylbenzene derivatives-a new family of inclusion hosts. Journal of Chemical Society, Perkin Transactions 2. (12), 2458-2464 (2000).
- Scansetti, M., Hu, X., McDermott, B., Lam, H. W. Synthesis of Pyroglutamic Acid Derivatives via Double Michael Reactions of Alkynones. Organic Letters. 9 (11), 2159-2162 (2007).
- Ge, G. C., Mo, D. L., Ding, C. H., Dai, L. X., Hou, X. L. Palladacycle-Catalyzed Reaction of Bicyclic Alkenes with Terminal Ynones: Regiospecific Synthesis of Polysubstituted Furans. Organic Letters. 14 (22), 5756-5759 (2012).
- Maeda, Y., et al. Oxovanadium Complex-Catalyzed Aerobic Oxidation of Propargylic Alcohols. The Journal of Organic Chemistry. 67 (19), 6718-6724 (2002).
- Gribble, G. W. Indole Ring Synthesis: from Natural Products to Drug Discovery. , Wiley & Sons Ltd. Chichester. (2016).
- Palmisano, G., et al. Synthesis of Indole Derivatives with Biological Activity by Reactions Between Unsaturated Hydrocarbons and N-Aromatic Precursors. Current Organic Chemistry. 14 (20), 2409-2441 (2010).
- Youn, S. W., Ko, T. Y. Metal-Catalyzed Synthesis of Substituted Indoles. Asian Journal of Organic Chemistry. 7 (8), 1467-1487 (2018).
- Bugaenko, D. I., Karchava, A. V., Yurovskaya, M. A. Synthesis of indoles: recent advances. Russian Chemical Reviews. 88 (2), 99-159 (2019).
- Kuo, C. C., et al. BPR0L075, a Novel Synthetic Indole Compound with Antimitotic Activity in Human Cancer Cells, Exerts Effective Antitumoral Activity in Vivo. Cancer Research. 64 (13), 4621-4628 (2004).
- Kaushik, N. K., et al. Biomedical Importance of Indoles. Molecules. 18 (6), 6620-6662 (2013).
- El Sayed, M. T., Hamdy, N. A., Osman, D. A., Ahmed, K. M. Indoles as anti-cancer agents. Advances in Modern Oncology Research. 1 (1), 20-35 (2015).
- Somei, M., et al. The Chemistry of 1-Hydroxyindole Derivatives: Nucleophilic Substitution Reactions on Indole Nucleus. Heterocycles. 34 (10), 1877-1884 (1992).
- Somei, M., Fukui, Y. Nucleophilic Substitution Reaction of 1-Hydroxytryptophan and 1-Hydroxytryptamine Derivatives (Regioselective Syntheses of 5-Substituted Derivatives of Tryptophane and Tryptamine. Heterocycles. 36 (8), 1859-1866 (1993).
- Somei, M., Fukui, Y., Hasegawa, M. Preparations of Tryptamine-4,5-dinones, and Their Diels-Alder and Nucleophilic Addition Reactions. Heterocycles. 41 (10), 2157-2160 (1995).
- Somei, M. The Chemistry of 1-Hydroxyindoles and Their Derivatives. Journal of Synthetic Organic Chemistry (Japan). 49 (3), 205-217 (1991).
- Rani, R., Granchi, C. Bioactive heterocycles containing endocyclic N-hydroxy groups. European Journal of Medicinal Chemistry. 97, 505-524 (2015).
- Escolano, C. Stephacidin B, the avrainvillamide dimer: a formidable synthetic challenge. Angewandte Chemie, International Edition. 44 (47), 7670-7673 (2005).
- Blunt, J. W., Munro, M. H. G. Coproverdine, a Novel, Cytotoxic Marine Alkaloid from a New Zealand Ascidian Sylvia Urban. Journal of Natural Products. 65 (9), 1371-1373 (2002).
- Li, W., Huang, S., Liu, X., Leet, J. E., Cantone, J., Lam, K. S. N-Demethylation of nocathiacin I via photo-oxidation. Bioorganic and Medicinal Chemistry Letters. 18 (14), 4051-4053 (2008).
- Tsukamoto, S., et al. Notoamides F-K, Prenylated Indole Alkaloids Isolated from a Marine-Derived Aspergillus sp. Journal of Natural Products. 71 (12), 2064-2067 (2008).
- Nicolaou, K. C., Lee, S. H., Estrada, A. A., Zak, M. Construction of Substituted N-Hydroxyindoles: Synthesis of a Nocathiacin I Model System. Angewandte Chemie, International Edition. 44 (24), 3736-3740 (2005).
- Nicolaou, K. C., Estrada, A. A., Lee, S. H., Freestone, G. C. Synthesis of Highly Substituted N-Hydroxyindoles through 1,5-Addition of Carbon Nucleophiles to In Situ Generated Unsaturated Nitrones. Angewandte Chemie, International Edition. 45 (32), 5364-5368 (2006).
- Nicolaou, K. C., Estrada, A. A., Freestone, G. C., Lee, S. H., Alvarez-Mico, X. New synthetic technology for the construction of N-hydroxyindoles and synthesis of nocathiacin I model systems. Tetrahedron. 63 (27), 6088-6114 (2007).
- Chan, S. T. S., Norrie Pearce, A., Page, M. J., Kaiser, M., Copp, B. R. Antimalarial β-Carbolines from the New Zealand Ascidian Pseudodistoma opacum. Journal of Natural Products. 74 (9), 1972-1979 (2011).
- Bartsch, A., Bross, M., Spiteller, P., Spiteller, M., Steglich, W. Birnbaumin A and B: Two Unusual 1-Hydroxyindole Pigments from the "Flower Pot Parasol" Leucocoprinus birnbaumii. Angewandte Chemie., International Edition. 44 (19), 2957-2959 (2005).
- Di Bussolo, V., et al. Synthesis and biological evaluation of non-glucose glycoconjugated N-hydroyxindole class LDH inhibitors as anticancer agents. RSC Advances. 5 (26), 19944-19954 (2015).
- Granchi, C., et al. Discovery of N-Hydroxyindole-Based Inhibitors of Human Lactate Dehydrogenase Isoform A (LDH-A) as Starvation Agents against Cancer Cells. Journal of Medicinal Chemistry. 54 (6), 1599-1612 (2011).
- Granchi, C., et al. N-Hydroxyindole-based inhibitors of lactate dehydrogenase against cancer cell proliferation. European Journal of Medicinal Chemistry. 46 (11), 5398-5407 (2011).
- Granchi, C., et al. Synthesis of sulfonamide-containing N-hydroxyindole-2-carboxylates as inhibitors of human lactate dehydrogenase-isoform 5. Bioorganic Medicinal Chemistry Letters. 21 (24), 7331-7336 (2011).
- Granchi, C., et al. Assessing the differential action on cancer cells of LDH-A inhibitors based on the N-hydroxyindole-2-carboxylate (NHI) and malonic (Mal) scaffolds. Organic Biomolecular Chemistry. 11 (38), 6588-6596 (2013).
- Minutolo, F., et al. Compounds Inhibitors of Enzyme Lactate Dehydrogenase (LDH) and Pharmaceutical Compositions Containing These Compounds. Chemical Abstracts. , WO 2011054525 154(2011).
- Granchi, C., et al. Triazole-substituted N-hydroxyindol-2-carboxylates as inhibitors of isoform 5 of human lactate dehydrogenase (hLDH5). Medicinal Chemistry Communications. 2 (7), 638-643 (2011).
- Kuethe, J. T. A General Approach to Indoles: Practical Applications for the Synthesis of Highly Functionalized Pharmacophores. Chimia. 60 (9), 543-553 (2006).
- Somei, M. 1-Hydroxyindoles. Heterocycles. 50 (2), 1157-1211 (1999).
- Belley, M., Beaudoin, D., Duspara, P., Sauer, E., St-Pierre, G., Trimble, L. A. Synthesis and Reactivity of N-Hydroxy-2-Amino-3-Arylindoles. Synlett. 18 (19), 2991-2994 (2007).
- Belley, M., Sauer, E., Beaudoin, D., Duspara, P., Trimble, L. A., Dubé, P. Synthesis and reactivity of N-hydroxy-2-aminoindoles. Tetrahedron Letters. 47 (2), 159-162 (2006).
- Hasegawa, M., Tabata, M., Satoh, K., Yamada, F., Somei, M. A Novel Dimerization of 1-Hydroxyindoles. Heterocycles. 43 (11), 2333-2336 (1996).
- Tollari, S., Penoni, A., Cenini, S. The unprecedented detection of the intermediate formation of N-hydroxy derivatives during the carbonylation of 2'-nitrochalcones and 2-nitrostyrenes catalysed by palladium. Journal of Molecular Catalysis A: Chemical. 152 (1-2), 47-54 (2000).
- Penoni, A., Nicholas, K. M. A novel and direct synthesis of indoles via catalytic reductive annulation of nitroaromatics with alkynes. Chemical Communication. 38 (5), 484-485 (2002).
- Penoni, A., Volkman, J., Nicholas, K. M. Regioselective Synthesis of Indoles via Reductive Annulation of Nitrosoaromatics with Alkynes. Organic Letters. 4 (5), 699-701 (2002).
- Penoni, A., Palmisano, G., Broggini, G., Kadowaki, A., Nicholas, K. M. Efficient Synthesis of N-Methoxyindoles via Alkylative Cycloaddition of Nitrosoarenes with Alkynes. The Journal of Organic Chemistry. 71 (2), 823-825 (2006).
- Ieronimo, G., et al. A simple, efficient, regioselective and one-pot preparation of N-hydroxy- and N-O-protected hydroxyindoles via cycloaddition of nitrosoarenes with alkynes. Synthetic scope, applications and novel by-products. Tetrahedron. 69 (51), 10906-10920 (2013).
- Penoni, A., Palmisano, G., Zhao, Y. L., Houk, K. N., Volkman, J., Nicholas, K. M. On the Mechanism of Nitrosoarene-Alkyne Cycloaddition. Journal of the American Chemical Society. 131 (2), 653-661 (2009).
- Tibiletti, F., et al. One-pot synthesis of meridianins and meridianin analogues via indolization of nitrosoarenes. Tetrahedron. 66 (6), 1280-1288 (2010).
- Walker, S. R., Carter, E. J., Huff, B. C., Morris, J. C. Variolins and Related Alkaloids. Chemical Reviews. 109 (7), 3080-3098 (2009).
- Walker, S. R., Czyz, M. L., Morris, J. C. Concise Syntheses of Meridianins and Meriolins Using a Catalytic Domino Amino-Palladation Reaction. Organic Letters. 16 (3), 708-711 (2014).
- Tibiletti, F., Penoni, A., Palmisano, G., Maspero, A., Nicholas, K. M., Vaghi, L. (1H-Benzo[d][1,2,3]triazol=1-yl)(5-bromo-1-hydroxy-1H-indol-3-yl)methanone. Molbank. 2014 (3), 829(2014).
- Ieronimo, G., et al. A novel synthesis of N-hydroxy-3-aroylindoles and 3-aroylindoles. Organic Biomolecular Chemistry. 16 (38), 6853-6859 (2018).
- Chen, Y. F., Chen, J., Lin, L. J., Chuang, G. J. Synthesis of Azoxybenzenes by Reductive Dimerization of Nitrosobenzene. The Journal of Organic Chemistry. 82 (21), 11626-11630 (2017).
- Beaudoin, D., Wuest, J. D. Dimerization of Aromatic C-Nitroso Compounds. Chemical Reviews. 116 (1), 258-286 (2016).
- EL-Atawy, M. A., Formenti, D., Ferretti, F., Ragaini, F. Synthesis of 3,6-Dihydro-2H-[1, 2]-Oxazines from Nitroarenes and Conjugated Dienes, Catalyzed by Palladium/Phenanthroline Complexes and Employing Phenyl Formate as a CO Surrogate. ChemCatChem. 10 (20), 4707-4717 (2018).
- Formenti, D., Ferretti, F., Ragaini, F. Synthesis of N-Heterocycles by Reductive Cyclization of Nitro Compounds using Formate Esters as Carbon Monoxide Surrogates. ChemCatChem. 10 (1), 148-152 (2018).
- EL-Atawy, M. A., Ferretti, F., Ragaini, F. A Synthetic Methodology for Pyrroles from Nitrodienes. European Journal of Organic Chemistry. (34), 4818-4825 (2018).
- Ragaini, F., Cenini, S., Brignoli, D., Gasperini, M., Gallo, E. Synthesis of oxazines and N-arylpyrroles by reaction of unfunctionalized dienes with nitroarenes and carbon monoxide, catalyzed by palladium-phenanthroline complexes. The Journal of Organic Chemistry. 68 (2), 460-466 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten