Method Article
Una sintesi diretta, regiosesesesese ed economica di 3-Aroyl-N-idrossicco-5-nitroindoles di Cycloaddition di 4-Nitronidobenzee con alchinoni
In questo articolo
Riepilogo
3-Aroyl-N-idrossio-5-nitroindoles sono stati sintetizzati da cicloaddition di 4-nitronitrosobenzene con un alchinone terminale coniugato in una procedura termica in un solo passaggio. La preparazione del nitrosoarene e degli alchinoni è stata adeguatamente segnalata e rispettivamente attraverso procedure di ossidazione sull'anilina corrispondente e sull'alchinolo.
Abstract
Abbiamo introdotto una procedura regioselettiva ed atom-economica per la sintesi di 3 indoles sostituiti con l'annlazione di nitrosoareni con chetoni di tinyl. Le reazioni sono state effettuate realizzando indoles senza catalizzatore e con un'eccellente regioselettività. Non sono state rilevate tracce di prodotti a 2 aroylindoli. Lavorando con 4-nitronitrosobenzene come materiale di partenza, i prodotti 3-aroyl-N-idrossido-5-nitroindole precipitarono dalle miscele di reazione e sono stati isolati dalla filtrazione senza alcuna ulteriore tecnica di purificazione. A differenza dei corrispondenti indoles N-idrossi-3-aryl che, spontaneamente in soluzione, danno prodotti di deidratazione, gli indoles N-hydroxy-3-aroyl sono stabili e non sono stati osservati composti di dimerizzazione.
Introduzione
I composti aromatici C-nitroso1 e alkynones2 sono reattori versatili che vengono continuamente e profondamente utilizzati e studiati come materiali di partenza per la preparazione di composti di alto valore. I nitrosoareni svolgono un ruolo sempre più importante nella sintesi organica. Essi sono utilizzati per molti scopi diversi (ad esempio, etero Diels-Alder reazione3,4, Nitroso-Aldol reazione5,6, Nitroso-Ene reazione7, sintesi di azocompounds8,9,10). Recentemente sono stati anche utilizzati come materiali di partenza per permettersi diversi composti eterociclici11,12,13. Negli ultimi decenni, ynones coniugati sono stati studiati per il loro ruolo come impalcature molto interessanti e utili nel raggiungimento di molti derivati di alto valore e prodotti eterociclici14,15,16,17,18. C-Nitrosoaromatics può essere offerto da reazioni di ossidazione delle corrispondenti e disponibili in commercio di aniline utilizzando diversi agenti ossidanti come potassio peroxymonosulfate (KHSO50,5 KHMESO40,5K2SO4)19, Na2WO4/H2O20, Mo(VI)-complessi/H2221,22,23, derivati del selenio 24.Gli alchinoni sono facilmente preparati dall'ossidazione degli alchinosi corrispondenti utilizzando vari ossidanti (CrO325, noti anche come reagenti o reagenti lievi di Jones come MnO226 e Dess-Martin periodinane27). Gli alkynols possono essere raggiunti dalla reazione diretta di bromuro di enylmagnesio con arylaldedei o eteroarylaldedei28.
Indole è probabilmente il composto eterociclico più studiato e derivati di indole hanno ampie e varie applicazioni in molti campi di ricerca diversi. Sia i chimici medicinali che gli scienziati di materiale hanno prodotto molti prodotti a base di indole che coprono diverse funzioni e attività potenziali. Composti Indole sono stati studiati da molti gruppi di ricerca e sia prodotti naturali che derivati sintetici contenenti il quadro indole mostrano proprietà rilevanti e peculiari29,30,31,32. Tra la pletora di composti indole, le 3-aroylindole hanno un ruolo rilevante tra le molecole che mostrano attività biologiche (Figura 1). Diversi prodotti indole appartengono a diverse classi di candidati farmaceutici per diventare potenziali nuovi farmaci33. Sintetici e naturalmente che si verificano 3 aroylindoles sono noti per svolgere un ruolo come antibatterico, antimitotico, analgesico, antivirale, anti-infiammatorio, antinocicetico, antidiabetico e anticancro34,35. L'ipotesi "1-idrossidindole" è stata introdotta provocatoriamente da Somei e dai colleghi come una supposizione interessante e stimolante per sostenere il ruolo biologico di N-idrossiindole nella biosintesi e funzionalizzazione degli alcaloidi indole36,37,38, 39. Questa ipotesi è stata recentemente rafforzata dall'osservazione di molti composti eterociclici endogeniche mostrano rilevanti attività biologiche e un ruolo interessante per molti scopi come pro-farmaci40. Negli ultimi anni, la ricerca di nuovi ingredienti farmaceutici attivi ha rivelato che diversi frammenti N-idrossiindole sono stati rilevati e scoperti in prodotti naturali e composti bioattivi (Figura 2): Stephacidin B41 e Coproverdine42 sono noti come alcaloidi antitumor, I tiazomici43 (A e D), Notoamide G44 e Nocathacins45,46,47 (I, III e IV) sono profondamente studiati antibiotici, Opacaline B48 è un alcaloide naturale da ascidian Pseudodistoma opacum e Birnbaumin A e B sono due pigmenti di Leucocoprinus birnbaumii49. Nuovi ed efficienti inibitori basati su N-idrossiindole di LDH-A (Lactate DeHydrogenase-A) e la loro capacità di ridurre la conversione del glucosio alla lattazione all'interno della cellula sono stati sviluppati50,51, 52,53,54,55,56. Altri ricercatori hanno ripetuto che i composti indole, che non mostravano attività biologiche, sono diventati utili farmaci pro-farmaci dopo l'inserimento di ungruppo N-idrossi5 .
Un motivo di dibattito era la stabilità di N-idrossiindoles e alcuni di questi composti hanno dato facilmente una reazione di deidratazione che porta alla formazione di una classe di nuovi composti, successivamente rinominati come kabutanes58,59, 60,61, dalla formazione di un nuovo legame C-C e due nuovi legami C-O. A causa dell'importanza di Stabile N-idrossiindoles lo studio di diversi approcci sintetici per la facile preparazione di tali composti diventa un argomento fondamentale. In una precedente ricerca di alcuni di noi, una ciclizzazione intramolecolare da una reazione di tipo Cadogan-Sundberg è stata riportata utilizzando nitrostyrenes e nitrostilbene come materiali di partenza62. Negli ultimi decenni abbiamo sviluppato un nuovo cicloaddition tra nitro e nitrosoarenes con diversi alkynes in modo intermolecolare che offre indoles, N-hydroxy- e N-alkoxyindoles come prodotti principali (Figura 3).
All'inizio, utilizzando alkynes aromatiche e alipatiche63,64,65,66,67le reazioni sono state effettuate in grande eccesso di alchine (10 o 12 volte) e talvolta in condizioni alchilative per evitare la formazione di kabutane. 3-Prodotti indole sostituiti sono stati ottenuti regiosesettivamente in rese da moderate a buone. Utilizzando gli alkynes poveri di elettroni, come i derivati 4-ethynylpyrimidine come substrati privilegiati potremmo effettuare le reazioni per questo protocollo sintetico one-pot utilizzando unrapportomolaro 1/1 Con questo protocollo, è stata preparata un'interessante classe di inibitori della chinasi come meridianini, alcaloidi marini isolati da Aplidium meridianum69, mostrando un diverso approccio ai meridianini attraverso una procedura di indolizzazione (Figura 4)68. I Meridianin sono stati generalmente prodotti finora con strumenti sintetici a partire da reattivi preformati. Al meglio delle nostre conoscenze, solo un paio di metodologie hanno riportato la sintesi totale di meridianini o derivati meridianini attraverso una procedura di indolizzazione68,70.
In uno sviluppo più recente sull'uso di elettroni poveri alkynes valeva la pena di testare l'impiego di alkynones terminali come substrati per la procedura di indolizzazione e questo ci ha portato a rivelare una tecnica sintetica intermolecolare per permettersi 3-aroyl-N-hydroxyindoleprodotti 71,72. Analogamente al processo studiato per la preparazione dei meridianini, utilizzando composti di arylalkynone terminali, è stato utilizzato il rapporto di 1/1 Ar-N-O/Ar-(C)-CH -CH molare (Figura 5). Lavorando con gli alchinones come materiali di partenza privilegiati, la sintesi generale indole è stata eseguita con diversi reattivi esplorando un'ampia indagine sul substrato e cambiando la natura dei substituenti sia sui nitrosoari che sugli ynoneti aromatici. I gruppi di ritiro dell'elettrone sul composto C-nitrosaromatic ci hanno portato a osservare un miglioramento sia nei tempi di reazione che nelle rese dei prodotti. Un interessante approccio sintetico che rende facilmente disponibile una libreria stabile di questi composti potrebbe essere molto utile e, dopo uno studio preliminare, abbiamo ottimizzato il nostro protocollo sintetico usando questa reazione stoichiometrica tra alchinoni e 4-nitronitrosobenzene per permettersi 3-aroyl-N-hydroxy-5-nitroindoles. Fondamentalmente, questo facile accesso a N-idxyindoles ci ha portato a testimoniare come la reazione di cicloaddition tra nitrosoarene e alkynone è un processo molto economico da atomo.
Protocollo
1. Preparazione preliminare del Jones Reagent
- Aggiungere 25 g di triossido di cromo con una spatola in un becher da 500 mL che contiene una barra di agitazione magnetica.
- Aggiungere 75 mL di acqua e mantenere la soluzione sotto agitazione magnetica.
- Aggiungere lentamente 25 mL di acido solforico concentrato con un'attenta mescolamento e raffreddamento in un bagno d'acqua ghiacciata.
NOTA: Ora la soluzione è pronta ed è stabile e utilizzabile per molte procedure di ossidazione; la concentrazione della soluzione preparata da questa procedura è di 2,5 M.
2. Sintesi di 1-fenil-2-propyne-1-one
- Aggiungere 75 mL di acetone in una fiaschetta rotonda all'aperto che contiene una barra di agitazione magnetica.
- Aggiungere 2,0 g (15,13 mmol) di 1-phenyl-2-propyne-1-ol tramite una pipetta Pasteur in vetro.
- Mantenere la miscela di reazione a 0 gradi centigradi e sotto agitazione magnetica.
- Aggiungere una soluzione di Jones reagent dropwise fino alla presenza di un colore arancione persistente.
- Aggiungere 2-propanol dropwise fino a quando l'eccesso di Cr(VI) viene consumato al punto di un colore verde.
- Filtrare la soluzione attraverso un pad di terra diatomaceous.
- Concentrare i lavaggi mediante evaporazione rotante ottenendo un olio.
- Sciogliere l'olio in 100 mL di CH2Cl2 e mettere in un imbuto separatore.
- Lavare questa fase organica con una soluzione satura di NaHCO3 (2 x 125 mL).
- Lavare lo strato organico con salamoia (125 mL).
- Asciugare la soluzione organica sopra l'anhydrous Na2SO4 e filtrarla.
- Evaporare la soluzione ottenendo 1,77 g di 1-fenil-2-propyne-1-one come un solido giallo (rendimento quantitativo).
- Lasciare asciugare il solido nel vuoto.
- Analizzare e caratterizzare da 1H-NMR.
3. Preparazione di 4-nitronitrosobenzene
- Aggiungere 16 g di potassio peroxymonosulfate (2KHSO5 KHSO4 K2SO4) (26 mmol) utilizzando una spatola in un bicchiere, aperto all'aria che contiene una barra di agitazione magnetica.
- Aggiungere 150 mL di acqua e mantenere la soluzione a 0 gradi centigradi sotto agitazione magnetica.
- Aggiungere 3,6 g di 4-nitroaniline (26 mol) con una spatola.
- Mescolare la sospensione a temperatura ambiente.
- Controllare la reazione da parte di TLC fino alla completa conversione di 4-nitroaniline (Rf4-Nitroaniline - 0,44, Rf4-Nitronidobenzene - 0,77; CH2Cl2 come eluente).
- Filtrare la miscela di reazione grezza su un Buchner dopo 48 h.
- Mettere il solido in un flacone rotondo a un collo.
- Cristallizzare il solido in metanolo (50 mL).
- Riscaldare la sospensione con una pistola termica fino al punto di ebollizione del metanolo e filtrare immediatamente la sospensione a caldo.
- Scartare il solido e riutilizzarlo alla fine per un'altra ricristallo.
- Filtrare il secondo precipitato formatosi nel pallone Erlenmeyer quando la soluzione raggiunge la temperatura ambiente.
- Lasciare asciugare il solido nel vuoto su un imbuto Buchner.
- Caratterizzare il solido di 1H-NMR.
4. Sintesi di 3-benzoyl-1-idrossio-5-nitroindole
- Collegare tutte le vetrerie essiccate del forno (una fiaschetta inferiore rotonda da 250 mL a due collo contenente una barra magnetica di agitazione, un tappo, un refrigerante e un giunto per collegarsi al sistema di vuoto/azoto) e mettere sotto vuoto per 30 min.
- A temperatura ambiente, dopo alcuni cicli di vuoto/azoto, lavare tutte le vetrerie con azoto e lasciarlo sotto atmosfera inerte.
- Aggiungere 1,52 g (10 mmol) di 4-nitronitrosobenzene in atmosfera inerte.
- Aggiungere 1,30 g (10 mmol) di 1-fenil-2-propyne-1-one.
- Aggiungere 80 mL di toluene tramite una siringa e mantenere la miscela di reazione sotto mescolando magnetica a 80 gradi centigradi.
- Dopo pochi minuti, controllare la solubilizzazione completa dei reattori.
- Verificare la formazione di un precipitato arancione dopo circa 30-40 min a 80 gradi centigradi.
- Dopo la precipitazione completa di un solido arancione (circa 2,5 h), spegnere il riscaldamento e lasciare che la reazione raggiunga la temperatura ambiente.
- Filtrare la miscela e raccogliere 3-benzoyl-1-idrossio-5-nitroindole come un solido arancione su un imbuto Buchner.
- Mantenere sotto vuoto a secco.
- Analizzare e caratterizzare il prodotto solido di 1H e 13C-NMR, FT-IR e HRMS.
Risultati
La preparazione di 4-nitronitrosobenzene 2 è stata ottenuta mediante ossidazione di 4-nitroaniline 1 dalla reazione con peroxymonosulfate di potassio, come riportato nella Figura 6. Il prodotto 2 è stato ottenuto nel 64% di resa dopo la ricontificazione in MeOH (due volte) con 3-5% di contaminazione di 4,4'-bis-nitro-azoxybenzene 6. La struttura del prodotto 2 è stata confermata da 1H-NMR(Figura 7). 1 : il nome del H-NMR (400 MHz, CDCl3): 8,53 (d, J - 8,8 Hz, 2H), 8,07 (d, J - 8,8 Hz, 2H).
La preparazione di 1-fenil-2-propyne-1-one 4 è stata offerta dall'ossidazione di 1-phenyl-2-propyne-1-ol 3 con il reagente Jones come riportato nella Figura 8. Il prodotto 4 è stato isolato come solido giallo nel 90% di resa e la struttura è stata confermata da 1H-NMR (Figura 9). 1 : il nome del H-NMR (400 MHz, CDCl3): 8,10 (d, J - 7,4 Hz, 2H), 7,57 (t, 0, 7,4 Hz, 1H), 7,43 (t, J - 7,4 Hz, 2H), 3,36 (s, 1H).
La sintesi di 3-benzoyl-1-idrossio-5-nitroindole è stata realizzata dalla reazione termica di 4-nitronitrosobenzene 2 e 1-fenil-2-propyne-1-one 4 in toluene a 80 gradi centigradi come riportato nella Figura 10. Il composto indole 5 è stato isolato nel 58% di resa per filtrazione dopo 2,5 h. Il derivato azosa 6 è stato isolato nel 22% di resa come il prodotto principale del liquore madre dopo la cromatografia (Rf 0,36) utilizzando CH2Cl2/ hexane s.r.l. La struttura del prodotto 6 è stata confermata da 1H-NMR(Figura 11). 1 : il nome del H-NMR (400 MHz, CDCl3): ): 8,47 (d, J - 9,2 Hz, 2H), 8,35 (d, J - 9,2 Hz, 2H), 8,30 (d, J - 9,2 Hz, 2H), 8,23 (d, J - 9,H). La struttura del composto 5 è stata determinata da FT-IR, 1H-NMR (Figura 12), 13C-NMR (Figura 13) e HRMS (Figura 14 e Figura 15).
FT-IR (disco KBr): 1619, 1560, 1518, 1336, 850, 817, 740, 700 cm-1. 1 : il nome del H-NMR (400 MHz, DMSO-d6):12,68 usd (s, 1H, bs), 9,16 (d, J - 2,3 Hz, 1H), 8,38 (s, 1H), 8,22 (dd, J - 9,0 Hz, J - 2,3 Hz, 1 H), 7,85 (d, J - 7,2 Hz, 2H), 7,74 (d, J - 9,0 Hz, 1H), 7,66 (t, J - 7,2 Hz, 1 H), 7,58 (t, 7,2 Hz). 13 del sistema C-NMR (400 MHz, DMSO-d6): 188,94, 143,24, 139,19, 136,58, 136,40, 131,81, 128,61, 128,53, 122,05, 118,81, 118,25, 110,96, 110.96, 110.19. HRMS (ESI-) calcato per C15H10N2O4: 281.0562 ([M-1]); trovato: 281.0565. HRMS(ESI) calcato per C15H10 N2O4: 283.0719 ([M-1]), 305.0538 [M-Na]; trovato: 283.0713, 305.0532.
1 : il nome del Gli spettri H-NMR sono stati ottenuti per i composti 2, 4, 5 e 6; 13 del sistema C-NMR sono stati ottenuti per composto 5. A meno che non diversamente indicato, tutti gli spettri sono stati raccolti a temperatura ambiente. Spettri di massa ad alta risoluzione sono stati ottenuti per il composto 5 con ionizzazione ESI (positiva e negativa). Lo spettro IR è stato ottenuto per il composto 5.
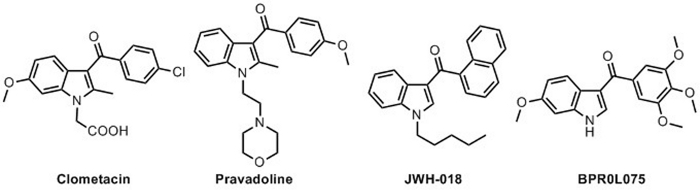
Figura 1: Diversi composti a 3 aroylindoli che mostrano attività biologiche. Clometacina (farmaco antinfiammatorio), Pravadoline (analgesico), JWH-018 (agonista dei recettori CB1 e CB2) e BPR0L075 (agente antimitotico e antivascolare). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Alcuni esempi di indos N-idrossi naturali e sintetici. Birnbaumins A e B sono due composti tossici di pigmento giallo, inibitori di Lactate DeHydrogenase, Coproverdine un alcaloide marino citotossico da un ascidiano neozelandese, Stephacidin B un alcaloide antitumor isolato dal fungo Aspergillus ochraceus.

Figura 3: Risultati precedenti della ricerca nella procedura di indolizzazione intermolecolare. Sintesi di indoles, N-hydroxyindoles e N-alkoxyindoles da cicloaddition di nitro- e nitrosoarenes con alchines Si prega di fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Applicazione dell'approccio sintetico alla preparazione di prodotti naturali. Sintesi di Meridianin e analoghi attraverso l'annlazione di C-nitrosoaromatics con composti etinylpyriminamina. Fare clic qui per visualizzare una versione più grande di questa figura.
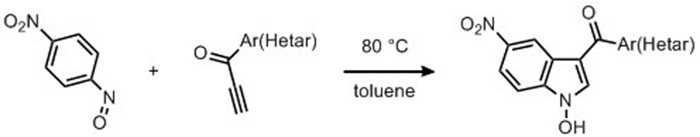
Figura 5: Sviluppi recenti con alkynones. Sintesi di 3-aroyl-1-idrossio-5-nitroindoles da ciclizzazione di 4-nitronitrosobenzenene con ynones coniugati. Fare clic qui per visualizzare una versione più grande di questa figura.
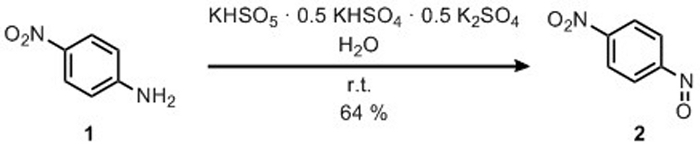
Figura 6: Preparazione di 4-Nitro-nitrosobenzene per ossidazione di 4-Nitroanial. Un'ossidazione selettiva del gruppo di ammino- al gruppo nitroso. Fare clic qui per visualizzare una versione più grande di questa figura.
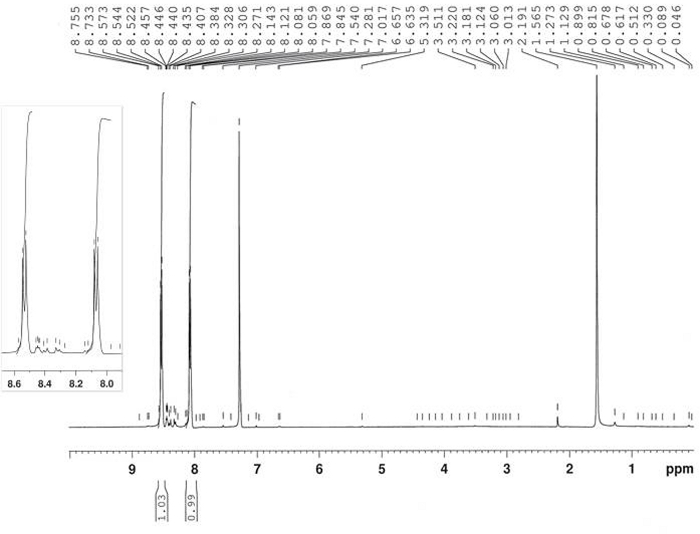
Figura 7: 1spettro H-NMR di 4-nitronitrosobenzene (2). Un tipico modello di divisione AA'BB' è mostrato qui. Fare clic qui per visualizzare una versione più grande di questa figura.
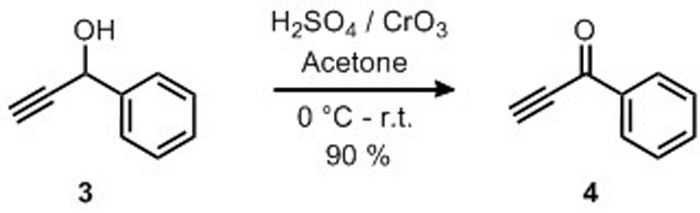
Figura 8: Preparazione di 1-Phenyl-2-propyne-1-one da ossidazione di 1-Phenyl-2-propyne-1-ol. Un'ossidazione selettiva dell'alcol a un chetone. Fare clic qui per visualizzare una versione più grande di questa figura.
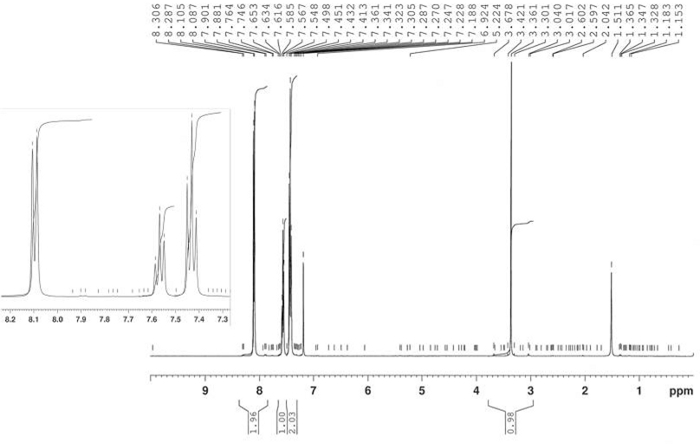
Figura 9: 1spettro H-NMR di 1-fenil-2-propyne-1-one (4). Uno spettro di un composto aromatico monosostituito con un singolo di un alchino terminale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 10: Sintesi di 3-Benzoyl-1-idrossio-5-nitroindole (5) mediante cicloaddition di 2 e 4. La sintesi regiosesese di indoles a partire da uno ynone terminale e un nitrosoarene. Fare clic qui per visualizzare una versione più grande di questa figura.
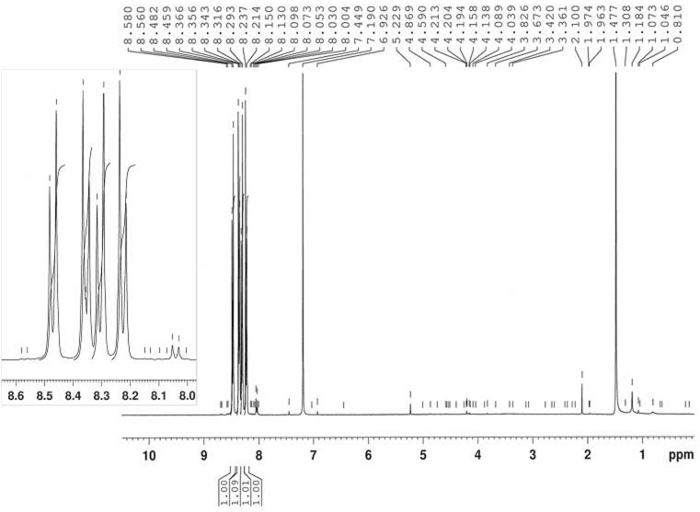
Figura 11: 1spettro H-NMR di 4,4'-bis-nitroazoxybenzene (6). Un tipico doppio modello di divisione AA'BB' è mostrato qui per il sottoprodotto maggiore. Fare clic qui per visualizzare una versione più grande di questa figura.
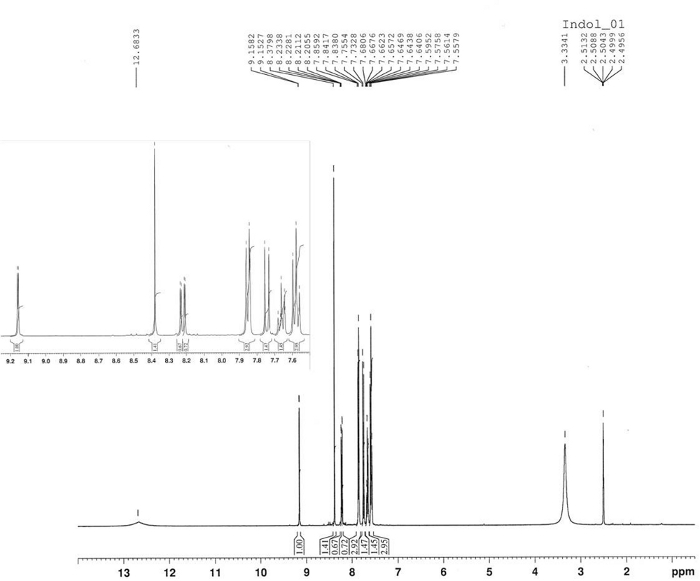
Figura 12: 1spettro H-NMR di 3-benzoyl-1-idrossi-5-nitroindole (5). Lo spettro mostra il modello di sostituzione aromatico di un 3,5-dissubstituted-N-hydoxyindole. Fare clic qui per visualizzare una versione più grande di questa figura.
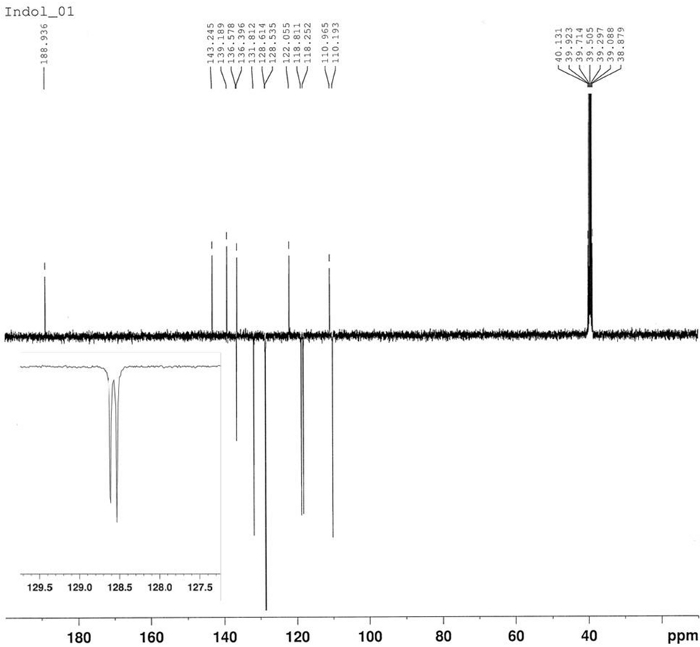
Figura 13: 13spettro C-NMR di 3-benzoyl-1-idrossi-5-nitroindole (5). Sei segnali per gli atomi di carbonio quaternari e sette segnali per gli atomi di carbonio terziari. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 14: HRMS (ESI-) spettro di 3-benzoyl-1-idrossi-5-nitroindole (5). Modalità ionizzazione negativa spettrometria di massa del composto di destinazione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 15: HRMS(ESI ) spettro di 3-benzoyl-1-idrossi-5-nitroindole (5). Modalità ionizzazione positiva spettrometria di massa del composto di destinazione. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La reazione per la sintesi indole tra nitrosoarene e alkynones mostra un'elevata versatilità e un'applicazione forte e ampia. In una relazione precedente, potremmo generalizzare il nostro protocollo sintetico lavorando con diversi C-nitrosoaromatics e sostitutivi arylalkynones terminali o eteroarylalkyones72. La procedura mostra un'indagine condotta su substrati profondi e un'elevata tolleranza funzionale al gruppo e sia i gruppi di ritiro elettronico che i gruppi elettrone-donatore erano presenti sia nel nitrosoarene che nell'alchinone.
Una singola procedura per l'indolizzazione mediante cicloaddition di 4-nitro-nitrosobenenzene con 1-fenil-2-propyne-1-one è stata qui riportata come reazione rappresentativa. Dopo un sondaggio parziale, toluene, è stato trovato come il miglior solvente. Esecuzione del nostro protocollo, 3-benzoyl-1-idrossio-5-nitroindole 5 precipitato dalla miscela di reazione. Il prodotto indole è stato l'unico composto trovato nel solido che è stato isolato dalla filtrazione senza ulteriore purificazione. L'analisi dei liquori madre ci ha portato a trovare e rilevare l'unica presenza di 4,4'-dinitroazoxybenzene 6 come un importante sottoprodotto contenente azoto insieme all'alchinone non reagito 4 e ai prodotti sono stati isolati e purificati dalla cromatografia (Rfazoxyarene - 0,36 e Rfalkynone - 0,30 usando CH2Cl2 / Hexane - 6/4 come eluente). Gli azoxybenzenes sono prodotti collaterali tipici delle reazioni con i nitrosoareni come materiali di partenza. Recentemente è stato riportato come questa classe di composti può essere ottenuta selettivamente come i principali prodotti di reazioni termiche effettuate in una vasta gamma di solventi organici attraverso un accoppiamento deossigenario deduttivamente di C-nitrosoaromaticis73 . Nella procedura introdotta da noi72, utilizzando 4-nitronitrosobenzene con diversi alkynones la precipitazione di 3-aroyl(heteroaroyl)-N-idrossio-5-nitroindoles è stato sempre osservato ottenere più di una dozzina di composti. Altri prodotti C-nitrosoaromatics che mostravano forti substituenti di prelievo di elettroni davano prevalentemente la formazione di 3-aroyl-1-idrossiindoles e/o 3-aroylindole prodotti. Impiegando nitrosoareni ricchi di elettroni, sono stati rilevati solo 3 aroylindoli. Tutti gli indoles sono stati prodotti in rese da moderate a buone. Uno studio parallelo è stato recentemente avviato nel nostro laboratorio dedicato allo studio del meccanismo di reazione e all'ottimizzazione delle condizioni che cercano di permettersi composti bersaglio in rendimenti più elevati. Potrebbe essere possibile aumentare le rese del prodotto, dopo la filtrazione del primo precipitato, e l'aggiunta di un altro equivalente di 4-nitronitrosobenzene ai liquori madre della reazione e riscaldare la miscela. Questa aggiunta e una seconda corsa portano alla formazione di ulteriori precipitazioni, ottenendo un'altra aliquota di prodotto indole. È risaputo che i nitrosoareni, sia in soluzione che come solidi, potrebbero essere presenti comedimeri 74. Questo è probabilmente il modo che favorisce la formazione di azoxyareni. La formazione di questo prodotto collaterale sottrae due equivalenti di nitrosoarene alla cicloaddition con l'alchino. Un'ipotesi meccanicistica per la preparazione di composti azossici è stata proposta da Chuang e colleghi73. In linea di principio, la procedura di indolizzazione funziona probabilmente meglio in alta diluizione del composto nitrosoaromatico. L'alta concentrazione potrebbe essere un tallone d'Achille per la dimerizzazione competitiva che è fortemente collegato con la formazione del composto azosa. Su questo argomento stiamo progettando di eseguire la reazione con lenta aggiunta di nitrosoarene e potrebbe essere utile impostare un apparato per eseguire sperimentalmente una procedura di reazione al flusso. Ulteriori esperimenti saranno effettuati nel prossimo futuro. Non abbiamo ancora costruito una solida congettura meccanicistica per spiegare la formazione di 3 aroylindole. Tuttavia, in una relazione precedente, lavorando con arylacetylenes, potremmo studiare il meccanismo della formazione di 3-arylindoles determinando che l'intermedio più plausibile è probabilmente undiradicale 67specie . Il legame carbonio-azoto si forma per primo, seguito dalla ciclicizzazione attraverso la formazione di un legame carbonio-carbonio.
L'uso dell'alchinone è un punto chiave per il nostro studio attuale e la preparazione degli ynones terminali è una procedura facile. 1-Phenyl-2-propyne-1-ol è l'unico arylalkynol disponibile in commercio. La preparazione di diversi arylalkynones e eteroarylalkynones è stato facilmente effettuata a partire da diverse aldeidi aromatiche ed eteroaromatici disponibili in commercio. Questi ultimi composti sono stati trattati con bromuro di magnesio etinyl per generare alchinoli da reazioni spesso effettuate a -78 gradi centigradi. Gli alhol propargyl secondari ottenuti sono stati ossidati dalla reazione con diversi agenti25,26,27. Questa procedura ci ha portato a permettersi ynones terminali come composti stabili e solidi. I nitrosoareni, diversamente dai corrispondenti nitroaromatics e aniline, non sono facilmente disponibili in commercio e sono stati preparati dall'ossidazione delle corrispondenti aniline19,20,21,22,23,24. Potrebbe essere utile studiare il nostro approccio sintetico mediante una formazione in situ di composti di nitroso per ossidazione o per riduzione. Recenti studi di Ragaini e colleghi hanno riportato la formazione di C-nitrosoaromatics a partire dai precursori nitroaromatici75,76,77,78. La scoperta, l'introduzione, lo studio e l'applicazione di nuovi protocolli di indolizzazione che potrebbero produrre indoles regiosesely e con un'economia atomo molto elevata, sono argomenti rilevanti nella chimica organica sintetica e siamo fiduciosi che questa metodologia attraverso la ciclotizzazione tra nitrosoareni e alchinoni potrebbe essere utile per diversi gruppi di ricerca.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
La dott.ssa Enrica Alberti e la dott.ssa Marta Brucka sono riconosciute per la raccolta e la registrazione degli spettri NMR. Ringraziamo il Dr. Francesco Tibiletti e la Dott.ssa Gabriella Ieronimo per le discussioni utili e l'assistenza sperimentale.
Materiali
| Name | Company | Catalog Number | Comments |
| 4-Nitroaniline | TCI Chemicals | N0119 | |
| Acetone | TCI Chemicals | A0054 | |
| 1-Phenyl-2-propyne-1-ol | TCI Chemicals | P0220 | |
| Celite 535 | Fluorochem | 44931 | |
| Dichloromethane | TCI Chemicals | D3478 | |
| Sodium hydrogen carbonate | Sigma Aldrich | S5761 | |
| Sodium chloride | Sigma Aldrich | 746398 | |
| Sodium sulfate anhydrous | Sigma Aldrich | 239313 | |
| Oxone | TCI Chemicals | O0310 | |
| Methanol | TCI Chemicals | M0628 | |
| Toluene | TCI Chemicals | T0260 | |
| Chromium Trioxide | Sigma Aldrich | 236470 | |
| Dichloromethane anhydrous | TCI Chemicals | D3478 | |
| Hexane anhydrous | TCI Chemicals | H1197 |
Riferimenti
- Vančik, H. Aromatic C-nitroso Compounds. , Springer. Dordrecht. (2013).
- Whittaker, R. E., Dermenci, A., Dong, G. Synthesis of Ynones and Recent Application in Transition-Metal-Catalyzed Reactions. Synthesis. 48 (2), 161-183 (2016).
- Carosso, S., Miller, M. J. Nitroso Diels-Alder (NDA) reaction as an efficient tool for the functionalization of diene-containing natural products. Organic Biomolecular Chemistry. 12 (38), 7445-7468 (2014).
- Maji, B., Yamamoto, H. Catalytic Enantioselective Nitroso Diels-Alder Reaction. Journal of the American Chemical Society. 137 (50), 15957-15963 (2015).
- Momiyama, N., Yamamoto, H. Enantioselective O- and N-Nitroso Aldol Synthesis of Tin Enolates. Isolation of Three BINAP-Silver Complexes and Their Role in Regio- and Enantioselectivity. Journal of the American Chemical Society. 126 (17), 5360-5361 (2004).
- Hayashi, Y., Yamaguchi, J., Sumiya, T., Shoji, M. Direct proline-catalyzed asymmetric alpha-aminoxylation of ketones. Angewandte Chemie International Edition. 43 (9), 1112-1115 (2004).
- Adam, W., Krebs, O. The Nitroso Ene Reaction: A Regioselective and Stereoselective Allylic Nitrogen Functionalization of Mechanistic Delight and Synthetic Potential. Chemical Reviews. 103 (10), 4131-4146 (2003).
- Merino, E. Synthesis of azobenzenes: the coloured pieces of molecular materials. Chemical Society Reviews. 40 (7), 3835-3853 (2011).
- Yu, B. C., Shirai, Y., Tour, J. M. Syntheses of new functionalized azobenzenes for potential molecular electronic devices. Tetrahedron. 62 (44), 10303-10310 (2006).
- Priewisch, B., Rück-Braun, K. Efficient Preparation of Nitrosoarenes for the Synthesis of Azobenzenes. The Journal of Organic Chemistry. 70 (6), 2350-2352 (2005).
- Wu, M. Y., He, W. W., Liu, X. Y., Tan, B. Asymmetric Construction of Spirooxindoles by Organocatalytic Multicomponent Reactions Using Diazooxindoles. Angewandte Chemie International Edition. 54 (32), 9409-9413 (2015).
- Sharma, P., Liu, R. S. [3+2]-Annulations of N-Hydroxy Allenylamines with Nitrosoarenes: One-Pot Synthesis of Substituted Indole Products. Organic Letters. 18 (3), 412-415 (2016).
- Wróbel, Z., Stachowska, K., Grudzień, K., Kwast, A. N-Aryl-2-nitrosoanilines as Intermediates in the Two-Step Synthesis of Substituted 1,2-Diarylbenzimidazoles from Simple Nitroarenes. Synlett. 22 (10), 1439-1443 (2011).
- Oakdale, J. S., Sit, R. K., Fokin, V. V. Ruthenium-Catalyzed Cycloadditions of 1-Haloalkynes with Nitrile Oxides and Organic Azides: Synthesis of 4-Haloisoxazoles and 5-Halotriazoles. Chemistry a European Journal. 20 (35), 11101-11110 (2014).
- Abbiati, G., Arcadi, A., Marinelli, F., Rossi, E. Sequential Addition and Cyclization Processes of α,β-Ynones and α,β-Ynoates Containing Proximate Nucleophiles. Synthesis. 46 (6), 687-721 (2014).
- Zhang, Z., et al. Chiral Co(II) complex catalyzed asymmetric Michael reactions of β-ketoamides to nitroolefins and alkynones. Tetrahedron Letters. 55 (28), 3797-3801 (2014).
- Bella, M., Jørgensen, K. A. Organocatalytic Enantioselective Conjugate Addition to Alkynones. Journal of the American Chemical Society. 126 (18), 5672-5673 (2004).
- Karpov, A. S., Merkul, E., Rominger, F., Müller, T. J. J. Concise Syntheses of Meridianins by Carbonylative Alkynylation and a Four-Component Pyrimidine Synthesis. Angewandte Chemie Internationa Edition. 44 (42), 6951-6956 (2005).
- Krebs, O. Dissertation, Wurzburg. , Wurzburg. available at http://www.bibliothek.uni-wuerzburg.de from the OPUS server (2002).
- Mel'nikov, E. B., Suboch, G. A., Belyaev, E. Y. Oxidation of Primary Aromatic Amines, Catalyzed by Tungsten Compounds. Russian Journal of Organic Chemistry. 31 (12), 1640-1642 (1995).
- Porta, F., Prati, L. Catalytic synthesis of C-nitroso compounds by cis-Mo(O)2(acac)2. Journal of Molecular Catalysis. A: Chemical. 157 (1-2), 123-129 (2000).
- Biradar, A. V., Kotbagi, T. V., Dongare, M. K., Umbarkar, S. B. Selective N-oxidation of aromatic amines to nitroso derivatives using a molybdenum acetylide oxo-peroxo complex as catalyst. Tetrahedron Letters. 49 (22), 3616-3619 (2008).
- Defoin, A. Simple Preparation of Nitroso Benzenes and Nitro Benzenes by Oxidation of Anilines with H2O2 Catalysed with Molybdenum Salts. Synthesis. 36 (5), 706-710 (2004).
- Zhao, D., Johansson, M., Bäckvall, J. E. In Situ Generation of Nitroso Compounds from Catalytic Hydrogen Peroxide Oxidation of Primary Aromatic Amines and Their One-Pot Use in Hetero-Diels-Alder Reactions. European Journal of Organic Chemistry. (26), 4431-4436 (2007).
- Pigge, F. C., et al. Structural characterization of crystalline inclusion complexes formed from 1,3,5-triaroylbenzene derivatives-a new family of inclusion hosts. Journal of Chemical Society, Perkin Transactions 2. (12), 2458-2464 (2000).
- Scansetti, M., Hu, X., McDermott, B., Lam, H. W. Synthesis of Pyroglutamic Acid Derivatives via Double Michael Reactions of Alkynones. Organic Letters. 9 (11), 2159-2162 (2007).
- Ge, G. C., Mo, D. L., Ding, C. H., Dai, L. X., Hou, X. L. Palladacycle-Catalyzed Reaction of Bicyclic Alkenes with Terminal Ynones: Regiospecific Synthesis of Polysubstituted Furans. Organic Letters. 14 (22), 5756-5759 (2012).
- Maeda, Y., et al. Oxovanadium Complex-Catalyzed Aerobic Oxidation of Propargylic Alcohols. The Journal of Organic Chemistry. 67 (19), 6718-6724 (2002).
- Gribble, G. W. Indole Ring Synthesis: from Natural Products to Drug Discovery. , Wiley & Sons Ltd. Chichester. (2016).
- Palmisano, G., et al. Synthesis of Indole Derivatives with Biological Activity by Reactions Between Unsaturated Hydrocarbons and N-Aromatic Precursors. Current Organic Chemistry. 14 (20), 2409-2441 (2010).
- Youn, S. W., Ko, T. Y. Metal-Catalyzed Synthesis of Substituted Indoles. Asian Journal of Organic Chemistry. 7 (8), 1467-1487 (2018).
- Bugaenko, D. I., Karchava, A. V., Yurovskaya, M. A. Synthesis of indoles: recent advances. Russian Chemical Reviews. 88 (2), 99-159 (2019).
- Kuo, C. C., et al. BPR0L075, a Novel Synthetic Indole Compound with Antimitotic Activity in Human Cancer Cells, Exerts Effective Antitumoral Activity in Vivo. Cancer Research. 64 (13), 4621-4628 (2004).
- Kaushik, N. K., et al. Biomedical Importance of Indoles. Molecules. 18 (6), 6620-6662 (2013).
- El Sayed, M. T., Hamdy, N. A., Osman, D. A., Ahmed, K. M. Indoles as anti-cancer agents. Advances in Modern Oncology Research. 1 (1), 20-35 (2015).
- Somei, M., et al. The Chemistry of 1-Hydroxyindole Derivatives: Nucleophilic Substitution Reactions on Indole Nucleus. Heterocycles. 34 (10), 1877-1884 (1992).
- Somei, M., Fukui, Y. Nucleophilic Substitution Reaction of 1-Hydroxytryptophan and 1-Hydroxytryptamine Derivatives (Regioselective Syntheses of 5-Substituted Derivatives of Tryptophane and Tryptamine. Heterocycles. 36 (8), 1859-1866 (1993).
- Somei, M., Fukui, Y., Hasegawa, M. Preparations of Tryptamine-4,5-dinones, and Their Diels-Alder and Nucleophilic Addition Reactions. Heterocycles. 41 (10), 2157-2160 (1995).
- Somei, M. The Chemistry of 1-Hydroxyindoles and Their Derivatives. Journal of Synthetic Organic Chemistry (Japan). 49 (3), 205-217 (1991).
- Rani, R., Granchi, C. Bioactive heterocycles containing endocyclic N-hydroxy groups. European Journal of Medicinal Chemistry. 97, 505-524 (2015).
- Escolano, C. Stephacidin B, the avrainvillamide dimer: a formidable synthetic challenge. Angewandte Chemie, International Edition. 44 (47), 7670-7673 (2005).
- Blunt, J. W., Munro, M. H. G. Coproverdine, a Novel, Cytotoxic Marine Alkaloid from a New Zealand Ascidian Sylvia Urban. Journal of Natural Products. 65 (9), 1371-1373 (2002).
- Li, W., Huang, S., Liu, X., Leet, J. E., Cantone, J., Lam, K. S. N-Demethylation of nocathiacin I via photo-oxidation. Bioorganic and Medicinal Chemistry Letters. 18 (14), 4051-4053 (2008).
- Tsukamoto, S., et al. Notoamides F-K, Prenylated Indole Alkaloids Isolated from a Marine-Derived Aspergillus sp. Journal of Natural Products. 71 (12), 2064-2067 (2008).
- Nicolaou, K. C., Lee, S. H., Estrada, A. A., Zak, M. Construction of Substituted N-Hydroxyindoles: Synthesis of a Nocathiacin I Model System. Angewandte Chemie, International Edition. 44 (24), 3736-3740 (2005).
- Nicolaou, K. C., Estrada, A. A., Lee, S. H., Freestone, G. C. Synthesis of Highly Substituted N-Hydroxyindoles through 1,5-Addition of Carbon Nucleophiles to In Situ Generated Unsaturated Nitrones. Angewandte Chemie, International Edition. 45 (32), 5364-5368 (2006).
- Nicolaou, K. C., Estrada, A. A., Freestone, G. C., Lee, S. H., Alvarez-Mico, X. New synthetic technology for the construction of N-hydroxyindoles and synthesis of nocathiacin I model systems. Tetrahedron. 63 (27), 6088-6114 (2007).
- Chan, S. T. S., Norrie Pearce, A., Page, M. J., Kaiser, M., Copp, B. R. Antimalarial β-Carbolines from the New Zealand Ascidian Pseudodistoma opacum. Journal of Natural Products. 74 (9), 1972-1979 (2011).
- Bartsch, A., Bross, M., Spiteller, P., Spiteller, M., Steglich, W. Birnbaumin A and B: Two Unusual 1-Hydroxyindole Pigments from the "Flower Pot Parasol" Leucocoprinus birnbaumii. Angewandte Chemie., International Edition. 44 (19), 2957-2959 (2005).
- Di Bussolo, V., et al. Synthesis and biological evaluation of non-glucose glycoconjugated N-hydroyxindole class LDH inhibitors as anticancer agents. RSC Advances. 5 (26), 19944-19954 (2015).
- Granchi, C., et al. Discovery of N-Hydroxyindole-Based Inhibitors of Human Lactate Dehydrogenase Isoform A (LDH-A) as Starvation Agents against Cancer Cells. Journal of Medicinal Chemistry. 54 (6), 1599-1612 (2011).
- Granchi, C., et al. N-Hydroxyindole-based inhibitors of lactate dehydrogenase against cancer cell proliferation. European Journal of Medicinal Chemistry. 46 (11), 5398-5407 (2011).
- Granchi, C., et al. Synthesis of sulfonamide-containing N-hydroxyindole-2-carboxylates as inhibitors of human lactate dehydrogenase-isoform 5. Bioorganic Medicinal Chemistry Letters. 21 (24), 7331-7336 (2011).
- Granchi, C., et al. Assessing the differential action on cancer cells of LDH-A inhibitors based on the N-hydroxyindole-2-carboxylate (NHI) and malonic (Mal) scaffolds. Organic Biomolecular Chemistry. 11 (38), 6588-6596 (2013).
- Minutolo, F., et al. Compounds Inhibitors of Enzyme Lactate Dehydrogenase (LDH) and Pharmaceutical Compositions Containing These Compounds. Chemical Abstracts. , WO 2011054525 154(2011).
- Granchi, C., et al. Triazole-substituted N-hydroxyindol-2-carboxylates as inhibitors of isoform 5 of human lactate dehydrogenase (hLDH5). Medicinal Chemistry Communications. 2 (7), 638-643 (2011).
- Kuethe, J. T. A General Approach to Indoles: Practical Applications for the Synthesis of Highly Functionalized Pharmacophores. Chimia. 60 (9), 543-553 (2006).
- Somei, M. 1-Hydroxyindoles. Heterocycles. 50 (2), 1157-1211 (1999).
- Belley, M., Beaudoin, D., Duspara, P., Sauer, E., St-Pierre, G., Trimble, L. A. Synthesis and Reactivity of N-Hydroxy-2-Amino-3-Arylindoles. Synlett. 18 (19), 2991-2994 (2007).
- Belley, M., Sauer, E., Beaudoin, D., Duspara, P., Trimble, L. A., Dubé, P. Synthesis and reactivity of N-hydroxy-2-aminoindoles. Tetrahedron Letters. 47 (2), 159-162 (2006).
- Hasegawa, M., Tabata, M., Satoh, K., Yamada, F., Somei, M. A Novel Dimerization of 1-Hydroxyindoles. Heterocycles. 43 (11), 2333-2336 (1996).
- Tollari, S., Penoni, A., Cenini, S. The unprecedented detection of the intermediate formation of N-hydroxy derivatives during the carbonylation of 2'-nitrochalcones and 2-nitrostyrenes catalysed by palladium. Journal of Molecular Catalysis A: Chemical. 152 (1-2), 47-54 (2000).
- Penoni, A., Nicholas, K. M. A novel and direct synthesis of indoles via catalytic reductive annulation of nitroaromatics with alkynes. Chemical Communication. 38 (5), 484-485 (2002).
- Penoni, A., Volkman, J., Nicholas, K. M. Regioselective Synthesis of Indoles via Reductive Annulation of Nitrosoaromatics with Alkynes. Organic Letters. 4 (5), 699-701 (2002).
- Penoni, A., Palmisano, G., Broggini, G., Kadowaki, A., Nicholas, K. M. Efficient Synthesis of N-Methoxyindoles via Alkylative Cycloaddition of Nitrosoarenes with Alkynes. The Journal of Organic Chemistry. 71 (2), 823-825 (2006).
- Ieronimo, G., et al. A simple, efficient, regioselective and one-pot preparation of N-hydroxy- and N-O-protected hydroxyindoles via cycloaddition of nitrosoarenes with alkynes. Synthetic scope, applications and novel by-products. Tetrahedron. 69 (51), 10906-10920 (2013).
- Penoni, A., Palmisano, G., Zhao, Y. L., Houk, K. N., Volkman, J., Nicholas, K. M. On the Mechanism of Nitrosoarene-Alkyne Cycloaddition. Journal of the American Chemical Society. 131 (2), 653-661 (2009).
- Tibiletti, F., et al. One-pot synthesis of meridianins and meridianin analogues via indolization of nitrosoarenes. Tetrahedron. 66 (6), 1280-1288 (2010).
- Walker, S. R., Carter, E. J., Huff, B. C., Morris, J. C. Variolins and Related Alkaloids. Chemical Reviews. 109 (7), 3080-3098 (2009).
- Walker, S. R., Czyz, M. L., Morris, J. C. Concise Syntheses of Meridianins and Meriolins Using a Catalytic Domino Amino-Palladation Reaction. Organic Letters. 16 (3), 708-711 (2014).
- Tibiletti, F., Penoni, A., Palmisano, G., Maspero, A., Nicholas, K. M., Vaghi, L. (1H-Benzo[d][1,2,3]triazol=1-yl)(5-bromo-1-hydroxy-1H-indol-3-yl)methanone. Molbank. 2014 (3), 829(2014).
- Ieronimo, G., et al. A novel synthesis of N-hydroxy-3-aroylindoles and 3-aroylindoles. Organic Biomolecular Chemistry. 16 (38), 6853-6859 (2018).
- Chen, Y. F., Chen, J., Lin, L. J., Chuang, G. J. Synthesis of Azoxybenzenes by Reductive Dimerization of Nitrosobenzene. The Journal of Organic Chemistry. 82 (21), 11626-11630 (2017).
- Beaudoin, D., Wuest, J. D. Dimerization of Aromatic C-Nitroso Compounds. Chemical Reviews. 116 (1), 258-286 (2016).
- EL-Atawy, M. A., Formenti, D., Ferretti, F., Ragaini, F. Synthesis of 3,6-Dihydro-2H-[1, 2]-Oxazines from Nitroarenes and Conjugated Dienes, Catalyzed by Palladium/Phenanthroline Complexes and Employing Phenyl Formate as a CO Surrogate. ChemCatChem. 10 (20), 4707-4717 (2018).
- Formenti, D., Ferretti, F., Ragaini, F. Synthesis of N-Heterocycles by Reductive Cyclization of Nitro Compounds using Formate Esters as Carbon Monoxide Surrogates. ChemCatChem. 10 (1), 148-152 (2018).
- EL-Atawy, M. A., Ferretti, F., Ragaini, F. A Synthetic Methodology for Pyrroles from Nitrodienes. European Journal of Organic Chemistry. (34), 4818-4825 (2018).
- Ragaini, F., Cenini, S., Brignoli, D., Gasperini, M., Gallo, E. Synthesis of oxazines and N-arylpyrroles by reaction of unfunctionalized dienes with nitroarenes and carbon monoxide, catalyzed by palladium-phenanthroline complexes. The Journal of Organic Chemistry. 68 (2), 460-466 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon