Method Article
Выделение экзосомных внеклеточных везикул, несущих гранулоцитарно-макрофагальный колониестимулирующий фактор, из эмбриональных стволовых клеток
В этой статье
Резюме
Это исследование описывает метод выделения из эмбриональных стволовых клеток, обогащенных экзосомами внеклеточных везикул, несущих иммуностимулирующие колониестимулирующие факторы гранулоцитарных макрофагов.
Аннотация
Эмбриональные стволовые клетки (ЭСК) представляют собой плюрипотентные стволовые клетки, способные к самообновлению и дифференцировке во все типы эмбриональных клеток. Как и многие другие типы клеток, ESCs высвобождают небольшие мембранные везикулы, такие как экзосомы, во внеклеточную среду. Экзосомы служат важнейшими медиаторами межклеточной коммуникации и играют основную роль во многих (пато)физиологических процессах. Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) функционирует как цитокин для модуляции иммунного ответа. Присутствие GM-CSF в экзосомах может повысить их иммунорегукрепительную функцию. Здесь GM-CSF стабильно переэкспрессировался в мышиной клеточной линии ESC ES-D3. Был разработан протокол для выделения высококачественных экзосомных внеклеточных везикул (EV) из клеток ES-D3, чрезмерно экспрессировающих GM-CSF. Изолированные экзосомные ev были характеризованы различными экспериментальными подходами. Важно отметить, что было обнаружено, что значительное количество GM-CSF присутствует в обогащенных экзосомами EV. В целом, обогащенные ГМ-CSF экзосомами EV из ЭСК могут функционировать как бесклеточные везикулы для осуществления своей иммунорегуляторной деятельности.
Введение
ESCs получены из стадии бластоцисты предимплантационного эмбриона1. Как плюрипотентные стволовые клетки, ESCs обладают способностью самообновляться и дифференцироваться в любой тип эмбриональных клеток. Благодаря своему замечательному потенциалу развития и долгосрочной пролиферативной способности, ЭСЦ чрезвычайно ценны для биомедицинских исследований1. Текущие исследовательские усилия в основном сосредоточены на терапевтическом потенциале ESCs для различных основных патологических расстройств, включая диабет, болезни сердца и нейродегенеративные заболевания2,3,4.
Известно, что клетки млекопитающих, включая ЭСК, высвобождают везикулы с переменными размерами во внеклеточную среду, и эти EV обладают многими физиологическими и патологическими функциями из-за их роли в межклеточной связи5. Среди различных подтипов EV экзосомы представляют собой небольшие мембранные везикулы, высвобождаемые из различных типов клеток во внеклеточное пространство при слиянии промежуточных эндоцитарных компартментов, мультивезикулярных тел (MVB), с плазматической мембраной6. Сообщалось, что экзосомы опосредовывают межклеточную коммуникацию и критически участвуют во многих (пато)физиологических процессах7,8. Экзосомы наследуют некоторые биологические функции от своих собственных родительских клеток, потому что экзосомы содержат биологические материалы, полученные из цитозола, включая белки и нуклеиновые кислоты. Таким образом, ассоциированные антигены или факторы, стимулирующие иммунный ответ, специфичный для данного заболевания, инкапсулируются в экзосомах из определенных типов клеток9. Это проложило путь к клиническим испытаниям, изучающим экзосомы, полученные из опухолей, в качестве противораковой вакцины10.
GM-CSF представляет собой цитокин, секретируемый различными типами иммунных клеток11. Новые данные свидетельствуют о том, что GM-CSF активирует и регулирует иммунную систему и играет важную роль в антиген-презентационно-презентационном процессе12. Например, клинический отчет предполагает, что GM-CSF стимулирует иммунный ответ на опухоли в качестве адъюванта вакцины13. Несколько стратегий иммунотерапии рака на основе GM-CSF для использования мощной иммуностимулирующей активности GM-CSF были исследованы в клинических испытаниях14. Среди них противораковая вакцина, состоящая из облученных ГМ-CSF-секреторных опухолевых клеток, показала некоторые перспективы у пациентов с прогрессирующей меланомой, индуцируя клеточные и гуморальные противоопухолевые ответы и последующий некроз в метастазированных опухолях15.
Поскольку экзосомы, полученные из ESCs, обладают аналогичной биологической активностью, что и исходные ESCs, возможно, экзосомы, несущие GM-CSF из ESCs, могут функционировать как бесклеточные везикулы для регулирования иммунного ответа. В данной работе описан подробный способ получения высококачественных обогащенных экзосомами EV из ЭСК, экспрессивующих GM-CSF. Эти обогащенные экзосомами электромобили могут служить иммунорегуляционными везикулами для модуляции иммунного ответа.
протокол
1. Культивирование клеток ES-D3
- Для получения фетальной бытовой сыворотки без экзосом (FBS) загрузите FBS в ультрацентрифугу и центрифугу при 100 000 х г в течение 16 ч при 4 °C. После центрифугирования соберите супернатант сыворотки в виде FBS без экзосом для культивирования мышиной клеточной линии ESC ES-D3 и получения обогащенных экзосомами EV.
- Перед обшивкой клеток ES-D3 обмойте посуду культурой ткани 15 см желатином (0,1%) при комнатной температуре в течение 30 мин.
- Следуя ранее описаннойпротоколе 16,культивируйте клетки ES-D3 без питательного слоя клеток в покрытых желатином 15 см тканевых культурных посудах. Среда клеточной культуры ES-D3 состоит из DMEM, FBS без экзосом (15%), несущественных аминокислот (0,1 мМ), L-глутамина (2 мМ), β-меркаптоэтанола (0,1 мМ), пенициллина (50 единиц / мл), стрептомицина (50 мкг / мл) и фактора ингибиции лейкемии (LIF; 100 единиц / мл). Культивирует клетки ES-D3 при 37 °C в 5% увлажненный инкубаторCO2.
- Как только клетки ES-D3 достигнут около 90% слияния в 15 см тканевых культурных посудах, удалите среду путем аспирации. Промывайте клетки с помощью трипсина (5 мл; 0,05%). Добавить в посуду трипсин (5 мл) и инкубировать при 37 °C в течение 5 мин. Соберите клетки с посуды.
- Добавьте свежую культурную среду (5 мл) к собранным клеткам, чтобы инактивировать трипсин. Центрифугировать ячейки при 390 х г в течение 5 мин. Повторно суспендирует клетки в свежей среде и определите количество клеток с помощью гемоцитометра.
- Для пассажа клеток нанесите клетки ES-D3 (5 х 106)в желатиновую (0,1%) 15 см чашку для культивирования тканей свежей средой (15 мл) и культивируем в течение 3 дней перед субкультурация клеток.
- Чтобы собрать супернатант клеточной культуры для выделения обогащенных экзосомами EV, обложите клетки ES-D3 (1 х 107)в покрытую желатином (0,1%) 15 см чашку для культуры тканей со свежей средой (15 мл) в течение 3 дней до сбора супернатанта клеточной культуры.
2. Генерация плазмиды экспрессии GM-CSF
ПРИМЕЧАНИЕ: Генерация трансфекционной плазмиды pEF1α-mGM-CSF-IRES-hrGFP для сверхэкспрессии GM-CSF в клетках ES-D3. В этой плазмиде экспрессия мышиной ГМ-CSF кДНК вместе с маркерным белком гуманизированным Renilla reniformis GFP (hrGFP) обусловлена фактором удлинения полипептидной цепи человека 1α (EF1α)промотором 17,18.
- Сгенерируйте векторную магистраль.
- Переваривайте плазмиду pEF1α-FD3ER-IRES-hrGFP (20 мкг ДНК) с помощью фермента рестрикции EcoRI (100 единиц) при 37 °C в течение 2 ч для генерации двух фрагментов ДНК: векторной магистрали (6,0 кб) и вставки FD3ER (2,5 кб).
- Переложить 50% переваренной плазмидной ДНК (10 мкг) в одну микроцентрифужную трубку объемом 1,5 мл и обработать щелочной фосфатазой (20 единиц) при 37 °C в течение 1 ч. Рецируются как необработанная, так и дефосфорилированная ДНК с помощью электрофореза агарозного геля (2%).
- Очистите векторные фрагменты ДНК позвоночника (6,0 кб) с помощью набора для экстракции ДНК-геля. В то время как необработанная векторная основа будет служить пустым вектором (pEF1α-IRES-hrGFP), дефосфорилированная векторная основа будет использоваться для генерации GM-CSF-экспрессирующей плазмиды (pEF1α-mGM-CSF-IRES-hrGFP).
- Сгенерируйте вставку кДНК GM-CSF.
- Переваривайте плазмиду pMSCV-mGM-CSF-IRES-EGFP19 (20 мкг) с помощью фермента рестрикции EcoRI (100 единиц) при 37 °C в течение 2 ч для получения двух фрагментов ДНК: векторной основы (6,5 кб) и мышиной вставки гм-ликвора кДНК (474 бп).
- Рассасывать переваренные ДНК с помощью электрофореза агарозного геля (2%). Очистите фрагмент кДНК GM-CSF в мыщах (474 bp) с помощью набора для экстракции ДНК-геля.
- Генерация экспрессии плазмид.
- Настройте 2 реакции лигирования (общий объем 10 мкл) с помощью набора для лигирования ДНК.
- Чтобы сгенерировать пустой вектор pEF1α-IRES-hrGFP, сложи необработанный векторный костяк с шага 2.1.3 (6.0 kb; 500 ng).
- Для генерации pEF1α-mGM-CSF-IRES-hrGFP сшифруйте следующие фрагменты ДНК: (1) дефосфорилированную векторную основу с шага 2.1.3 (6.0 kb; 500 ng) и (2) фрагмент кДНК mGM-CSF, сгенерированный на шаге 2.2.2 (474 bp; 200 ng).
- Лигат при 25 °C в течение 5 мин. Преобразование лигированной ДНК в DH5α-компетентные клетки E. coli. Накладываем преобразованные клетки E. coli на пластины LB-агара, содержащие карбенициллин (50 мкг/мл).
- Очищайте плазмиды от одиночных колоний E. coli с помощью набора для изоляции ДНК. Проверка идентичности плазмид путем секвенирования ДНК.
- Настройте 2 реакции лигирования (общий объем 10 мкл) с помощью набора для лигирования ДНК.
3. Генерация клеток ES-D3, чрезмерно экспрессивных GM-CSF
ПРИМЕЧАНИЕ: Трансфектировать клетки ES-D3 плазмидой pEF1α-mGM-CSF-IRES-hrGFP для сверхэкспрессии GM-CS. Котрансфектировать плазмиду pBabe-Neo в клетки ES-D3 для облегчения отбора стабильно трансфектированных клеток18,20.
- Трансфектирует плазмиды в клетки ES-D3.
- Выкладываем клетки ES-D3 (1,4 х 106)в желатиновую (0,1%) 10 см тканевую культурную чашку с культурной средой (10 мл) для трансфекции. Культивируется покрывая клетками ES-D3 при 37 °C в течение 24 ч.
- Готовят две плазмидные смеси в микроцентрифужных пробирках по 1,5 мл: (1) pEF1α-IRES-hrGFP (28 мкг, контроль векторов) с pBabe-Neo (4 мкг) и (2) pEF1α-mGM-CSF-IRES-hrGFP (28 мкг, экспрессирующий GM-CSF) с pBabe-Neo (4 мкг). Проводите трансфекцию с помощью трансфекционного комплекта в соответствии с протоколом производителя.
- Добавляют трансфекционную среду (1 мл) и трансфекционный реагент (64 мкл) в каждую трубку, содержащую плазмидные смеси, и инкубируют при комнатной температуре в течение 5 мин.
- Добавьте трансфекционные смеси в соответствующие 10 см тарелки из клеток ES-D3. Инкубировать при 37 °C в течение 5 ч.
- Заменить среду в 10 см посуде свежей питательной средой (10 мл). Инкубировать при 37 °C в течение 24 ч.
- Генерировать объемные популяции стабильно трансфекированных клеток ES-D3.
- Удалите среду из трансфекированных клеток ES-D3. Промыть клетки трипсином (2 мл; 0,05%). Добавьте трипсин (2 мл) и инкубируют при 37 °C в течение 5 мин. Переложите клетки в 15 мл центрифужную трубку и добавьте 2 мл свежей питательной среды для нейтрализации трипсина. Центрифуга при 390 х г в течение 5 мин.
- Повторно суспендирует трансфекцию клеток в свежей питательной среде (10 мл). Оцените интенсивность флуоресценции GFP в трансфекированных ячейках ES-D3 с помощью флуоресцентно-активированной сортировки клеток (FACS) в соответствии с протоколом производителя.
- Переложите трансфектированные клетки в две 10 см посуды, содержащие свежую питательную среду (10 мл). Добавьте неомицин (0,5 мг/мл) для устранения нетрансферазированных клеток.
- Продолжают культивирование трансфефедированных клеток в культуральная среда, содержащая неомицин (0,5 мг/мл). Когда трансфектированные ES-D3 достигнут 90% конфюентности, снова переложите клетки на 15 см тканевую культуру посуды. Повторяют процедуру в течение 2 недель.
- Генерация клонов стабильно трансфекированных клеток ES-D3.
- Как только будут сформированы массовые популяции стабильно трансфекированных клеток ES-D3, соберите клетки, как и раньше. Определите номера клеток с помощью гемоцитометра. Центрифугировать ячейки при 390 х г в течение 5 мин. Повторное суспендирование клеток (1 х 107 клеток/мл) в свежей питательной среде.
- Фильтруйте клетки через стерильный клеточный сетчатый фильтр 40 мкм. Очищайте GFP-положительные ячейки ES-D3 с помощью FACS, следуя протоколу производителя.
- Поместить одну отсортированную клетку ES-D3 в одну скважину желатиновой (0,1%) 96-скважинной тканевой культурной пластины, содержащей родительские клетки ES-D3 (1 x 103)в среде, свободной от неомицина (200 мкл). Совместное культивирование трансфектированных клеток ES-D3 с их нетрансфектными родительскими аналогами гарантирует, что стабильно трансфектированные одиночные клетки ES-D3 выживают и размножаются как один клон.
- Культивировать клетки в течение 48 ч, а затем добавлять неомицин (0,5 мг/мл) в 96-щеточные пластины для устранения нетрансфексированных родительских клеток ES-D3.
- Продолжают культивирование GFP-положительных ES-D3 клеток в 96-скважинных тканевых культурных пластинах со средой, содержащей неомицин (0,5 мг/мл) в течение 1 недели. Перенос клональных клеточных линий ES-D3 в покрытые желатином (0,1%) 6 см блюда для посева тканей с культуральной средой (5 мл), содержащей неомицин (0,5 мг/мл) в течение 1 недели.
- Определите интенсивность флуоресценции GFP в каждом из трансфекированных клонов клеток ES-D3 с помощью FACS, следуя протоколу производителя. Выберите клоны ES-D3, выражающие либо GM-CSF, либо пустой вектор с высоким уровнем зеленой флуоресценции.
- Определите количество GM-CSF, секретируемого клетками ES-D3, используя мышиный набор GM-CSF ELISA, следуя протоколу производителя.
4. Выделение экзосомных внеклеточных везикул
- Культивирование клеток ES-D3 (1 х 107)в 15 см тканевых культурных посудах в течение 72 ч при 37 °C. Соберите супернатант клеточной культуры. Хранить собранный супернатант при 4 °C до 1 недели для поддержания экзосомальной целостности.
- Центрифугируют супернатант клеточной культуры при 5000 х г в течение 60 мин при 4 °C с помощью центрифуги для осаждения крупных фрагментов клеток.
- Соберите супернатант и центрифугу при 100 000 х г в течение 90 мин при 4 °C с помощью ультрацентрифуги.
- Удалите супернатант. Осторожно промыть каждую гранулу дважды фосфатно-буферным физиологическим раствором (PBS; 1 мл) для удаления остаточного супернатанта культуры.
- Повторно суспендирует каждую гранулу в PBS. Количественная оценка обогащенных экзосомами EV по содержанию белка5.
- Измерьте концентрацию белка в обогащенных экзосомами EV с помощью анализа бицинхониновой кислоты (BCA). Ожидаемый выход обогащенных экзосомами EV из клеток ES-D3 составляет приблизительно 4 мкг белка/мл супернатанта клеточной культуры. Ресуспендированных экзосомами EV в PBS (концентрация белка: ~6 мкг/мкл). Храните обогащенные экзосомами электромобили при -80 °C.
5. Характеристика экзосомных внеклеточных везикул методом просвечивательной электронной микроскопии
ПРИМЕЧАНИЕ: Исследовать состав и структуру обогащенных экзосомами EV, выделенных из ЭСК, с помощью просвечивающих электронных микроскопий(ТЭМ)5.
- Фиксируют обогащенные экзосомами EV (3-5 мкг/мкл) конечной концентрацией 2% параформальдегида ЭМ-класса при комнатной температуре в течение 2 ч.
- Загрузите фиксированные образцы (10 мкл) на медные решетки с углеродной поддерживающей пленкой. Инкубируют образцы медными сетками в течение 1 мин, а затем сливают сетки фильтровальной бумагой.
- Окрашивают сетки окрашивающим раствором по протоколу производителя.
- Переложите сетки на лист фильтровальной бумаги с помощью пинцетса. Дайте сеткам высохнуть ночью при комнатной температуре.
- Получение изображений электронной микроскопии с помощью просвечивающих электронных микроскопов (увеличение 50 000x) в соответствии с протоколом производителя.
6. Оценка экзосомных внеклеточных везикул методом вестерн-блот-анализа
- Приготовьте экстракты цельных клеток.
- Удалите среду из клеток ES-D3, культивированных в посуде по 15 см. Промыть клетки трипсином (5 мл; 0,05%). Добавьте трипсин (5 мл) в клетки. Инкубировать при 37 °C в течение 5 мин. Соберите клетки и добавьте свежую культурную среду (5 мл) для нейтрализации трипсина. Центрифугировать ячейки при 390 х г в течение 5 мин. Повторное суспендирование ячеек в PBS.
- Определите количество клеток с помощью гемоцитометра. Центрифугировать ячейки снова при 390 х г в течение 5 мин. Повторное суспендирование ячеек в буфере загрузки SDS-PAGE, содержащем 0,5% SDS (5 000 ячеек/мкл).
- Облицовка образцов ультразвуком в течение 10 с помощью ультразвукового аппарата с амплитудой 10% (мощность: 500 Вт; ультразвуковая частота: 20 кГц). Нагревать образцы при 100 °C в течение 5 мин.
- Приготовьте лизаты обогащенных экзосомами электромобилей.
- Повторное суспендирование обогащенных экзосомами EV в буфере загрузки SDS-PAGE, содержащем 0,5% SDS в концентрации 1,2 мкг/мкл.
- Облицовка образцов ультразвуком в течение 10 с помощью ультразвукового аппарата с амплитудой 10% (мощность: 500 Вт; ультразвуковая частота: 20 кГц). Нагревать образцы при 100 °C в течение 5 мин.
- Обнаружение белков с помощью вестерн-блотта.
- Экстракты целых клеток нагрузки (10 мкл; 5000 клеток/мкл) и обогащенные экзосомами ЛИЗАТЫ ЭВ (10 мкл; 1,2 мкг/мкл) попадают в каждую скважину геля Bis-Tris PAGE (4-20%). Перенос белков на мембраны из поливинилиденфторида (PVDF).
- Инкубировать мембраны с соответствующими первичными и вторичными антителами. Разбавляют антитела (в концентрациях, указанных ниже) в промокательном буфере, содержащем PBS, Tween-20 (0,2%) и ожиренное сухое молоко (10% мас./об.).
- Используйте следующие первичные антитела: анти-Аннексин V (200 нг/мл), анти-CD81 (50 нг/мл), анти-Флотиллин-1 (200 нг/мл), антицитохром c (100 нг/мл), антибелокдисульфид изомераза (200 нг/мл), анти-GAPDH (33 нг/мл) и анти-Оксфос COX IV-субъединица IV (600 нг/мл).
- Используйте следующие вторичные антитела: пероксидаза-конъюгированная козья анти-кролик IgG (20 нг/мл) и пероксидаза-конъюгированная козья антимышка IgG (20 нг/мл).
- Обнаружение белков с помощью усовершенствованной установки для детектирования хемилюминесценции.
7. Определение концентраций GM-CSF во внеклеточных везикулах, обогащенных экзосомами, с помощью ИФА
ПРИМЕЧАНИЕ: Оцените количества GM-CSF в обогащенных экзосомами EV с помощью ИФА с использованием набора для мышиного GM-CSF в соответствии с протоколом производителя с некоторыми изменениями.
- Покрывайте пластину ИФА захватным антителом. Обрабатывайте обогащенные экзосомами ЭЛЕКТРОМОБИЛИ (0,6 мкг) только в PBS или PBS + 0,05% Tween-20 (100 мкл) при комнатной температуре в течение 30 мин. Добавьте обработанные образцы в ИФА-пластину с покрытием и инкубировать при комнатной температуре в течение 1 ч. Вымойте тарелку только PBS или PBS + 0,05% Tween-20.
- Добавьте к образцам антитела обнаружения. Инкубировать при комнатной температуре в течение 1 ч. Вымойте тарелку только PBS или PBS + 0,05% Tween-20. Добавьте avidin-HRP в образцы. Инкубировать при комнатной температуре в течение 30 мин. Вымойте тарелку только PBS или PBS + 0,05% Tween-20.
- Определение концентраций GM-CSF в обогащенных экзосомами EV путем измерения поглощения при 450 нм на считывателе микропластин.
Результаты
GM-CSF чрезмерно экспрессируется в мышиных ESCs.
Чтобы стабильно сверхэкспрессировать GM-CSF в клетках ES-D3, мышиную ГМ-ликворную кДНК клонировали в трансфекционный вектор для генерации вектора экспрессии pEF1α-mGM-CSF-IRES-hrGFP(рисунок 1A). GM-CSF был чрезмерно экспрессирован в клетках ES-D3 путем трансфекции, и около 20% транзитопрофицитированных клеток ES-D3 были GFP-положительными. Клоны клеток, стабильно переэкспрессивающие GM-CSF или пустую контроль переносчиков, были приобретены FACS. Как показано на рисунке 1B,интенсивность флуоресценции GFP клеточной линии ES-D3, экспрессии ES-D3 или клеточной линии ES-D3, экспрессиивющей пустой вектор, была намного выше, чем у их родительских аналогов. Был проведен ИФА-анализ для оценки концентраций GM-CSF в супернатанте клеточной культуры различных клеточных линий(рисунок 2). Клетки ES-D3, экспрессивающие GM-CSF, продуцировали заметно более высокие уровни GM-CSF в супернатанте клеточной культуры, чем их контроль пустого вектора. Кроме того, количество GM-CSF, генерируемого GM-CSF-экспрессирующими клетками ES-D3, было аналогично количеству ФИБРОБЛАСТОВ STO, экспрессирующих GM-CSF, как сообщалосьранее 19.
Экзосомы обогащаются внеклеточными везикулами, полученными из мышиных ЕСК.
Контроль переносчиков и ГМ-CSF-экспрессировка ES-D3 клеточные культуры были расширены, и был собран супернатант клеточной культуры. Электромобили были выделены после нескольких этапов центрифугирования. Одиночные электромобили были впервые оценены TEM(рисунок 3). Как показано на изображениях ТЭМ, изолированные EV содержали везикулы разных размеров, что обычно наблюдается в экзосомальных препаратах5. Важно отметить, что диаметр отдельных везикул составлял 30-100 нм, что согласуется с более ранними отчетами, описывающими экзосомы21. Кроме того, наличие экзосом в EV было исследовано с помощью вестерн-блоттинга(рисунок 4). Экспрессия экзосомальных маркеров, включая CD81, аннексин V и flotillin-1, была заметно усилена в EV, выделенных из клеток ES-D3, по сравнению с соответствующими экстрактами цельноклеток (WCE). Важно отметить, что присутствие других субклеточных маркеров компартмента в ES-D3-производных EV не было обнаружено, включая (1) эндоплазматический ретикулум (ER) маркер белковой дисульфидизомеразы (PDI), (2) митохондриальные маркеры цитохром c и COX IV-субъединицу IV и (3) цитозольный маркер GAPDH. В целом, эти данные демонстрируют, что экзосомы были высоко обогащены EV, полученными из клеток ES-D3.
GM-CSF локализуется внутри обогащенных экзосомами внеклеточных везикул, выделенных из ЕСК.
Чтобы определить, содержат ли обогащенные экзосомами EV молекулы GM-CSF, был проведен ИФА-анализ для оценки уровней GM-CSF в обогащенных экзосомами EV, полученных из клеток ES-D3 с экспрессией GM-CSF или безнее (рисунок 5). Для дальнейшего исследования локализации белка GM-CSF в обогащенных экзосомами EV уровни GM-CSF были количественно оценены в обогащенных экзосомами EV в различных условиях промывки с помощью ИФА. Для этой цели моющее средство Tween-20 (0,05%) сначала использовали для пермеабилизации экзосомальных мембран, а ИФА-анализы проводили в буферах с или без 0,05% Tween-20. Поскольку известно, что Tween-20 снижает белково-белковые взаимодействия, фоновые уровни GM-CSF, обнаруженные в контрольных EV, были значительно снижены Tween-20 в буфере промывки. Напротив, уровни GM-CSF в EV ГМ-CSF-экспрессивных клеток были значительно увеличены Tween-20. Эти результаты демонстрируют, что tween-20-индуцированная пермеабилизация экзосомальной мембраны делает молекулы GM-CSF внутри везикул доступными для распознавания антител, предоставляя доказательства того, что большинство экзосомальных молекул GM-CSF локализованы внутри просвета изолированных везикул.
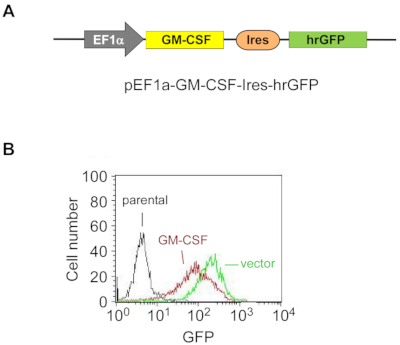
Рисунок 1: Экзогенный GM-CSF стабильно сверхэкспрессируется в клетках ES-D3.
(A) Принципиальная схема плазмиды для сверхэкспрессии мышиного GM-CSF в клетках ES-D3, в которой промотор EF1α управляет экспрессией GM-CSF, а hrGFP служит маркером экспрессии.
(B)Интенсивность флуоресценции GFP в ГМ-CSF-экспрессивных клетках ES-D3 или их пустых аналогах по борьбе с переносчиками определялась FACS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
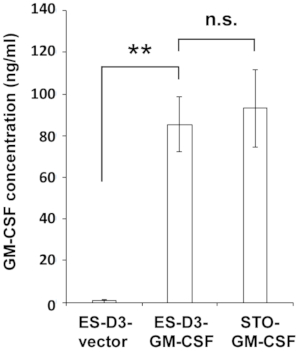
Рисунок 2: Клетки ES-D3, чрезмерно экспрессивающие GM-CSF, производят высокие уровни GM-CSF.
Концентрации GM-CSF в среде указанных клеток измеряли с помощью ИФА. Данные представлены в виде средних ± стандартных отклонений (среднее ± SD) трех независимых измерений ИФА: **p < 0,001, NS = незначимый, ANOVA с множественным сравнительным тестом Туки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Внеклеточные везикулы, полученные из ES-D3, исследуются с помощью просвечивающих электронных микроскопий.
Внеклеточные везикулы получали из клеток ES-D3, трансфектерированных плазмидой, экспрессифицировывающей GM-CSF или ее пустым векторным аналогом. Стрелки указывают на отдельные везикулы. Шкала = 100 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
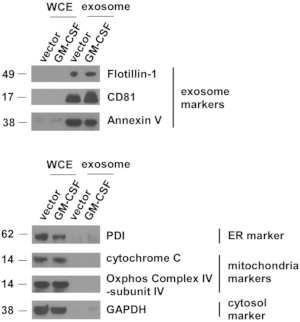
Рисунок 4: Экзосомальные маркеры высоко сконцентрированы во внеклеточных везикулах, выделенных из клеток ES-D3.
Количество маркеров экзосом, эндоплазматического ретикулума (ER), митохондрий и цитозола в указанных экстрактах цельноклеточных клеток (WCE) и EV оценивали с помощью западного блоттинга. PDI = протеиндисульфидизомераза. Маркеры молекулярных весов (kD) находятся слева. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Оценка уровней GM-CSF во внеклеточных везикулах, обогащенных экзосомами.
Уровни GM-CSF в указанных обогащенных экзосомами EV определяли при различных условиях ИФА. Обогащенные экзосомами EV предварительно обработали 0,05% Tween-20 или без него. ИФА проводили с использованием промывного буфера, содержащего либо только PBS, либо PBS + 0,05% Tween-20. Данные представлены в виде среднего ± SD трех независимых анализов ИФА. *p < 0,05, **p < 0,005, ANOVA с множественным сравнительным тестом Туки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Это исследование показывает высокоэффективный метод производства обогащенных экзосомами EV, несущих иммуностимулирующий белок GM-CSF, который может быть использован для изучения иммуномодулирующих эффектов обогащенных экзосомами EV. Несколько исследований показывают, что экзосомы проявляют иммунорегуляторы и противоопухолевые функции22. Таким образом, экзосомы из ESCs, экспрессирующие GM-CSF, могут также обладать биологической активностью, которая регулирует иммунный ответ. В этом протоколе экзогенный мышиный GM-CSF стабильно переэкспрессировался в мышиных клетках ES-D3 путем трансфекции(рисунок 1). Важно отметить, что значительное количество GM-CSF было обнаружено в обогащенных экзосомами EV, выделенных из клеток ES-D3, чрезмерно экспрессировающих GM-CSF(рисунок 5).
Эти данные свидетельствуют о том, что почти все GM-CSF находятся в обогащенных экзосомами EV. В виде цитокина большая часть белка GM-CSF секретируется внеклеточнымобразом 11. Как и другие экзосомальные грузовые материалы (например, мРНК, миРНК и белки), молекулы GM-CSF в цитозоле инкапсулируются во внутрипросветные везикулы (ILV) мультивезикулярных тел (MVB)6,23. При слиянии MVB с плазматической мембраной ГМ-CSF-несущие ILV высвобождаются во внеклеточное пространство.
Важным шагом в этом протоколе является эффективная сверхэкспрессия GM-CSF в мышиных клетках ES-D3(рисунок 2). Более ранние усилия по достижению этой цели путем ретровирусной инфекции в значительной степени потерпели неудачу, вероятно, из-за подавления экспрессии ретровирусных генов на транскрипционных уровнях в ESCs24. Среди нескольких исследованных вирусных и клеточных промотеров человеческий промотор EF1α показал наиболее надежную активность в клетках ES-D3. Важно отметить, что экспрессия трансгенов под контролем промотора EF1α оставалась стабильной после длительной клеточной культуры трансфектерных клеток ES-D3. Чтобы экспрессировать экзогенный GM-CSF в другом типе клеток, необходимы дальнейшие исследования для оценки эффективности различных промоторов. Применение этого метода для выделения ГМ-CSF-несущих экзосомных EV может быть распространено на другие типы стволовых клеток, а также опухолевые клетки, спроектированные для экспрессии различных цитокинов. Как и GM-CSF, большинство цитокинов секретируются внеклеточно25. Поэтому возможным ограничением этого подхода является то, что количество данного цитокина, накопленного в обогащенных экзосомами EV, слишком мало, чтобы проявлять свою биологическую активность. Для конкретного цитокина необходимо провести новые исследования для оптимизации его уровня белка и биологической активности в обогащенных экзосомами EV.
Наиболее важным препятствием в этом исследовании является генерация клонов ES-D3, чрезмерно экспрессирующих GM-CSF. Для поддержания плюрипотенциального состояния и содействия пролиферации клеток in vitro мышиные ЭСК обычно культивируют в присутствии фидерных клеток26. Для получения экзосом исключительно из ESCs был использован протокол без фидерных клеток для культивировании ESCs27. В этом исследовании клетки ES-D3 культивировали в блюдах, покрытых желатином, с использованием среды, дополненной LIF. Эффективность пластин и пролиферация одиночных клонов клеток ES-D3 в этом условии культуры были чрезвычайно низкими, что делало очень сложным создание клонов ES-D3 из отдельных клеток. Добавление условной среды, полученной из родительских клеток ES-D3, не смогло спасти дефицит пролиферации покрытых одиночных клеток ES-D3. Чтобы преодолеть это ограничение, одиночные клетки ES-D3, чрезмерно экспрессивающие GM-CSF, были покрыты вместе с родительскими клетками ES-D3. Такой подход к покрытию повысил жизнеспособность ГМ-CSF-экспрессирующих одиночных клонов ES-D3, способствуя клональному распространению и расширению. После трансфектерирования одиночные клоны ES-D3, по-видимому, прикрепляются к тканевым культурным пластинам. Они размножались независимо от присутствия других клеток ES-D3, поскольку родительские клетки ES-D3 были устранены через 48 ч после позолочения, что позволило расти только трансфектным одиночным клеткам ES-D3.
В целом, был разработан протокол для успешной генерации обогащенных экзосомами EV, несущих GM-CSF из ЭСК с потенциалом стимулировать иммунный ответ при различных заболеваниях. Кроме того, наше недавно опубликованное исследование показывает, что обогащенные ГМ-CSF экзосомы ev из ЭСК могут служить бесклеточной профилактической вакциной против рака28.
Раскрытие информации
Кавита Ядданапуди, Чи Ли и Джон У. Итон подали заявку на патент США «Композиции, содержащие инженерные экзосомы, полученные из эмбриональных стволовых клеток, и способы их использования».
Благодарности
Мы благодарны г-ну Аркадиузу Слюсарчику и Сети биомедицинских исследований Кентукки (KBRIN, P20GM103436) за получение изображений просвечивающих электронных микроскопов. Эта работа была частично поддержана грантами NIH AA018016-01 (J.W.E.), Commonwealth of Kentucky Research Challenge Trust Fund (J.W.E.), NIH CA106599 и CA175003 (C.L.), NIH CA198249 (K.Y.) и Free to Breathe Research Grant (K.Y.).
Материалы
| Name | Company | Catalog Number | Comments |
| Alkaline phosphate, Calf Intestinal | New England Biolabs | M0290S | Dephosphorylating DNA plasmid |
| anti-Annexin V mAb | Santa Cruz Biotechnology | clone H-3, sc-74438 | Western blot, RRID:AB_1118989 |
| anti-CD81 mAb | Santa Cruz Biotechnology | clone B-11, sc-166029 | Western blot, RRID:AB_2275892 |
| anti-cytochrome c mAb | Santa Cruz Biotechnology | clone A-8, sc-13156 | Western blot, RRID:AB_627385 |
| anti-Flotillin-1 mAb | Santa Cruz Biotechnology | clone C-2; sc-74566 | Western blot, RRID:AB_2106563 |
| anti-GAPDH pAb | Rockland | 600-401-A33S | Western blot, RRID:AB_11182910 |
| anti-mouse IgG, goat, peroxidase-conjugated | Thermo Fisher | 31430 | Western blot, RRID:AB_228307 |
| anti-Oxphos COX IV-subunit IV mAb | Thermo Fisher | clone 20E8C12 A21348 | Western blot, RRID:AB_221509 |
| anti-protein disulfide isomerase (PDI) pAb | Enzo | ADI-SPA-890 | Western blot, RRID:AB_10616242 |
| anti-rabbit IgG, goat, peroxidase-conjugated | Thermo Fisher | 31460 | Western blot, RRID:AB_228341 |
| BCA (bicinchoninic acid) assay | Thermo Fisher | 23223 | Determining protein concentrations |
| Bis-Tris PAGE Gel, ExpressPlus, 4-20% | Genscript | M42015 | Western blot |
| Carbenicillin, Disodium Salt | Thermo Fisher | 10177012 | Selecting E. coli colonies |
| Centrifuge, Avanti J-26 XPI | Beckman Coulter | Low speed centrifugation | |
| Centrifuge rotor, JA-10 | Beckman Coulter | 09U1597 | Low speed centrifugation |
| Centrifuge bottle, Nalgene PPCO | Thermo Fisher | 3120-0500PK | Low speed centrifugation |
| Cu grids with carbon support film | Electron Microscopy Sciences | FF200-Cu | Acquiring electron microscopy images |
| EcoRI | New England Biolabs | R0101 | Digesting DNA plasmid |
| Enhanced chemiluminescence detection system | Thermo Fisher | 32106 | Western blot |
| FACScalibur flow cytometer | Becton Dickinson | Examining GFP levels of ES-D3 cells | |
| Fetal bovine serum | ATCC | SCRR-30-2020 | Medium for ES-D3 cells |
| Fisherbrand Sterile Cell Strainers; Mesh Size: 40μm | Thermo Fisher | 22-363-547 | Filtering ES-D3 cells for FACS sorting |
| Gelatin (0.1%) | Thermo Fisher | ES006B | Culturing ES-D3 cells |
| GM-CSF ELISA kit | Thermo Fisher | 88733422 | Determining GM-CSF concentrations |
| KnockOut Dulbecco’s Modified Eagle’s Medium | Thermo Fisher | 10-829-018 | Medium for ES-D3 cells |
| Leukemia Inhibitory Factor | Thermo Fisher | ESG1106 | Medium for ES-D3 cells |
| L-glutamine | VWR | VWRL0131-0100 | Medium for ES-D3 cells |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668019 | Transfecting ES-D3 cells |
| Microplate reader, PowerWave XS | BioTek | Determining GM-CSF concentrations | |
| MoFlo XDP high-speed cell sorter | Beckman Coulter | Isolating single ES-D3 cell clones | |
| NEB 5-alpha Competent E. coli | New England Biolabs | C2988J | Generating GM-CSF expression plasmid |
| Neomycin | Thermo Fisher | 10-131-035 | Selecting ES-D3 clones |
| Non-essential amino acids | Thermo Fisher | SH3023801 | Medium for ES-D3 cells |
| Non-fat dry milk | Thermo Fisher | NC9022655 | Western blot |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher | 31985062 | Transfecting ES-D3 cells |
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | Acquiring electron microscopy images |
| Penicillin/streptomycin | VWR | sc45000-652 | Medium for ES-D3 cells |
| Plasmid pEF1a-FD3ER-IRES-hrGFP | Addgene | 37270 | Generating GM-CSF expression plasmid |
| PVDF membranes | Millipore EMD | IPVH00010 | Western blot |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | Generating GM-CSF expression plasmid |
| QIAquick Gel Extraction Kit (50) | QIAGEN | 28704 | Generating GM-CSF expression plasmid |
| Quick Ligation Kit | New England Biolabs | M2200S | Generating GM-CSF expression plasmid |
| Transmission electron microscope | Hitachi | HT7700 | Acquiring electron microscopy images |
| Trypsin | VWR | 45000-660 | Culturing ES-D3 cells |
| Ultracentrifuge, OptimaTM L-100 XP | Beckman Coulter | High speed centrifugation | |
| Ultracentrifuge rotor, 45Ti | Beckman Coulter | 09U4454 | High speed centrifugation |
| Ultracentrifuge polycarbonate bottle | Beckman Coulter | 355622 | High speed centrifugation |
| UranyLess staining solution | Electron Microscopy Sciences | 22409 | Acquiring electron microscopy images |
Ссылки
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Sakthiswary, R., Raymond, A. A. Stem cell therapy in neurodegenerative diseases: From principles to practice. Neural Regeneration Research. 7 (23), 1822-1831 (2012).
- Liu, Y. W., et al. Human embryonic stem cell-derived cardiomyocytes restore function in infarcted hearts of non-human primates. Nature Biotechnology. 36 (7), 597-605 (2018).
- Aguayo-Mazzucato, C., Bonner-Weir, S. Stem cell therapy for type 1 diabetes mellitus. Nature Reviews: Endocrinology. 6 (3), 139-148 (2010).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracell Vesicles. 7 (1), 1535750 (2018).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Meldolesi, J. Exosomes and Ectosomes in Intercellular Communication. Current Biology. 28 (8), R435-R444 (2018).
- Stremersch, S., De Smedt, S. C., Raemdonck, K. Therapeutic and diagnostic applications of extracellular vesicles. Journal of Control Release. 244 (Pt B), 167-183 (2016).
- Lindenbergh, M. F. S., Stoorvogel, W. Antigen Presentation by Extracellular Vesicles from Professional Antigen-Presenting Cells. Annual Review of Immunology. 36, 435-459 (2018).
- Kunigelis, K. E., Graner, M. W. The Dichotomy of Tumor Exosomes (TEX) in Cancer Immunity: Is It All in the ConTEXt?. Vaccines (Basel). 3 (4), 1019-1051 (2015).
- Becher, B., Tugues, S., Greter, M. GM-CSF: From Growth Factor to Central Mediator of Tissue Inflammation. Immunity. 45 (5), 963-973 (2016).
- Conti, L., Gessani, S. GM-CSF in the generation of dendritic cells from human blood monocyte precursors: recent advances. Immunobiology. 213 (9-10), 859-870 (2008).
- Higano, C. S., et al. Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer. 115 (16), 3670-3679 (2009).
- Yan, W. L., Shen, K. Y., Tien, C. Y., Chen, Y. A., Liu, S. J. Recent progress in GM-CSF-based cancer immunotherapy. Immunotherapy. 9 (4), 347-360 (2017).
- Dranoff, G., et al. Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulates potent, specific, and long-lasting anti-tumor immunity. Proceedings of the National Academy of Sciences of the United States of America. 90 (8), 3539-3543 (1993).
- Tremml, G., Singer, M., Malavarca, R. Chapter 1, Unit 1C 4, Culture of mouse embryonic stem cells. Current Protocols in Stem Cell Biology. , (2008).
- Kirsch, P., Hafner, M., Zentgraf, H., Schilling, L. Time course of fluorescence intensity and protein expression in HeLa cells stably transfected with hrGFP. Molecules and Cells. 15 (3), 341-348 (2003).
- Zeng, X., et al. Stable expression of hrGFP by mouse embryonic stem cells: promoter activity in the undifferentiated state and during dopaminergic neural differentiation. Stem Cells. 21 (6), 647-653 (2003).
- Yaddanapudi, K., et al. Vaccination with embryonic stem cells protects against lung cancer: is a broad-spectrum prophylactic vaccine against cancer possible?. PLoS One. 7 (7), e42289 (2012).
- Dalby, B., et al. Advanced transfection with Lipofectamine 2000 reagent: primary neurons, siRNA, and high-throughput applications. Methods. 33 (2), 95-103 (2004).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Chapter 3, Unit 3 22, Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , (2006).
- Zhang, X., et al. Exosomes for Immunoregulation and Therapeutic Intervention in Cancer. Journal of Cancer. 7 (9), 1081-1087 (2016).
- Bunggulawa, E. J., et al. Recent advancements in the use of exosomes as drug delivery systems. Journal of Nanobiotechnology. 16 (1), 81 (2018).
- Schlesinger, S., Lee, A. H., Wang, G. Z., Green, L., Goff, S. P. Proviral silencing in embryonic cells is regulated by Yin Yang 1. Cell Reports. 4 (1), 50-58 (2013).
- Dranoff, G. GM-CSF-based cancer vaccines. Immunological Reviews. 188, 147-154 (2002).
- Park, Y. G., et al. Effects of Feeder Cell Types on Culture of Mouse Embryonic Stem Cell In Vitro. Development and Reproduction. 19 (3), 119-126 (2015).
- Lin, S., Talbot, P. Methods for culturing mouse and human embryonic stem cells. Methods in Molecular Biology. 690, 31-56 (2011).
- Yaddanapudi, K., et al. Exosomes from GM-CSF expressing embryonic stem cells are an effective prophylactic vaccine for cancer prevention. OncoImmunology. 8 (3), 1561119 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены