Method Article
Isolement de vésicules extracellulaires enrichies en exosomes transportant un facteur de stimulation des colonies de granulocytes-macrophages à partir de cellules souches embryonnaires
Dans cet article
Résumé
Cette étude décrit une méthode pour isoler des vésicules extracellulaires enrichies en exosomes porteuses de facteurs de stimulation des colonies de macrophages granulocytaires immunostimulants à partir de cellules souches embryonnaires.
Résumé
Les cellules souches embryonnaires (CSE) sont des cellules souches pluripotentes capables de s’auto-renouveler et de se différencier en tous types de cellules embryonnaires. Comme beaucoup d’autres types de cellules, les CSE libèrent de petites vésicules membranaires, telles que des exosomes, dans l’environnement extracellulaire. Les exosomes servent de médiateurs essentiels de la communication intercellulaire et jouent un rôle fondamental dans de nombreux processus (patho)physiologiques. Le facteur de stimulation des colonies de granulocytes-macrophages (GM-CSF) fonctionne comme une cytokine pour moduler la réponse immunitaire. La présence de GM-CSF dans les exosomes a le potentiel de renforcer leur fonction immunorégulatrice. Ici, gm-CSF a été surexprimé de manière stable dans la lignée cellulaire murine ESC ES-D3. Un protocole a été développé pour isoler des vésicules extracellulaires (VE) enrichies en exosomes de haute qualité à partir de cellules ES-D3 surexprimant le GM-CSF. Les véhicules électriques isolés enrichis en exosomes ont été caractérisés par une variété d’approches expérimentales. Il est important de se trouver des quantités importantes de GM-CSF dans les véhicules électriques enrichis en exosomes. Dans l’ensemble, les VE enrichis en exosomes porteurs de GM-CSF provenant de CES pourraient fonctionner comme des vésicules sans cellules pour exercer leurs activités immunorégulatrices.
Introduction
Les CSE sont dérivés du stade de blastocyste d’un embryon préimplantatoire1. En tant que cellules souches pluripotentes, les CSE ont la capacité de s’auto-renouveler et de se différencier en tout type de cellule embryonnaire. En raison de leur potentiel de développement remarquable et de leur capacité proliférative à long terme, les CES sont extrêmement précieux pour la recherche biomédicale1. Les efforts de recherche actuels se sont largement concentrés sur le potentiel thérapeutique des CSE pour une variété de troubles pathologiques majeurs, y compris le diabète, les maladies cardiaques et les maladies neurodégénératives2,3,4.
Les cellules de mammifères, y compris les CSE, sont connues pour libérer des vésicules de tailles variables dans l’environnement extracellulaire, et ces VE possèdent de nombreuses fonctions physiologiques et pathologiques en raison de leur rôle dans la communication intercellulaire5. Parmi les différents sous-types de VE, les exosomes sont de petites vésicules membranaires libérées par divers types de cellules dans l’espace extracellulaire lors de la fusion de compartiments endocytaires intermédiaires, de corps multivésiculaires (M MVB), avec la membraneplasmique 6. Il a été rapporté que les exosomes médient la communication intercellulaire et sont impliqués de manière critique dans de nombreux processus (patho)physiologiques7,8. Les exosomes héritent de certaines fonctions biologiques de leurs propres cellules parentales, car les exosomes contiennent des matériaux biologiques acquis à partir du cytosol, y compris des protéines et des acides nucléiques. Ainsi, les antigènes associés ou les facteurs stimulant la réponse immunitaire spécifique à une maladie donnée sont encapsulés dans les exosomes de types particuliers de cellules9. Cela a ouvert la voie à des essais cliniques explorant les exosomes dérivés de tumeurs en tant que vaccin anticancéreux10.
Gm-CSF est une cytokine sécrétée par différents types de cellules immunitaires11. De nouvelles preuves démontrent que le GM-CSF active et régule le système immunitaire et joue un rôle essentiel dans le processus de présentation de l’antigène12. Par exemple, un rapport clinique suggère que le GM-CSF stimule la réponse immunitaire aux tumeurs en tant qu’adjuvantvaccinal 13. Plusieurs stratégies d’immunothérapie du cancer à base de GM-CSF pour exploiter la puissante activité immunostimulatrice du GM-CSF ont été étudiées dans des essais cliniques14. Parmi ceux-ci, un vaccin anticancéreux composé de cellules tumorales sécrérant du GM-CSF irradiées s’est révélé prometteur chez les patients atteints de mélanome avancé en induisant des réponses antitumorales cellulaires et humorales et une nécrose ultérieure dans les tumeurs métastasées15.
Parce que les exosomes dérivés des CSE possèdent des activités biologiques similaires à celles des CES d’origine, peut-être que les exosomes porteurs de GM-LCR des CES pourraient fonctionner comme des vésicules sans cellules pour réguler la réponse immunitaire. Dans cet article, une méthode détaillée pour produire des VÉHICULES enrichis en exosomes de haute qualité à partir de CES exprimant gm-CSF est décrite. Ces VE enrichis en exosomes ont le potentiel de servir de vésicules immunorégulatrices pour moduler la réponse immunitaire.
Protocole
1. Cultiver des cellules ES-D3
- Pour générer du sérum bovin fœtal (FBS) sans exosomes, chargez FBS dans une ultracentrifugeuse et centrifugez à 100 000 x g pendant 16 h à 4 °C. Après la centrifugation, prélever le surnageant sérique sous forme de FBS sans exosomes pour la culture de la lignée cellulaire murine ESC ES-D3 et l’acquisition de VE enrichis en exosomes.
- Avant de plaquer les cellules ES-D3, recouvrir des boîtes de culture tissulaire de 15 cm à l’aide de gélatine (0,1%) à température ambiante pendant 30 min.
- Conformément à un protocole16décrit précédemment, la culture des cellules ES-D3 sans cellules de la couche nourricière dans les boîtes de culture tissulaire de 15 cm recouvertes de gélatine. Le milieu de culture cellulaire ES-D3 est composé de DMEM, de FBS sans exosomes (15 %), d’acides aminés non essentiels (0,1 mM), de L-glutamine (2 mM), de β-mercaptoéthanol (0,1 mM), de pénicilline (50 unités/mL), de streptomycine (50 μg/mL) et de facteur inhibiteur de la leucémie (LIF; 100 unités/mL). Culturez des cellules ES-D3 à 37 °C dans un incubateur humidifié à 5 % de CO2.
- Une fois que les cellules ES-D3 atteignent environ 90% de confluence dans des boîtes de culture tissulaire de 15 cm, retirez le milieu par aspiration. Laver les cellules à l’aide de trypsine (5 mL; 0,05%). Ajouter la trypsine (5 mL) dans les plats et incuber à 37 °C pendant 5 min. Collectez les cellules des plats.
- Ajouter un milieu de culture frais (5 mL) aux cellules prélevées pour inactiver la trypsine. Centrifuger les cellules à 390 x g pendant 5 min. Ressuspendez les cellules dans un milieu frais et déterminez le nombre de cellules à l’aide d’un hémocytomètre.
- Pour les cellules passages, plaquer les cellules ES-D3 (5 x 106) dans un plat de culture tissulaire de 15 cm recouvert de gélatine (0,1%) avec un milieu frais (15 mL) et la culture pendant 3 jours avant de sous-culer les cellules.
- Pour recueillir le surnageant de culture cellulaire pour l’isolement des VE enrichis en exosomes, plaquer les cellules ES-D3 (1 x 107)dans une boîte de culture tissulaire de 15 cm recouverte de gélatine (0,1%) avec un milieu frais (15 mL) pendant 3 jours avant de collecter un surnageant de culture cellulaire.
2. Génération de plasmide d’expression GM-CSF
REMARQUE: Générer le plasmide de transfection pEF1α-mGM-CSF-IRES-hrGFP pour surexprimer GM-CSF dans les cellules ES-D3. Dans ce plasmide, l’expression de l’ADNc GM-CSF murin avec la protéine marqueur humanisée Renilla reniformis GFP (hrGFP) est entraînée par le promoteur du facteur d’élongation de la chaîne polypeptidique humaine 1α (EF1α)17,18.
- Générez l’épine dorsale vectorielle.
- Digérer le plasmide pEF1α-FD3ER-IRES-hrGFP (20 μg d’ADN) à l’aide de l’enzyme de restriction EcoRI (100 unités) à 37 °C pendant 2 h pour générer deux fragments d’ADN : le squelette vectoriel (6,0 kb) et l’insert FD3ER (2,5 kb).
- Transférer 50 % de l’ADN plasmidique digéré (10 μg) dans un tube de microcentrifugation de 1,5 mL et traiter avec de la phosphatase alcaline (20 unités) à 37 °C pendant 1 h. Résoudre l’ADN non traité et déphosphorylé à l’aide de l’électrophorèse sur gel d’agarose (2%).
- Purifier les fragments d’ADN de l’épine dorsale du vecteur (6,0 kb) à l’aide d’un kit d’extraction de gel d’ADN. Alors que l’épine dorsale vectorielle non traitée servira de vecteur vide (pEF1α-IRES-hrGFP), l’épine dorsale vectorielle déphosphorylée sera utilisée pour générer un plasmide exprimant gm-CSF (pEF1α-mGM-CSF-IRES-hrGFP).
- Générez l’insert d’ADNc GM-CSF.
- Digérer le plasmide pMSCV-mGM-CSF-IRES-EGFP19 (20 μg) en utilisant l’enzyme de restriction EcoRI (100 unités) à 37 °C pendant 2 h pour produire deux fragments d’ADN : l’épine dorsale vectorielle (6,5 kb) et l’insert murin GM-CSF aDNc (474 pb).
- Résoudre l’ADN digéré par électrophorèse sur gel d’agarose (2%). Purifier le fragment d’ADNc gm-LCR murin (474 pb) à l’aide d’un kit d’extraction de gel d’ADN.
- Générez les plasmides d’expression.
- Mettez en place 2 réactions de ligature (volume total de 10 μL) à l’aide d’un kit de ligature de l’ADN.
- Pour générer le vecteur vide pEF1α-IRES-hrGFP, ligaturez l’épine dorsale du vecteur non traité à partir de l’étape 2.1.3 (6,0 kb; 500 ng).
- Pour générer pEF1α-mGM-CSF-IRES-hrGFP, ligaturez les fragments d’ADN suivants : (1) l’épine dorsale du vecteur déphosphorylé de l’étape 2.1.3 (6,0 kb; 500 ng) et (2) le fragment d’ADNc mGM-CSF généré à l’étape 2.2.2 (474 pb ; 200 ng).
- Ligature à 25 °C pendant 5 min. Transformez l’ADN ligaturé en cellules E. coli compétentes en DH5α. Plaquer les cellules d’E. coli transformées sur des plaques de LB-agar contenant de la carbénicilline (50 μg/mL).
- Purifier les plasmides des colonies uniques d’E. coli à l’aide d’un kit d’isolement de l’ADN. Valider l’identité des plasmides par séquençage de l’ADN.
- Mettez en place 2 réactions de ligature (volume total de 10 μL) à l’aide d’un kit de ligature de l’ADN.
3. Génération de cellules ES-D3 surexprimant GM-CSF
REMARQUE: Transfecter les cellules ES-D3 avec le plasmide pEF1α-mGM-CSF-IRES-hrGFP pour surexprimer GM-CS. Cotransfecter le plasmide pBabe-Neo dans les cellules ES-D3 pour faciliter la sélection des cellules transfectées de manière stable18,20.
- Transfecter les plasmides dans les cellules ES-D3.
- Plaquer les cellules ES-D3 (1,4 x 106) dans une boîte de culture tissulaire de 10 cm recouverte de gélatine (0,1%) avec milieu de culture (10 mL) pour la transfection. Culture de cellules ES-D3 plaquées à 37 °C pendant 24 h.
- Préparer deux mélanges de plasmides dans des tubes de microcentrifugation de 1,5 mL : (1) pEF1α-IRES-hrGFP (28 μg, lutte antivectorielle) avec pBabe-Neo (4 μg) et (2) pEF1α-mGM-CSF-IRES-hrGFP (28 μg, exprimant GM-CSF) avec pBabe-Neo (4 μg). Effectuer la transfection à l’aide d’un kit de transfection en suivant le protocole du fabricant.
- Ajouter le milieu de transfection (1 mL) et le réactif de transfection (64 μL) à chaque tube contenant les mélanges de plasmides et incuber à température ambiante pendant 5 min.
- Ajouter les mélanges de transfection aux plats respectifs de 10 cm de cellules ES-D3. Incuber à 37 °C pendant 5 h.
- Remplacer le milieu dans les plats de 10 cm par un milieu de culture frais (10 mL). Incuber à 37 °C pendant 24 h.
- Générer des populations en vrac de cellules ES-D3 transfectées de manière stable.
- Retirez le milieu des cellules ES-D3 transfectées. Laver les cellules avec de la trypsine (2 mL; 0,05%). Ajouter la trypsine (2 mL) et incuber à 37 °C pendant 5 min. Transférer les cellules dans un tube de centrifugeuse de 15 mL et ajouter 2 mL de milieu de culture frais pour neutraliser la trypsine. Centrifuger à 390 x g pendant 5 min.
- Ressuspendez les cellules transfectées dans un milieu de culture frais (10 mL). Évaluer l’intensité de fluorescence de la GFP dans les cellules ES-D3 transfectées à l’aide du tri cellulaire activé par fluorescence (FACS), conformément au protocole du fabricant.
- Transférer les cellules transfectées dans deux plats de 10 cm contenant un milieu de culture frais (10 mL). Ajouter la néomycine (0,5 mg/mL) pour éliminer les cellules non transfectées.
- Continuer à cultiver les cellules transfectées dans un milieu de culture contenant de la néomycine (0,5 mg/mL). Lorsque l’ES-D3 transfecté atteint 90% de confluence, transférez à nouveau les cellules dans des boîtes de culture tissulaire de 15 cm. Répétez la procédure pendant 2 semaines.
- Générez des clones de cellules ES-D3 transfectées de manière stable.
- Une fois que des populations en vrac de cellules ES-D3 transfectées de manière stable sont générées, collectez les cellules comme auparavant. Déterminez le nombre de cellules à l’aide d’un hémocytomètre. Centrifuger les cellules à 390 x g pendant 5 min. Ressuspendez les cellules (1 x 107 cellules/mL) dans un milieu de culture frais.
- Filtrer les cellules à travers une passoire cellulaire stérile de 40 μm. Purifier les cellules ES-D3 GFP positives à l’aide de FACS, en suivant le protocole du fabricant.
- Plaquer une seule cellule ES-D3 triée dans un puits d’une plaque de culture tissulaire de 96 puits recouverte de gélatine (0,1%) contenant des cellules ES-D3 parentales (1 x 103)dans un milieu exempt de néomycine (200 μL). La co-culture de cellules ES-D3 transfectées avec leurs homologues parentaux non transfectés garantit que les cellules ES-D3 uniques transfectées de manière stable survivent et prolifèrent en tant que clone unique.
- Culturez les cellules pendant 48 h, puis ajoutez de la néomycine (0,5 mg/mL) sur des plaques de 96 puits pour éliminer les cellules ES-D3 parentales non transfectées.
- Continuer à cultiver les cellules ES-D3 GFP positives dans des plaques de culture tissulaire à 96 puits avec un milieu contenant de la néomycine (0,5 mg / mL) pendant 1 semaine. Transférer des lignées cellulaires clonales ES-D3 dans des boîtes de culture tissulaire de 6 cm recouvertes de gélatine (0,1 %) avec un milieu de culture (5 mL) contenant de la néomycine (0,5 mg/mL) pendant 1 semaine.
- Déterminer l’intensité de la fluorescence GFP dans chacun des clones de cellules ES-D3 transfectés à l’aide de FACS, en suivant le protocole du fabricant. Sélectionnez les clones ES-D3 exprimant soit GM-CSF, soit le vecteur vide avec des niveaux élevés de fluorescence verte.
- Déterminer les quantités de GM-CSF sécrétées par les cellules ES-D3 à l’aide d’un kit ELISA GM-CSF murin, en suivant le protocole du fabricant.
4. Isolement des vésicules extracellulaires enrichies en exosomes
- Culture des cellules ES-D3 (1 x 107) dans des boîtes de culture tissulaire de 15 cm pendant 72 h à 37 °C. Recueillir le surnageant de culture cellulaire. Conserver le surnageant collecté à 4 °C jusqu’à 1 semaine pour maintenir l’intégrité exosomale.
- Centrifuger le surnageant de culture cellulaire à 5 000 x g pendant 60 min à 4 °C à l’aide d’une centrifugeuse pour sédimenter de gros fragments cellulaires.
- Recueillir le surnageant et centrifuger à 100 000 x g pendant 90 min à 4 °C à l’aide d’une ultracentrifugeuse.
- Retirez le surnageant. Rincez doucement chaque pastille deux fois avec une solution saline tamponnée au phosphate (PBS; 1 mL) pour éliminer le surnageant résiduel de culture.
- Resuspendez chaque granulé dans PBS. Quantifier les VE enrichis en exosomes par leur teneur en protéines5.
- Mesurer la concentration en protéines des VE enrichis en exosomes à l’avec un test à l’acide bicinchoninique (ACA). Le rendement attendu des VE enrichis en exosomes des cellules ES-D3 est d’environ 4 μg de protéine/mL de surnageant de culture cellulaire. Resuspendez les VE enrichis en exosomes dans le PBS (concentration en protéines : ~6 μg/μL). Stockez les véhicules électriques enrichis en exosomes à -80 °C.
5. Caractérisation des vésicules extracellulaires enrichies en exosomes par microscopie électronique à transmission
REMARQUE: Étudier la composition et la structure des VE enrichis en exosomes isolés des CES à l’aide de la microscopie électronique à transmission (TEM)5.
- Fixer les VE enrichis en exosomes (3-5 μg/μL) avec une concentration finale de 2% de paraformaldéhyde de qualité EM à température ambiante pendant 2 h.
- Charger des échantillons fixes (10 μL) sur des grilles de cuivre avec un film de support en carbone. Incuber les échantillons avec des grilles de cuivre pendant 1 min, puis égoutter les grilles avec du papier filtre.
- Téfez les grilles avec une solution de coloration suivant le protocole du fabricant.
- Transférez les grilles sur un morceau de papier filtre à l’aide d’une pince à épilez. Laissez les grilles sécher pendant la nuit à température ambiante.
- Acquérir des images de microscopie électronique à l’aide d’un microscope électronique à transmission (grossissement de 50 000x), en suivant le protocole du fabricant.
6. Évaluation des vésicules extracellulaires enrichies en exosomes par analyse par transfert de Western
- Préparez des extraits de cellules entières.
- Retirer le milieu des cellules ES-D3 cultivées dans des plats de 15 cm. Laver les cellules avec de la trypsine (5 mL; 0,05%). Ajouter la trypsine (5 mL) aux cellules. Incuber à 37 °C pendant 5 min. Prélever les cellules et ajouter un milieu de culture frais (5 mL) pour neutraliser la trypsine. Centrifuger les cellules à 390 x g pendant 5 min. Resuspendez les cellules dans PBS.
- Déterminez le nombre de cellules à l’aide d’un hémocytomètre. Centrifuger à nouveau les cellules à 390 x g pendant 5 min. Resuspendez les cellules dans un tampon de chargement SDS-PAGE contenant 0,5 % de FDS (5 000 cellules/μL).
- Soniquer les échantillons pendant 10 s à l’aide d’un sonicateur d’amplitude de 10% (puissance: 500 W; fréquence ultrasonique: 20 kHz). Chauffer les échantillons à 100 °C pendant 5 min.
- Préparez les lysates des véhicules électriques enrichis en exosomes.
- Resuspendez les VE enrichis en exosomes dans un tampon de chargement SDS-PAGE contenant 0,5 % de FDS à une concentration de 1,2 μg/μL.
- Soniquer les échantillons pendant 10 s à l’aide d’un sonicateur d’amplitude de 10% (puissance: 500 W; fréquence ultrasonique: 20 kHz). Chauffer les échantillons à 100 °C pendant 5 min.
- Détecter les protéines par transfert Western.
- Chargez des extraits de cellules entières (10 μL; 5 000 cellules/μL) et des lysates EV enrichis en exosomes (10 μL; 1,2 μg/μL) dans chaque puits d’un gel Bis-Tris PAGE (4-20%). Transférer des protéines sur des membranes de fluorure de polyvinylidène (PVDF).
- Incuber les membranes avec des anticorps primaires et secondaires appropriés. Anticorps dilués (aux concentrations indiquées ci-dessous) dans un tampon de buvard contenant du PBS, du Tween-20 (0,2 %) et du lait sec non grasse (10 % p/v).
- Utilisez les anticorps primaires suivants : anti-annexine V (200 ng/mL), anti-CD81 (50 ng/mL), anti-flottilline-1 (200 ng/mL), anti-cytochrome c (100 ng/mL), anti-disulfure isomérase (200 ng/mL), anti-GAPDH (33 ng/mL) et anti-Oxphos COX IV-sous-unité IV (600 ng/mL).
- Utilisez les anticorps secondaires suivants : IgG anti-lapin de chèvre conjuguée à la peroxydase (20 ng/mL) et IgG anti-souris de chèvre conjuguée à la peroxydase (20 ng/mL).
- Détectez les protéines à l’aide d’un kit de détection de chimiluminescence amélioré.
7. Détermination des concentrations de GM-LCR dans les vésicules extracellulaires enrichies en exosomes par ELISA
REMARQUE: Évaluer les quantités de GM-CSF dans les VE enrichis en exosomes par ELISA à l’aide d’un kit pour le GM-CSF murin, en suivant le protocole du fabricant avec quelques modifications.
- Enduire la plaque ELISA d’anticorps de capture. Traiter les VE enrichis en exosomes (0,6 μg) dans le PBS seul ou le PBS + 0,05 % Tween-20 (100 μL) à température ambiante pendant 30 min. Ajouter les échantillons traités sur la plaque ELISA revêtue et incuber à température ambiante pendant 1 h. Lavez la plaque avec PBS seul ou PBS + 0,05% Tween-20.
- Ajouter un anticorps de détection aux échantillons. Incuber à température ambiante pendant 1 h. Lavez la plaque avec PBS seul ou PBS + 0,05% Tween-20. Ajoutez Avidin-HRP aux échantillons. Incuber à température ambiante pendant 30 min. Lavez la plaque avec PBS seul ou PBS + 0,05% Tween-20.
- Déterminer les concentrations de GM-CSF dans les VE enrichis en exosomes en mesurant l’absorbance à 450 nm sur un lecteur de microplaques.
Résultats
Gm-CSF est surexprimé dans les ESC murins.
Pour surexprimer de manière stable le GM-CSF dans les cellules ES-D3, l’ADNc GM-CSF murin a été cloné dans un vecteur de transfection pour générer le vecteur d’expression pEF1α-mGM-CSF-IRES-hrGFP (Figure 1A). Le GM-CSF a été surexprimé dans les cellules ES-D3 par transfection, et environ 20% des cellules ES-D3 transfectées transitoirement étaient GFP-positives. Des clones cellulaires surexprimant de manière stable GM-CSF ou la lutte antivectorielle vide ont été acquis par FACS. Comme le montre la figure 1B,l’intensité de fluorescence GFP d’une lignée cellulaire ES-D3 exprimant GM-CSF ou d’une lignée cellulaire ES-D3 exprimant le vecteur vide était beaucoup plus élevée que celle de leurs homologues parentaux. Un test ELISA a été effectué pour évaluer les concentrations de GM-CSF dans le surnageant de culture cellulaire de différentes lignées cellulaires (Figure 2). Les cellules ES-D3 exprimant le GM-CSF ont produit des niveaux nettement plus élevés de GM-CSF dans le surnageant de culture cellulaire que leur contrôle vectoriel vide. En outre, la quantité de GM-CSF générée par les cellules ES-D3 exprimant GM-CSF était similaire à celle des fibroblastes STO exprimant GM-CSF, comme indiqué précédemment19.
Les exosomes sont enrichis en vésicules extracellulaires dérivées de CSE murins.
La lutte antivectorielle et les cultures cellulaires ES-D3 exprimant le GM-CSF ont été étendues et un surnageant de culture cellulaire a été recueilli. Les véhicules électriques ont été isolés après plusieurs étapes de centrifugation. Les véhicules électriques individuels ont d’abord été évalués par TEM (Figure 3). Comme le montrent les images TEM, les VE isolés contenaient des vésicules de différentes tailles, ce qui est couramment observé dans les préparations exosomales5. Il est important de se faire une évidence, les diamètres des vésicules individuelles étaient de 30 à 100 nm, ce qui correspond aux rapports antérieurs décrivant les exosomes21. De plus, la présence d’exosomes dans les VE a été examinée par Transfert western(Figure 4). L’expression des marqueurs exosomaux, y compris CD81, annexine V et flotilline-1, a été nettement améliorée dans les VE isolés à partir de cellules ES-D3 par rapport aux extraits de cellules entières (WCE) correspondants. Il est important de noter que la présence d’autres marqueurs de compartiment subcellulaire dans les VE dérivés de l’ES-D3 n’a pas été détectée, y compris (1) l’isomérase (PDI) de la protéine disulfure de réticulum endoplasmique (ER), (2) les marqueurs mitochondriaux cytochrome c et COX IV-sous-unité IV, et (3) le marqueur cytosolique GAPDH. Dans l’ensemble, ces données démontrent que les exosomes étaient fortement enrichis en VÉHICULES dérivés de cellules ES-D3.
Le GM-CSF est localisé à l’intérieur de vésicules extracellulaires enrichies en exosomes isolées des CES.
Pour déterminer si les VE enrichis en exosomes contiennent des molécules GM-CSF, un test ELISA a été mené pour évaluer les niveaux de GM-CSF dans les VE enrichis en exosomes acquis à partir de cellules ES-D3 avec ou sans expression GM-CSF (Figure 5). Pour étudier plus avant la localisation des protéines GM-CSF dans les VE enrichis en exosomes, les niveaux de GM-CSF ont été quantifiés dans des VE enrichis en exosomes dans différentes conditions de lavage par ELISA. À cette fin, le détergent Tween-20 (0,05%) a d’abord été utilisé pour perméabiliser les membranes exosomales, et des tests ELISA ont été effectués dans les tampons avec ou sans 0,05% Tween-20. Étant donné que Tween-20 est connu pour réduire les interactions protéine-protéine, les niveaux de fond GM-CSF détectés dans les VE témoins ont été considérablement réduits par Tween-20 dans le tampon de lavage. En revanche, les niveaux de GM-CSF dans les VE des cellules exprimant GM-CSF ont été significativement augmentés par Tween-20. Ces résultats démontrent que la perméabilisation de la membrane exosomale induite par la Tween-20 rend les molécules gm-CSF à l’intérieur des vésicules accessibles pour la reconnaissance des anticorps, fournissant des preuves que la majorité des molécules exosomales de GM-CSF sont localisées à l’intérieur de la lumière des vésicules isolées.
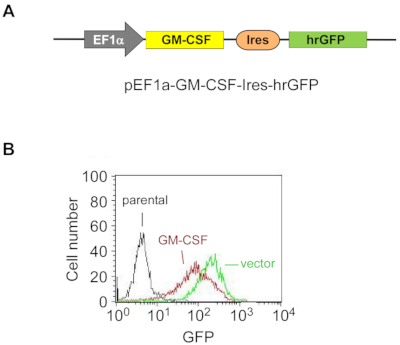
Figure 1 : Le GM-CSF exogène est surexprimé de manière stable dans les cellules ES-D3.
(A) Diagramme schématique du plasmide pour la surexpression du GM-CSF murin dans les cellules ES-D3, dans lequel un promoteur EF1α conduit l’expression du GM-CSF et hrGFP sert de marqueur d’expression.
(B) L’intensité de fluorescence de la GFP dans les cellules ES-D3 exprimant gm-CSF ou leurs homologues vecteurs vides a été déterminée par FACS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
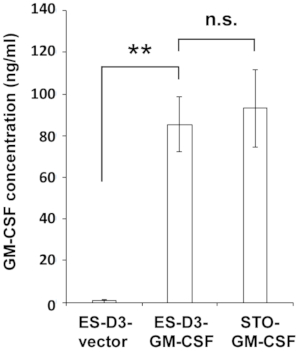
Figure 2 : Les cellules ES-D3 surexprimant le GM-CSF produisent des niveaux élevés de GM-CSF.
Les concentrations de GM-CSF dans le milieu des cellules indiquées ont été mesurées par ELISA. Les données sont présentées sous forme d’écarts-types moyens ± (moyenne ± ET) de trois mesures ELISA indépendantes : **p < 0,001, NS = non significatif, ANOVA avec le test de comparaison multiple de Tukey. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Les vésicules extracellulaires dérivées de l’ES-D3 sont examinées par microscopie électronique à transmission.
Les vésicules extracellulaires ont été préparées à partir de cellules ES-D3 transfectées avec le plasmide exprimant le GM-CSF ou son homologue vecteur vide. Les flèches indiquent les vésicules individuelles. Barre d’échelle = 100 nm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
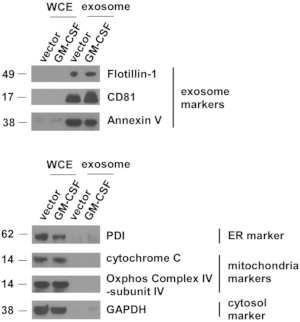
Figure 4 : Les marqueurs exosomaux sont très concentrés dans les vésicules extracellulaires isolées des cellules ES-D3.
Les quantités de marqueurs pour les exosomes, le réticulum endoplasmique (RE), les mitochondries et le cytosol dans les extraits de cellules entières (WCE) et les VE indiqués ont été évaluées par western blotting. PDI = protéine disulfure isomérase. Les marqueurs de poids moléculaires (kD) sont à gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Évaluation des niveaux de GM-LCR dans les vésicules extracellulaires enrichies en exosomes.
Les niveaux de GM-CSF dans les VE enrichis en exosomes indiqués ont été déterminés dans différentes conditions ELISA. Les véhicules électriques enrichis en exosomes ont été prétraités avec ou sans 0,05 % de Tween-20. ELISA a été réalisé à l’aide d’un tampon de lavage contenant soit du PBS uniquement, soit du PBS + 0,05% Tween-20. Les données sont présentées comme la moyenne ± et de développement de trois tests ELISA indépendants. *p < 0,05, **p < 0,005, ANOVA avec le test de comparaison multiple de Tukey. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette étude montre une méthode très efficace de production de VE enrichis en exosomes portant la protéine immunostimulatrice GM-CSF, qui peut être utilisée pour étudier les effets immunomodulateurs des VE enrichis en exosomes. Plusieurs études suggèrent que les exosomes présentent des fonctions immunorégulatrices etantitumorales 22. Ainsi, les exosomes des CSE exprimant le GM-CSF pourraient également posséder des activités biologiques qui régulent la réponse immunitaire. Dans ce protocole, le GM-CSF murin exogène a été surexprimé de manière stable dans les cellules murines ES-D3 par transfection (Figure 1). Il est important de se faire une évidence que des quantités importantes de GM-CSF ont été détectées dans des VE enrichis en exosomes isolés à partir de cellules ES-D3 surexprimant gm-CSF(Figure 5).
Ces données suggèrent que presque tous les GM-CSF résident dans des VÉHICULES enrichis en exosomes. En tant que cytokine, la majorité de la protéine GM-CSF est sécrétée extracellulairement11. Comme d’autres matériaux de cargaison exosomaux (par exemple, les ARNm, les miARN et les protéines), les molécules GM-CSF dans le cytosol sont encapsulées dans les vésicules intraluminales (ILV) des corps multivésiculaires (MLB)6,23. Lors de la fusion des MBC avec la membrane plasmique, les ILV porteurs de GM-CSF sont libérés dans l’espace extracellulaire.
Une étape importante de ce protocole consiste à surexprimer efficacement le GM-CSF dans les cellules ES-D3 murines(Figure 2). Les efforts antérieurs pour atteindre cet objectif par infection rétrovirale ont largement échoué, probablement en raison de la suppression de l’expression des gènes rétroviraux aux niveaux transcriptionnels dans lesCSE 24. Parmi plusieurs promoteurs viraux et cellulaires examinés, le promoteur EF1α humain a montré l’activité la plus robuste dans les cellules ES-D3. Il est important de se faire une évidence que l’expression du transgène sous le contrôle du promoteur EF1α est restée stable après la culture cellulaire à long terme de cellules ES-D3 transfectées. Pour exprimer le GM-CSF exogène dans un autre type de cellule, d’autres études sont nécessaires pour évaluer l’efficacité de divers promoteurs. L’application de cette méthode pour isoler les VE enrichis en exosomes porteurs de GM-CSF peut être étendue à d’autres types de cellules souches ainsi qu’aux cellules tumorales conçues pour exprimer diverses cytokines. Comme le GM-CSF, la plupart des cytokines sont sécrétées extracellulairement25. Par conséquent, une limitation possible de cette approche est que la quantité d’une cytokine donnée accumulée dans les VE enrichis en exosomes est trop faible pour présenter son activité biologique. Pour une cytokine particulière, de nouvelles études doivent être menées pour optimiser son niveau de protéines et son activité biologique dans les VE enrichis en exosomes.
L’obstacle le plus critique dans cette étude est la génération de clones ES-D3 surexprimant GM-CSF. Pour maintenir l’état pluripotentiel et favoriser la prolifération cellulaire in vitro, les CSE murins sont généralement cultivés en présence de cellules nourricières26. Pour acquérir des exosomes exclusivement à partir de CSE, un protocole sans cellules nourricaires pour la culturede CSE 27 a été utilisé. Dans cette étude, les cellules ES-D3 ont été cultivées dans des plats enrobés de gélatine en utilisant un milieu complété par du LIF. L’efficacité des plaques et la prolifération des clones uniques de cellules ES-D3 dans ces conditions de culture étaient extrêmement faibles, ce qui rendait très difficile la génération de clones ES-D3 à partir de cellules uniques. L’ajout du milieu conditionnel obtenu à partir de cellules ES-D3 parentales n’a pas réussi à sauver le déficit de prolifération des cellules ES-D3 uniques plaquées. Pour surmonter cette limitation, des cellules ES-D3 uniques surexprimant gm-CSF ont été plaquées avec des cellules ES-D3 parentales. Cette approche de placage a amélioré la viabilité des clones uniques ES-D3 exprimant GM-CSF, facilitant la prolifération et l’expansion clonales. Une fois transfectés, des clones uniques d’ES-D3 apparemment attachés à des plaques de culture tissulaire. Ils ont proliféré indépendamment de la présence d’autres cellules ES-D3, car les cellules ES-D3 parentales ont été éliminées 48 h après avoir été plaquées, ne permettant qu’à des cellules ES-D3 uniques transfectées de se développer.
Dans l’ensemble, un protocole visant à générer avec succès des VE enrichis en exosomes porteurs de GM-CSF à partir de CES ayant le potentiel de stimuler la réponse immunitaire dans différentes maladies a été développé. De plus, notre étude récemment publiée démontre que les VE enrichis en exosomes porteurs de GM-CSF provenant de CES peuvent servir de vaccin prophylactique sans cellules contre le cancer28.
Déclarations de divulgation
Kavitha Yaddanapudi, Chi Li et John W. Eaton ont déposé une demande de brevet aux États-Unis « Compositions comprenant des exosomes dérivés de cellules souches embryonnaires modifiées et leurs méthodes d’utilisation ».
Remerciements
Nous sommes reconnaissants à M. Arkadiusz Slusarczyk et au Kentucky Biomedical Research Infrastructure Network (KBRIN, P20GM103436) d’avoir acquis des images au microscope électronique à transmission. Ce travail a été soutenu en partie par des subventions des NIH AA018016-01 (J.W.E.), du Commonwealth of Kentucky Research Challenge Trust Fund (J.W.E.), des NIH CA106599 et CA175003 (C.L.), nih CA198249 (K.Y.) et Free to Breathe Research Grant (K.Y.).
matériels
| Name | Company | Catalog Number | Comments |
| Alkaline phosphate, Calf Intestinal | New England Biolabs | M0290S | Dephosphorylating DNA plasmid |
| anti-Annexin V mAb | Santa Cruz Biotechnology | clone H-3, sc-74438 | Western blot, RRID:AB_1118989 |
| anti-CD81 mAb | Santa Cruz Biotechnology | clone B-11, sc-166029 | Western blot, RRID:AB_2275892 |
| anti-cytochrome c mAb | Santa Cruz Biotechnology | clone A-8, sc-13156 | Western blot, RRID:AB_627385 |
| anti-Flotillin-1 mAb | Santa Cruz Biotechnology | clone C-2; sc-74566 | Western blot, RRID:AB_2106563 |
| anti-GAPDH pAb | Rockland | 600-401-A33S | Western blot, RRID:AB_11182910 |
| anti-mouse IgG, goat, peroxidase-conjugated | Thermo Fisher | 31430 | Western blot, RRID:AB_228307 |
| anti-Oxphos COX IV-subunit IV mAb | Thermo Fisher | clone 20E8C12 A21348 | Western blot, RRID:AB_221509 |
| anti-protein disulfide isomerase (PDI) pAb | Enzo | ADI-SPA-890 | Western blot, RRID:AB_10616242 |
| anti-rabbit IgG, goat, peroxidase-conjugated | Thermo Fisher | 31460 | Western blot, RRID:AB_228341 |
| BCA (bicinchoninic acid) assay | Thermo Fisher | 23223 | Determining protein concentrations |
| Bis-Tris PAGE Gel, ExpressPlus, 4-20% | Genscript | M42015 | Western blot |
| Carbenicillin, Disodium Salt | Thermo Fisher | 10177012 | Selecting E. coli colonies |
| Centrifuge, Avanti J-26 XPI | Beckman Coulter | Low speed centrifugation | |
| Centrifuge rotor, JA-10 | Beckman Coulter | 09U1597 | Low speed centrifugation |
| Centrifuge bottle, Nalgene PPCO | Thermo Fisher | 3120-0500PK | Low speed centrifugation |
| Cu grids with carbon support film | Electron Microscopy Sciences | FF200-Cu | Acquiring electron microscopy images |
| EcoRI | New England Biolabs | R0101 | Digesting DNA plasmid |
| Enhanced chemiluminescence detection system | Thermo Fisher | 32106 | Western blot |
| FACScalibur flow cytometer | Becton Dickinson | Examining GFP levels of ES-D3 cells | |
| Fetal bovine serum | ATCC | SCRR-30-2020 | Medium for ES-D3 cells |
| Fisherbrand Sterile Cell Strainers; Mesh Size: 40μm | Thermo Fisher | 22-363-547 | Filtering ES-D3 cells for FACS sorting |
| Gelatin (0.1%) | Thermo Fisher | ES006B | Culturing ES-D3 cells |
| GM-CSF ELISA kit | Thermo Fisher | 88733422 | Determining GM-CSF concentrations |
| KnockOut Dulbecco’s Modified Eagle’s Medium | Thermo Fisher | 10-829-018 | Medium for ES-D3 cells |
| Leukemia Inhibitory Factor | Thermo Fisher | ESG1106 | Medium for ES-D3 cells |
| L-glutamine | VWR | VWRL0131-0100 | Medium for ES-D3 cells |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668019 | Transfecting ES-D3 cells |
| Microplate reader, PowerWave XS | BioTek | Determining GM-CSF concentrations | |
| MoFlo XDP high-speed cell sorter | Beckman Coulter | Isolating single ES-D3 cell clones | |
| NEB 5-alpha Competent E. coli | New England Biolabs | C2988J | Generating GM-CSF expression plasmid |
| Neomycin | Thermo Fisher | 10-131-035 | Selecting ES-D3 clones |
| Non-essential amino acids | Thermo Fisher | SH3023801 | Medium for ES-D3 cells |
| Non-fat dry milk | Thermo Fisher | NC9022655 | Western blot |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher | 31985062 | Transfecting ES-D3 cells |
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | Acquiring electron microscopy images |
| Penicillin/streptomycin | VWR | sc45000-652 | Medium for ES-D3 cells |
| Plasmid pEF1a-FD3ER-IRES-hrGFP | Addgene | 37270 | Generating GM-CSF expression plasmid |
| PVDF membranes | Millipore EMD | IPVH00010 | Western blot |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | Generating GM-CSF expression plasmid |
| QIAquick Gel Extraction Kit (50) | QIAGEN | 28704 | Generating GM-CSF expression plasmid |
| Quick Ligation Kit | New England Biolabs | M2200S | Generating GM-CSF expression plasmid |
| Transmission electron microscope | Hitachi | HT7700 | Acquiring electron microscopy images |
| Trypsin | VWR | 45000-660 | Culturing ES-D3 cells |
| Ultracentrifuge, OptimaTM L-100 XP | Beckman Coulter | High speed centrifugation | |
| Ultracentrifuge rotor, 45Ti | Beckman Coulter | 09U4454 | High speed centrifugation |
| Ultracentrifuge polycarbonate bottle | Beckman Coulter | 355622 | High speed centrifugation |
| UranyLess staining solution | Electron Microscopy Sciences | 22409 | Acquiring electron microscopy images |
Références
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Sakthiswary, R., Raymond, A. A. Stem cell therapy in neurodegenerative diseases: From principles to practice. Neural Regeneration Research. 7 (23), 1822-1831 (2012).
- Liu, Y. W., et al. Human embryonic stem cell-derived cardiomyocytes restore function in infarcted hearts of non-human primates. Nature Biotechnology. 36 (7), 597-605 (2018).
- Aguayo-Mazzucato, C., Bonner-Weir, S. Stem cell therapy for type 1 diabetes mellitus. Nature Reviews: Endocrinology. 6 (3), 139-148 (2010).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracell Vesicles. 7 (1), 1535750 (2018).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Meldolesi, J. Exosomes and Ectosomes in Intercellular Communication. Current Biology. 28 (8), R435-R444 (2018).
- Stremersch, S., De Smedt, S. C., Raemdonck, K. Therapeutic and diagnostic applications of extracellular vesicles. Journal of Control Release. 244 (Pt B), 167-183 (2016).
- Lindenbergh, M. F. S., Stoorvogel, W. Antigen Presentation by Extracellular Vesicles from Professional Antigen-Presenting Cells. Annual Review of Immunology. 36, 435-459 (2018).
- Kunigelis, K. E., Graner, M. W. The Dichotomy of Tumor Exosomes (TEX) in Cancer Immunity: Is It All in the ConTEXt?. Vaccines (Basel). 3 (4), 1019-1051 (2015).
- Becher, B., Tugues, S., Greter, M. GM-CSF: From Growth Factor to Central Mediator of Tissue Inflammation. Immunity. 45 (5), 963-973 (2016).
- Conti, L., Gessani, S. GM-CSF in the generation of dendritic cells from human blood monocyte precursors: recent advances. Immunobiology. 213 (9-10), 859-870 (2008).
- Higano, C. S., et al. Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer. 115 (16), 3670-3679 (2009).
- Yan, W. L., Shen, K. Y., Tien, C. Y., Chen, Y. A., Liu, S. J. Recent progress in GM-CSF-based cancer immunotherapy. Immunotherapy. 9 (4), 347-360 (2017).
- Dranoff, G., et al. Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulates potent, specific, and long-lasting anti-tumor immunity. Proceedings of the National Academy of Sciences of the United States of America. 90 (8), 3539-3543 (1993).
- Tremml, G., Singer, M., Malavarca, R. Chapter 1, Unit 1C 4, Culture of mouse embryonic stem cells. Current Protocols in Stem Cell Biology. , (2008).
- Kirsch, P., Hafner, M., Zentgraf, H., Schilling, L. Time course of fluorescence intensity and protein expression in HeLa cells stably transfected with hrGFP. Molecules and Cells. 15 (3), 341-348 (2003).
- Zeng, X., et al. Stable expression of hrGFP by mouse embryonic stem cells: promoter activity in the undifferentiated state and during dopaminergic neural differentiation. Stem Cells. 21 (6), 647-653 (2003).
- Yaddanapudi, K., et al. Vaccination with embryonic stem cells protects against lung cancer: is a broad-spectrum prophylactic vaccine against cancer possible?. PLoS One. 7 (7), e42289 (2012).
- Dalby, B., et al. Advanced transfection with Lipofectamine 2000 reagent: primary neurons, siRNA, and high-throughput applications. Methods. 33 (2), 95-103 (2004).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Chapter 3, Unit 3 22, Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , (2006).
- Zhang, X., et al. Exosomes for Immunoregulation and Therapeutic Intervention in Cancer. Journal of Cancer. 7 (9), 1081-1087 (2016).
- Bunggulawa, E. J., et al. Recent advancements in the use of exosomes as drug delivery systems. Journal of Nanobiotechnology. 16 (1), 81 (2018).
- Schlesinger, S., Lee, A. H., Wang, G. Z., Green, L., Goff, S. P. Proviral silencing in embryonic cells is regulated by Yin Yang 1. Cell Reports. 4 (1), 50-58 (2013).
- Dranoff, G. GM-CSF-based cancer vaccines. Immunological Reviews. 188, 147-154 (2002).
- Park, Y. G., et al. Effects of Feeder Cell Types on Culture of Mouse Embryonic Stem Cell In Vitro. Development and Reproduction. 19 (3), 119-126 (2015).
- Lin, S., Talbot, P. Methods for culturing mouse and human embryonic stem cells. Methods in Molecular Biology. 690, 31-56 (2011).
- Yaddanapudi, K., et al. Exosomes from GM-CSF expressing embryonic stem cells are an effective prophylactic vaccine for cancer prevention. OncoImmunology. 8 (3), 1561119 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon