Method Article
胚性幹細胞からの顆粒球マクロファージコロニー刺激因子を運ぶ外生エンリッチ細胞小胞の分離
要約
この研究では、胚性幹細胞から免疫刺激性顆粒球マクロファージマクロファージを担う外生富化細胞外小胞を単離する方法について説明する。
要約
胚性幹細胞(ESC)は、自己再生および分化が可能な多能性幹細胞であり、すべてのタイプの胚細胞に分化することができる。他の多くの細胞タイプと同様に、ESCはエキソソームなどの小さな膜小胞を細胞外環境に放出する。エキソソームは細胞間コミュニケーションの不可欠なメディエーターとして機能し、多くの(パソ)生理学的プロセスにおいて基本的な役割を果たす。顆粒球マクロファージコロニー刺激因子(GM-CSF)は、免疫応答を調節するサイトカインとして機能する。エキソソームにおけるGM-CSFの存在は、免疫調節機能を高める可能性を秘めています。ここで、GM-CSFは、マウスESC細胞株ES-D3において安定的に過剰発現していた。GM-CSFを過剰発現するES-D3細胞から高品質のエキソソームエンリッチ細胞小胞(EV)を分離するプロトコルが開発されました。分離エキソソームエンリッチEVは、様々な実験的アプローチによって特徴付けられていた。重要なことに、大量のGM-CSFがエキソソームエンリッチEVに存在することが判明した。全体として、ESCからのGM-CSFを持つエキソソームエンリッチEVは、免疫調節活動を行うために無細胞小胞として機能する可能性があります。
概要
ESCは、着床前胚1の胚盤胞期に由来する。多能性幹細胞として、ESCは自己更新し、あらゆるタイプの胚細胞に分化する能力を有する。その著しい発達力と長期的な増殖能力のために、ESCは生物医学研究のために非常に価値がある1.現在の研究努力は、糖尿病、心臓病、および神経変性疾患2、3、4を含む様々な主要な病的障害に対するESCの治療可能性に主に焦点を当てている。
ESCを含む哺乳類細胞は、細胞外環境に可変サイズの小胞を放出することが知られており、これらのEVは細胞間コミュニケーションにおけるそれらの役割のために多くの生理学的および病理学的機能を有する5。EVの異なるサブタイプの中で、エキソソームは、中間内視鏡コンパートメント、多胞体(MVB)の融合時に細胞外空間に様々な細胞タイプから放出される小さな膜小胞である、血漿膜6を有する。エキソソームは細胞間通信を媒介することが報告されており、多くの(パソ)生理学的プロセス7,8に批判的に関与している。エキソソームは、タンパク質や核酸を含むサイトゾルから得られた生物学的物質を含んでいるため、自分の親細胞からいくつかの生物学的機能を継承します。従って、特定の疾患に特異的な免疫応答を刺激する関連抗原または因子は、特定のタイプの細胞9からエキソソームに封入される。これは、抗癌ワクチン10として腫瘍由来エキソソームを探索する臨床試験への道を開いた。
GM-CSFは、異なるタイプの免疫細胞11によって分泌されるサイトカインである。新たな証拠は、GM-CSFが免疫系を活性化し、調節し、抗原提示プロセス12において不可欠な役割を果たしていることを示す。例えば、臨床報告は、GM-CSFがワクチンアジュバント13として腫瘍に対する免疫応答を刺激することを示唆している。GM-CSFの強力な免疫刺激活性を利用するいくつかのGM-CSFベースの癌免疫療法戦略は、臨床試験14で調査されている。これらの中で、照射されたGM-CSF分泌腫瘍細胞からなるがんワクチンは、転移性腫瘍15において細胞および体液性抗腫瘍応答とその後の壊死を誘導することによって進行した黒色腫患者に何らかの約束を示している。
ESCに由来するエキソソームは元のESCと同様の生物学的活性を有するため、ESCからのGM-CSFを運ぶエキソソームは、免疫応答を調節するための無細胞小胞として機能する可能性があります。本論文では、GM-CSFを発現するESCから高品質エキソソームエンリッチEVを製造する詳細な方法を説明する。これらのエキソソームエンリッチEVは、免疫応答を調節する免疫調節小胞として機能する可能性を秘めています。
プロトコル
1. ES-D3細胞の培養
- エキソソームフリーウシ血清(FBS)を生成するには、FBSを超遠心分離機に、遠心分離機を100,000 x g で4°Cで16時間ロードします。 遠心分離後、マウスESC細胞株ES-D3を培養し、エキソソームエンリッチEVを取得するためのエキソソームフリーFBSとして血清上清を収集します。
- ES-D3細胞をめっきする前に、ゼラチン(0.1%)を室温で30分間使用して15cmの組織培養皿をコーティングします。
- 先に説明したプロトコル16に従って、ゼラチンコーティング15cmの組織培養皿中のフィーダー層細胞を含まないES-D3細胞を培養する。ES-D3細胞培養培地はDMEMで構成され、 エキソソームフリーFBS(15%)、非必須アミノ酸(0.1mM)、L-グルタミン(2mM)、βメルカプトエタノール(0.1mM)、ペニシリン(50単位/mL)、ストレプトマイシン(50μg/mL)、白血病阻害因子(LIF;100単位/mL)。ES-D3細胞を5%CO2加湿インキュベーターで37°Cで培養した。
- ES-D3細胞が15cmの組織培養皿で約90%の合流度に達したら、吸引によって培地を取り除く。トリプシン(5 mL;0.05%)を使用して細胞を洗浄します。皿にトリプシン(5 mL)を加え、37°Cで5分間インキュベートします。皿から細胞を収集します。
- 回収した細胞に新鮮な培養培地(5mL)を加え、トリプシンを不活性化する。5分間390xgで細胞を遠心分離する。新鮮な培地で細胞を再懸濁し、ヘモサイトメーターを使用して細胞数を決定します。
- 通過細胞の場合、ES-D3細胞(5 x 106)をゼラチンコーティング(0.1%)に15cmの組織培養皿に新鮮な培地(15mL)でプレートし、細胞をサブキュアする前に3日間培養します。
- エキソソーム濃縮EVの単離のために細胞培養上清を収集するには、ES-D3細胞(1 x 107)をゼラチンコーティング(0.1%)15cmの組織培養皿に、細胞培養上清を採取する前に3日間、新鮮な培地(15mL)でプレートします。
GM-CSF発現プラスミドの生成
注: トランスフェクションプラスミド pEF1α-mGM-CSF-IRES-hrGFP を生成し、ES-D3 細胞で GM-CSF を過剰発現させます。このプラスミドにおいて、マウスGM-CSF cDNAの発現は、ヒト化レニラ・レニフォルミスGFP(hrGFP)をヒト化したタンパク質と共に、ヒトポリペプチド鎖伸び因子1α(EF1α)プロモーター17、18によって駆動される。
- ベクトルバックボーンを生成します。
- 37°Cの制限酵素EcoRI(100単位)を2時間使用してプラスミドpEF1α-FD3ER-IRES-hrGFP(DNA 20μg)を消化し、ベクターバックボーン(6.0 kb)とFD3ERインサート(2.5kb)の2つのDNA断片を生成します。
- 消化したプラスミドDNA(10μg)の50%を1.5mLマイクロ遠心分離チューブに移し、アルカリホスファターゼ(20単位)を37°Cで1時間処理します。アガロースゲル電気泳動(2%)を用いて、未処理のDNAと脱リン酸化DNAの両方を解決します。
- DNAゲル抽出キットを使用してベクターバックボーンDNA断片(6.0 kb)を精製します。未処理のベクターバックボーンは空のベクター(pEF1α-IRES-hrGFP)として機能しますが、脱リン酸化ベクターバックボーンはGM-CSF発現プラスミド(pEF1α-mGM-CSF-IRES-hrGFP)の生成に使用されます。
- GM-CSF cDNA 挿入を生成します。
- プラスミドpMSCV-mGM-CSF-IRES-IRES-EGFP 19(20μg)を37°Cの制限酵素EcoRI(100単位)で2時間消化し、ベクターバックボーン(6.5 kb)とマウスGM-CSF cDNAインサート(474 bp)の2つのDNA断片を生成します。
- アガロースゲル電気泳動(2%)を介して消化されたDNAを解決します。DNAゲル抽出キットを使用して、マウスGM-CSF cDNA断片(474 bp)を精製します。
- 発現プラスミドを生成します。
- DNAライゲーションキットを使用して2ライゲーション反応(総体積10μL)を設定します。
- 空のベクトルpEF1α-IRES-hrGFPを生成するには、ステップ2.1.3(6.0 kb;500 ng)から未処理のベクターバックボーンをリゲートします。
- pEF1α-mGM-CSF-IRES-hrGFPを生成するには、ステップ2.1.3(6.0 kb;500 ng)から脱リン酸化ベクターバックボーンを(2)ステップ2.2.2(474 bp;200ng)で生成したmGM-CSF cDNA断片をリゲートします。
- 25°Cで5分間リゲートします。合体DNAをDH5αの有能な 大腸菌 細胞に変換する。変換された 大腸菌 細胞をカルベニシリン(50 μg/mL)を含むLB寒天プレートにプレートします。
- DNA分離キットを使用して、単一 の大腸菌 コロニーからプラスミドを精製します。DNAシーケンシングによりプラスミドの身元を検証します。
- DNAライゲーションキットを使用して2ライゲーション反応(総体積10μL)を設定します。
3. GM-CSFを過剰発現するES-D3細胞の生成
注: プラスミド pEF1α-mGM-CSF-IRES-hrGFP を使用して、ES-D3 細胞を GM-CS を過剰発現させます。プラスミドpBabe-NeoをES-D3細胞にコトランスフェクトし、安定したトランスフェクト細胞18,20の選択を容易にする。
- プラスミドをES-D3細胞にトランスフェクトする。
- ES-D3細胞(1.4 x 106)をゼラチンコーティング(0.1%)に、トランスフェクション用培養培地(10mL)で10cmの組織培養皿に入れます。ES-D3細胞を37°Cで24時間培養した。
- 1.5 mLマイクロ遠心分離チューブで2つのプラスミド混合物を調製する:(1)pEF1α-IRES-hrGFP(28 μg、ベクターコントロール)、pBabe-Neo(4 μg)および(2)pEF1α-mGM-CSF-IRES-hrGFP(28 μg、発現GM-CSF)を用いたpBa-4.4。メーカーのプロトコルに従ってトランスフェクションキットを使用してトランスフェクションを行います。
- プラスミド混合物を含む各チューブにトランスフェクション媒体(1 mL)とトランスフェクション試薬(64 μL)を加え、室温で5分間インキュベートします。
- ES-D3細胞の各10cmの皿にトランスフェクション混合物を加えます。37°Cで5時間インキュベートする。
- 10cmの皿の中の培地を新鮮な培養培地(10mL)に交換してください。37°Cで24時間インキュベートする。
- 安定してトランスフェクトされたES-D3細胞のバルク集団を生成する。
- トランスフェクトされたES-D3細胞から培地を取り除きます。トリプシン(2 mL;0.05%)で細胞を洗います。トリプシン(2 mL)を加え、37°Cで5分間インキュベートします。細胞を15 mL遠心分離チューブに移し、2 mLの新鮮な培養培地を加えてトリプシンを中和します。遠心分離機 390 x g で 5 分間
- 新鮮な培養培地(10mL)でトランスフェクトされた細胞を再懸濁する。トランスフェクトES-D3細胞におけるGFPの蛍光強度を、メーカーのプロトコルに従って蛍光活性化細胞選別(FACS)を用いて評価する。
- トランスフェクトした細胞を、新鮮な培養培地(10 mL)を含む2つの10cm皿に移します。ネオマイシン(0.5 mg/mL)を加えて、未感染細胞を排除します。
- ネオマイシン(0.5 mg/mL)を含む培地中のトランスフェクト細胞の培養を継続する。トランスフェクトされたES-D3が90%の合流度に達すると、細胞を再び15cmの組織培養皿に移す。手順を2週間繰り返します。
- 安定してトランスフェクトされたES-D3細胞のクローンを生成します。
- 安定してトランスフェクトされたES-D3細胞のバルク集団が生成されたら、細胞を以前のように収集します。ヘモサイトメーターを使用して細胞数を決定します。5分間390xgで細胞を遠心分離する。新鮮な培地で細胞(1 x 107細胞/mL)を再懸濁する。
- 滅菌40 μm細胞ストレーナーを通して細胞をフィルターします。メーカーのプロトコルに従って、FACSを使用してGFP陽性ES-D3セルを精製します。
- 単一の選別されたES-D3細胞を、ネオマイシンフリー培地(200μL)に親のES-D3細胞(1 x 103)を含むゼラチンコーティング(0.1%)96ウェル組織培養プレートの1つのウェルにプレートします。トランスフェクトされたES-D3細胞を、トランスフェクトされていない親の細胞と共培養することで、安定的にトランスフェクトされた単一のES-D3細胞が生き残り、単一のクローンとして増殖することが保証されます。
- 細胞を48時間培養し、ネオマイシン(0.5 mg/mL)を96ウェルプレートに添加して、感染していない親のES-D3細胞を排除します。
- ネオマイシン(0.5 mg/mL)を含む培地を含む96ウェル組織培養プレートでGFP陽性ES-D3細胞を1週間培養し続ける。クローンES-D3細胞株をゼラチンコーティング(0.1%)6 cmの組織培養皿に、ネオマイシン(0.5mg/mL)を含む培養培地(5 mL)で1週間移管します。
- メーカーのプロトコルに従って、FACSを使用して、トランスフェクションされたES-D3細胞クローンのGFP蛍光強度を決定します。GM-CSFまたは高レベルの緑色蛍光を有する空のベクターを発現するES-D3クローンを選択します。
- メーカーのプロトコルに従って、マウスGM-CSF ELISAキットを使用してES-D3細胞によって分泌されるGM-CSFの量を決定します。
4. エキソソームエンリッチ細胞小胞の分離
- ES-D3細胞(1 x 107)を37°Cで72時間培養して15cmの組織培養皿に培養する。 細胞培養上清を収集する。4°Cで上清を収集し、1週間まで保存し、エキソソームの完全性を維持します。
- 遠心分離機を4°Cで60分間5,000xgで遠心分離し、大細胞断片を沈降させる遠心分離機を用いた。
- 超遠心布を使用して、4°Cで90分間100,000 x g で上清と遠心分離機を収集します。
- 上清を取り除く。各ペレットをリン酸緩衝生理食塩分(PBS;1 mL)で2回やさしくすすいで、残留培養上清を除去する。
- PBS内の各ペレットを再懸濁します。エキソソームエンリッチ化されたEVをタンパク質含有量5で定量化する。
- バイチンコニン酸(BCA)アッセイを用いて、エキソソーム濃縮EVのタンパク質濃度を測定します。ES-D3細胞からのエキソソームエンリッチEVの期待収量は、細胞培養上清のタンパク質/mLの約4μgです。エキソソーム濃縮EVをPBS(タンパク質濃度:~6 μg/μL)で再懸濁します。エキソソームを豊富に含むEVは-80°Cで保管してください。
透過電子顕微鏡による外生富化細胞外小胞の特徴化
注:透過電子顕微鏡(TEM)5を用いて、ESCから分離されたエキソソームエンリッチEVの組成と構造を調べる。
- エキソソームを濃縮したEV(3~5 μg/μL)を、室温で2時間の間、2%EMグレードのパラホルムアルデヒドの最終濃度で固定します。
- 固定サンプル(10 μL)をカーボン支持フィルムで銅グリッドに積み込みます。サンプルを銅格子で1分間インキュベートし、フィルターペーパーでグリッドを排出します。
- メーカーのプロトコルに従って染色液でグリッドを染色します。
- ピンセットを使用して、グリッドをフィルター用紙に転送します。グリッドを室温で一晩乾燥させます。
- メーカーのプロトコルに従って、透過型電子顕微鏡(50,000倍倍率)を用いて電子顕微鏡画像を取得します。
6. ウェスタンブロット解析によるエキソソーム濃縮細胞外小胞の評価
- 全細胞抽出物を準備します。
- 15cmの皿で培養したES-D3細胞から培地を取り出します。トリプシン(5 mL;0.05%)で細胞を洗います。細胞にトリプシン(5 mL)を加えます。37°Cで5分間インキュベートします。細胞を収集し、新鮮な培養培地(5 mL)を加えてトリプシンを中和します。5分間390xgで細胞を遠心分離する。PBS のセルを再中断します。
- ヘモサイトメーターを使用して細胞数を決定します。5分間390xgで再び遠心分離します。0.5% SDS(5,000セル/μL)を含むSDS-PAGEローディングバッファ内のセルを再中断します。
- 10%の振幅(ワット数:500 W;超音波周波数:20 kHz)の超音波処理器を使用して10 sのサンプルを超音波処理します。サンプルを100°Cで5分間加熱します。
- エキソソームエンリッチEVのリセートを準備します。
- 0.5%のSDSを含むSDS-PAGE負荷バッファ内のエキソソームエンリッチEVを1.2 μg/μLの濃度で再中断します。
- 10%の振幅(ワット数:500 W;超音波周波数:20 kHz)の超音波処理器を使用して10 sのサンプルを超音波処理します。サンプルを100°Cで5分間加熱します。
- ウェスタンブロットでタンパク質を検出します。
- 細胞全体抽出物(10 μL;5,000細胞/μL)およびエキソソーム濃縮EVリセート(10 μL;1.2 μg/μL)をビストリスPAGEゲル(4-20%)の各ウェルにロードします。ポリビニリデンフッ化物(PVDF)膜にタンパク質を移す。
- 適切な一次および二次抗体を用いて膜をインキュベートする。PBS、Tween-20(0.2%)、および非脂肪乾燥乳(10%w/v)を含むブロッティング緩衝液中の希薄化抗体(以下に示す濃度で)
- 抗アネキシンV(200 ng/mL)、抗CD81(50 ng/mL)、抗フロティリン-1(200 ng/mL)、抗シトクロムc(100) ng/mL)、抗タンパク質ジスルフィドイソメラーゼ(200 ng/mL)、抗GAPDH(33 ng/mL)、抗オックスホスコックスIVサブユニットIV(600 ng/mL)。
- ペルオキシダーゼ共役ヤギ抗ウサギIgG(20 ng/mL)およびペルオキシダーゼ共役ヤギ抗マウスIgG(20 ng/mL)を使用してください。
- 強化された化学発光検出キットを使用してタンパク質を検出します。
7. エキソソームエンリッチ化細胞外小胞中のGM-CSF濃度をELISAで決定する
注: いくつかの変更を加えたメーカーのプロトコルに従って、マウス GM-CSF 用のキットを使用して ELISA によるエキソソームエンリッチ EV の GM-CSF の量を評価します。
- ELISAプレートにキャプチャ抗体を塗布します。エキソソームエンリッチEV(0.6 μg)をPBS単独で、またはPBS + 0.05%Tween-20(100 μL)で室温で30分間処理します。被覆されたELISAプレートに処理サンプルを加え、室温で1時間インキュベートします。PBS単独またはPBS + 0.05%Tween-20でプレートを洗います。
- 検出抗体をサンプルに追加します。室温で1時間インキュベートする。PBS単独またはPBS + 0.05%Tween-20でプレートを洗います。サンプルにアビジン HRP を追加します。室温で30分間インキュベートします。PBS単独またはPBS + 0.05%Tween-20でプレートを洗います。
- マイクロプレートリーダー上で450 nmの吸光度を測定することにより、エキソソームエンリッチEVにおけるGM-CSF濃度を測定します。
結果
GM-CSFはマウスESCで過剰発現している。
ES-D3細胞中でGM-CSFを安定的に過剰発現させるために、マウスGM-CSF cDNAをトランスフェクションベクターにクローニングし、発現ベクターpEF1α-mGM-CSF-IRES-hrGFPを生成した(図1A)。GM-CSFはトランスフェクションによりES-D3細胞で過剰発現し、一過性トランスフェクションES-D3細胞の約20%がGFP陽性であった。GM-CSFまたは空ベクトル制御を安定的に過剰発現する細胞クローンをFACSによって獲得した。図1Bに示すように、空のベクターを発現するGM-CSF発現ES-D3細胞株またはES-D3細胞株のGFP蛍光強度は、親の細胞株よりもはるかに高かった。ELISAアッセイを実施し、細胞培養上清中の異なる細胞株のGM-CSF濃度を評価した(図2)。GM-CSFを発現するES-D3細胞は、細胞培養上清において、その空のベクター制御よりも著しく高いレベルのGM-CSFを産生した。さらに、GM-CSF発現ES-D3細胞によって生成されるGM-CSFの量は、GM-CSFを発現するSTO線維芽細胞の量と同様であったが、前述の19例に報告された。
エキソソームは、マウスESCに由来する細胞外小胞に富む。
ベクター制御およびGM-CSF発現ES-D3細胞培養を拡大し、細胞培養上清を採取した。EVは遠心分離のいくつかのステップの後に分離されました。単一の EV は、最初に TEM によって評価されました (図 3)。TEM画像に示すように、分離されたEVには異なるサイズの小胞が含まれ、これは外生製剤5で一般的に観察される。重要なことに、個々の小胞の直径は30〜100nmであり、エキソソーム21を記述する以前の報告と一致した。さらに、EVにおけるエキソソームの存在をウェスタンブロッティングで調べた(図4)。CD81、アネキシンV、フロティリン-1を含むエキソソームマーカーの発現は、対応する全細胞抽出物(WCE)と比較してES-D3細胞から分離されたEVにおいて顕著に増強された。重要なことに、ES-D3由来EVにおける他の細胞内区画マーカーの存在は検出されなかったが、(1)小胞体(ER)マーカータンパク質ジスルフィドイソメラーゼ(PDI)、(2)ミトコンドリアマーカーシトクロムcおよびCOX IVサブユニットIV、および(3)シトソリックマーカーGAPDHを含む。全体として、これらのデータは、エキソソームがES-D3細胞から得られたEVで高度に濃縮されたことを示しています。
GM-CSFは、ESCから分離されたエキソソームエンリッチ化細胞外小胞の中に局在する。
エキソソームエンリッチEVにGM-CSF分子が含まれているかどうかを判定するために、ELISAアッセイを実施し、ES-D3細胞から取得したエキソソームエンリッチ型EVの中で、GM-CSF発現の有無にかかわらず、GM-CSFのレベルを評価した(図5)。エキソソーム濃縮EV内のGM-CSFタンパク質の局在化をさらに調査するために、ELISAによって異なる洗浄条件下でエキソソーム濃縮EVでGM-CSFレベルを定量した。この目的のために、洗剤Tween-20(0.05%)を最初に外膜を透過させるために採用され、ELISAアッセイは、0.05%Tween-20の有無にかかわらず緩衝液中で実施した。Tween-20はタンパク質とタンパク質の相互作用を減少させることが知られているため、コントロールEVで検出されたGM-CSFレベルのバックグラウンドは、洗浄バッファー内のTween-20によって有意に減少した。これに対し、GM-CSF発現細胞のEVにおけるGM-CSFレベルは、Tween-20によって有意に増加した。これらの結果は、Tween-20誘導性外膜透過化により、抗体認識のために小胞内のGM-CSF分子がアクセス可能になり、外生GM-CSF分子の大部分が単離された小胞の内に局在しているという証拠を提供することを示している。
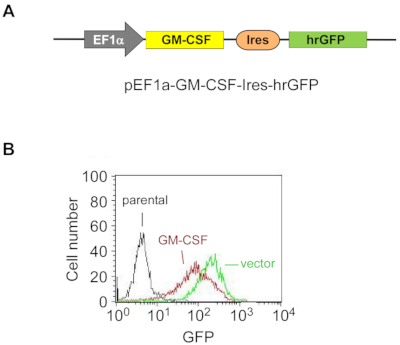
図1:外因性GM-CSFは、ES-D3細胞において安定的に過剰発現している。
(A)ES-D3細胞におけるマウスGM-CSFを過剰発現させるプラスミドの概略図であり、EF1αプロモーターがGM-CSF発現およびhrGFPを駆動する発現マーカーとしての役割を果たす。
(B)GM-CSF発現ES-D3細胞又はそれらの空ベクトル制御の対応するGFPの蛍光強度は、FACSによって決定された。この図の大きなバージョンを表示するには、ここをクリックしてください。
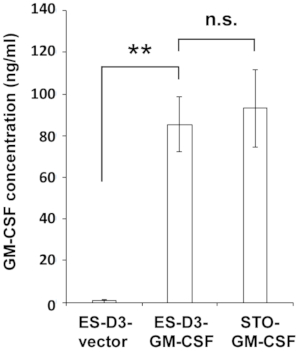
図2:GM-CSFを過剰発現するES-D3細胞は、高レベルのGM-CSFを産生する。
示された細胞の培地中のGM-CSF濃度をELISAにより測定した。データは、3つの独立したELISA測定の平均±標準偏差(平均±SD)として提示されます:**p < 0.001、NS =有意ではない、Tukeyの多重比較検定を用いたANOVA。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:ES-D3由来の細胞外小胞を透過電子顕微鏡で調べる。
細胞外小胞は、GM-CSFまたはその空のベクターを発現するプラスミドをトランスフェクトしたES-D3細胞から調製した。矢印は個々の小胞を示す。スケール バー = 100 nm。 この図の大きなバージョンを表示するには、ここをクリックしてください。
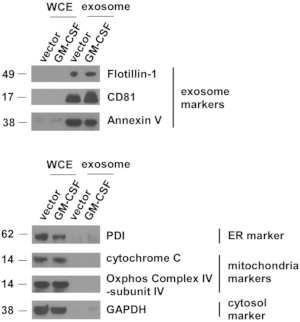
図4:エキソソームマーカーは、ES-D3細胞から分離された細胞外小胞に高濃度である。
エキソソーム、小胞体(ER)、ミトコンドリア、および細胞質ゾルのマーカー量は、示された全細胞抽出物(WCE)およびEVにおいて、ウェスタンブロッティングにより評価した。PDI =ジスルフィドイソメラーゼのタンパク質。分子量マーカー(kD)は左側にあります。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:エキソソームエンリッチ化細胞外小胞中のGM-CSFレベルの評価
示されたエキソソームエンリッチEVにおけるGM-CSFのレベルは、異なるELISA条件下で決定された。エキソソームエンリッチEVは、0.05%Tween-20の有無にかかわらず前処理された。ELISAは、PBSのみまたはPBS+0.05%Tween−20のいずれかを含有する洗浄バッファーを用いて行った。データは、3つの独立したELISAアッセイの平均±SDとして提示される。*p < 0.05, **p < 0.005, Tukeyの多重比較テストを使用した ANOVA. この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本研究は、免疫刺激タンパク質GM-CSFを有するエキソソームエンリッチEVを産生する非常に効率的な方法を示し、エキソソームエンリッチEVの免疫調節効果を研究するために使用することができる。いくつかの研究は、エキソソームが免疫調節および抗腫瘍機能22を示すことを示唆している。したがって、GM-CSFを発現するESCのエキソソームは、免疫応答を調節する生物学的活性を有する可能性もある。このプロトコルにおいて、外因性マウスGM-CSFは、トランスフェクションによってマウスES-D3細胞において安定的に過剰発現した(図1)。重要なことに、GM-CSFを過剰発現させるES-D3細胞から分離されたエキソソームエンリッチEVで、かなりの量のGM-CSFが検出された(図5)。
これらのデータは、ほぼすべてのGM-CSFがエキソソームエンリッチEV内に存在することを示唆しています。サイトカインとして、大部分のGM-CSFタンパク質が細胞外11に分泌される。他の外生カルゴ材料(例えば、mRNA、miRNA、およびタンパク質)と同様に、サイトゾル中のGM-CSF分子は、多胎児体(MVB)6,23の内胞小胞(ILV)に封入される。MVBと血漿膜の融合により、GM-CSFを搭載したILVは細胞外空間に放出されます。
このプロトコルの重要なステップは、マウスES-D3細胞でGM-CSFを効果的に過剰発現することです(図2)。レトロウイルス感染によるこの目標を達成するための以前の取り組みは、ESCs24における転写レベルでのレトロウイルス遺伝子発現の抑制のために、ほとんど失敗した。調べたいくつかのウイルスおよび細胞プロモーターのうち、ヒトEF1αプロモーターはES-D3細胞において最も強い活性を示した。重要なことに、EF1αプロモーターの制御下でのトランスジーン発現は、トランスフェクトされたES-D3細胞の長期細胞培養に続いて安定した状態を保った。外因性GM-CSFを別の細胞型で発現させるためには、様々なプロモーターの効率を評価するためのさらなる研究が必要である。この方法を用いて、GM-CSFを持つエキソソームエンリッチEVを分離させることにより、他の幹細胞タイプや、さまざまなサイトカインを発現するように設計された腫瘍細胞に拡大することができる。GM-CSFと同様に、ほとんどのサイトカインは細胞外25に分泌される。したがって、このアプローチの可能な制限は、エキソソーム濃縮EVに蓄積された所定のサイトカインの量が、その生物学的活性を示すには低すぎるということである。特定のサイトカインについては、エキソソームエンリッチ化されたEVにおけるタンパク質レベルと生物学的活性を最適化するための新しい研究が必要です。
この研究で最も重要なハードルは、GM-CSFを過剰発現するES-D3クローンを生成することです。多発性ポテンシャル状態を維持し、インビトロで細胞増殖を促進するために、マウスESCは、一般に、フィーダー細胞26の存在下で培養される。ESCから排他的にエキソソームを取得するために、培養ESC27 に対するフィーダーセルフリープロトコルを採用した。本研究では、ES-D3細胞を、LIFを添加した培地を用いてゼラチンコーティングされた料理で培養した。この培養条件下でのES-D3細胞の単クローンのプレート効率と増殖は極めて低く、単一細胞からES-D3クローンを生成することは非常に困難でした。親のES-D3細胞から得られた条件付き培地の添加は、めっきされた単一のES-D3細胞の増殖欠乏を救うことができなかった。この制限を克服するために、GM-CSFを過剰発現する単一のES-D3細胞を親のES-D3細胞と共にめっきした。このめっきアプローチは、GM-CSF発現単一ES-D3クローンの生存率を向上させ、クローンの増殖と拡張を促進しました。一度トランスフェクションすると、単一のES-D3クローンが組織培養プレートに付着したと思われる。彼らは他のES-D3細胞の存在に関係なく増殖し、親のES-D3細胞はメッキ後48時間除去され、トランスフェクトされた単一のES-D3細胞のみが増殖することを可能にした。
全体として、異なる疾患条件で免疫応答を刺激する可能性のあるESCからGM-CSFを搭載したエキソソームエンリッチEVを生成するプロトコルが開発されました。さらに、我々の最近発表された研究は、ESCからのGM-CSFを持つエキソソームエンリッチEVが癌28に対する無細胞予防ワクチンとして役立つことを示している。
開示事項
カヴィタ・ヤダナプディ、チー・リー、ジョン・W・イートンは、米国特許出願「人工胚性幹細胞由来エキソソームとその使用方法を含む組成物」を提出した。
謝辞
透過型電子顕微鏡画像を取得してくれたアルカディウシュ・スルサルチク氏とケンタッキー州生物医学研究基盤ネットワーク(KBRIN、P20GM103436)に感謝しています。この研究の一環として、NIH AA018016-01(J.W.E.)、ケンタッキー州連邦リサーチチャレンジトラストファンド(J.W.E.)、NIH CA106599、CA175003(C.L.)、NIH CA198249(K.Y.)、フリー・オブ・ブレス・リサーチ・グラント(K.Y.)からの助成金が支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Alkaline phosphate, Calf Intestinal | New England Biolabs | M0290S | Dephosphorylating DNA plasmid |
| anti-Annexin V mAb | Santa Cruz Biotechnology | clone H-3, sc-74438 | Western blot, RRID:AB_1118989 |
| anti-CD81 mAb | Santa Cruz Biotechnology | clone B-11, sc-166029 | Western blot, RRID:AB_2275892 |
| anti-cytochrome c mAb | Santa Cruz Biotechnology | clone A-8, sc-13156 | Western blot, RRID:AB_627385 |
| anti-Flotillin-1 mAb | Santa Cruz Biotechnology | clone C-2; sc-74566 | Western blot, RRID:AB_2106563 |
| anti-GAPDH pAb | Rockland | 600-401-A33S | Western blot, RRID:AB_11182910 |
| anti-mouse IgG, goat, peroxidase-conjugated | Thermo Fisher | 31430 | Western blot, RRID:AB_228307 |
| anti-Oxphos COX IV-subunit IV mAb | Thermo Fisher | clone 20E8C12 A21348 | Western blot, RRID:AB_221509 |
| anti-protein disulfide isomerase (PDI) pAb | Enzo | ADI-SPA-890 | Western blot, RRID:AB_10616242 |
| anti-rabbit IgG, goat, peroxidase-conjugated | Thermo Fisher | 31460 | Western blot, RRID:AB_228341 |
| BCA (bicinchoninic acid) assay | Thermo Fisher | 23223 | Determining protein concentrations |
| Bis-Tris PAGE Gel, ExpressPlus, 4-20% | Genscript | M42015 | Western blot |
| Carbenicillin, Disodium Salt | Thermo Fisher | 10177012 | Selecting E. coli colonies |
| Centrifuge, Avanti J-26 XPI | Beckman Coulter | Low speed centrifugation | |
| Centrifuge rotor, JA-10 | Beckman Coulter | 09U1597 | Low speed centrifugation |
| Centrifuge bottle, Nalgene PPCO | Thermo Fisher | 3120-0500PK | Low speed centrifugation |
| Cu grids with carbon support film | Electron Microscopy Sciences | FF200-Cu | Acquiring electron microscopy images |
| EcoRI | New England Biolabs | R0101 | Digesting DNA plasmid |
| Enhanced chemiluminescence detection system | Thermo Fisher | 32106 | Western blot |
| FACScalibur flow cytometer | Becton Dickinson | Examining GFP levels of ES-D3 cells | |
| Fetal bovine serum | ATCC | SCRR-30-2020 | Medium for ES-D3 cells |
| Fisherbrand Sterile Cell Strainers; Mesh Size: 40μm | Thermo Fisher | 22-363-547 | Filtering ES-D3 cells for FACS sorting |
| Gelatin (0.1%) | Thermo Fisher | ES006B | Culturing ES-D3 cells |
| GM-CSF ELISA kit | Thermo Fisher | 88733422 | Determining GM-CSF concentrations |
| KnockOut Dulbecco’s Modified Eagle’s Medium | Thermo Fisher | 10-829-018 | Medium for ES-D3 cells |
| Leukemia Inhibitory Factor | Thermo Fisher | ESG1106 | Medium for ES-D3 cells |
| L-glutamine | VWR | VWRL0131-0100 | Medium for ES-D3 cells |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668019 | Transfecting ES-D3 cells |
| Microplate reader, PowerWave XS | BioTek | Determining GM-CSF concentrations | |
| MoFlo XDP high-speed cell sorter | Beckman Coulter | Isolating single ES-D3 cell clones | |
| NEB 5-alpha Competent E. coli | New England Biolabs | C2988J | Generating GM-CSF expression plasmid |
| Neomycin | Thermo Fisher | 10-131-035 | Selecting ES-D3 clones |
| Non-essential amino acids | Thermo Fisher | SH3023801 | Medium for ES-D3 cells |
| Non-fat dry milk | Thermo Fisher | NC9022655 | Western blot |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher | 31985062 | Transfecting ES-D3 cells |
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | Acquiring electron microscopy images |
| Penicillin/streptomycin | VWR | sc45000-652 | Medium for ES-D3 cells |
| Plasmid pEF1a-FD3ER-IRES-hrGFP | Addgene | 37270 | Generating GM-CSF expression plasmid |
| PVDF membranes | Millipore EMD | IPVH00010 | Western blot |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | Generating GM-CSF expression plasmid |
| QIAquick Gel Extraction Kit (50) | QIAGEN | 28704 | Generating GM-CSF expression plasmid |
| Quick Ligation Kit | New England Biolabs | M2200S | Generating GM-CSF expression plasmid |
| Transmission electron microscope | Hitachi | HT7700 | Acquiring electron microscopy images |
| Trypsin | VWR | 45000-660 | Culturing ES-D3 cells |
| Ultracentrifuge, OptimaTM L-100 XP | Beckman Coulter | High speed centrifugation | |
| Ultracentrifuge rotor, 45Ti | Beckman Coulter | 09U4454 | High speed centrifugation |
| Ultracentrifuge polycarbonate bottle | Beckman Coulter | 355622 | High speed centrifugation |
| UranyLess staining solution | Electron Microscopy Sciences | 22409 | Acquiring electron microscopy images |
参考文献
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Sakthiswary, R., Raymond, A. A. Stem cell therapy in neurodegenerative diseases: From principles to practice. Neural Regeneration Research. 7 (23), 1822-1831 (2012).
- Liu, Y. W., et al. Human embryonic stem cell-derived cardiomyocytes restore function in infarcted hearts of non-human primates. Nature Biotechnology. 36 (7), 597-605 (2018).
- Aguayo-Mazzucato, C., Bonner-Weir, S. Stem cell therapy for type 1 diabetes mellitus. Nature Reviews: Endocrinology. 6 (3), 139-148 (2010).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracell Vesicles. 7 (1), 1535750 (2018).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Meldolesi, J. Exosomes and Ectosomes in Intercellular Communication. Current Biology. 28 (8), R435-R444 (2018).
- Stremersch, S., De Smedt, S. C., Raemdonck, K. Therapeutic and diagnostic applications of extracellular vesicles. Journal of Control Release. 244 (Pt B), 167-183 (2016).
- Lindenbergh, M. F. S., Stoorvogel, W. Antigen Presentation by Extracellular Vesicles from Professional Antigen-Presenting Cells. Annual Review of Immunology. 36, 435-459 (2018).
- Kunigelis, K. E., Graner, M. W. The Dichotomy of Tumor Exosomes (TEX) in Cancer Immunity: Is It All in the ConTEXt?. Vaccines (Basel). 3 (4), 1019-1051 (2015).
- Becher, B., Tugues, S., Greter, M. GM-CSF: From Growth Factor to Central Mediator of Tissue Inflammation. Immunity. 45 (5), 963-973 (2016).
- Conti, L., Gessani, S. GM-CSF in the generation of dendritic cells from human blood monocyte precursors: recent advances. Immunobiology. 213 (9-10), 859-870 (2008).
- Higano, C. S., et al. Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer. 115 (16), 3670-3679 (2009).
- Yan, W. L., Shen, K. Y., Tien, C. Y., Chen, Y. A., Liu, S. J. Recent progress in GM-CSF-based cancer immunotherapy. Immunotherapy. 9 (4), 347-360 (2017).
- Dranoff, G., et al. Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulates potent, specific, and long-lasting anti-tumor immunity. Proceedings of the National Academy of Sciences of the United States of America. 90 (8), 3539-3543 (1993).
- Tremml, G., Singer, M., Malavarca, R. Chapter 1, Unit 1C 4, Culture of mouse embryonic stem cells. Current Protocols in Stem Cell Biology. , (2008).
- Kirsch, P., Hafner, M., Zentgraf, H., Schilling, L. Time course of fluorescence intensity and protein expression in HeLa cells stably transfected with hrGFP. Molecules and Cells. 15 (3), 341-348 (2003).
- Zeng, X., et al. Stable expression of hrGFP by mouse embryonic stem cells: promoter activity in the undifferentiated state and during dopaminergic neural differentiation. Stem Cells. 21 (6), 647-653 (2003).
- Yaddanapudi, K., et al. Vaccination with embryonic stem cells protects against lung cancer: is a broad-spectrum prophylactic vaccine against cancer possible?. PLoS One. 7 (7), e42289 (2012).
- Dalby, B., et al. Advanced transfection with Lipofectamine 2000 reagent: primary neurons, siRNA, and high-throughput applications. Methods. 33 (2), 95-103 (2004).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Chapter 3, Unit 3 22, Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , (2006).
- Zhang, X., et al. Exosomes for Immunoregulation and Therapeutic Intervention in Cancer. Journal of Cancer. 7 (9), 1081-1087 (2016).
- Bunggulawa, E. J., et al. Recent advancements in the use of exosomes as drug delivery systems. Journal of Nanobiotechnology. 16 (1), 81 (2018).
- Schlesinger, S., Lee, A. H., Wang, G. Z., Green, L., Goff, S. P. Proviral silencing in embryonic cells is regulated by Yin Yang 1. Cell Reports. 4 (1), 50-58 (2013).
- Dranoff, G. GM-CSF-based cancer vaccines. Immunological Reviews. 188, 147-154 (2002).
- Park, Y. G., et al. Effects of Feeder Cell Types on Culture of Mouse Embryonic Stem Cell In Vitro. Development and Reproduction. 19 (3), 119-126 (2015).
- Lin, S., Talbot, P. Methods for culturing mouse and human embryonic stem cells. Methods in Molecular Biology. 690, 31-56 (2011).
- Yaddanapudi, K., et al. Exosomes from GM-CSF expressing embryonic stem cells are an effective prophylactic vaccine for cancer prevention. OncoImmunology. 8 (3), 1561119 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved