Method Article
Aislamiento de vesículas extracelulares enriquecidas con exosomas que transportan factor estimulante de colonias de granulocitos y macrófagos a partir de células madre embrionarias
En este artículo
Resumen
Este estudio describe un método para aislar vesículas extracelulares enriquecidas con exosomas que transportan factores estimulantes de colonias de macrófagos de granulocitos inmunoestimulantes a partir de células madre embrionarias.
Resumen
Las células madre embrionarias (CES) son células madre pluripotentes capaces de autorrenovarse y diferenciarse en todo tipo de células embrionarias. Al igual que muchos otros tipos de células, las CES liberan pequeñas vesículas de membrana, como los exosomas, al entorno extracelular. Los exosomas sirven como mediadores esenciales de la comunicación intercelular y desempeñan un papel básico en muchos procesos (pato)fisiológicos. El factor estimulante de colonias de granulocitos-macrófagos (GM-CSF) funciona como una citoquina para modular la respuesta inmune. La presencia de GM-CSF en exosomas tiene el potencial de aumentar su función inmuno-reguladora. Aquí, GM-CSF se sobreexpresó de manera estable en la línea celular ESC murina ES-D3. Se desarrolló un protocolo para aislar vesículas extracelulares (VE) enriquecidas con exosomas de alta calidad de células ES-D3 que sobreexpresan GM-CSF. Los vehículos eléctricos aislados enriquecidos con exosomas se caracterizaron por una variedad de enfoques experimentales. Es importante destacar que se encontró que cantidades significativas de GM-CSF estaban presentes en los vehículos eléctricos enriquecidos con exosomas. En general, los vehículos eléctricos enriquecidos con exosomas que contienen GM-CSF de las CES podrían funcionar como vesículas libres de células para ejercer sus actividades inmunorreguladoras.
Introducción
Las CES se derivan de la etapa de blastocisto de un embrión preimplantacional1. Como células madre pluripotentes, las ESC tienen la capacidad de autorrenovarse y diferenciarse en cualquier tipo de célula embrionaria. Debido a su notable potencial de desarrollo y capacidad proliferativa a largo plazo, los CES son extremadamente valiosos para la investigación biomédica1. Los esfuerzos de investigación actuales se han centrado en gran medida en el potencial terapéutico de las CES para una variedad de trastornos patológicos importantes, como la diabetes, las enfermedades cardíacas y las enfermedades neurodegenerativas2,3,4.
Se sabe que las células de mamíferos, incluidas las CES, liberan vesículas con tamaños variables al entorno extracelular, y estas EV poseen muchas funciones fisiológicas y patológicas debido a su papel en la comunicación intercelular5. Entre los diferentes subtipos de EVs, los exosomas son pequeñas vesículas de membrana liberadas desde varios tipos de células en el espacio extracelular tras la fusión de compartimentos endocíticos intermedios, cuerpos multivesiculares (MVB), con la membrana plasmática6. Se ha informado que los exosomas median la comunicación intercelular y están críticamente involucrados en muchos procesos (pato)fisiológicos7,8. Los exosomas heredan algunas funciones biológicas de sus propias células parentales, porque los exosomas contienen materiales biológicos adquiridos del citosol, incluidas proteínas y ácidos nucleicos. Así, los antígenos o factores asociados que estimulan la respuesta inmune específica para una enfermedad dada se encapsulan en los exosomas de tipos particulares de células9. Esto allanó el camino para los ensayos clínicos que exploran los exosomas derivados de tumores como una vacuna contra el cáncer10.
GM-CSF es una citocina secretada por diferentes tipos de células inmunes11. La evidencia emergente demuestra que el GM-CSF activa y regula el sistema inmunológico y desempeña un papel esencial en el proceso de presentación de antígenos12. Por ejemplo, un informe clínico sugiere que GM-CSF estimula la respuesta inmune a los tumores como adyuvante de la vacuna13. Varias estrategias de inmunoterapia contra el cáncer basadas en GM-CSF para explotar la potente actividad inmunoestimuladora de GM-CSF han sido investigadas en ensayos clínicos14. Entre estos, una vacuna contra el cáncer compuesta de células tumorales secretoras de GM-CSF irradiadas ha demostrado ser prometedora en pacientes con melanoma avanzado al inducir respuestas antitumorales celulares y humorales y la necrosis posterior en tumores metastásicos15.
Debido a que los exosomas derivados de las CES poseen actividades biológicas similares a las CES originales, tal vez los exosomas portadores de GM-CSF de las CSC podrían funcionar como vesículas libres de células para regular la respuesta inmune. En este artículo, se describe un método detallado para producir vehículos eléctricos enriquecidos con exosomas de alta calidad a partir de CES que expresan GM-CSF. Estos vehículos eléctricos enriquecidos con exosomas tienen el potencial de servir como vesículas inmunorreguladoras para modular la respuesta inmune.
Protocolo
1. Cultivo de células ES-D3
- Para generar suero bovino fetal libre de exosomas (FBS), cargue FBS en una ultracentrífuga y centrífuga a 100.000 x g durante 16 h a 4 °C. Después de la centrifugación, recoja el sobrenadante sérico como FBS libre de exosomas para cultivar la línea celular ESC murina ES-D3 y adquirir EV enriquecidos con exosomas.
- Antes de emplatar las células ES-D3, cubra los platos de cultivo de tejidos de 15 cm con gelatina (0,1%) a temperatura ambiente durante 30 min.
- Siguiendo un protocolo16descrito anteriormente, culta las células ES-D3 sin células de capa alimentadora en las vajillas de cultivo de tejido de 15 cm recubiertas de gelatina. El medio de cultivo celular ES-D3 está compuesto por DMEM, FBS libre de exosomas (15%), aminoácidos no esenciales (0,1 mM), L-glutamina (2 mM), β-mercaptoetanol (0,1 mM), penicilina (50 unidades/mL), estreptomicina (50 μg/mL) y factor inhibidor de la leucemia (LIF; 100 unidades/mL). Culta células ES-D3 a 37 °C en una incubadora humidificada al 5% de CO2.
- Una vez que las células ES-D3 alcancen alrededor del 90% de confluencia en platos de cultivo de tejidos de 15 cm, retire el medio por aspiración. Lavar las células con tripsina (5 ml; 0,05%). Añadir tripsina (5 ml) a los platos e incubar a 37 °C durante 5 min. Recoge las células de los platos.
- Agregue un medio de cultivo fresco (5 ml) a las células recolectadas para inactivar la tripsina. Centrifugar las células a 390 x g durante 5 min. Resuspend las células en medio fresco y determine el número de células usando un hemocitómetro.
- Para las células de paso, placa las células ES-D3 (5 x 106) en una placa de cultivo de tejido de 15 cm recubierta de gelatina (0,1%) con medio fresco (15 ml) y cultivo durante 3 días antes de subcultivar las células.
- Para recolectar el sobrenadante de cultivo celular para el aislamiento de EVs enriquecidos con exosomas, coloca las células ES-D3 (1 x 107) en una placa de cultivo de tejido de 15 cm recubierta de gelatina (0,1%) con medio fresco (15 mL) durante 3 días antes de recolectar el sobrenadante de cultivo celular.
2. Generación de plásmido de expresión GM-CSF
NOTA: Generar el plásmido de transfección pEF1α-mGM-CSF-IRES-hrGFP para sobreexpresar GM-CSF en células ES-D3. En este plásmido, la expresión del ADNc gm-CSF murino junto con el marcador proteico humanizado Renilla reniformis GFP (hrGFP) es impulsado por el promotor del factor de elongación de la cadena polipeptídica humana 1α (EF1α)17,18.
- Generar la columna vertebral vectorial.
- Digerir el plásmido pEF1α-FD3ER-IRES-hrGFP (20 μg de ADN) utilizando la enzima de restricción EcoRI (100 unidades) a 37 °C durante 2 h para generar dos fragmentos de ADN: la columna vertebral del vector (6,0 kb) y el inserto FD3ER (2,5 kb).
- Transfiera el 50% del ADN plásmido digerido (10 μg) a un tubo de microcentrífuga de 1,5 ml y trátelo con fosfatasa alcalina (20 unidades) a 37 °C durante 1 h. Resolver tanto el ADN no tratado como el desfosforilado mediante electroforesis en gel de agarosa (2%).
- Purificar los fragmentos de ADN de la columna vertebral del vector (6.0 kb) utilizando un kit de extracción de gel de ADN. Mientras que la columna vertebral del vector no tratado servirá como vector vacío (pEF1α-IRES-hrGFP), la columna vertebral del vector desfosforilado se utilizará para generar plásmido que expresa GM-CSF (pEF1α-mGM-CSF-IRES-hrGFP).
- Genere el inserto gm-CSF cDNA.
- Digerir el plásmido pMSCV-mGM-CSF-IRES-EGFP19 (20 μg) utilizando la enzima de restricción EcoRI (100 unidades) a 37 °C durante 2 h para producir dos fragmentos de ADN: la columna vertebral vectorial (6,5 kb) y el inserto murino GM-CSF cDNA (474 pb).
- Resolver el ADN digerido a través de la electroforesis en gel de agarosa (2%). Purificar el fragmento murino de ADNc GM-CSF (474 pb) utilizando un kit de extracción de gel de ADN.
- Generar los plásmidos de expresión.
- Configure 2 reacciones de ligadura (volumen total de 10 μL) utilizando un kit de ligadura de ADN.
- Para generar el vector vacío pEF1α-IRES-hrGFP, ligar la columna vertebral del vector no tratado a partir del paso 2.1.3 (6.0 kb; 500 ng).
- Para generar pEF1α-mGM-CSF-IRES-hrGFP, ligar los siguientes fragmentos de ADN: (1) la columna vertebral del vector desfosforilado del paso 2.1.3 (6.0 kb; 500 ng) y (2) el fragmento de aDNc mGM-CSF generado en el paso 2.2.2 (474 bp; 200 ng).
- Ligar a 25 °C durante 5 min. Transformar el ADN ligado en células de E. coli competentes en DH5α. Placa las células transformadas de E. coli en placas de LB-agar que contienen carbenicilina (50 μg/mL).
- Purificar plásmidos de colonias individuales de E. coli utilizando un kit de aislamiento de ADN. Validar las identidades de los plásmidos mediante secuenciación de ADN.
- Configure 2 reacciones de ligadura (volumen total de 10 μL) utilizando un kit de ligadura de ADN.
3. Generación de células ES-D3 que sobreexpresan GM-CSF
NOTA: Transfectar las células ES-D3 con el plásmido pEF1α-mGM-CSF-IRES-hrGFP para sobreexpresar GM-CS. Cotransfectar el plásmido pBabe-Neo en células ES-D3 para facilitar la selección de células transfectadas de forma estable18,20.
- Transfectar los plásmidos en las células ES-D3.
- Placa las células ES-D3 (1,4 x 106) en una placa de cultivo de tejidos de 10 cm recubierta de gelatina (0,1%) con medio de cultivo (10 ml) para transfección. Cultivar células ES-D3 chapadas a 37 °C durante 24 h.
- Preparar dos mezclas de plásmidos en tubos de microcentrífuga de 1,5 mL: (1) pEF1α-IRES-hrGFP (28 μg, control vectorial) con pBabe-Neo (4 μg) y (2) pEF1α-mGM-CSF-IRES-hrGFP (28 μg, expresando GM-CSF) con pBabe-Neo (4 μg). Realizar la transfección utilizando un kit de transfección siguiendo el protocolo del fabricante.
- Añadir medio de transfección (1 ml) y reactivo de transfección (64 μL) a cada tubo que contenga las mezclas de plásmidos e incubar a temperatura ambiente durante 5 min.
- Agregue las mezclas de transfección a los respectivos platos de 10 cm de células ES-D3. Incubar a 37 °C durante 5 h.
- Reemplace el medio en platos de 10 cm con medio de cultivo fresco (10 ml). Incubar a 37 °C durante 24 h.
- Generar poblaciones masivas de células ES-D3 transfectadas de manera estable.
- Retire el medio de las células ES-D3 transfectadas. Lavar las células con tripsina (2 ml; 0,05%). Añadir tripsina (2 ml) e incubar a 37 °C durante 5 min. Transfiera las células a un tubo centrífugo de 15 ml y agregue 2 ml de medio de cultivo fresco para neutralizar la tripsina. Centrifugadora a 390 x g durante 5 min.
- Resuspend las células transfectadas en medio de cultivo fresco (10 mL). Evaluar la intensidad de fluorescencia de GFP en células ES-D3 transfectadas utilizando la clasificación celular activada por fluorescencia (FACS), siguiendo el protocolo del fabricante.
- Transfiera las células transfectadas a dos platos de 10 cm que contengan un medio de cultivo fresco (10 ml). Añadir neomicina (0,5 mg/ml) para eliminar las células no transfectadas.
- Continuar cultivando las células transfectadas en medio de cultivo que contenga neomicina (0,5 mg/ml). Cuando el ES-D3 transfectado alcance el 90% de confluencia, transfiera las células a platos de cultivo de tejido de 15 cm nuevamente. Repita el procedimiento durante 2 semanas.
- Generar clones de células ES-D3 transfectadas de forma estable.
- Una vez que se generan poblaciones masivas de células ES-D3 transfectadas de manera estable, recoja las células como antes. Determine los números de células usando un hemocitómetro. Centrifugar las células a 390 x g durante 5 min. Resuspend las células (1 x 107 células/ml) en medio de cultivo fresco.
- Filtre las células a través de un colador de células estéril de 40 μm. Purifique las células ES-D3 GFP positivas utilizando FACS, siguiendo el protocolo del fabricante.
- Placa una sola célula ES-D3 clasificada en un pozo de una placa de cultivo de tejido de 96 pozos recubierta de gelatina (0,1%) que contiene células ES-D3 parentales (1 x 103) en medio libre de neomicina (200 μL). El cocultivo de células ES-D3 transfectadas con sus contrapartes parentales no transfectadas garantiza que las células ES-D3 individuales transfectadas de manera estable sobrevivan y proliferen como un solo clon.
- Culta las células durante 48 h y luego agregue neomicina (0,5 mg / ml) a placas de 96 póyes para eliminar las células ES-D3 parentales no transfectadas.
- Continuar cultivando las células ES-D3 GFP positivas en placas de cultivo de tejidos de 96 pozos con medio que contenga neomicina (0,5 mg/ml) durante 1 semana. Transferir líneas celulares clonales es-D3 a platos de cultivo de tejidos de 6 cm recubiertos de gelatina (0,1%) con medio de cultivo (5 ml) que contenga neomicina (0,5 mg/ml) durante 1 semana.
- Determinar la intensidad de la fluorescencia GFP en cada uno de los clones de células ES-D3 transfectadas utilizando FACS, siguiendo el protocolo del fabricante. Seleccione los clones de ES-D3 que expresan GM-CSF o el vector vacío con altos niveles de fluorescencia verde.
- Determine las cantidades de GM-CSF secretadas por las células ES-D3 utilizando un kit ELISA GM-CSF murino, siguiendo el protocolo del fabricante.
4. Aislamiento de vesículas extracelulares enriquecidas con exosomas
- Cultivo de las células ES-D3 (1 x 107) en platos de cultivo de tejidos de 15 cm durante 72 h a 37 °C. Recoger el sobrenadante de cultivo celular. Almacene el sobrenadante recolectado a 4 °C hasta 1 semana para mantener la integridad exosomal.
- Centrifugar el sobrenadante de cultivo celular a 5.000 x g durante 60 min a 4 °C utilizando una centrífuga para sedimentar fragmentos celulares grandes.
- Recoger el sobrenadante y la centrífuga a 100.000 x g durante 90 min a 4 °C utilizando una ultracentrífuga.
- Retire el sobrenadante. Enjuague suavemente cada gránulo dos veces con solución salina tamponada con fosfato (PBS; 1 ml) para eliminar el sobrenadante de cultivo residual.
- Resuspenda cada pellet en PBS. Cuantificar los EVs enriquecidos con exosomas por su contenido proteico5.
- Mida la concentración de proteínas de los vehículos eléctricos enriquecidos con exosomas con un ensayo de ácido bicinconinico (BCA). El rendimiento esperado de los EV enriquecidos con exosomas de las células ES-D3 es de aproximadamente 4 μg de proteína/ml de sobrenadante de cultivo celular. Resuspend los EV enriquecidos con exosomas en PBS (concentración de proteínas: ~6 μg/μL). Guarde los vehículos eléctricos enriquecidos con exosomas a -80 °C.
5. Caracterización de vesículas extracelulares enriquecidas con exosomas mediante microscopía electrónica de transmisión
NOTA: Investigar la composición y la estructura de los vehículos eléctricos enriquecidos con exosomas aislados de CES mediante microscopía electrónica de transmisión (TEM)5.
- Fije los vehículos eléctricos enriquecidos con exosomas (3-5 μg/μL) con una concentración final de paraformaldehído de grado EM al 2% a temperatura ambiente durante 2 h.
- Cargue muestras fijas (10 μL) en rejillas de cobre con película de soporte de carbono. Incubar las muestras con rejillas de cobre durante 1 minuto y luego drenar las rejillas con papel de filtro.
- Manche las rejillas con una solución de tinción siguiendo el protocolo del fabricante.
- Transfiera las rejillas a un trozo de papel de filtro con pinzas. Deje que las rejillas se sequen durante la noche a temperatura ambiente.
- Adquirir imágenes de microscopía electrónica utilizando un microscopio electrónico de transmisión (aumento de 50.000x), siguiendo el protocolo del fabricante.
6. Evaluación de vesículas extracelulares enriquecidas con exosomas mediante análisis de western blot
- Preparar extractos de células enteras.
- Retire el medio de las células ES-D3 cultivadas en platos de 15 cm. Lavar las células con tripsina (5 ml; 0,05%). Agregue tripsina (5 ml) a las células. Incubar a 37 °C durante 5 min. Recoger las células y añadir medio de cultivo fresco (5 ml) para neutralizar la tripsina. Centrifugar las células a 390 x g durante 5 min. Resuspend las células en PBS.
- Determine los números de células utilizando un hemocitómetro. Centrifugar las células de nuevo a 390 x g durante 5 min. Resuspend las celdas en el búfer de carga SDS-PAGE que contiene 0,5% SDS (5.000 celdas/μL).
- Sonicar las muestras durante 10 s utilizando un sonicador con 10% de amplitud (potencia: 500 W; frecuencia ultrasónica: 20 kHz). Calentar las muestras a 100 °C durante 5 min.
- Prepare los lisados de los vehículos eléctricos enriquecidos con exosomas.
- Resuspend los EV enriquecidos con exosomas en tampón de carga SDS-PAGE que contiene 0,5% SDS a una concentración de 1,2 μg/μL.
- Sonicar las muestras durante 10 s utilizando un sonicador con 10% de amplitud (potencia: 500 W; frecuencia ultrasónica: 20 kHz). Calentar las muestras a 100 °C durante 5 min.
- Detectar proteínas por Western blot.
- Cargue extractos de células enteras (10 μL; 5.000 células/μL) y lisatos EV enriquecidos con exosomas (10 μL; 1,2 μg/μL) en cada pozo de un gel Bis-Tris PAGE (4-20%). Transfiera proteínas a membranas de fluoruro de polivinilideno (PVDF).
- Incubar membranas con anticuerpos primarios y secundarios apropiados. Diluir los anticuerpos (en las concentraciones indicadas a continuación) en tampón secante que contenga PBS, Tween-20 (0,2%) y leche en polvo sin grasa (10% p/v).
- Utilice los siguientes anticuerpos primarios: anti-Anexina V (200 ng/mL), anti-CD81 (50 ng/mL), anti-Flotillin-1 (200 ng/mL), anti-citocromo c (100 ng/mL), anti-proteína disulfuro isomerasa (200 ng/mL), anti-GAPDH (33 ng/mL) y anti-Oxphos COX IV-subunidad IV (600 ng/mL).
- Utilice los siguientes anticuerpos secundarios: IgG anti-conejo de cabra conjugada con peroxidasa (20 ng/mL) e IgG anti-ratón de cabra conjugada con peroxidasa (20 ng/mL).
- Detecte proteínas utilizando un kit de detección de quimioluminescencia mejorado.
7. Determinación de las concentraciones de GM-CSF en vesículas extracelulares enriquecidas con exosomas por ELISA
NOTA: Evalúe las cantidades de GM-CSF en vehículos eléctricos enriquecidos con exosomas mediante ELISA utilizando un kit para GM-CSF murino, siguiendo el protocolo del fabricante con algunas modificaciones.
- Cubra la placa ELISA con anticuerpos de captura. Tratar los EVs enriquecidos con exosomas (0,6 μg) en PBS solo o PBS + 0,05% Tween-20 (100 μL) a temperatura ambiente durante 30 min. Agregue las muestras tratadas a la placa ELISA recubierta e incube a temperatura ambiente durante 1 h. Lave la placa con PBS solo o PBS + 0.05% Tween-20.
- Agregue anticuerpos de detección a las muestras. Incubar a temperatura ambiente durante 1 h. Lave la placa con PBS solo o PBS + 0.05% Tween-20. Agregue Avidin-HRP a las muestras. Incubar a temperatura ambiente durante 30 min. Lave la placa con PBS solo o PBS + 0.05% Tween-20.
- Determine las concentraciones de GM-CSF en vehículos eléctricos enriquecidos con exosomas midiendo la absorbancia a 450 nm en un lector de microplacas.
Resultados
Gm-CSF se sobreexpresa en las CES murinas.
Para sobreexpresar de manera estable GM-CSF en células ES-D3, el ADNc GM-CSF murino se clonó en un vector de transfección para generar el vector de expresión pEF1α-mGM-CSF-IRES-hrGFP (Figura 1A). GM-CSF se sobreexpresó en las células ES-D3 por transfección, y alrededor del 20% de las células ES-D3 transfectadas transitoriamente fueron GFP positivas. Los clones celulares que sobreexpresan de manera estable GM-CSF o el control de vectores vacíos fueron adquiridos por FACS. Como se muestra en la Figura 1B,la intensidad de fluorescencia GFP de una línea celular ES-D3 que expresa GM-CSF o una línea celular ES-D3 que expresa el vector vacío fue mucho mayor que la de sus contrapartes parentales. Se realizó un ensayo ELISA para evaluar las concentraciones de GM-CSF en el sobrenadante de cultivo celular de diferentes líneas celulares (Figura 2). Las células ES-D3 que expresan GM-CSF produjeron niveles marcadamente más altos de GM-CSF en el sobrenadante de cultivo celular que su control de vector vacío. Además, la cantidad de GM-CSF generada por las células ES-D3 que expresan GM-CSF fue similar a la de los fibroblastos STO que expresan GM-CSF, como se informó anteriormente19.
Los exosomas se enriquecen en vesículas extracelulares derivadas de LAS ESC murinas.
Se amplió el control de vectores y los cultivos celulares ES-D3 que expresan GM-CSF, y se recolectó el sobrenadante de cultivo celular. Los vehículos eléctricos se aislaron después de varios pasos de centrifugación. Los vehículos eléctricos individuales fueron evaluados por primera vez por TEM(Figura 3). Como se muestra en las imágenes TEM, los VEHÍCULOS eléctricos aislados contenían vesículas de diferentes tamaños, lo que se observa comúnmente en preparaciones exosómicas5. Es importante destacar que los diámetros de las vesículas individuales fueron de 30-100 nm, consistentes con informes anteriores que describían exosomas21. Además, la presencia de exosomas en los vehículos eléctricos se examinó mediante Western blotting(Figura 4). La expresión de marcadores exosomales, incluyendo CD81, anexina V y Flotillin-1, se mejoró notablemente en los EV aislados de células ES-D3 en comparación con los correspondientes extractos de células enteras (WCE). Es importante destacar que no se detectó la presencia de otros marcadores de compartimento subcelular en los EV derivados de ES-D3, incluyendo (1) el marcador endoplásmico de la proteína disulfuro isomerasa (PDI) del marcador endoplásmico (ER), (2) los marcadores mitocondriales citocromo c y COX IV-subunidad IV, y (3) el marcador citosólico GAPDH. En general, estos datos demuestran que los exosomas estaban altamente enriquecidos en los vehículos eléctricos derivados de células ES-D3.
GM-CSF se localiza dentro de vesículas extracelulares enriquecidas con exosomas aisladas de ESCs.
Para determinar si los EV enriquecidos con exosomas contienen moléculas GM-CSF, se realizó un ensayo ELISA para evaluar los niveles de GM-CSF en EVs enriquecidos con exosomas adquiridos de células ES-D3 con o sin expresión de GM-CSF (Figura 5). Para investigar más a fondo la localización de proteínas GM-CSF dentro de los EVs enriquecidos con exosomas, los niveles de GM-CSF fueron cuantificados en EVs enriquecidos con exosomas bajo diferentes condiciones de lavado por ELISA. Para este propósito, el detergente Tween-20 (0.05%) se empleó por primera vez para permeabilizar las membranas exosomales, y se realizaron ensayos ELISA en los tampones con o sin Tween-20 al 0.05%. Debido a que se sabe que Tween-20 reduce las interacciones proteína-proteína, los niveles de GM-CSF de fondo detectados en los VEHÍCULOS de control se redujeron significativamente por Tween-20 en el tampón de lavado. En contraste, los niveles de GM-CSF en los EVs de las células que expresan GM-CSF aumentaron significativamente por Tween-20. Estos resultados demuestran que la permeabilización de la membrana exosomal inducida por Tween-20 hace que las moléculas gm-CSF dentro de las vesículas sean accesibles para el reconocimiento de anticuerpos, proporcionando evidencia de que la mayoría de las moléculas exosómicas GM-CSF están localizadas dentro de la luz de las vesículas aisladas.
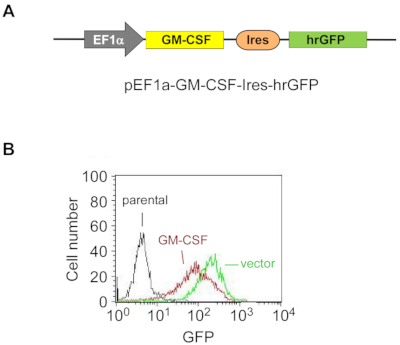
Figura 1: El GM-CSF exógeno se sobreexpresa de manera estable en las células ES-D3.
(A) El diagrama esquemático del plásmido para la sobreexpresión murina de GM-CSF en células ES-D3, en el que un promotor EF1α impulsa la expresión de GM-CSF y hrGFP sirve como marcador de expresión.
(B) La intensidad de fluorescencia de la GFP en células ES-D3 que expresan GM-CSF o sus contrapartes de control de vectores vacíos fue determinada por FACS. Haga clic aquí para ver una versión más grande de esta figura.
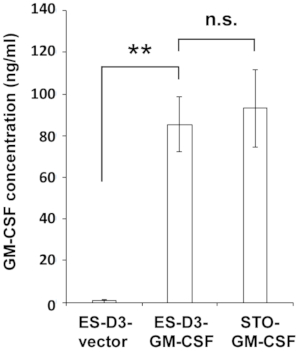
Figura 2: Las células ES-D3 que sobreexpresan GM-CSF producen altos niveles de GM-CSF.
Las concentraciones de GM-CSF en el medio de las células indicadas se midieron mediante ELISA. Los datos se presentan como desviaciones medias ± estándar (media ± DE) de tres mediciones ELISA independientes: **p < 0,001, NS = no significativo, ANOVA con la prueba de comparación múltiple de Tukey. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Las vesículas extracelulares derivadas de ES-D3 se examinan mediante microscopía electrónica de transmisión.
Las vesículas extracelulares se prepararon a partir de células ES-D3 transfectadas con el plásmido que expresa GM-CSF o su contraparte vectorial vacía. Las flechas indican vesículas individuales. Barra de escala = 100 nm. Haga clic aquí para ver una versión más grande de esta figura.
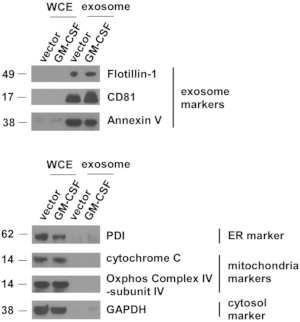
Figura 4: Los marcadores exosómicos están altamente concentrados en vesículas extracelulares aisladas de células ES-D3.
Las cantidades de marcadores para exosomas, retículo endoplásmico (ER), mitocondrias y citosol en los extractos de células enteras (WCE) y EV indicados se evaluaron mediante Western blotting. PDI = proteína disulfuro isomerasa. Los marcadores de peso molecular (kD) están a la izquierda. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Evaluación de los niveles de GM-CSF en vesículas extracelulares enriquecidas con exosomas.
Los niveles de GM-CSF en los EVs enriquecidos con exosomas indicados se determinaron bajo diferentes condiciones ELISA. Los vehículos eléctricos enriquecidos con exosomas fueron pretratados con o sin Tween-20 al 0,05%. ELISA se llevó a cabo utilizando tampón de lavado que contenía pbs solamente o PBS + 0.05% Tween-20. Los datos se presentan como la media ± de la DE de tres ensayos ELISA independientes. *p < 0.05, **p < 0.005, ANOVA con la prueba de comparación múltiple de Tukey. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este estudio muestra un método altamente eficiente para producir vehículos eléctricos enriquecidos con exosomas que transportan la proteína inmunoestimulante GM-CSF, que se puede emplear para estudiar los efectos inmunomoduladores de los vehículos eléctricos enriquecidos con exosomas. Varios estudios sugieren que los exosomas exhiben funciones inmunorreguladoras y antitumorales22. Por lo tanto, los exosomas de las CES que expresan GM-CSF también podrían poseer actividades biológicas que regulan la respuesta inmune. En este protocolo, el GM-CSF murino exógeno se sobreexpresó de manera estable en células ES-D3 murinas por transfección (Figura 1). Es importante destacar que se detectaron cantidades significativas de GM-CSF en EVs enriquecidos con exosomas aislados de células ES-D3 que sobreexpresan GM-CSF(Figura 5).
Estos datos sugieren que casi todos los GM-CSF residen dentro de los vehículos eléctricos enriquecidos con exosomas. Como citoquina, la mayoría de la proteína GM-CSF se secreta extracelularmente11. Al igual que otros materiales de carga exosómicos (por ejemplo, ARNm, miARN y proteínas), las moléculas gm-CSF en el citosol están encapsuladas en las vesículas intraluminales (IEV) de los cuerpos multivesiculares (MVB)6,23. Tras la fusión de los MVB con la membrana plasmática, los IVI portadores de GM-CSF se liberan en el espacio extracelular.
Un paso importante en este protocolo es sobreexpresar efectivamente GM-CSF en células MURINAS ES-D3 (Figura 2). Los esfuerzos anteriores para lograr este objetivo mediante la infección retroviral fracasaron en gran medida, probablemente debido a la supresión de la expresión génica retroviral a los niveles transcripcionales en las CES24. Entre varios promotores virales y celulares examinados, el promotor EF1α humano mostró la actividad más robusta en las células ES-D3. Es importante destacar que la expresión transgénica bajo el control del promotor EF1α se mantuvo estable después del cultivo celular a largo plazo de células ES-D3 transfectadas. Para expresar GM-CSF exógeno en otro tipo de célula, se necesitan más estudios para evaluar la eficiencia de varios promotores. La aplicación de este método para aislar los VEHÍCULOS enriquecidos con exosomas que contienen GM-CSF se puede ampliar a otros tipos de células madre, así como a células tumorales diseñadas para expresar varias citoquinas. Al igual que el GM-CSF, la mayoría de las citoquinas se secretan extracelularmente25. Por lo tanto, una posible limitación de este enfoque es que la cantidad de una citoquina dada acumulada en los VEHÍCULOS enriquecidos con exosomas es demasiado baja para exhibir su actividad biológica. Para una citoquina en particular, se deben realizar nuevos estudios para optimizar su nivel de proteína y su actividad biológica en vehículos eléctricos enriquecidos con exosomas.
El obstáculo más crítico en este estudio es generar clones de ES-D3 que sobreexpresan GM-CSF. Para mantener el estado pluripotencial y promover la proliferación celular in vitro, las CES murinas se cultivan generalmente en presencia de células alimentadoras26. Para adquirir exosomas exclusivamente de CES, se empleó un protocolo libre de células alimentadoras para cultivar CES27. En este estudio, las células ES-D3 se cultivaron en platos recubiertos de gelatina utilizando un medio suplementado con LIF. La eficiencia de la placa y la proliferación de clones individuales de células ES-D3 bajo esta condición de cultivo fueron extremadamente bajas, lo que hace que sea muy difícil generar clones de ES-D3 a partir de células individuales. La adición del medio condicional obtenido de las células ES-D3 parentales no logró rescatar la deficiencia de proliferación de células ES-D3 individuales chapadas. Para superar esta limitación, se colocaron células ES-D3 individuales que sobreexpresan GM-CSF junto con células ES-D3 parentales. Este enfoque de recubrimiento mejoró la viabilidad de los clones únicos de ES-D3 que expresan GM-CSF, facilitando la proliferación y expansión clonal. Una vez transfectados, clones únicos de ES-D3 aparentemente se unieron a placas de cultivo de tejidos. Proliferaron independientemente de la presencia de otras células ES-D3, ya que las células ES-D3 parentales se eliminaron 48 h después de ser chapadas, lo que permitió que solo crecieran células ES-D3 individuales transfectadas.
En general, se desarrolló un protocolo para generar con éxito vehículos eléctricos enriquecidos con exosomas que transportan GM-CSF de ESCs con el potencial de estimular la respuesta inmune en diferentes condiciones de enfermedad. Además, nuestro estudio recientemente publicado demuestra que los vehículos eléctricos enriquecidos con exosomas que contienen GM-CSF de LAS ESC pueden servir como una vacuna profiláctica libre de células contra el cáncer28.
Divulgaciones
Kavitha Yaddanapudi, Chi Li y John W. Eaton presentaron una solicitud de patente estadounidense "Composiciones que comprenden exosomas derivados de células madre embrionarias modificadas y métodos de uso de los mismos".
Agradecimientos
Agradecemos al Sr. Arkadiusz Slusarczyk y a kentucky Biomedical Research Infrastructure Network (KBRIN, P20GM103436) por adquirir imágenes de microscopio electrónico de transmisión. Este trabajo fue apoyado en parte por subvenciones de NIH AA018016-01 (J.W.E.), Commonwealth of Kentucky Research Challenge Trust Fund (J.W.E.), NIH CA106599 y CA175003 (C.L.), NIH CA198249 (K.Y.) y Free to Breathe Research Grant (K.Y.).
Materiales
| Name | Company | Catalog Number | Comments |
| Alkaline phosphate, Calf Intestinal | New England Biolabs | M0290S | Dephosphorylating DNA plasmid |
| anti-Annexin V mAb | Santa Cruz Biotechnology | clone H-3, sc-74438 | Western blot, RRID:AB_1118989 |
| anti-CD81 mAb | Santa Cruz Biotechnology | clone B-11, sc-166029 | Western blot, RRID:AB_2275892 |
| anti-cytochrome c mAb | Santa Cruz Biotechnology | clone A-8, sc-13156 | Western blot, RRID:AB_627385 |
| anti-Flotillin-1 mAb | Santa Cruz Biotechnology | clone C-2; sc-74566 | Western blot, RRID:AB_2106563 |
| anti-GAPDH pAb | Rockland | 600-401-A33S | Western blot, RRID:AB_11182910 |
| anti-mouse IgG, goat, peroxidase-conjugated | Thermo Fisher | 31430 | Western blot, RRID:AB_228307 |
| anti-Oxphos COX IV-subunit IV mAb | Thermo Fisher | clone 20E8C12 A21348 | Western blot, RRID:AB_221509 |
| anti-protein disulfide isomerase (PDI) pAb | Enzo | ADI-SPA-890 | Western blot, RRID:AB_10616242 |
| anti-rabbit IgG, goat, peroxidase-conjugated | Thermo Fisher | 31460 | Western blot, RRID:AB_228341 |
| BCA (bicinchoninic acid) assay | Thermo Fisher | 23223 | Determining protein concentrations |
| Bis-Tris PAGE Gel, ExpressPlus, 4-20% | Genscript | M42015 | Western blot |
| Carbenicillin, Disodium Salt | Thermo Fisher | 10177012 | Selecting E. coli colonies |
| Centrifuge, Avanti J-26 XPI | Beckman Coulter | Low speed centrifugation | |
| Centrifuge rotor, JA-10 | Beckman Coulter | 09U1597 | Low speed centrifugation |
| Centrifuge bottle, Nalgene PPCO | Thermo Fisher | 3120-0500PK | Low speed centrifugation |
| Cu grids with carbon support film | Electron Microscopy Sciences | FF200-Cu | Acquiring electron microscopy images |
| EcoRI | New England Biolabs | R0101 | Digesting DNA plasmid |
| Enhanced chemiluminescence detection system | Thermo Fisher | 32106 | Western blot |
| FACScalibur flow cytometer | Becton Dickinson | Examining GFP levels of ES-D3 cells | |
| Fetal bovine serum | ATCC | SCRR-30-2020 | Medium for ES-D3 cells |
| Fisherbrand Sterile Cell Strainers; Mesh Size: 40μm | Thermo Fisher | 22-363-547 | Filtering ES-D3 cells for FACS sorting |
| Gelatin (0.1%) | Thermo Fisher | ES006B | Culturing ES-D3 cells |
| GM-CSF ELISA kit | Thermo Fisher | 88733422 | Determining GM-CSF concentrations |
| KnockOut Dulbecco’s Modified Eagle’s Medium | Thermo Fisher | 10-829-018 | Medium for ES-D3 cells |
| Leukemia Inhibitory Factor | Thermo Fisher | ESG1106 | Medium for ES-D3 cells |
| L-glutamine | VWR | VWRL0131-0100 | Medium for ES-D3 cells |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668019 | Transfecting ES-D3 cells |
| Microplate reader, PowerWave XS | BioTek | Determining GM-CSF concentrations | |
| MoFlo XDP high-speed cell sorter | Beckman Coulter | Isolating single ES-D3 cell clones | |
| NEB 5-alpha Competent E. coli | New England Biolabs | C2988J | Generating GM-CSF expression plasmid |
| Neomycin | Thermo Fisher | 10-131-035 | Selecting ES-D3 clones |
| Non-essential amino acids | Thermo Fisher | SH3023801 | Medium for ES-D3 cells |
| Non-fat dry milk | Thermo Fisher | NC9022655 | Western blot |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher | 31985062 | Transfecting ES-D3 cells |
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | Acquiring electron microscopy images |
| Penicillin/streptomycin | VWR | sc45000-652 | Medium for ES-D3 cells |
| Plasmid pEF1a-FD3ER-IRES-hrGFP | Addgene | 37270 | Generating GM-CSF expression plasmid |
| PVDF membranes | Millipore EMD | IPVH00010 | Western blot |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | Generating GM-CSF expression plasmid |
| QIAquick Gel Extraction Kit (50) | QIAGEN | 28704 | Generating GM-CSF expression plasmid |
| Quick Ligation Kit | New England Biolabs | M2200S | Generating GM-CSF expression plasmid |
| Transmission electron microscope | Hitachi | HT7700 | Acquiring electron microscopy images |
| Trypsin | VWR | 45000-660 | Culturing ES-D3 cells |
| Ultracentrifuge, OptimaTM L-100 XP | Beckman Coulter | High speed centrifugation | |
| Ultracentrifuge rotor, 45Ti | Beckman Coulter | 09U4454 | High speed centrifugation |
| Ultracentrifuge polycarbonate bottle | Beckman Coulter | 355622 | High speed centrifugation |
| UranyLess staining solution | Electron Microscopy Sciences | 22409 | Acquiring electron microscopy images |
Referencias
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Sakthiswary, R., Raymond, A. A. Stem cell therapy in neurodegenerative diseases: From principles to practice. Neural Regeneration Research. 7 (23), 1822-1831 (2012).
- Liu, Y. W., et al. Human embryonic stem cell-derived cardiomyocytes restore function in infarcted hearts of non-human primates. Nature Biotechnology. 36 (7), 597-605 (2018).
- Aguayo-Mazzucato, C., Bonner-Weir, S. Stem cell therapy for type 1 diabetes mellitus. Nature Reviews: Endocrinology. 6 (3), 139-148 (2010).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracell Vesicles. 7 (1), 1535750 (2018).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Meldolesi, J. Exosomes and Ectosomes in Intercellular Communication. Current Biology. 28 (8), R435-R444 (2018).
- Stremersch, S., De Smedt, S. C., Raemdonck, K. Therapeutic and diagnostic applications of extracellular vesicles. Journal of Control Release. 244 (Pt B), 167-183 (2016).
- Lindenbergh, M. F. S., Stoorvogel, W. Antigen Presentation by Extracellular Vesicles from Professional Antigen-Presenting Cells. Annual Review of Immunology. 36, 435-459 (2018).
- Kunigelis, K. E., Graner, M. W. The Dichotomy of Tumor Exosomes (TEX) in Cancer Immunity: Is It All in the ConTEXt?. Vaccines (Basel). 3 (4), 1019-1051 (2015).
- Becher, B., Tugues, S., Greter, M. GM-CSF: From Growth Factor to Central Mediator of Tissue Inflammation. Immunity. 45 (5), 963-973 (2016).
- Conti, L., Gessani, S. GM-CSF in the generation of dendritic cells from human blood monocyte precursors: recent advances. Immunobiology. 213 (9-10), 859-870 (2008).
- Higano, C. S., et al. Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer. 115 (16), 3670-3679 (2009).
- Yan, W. L., Shen, K. Y., Tien, C. Y., Chen, Y. A., Liu, S. J. Recent progress in GM-CSF-based cancer immunotherapy. Immunotherapy. 9 (4), 347-360 (2017).
- Dranoff, G., et al. Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulates potent, specific, and long-lasting anti-tumor immunity. Proceedings of the National Academy of Sciences of the United States of America. 90 (8), 3539-3543 (1993).
- Tremml, G., Singer, M., Malavarca, R. Chapter 1, Unit 1C 4, Culture of mouse embryonic stem cells. Current Protocols in Stem Cell Biology. , (2008).
- Kirsch, P., Hafner, M., Zentgraf, H., Schilling, L. Time course of fluorescence intensity and protein expression in HeLa cells stably transfected with hrGFP. Molecules and Cells. 15 (3), 341-348 (2003).
- Zeng, X., et al. Stable expression of hrGFP by mouse embryonic stem cells: promoter activity in the undifferentiated state and during dopaminergic neural differentiation. Stem Cells. 21 (6), 647-653 (2003).
- Yaddanapudi, K., et al. Vaccination with embryonic stem cells protects against lung cancer: is a broad-spectrum prophylactic vaccine against cancer possible?. PLoS One. 7 (7), e42289 (2012).
- Dalby, B., et al. Advanced transfection with Lipofectamine 2000 reagent: primary neurons, siRNA, and high-throughput applications. Methods. 33 (2), 95-103 (2004).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Chapter 3, Unit 3 22, Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , (2006).
- Zhang, X., et al. Exosomes for Immunoregulation and Therapeutic Intervention in Cancer. Journal of Cancer. 7 (9), 1081-1087 (2016).
- Bunggulawa, E. J., et al. Recent advancements in the use of exosomes as drug delivery systems. Journal of Nanobiotechnology. 16 (1), 81 (2018).
- Schlesinger, S., Lee, A. H., Wang, G. Z., Green, L., Goff, S. P. Proviral silencing in embryonic cells is regulated by Yin Yang 1. Cell Reports. 4 (1), 50-58 (2013).
- Dranoff, G. GM-CSF-based cancer vaccines. Immunological Reviews. 188, 147-154 (2002).
- Park, Y. G., et al. Effects of Feeder Cell Types on Culture of Mouse Embryonic Stem Cell In Vitro. Development and Reproduction. 19 (3), 119-126 (2015).
- Lin, S., Talbot, P. Methods for culturing mouse and human embryonic stem cells. Methods in Molecular Biology. 690, 31-56 (2011).
- Yaddanapudi, K., et al. Exosomes from GM-CSF expressing embryonic stem cells are an effective prophylactic vaccine for cancer prevention. OncoImmunology. 8 (3), 1561119 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados