Method Article
Очистка человека S100A12 и его ион-индуцированных олигомеров для стимуляции иммунных клеток
В этой статье
Резюме
Этот протокол описывает метод очистки для рекомбинантных тегов без кальция связывающий белок S100A12 и его ион-индуцированных олигомеров для человека моноцитов стимуляции анализов.
Аннотация
В этом протоколе мы описываем метод очистки человека кальций-связывающий белок S100A12 и его ион-индуцированных олигомеров из культуры escherichia coli для стимуляции иммунных клеток. Этот протокол основан на двухступенчатой стратегии хроматографии, которая включает в себя предочищение белка на колонке хроматографии анион-обменификации и последующий полировка шага на колонке гидрофобного взаимодействия. Эта стратегия производит белок S100A12 высокой чистоты и урожайности при управляемых затратах. Для функциональных анализов на иммунных клетках возможное пережитеевое эндотоксинное загрязнение требует тщательного мониторинга и дальнейших мер по очистке для получения белка без эндотоксина. Большинство эндотоксинных загрязнений могут быть исключены с помощью анион-обменной хроматографии. Для истощения остаточного загрязнения в этом протоколе описывается шаг удаления центробежных фильтров. В зависимости от доступных ионно-силовых S100A12 может организовать в различных homomultimers. Для изучения взаимосвязи между структурой и функцией, этот протокол далее описывает ионную обработку белка S100A12 с последующим химическим перекрестным соединением для стабилизации олигомеров S100A12 и их последующего разделения путем исключения размера Хроматографии. Наконец, мы описываем анализ на основе клеток, который подтверждает биологическую активность очищенного белка и подтверждает препарат без LPS.
Введение
S100A12 является кальциевый связывающий белок, который в основном производится человеческими гранулоцитами. Белок переэкспрессирован во время (системного) воспаления и его уровня сыворотки, особенно при (авто) воспалительных заболеваниях, таких как системный ювенильный идиопатический артрит (sJIA), семейная средиземноморская лихорадка (FMF) или болезнь Кавасаки (KD) может сообщить о активности заболевания и реакции на терапию. В зависимости от рецепторов распознавания образов (PRRs), таких как платные рецепторы (TLRs), врожденная иммунная система может быть активирована патогенно-ассоциированными молекулярными моделями (PAMP), такими как липополисахариды (LPS) или повреждения, связанные с молекулярными моделями (DAMPs; также называют «аларминами»). DAMPs являются эндогенные молекулы, такие как клеточные белки, липиды или нуклеиновые кислоты1. DAMP-функции хорошо описаны для членов семейства белка кальгранулин, S100A8/A9 и S100A122, которые также, как сообщается, работают как divalent металл ион-chelating антимикробных пептидов3,4, 5,6. В зависимости от имеющейся ионной силы S100A12 может, как и другие члены семейства S100, организовать в различных homomultimers и до недавнего времени влияние S100A12-олигомеризации на PRR-взаимодействия, в частности TLR4, было неизвестно.
Мономерная форма белка (92 аминокислоты, 10,2 кДа) состоит из двух структур сгелиса-петли-селикса EF, соединенных гибким связующим звеном. C-терминальныйEF-hand содержит классический мотив Ca 2'-связывающий, в то время как N-терминальныйEF-hand демонстрирует структуру расширенной петли S100 («псевдо-EF-hand») и показывает уменьшенную Ca2'-сродство. Ca 2 "-связывание S100A12 может вызвать серьезные конформационные изменения в C-терминубелков, что приводит к воздействию гидрофобного патча на каждом мономере и образует димеризации интерфейса. Таким образом, в физиологических условиях наименьшая четырехкратная структура, образованная S100A12, является нековалентным dimer (примерно 21 kDa), в котором отдельные мономеры находятся в антипараллельной ориентации. При расположении в качестве димера, S100A12, как сообщается, секвестр »n2", а также другие divalent ионов металла, например, Cu2 "с высоким сродством7. Эти ионы координируются в интерфейсе S100A12 dimer аминокислотами H15 и D25 одного подразделения и H85, а также H89 антипараллельного другого подразделения8,9,10. В то время как более ранние исследования предполагают, что «n2»- загруженный S100A12 может вызвать организацию белка в гомо-тетрамеры (44 kDa) и привести к увеличению Ca2 "сродство11,12, недавняя металлическая титровка исследования6 показывают, Ca 2 "-связывание s100A12, чтобы увеличить сродство белка к »n2 ". После того, как S100A12 EF-руки полностью заняты Ca2 ",дополнительные Ca2 ", как полагают, связывать между димерами, вызывая образование гексемеров (примерно 63 kDa). Архитектура хексамерной квартальной структуры явно отличается от тетрамерной. Предлагается, что интерфейс тетрамера нарушается, чтобы привести к новым димер-димер интерфейсы, которые выгоды hexamer формирования10. S100A12 почти исключительно выражается человеческими гранулоцитами, где она составляет около 5% всего цитосолильного белка13. В своей функции DAMP S100A12 исторически был описан как агонист рецептора мульти-лиганд для передовых конечных продуктов гликации (RAGE), а затем назвал внеклеточной вновь выявленных RAGE-связывающий белок (EN-RAGE)14. Хотя мы ранее сообщили биохимических S100A12-связывания как RAGE и TLR415, мы недавно продемонстрировали человеческие моноциты реагировать на S100A12 стимуляции в TLR4-зависимым образом16. Это требует расположения S100A12 в его Ca2 "/n2"-индуцированной hexameric quarternary структуры16.
Здесь мы описываем процедуру очистки для рекомбинантного человека S100A12 и его ион-индуцированных олигомеров для стимуляции иммунных клеток16,17. Это основано на двухступенчатой стратегии хроматографии, которая первоначально включает в себя колонку обмена анионов для изоляции и концентрации белка и удаления объемных загрязнений (например, эндотоксины/липополисахариды)18. Ионно-обменная хроматография мели с разъединяет белки на основе различных чистых поверхностных зарядов. Для кислых белков, таких как S100A12 (изоэлектрическая точка 5,81), буферная система с рН 8,5 и сильной анион-обменной мисиной приводит к хорошему разделению. Связанные белки были eluted с высоким содержанием соли буферград градиента. С увеличением ионной силы отрицательные ионы в элютионном буфере конкурируют с белками за заряды на поверхности мисинки. Белки индивидуально elute в зависимости от их чистого заряда и в результате этого, буферы, описанные в настоящим, позволяют изолировать и сконцентрировать переэкспрессии S100A12 белка. Из-за отрицательно заряженных групп в липополисахаридах, эти молекулы также связываются с анион-обменом мишенями. Однако их более высокий чистый заряд приводит к более позднему выращению приприменении высокосолевого градиента. Для полировки введен второй этап процедуры очистки. Это делает использование кальция связывающей способности S100A12 и удаляет оставшиеся примеси на гидрофобных взаимодействия колонки. Связывание кальция S100A12 приводит к конформационным изменениям и воздействию гидрофобных пятен на поверхность белка. При этом условии S100A12 взаимодействует с гидрофобной поверхностью мисы. После кальция-chelating ЭДТА, это взаимодействие вспять. При наличии ионов, особенно кальция и цинка, S100A12 устраивается в гомомерные олигомеры. Для изучения структурно-функциональных отношений различных олигомеров мы стабилизировали димерические, тетрамерные и гексамерные рекомбинантные S100A12 с химическим кросслинкером и разделили комплексы на столбец хроматографии размеров исключения. Наконец, для анализа функциональности и биологической активности очищенного белка и его ионно-индуцированных олигомеров можно сравнить высвобождение цитокинов S100A12 и LPS стимулируемых моноцитов.
До сих пор описаны различные методы очистки S100A12. Джексон и др.19, например, опубликовал протокол с очищением через колонку обмена анионом и последующего размера исключения хроматографии. Полировка очистки на столбце исключения размера приводит к хорошим результатам, но, например, из-за ограниченных объемов загрузки, менее гибкая по масштабируемости. Другой подход, опубликованный Kiss et al.20, описывает очищение помеченного белка через колонку сродства Ni2 в качестве первого шага очистки, а затем ферментативного расщепления для удаления тега и дальнейших шагов по очистке. В отличие от вышеупомянутых исследований19,20, производится белка, как описано в этом протоколе определяется для экспериментов на иммунных клетках. Таким образом, остатки эндотоксина загрязнения от бактериальной культуры является проблемой. Хотя различные подходы для удаления эндотоксинов были описаны до сих пор, нет единого метода, который работает одинаково хорошо для любого данного белковогораствора 21,22.
Таким образом, наш протокол сочетает в себе преимущества безметного выражения в бактериальной системе с эффективным удалением эндотоксинов и высокой урожайностью чистого белка.
протокол
ПРИМЕЧАНИЕ: Пожалуйста, обратитесь к дополнительной таблице 1 для подготовки буферов и фондовых решений.
1. Выражение белка в кишечной палочке
-
Клонирование
- Клон тегов без человека S100A12 (NCBI Справочная последовательность: NP-005612.1) в бактериальной экспрессии вектор pET11b. Чтобы выразить белок, преобразуйте конструкцию в E. coli BL21 (DE3).
-
Культуры
- Подготовьте стартер культуры путем прививки одной колонии в 5 мл среды роста (LB бульон с 100 мкг /мл ампициллин) в 14 мл круглого дна трубки. Инкубировать на ночь при 37 градусах Цельсия при встряхивании при 220 об/мин. Перенесите 2-4 мл ночной культуры в 400 мл среды роста в 2 L колбе Erlenmayer и инкубировать культуру при 37 градусах Цельсия с тряской при 220 об/мин.
ПРИМЕЧАНИЕ: Первоначальная плотность основной культуры должна быть оптической плотностью в 600 нм (OD600) и 0,1. - Мониторинг OD600 во время роста. Индуцировать выражение белка путем добавления 1 M изопропил-Д-Thiogalactopyranosid (IPTG) к конечной концентрации 1 мМ при OD600 и 0,5-0,6. Инкубировать при 37 градусах и 220 об/мин дополнительно 4 ч.
ПРИМЕЧАНИЕ: В целом, OD600 из 0.6 будет достигнут после 1,5-2,5 ч при 37 градусах Цельсия. - Приготовьте 50 мл звукового буфера, растворив 50 мМ Tris, 50 мМ NaCl и 1 мМ этиленденамин тетраацетическая кислота (ЭДТА) в 40 мл деионированной воды. Отрегулируйте pH с HCl до 8.0 и сделайте до 50 mL. Добавьте ингибитор протеазы (1 таблетка на 50 мл раствора) и уравновесите буфер до 4 градусов по Цельсию.
- Перенесите бактериальную культуру в подходящие центрифуги и собираем клетки при 3200 х г в течение 30 мин при 4 градусах Цельсия. Откажитесь от супернатанта и отрепетите гранулы в 25 мл ледяного звукового буфера. Отныне держите клетки на льду.
ПРИМЕЧАНИЕ: Перепровимые ячейки могут храниться при -20 градусов по Цельсию в краткосрочной перспективе и при -80 градусов по Цельсию в долгосрочной перспективе.
- Подготовьте стартер культуры путем прививки одной колонии в 5 мл среды роста (LB бульон с 100 мкг /мл ампициллин) в 14 мл круглого дна трубки. Инкубировать на ночь при 37 градусах Цельсия при встряхивании при 220 об/мин. Перенесите 2-4 мл ночной культуры в 400 мл среды роста в 2 L колбе Erlenmayer и инкубировать культуру при 37 градусах Цельсия с тряской при 220 об/мин.
-
Соникация/лиза
- Сножайте клетки в течение 6 циклов по 30 с на льду. После каждого цикла, остальные клетки на 30-60 с, чтобы защитить клетки от перегрева.
- Перенесите суспензию ячейки на предварительно охлажденную 50 мл высокоскоростной центрифугии и центрифугу в стационарном угловом роторе при 15 000 х г в течение 30 мин при 4 градусах Цельсия. Декант очищенный лизат, который содержит растворимые цитозолические белки в свежую трубку 50 мл и отбрасывает гранулы.
2. Очистка белка
- Хроматография анион-обмен
- Диализ
- Подготовка анион-обмен хроматографии (AIEX) буфер А путем растворения 20 мМ Трис, 1 мМ EDTA и 1 мМ этилен гликоль-бис (2-аминоэтилет)-N, N,N',N'-тетраацетической кислоты (EGTA) в деионизированной воде и настроить pH до 8,5 с HCl. Для диализа приготовьтесь 2 x 5 л и для хроматографии 2x 1 l буфера AIEX A.
ПРИМЕЧАНИЕ: Объем диализата должен быть примерно в 100 раз больше объема образца. Все буферы, используемые для хроматографии, должны быть отфильтрованы (0,45 мкм или меньше) и дегазированы (например, ультразвуковой ванной или вакуумной дегазованием). - Вырежьте диализные трубки (молекулярное отсечение веса (MWCO) (MWCO) в соответствующую длину с дополнительным пространством для воздуха, чтобы обеспечить плавучесть образца над вращающейся панелью перемешивания.
ПРИМЕЧАНИЕ: Глицерол сохраняет мембрану и должен быть удален перед использованием. - Чтобы уменьшить вязкость очищенного белкового раствора со ступени 1.3.2, разбавьте раствор 25 мл буфера AIEX A, чтобы облегчить последующее применение в столбец хроматографии. Прикрепите первое замыкание на трубу, загрузите образец в мембрану и прикрепите вторую замыкание не менее чем на 1 см от верхнего конца трубки.
- Поместите контейнер 5 l с буфером AIEX A на тарелку перемешать, добавьте бар перемешания и мембрану, наполненную белковым раствором. Отрегулируйте скорость, чтобы повернуть образец, избегая помех с вращающейся панелью. Диализ для 12-24 ч при 4 градусах Цельсия, затем замените диализный буфер (буфер AIEX A) свежим предварительно охлажденный препарат и продолжайте, по крайней мере, 4 дополнительных часа. Перенесите диализированный белковый раствор в трубку 50 мл и процедите через фильтр 0,45 мкм.
ПРИМЕЧАНИЕ: Хранение возможно.
- Подготовка анион-обмен хроматографии (AIEX) буфер А путем растворения 20 мМ Трис, 1 мМ EDTA и 1 мМ этилен гликоль-бис (2-аминоэтилет)-N, N,N',N'-тетраацетической кислоты (EGTA) в деионизированной воде и настроить pH до 8,5 с HCl. Для диализа приготовьтесь 2 x 5 л и для хроматографии 2x 1 l буфера AIEX A.
- Хроматографии
- Запустите систему жидкой хроматографии (FPLC) с общим обслуживанием, подключите буферы столбцов AIEX A и AIEX B (буфер AIEX A с 1 M NaCl) и анион-обменную мизину, содержащую столбец. Обратитесь к таблице 1 для общих хроматографических параметров.
ПРИМЕЧАНИЕ: Буферы, колонки и fPLC оборудование должно быть уравновешена до той же температуры перед началом запуска (обратитесь к хроматографическим параметрам в таблице 1, Таблица 2, Таблица 3, Таблица 4, и таблица 5). - Уравновесите столбец буфером AIEX A, затем загрузите образец на столбец и удалите белки линейным градиентом от 0% до 100% буфера высокой соли (AIEX B). Обратитесь к таблице 2 для детального протокола метода.
- Соберите 2 мл фракций во время elution и проанализировать 10 л каждую фракцию на Coomassie окрашенных 15% натрия dodecyl сульфат полиакриламид гель электрофоресис (SDS-PAGE). Объедините фракции, содержащие белок S100A12 для диализа.
ПРИМЕЧАНИЕ: Молекулярный вес S100A12 составляет 10 575 Da.
- Диализ
- Кальциева-зависимая гидрофобно-взаимодействия хроматографии (HIC)
- Диализ
- Диализ ирует сярприза белкового раствора против 20 мМ Трис, 140 мМ NaCl, pH 7.5 после процедуры, описанной в разделе 2.1.1.
- Хроматографии
- Подготовьте 1 л хроматографического буфера HIC A путем растворения 20 мМ Tris, 140 mM NaCl и 25 мМ CaCl2 в деионизированной воде и отрегулируйте рН до 7,5. Для буфера HIC B растворите 20 мМ Трис, 140 мм NaCl и 50 мМ EDTA. Отрегулируйте pH до 7.0 и отфильтруйте и дегазируйте буферы. Добавьте CaCl2 к образцу до конечной концентрации 25 мМ и процедите через 0,45 мкм. Equilibrate HIC буферов и образец до 4 градусов по Цельсию (температура колонки).
- Запустите систему жидкой хроматографии с общим обслуживанием, подключите буферы столбцов HIC A и B и колонку. Обратитесь к таблице 3 для дальнейших хроматографических параметров.
- Равновесие столбца, загрузите образец и расширьте блок «мыть несвязанный образец» до тех пор, пока УФ-сигнал не достигнет базового уровня снова. Затем начните элуциацию с кальциевым хелатором, содержащим буфер (EDTA). Обратитесь к таблице 4 для детального протокола метода.
ПРИМЕЧАНИЕ: Предыдущие эксперименты показали, что избыток кальция, кажется, полезен для связывания S100A12 с хроматографией. - Соберите пиковые фракции 2 мл и проанализируйте 10 л каждой фракции на окрашенных в Coomassie 15% SDS-PAGE. Бассейн чистый S100A12 фракций и диализ против hepes-буферный солевой раствор (HBS; 20 мм hepes, 140 mM NaCl, pH 7.0), как описано в разделе 2.1.1.
ПРИМЕЧАНИЕ: Коэффициент вымирания мономерного S100A12 составляет 2980 М-1 см-1.
- Диализ
3. Обнаружение и удаление эндотоксина
-
Обнаружение эндотоксина
- Для определения эндотоксинного загрязнения измеряйте концентрации разбавленного белка со ступени 2.2.2.4. (например, 1:10 и 1:100 в HBS) с использованием фермента связанных иммуносорбент анализа (ELISA) основе, флуоресцентные эндотоксин обнаружения анализа (Таблица материалов). Выполните этот ассс, следуя протоколу производителя.
ПРИМЕЧАНИЕ: Используйте свежеприготовленные растворы HBS, растворенные в ультрачистой деионизированной воде, чтобы избежать (нового) эндотоксинного загрязнения буфером.
- Для определения эндотоксинного загрязнения измеряйте концентрации разбавленного белка со ступени 2.2.2.4. (например, 1:10 и 1:100 в HBS) с использованием фермента связанных иммуносорбент анализа (ELISA) основе, флуоресцентные эндотоксин обнаружения анализа (Таблица материалов). Выполните этот ассс, следуя протоколу производителя.
-
Удаление эндотоксина и концентрация белка
- Загрузите 15 мл образца на центробежный фильтр 50 кДа и центрифугу на 3200 х г и 10 градусов по Цельсию в течение примерно 10 мин. Перенесите проточение в свежий сосуд (на льду) и пополнить и центрифугу фильтровальной трубки 50 kDa по мере необходимости. Вымойте мембрану фильтра дважды с HBS, чтобы восстановить как можно больше белка, как это возможно после каждого шага.
- Сосредоточьтесь на S100A12-содержащий поток через с помощью 3 kDa центробежный фильтр, пока объем уменьшается до одной пятой до одной десятой первоначального объема нагрузки (центрифугирование при 3200 х г, 10 градусов по Цельсию в течение примерно 30 мин). Пополнить фильтр так часто, как это необходимо, промыть мембрану и передать концентрированный раствор в новую трубку после каждого пополнения. Откажитесь от потока через. Фильтр снова через 50 kDa, как описано выше.
ПРИМЕЧАНИЕ: Во время этой процедуры, потеря белка замечательна (до 50%), но оставшийся препарат белка полностью исчерпан из LPS. Этот метод дает около 10-15 мг белка из культуры 400 мл. - Отрегулируйте белковый раствор до 1 мг/мл с помощью HBS без эндотоксина и измерьте содержание LPS, как описано в шаге 3.1.1. В случае, если белковый раствор все еще не протестирован как LPS-бесплатно (Злт;0.1 EU/mL), устраните остатки загрязнений с помощью эндотоксина удаления мизени.
ПРИМЕЧАНИЕ: При концентрации белка 1 мг/мл, загрязнение 0,1 EU/mL LPS составляет примерно 0,01 пг LPS/мкг белка.
4. Химическое перекрестное соединение и олигомерное разделение
-
Химическое перекрестное соединение
- Подготовка очень чистых (эндотоксинов) фондовых решений 1 M CaCl2 и 100 мМ NCl2 в ультрачистой деионизированной воды (Таблица материалов). Используйте этот буфер, только что сделанный, для следующего шага.
- Инкубировать 10 мл очищенного эндотоксина без S100A12 (концентрация 1 мг/мл в HBS) в течение 30 мин при комнатной температуре (RT) либо с 25 мм CaCl2 для dimeric/tetrameric, или 25 мм CaCl2 и 1 мМ nCl2 для гксамерик/тетрамерия S100A12 Олигомеров.
- Подготовка crosslinker путем растворения 8 мг BS3 в 500 л без эндотоксина воды непосредственно перед использованием (8 мг кросслинкера для 10 мл ионно-spiked белковый раствор равна конечной концентрации 1,4 мм). Смешайте кросслинкер и образец путем pipetting и инкубировать в течение дополнительных 30 минут на RT. Утолить реакцию, добавив 1 M Tris-HCl, рН 7,5 до конечной концентрации 50 мм и фильтр через 0,45 мкм.
-
Хроматография исключения размера
- Уравновесите перекрестный образец до 12-15 градусов по Цельсию (температура колонны) и запустите систему жидкой хроматографии с общим обслуживанием. Подключите буфер столбца (HBS) и столбец исключения размера. Для получения подробной информации обратитесь к таблице 5.
- Равновесие столбца в HBS, загрузите образец и соберите пиковые фракции (1'2 мл) во время выполнения. Проанализируйте эти фракции на градиенте SDS-PAGE 4'20% и фракциях пула с основными полосами желаемого белкового комплекса.
ПРИМЕЧАНИЕ: Гидролиз эфирных реагентов NHS, таких как BS3 в aqueous решениях, приводит к сильному абсорбции на уровне 280 нм. Несвязанный кросслинкер (молекулярный вес: 572 г/мол) высечен в конце пробега и приводит к сильному пику. - Сосредоточьтесь на решениях с помощью центробежных фильтров с MWCOs 10 kDa (димер), 30 kDa (тетрамер) или 50 kDa (hexamer). Определите эндотоксинное загрязнение, описанное в разделе 3.1. При необходимости удалите оставшиеся LPS с помощью эндотоксинной удаления мизины в соответствии с рекомендациями производителя(Таблица материалов).
5. Функциональное тестирование на моноцитах
- Приготовление моноцитов
- Изолировать моноциты из человека баффи пальто по плотности градиент центрифугирования и последующего обогащения моноцитов с помощью магнитного комплекта разделения бисера (Таблица материалов).
ПРИМЕЧАНИЕ: Этот протокол приведет примерно к 5 х 7 107 моноцитов (один буйный слой) с чистотой 83-95%. Поскольку число, но и отзывчивость клеток сильно зависит от донора, протокол, возможно, придется расширить (в зависимости от необходимого количества клеток). - Для центрифугации плотности уравновешиваем разделительный раствор (плотность 1,077 г/мл) на RT и перенесите 20 мл в центрифуги 50 мл (2 трубки на шубу). Разбавить кровь из человеческого шубного пальто буферным сосольным раствором Хэнка (HBSS) до общего объема 60 мл и слоя 30 мл этой смеси тщательно поверх среды разделения. Центрифуга при 550 х г в течение 35 мин на RT. Отлините центрифужный тормоз.
- После центрифугирования моноядерные периферических кровяных клеток (ПБМК) расположены непосредственно на верхней части среды разделения. Перенесите эти клетки в свежую центрифугу мощностью 50 мл, сделайте до 50 мл с HBSS и центрифугу при 170 х г в течение 10 мин. Аспирируйте супернатант и переприостановите клетку гранулв в небольшом объеме HBSS путем пипеттинга.
- Заполните трубку до 50 мл и центрифугу при 290 х г в течение 10 мин. Снова приспособите супернатант, повторите работу клеток в HBSS (50 мл) и центрифуге при 170 х г в течение 10 мин. Сосчитайте клетки и отдохните их в буфере разделения клеток(Таблица материалов) /c9) до концентрации 5 x 107 клеток/мл.
ПРИМЕЧАНИЕ: Вместо HBSS, фосфат-буферированный солен (PBS) может быть использован для мытья клеток. - Для моноцитной изоляции от ПБМК используйте магнитно-отрицательный комплект изоляции клеток и следуйте протоколу производителя. Подсчитайте моноциты и отдохните в моноцитной среде (RPMI 1640, 15% теплоинактивированной сыворотки плода, 4 мМ L-глютамина, 100 U/mL пенициллин/стрептомицин) до концентрации 2 х 106 клеток/мл.
- Для культуры моноцитов, блюда культуры пальто (например, 100 мм) с гидрофобной, газопроницаемой пленкой, подходящей для подвесных клеток(Таблица материалов). Стерилизовать пластины с помощью уф-излучения в течение примерно 30 мин. Перенесите клетки к этим культурным пластинам и дайте им отдохнуть на ночь при 37 градусах Цельсия и 5% CO2.
ПРИМЕЧАНИЕ: Используйте 15-25 мл клеточной подвески на тарелку с покрытием.
- Изолировать моноциты из человека баффи пальто по плотности градиент центрифугирования и последующего обогащения моноцитов с помощью магнитного комплекта разделения бисера (Таблица материалов).
- Стимуляция моноцитов
- Стимуляция с помощью S100A12 (дикий тип)
ПРИМЕЧАНИЕ: Чтобы отличить необработанный S100A12 (конечный продукт из раздела 2.2.2) от перекрестного белка, S100A12 в следующем называется «дикий тип».- Передача отдохнувшие клетки в 50 мл центробежной трубки и центрифуги на 350 х г в течение 10 мин. Аспирировать супернатант и resuspend клеточные гранулы в стимуляции среды (RPMI 1640, 5% тепло-инактивированных FCS, 4 мм L-глутамамин, 100 U/mL пенициллин/ стрептомицин) при концентрации 2 х 106 клеток/мл.
- Для стимуляции используйте 24 подвесные пластины и добавьте 250 qL клеточной подвески на скважину (0,5 х 106 клеток/хорошо). Добавьте 50 мкг/мл полимиксина В к предполагаемым скважинам, за которыми следует lpS в различных концентрациях (25, 50, 100 и 200 pg/mL) или дикий тип S100A12 (10, 20, 40, 60 мкг/мл). Кроме того, применять белок либо необработанных или теплоденатурированных (99 кв.к. 10 мин) в различных концентрациях клеток.
ПРИМЕЧАНИЕ: Короткая термальная обработка денатурирует белок S100A12, но не оказывает меньшего влияния на LPS. - Инкубировать пластины для 4 ч при 37 градусах по Цельсию и 5% CO2. Урожай клетки путем передачи клеточной подвески каждой скважины в 1,5 мл реакционных труб. Центрифуга при 500 х г в течение 10 мин. Перенесите супернационты в свежие трубки и измерьте высвобождение ТНФЗ в различных разбавлениях (например, 1:2, 1:5, 1:10) с человеческим комплектом TNF' ELISA, следуя рекомендациям производителя.
- Стимулирование с помощью олигомеров S100A12
- Подготовка и семя из моноцитов в 24 хорошо подвесной пластины, как описано выше. Стимулировать клетки, добавляя олигомеры S100A12 со ступени 4.2.3. в различных моляровских концентрациях (125 нм, 250 нм, 500 нм, 1000 нм).
ПРИМЕЧАНИЕ: Для сравнения способностей различных олигомеров стимулировать моноциты, к клеткам в сопоставимых молярах были применены олигомеры. - Инкубировать в течение 4 ч при 37 и 5% CO2,собирать клетки и измерять высвобождение TNF в супернатантах, как описано выше.
- Подготовка и семя из моноцитов в 24 хорошо подвесной пластины, как описано выше. Стимулировать клетки, добавляя олигомеры S100A12 со ступени 4.2.3. в различных моляровских концентрациях (125 нм, 250 нм, 500 нм, 1000 нм).
- Стимуляция с помощью S100A12 (дикий тип)
Результаты
После предварительной очистки на колонке AIEX(Рисунок 1A-C) и последующих кальциевых зависимых HIC (Рисунок 2A,B), очень чистый белок был получен(рисунок 2C). Кроме того, измерения эндотоксина показали успешное удаление ЛПС. Содержание LPS после AIEX измерялось в 1:10 разбавления выше предела обнаружения ассеа, т.е. выше 500 EU/mL. После первой фильтрации через фильтр 50 kDa, содержание LPS было уменьшено до 1 EU/mL. После концентрации с блоком фильтра 3 kDa и дополнительной фильтрацией через 50 kDa, измеренное загрязнение LPS составило 0.08 EU/mL.
В качестве дополнительного контроля, человеческие моноциты были стимулированы с производства белка дикого типа(Рисунок 3A,B). Обработка Polymyxin b отменяет отпуск TNF' от LPS-стимулированных моноцитов, которые не могут быть наблюданы с S100A12. С другой стороны, тепловая обработка LPS и S100A12 отменяет способность белка стимулировать клетки, в то время как это не влияет на клеточную реакцию на стимуляцию LPS.
Белковое воздействие различных ионов приводит к расположению различных олигомеров S100A12(рисунок 4A). Химическое перекрестное соединение позволяет захватывать определенные комплексы, такие как димеры, тетрамеры и гексемеры, а также состояния перехода (например, "тримеры", полоса примерно на 30 кДА). Для того, чтобы вызвать выраженный сдвиг олигомера равновесия до перекрестного, избыток ионов был применен(рисунок 4B).
Изолированные олигомеры в равных моляровских концентрациях(рисунок 5A-C)затем использовались для стимуляции моноцитов для сравнения способностей сигнализации с помощью PRRs. Моноцит-стимуляция с гексамерной S100A12 привела к выраженной высвобождению TNF (Рисунок 6 ). Остаток цитокинов высвобождение может быть обнаружено из клеток, стимулируемых тетрамерическим S100A12, в то время как лечение димерическим белком не вызывает высвобождения TNF.

Рисунок 1: Результаты анион-обменной хроматографии. (A) Хроматограмма с абсорбцией на 280 нм (A280) и процент elution буфера B (пунктирной линии). Блоки методов обозначены с помощью неограниченного образца, B - линейного градиента с буфером выдвижения (буфер B), C и промывают сярем с буфером B, а D - повторное равновесие в буфере A. (B) Фокус на соответствующих пиках с номерами фракционной трубки в красном цвете. (C) Выбранные фракции были проанализированы на 15% Coomassie окрашенных SDS-PAGE. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Результаты гидрофобно-взаимодействия хроматографии. (A) Хроматограмма с абсорбцией на 280 нм (A280) и процент elution буфера B (пунктирной линии). Блоки методов обозначены с помощью неограниченного образца, B и elution с буфером B, и переквибрибристого C в буфере A. (B) Фокус на соответствующих пиках с номерами фракционной трубки в красном цвете. (C) Проанализированы фракции на 15% Coomassie окрашенных SDS-PAGE. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Первичные моноциты человека стимулировались при указанных концентрациях. LPS (A) или S100A12 (дикий тип, B) остались без лечения или теплоденета (99 градусов по Цельсию, 10 мин). Оба условия были протестированы в присутствии и отсутствии полимиксин B. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
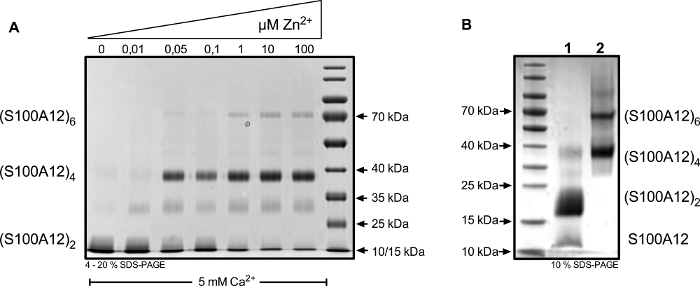
Рисунок 4: Белок S100A12 был перекрестным с BS3 после инкубации в буфере HBS, содержащим 5 мМ Ca2 и указанным концентрациями «n2». (A) Увеличение концентрации N 2 "инд-авт." в тетрамеры и гексемеры при разделении на 4-20% Coomassie окрашенных SDS-PAGE. (B) Представитель результат перекрестных олигомеров с условиями, используемыми для разделения на столбце исключения размера. S100A12 был перекрестным в присутствии либо 25 мМ Ca2 "(полоса 1) или 25 мМ Ca2 " и 1 мМ "n2" (полоса 2). (S100A12) 2 - димер; (S100A12) 4 - тетрамер; (S100A12) 6 - хексамер. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Олигомеры S100A12 были разделены на столбец исключения размера. (A) Chromatogram из hexamer/tetramer разделения после перекрестного соединения в буфере HBS с 25 mM CaCl2 и 1 mM nCl2. (B) Chromatogram для тетрамера / димера разделения в буфере HBS с 25 мМ CaCl2. (C) Пример объединенных и концентрированных олигомеров после разделения на Coomassie окрашенных 4-15% градиент SDS-PAGE. Переулок 1 - димер; переулок 2 - тетрамер; переулок 3 - hexamer. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: Стимуляция моноцитов с очищенными олигомерами S100A12. Выпуск ТНФЗ после инкубации 4 ч был количественно оценен ELISA. Данные показывают среднее значение двух независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Объем кровати (CV) | 75 мл |
| Монитор | Абсорбция при 280 нм |
| Давление Макс | 3 бар |
| Буфер столбца A | 20 мМ Tris-HCl, 1 мМ EDTA, 1 мм EGTA, рН 8.5 |
| Буфер столбцов b | 20 мМ Tris-HCl, 1 мМ EDTA, 1 мм EGTA, 1 М Н. |
| Объем примера | Переменной |
| Расход | 1'2 мл/мин |
| Температура | 4 кк с |
Таблица 1: Подробная информация о прикладных параметрах хроматографии анион-обмена.
| Блок | Объем | Буфера | Выходе |
| Равновесие | Объемы столбцов 1х2 (CVs) | A | Отходов |
| Нагрузка образца | n/a | A | Отходов |
| Вымыть несвязанный образец | 1 CV | A | Выход с большой громкости |
| Градиент-Элюция | 0-100 % Буфер B в 1 резюме | От А до Б | Фракционный коллектор |
| Вымойте-Буфер B | 1 CV | B | Отходов |
| Перекалибровка | 2 резюме | A | Отходов |
Таблица 2: Подробная информация об используемом методе анион-обменной хроматографии.
| Объем кровати (CV) | 125 мл |
| Монитор | Абсорбция при 280 нм |
| Давление Макс | 4 бар |
| Буфер столбца A | 20 мМ Трис, 140 мМ NaCl, 25 мМ CaCl2, рН 7.5 |
| Буфер столбцов b | 20 мМ Трис, 140 мМ NaCl, 50 мМ EDTA, рН 7.5 |
| Объем примера | Переменной |
| Расход | 1'2 мл/мин |
| Температура | 4 кк с |
Таблица 3: Подробная информация о прикладных параметрах гидрофобно-взаимодействия хроматографии.
| Блок | Объем | Буфера | Выходе |
| Равновесие | Объемы столбцов 1х2 (CVs) | A | Отходов |
| Нагрузка образца | n/a | A | Отходов |
| Вымыть несвязанный образец | Резюме от 1:2 | A | Выход с большой громкости |
| Элуцион | 100 % Буфер B | B | Фракционный коллектор |
| Вымойте-Буфер B | 1 CV | B | Отходов |
| Перекалибровка | 2 резюме | A | Отходов |
Таблица 4: Подробная информация об используемом методе гидрофобно-взаимодействия хроматографии.
| Объем кровати (CV) | 320 мл |
| Монитор | Абсорбция при 280 нм |
| Давление Макс | 3 бар |
| Буфер столбца A | 20 мМ хепес, 140 мМ NaCl, рН 7.2 |
| Объем примера | До 13 мл |
| Расход | 1,1 мл/мин |
| Температура | 12-15 кв. м |
Таблица 5: Подробная информация по прикладным параметрам хроматографии, исключенной из размера.
Дополнительная таблица 1: Подготовка буферов и фондовых решений. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В этом протоколе мы описываем безметиваемую бактериальную экспрессию человека S100A12 и его очищение, а также разделение на различные ионные олигомеры для стимуляции иммунных клеток. По сравнению с опубликованной литературой по очистке белка S100A128,23,24, использование высокого CaCl2 (25 мМ) в гидрофобно-взаимодействии хроматографии, насколько нам известно, уникальным. Несколько протоколов, применяющих концентрации от 1 до 5 мМ, производят чистый белок, но мы наблюдали в несколько раз более высокую урожайность после нашего подхода, используя вместо этого 25 мМ CaCl2. Это может быть объяснено иерархией взаимодействия белка с материалом столбца:S100A12 может непосредственно связываться с материалом столбца, но избыток Ca2 'может также облегчить непрямую привязку S100A12-dimers к уже связанному с колонкой белку 8. Таким образом, высокие концентрации Ca2 "может увеличить поверхность, доступную для очистки S100A12. Elution (с помощью линейного градиента) S100A12 от HIC как один рано (косвенно связаны S100A12) и один очень поздний пик (колонка материал связанных белка) может поддерживать эту спекуляцию (данные не показано).
Для производства рекомбинантных S100A12 (как и других белков) при высоких урожаях и управляемых затратах экспрессия белка в кишечной палочке по-прежнему является методом выбора. Однако, неизбежное загрязнение с бактериальными эндотоксинами остает проблемой, когда протеины определены для экспериментов культуры клетки, определенно в изучениях включая innate иммунные клетки. По нашему опыту, даже коммерчески доступные белки, явно заявленные для использования клеточной культуры, могут содержать эндотоксинные загрязнения до 1 белка ЕС/мкг, что может значительно исказить анализы. Таким образом, полное удаление эндотоксинов является обязательным. Эндотоксинмономеры в растворе варьируются от молекулярных весов от 10 до 20 кДа, но они могут образовывать мицелле и структуры с более высоким молекулярным весом. Формирование очень больших структур, например, способствует через двухвалентные ионы21,25.
Согласно нашему протоколу, мы проверяем производство белка S100A12 без эндотоксина без эндотоксина, сочетая высокочувствительные измерения эндотоксина с анализами стимуляции моноцитов. Мы считаем, что такое сочетание особенно значимо, как а) низкоуровневое эндотоксинное загрязнение может быть трудно оценить в зависимости от чувствительности анализа и б) использование полимиксина B в качестве ингибитора ЛПС на моноцитах может привести к трудной интерпретации данных из-за к эксклюзивным полимиксинbю B воздействию на клетки26,27. Полимиксин B, а также другие катионные пептиды, как сообщается, связывают LPS через отрицательно заряженный липид A28. Поскольку платежеспособная поверхность S100A12 также содержит большие отрицательно заряженные патчи, наблюдаемое сокращение TNF-релиза от моноцитов S100A12 стимулировали человека в присутствии полимиксина B(рисунок 3B) может быть связано с) неспецифическим прямым связыванием полимиксин B до S100A12 и/или b) прямое воздействие полимиксина В на стимулированные клетки26,27. В связи с известными ограничениями как обнаружения низкоуровневого эндотоксинного загрязнения, так и неспецифических эффектов полимиксина В, наш протокол далее содержит шаг тепловой инактивации, чтобы четко различать LPS- и белок опосредованный TLR4-сигнал.
Использование LPS-бесплатноs S100A12 для генерации и очистки определенных ионных олигомеров имеет решающее значение и дополнительное внимание должно быть уделено их последующей очистки, чтобы избежать возможного повторного введения эндотоксина через буферы или столбец материала и, таким образом, дальнейшее белково-требующее LDS-истощение через эндотоксин удаления сечения.
Актуальность олигомеризации для биологической функции белков можно оценить различными способами. В случае S100A12, мы использовали поверхностный плазмон резонанс, а также целевые аминокислотные обмены на ионно-обязательных участках и наиболее точно определить белково-комплекс, способный связывать и сигналировать через TLR4 »мы использовали химический крест Ca2 '/n2 » -импульсный рекомбинантный S100A1216. Химическое перекрестное соединение S100A12 в различных ионных условиях замораживает мгновенное состояние, включая несколько олигомерных форм, настадивающих переходный период. Из экспериментов ионной титроции, мы определили условия, при которых димерические, тетрамерные или гексамерные олигомеры могут быть определены как преобладающие олигомеры16. Кроме того, предыдущие эксперименты показали, что избыток ионов полезен для сопоставимых, стабильных перекрестных и последующего очищения, хотя олигомеризация также может быть индуцирована при значительно более низких концентрациях ионов. Однако очищение этих олигомеров путем исключения размера хроматографии приводит к хорошему, но не абсолютному разделению. Тем не менее, выборочное обогащение олигомеров позволяет проводить надежные анализы ниже по течению.
Таким образом, этот протокол предоставляет метод для очистки LPS-свободного человека S100A12 или связанных с ними белков связывания кальция. Для фиксации ионно-индуцированных конформационных изменений, химическое перекрестное и последующее сложное разделение по размеру исключения хроматографии является полезным инструментом для понимания актуальности олигомеризации белка для вниз по течению биологических процессов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано грантами от интрамуральной инновационной медицинской исследовательской программы медицинского факультета Университета Мюнстера (KE121201 до C.K.) и Немецкого исследовательского фонда (DFG, Fo354/3-1 до D.F.).
Материалы
| Name | Company | Catalog Number | Comments |
| pET11b vector | Novagen | ||
| BL21(DE3) competent E. coli | New England Biolabs | C2527 | |
| 100x Non-essential amino acids | Merck | K 0293 | |
| 25% HCl | Carl Roth | X897.1 | |
| 4−20% Mini-PROTEAN TGX Protein Gels | BioRad | 4561093 | |
| Ampicillin sodium salt | Carl Roth | HP62.1 | |
| BS3 (bis(sulfosuccinimidyl)suberate) - 50 mg | ThermoFisher Scientific | 21580 | |
| Calciumchlorid Dihydrat | Carl Roth | 5239.1 | |
| Coomassie Briliant Blue R250 Destaining Solution | BioRad | 1610438 | |
| Coomassie Briliant Blue R250 Staining Solution | BioRad | 1610436 | |
| EasySep Human Monocyte Enrichment Kit | Stemcell | 19059 | Magnetic negative cell isolation kit |
| EDTA disodium salt dihydrate | Carl Roth | 8043.1 | |
| EGTA | Carl Roth | 3054.3 | |
| EndoLISA | Hyglos | 609033 | Endotoxin detection assay |
| Endotoxin-Free Ultra Pure Water | Sigma-Aldrich | TMS-011-A | Ultrapure water for preparation of endotoxin-free buffers |
| EndoTrap red | Hyglos | 321063 | Endotoxin removal resin |
| FBS (heat-inactivated) | Gibco | 10270 | |
| HBSS, no calcium, no magnesium | ThermoFisher Scientific | 14175053 | |
| Hepes | Carl Roth | 9105 | |
| Hepes (high quality, endotoxin testet) | Sigma-Aldrich | H4034 | |
| hTNF-alpha - OptEia ELISA Set | BD | 555212 | |
| IPTG (isopropyl-ß-D-thiogalactopyranosid) | Carl Roth | CN08.1 | |
| L-Glutamine (200 mM) | Merck | K 0282 | |
| LB-Medium | Carl Roth | X968.1 | |
| Lipopolysaccharides from E. coli O55:B5 | Merck | L6529 | |
| Pancoll, human | PAN Biotech | P04-60500 | Separation solution (density gradient centrifugation) |
| Penicillin/Streptomycin (10.000 U/mL) | Merck | A 2212 | |
| Phenyl Sepharose High Performance | GE Healthcare | 17-1082-01 | Resin for hydrophobic interaction chromatography |
| Polymyxin B | Invivogen | tlrl-pmb | |
| Protease inhibitor tablets | Roche | 11873580001 | |
| Q Sepharose Fast Flow | GE Healthcare | 17-0510-01 | Resin for anion-exchange chromatography |
| RoboSep buffer | Stemcell | 20104 | Cell separation buffer (section 5.1.4) |
| RPMI 1640 Medium | Merck | F 1215 | |
| Sodium chloride (NaCl) | Carl Roth | 3957.2 | |
| Sodium hydroxide | Carl Roth | P031.1 | |
| Tris Base | Carl Roth | 4855.3 | |
| Zinc chloride | Carl Roth | T887 | |
| Labware | |||
| 0,45 µm syringe filter | Merck | SLHA033SS | |
| 14 mL roundbottom tubes | BD | 352059 | |
| 2 L Erlenmyer flask | Carl Roth | LY98.1 | |
| 24 well suspension plates | Greiner | 662102 | |
| 5 L measuring beaker | Carl Roth | CKN3.1 | |
| 50 mL conical centrifuge tubes | Corning | 430829 | |
| 50 mL high-speed centrifuge tubes | Eppendorf | 3,01,22,178 | |
| Amicon Ultra-15 Centrifugal Filter Unit MWCO 3 kDa | Merck | UFC900324 | |
| Amicon Ultra-15 Centrifugal Filter Unit MWCO 50 kDa | Merck | UFC905024 | |
| Culture dish (100 mm) | Sarstedt | 83.3902 | |
| Dialysis Tubing Closures | Spectrum | 132738 | |
| EasySep magnet 'The Big Easy` | Stemcell | 18001 | |
| Fraction collector tubes 5 mL | Greiner | 115101 | |
| Lumox film, 25 µm, 305 mm x 40 m | Sarstedt | 94,60,77,316 | Film for monocyte culture plates |
| Spectra/Por Dialysis Membrane (3.5 kDa) | Spectrum | 132724 | |
| Steritop filter unit | Merck | SCGPT01RE | |
| Equipment | |||
| 37 °C Incubator (with shaking) | New Brunswick Scientific | Innova 42 | |
| ÄKTA purifier UPC 10 | GE Healthcare | FPLC System | |
| Fraction collector | GE Healthcare | Frac-920 | |
| Centrifuge (with rotor A-4-81) | Eppendorf | 5810R | |
| Fixed angle rotor | Eppendorf | F-34-6-38 | |
| Mini Protean Tetra Cell | BioRad | 1658000EDU | |
| NanoPhotometer | Implen | P330 | |
| Sonicator | Brandelin | UW2070 | |
| Fluorescence reader | Tecan | infinite M200PRO | |
| pH meter | Knick | 765 |
Ссылки
- Liston, A., Masters, S. L. Homeostasis-altering molecular processes as mechanisms of inflammasome activation. Nature Reviews Immunology. 17 (3), 208-214 (2017).
- Kessel, C., Holzinger, D., Foell, D. Phagocyte-derived S100 proteins in autoinflammation: putative role in pathogenesis and usefulness as biomarkers. Clinical Immunology. 147 (3), 229-241 (2013).
- Baker, T. M., Nakashige, T. G., Nolan, E. M., Neidig, M. L. Magnetic circular dichroism studies of iron(ii) binding to human calprotectin. Chemical Science. 8 (2), 1369-1377 (2017).
- Nakashige, T. G., Zhang, B., Krebs, C., Nolan, E. M. Human calprotectin is an iron-sequestering host-defense protein. Nature Chemical Biology. 11 (10), 765-771 (2015).
- Nakashige, T. G., Zygiel, E. M., Drennan, C. L., Nolan, E. M. Nickel Sequestration by the Host-Defense Protein Human Calprotectin. Journal of the American Chemical Society. 139 (26), 8828-8836 (2017).
- Cunden, L. S., Gaillard, A., Nolan, E. M. Calcium Ions Tune the Zinc-Sequestering Properties and Antimicrobial Activity of Human S100A12. Chemical Science. 7 (2), 1338-1348 (2016).
- Moroz, O. V., et al. Structure of the human S100A12-copper complex: implications for host-parasite defence. Acta Crystallographica Section D, Biological Crystallography. 59 (Pt 5), 859-867 (2003).
- Moroz, O. V., Blagova, E. V., Wilkinson, A. J., Wilson, K. S., Bronstein, I. B. The crystal structures of human S100A12 in apo form and in complex with zinc: new insights into S100A12 oligomerisation. Journal of Molecular Biology. 391 (3), 536-551 (2009).
- Korndorfer, I. P., Brueckner, F., Skerra, A. The crystal structure of the human (S100A8/S100A9)2 heterotetramer, calprotectin, illustrates how conformational changes of interacting alpha-helices can determine specific association of two EF-hand proteins. Journal of Molecular Biology. 370 (5), 887-898 (2007).
- Moroz, O. V., et al. Both Ca2+ and Zn2+ are essential for S100A12 protein oligomerization and function. BMC Biochemistry. 10, 11(2009).
- Baudier, J., Glasser, N., Gerard, D. Ions binding to S100 proteins. I. Calcium- and zinc-binding properties of bovine brain S100 alpha alpha, S100a (alpha beta), and S100b (beta beta) protein: Zn2+ regulates Ca2+ binding on S100b protein. Journal of Biological Chemistry. 261 (18), 8192-8203 (1986).
- Dell’Angelica, E. C., Schleicher, C. H., Santome, J. A. Primary structure and binding properties of calgranulin C, a novel S100-like calcium-binding protein from pig granulocytes. Journal of Biological Chemistry. 269 (46), 28929-28936 (1994).
- Vogl, T., et al. S100A12 is expressed exclusively by granulocytes and acts independently from MRP8 and MRP14. Journal of Biological Chemistry. 274 (36), 25291-25296 (1999).
- Hofmann, M. A., et al. RAGE mediates a novel proinflammatory axis: a central cell surface receptor for S100/calgranulin polypeptides. Cell. 97 (7), 889-901 (1999).
- Foell, D., et al. Proinflammatory S100A12 Can Activate Human Monocytes via Toll-like Receptor 4. American Journal of Respiratory and Critical Care Medicine. 187 (12), 1324-1334 (2013).
- Kessel, C., et al. Calcium and zinc tune autoinflammatory Toll-like receptor 4 signaling by S100A12. Journal of Allergy and Clinical Immunology. 142 (4), 1370-1373 (2018).
- Armaroli, G., et al. Monocyte-Derived Interleukin-1beta As the Driver of S100A12-Induced Sterile Inflammatory Activation of Human Coronary Artery Endothelial Cells: Implications for the Pathogenesis of Kawasaki Disease. Arthritis & Rheumatology. 71 (5), 792-804 (2019).
- GE Healthcare. Strategies for Protein Purification. Handbook. , Freiburg, Germany. (2010).
- Jackson, E., Little, S., Franklin, D. S., Gaddy, J. A., Damo, S. M. Expression, Purification, and Antimicrobial Activity of S100A12. Journal of Visualized Experiments. (123), (2017).
- Kiss, B., Ecsedi, P., Simon, M., Nyitray, L. Isolation and Characterization of S100 Protein-Protein Complexes. Methods in Molecular Biology. 1929, 325-338 (2019).
- Magalhaes, P. O., et al. Methods of endotoxin removal from biological preparations: a review. Journal of Pharmacy and Pharmaceutical Sciences. 10 (3), 388-404 (2007).
- Petsch, D., Anspach, F. B. Endotoxin removal from protein solutions. Journal of Biotechnology. 76 (2-3), 97-119 (2000).
- Heilmann, R. M., Suchodolski, J. S., Steiner, J. M. Purification and partial characterization of canine S100A12. Biochimie. 92 (12), 1914-1922 (2010).
- Hung, K. W., Hsu, C. C., Yu, C. Solution structure of human Ca2+-bound S100A12. Journal of Biomolecular NMR. 57 (3), 313-318 (2013).
- Endotoxin Removal. Application Note - Sartorius Stedim Biotech. , (2010).
- Hogasen, A. K. M., Abrahamsen, T. G. Polymyxin-B Stimulates Production of Complement Components and Cytokines in Human Monocytes. Antimicrobial Agents and Chemotherapy. 39 (2), 529-532 (1995).
- Valentinis, B., et al. Direct effects of polymyxin B on human dendritic cells maturation - The role of I kappa B-alpha/NF-kappa B and ERK1/2 pathways and adhesion. Journal of Biological Chemistry. 280 (14), 14264-14271 (2005).
- Teuber, M., Miller, I. R. Selective Binding of Polymyxin-B to Negatively Charged Lipid Monolayers. Biochimica Et Biophysica Acta. 467 (3), 280-289 (1977).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены