Method Article
免疫細胞刺激のためのヒトS100A12とそのイオン誘発オリゴマーの精製
要約
このプロトコルは、組換えタグフリーカルシウム結合タンパク質S100A12およびヒト単球刺激アッセイのためのイオン誘導オリゴマーの精製方法を説明する。
要約
本プロトコルでは、ヒトカルシウム結合タンパク質S100A12及びそのイオン誘発オリゴマーを免疫細胞刺激のための大腸菌培養から精製する方法について述べた。このプロトコルは、アニオン交換クロマトグラフィーカラム上のタンパク質事前精製および疎水性相互作用カラム上のその後の研磨工程を含む2段階のクロマトグラフィー戦略に基づいています。この戦略は、高純度のS100A12タンパク質を生成し、管理可能なコストで収量します。免疫細胞の機能的アッセイの場合、最終的に残りのエンドトキシン汚染は、エンドトキシンフリータンパク質を得るために慎重な監視とさらなる洗浄ステップを必要とします。エンドトキシン汚染の大部分は、アニオン交換クロマトグラフィーによって除外することができます。残留汚染を枯渇させるために、このプロトコルは遠心フィルターによる除去ステップを記述する。利用可能なイオン強度S100A12に応じて、異なるホモマルチマーに配置することができます。構造と機能の関係を調べるために、このプロトコルはさらにS100A12タンパク質のイオン処理について説明し、続いて化学架橋でS100A12オリゴマーを安定化させ、その後のサイズ排除による分離を行う。クロマトグラフィー。最後に、精製タンパク質の生物活性を確認し、LPSフリー製剤を確認する細胞ベースのアッセイについて説明します。
概要
S100A12は、主にヒト顆粒球によって産生されるカルシウム結合タンパク質である。タンパク質は(全身性)炎症およびその血清レベルの間に過剰発現され、特に全身性若年性特発性関節炎(sJIA)、家族性地中海熱(FMF)または川崎病(KD)などの(自動)炎症性疾患において、疾患活動と治療への反応。トール様受容体(TCR)などのパターン認識受容体(PRR)に応じて、自然免疫系は、リポ多糖類(LPS)のような病原体関連分子パターン(AmpP)または損傷関連分子パターン(AmpP;「アラームイン」とも呼ばれます)。DamPは、細胞タンパク質、脂質または核酸1などの内因性分子である。DAMP機能は、カルグラヌリンタンパク質ファミリーのメンバー、S100A8/A9およびS100A122のメンバーについてよく記載されており、これはまた、解数金属イオンキレート系抗菌ペプチド3、4、として動作することが報告されています。5,6.利用可能なイオン強度S100A12は、S100ファミリーの他のメンバーと同様に、異なるホモマルチマーに配置し、最近までPrR相互作用、特にTLR4に対するS100A12オリゴマーライゼーションの影響は不明であった。
タンパク質の単量体形態(92アミノ酸、10.2 kDa)は、柔軟なリンカーによって接続された2つのEFハンドらせんループ-らせん構造から構成されています。C末端EFハンドは古典的なCa2+-結合モチーフを含み、N-末端EF-handはS100タンパク質特異的拡張ループ構造(「擬似EF-hand」)を示し、Ca2+-親和性の低下を明らかにする。S100A12によるCa2+結合は、タンパク質のC-終端の大きな立体構造変化を誘発し、各モノマー上の疎水性パッチの曝露を引き起こし、ダイメナライゼーション界面を形成する。したがって、生理学的条件下では、S100A12によって形成される最小の四分円構造は、個々のモノマーが反平行方向にある非共有ダイマー(約21 kDa)である。ダイマーとして配置された場合、S100A12は、Zn2+ならびに他の二価金属イオン、例えば、高い親和性7を持つCu2+を隔離すると報告される。これらのイオンは、1つのサブユニットおよびH85のアミノ酸H15およびD25、ならびに反並列他のサブユニット8、9、10のH89によってS100A12ダイマー界面で調整される。以前の研究では、Zn2+-loaded S100A12がタンパク質の組織をホモテトラマー(44 kDa)に誘導し、Ca2+-親和性11、12、最近の金属滴定を増加させる可能性があることを提案しています。研究6は、Zn 2+に対するタンパク質の親和性を高めるためにS100A12によるCa2+-結合を示唆している。S100A12 EF-handsがCa2+によって完全に占有されると、追加のCa2+はダイマー間で結合すると考えられ、ヘキサ形成(約63 kDa)をトリガする。ヘメザリック四半期構造のアーキテクチャは、テトラマーの構造とは明らかに異なります。テトラマーインターフェイスは、ヘキサー形成10に利益をもたらす新しいダイマーダイマーインターフェイスを生み出すために破壊することが提案されています。S100A12は、全ての細胞質タンパク質13の約5%を構成するヒト顆粒球によってほぼ排他的に発現される。そのDAMP機能S100A12では、歴史的に高度な糖化最終産物(RAGE)に対するマルチリガンド受容体のアゴニストとして記述され、次いで細胞外同定されたRAGE結合タンパク質(EN-RAGE)14と呼ばれる。我々は以前にRAGEとTLR415の両方に生化学的S100A12結合を報告したが、我々は最近、TLR4依存的な方法16でS100A12刺激に応答するヒト単球を実証した。これには、Ca2+/Zn2+-誘発されたヘメザリック四半期構造 16 に S100A12 を配置する必要があります。
ここでは、組換えヒトS100A12およびその免疫細胞刺激のためのイオン誘発オリゴマーの精製手順を説明する 16,17.これは、最初にタンパク質を単離して濃縮し、バルク汚染(例えば、エンドトキシン/リポ多糖類)18を除去するアニオン交換カラムを含む2段階のクロマトグラフィー戦略に基づいています。イオン交換クロマトグラフィー樹脂は、異なる正味表面電荷に基づいてタンパク質を分離します。S100A12(等電点5.81)のような酸性タンパク質の場合、pHが8.5と強いアニオン交換樹脂を持つ緩衝系が良好な分離につながります。結合タンパク質を高塩バッファー勾配でタンパク質でタンパク質化した。溶出バッファー内のイオン強度マイナスイオンの増加に伴い、樹脂表面の荷当量に対するタンパク質と競合する。タンパク質は、その正味電荷に応じて個別に溶出し、その結果、ここに記載される緩衝液は、過剰発現したS100A12タンパク質を単離および濃縮することを可能にする。リポ多糖類の負の荷電基のために、これらの分子はまた、アニオン交換樹脂に結合します。しかし、その正味電荷は、適用された高塩勾配で後で溶出します。精製手順の第2段階は、研磨のために導入されている。これはS100A12のカルシウム結合能を利用し、疎水性相互作用カラム上の残りの不純物を除去する。S100A12のカルシウム結合は、タンパク質の表面に立体構造変化および疎水性パッチの曝露につながる。その条件下で、S100A12は樹脂の疎水性表面と相互作用する。EDTAによるカルシウムキレートでは、この相互作用が逆転する。イオン、特にカルシウムおよび亜鉛の存在下で、S100A12はホモメリックオリゴマーに配置する。異なるオリゴマーの構造機能関係を研究するために、化学架リンカーでダイメリック、四面体およびヘメダリック組換えS100A12を安定化させ、サイズ排除クロマトグラフィーカラム上の複合体を分離した。最後に、精製タンパク質とそのイオン誘発オリゴマーの機能性および生物学的活性を分析するために、S100A12およびLPS刺激単球のサイトカイン放出を比較することができる。
S100A12を精製するための種々の方法は、これまでに説明されている。Jackson et al.19は、例えば、アニオン交換カラムおよびその後のサイズ排除クロマトグラフィーを介して精製したプロトコルを公開した。サイズ除外列の精製研磨は良好な結果につながりますが、例えば荷重量が限られているため、スケーラビリティの柔軟性が低くなります。Kiss et al.20によって公開された別のアプローチは、最初の精製ステップとしてNi2+アフィニティカラムを介してタグ付けされたタンパク質の精製を記述し、続いてタグを除去し、さらに精製ステップを酵素切断する。前述の研究19、20とは対照的に、このプロトコルに記載されているように産生されたタンパク質は、免疫細胞上の実験のために決定される。従って、細菌培養物からの残存エンドトキシン汚染が課題である。エンドトキシン除去のための異なるアプローチはこれまで説明されているが、任意の与えられたタンパク質溶液21、22に対して同等に機能する均一な方法はない。
要約すると、我々のプロトコルは、効率的なエンドトキシン除去と純粋なタンパク質の高収率と細菌系におけるタグフリー発現の利点を兼ね備えています。
プロトコル
注:バッファーおよびストックソリューションの準備については、補足表1を参照してください。
1.大腸菌におけるタンパク質発現
-
クローニング
- クローンタグフリーヒトS100A12(NCBI基準配列:NP_005612.1)を細菌発現ベクターpET11bに分けます。タンパク質を発現させるには、大腸菌BL21(DE3)に分解物を変換する。
-
文化
- 14 mLの丸底チューブに成長培地(LBブロス100μg/mLアンピシリン)を5mLで接種してスターター培養を調製する。220 rpmで振りながら37°Cで一晩インキュベートします。2Lエルレンマイヤーフラスコで成長培地の400mLに一晩培養の2−4 mLを移し、220rpmで振盪して37°Cで培養する。
注:主培養の初期密度は、600 nm (OD600)= 0.1 の光学密度でなければなりません。 - 成長中にOD600を監視します。1 Mイソプロピル-D-チオガラクトピラノシド(IPTG)をOD600= 0.5−0.6で1mMの最終濃度に添加してタンパク質発現を誘導する。37 °C および 220 rpm で 4 時間を追加でインキュベートします。
注:一般に、0.6 の OD600は、37 °C で 1.5~2.5 h の後に到達します。 - 脱イオン水の40mLで50mMトリス、50mM NaClおよび1mMエチレンディアミンテトラ酢酸(EDTA)を溶解することにより、50 mLの超音波処理バッファーを調圧します。HClでpHを8.0に調整し、最大50 mLにします。プロテアーゼ阻害剤(50 mL溶液当たり1錠)を追加し、バッファを4°Cに平衡化します。
- 細菌培養を適切な遠心ボトルに移し、3,200 x gで30分間30分間細胞を収穫します。上清を廃棄し、25 mLの氷冷超音波処理バッファーでペレットを再懸濁します。これからは細胞を氷の上に置いておく。
注:再懸濁細胞は、短期的には-20°C、長期は-80°Cで保存できます。
- 14 mLの丸底チューブに成長培地(LBブロス100μg/mLアンピシリン)を5mLで接種してスターター培養を調製する。220 rpmで振りながら37°Cで一晩インキュベートします。2Lエルレンマイヤーフラスコで成長培地の400mLに一晩培養の2−4 mLを移し、220rpmで振盪して37°Cで培養する。
-
超音波処理/リシス
- 氷の上で30sの6サイクルのために細胞を超音波処理します。各サイクルの後、細胞を30−60秒の休止し、細胞が過熱するのを防ぐ。
- セルサスペンションを予め冷やされた50 mLの高速遠心分離管と遠心分離機に15,000 x gの固定角度ローターに移し、4°Cで30分間使用します。可溶性サイトソリックタンパク質を含むクリアされた溶解物を新鮮な50 mLチューブにデカントし、ペレットを廃棄します。
2. タンパク質精製
- アニオン交換クロマトグラフィー
- 透析
- 20mMトリス、1mM EDTAおよび1mMエチレングリコールビス(2-アミノエチルトラー)-N、N'、N'、N'-テトラセチン酸(EGTA)を脱イオン水中に溶解することにより、イオン交換クロマトグラフィー(AIEX)バッファーAを調製し、pHを8.5Hに調整する。透析用は2x5L、クロマトグラフィー用はAIEXバッファAの2x1 Lを調出します。
注:透析液量は、サンプル体積の約100倍である必要があります。クロマトグラフィーに使用されるすべてのバッファーは、濾過(0.45 μm以下)および脱気(例えば、超音波浴または真空脱気によって)にする必要があります。 - 透析チューブ(分子量カットオフ[MWCO]:3.5 kDa)を適切な長さにカットし、回転撹拌バーの上のサンプル浮力を確保するために空気のための追加のスペースを持つ。
注:グリセロールは、膜を保持し、使用する前に除去する必要があります。. - ステップ1.3.2からクリアされたタンパク質溶液の粘度を低下させるために、AIEXバッファーAの25 mLで溶液を希釈し、クロマトグラフィーカラムへの後続の適用を容易にする。最初の閉鎖をチューブに取り付け、サンプルを膜にロードし、チューブの上端から少なくとも1cmの第2の閉鎖を取り付けます。
- AIEXバッファーAを入れた5L容器を攪拌板に置き、攪拌棒とタンパク質溶液で満たされた膜を加える。回転撹拌バーとの干渉を避けて、サンプルを回転させる速度を調整します。4°Cで12−24hの透析を行い、次いで透析液バッファー(AIEXバッファA)を新鮮な予冷製調物に置き換え、少なくとも4時間は継続します。透析タンパク質溶液を50 mLチューブに移し、0.45 μmフィルターユニットを通してフィルターを通します。
注:可能なストレージ。
- 20mMトリス、1mM EDTAおよび1mMエチレングリコールビス(2-アミノエチルトラー)-N、N'、N'、N'-テトラセチン酸(EGTA)を脱イオン水中に溶解することにより、イオン交換クロマトグラフィー(AIEX)バッファーAを調製し、pHを8.5Hに調整する。透析用は2x5L、クロマトグラフィー用はAIEXバッファAの2x1 Lを調出します。
- クロマトグラフィー
- 液体クロマトグラフィーシステム(FPLC)を一般メンテナンスで起動し、カラムバッファAIEX AとAIEX B(AIEXバッファA、1M NaCl)、およびイオン交換樹脂を含むカラムを接続します。一般的なクロマトグラフィーパラメータについては、表1を参照してください。
注: バッファー、カラム、および FPLC 装置は、実行を開始する前に同じ温度に平衡化する必要があります (表 1、表 2、表 3、表 4、および表 5のクロマトグラフィー パラメータを参照)。 - AIEXバッファーAでカラムを平衡化し、その後、サンプルをカラムにロードし、0%から100%の高塩バッファー(AIEX B)に線形勾配でタンパク質を溶出させます。詳細な方法プロトコルについては、表 2を参照してください。
- 溶出中に2mL分画を収集し、クーマッシー染色された15%のドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動(SDS-PAGE)で各画分の10μLを分析します。透析用のS100A12タンパク質を含む分数をプールします。
注:S100A12の分子量は10,575 Daである。
- 透析
- カルシウム依存性疎水性相互作用クロマトグラフィー(HIC)
- 透析
- 20 mMトリス、140 mM NaCl、pH 7.5に対してタンパク質溶液を透析し、セクション2.1.1に記載の手順に従います。
- クロマトグラフィー
- 脱イオン水中に20mMトリス、140mM NaClおよび25 mM CaCl2を溶解することにより、クロマトグラフィーバッファーHIC Aの1Lを調作し、pHを7.5に調整します。HICバッファBの場合、20 mMトリス、140 mM NaClおよび50 mM EDTAを溶解します。pH を 7.0 に調整し、バッファをフィルタリングして脱気します。25 mMの最終濃度にCaCl2を加え、0.45 μmを通して濾過し、HICバッファーを平衡化し、サンプルを4°C(カラム温度)にします。
- 液体クロマトグラフィーシステムを一般的なメンテナンスで起動し、カラムバッファHIC AとBとカラムを接続します。さらなるクロマトグラフィーパラメータについては、表3を参照してください。
- カラムを平衡化し、サンプルをロードし、UV信号が再びベースラインレベルに達するまで「バインドされていないサンプルを洗浄」ブロックを拡張します。次に、緩衝液(EDTA)を含むカルシウムキレート器で溶出を開始する。詳細な方法プロトコルについては、表 4を参照してください。
注:これまでの実験では、S100A12をクロマトグラフィー樹脂に結合させるにはカルシウムの過剰が有益であると考えられることが示されている。 - 2 mL のピーク画分を収集し、クマシー染色された 15% SDS-PAGE 上の各画分の 10 μL を分析します。プール純粋なS100A12分画およびヘペスバッファ化生理生理に対する透析(HBS;20 mM Hepes、140 mM NaCl、pH 7.0)に対してセクション2.1.1に記載されている。
注:モノマーS100A12の消滅係数は2980 M-1 cm-1です。
- 透析
3. エンドトキシンの検出と除去
-
エンドトキシンの検出
- エンドトキシン汚染を決定するには、ステップ2.2.2.4から希釈タンパク質の濃度を測定します。(例えば、HBSで1:10および1:100)酵素結合免疫吸着アッセイ(ELISA)ベースの蛍光エンドトキシン検出アッセイ(材料表)を用いて)製造元のプロトコルに従って、このアッセイを実行します。
注:超純粋な脱イオン水に溶解した新たに調製されたHBS溶液を使用して、バッファーによる(新しい)エンドトキシン汚染を回避します。
- エンドトキシン汚染を決定するには、ステップ2.2.2.4から希釈タンパク質の濃度を測定します。(例えば、HBSで1:10および1:100)酵素結合免疫吸着アッセイ(ELISA)ベースの蛍光エンドトキシン検出アッセイ(材料表)を用いて)製造元のプロトコルに従って、このアッセイを実行します。
-
エンドトキシンの除去とタンパク質の濃度
- サンプルの15 mLを50 kDa遠心フィルターユニットに積み込み、遠心分離機を3,200 x gおよび10°Cで約10分間、フロースルーを新鮮な容器(氷上)に移し、必要に応じて50kDaフィルターチューブを補充し、遠心分離します。フィルター膜をHBSで2回洗浄し、各工程の後にできるだけ多くのタンパク質を回収します。
- S100A12含有フロースルーは、3 kDa 遠心フィルターを使用して、体積が初期荷積量の 5 分の 1 に減少するまで(遠心分離は 3,200 x g、10 °C で約 30 分間)まで縮小します。必要に応じてフィルターを補充し、膜をすすいで、各補充後に濃縮溶液を新しいチューブに移します。フロースルーを破棄します。前述のように50 kDaを通して再度フィルタリングします。
注:この手順の間、タンパク質の損失は顕著である(最大50%)が、残りのタンパク質製剤はLPSから完全に枯渇する。この方法は、400 mL培養から約10−15mgのタンパク質を得る。 - エンドトキシンフリーHBSでタンパク質溶液を1mg/mLに調整し、ステップ3.1.1に記載されているLPS含有量を測定します。タンパク質溶液がまだLPSフリー(<0.1 EU/mL)としてテストされていない場合は、エンドトキシン除去樹脂を使用して残留汚染を排除します。
注:タンパク質濃度が 1 mg/mL の場合、0.1 EU/mL LPS の汚染は約 0.01 pg LPS/μg タンパク質に相当します。
4. 化学架橋とオリゴマー分離
-
化学架橋
- 超純脱イオン水中(材料の表)で1M CaCl2および100 mM ZnCl2の非常に純粋な(エンドトキシンフリー)ストック溶液を調製する。次の手順では、このバッファーを新しく作り上げたバッファーを使用します。
- 精製されたエンドトキシンフリーS100A12(HBS中の濃度1mg/mL)を室温(RT)で30分間インキュベートし、ダイメリック/テトラメリック用に25 mM CaCl2、または25 mM CaCl2および1 mM ZnCl2をヘマテリック/テコメリックS100A12オリゴマー。
- 使用直前にエンドトキシンフリー水の500μLでBS3の8mgを溶解して架リンカーを調製する(10mLイオンスパイクタンパク質溶液に対する8mgの架リンカーは、1.4mMの最終濃度に等しい)。ピペッティングによる架け出しとサンプルを混合し、RTでさらに30分間インキュベートし、1 Mトリス-HCl、pH 7.5を50mMの最終濃度に加え、0.45 μmを通して濾過して反応をクエンチします。
-
サイズ除外クロマトグラフィー
- 架橋されたサンプルを12~15°C(カラム温度)に平衡化し、液体クロマトグラフィーシステムを一般的なメンテナンスで開始します。列バッファ(HBS)とサイズ除外列を接続します。詳細については、表 5を参照してください。
- HBSでカラムを平衡化し、サンプルをロードし、実行中にピーク画分(1−2 mL)を収集します。4−20%の勾配SDS-PAGEでこれらの画分を分析し、所望のタンパク質複合体の主要なバンドを持つプール画分を分析します。
注:水溶液中のBS3のようなNHSエステル試薬の加水分解は、280nmで強い吸光度をもたらします。非結合架本体(分子量:572g/mol)は、実行の終わりに溶出し、強いピークをもたらします。 - 10 kDa(ダイマー)、30 kDa(テトラマー)または50 kDa(ヘキサ)のMWcOsを使用して遠心フィルタユニットを使用して、ソリューションを集中させます。セクション 3.1 で説明されているように、エンドトキシン汚染を確認します。必要に応じて、製造元の勧告(材料の表)に従ってエンドトキシン除去樹脂で残りのLPSを取り除きます。
5. 単球の機能試験
- 単球の調製
- 磁気ビーズ分離キット(材料の表)を使用して、密度勾配遠心分離およびその後の単球濃縮によってヒトバフィーコートから単球を分離します。
注:このプロトコルは、純度83−95%で約5−7 x 107単球(1バフィーコート)になります。数は、また、細胞の応答性がドナーに強く依存するので、プロトコルは(必要な細胞数に応じて)スケールアップする必要があります。 - 密度遠心分離の場合は、分離液(密度 = 1.077 g/mL)をRTに平衡化し、20 mLを50 mL遠心管(バフィーコートあたり2チューブ)に移します。ハンクの緩衝塩溶液(HBSS)を用いたヒトバフィーコートから、この混合物の総体積60mLと層30mLを分離媒体の上に慎重に希釈する。遠心分離機はRTで35分間550 x gで、遠心ブレーキを無効にします。
- 遠心分離後、単核末梢血細胞(PBMC)は分離媒体の上に直接位置する。これらの細胞を新鮮な50 mL遠心チューブに移し、HBSSで最大50 mL、遠心分離機を170 x gで10分間吸引し、ピペッティングにより少量のHBSSで細胞ペレットを再ステージェントします。
- チューブを最大50 mLで充填し、遠心分離機を290 x gで10分間吸引し、HBSS(50 mL)で細胞を再度再中断し、遠心分離機を170 x gで10分間再度使用し、細胞を細胞を数え、細胞バッファー分離(材料の表)でそれらを再中断します(材料の表)/c9>) 5 x 107細胞/mL の濃度に。
注:HBSSの代わりに、リン酸緩衝生理食べ物(PBS)を使用して細胞を洗浄することができます。 - PBMCからの単球単球単離の場合は、磁気陰性細胞絶縁キットを使用し、製造元のプロトコルに従ってください。単球をカウントし、単球培地(RPMI 1640、15%熱不活性化胎児子牛血清[FCS]、4mM L-グルタミン、100 U/mLペニシリン/ストレプトマイシン)を2 x 106細胞/mLの濃度に再ステージする。
- 単球を培養するために、コート培養皿(例えば、100mm)を疎水性、ガス透過性フィルムで、懸濁細胞に適した(材料の表)。約30分間UVライトを使用してプレートを殺菌し、これらの培養プレートに細胞を移し、37°Cと5%CO2で一晩休ませてください。
注:コーティングされた皿ごとに15−25 mLのセル懸濁液を使用してください。
- 磁気ビーズ分離キット(材料の表)を使用して、密度勾配遠心分離およびその後の単球濃縮によってヒトバフィーコートから単球を分離します。
- 単球刺激
- S100A12による刺激(ワイルドタイプ)
注:未処理のS100A12(セクション2.2.2からの最終産物)を架橋タンパク質と区別するために、以下のS100A12を「ワイルドタイプ」と呼ぶ。- 残りの細胞を50mL遠心管と遠心分離機に350 x gで10分間移し、刺激媒体で細胞ペレットを再停止(RPMI 1640、5%熱不活性化FCS、4mM L-グルタミン、100 U/mLicペニン/ストレプトマイシン)を2 x 106細胞/mLの濃度で。
- 刺激のために、24の井戸懸濁液板を使用し、ウェルあたり250 μLの細胞懸濁液を加える(0.5 x 106細胞/ウェル)。目的のウェルに50 μg/mLポリミキシンBを加え、次に異なる濃度(25、50、100、200 pg/mL)またはワイルドタイプS100A12(10、20、40、60 μg/mL)のいずれかのLPSを加えます。また、タンパク質を未処理または熱変性(99°C、10分)で細胞に異なる濃度で塗布する。
注:短い熱処理はS100A12タンパク質を変性させるが、LPSへの影響は少ない。 - 37 °C および 5% CO2で 4 時間のプレートをインキュベートします。各ウェルの細胞懸濁液を1.5mL反応管に移して細胞を収穫する。500 x gで 10 分間遠心分離機を新しいチューブに移し、製造元の推奨に従ってヒト TNFα ELISA キットを使用して、異なる希釈(例えば、1:2、1:5、1:10)でTNFα放出を測定します。
- S100A12オリゴマーによる刺激
- 上述したように24ウェル懸濁液板に単球を調作し、種をまく。ステップ4.2.3からS100A12オリゴマーを添加して細胞を刺激する。異なるモル濃度(125 nM、250 nM、500 nM、1000 nM)で。
注:異なるオリゴマーの能力を比較して単球を刺激するために、オリゴマーを同等のモル濃度で細胞に適用した。 - 37°Cおよび5%CO2で4時間インキュベートし、細胞を収穫し、上述のように上清中のTNFα放出を測定する。
- 上述したように24ウェル懸濁液板に単球を調作し、種をまく。ステップ4.2.3からS100A12オリゴマーを添加して細胞を刺激する。異なるモル濃度(125 nM、250 nM、500 nM、1000 nM)で。
- S100A12による刺激(ワイルドタイプ)
結果
AIEXカラム(図1A-C)およびその後のカルシウム依存性HIC(図2A,B)の事前精製に続いて、高純度タンパク質が得られた(図2C)。さらに、エンドトキシンの測定は、LPS除去に成功したことを明らかにした。AIEXに続くLPS含有量は、アッセイ検出限界を超える1:10希釈、すなわち500EU/mLを超えて測定した。50 kDaフィルターユニットを介した最初の濾過の後、LPS含有量は1 EU/mLに減少した。3 kDaフィルターユニットによる濃度と50kDaによる追加濾過に続いて、測定されたLPS汚染は0.08 EU/mLであった。
追加の対照として、ヒト単球は産生された野生型タンパク質で刺激された(図3A,B)。ポリミキシンB治療は、S100A12では観察できないLPS刺激単球からのTNFα放出を損なう。一方、LPSとS100A12の熱処理は、細胞を刺激するタンパク質の能力を廃止しますが、これはLPS刺激に対する細胞応答には影響しません。
異なるイオンへのタンパク質曝露は、異なるS100A12オリゴマーの配置をもたらす(図4A)。化学架橋は、ダイマー、テトラマー、ヘキマーなどの定義された複合体だけでなく、遷移状態(例えば、トリマー'、約30 kDaのバンド)をキャプチャすることができます。架橋前のオリゴマー平衡の顕著なシフトを誘導するために、過剰なイオンを加えた(図4B)。
等しいモル濃度(図5A-C)で単離されたオリゴマーを単球刺激に用い、PRRを介してシグナル伝達能力を比較した。).残存サイトカイン放出は、四面体S100A12で刺激された細胞から検出することができ、一方、薄暗質タンパク質による治療はTNFα放出を誘導しない。

図1:アニオン交換クロマトグラフィーの結果。(A)280 nm(A280)での吸光度を有するクロマトグラムと、溶出バッファーB(破線)の割合。メソッドブロックは、A =非連結サンプル、B=溶出バッファー(バッファB)を伴う線形勾配、バッファーBでの洗浄、およびバッファーA(B)の再平衡化で、赤色の分数チューブ番号を持つ関連ピークに焦点を当てて示されます。(C)選択された画分を15%クオマッシー染色SDS-PAGEで分析した。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:疎水性相互作用クロマトグラフィーの結果。(A)280 nm(A280)での吸光度を有するクロマトグラムと、溶出バッファーB(破線)の割合。メソッドブロックは、A =非結合サンプル、B =バッファーBによる溶出、およびバッファーA(B)の再平衡化で、分数チューブ番号を赤で示します。(C)15%クオマッシー染色SDS-PAGEで分画を分析した。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:原発性ヒト単球を示された濃度で刺激した。LPS(A)またはS100A12(野生型、B)を未処理または熱脱失(99°C、10分)のままにした。両方の条件は、ポリミキシンBの有無でテストされたこの図のより大きなバージョンを表示するには、ここをクリックしてください。
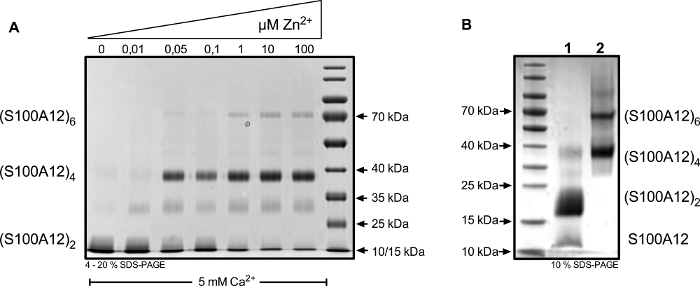
図4:S100A12タンパク質を5mMCa2+を含むHBSバッファー内インキュベーション後にBS3と架橋し、Zn2+濃度を示した。(A)Zn2+濃度の上昇は、4−20%クオマシー染色SDS-PAGEで分離すると、S100A12をテトラマーおよびヘキサに配置する。(B)サイズ除外列上の分離に使用される条件を持つ架橋オリゴマーの代表的な結果。S100A12は、25 mM Ca2+(レーン1)または25 mM Ca2+および1 mM Zn2+(レーン2)のいずれかの存在下で架橋された。(S100A12)2 = ダイマー;(S100A12)4 = テトラマー;(S100A12)6 = ヘキサ。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図5:S100A12オリゴマーをサイズ除外列上で分離した。(A)25 mM CaCl2および 1 mM ZnCl2を持つ HBS バッファーで架橋した後のヘキサ/テトラマー分離のクロマトグラム。(B) 25 mM CaCl2を持つ HBS バッファー内のテトラマー/ダイマー分離用クロマトグラム。(C)クーマッシー染色4-15%勾配SDS-PAGE上で分離した後にプールおよび濃縮オリゴマーの例。レーン 1 = ダイマー;レーン 2 = テトラマー;レーン 3 = ヘキサ。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図6:精製S100A12オリゴマーによる単球の刺激。4時間インキュベーション後のTNFα放出をELISAにより定量した。データは、2つの独立した実験からの平均値を示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| ベッドボリューム(CV) | 75 mL |
| モニター | 280 nMの吸光度 |
| 圧力マックス | 3バール |
| 列バッファ A | 20 mM トリス-HCl, 1 mM EDTA, 1 mM EGTA, pH 8.5 |
| 列バッファ B | 20 mM トリス-HCl, 1 mM EDTA, 1 mM EGTA, 1 M NaCl, pH 8.5 |
| サンプルボリューム | 変数 |
| 流量 | 1−2 mL/分 |
| 温度 | 4 °C |
表1:アニオン交換クロマトグラフィーの適用パラメータに関する詳細情報。
| ブロック | ボリューム | バッファー | コンセント |
| 平衡 | 1-2 列ボリューム(CV) | A | 廃棄 物 |
| サンプル負荷 | N/a | A | 廃棄 物 |
| バインドされていないサンプルを洗い流す | 1 CV | A | 大容量コンセント |
| グラデーション-溶出 | 0−100% バッファ B 1 CV | A から B | 分数コレクタ |
| ウォッシュアウト -バッファ B | 1 CV | B | 廃棄 物 |
| 再平衡化 | 2 CV | A | 廃棄 物 |
表2:アニオン交換クロマトグラフィーの使用方法に関する詳細情報。
| ベッドボリューム(CV) | 125メートル |
| モニター | 280 nMの吸光度 |
| 圧力マックス | 4バー |
| 列バッファ A | 20 mM トリス, 140 mM NaCl, 25 mM CaCl2, pH 7.5 |
| 列バッファ B | 20 mM トリス, 140 mM ナクル, 50 mM EDTA, pH 7.5 |
| サンプルボリューム | 変数 |
| 流量 | 1−2 mL/分 |
| 温度 | 4 °C |
表3:疎水性相互作用クロマトグラフィーの適用パラメータに関する詳細情報。
| ブロック | ボリューム | バッファー | コンセント |
| 平衡 | 1-2 列ボリューム(CV) | A | 廃棄 物 |
| サンプル負荷 | N/a | A | 廃棄 物 |
| バインドされていないサンプルを洗い流す | 1−2CV | A | 大容量コンセント |
| 溶出 | 100 % バッファ B | B | 分数コレクタ |
| ウォッシュアウト -バッファ B | 1 CV | B | 廃棄 物 |
| 再平衡化 | 2 CV | A | 廃棄 物 |
表4:疎水性相互作用クロマトグラフィーの使用方法に関する詳細情報。
| ベッドボリューム(CV) | 320 メートル |
| モニター | 280 nmの吸光度 |
| 圧力マックス | 3バール |
| 列バッファ A | 20 mM ヘップ、140 mM NaCl、pH 7.2 |
| サンプルボリューム | 最大 13 mL |
| 流量 | 1−1.5 mL/分 |
| 温度 | 12−15 °C |
表5:サイズ排除クロマトグラフィーの適用パラメータの詳細情報。
補足表1:バッファーおよびストックソリューションの準備このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルでは、ヒトS100A12のタグフリー細菌発現およびその精製、ならびに免疫細胞刺激のための異なるイオン誘発オリゴマーへの分離について説明する。S100A12タンパク質精製8、23、24に関する文献と比較して、疎水性相互作用クロマトグラフィーにおける高CaCl2(25mM)の使用は我々の知識に特有である。1から5 mMまでの濃度を適用するいくつかのプロトコルは純粋なタンパク質を産生しますが、代わりに25 mM CaCl2を使用して我々のアプローチに続いて数倍高い収率を観察しました。これは、カラム材料とのタンパク質相互作用の階層によって説明されるかもしれません:S100A12はカラム材料に直接結合することができますが、Ca2+の過剰は、既にカラム結合タンパク質へのS100A12-ダイマーの間接的な結合を促進する可能性があります。8.したがって、高Ca2+濃度は、S100A12精製のために利用可能な表面を拡大してもよい。溶出(HICからのS100A12の線形勾配を用いて)を早期(間接的に結合したS100A12)および1つの非常に遅いピーク(カラム材料結合タンパク質)として、この推測を支持し得る(データは示されていない)。
高収率および管理可能なコストで組換えS100A12(および他のタンパク質)の生産のために、大腸菌のタンパク質発現はまだ選択の方法である。しかし、細菌エンドトキシンによる必然的な汚染は、特に自然免疫細胞を含む研究において、細胞培養実験のためにタンパク質が決定される場合に問題のままである。私たちの経験では、細胞培養用に明示的に宣言された市販のタンパク質でさえ、最大1つのEU/μgタンパク質のエンドトキシン汚染を含むことができ、アッセイを著しく歪めることができます。したがって、エンドトキシンの完全な除去は必須です。溶液中のエンドトキシンモノマーは、10~20kDaの分子量の範囲ですが、より高い分子量を有するミセルおよび構造を形成することができます。非常に大きな構造の形成は、例えば、二価イオン21、25を介して促進される。
我々のプロトコルによれば、高感度エンドトキシン測定と単球刺激アッセイを組み合わせることで、S100A12タンパク質のエンドトキシンフリー産生を検証します。我々は、このような組み合わせが特に有意義であると考える)低レベルのエンドトキシン汚染は、アッセイおよびb)単球のLPS阻害剤としてのポリミキシンBの使用が原因でデータを解釈することが困難になる可能性がある。.細胞26、27に排他的なポリミキシンB効果に。ポリミキシンBならびに他のカチオン性ペプチドは、負に帯電した脂質A28を介してLPSに結合することが報告されている。S100A12の溶媒暴露面には、ポリミキシンB(図3B)の存在下でS100A12刺激ヒト単球からのTNFα放出の観察された減少が大きな負電荷パッチも含まれているため(図3B)の非特異的な直接結合に起因してもよい。ポリミキシンBからS100A12および/またはb)刺激細胞に対するポリミキシンBの直接的な効果26,27.低レベルのエンドトキシン汚染の検出と非特異的ポリミキシンB効果の両方の既知の制限により、我々のプロトコルはさらにLPSとタンパク質媒介性TLR4シグナル伝達を明確に区別するための熱不活性化ステップが含まれています。
定義されたイオン誘発オリゴマーの生成と精製のためのLPSフリーS100A12の使用は重要であり、バッファーまたはカラム材料を介したエンドトキシンの最終的な再導入を避けるために、その後の精製に特別な注意を払う必要があります。エンドトキシン除去樹脂を介してさらにタンパク質を要求するLPS-枯渇。
タンパク質の生物学的機能に対するオリゴマー化の関連性は、異なる手段によって評価することができる。S100A12の場合、イオン結合部位における表面プラズモン共鳴と標的アミノ酸交換を用い、TLR4を介して結合してシグナル伝達できるタンパク質複合体を最も正確に定義するために、Ca2+/Zn 2+の化学架橋を採用しました。-パルス組換えS100A1216.異なるイオン条件下でのS100A12の化学架橋は、遷移中のいくつかのオリゴマー形態を含む瞬間的な状態をスナップ凍結する。イオン滴定実験から、我々は、ジメラ、テトラメリックまたはヘメトリーオリゴマーが優勢なオリゴマー16として決定することができる条件を定義した。さらに、これまでの実験では、過剰なイオンが同等で安定した架橋およびその後の精製に有益であることが示されていますが、オリゴマー化はイオン濃度を著しく低いイオン濃度で誘導することも可能です。しかし、これらのオリゴマーをサイズ排除クロマトグラフィーによって精製すると、良好であるが、絶対分離は生じる。それでも、オリゴマーの選択的な濃縮は信頼できる下流の分析を可能にする。
要約すると、このプロトコルは、LPSフリーヒトS100A12または関連するカルシウム結合タンパク質の精製のための方法を提供する。イオン誘発性立体構造変化を修正するために、化学架橋およびその後のサイズ排除クロマトグラフィーによる複雑な分離は、下流の生物学的プロセスに対するタンパク質オリゴマー化の関連性を理解するのに有用なツールである。
開示事項
著者は何も開示していない。
謝辞
この研究は、ミュンスター大学医学部(KE121201からC.K.)とドイツ研究財団(DFG、Fo354/3-1からD.F.)の内壁内革新的な医学研究プログラムからの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| pET11b vector | Novagen | ||
| BL21(DE3) competent E. coli | New England Biolabs | C2527 | |
| 100x Non-essential amino acids | Merck | K 0293 | |
| 25% HCl | Carl Roth | X897.1 | |
| 4−20% Mini-PROTEAN TGX Protein Gels | BioRad | 4561093 | |
| Ampicillin sodium salt | Carl Roth | HP62.1 | |
| BS3 (bis(sulfosuccinimidyl)suberate) - 50 mg | ThermoFisher Scientific | 21580 | |
| Calciumchlorid Dihydrat | Carl Roth | 5239.1 | |
| Coomassie Briliant Blue R250 Destaining Solution | BioRad | 1610438 | |
| Coomassie Briliant Blue R250 Staining Solution | BioRad | 1610436 | |
| EasySep Human Monocyte Enrichment Kit | Stemcell | 19059 | Magnetic negative cell isolation kit |
| EDTA disodium salt dihydrate | Carl Roth | 8043.1 | |
| EGTA | Carl Roth | 3054.3 | |
| EndoLISA | Hyglos | 609033 | Endotoxin detection assay |
| Endotoxin-Free Ultra Pure Water | Sigma-Aldrich | TMS-011-A | Ultrapure water for preparation of endotoxin-free buffers |
| EndoTrap red | Hyglos | 321063 | Endotoxin removal resin |
| FBS (heat-inactivated) | Gibco | 10270 | |
| HBSS, no calcium, no magnesium | ThermoFisher Scientific | 14175053 | |
| Hepes | Carl Roth | 9105 | |
| Hepes (high quality, endotoxin testet) | Sigma-Aldrich | H4034 | |
| hTNF-alpha - OptEia ELISA Set | BD | 555212 | |
| IPTG (isopropyl-ß-D-thiogalactopyranosid) | Carl Roth | CN08.1 | |
| L-Glutamine (200 mM) | Merck | K 0282 | |
| LB-Medium | Carl Roth | X968.1 | |
| Lipopolysaccharides from E. coli O55:B5 | Merck | L6529 | |
| Pancoll, human | PAN Biotech | P04-60500 | Separation solution (density gradient centrifugation) |
| Penicillin/Streptomycin (10.000 U/mL) | Merck | A 2212 | |
| Phenyl Sepharose High Performance | GE Healthcare | 17-1082-01 | Resin for hydrophobic interaction chromatography |
| Polymyxin B | Invivogen | tlrl-pmb | |
| Protease inhibitor tablets | Roche | 11873580001 | |
| Q Sepharose Fast Flow | GE Healthcare | 17-0510-01 | Resin for anion-exchange chromatography |
| RoboSep buffer | Stemcell | 20104 | Cell separation buffer (section 5.1.4) |
| RPMI 1640 Medium | Merck | F 1215 | |
| Sodium chloride (NaCl) | Carl Roth | 3957.2 | |
| Sodium hydroxide | Carl Roth | P031.1 | |
| Tris Base | Carl Roth | 4855.3 | |
| Zinc chloride | Carl Roth | T887 | |
| Labware | |||
| 0,45 µm syringe filter | Merck | SLHA033SS | |
| 14 mL roundbottom tubes | BD | 352059 | |
| 2 L Erlenmyer flask | Carl Roth | LY98.1 | |
| 24 well suspension plates | Greiner | 662102 | |
| 5 L measuring beaker | Carl Roth | CKN3.1 | |
| 50 mL conical centrifuge tubes | Corning | 430829 | |
| 50 mL high-speed centrifuge tubes | Eppendorf | 3,01,22,178 | |
| Amicon Ultra-15 Centrifugal Filter Unit MWCO 3 kDa | Merck | UFC900324 | |
| Amicon Ultra-15 Centrifugal Filter Unit MWCO 50 kDa | Merck | UFC905024 | |
| Culture dish (100 mm) | Sarstedt | 83.3902 | |
| Dialysis Tubing Closures | Spectrum | 132738 | |
| EasySep magnet 'The Big Easy` | Stemcell | 18001 | |
| Fraction collector tubes 5 mL | Greiner | 115101 | |
| Lumox film, 25 µm, 305 mm x 40 m | Sarstedt | 94,60,77,316 | Film for monocyte culture plates |
| Spectra/Por Dialysis Membrane (3.5 kDa) | Spectrum | 132724 | |
| Steritop filter unit | Merck | SCGPT01RE | |
| Equipment | |||
| 37 °C Incubator (with shaking) | New Brunswick Scientific | Innova 42 | |
| ÄKTA purifier UPC 10 | GE Healthcare | FPLC System | |
| Fraction collector | GE Healthcare | Frac-920 | |
| Centrifuge (with rotor A-4-81) | Eppendorf | 5810R | |
| Fixed angle rotor | Eppendorf | F-34-6-38 | |
| Mini Protean Tetra Cell | BioRad | 1658000EDU | |
| NanoPhotometer | Implen | P330 | |
| Sonicator | Brandelin | UW2070 | |
| Fluorescence reader | Tecan | infinite M200PRO | |
| pH meter | Knick | 765 |
参考文献
- Liston, A., Masters, S. L. Homeostasis-altering molecular processes as mechanisms of inflammasome activation. Nature Reviews Immunology. 17 (3), 208-214 (2017).
- Kessel, C., Holzinger, D., Foell, D. Phagocyte-derived S100 proteins in autoinflammation: putative role in pathogenesis and usefulness as biomarkers. Clinical Immunology. 147 (3), 229-241 (2013).
- Baker, T. M., Nakashige, T. G., Nolan, E. M., Neidig, M. L. Magnetic circular dichroism studies of iron(ii) binding to human calprotectin. Chemical Science. 8 (2), 1369-1377 (2017).
- Nakashige, T. G., Zhang, B., Krebs, C., Nolan, E. M. Human calprotectin is an iron-sequestering host-defense protein. Nature Chemical Biology. 11 (10), 765-771 (2015).
- Nakashige, T. G., Zygiel, E. M., Drennan, C. L., Nolan, E. M. Nickel Sequestration by the Host-Defense Protein Human Calprotectin. Journal of the American Chemical Society. 139 (26), 8828-8836 (2017).
- Cunden, L. S., Gaillard, A., Nolan, E. M. Calcium Ions Tune the Zinc-Sequestering Properties and Antimicrobial Activity of Human S100A12. Chemical Science. 7 (2), 1338-1348 (2016).
- Moroz, O. V., et al. Structure of the human S100A12-copper complex: implications for host-parasite defence. Acta Crystallographica Section D, Biological Crystallography. 59 (Pt 5), 859-867 (2003).
- Moroz, O. V., Blagova, E. V., Wilkinson, A. J., Wilson, K. S., Bronstein, I. B. The crystal structures of human S100A12 in apo form and in complex with zinc: new insights into S100A12 oligomerisation. Journal of Molecular Biology. 391 (3), 536-551 (2009).
- Korndorfer, I. P., Brueckner, F., Skerra, A. The crystal structure of the human (S100A8/S100A9)2 heterotetramer, calprotectin, illustrates how conformational changes of interacting alpha-helices can determine specific association of two EF-hand proteins. Journal of Molecular Biology. 370 (5), 887-898 (2007).
- Moroz, O. V., et al. Both Ca2+ and Zn2+ are essential for S100A12 protein oligomerization and function. BMC Biochemistry. 10, 11(2009).
- Baudier, J., Glasser, N., Gerard, D. Ions binding to S100 proteins. I. Calcium- and zinc-binding properties of bovine brain S100 alpha alpha, S100a (alpha beta), and S100b (beta beta) protein: Zn2+ regulates Ca2+ binding on S100b protein. Journal of Biological Chemistry. 261 (18), 8192-8203 (1986).
- Dell’Angelica, E. C., Schleicher, C. H., Santome, J. A. Primary structure and binding properties of calgranulin C, a novel S100-like calcium-binding protein from pig granulocytes. Journal of Biological Chemistry. 269 (46), 28929-28936 (1994).
- Vogl, T., et al. S100A12 is expressed exclusively by granulocytes and acts independently from MRP8 and MRP14. Journal of Biological Chemistry. 274 (36), 25291-25296 (1999).
- Hofmann, M. A., et al. RAGE mediates a novel proinflammatory axis: a central cell surface receptor for S100/calgranulin polypeptides. Cell. 97 (7), 889-901 (1999).
- Foell, D., et al. Proinflammatory S100A12 Can Activate Human Monocytes via Toll-like Receptor 4. American Journal of Respiratory and Critical Care Medicine. 187 (12), 1324-1334 (2013).
- Kessel, C., et al. Calcium and zinc tune autoinflammatory Toll-like receptor 4 signaling by S100A12. Journal of Allergy and Clinical Immunology. 142 (4), 1370-1373 (2018).
- Armaroli, G., et al. Monocyte-Derived Interleukin-1beta As the Driver of S100A12-Induced Sterile Inflammatory Activation of Human Coronary Artery Endothelial Cells: Implications for the Pathogenesis of Kawasaki Disease. Arthritis & Rheumatology. 71 (5), 792-804 (2019).
- GE Healthcare. Strategies for Protein Purification. Handbook. , Freiburg, Germany. (2010).
- Jackson, E., Little, S., Franklin, D. S., Gaddy, J. A., Damo, S. M. Expression, Purification, and Antimicrobial Activity of S100A12. Journal of Visualized Experiments. (123), (2017).
- Kiss, B., Ecsedi, P., Simon, M., Nyitray, L. Isolation and Characterization of S100 Protein-Protein Complexes. Methods in Molecular Biology. 1929, 325-338 (2019).
- Magalhaes, P. O., et al. Methods of endotoxin removal from biological preparations: a review. Journal of Pharmacy and Pharmaceutical Sciences. 10 (3), 388-404 (2007).
- Petsch, D., Anspach, F. B. Endotoxin removal from protein solutions. Journal of Biotechnology. 76 (2-3), 97-119 (2000).
- Heilmann, R. M., Suchodolski, J. S., Steiner, J. M. Purification and partial characterization of canine S100A12. Biochimie. 92 (12), 1914-1922 (2010).
- Hung, K. W., Hsu, C. C., Yu, C. Solution structure of human Ca2+-bound S100A12. Journal of Biomolecular NMR. 57 (3), 313-318 (2013).
- Endotoxin Removal. Application Note - Sartorius Stedim Biotech. , (2010).
- Hogasen, A. K. M., Abrahamsen, T. G. Polymyxin-B Stimulates Production of Complement Components and Cytokines in Human Monocytes. Antimicrobial Agents and Chemotherapy. 39 (2), 529-532 (1995).
- Valentinis, B., et al. Direct effects of polymyxin B on human dendritic cells maturation - The role of I kappa B-alpha/NF-kappa B and ERK1/2 pathways and adhesion. Journal of Biological Chemistry. 280 (14), 14264-14271 (2005).
- Teuber, M., Miller, I. R. Selective Binding of Polymyxin-B to Negatively Charged Lipid Monolayers. Biochimica Et Biophysica Acta. 467 (3), 280-289 (1977).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved