Method Article
В Vivo Иммунофлуоресценция Локализация для оценки терапевтического и диагностического антитела биораспределения в онкологических исследований
В этой статье
Резюме
Метод локализации иммунофлуоресценции in vivo (IVIL) может быть использован для изучения биораспределения антител и антител в vivo для онкологических целей в живых организмах, используя сочетание таргетинга опухоли in vivo и иммунодефицита ex vivo Методы.
Аннотация
Моноклональные антитела (mAbs) являются важными инструментами в выявлении, диагностике и лечении рака. Они используются для распутывания роли белков в опухолевом игенезе, могут быть направлены на раковые биомаркеры, позволяющие выявлять и характеризовать его, и могут быть использованы для терапии рака в качестве mAbs или антител-наркотики, чтобы активировать клетки иммунного эффектора, ингибировать сигнальные пути, или непосредственно убить клетки, несущие конкретный антиген. Несмотря на клинические достижения в разработке и производстве новых и высокоспецифических mAbs, диагностическое и терапевтическое применение может быть нарушено сложностью и неоднородностью микроокружения опухоли. Таким образом, для развития эффективных антител на основе терапии и диагностики, имеет решающее значение для оценки биораспределения и взаимодействия антител на основе конъюгировать с живой микросреды опухоли. Здесь мы описываем In Vivo Иммунофлуоресценция Локализация (IVIL) как новый подход к изучению взаимодействия антител на основе терапии и диагностики в in vivo физиологических и патологических условиях. В этом методе, терапевтические или диагностические антиген-специфические антитела внутривенно вводят в vivo и локализованы ex vivo со вторичным антителом в изолированных опухолях. IVIL, таким образом, отражает in vivo биораспределение антител на основе наркотиков и целевых агентов. Описаны два применения IVIL, оценивающих биораспределение и доступность контрастных агентов на основе антител для молекулярной визуализации рака молочной железы. Этот протокол позволит будущим пользователям адаптировать метод IVIL для своих собственных исследовательских приложений на основе антител.
Введение
Моноклональные антитела (mAb) являются крупными гликопротеином (приблизительно 150 кДа) суперсемейства иммуноглобулина, которые выделяются В-клетками и имеют первичную функцию в иммунной системе для выявления и либо ингибирования биологической функции, либо знака для разрушение, бактериальных или вирусных патогенов, и может распознать ненормальное выражение белка на раковых клетках1. Антитела могут иметь чрезвычайно высокое сродство к их специфическим эпитопов вплоть до фемтомолярных концентраций, что делает их весьма перспективными инструментами в биомедицине2. С развитием технологии гибридомы Мильштейном и Кёлером (награжден Нобелевской премией в 1984 году), производство mAbs стало возможным3. Позже, человеческие mAbs были созданы с использованием технологии фагового дисплея или трансгенных штаммов мыши и революционизировали их использование в качестве новых исследовательских инструментов и терапевтических средств4,5.
Рак является проблемой здравоохранения во всем мире и основной причиной смерти, создающих необходимость новых подходов к профилактике, выявлению и терапии6. На сегодняшний день mAbs позволили вывести из роли генов и их белков в tumorigenesis и, когда направлены против рака биомаркеров, может позволить обнаружение опухоли и характеристики для стратификации пациента. Для терапии рака, биспецифические mAbs, антитела-наркотики конъюгирует, и меньше фрагменты антител разрабатываются в качестве терапии, и для целевой доставки наркотиков для повышения терапевтической эффективности7. Кроме того, антитела служат для биомаркера ориентации контрастных агентов для молекулярных методов визуализации, таких как флуоресцентная хирургия, фотоакустическая (PA) визуализация, ультразвуковая (US) молекулярная визуализация, и клинически используемые позитронное излучение томография (ПЭТ) или однофотонные эмиссионные компьютерная томография (SPECT)8. Наконец, антитела также могут быть использованы в качестве тераностических агентов, позволяющих стратификации пациентов и мониторинга ответов для целевых методов лечения9. Таким образом, новые mAbs начинают играть важную роль в выявлении рака, диагностике и лечении.
Несмотря на критические достижения в разработке и производстве новых и высокоспецифических mAbs, диагностическое и терапевтическое применение может оказаться неэффективным из-за сложности опухолевой среды. Взаимодействия антител зависят от типа эпитопа,т.е. ли это линейное или конформационное10. В дополнение к признанию антигенов, антитела должны преодолеть естественные барьеры, такие как стенки сосудов, базальные мембраны, и строма опухоли для достижения целевых клеток, выражающих антиген. Антитела взаимодействуют с тканью не только через переменный фрагмент антигена связывания (Fab) домена, но и через постоянный кристаллический фрагмент (Fc), который далее приводит к вне участка взаимодействия11. Ориентация также осложняется неоднородным выражением опухолевых маркеров по всей опухолевой массе и неоднородности в опухолевой васкуляризации и лимфатической системы12,13. Кроме того, микроокружение опухоли состоит из связанных с раком фибробластов, которые поддерживают опухолевые клетки, опухолевые иммунные клетки, которые подавляют противоопухолевые иммунные реакции, и опухолевый эндотелий, который поддерживает транспортировку кислорода и питательных веществ, все которые мешают проникновению, распространению и доступности антител на основе терапии или диагностики. В целом, эти соображения могут ограничить терапевтическую или диагностическую эффективность, уменьшить реакцию на лечение, и может привести к устойчивости к опухоли.
Поэтому для развития эффективных антител на основе терапии и диагностики, имеет решающее значение для оценки биораспределения и взаимодействия антител на основе конъюгировать в микроокружении опухоли. В настоящее время в доклинических исследованиях экспрессия маркеров в моделях исследования опухолей анализируется ex vivo по иммунофлуоресценции (ИФ) окрашивания опухолевых секций14. Стандартное окрашивание ЕСЛИ выполняется с первичными маркерными антителами, которые затем подчеркиваются вторичными флуоресцентно помеченными антителами на ломтиках опухолевой ткани ex vivo, которые были выделены от животного. Этот метод подчеркивает статическое расположение маркера во время фиксации тканей и не дает представления о том, как антитела на основе терапии или диагностики могут распространять или взаимодействовать в физиологических условиях. Молекулярная визуализация по ПЭТ, SPECT, США, и PA может предоставить информацию о антитела химки-конъюгированный контрастный агент распределения в живых доклинических моделей8,15. Поскольку эти методы визуализации являются неинвазивными, продольные исследования могут быть выполнены и чувствительные к времени данные могут быть собраны с минимальным количеством животных в группе. Однако эти неинвазивные подходы к молекулярной визуализации недостаточно чувствительны и не имеют достаточного разрешения для локализации распределения антител на клеточном уровне. Кроме того, физические и биологические характеристики первичного антитела могут быть резко изменены путем спряжения контрастного агента16.
Для того, чтобы принять in vivo физиологических и патологических условий во внимание, как антитела на основе терапии и диагностики взаимодействуют в опухолевой среде и получить высокое разрешение клеточной и даже суб-клеточной распределения профили неконъюгированных антител, мы предлагаем if подход, считается В Иво иммунофлуоресценции Локализация (IVIL), в котором антиген-специфические антитела внутривенно вводятся в vivo. Антитела на основе терапевтических или диагностических, действуя в качестве основного антитела, циркулирует в функциональных кровеносных сосудов и связывается с его целевой белок в высокоточной, живой среде опухоли. После изоляции опухолей с первичными антителами, вторичное антитело используется для локализации накопленных и сохраненных конъюгатов антител. Этот подход аналогичен ранее описанного подхода IF гистологии инъекционных флуоресцентно помеченных антител17. Хотя здесь, использование неконъюгированных антител позволяет избежать потенциального изменения в характеристиках биораспределения, вызванных модификацией антител. Кроме того, применение ex vivo флуоресцентных вторичных антител позволяет избежать возможной потери сигнала флуоресценции во время сбора и обработки тканей и обеспечивает усиление интенсивности флуоресценции. Наш подход к маркировке отражает биораспределение в vivo антител на основе лекарств и целевых агентов и может обеспечить важную информацию для разработки новых диагностических и терапевтических агентов.
Здесь мы описываем два применения метода IVIL, применяемых в предыдущих исследованиях, исследующих биораспределение и доступность контрастных агентов на основе антител для молекулярной визуализации подходов к обнаружению рака молочной железы. Во-первых, биораспределение антител ближнего инфракрасного красителя конъюгированных (анти-B7-H3 антитела связаны с ближней инфракрасной флуоресценции красителя, индоцианин зеленый, B7-H3-ICG) и изотип ный агент управления (Iso-ICG) для флуоресценции и фотоакустических молекулярных изображение исследуется18. Метод этого приложения описан в протоколе. Далее, результаты биораспределения конформистски чувствительных антител к нетрин-1, как правило, не обнаруживаемые с помощью традиционных IF изображений, используемых с ультразвуковой молекулярной визуализации, количественно и представлены в репрезентативных результатах19. В конце этого протокола документ, читатели должны чувствовать себя комфортно принятия метода IVIL для своих собственных антител на основе научно-исследовательских приложений.
протокол
Все описанные здесь методы были одобрены Институциональной административной группой по лабораторному уходу за животными (APLAC) Стэнфордского университета.
1. Трансгенная модель мыши развития рака молочной железы
- Наблюдайте мышей от пожеланной модели рака для соотвествующего роста тумора через palpation или измерение caliper перед продолжать.
ПРИМЕЧАНИЕ: Здесь была использована трансгенная модель морина развития рака молочной железы (FVB/N-Tg (MMTV-PyMT)634Mul/J) (MMTV-PyMT). Эти животные спонтанно развиваютинь инвазивных карциномы молочной железы между 6 и 12 недель в каждой молочной железы20. Нормальные молочные железы были использованы в качестве контроля от трансген-отрицательных, возрастных littermates.
2. Внутривенная инъекция специфических и неспецифических антител
- Очистите кролика анти-мышь B7-H3 и кроликig изотип антител управления на опреснительной колонке (например, PD-10) для удаления консервантов и буферов хранения в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Некоторые антитела, возможно, потребуется дальнейшее очищение с Protein-A агарозные бусы на основе протокола21. - Аликвот дозировки 33 мкг каждого антитела конъюгироваться в отдельных микроцентрифуговых труб.
ПРИМЕЧАНИЕ: Дозировка вводимого агента может варьироваться в зависимости от применения и соответствует дозам, в которых обычно используется конъюгированные антитела. Концентрация растворов антител необходима, если объем составляет более 100 л для безопасности животных. - В нужную точку времени перед сбором тканей, здесь 96 ч, анестезирует опухоль подшипника животного с 2% изофлуран течет в кислороде на 2 л / мин, и место на 37 градусов по Цельсию стадии. Сделайте щепотку ног, чтобы убедиться, что надлежащий уровень анестезии был достигнут до процедуры.
- Чтобы подготовиться к прививочению хвостовой вены растворами антител, дезинфицировать хвост животного, трижды вытирая спиртом салфетку. Разпьйте хвостовые вены, прогрев тепловой площадкой примерно на 30 с. Избегайте нагрева всего животного. Протрите хвост еще раз с алкоголем протрите после удаления тепловой площадки.
- Используя 27G хвост вены катетер, вставьте бабочку иглы в одном из двух боковых вен хвоста и тщательно исправить хвост с вставленной иглой на сцену с куском хирургической ленты.
ПРИМЕЧАНИЕ: Видимый приток крови в катетер указывает на правильное расположение иглы в хвостовой вены. - Промыть катетер с 25 л стерильного фосфата буферного солей (PBS), а затем ввести раствор антитела в катетер с помощью инсулиновых шприцев. Промыть катетер еще раз с 25 Зл стерильных PBS.
- Снимите иглу с хвоста и нанесите давление, чтобы остановить кровотечение.
- Выключите анестезию и наблюдайте за животным до полного пробуждения при любых признаках бедствия.
3. Сбор и подготовка опухолевых тканей мишени
- В желаемый момент времени гуманно эвтаназии животное в соответствии с приемлемой институциональной процедурой, здесь, путем постепенного вдыхания 100% CO2 из сжатого бензобака с камерным смещением потока 10-30% объема / мин.
ПРИМЕЧАНИЕ: Некоторые применения метода IVIL требуют эвтаназии сердечной перфузии с PBS, чтобы удалить свободно циркулирующих антител19,22. - После подтверждения гуманной эвтаназии через прекращение дыхательного и сердечного движения, отсутствие ответа на щепотку ног и седение слизистых оболочек, акцизные опухолевые ткани с помощью хирургических ножниц и щипцы следующим образом:
- Положите мышь в положение на спине и захватывая только внешний слой кожи между набором молочных желез ближе всего к хвосту(5-й) с щипками, сделать небольшой разрез с парой хирургических ножниц.
- Введите закрытые ножницы в разрез и медленно откройте кончик, чтобы тщательно отделить кожу от основной мембраны брюшной стенки, сохраняя ее нетронутой.
- Сделайте вертикальный разрез вверх по животу, продолжая отделять кожу от внутренней мембраны. Между3-й и4-й молочных желез, сделать горизонтальный разрез через живот, чтобы опрокидывая кожу и визуализации молочных желез.
ПРИМЕЧАНИЕ: Опухоли молочной железы и железы расположены поверхностно под кожей. - Схватив каждую опухоль или нормальную железу щипками, тщательно обрезайте прикрепленную кожу хирургическими ножницами.
- Поместите вырезанные ткани в ткани одноразовые базовые формы, предварительно помеченные и заполненные оптимальной температурой резки (OCT) встраивая среду и быстро заморозите формы путем размещения на сухом льду. Для изучения внецелевой доставки, акциз других тканей илиорганов, представляющих интерес (например, печени или легких).
ПРИМЕЧАНИЕ: Чтобы приостановить протокол в этой точке, храните замороженные блоки ткани при -80 градусов по Цельсию до тех пор, пока не будет готово к продолжению. - Используя криостат, раздел замороженных тканей блоков на 10 мкм толщина и место смежных разделов на предварительно помечены стекол стельки.
ПРИМЕЧАНИЕ: Чтобы приостановить протокол в этой точке, храните слайды при -80 градусов по Цельсию до тех пор, пока не будет готово к продолжению.
4. Протокол окрашивания Ex vivo
ПРИМЕЧАНИЕ: Для количественного сравнения флуоресцентных микроскопических изображений все слайды окрашены в то же время с теми же подготовленными решениями.
- Промыть замороженные ткани слайды с комнатной температурой PBS в течение 5 минут, чтобы удалить OCT.
- Размазать участки тканей гидрофобным барьерным пером, чтобы уменьшить объем растворов, необходимых во время окрашивания.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не позволить перо для запуска над образцами ткани, как это может либо удалить ткани из слайда или предотвратить надлежащее окрашивание на пораженной части ткани. Не допускайте обезвоживания секций тканей в любой момент. - Зафиксировать участки ткани с 4% раствором параформальдегида в течение 5 мин.
- Промыть слайды в PBS в течение 5 мин.
- Пермяки ткани разделов с 0,5% Тритон-X 100 в PBS в течение 15 минут.
- Промыть слайды в PBS в течение 5 мин.
- Блок тканей с 3% w/v бычьей сыворотки альбумина (BSA) и 5% v/v козьей сыворотки, как в PBS (блокирующий раствор) для 1 ч при комнатной температуре.
ПРИМЕЧАНИЕ: Матч блокирующего раствора сыворотки к вторичному антител хозяина животных. - Промыть слайды в PBS в течение 5 мин.
- Инкубировать секции с учета первичных антител по желанию, возможно, общие ядерные (например, DAPI), сосудистые (например, CD31), или цитоплазмический маркер (например, актин). Здесь, крыса анти-мышь CD31 (сосудистый маркер) на 1:100 разбавления был использован в соответствии с инструкциями производителя в блокирующем растворе ночь на 4 кВ защищены от обезвоживания на слайд лоток.
ПРИМЕЧАНИЕ: Не добавляйте дополнительные первичные антитела или антитела конъюгировать. Конъюгет, который был введен и позволил накапливаться в тканях in vivo выступать в качестве основного антитела. - Промыть слайды в PBS в течение 5 минут три раза, изменяя PBS каждый раз.
- Инкубировать слайды со вторичными антителами для обозначения первичных антител. Для этого приложения, визуализировать анти-B7-H3 антитела с помощью AlexaFluor-546 конъюгированных козы анти-кролик антитела (1:200 разбавления, оптимизированные в соответствии с инструкциями производителя) и CD31 с AlexaFluor-488 коза анти-крысы вторичного антитела (1:200 разбавления, оптимизированного в соответствии с инструкциями производителя) в блокирующем растворе, защищенном от света и обезвоживания на слайд-подносе, на 1 ч при комнатной температуре.
ПРИМЕЧАНИЕ: Вторичные антитела от такого же животного хозяина но сопрягают сродство вторичных антител к виду хозяина соответственно главным образом антитела. Слайды защищены от света с этой точки и далее. - Промыть слайды в PBS в течение 5 минут три раза, изменяя PBS каждый раз.
- Нанесите одну каплю монтажной среды в центр нарезанного нарезанного ткани и аккуратно поместите крышку, избегая захвата пузырьков воздуха.
- Запечатайте края крышки прозрачным лаком для ногтей и дайте высохнуть.
ПРИМЕЧАНИЕ: Чтобы приостановить протокол на срок до недели в этой точке, храните слайды при -20 градусов по Цельсию до тех пор, пока не будет готово к продолжению.
5. Конфокальная микроскопическая визуализация и количественный анализ изображений
ПРИМЕЧАНИЕ: Подготовка конфокального микроскопа и параметров изображения будет зависеть от используемой конфокальной системы. Микроскоп, используемый здесь, был приобретен на коммерческой цене (например, система «Зейсс ЛСМ 510 Мета»), а связанное с ним программное обеспечение для приобретения использовалось (например, дзэн 2009). Тем не менее, многие из этих шагов будут применяться к любой конфокальный микроскоп и взять на себя основные знания конфокальной микроскопии.
- После того, как система была включена и разогрета, выберите нужную цель; здесь была использована цель 20x (числовая диафрагма 0.8).
- Загрузите положительный слайд управления, coverslip вниз, чтобы обеспечить настройку оптимизации для самого яркого сигнала. Изображения в красном канале, сосредоточить систему на образец в режиме Live изображений.
- Для каждого используемого лазерного канала оптимизируйте интенсивность лазера, мастер-прибыль и размер пинхола следующим образом:
- Переключитесь в непрерывный режим для визуализации.
- Оптимизируйте интенсивность лазера (который управляет силой лазера) и уравновешивает (мастер) (который управляет напряжением для трубки photomultiplier) решетки скольжения пока контролирующ гистограмму взгляда вверх (LUT). Отрегулируйте эти две настройки до тех пор, пока динамический диапазон гистограммы не будет заполнен без насыщения пикселей.
ПРИМЕЧАНИЕ: Если интенсивность лазера слишком высока photobleaching будет происходить. Если Gain (Master) слишком высок, изображение станет шумным. В идеале, Gain (Master) будет в середине своего диапазона. - Установите пинхол на 1 воздушный блок (AU), который дает самое высокое разрешение и самый тонкий z-ломтик.
- Сдвиньте цифровой offset бар, чтобы свести к минимуму шум пол на lut гистограммы для истинного черного фона.
ПРИМЕЧАНИЕ: После того, как настройки микроскопии оптимизированы для каждого лазерного канала и цели, держать их постоянными на протяжении всего сеанса изображения и для визуализации всех слайдов, чтобы обеспечить количественное сравнение между слайдами.
- Под вкладкой Режим приобретения, под Усреднение, выберите желаемое число и bit Глубина. Нажмите кнопку «Оптимальный», чтобы установить оптимальный размер пикселей.
- Используйте кнопку приобретения Snap для сбора высококачественного изображения. Здесь, случайные поля зрения были выбраны изнутри опухоли, но и другие области, представляющие интерес могут применяться для различных приложений (сосуды, опухоли поля, глубина проникновения и т.д.)
- Сохранить файлы изображений в формате, используемом конфокальным программным обеспечением (здесь, ".lsm") для автономной обработки и количественной оценки.
ПРИМЕЧАНИЕ: Если не все слайды изображены во время одного сеанса, сохраните настройки и перезагрузите их при последующих посещениях, хотя повторное изображение одного и того же слайда не рекомендуется из-за фотоотбеления. - Выполните количественные измерения интенсивности флуоресценции. Открыть Фиджи (Фиджи Просто ImageJ программного обеспечения)19,23 и загрузить файл изображения .lsm, перетащив на состояние бар.
- Разделите данные цветного канала. Перейти к изображению
- Предварительно обработать флуоресценции изображения по мере необходимости, т.е. вычесть фоновый сигнал (Процесс »gt; Вычесть фон)или уменьшить шум с помощью метода фильтрации.
- Сегмент цветной канал, соответствующий справочному белку (сосудистый, ядерный, клеточный пятно), установив порог на интенсивность сигнала(Изображение
ПРИМЕЧАНИЕ: Ручное пороговое значение вводит субъективность в анализ изображений, поэтому использование автоматизированного алгоритма порогового значения или ссылки на гистограммы изображений делает результаты анализа изображений менее предвзятыми. - Используйте этот порог, чтобы создать двоичную маску (Процесс
- Измерение и этикетка ROIs в маске (Анализ
- Применить ROIs к цвету канала, соответствующего антител интерес (Нажмите изображение канала, Анализ Это позволит применить ROIs маски к изображению антител и обеспечить измерения изображения для разделов меток в окне результатов. Сохранить результаты окна (Файл
- Рассчитайте желаемую статистику интереса, например, средняя интенсивность флуоресценции, описанную здесь24.
- Выполните все этапы обработки, идентичные каждому изображению в наборе слайдов. Создайте макрос, чтобы автоматически сделать это для больших пакетовизображений 23.
- Для отображения изображения только после количественных измерений, применять качественные корректировки изображения для оптимизации визуализации моделей биораспределения путем корректировки минимального, максимума, яркости и контраста с теми же уровнями на всех слайдах (Изображение Яркость /Контрастность).
- Преобразуйте тип изображения (Изображение , Typesgt; RGB Цвет) и сохранить файлы в безпотеревом типе изображения, таких как .tiff (Файл
Результаты
Метод IVIL был использован здесь для изучения биораспределения in vivo и взаимодействия тканей B7-H3-ICG и Iso-ICG, позволяя агентам после внутривенной инъекции в живое животное взаимодействовать с целевой тканью в течение 96 ч, а затем, как только ткани собраны, чтобы выступать в качестве основных антител во время ex vivo иммуносохранения. Метод IVIL также сравнивали со стандартным ex vivo IF окрашиванием тканей для маркера B7-H3. Нормальные молочные железы не выражают маркер B7-H3, подтвержденный в ex vivo, стандартное окрашивание IF, и не накапливают антитела через другие пассивные механизмы, и, следовательно, никакого накопления B7-H3-ICG или Iso-ICG не было обнаружено, отрицательного результата(рисунок 1, верхний ряд). Тем не менее, опухоли мюрина молочной железы выражают B7-H3 как в сосуде, так и в эпителии (что подтверждается стандартным случаем окрашивания), и IVIL смог выделить агент B7-H3-ICG, который сильно накапливался на сосуде и смог частично экстравировать от сосуды, чтобы связаться с раковыми клетками себя, хотя в неоднородном порядке по сравнению с равномерной распределения B7-H3 маркера по всей опухоли, также показано на рисунке 1, нижний ряд. Кроме того, несмотря на то, что агент Iso-ICG не имеет молекулярной специфичности, все равно было показано, что он накапливается неспецифическим способом, из-за взаимодействия Fc, плохого межстициального дренажа и усиленного эффекта проницаемости и удержания в молочной момичности опухолей (рисунок 1). Это различие выделяется в биораспределении моделей показано между двумя агентами, и далее повышает конкретные результаты связывания конкретного агента антитела, и представляет два возможных результатов положительного результата.
Репрезентативные результаты B7-H3-ICG свидетельствуют о том, как метод IVIL может быть использован в качестве качественного метода для описания общего конъюгированного биораспределения антител/антител. Однако иногда может потребоваться более количественное толкование или антитело может иметь весьма чувствительный, конформивно-специфический связующий потенциал. В таких ситуациях IVIL также может предоставить нужную информацию. Во втором примере, в котором экспрессия белка нетрин-1 в опухолевых тканях и его со-локализация с CD31-положительным эндотелием опухоли должны были быть изучены, метод IVIL также успешно применяется19.
Netrin-1 является секретом 65 kDa белка, который чрезмерно выражен в некоторых видах рака, таких как метастатический рак молочной железы25,26. Для того чтобы начать молекулярный подход изображения для netrin-1, наличие in vivo протеина должно быть обусловлено19. Кроме того, как анти-нетрин-1 антитела не имеют достаточного сродства к его антигена после фиксации ткани, альтернативный протокол окрашивания к классической иммуногистохимии или IF окрашивания было необходимо и IVIL был реализован. Гуманизированные анти-нетрин-1 антитела и человека IgG изотип управления антитела были внутривенно введены 24 ч до сердечной перфузии и опухоли сбора. Сердечная перфузия была применена для уменьшения неспецифического фонового окрашивания в сосуды и для повышения обнаружения значительного накопления антинетрин-1 антитела по сравнению с изоттипом контроля антитела сигнала, когда цель выражение ограничено. Опухолевые секции были помечены ex vivo с сосудами, подчеркивающими антитела против CD31 (антитела против мыши CD31(Таблица материалов)и флуоресцентные вторичные антитела, Alexa 488-соединенная коза анти-крыса IgG, 1:500 разбавления и Alexa Fluor 594- соединенные коза анти-человека IgG, 1:500 разбавления соответственно) были использованы для выявления анти-нетрин-1/изотип и анти-CD31 mAbs. Интенсивность флуоресценции сигнала анти-нетрин-1 и изотипа контроля антитела были количественно определить различия в окрашивании совместно локализованы с CD31. На рисунке 2 показано, что анти-нетрин-1 антитела специально накоплены в эпителиальной опухоли MMTV-PyMT опухоли молочной (положительный результат), в то время как не было сигнала в нормальных молочных желез (отрицательный результат). Антитела далее совместно локализовались с эндотелиальным маркером CD31. Сравнение с опухолями антител, вводимых изоттипами, и нормальными железами показало, что эпителиевельное накопление было специфическим для опухолевой ткани. Было накопление сигнала в эндотелиальных клетках как опухолей, так и нормальных желез из-за связывания netrin-1 (опухоли) и неспецифических взаимодействия FC (опухоли и нормальные молочные железы)11. Таким образом, требовалась количественная количественная оценка сигнала флуоресценции с помощью бинарной маски на основе CD31 и показала, что антивирус-1 антитела сигнала антитела манти-нетригина-1 был значительно выше, чем сигнал антитела множествного контроля в опухолевой ткани, что предполагает нетрин-1 специально накапливается в опухолевом эндотелии.

Рисунок 1 : Представитель конфокальных микрографов сравнения конкретных B7-H3 антитела-ICG конъюгированной и неспецифической изотип управления антитела-ICG конъюгировать локализацию в молочных желез, содержащих нормальные или ткани карциномы. (Вверху) Нормальный murine молочные железы от животного внутривенно вводят с 33 мкг Iso-ICG или B7-H3-ICG (красный) и противозапятнаны CD31 (зеленый) не показывая окрашивания конъюгирует антитела. Нормальные ткани, как было показано, не имеют выражения B7-H3 стандартным ex vivo IF окрашивания. (Внизу) Я не против. Инвазивные опухоли молочной железы у животного внутривенно вводят 33 мкг B7-H3-ICG или Iso-ICG (красный) и сосудистые контрокрашенные CD31 (зеленый), показывающие обширное, неоднородное окрашивание, хотя и с различными структурами распределения, как для B7-H3-ICG, так и для Агенты Iso-ICG. B7-H3-ICG сильно связывается с сосудами, первой точкой контакта in vivo, а затем способен экстравироваться от сосуды до неоднородного пятна опухолевого эпителия. Iso-ICG показывает неспецифическое накопление в опухолевых тканях. Стандартный ex vivo IF окрашивание показывает равномерное выражение маркера B7-H3 на эпителиальных и эндотелиальных клетках. желтый цвет указывает на совместно локализованный красный и зеленый сигнал канала. Шкала бар 100 мкм и последовательной между панелями. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
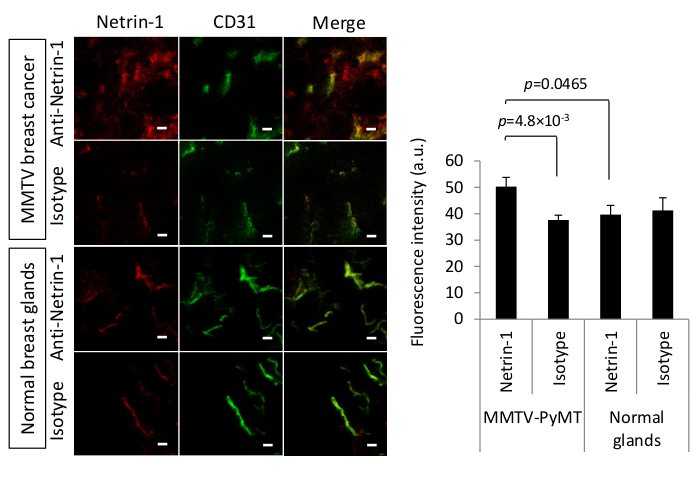
Рисунок 2 : In vivo иммунолокализация нетрина-1 при опухолях молочной железы MMTV-PyMT. (Слева) Представитель конфокальных микрографов метода IVIL для обнаружения недрин-1 выражение (красный) или изотип управления выражением (красный) в карциноме моурина и нормальных молочных желез. IVIL подтверждает эпителиальный сигнал для нетрин-1 в опухолях MMTV-PyMT, но не в нормальных молочных желез, и сильный нетрин-1 сигнал на эндотелиальных клеток (CD31 окрашивания, зеленый) в опухолях молочной железы и значительно слабее сигнал неттрина-1 в нормальных молочных желез. желтый цвет указывает на совместно локализованный красный и зеленый сигнал канала. Шкала баров означает 20 мкм. Для обнаружения белка нетрин-1 в опухолевом эндотелии, 100 мкг первичного гуманизированного NET1-H-mAb или 100 мкг человеческих антител контроля изотипа IgG были внутривенно введены 24 ч до сбора опухоли. Свободно циркулирующие антитела были удалены путем перфузии сердца с PBS и опухолевой ткани была изолирована, флэш-замороженные, и разделены на 15 мкм толщина на криостате. Эндотелиальные клетки были помечены первичной крысы анти-мышь CD31 антитела следуют вторичные Alexa 488-связанных коза анти-крыса IgG. Чтобы выявить первичное антитела ориентации netrin-1, вторичный Alexa Fluor 594-соединенный коза анти-человека IgG был использован. Чтобы избежать неспецифического взаимодействия козла вторичных антител, образцы тканей блокировались козьей сывороткой. (Справа) Бар график подчеркнув количественную оценку анти-нетрин-1 или изотип управления антитела сигнал, который colocalize s anti-CD31 антитела сигнала. Опухоли n-13 (из двух мышей) на группу MMTV-PyMT и N'7 молочных желез (одной мыши) на группу нормальных желез; Ошибки баров настоящее SEM; Двухгрупповые сравнения были проведены с T-тестом студента. Рисунок перепечатан с разрешения от 19 под лицензией creative Commons CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Этот метод имеет несколько важных шагов и требует потенциальных изменений для обеспечения успешной реализации. Во-первых, дозировка и сроки антитела / антитела конъюгированных внутривенных инъекций должны быть адаптированы к конкретному применению. Как правило, дозы должны быть использованы, которые согласуются с тем, как антитела конъюгировать, как правило, используются, т.е., соответствующие дозы терапевтических антитела или антитела основе контрастного агента. Кроме того, следует тщательно просмотреть сроки сбора тканей-мишеней. Антитела и конъюгаты антител имеют более длительное время циркуляции, чем стандартные препараты и контрастные агенты, однако, они очень изменчивы и должны быть оптимизированы для желаемого применения, но рекомендуется, чтобы по крайней мере 24 ч время циркуляции27 . Во-вторых, во время сбора целевой ткани, может потребоваться внедрить метод интракардиального перфузии для удаления свободно циркулирующих антител из бассейна крови19. При взгляде на распределение опухоли B7-H3-ICG, было признано ненужным из-за достаточно длительного времени циркуляции (96 ч) и внесосудистой локализации агента. Однако для применения netrin-1 метода IVIL, перфузия сердца считалась уместной из-за эндотелиального выражения нетротин-1 и его относительно низкого уровня экспрессии. В-третьих, во время окрашивания ткани ex vivo необходимо запятнать любые слайды, которые будут сравниваться количественно в течение той же сессии и с теми же решениями, чтобы предотвратить нормальные межпакетные вариации. Убедитесь, что слайды должным образом промывают между шагами и гидрофобных перо решение не вступает в контакт с тканью, чтобы избежать неоптимального окрашивания. Наконец, во время конфокальной микроскопии, поддерживать те же настройки изображения между слайдами, чтобы обеспечить относительную количественную оценку и быстро работать, чтобы предотвратить фотоотбеление слайдов. Эти ключевые моменты повысят вероятность успешной реализации IVIL.
Есть несколько преимуществ метода IVIL. Во-первых, хотя метод аналогичен стандартным методам Если, эти два метода предоставляют значительно разную информацию. ЕСЛИ окрашивание указывает на анатомическое расположение молекулярных маркеров в ткани в данный момент времени (когда ткань была собрана и зафиксирована). Тем не менее, IVIL предоставляет информацию о том, как антитела или антитела конъюгированные, как показано на локализации B7-H3-ICG, является распределение и взаимодействие, будь то конкретные или неспецифические накопления, интернализации, или удержания в цели Ткани. Это имеет решающее значение для фармакокинетической / динамической и биораспределения исследований. Во-вторых, традиционные методы ЕСЛИ, временами, ограничены фиксацией тканей, которые могут вызвать искажение антигена или маскировку предотвращения связывания первичным антителом28. Таким образом, IVIL может быть полезным, когда стандартные ЕСЛИ окрашивания или иммуногистохимии неудачу. Метод IVIL можно считать дополнительным методом проверки активности антител in vivo, которые в противном случае были бы необнаружимы. Наконец, те, кто знаком с традиционными методами окрашивания ЕСЛИ, найдут метод простым в исполнении и будут иметь большинство необходимых материалов под рукой.
Метод IVIL имеет несколько ограничений. Во-первых, из-за необходимости усыпления животное для сбора целевых тканей, IVIL предоставляет информацию о биологическом взаимодействии только в один момент времени. Инъекция первичных антител или антител конъюгированных в различные моменты времени в различных животных позволит более широкое время окна информации о биораспределении и in vivo взаимодействия. Во-вторых, если пользователи не знакомы с in vivo животных методов, таких как внутривенная инъекция хвостовой вены или потенциальной интракардиальной перфузии, это может быть ограничение метода. Эти методы требуют квалифицированных сотрудников для выполнения надежно. Тем не менее, использование катетера во время инъекции хвостовой вены обеспечивает введение всей дозы, как надлежащее размещение иглы может быть подтверждено до инъекции. Кроме того, одной из альтернатив инъекции хвостовой вены, которая может быть рассмотрена, является ретроорбитальная инъекция, которая, как правило, имеет более высокий показатель успеха с менее опытным персоналом. Необходимость окрашивание и изображение всех тканей скользит в одной партии, чтобы обеспечить количественную оценку ограничивает количество образцов и маркеров, которые могут быть включены в одно исследование. Исследование, возможно, должны быть организованы в серийное окрашивание в разные дни и на смежных ломтиков ткани для сбора необходимой информации. Наконец, использование видовых антител, т.е. антимышечных антител в доклинических моделях, поднимает вопрос о неспецифическом фоновом окрашивании вторичных антител. Таким образом, использование видов-несовместимых первичных антител требуется, как представлено в этом исследовании, или флуоресцентно помечены видов соответствующих первичных антител должны быть использованы.
Метод IVIL полезен для биораспределения анализа диагностических и терапевтических антител для многих применений. Различные приложения для внутривенных антител или лиганд инъекций и анализа ткани ex vivo были зарегистрированы ранее и подтверждают интерес к широко ввести эту процедуру окрашивания. Робертсон и его коллеги помечены сосудистые элементы, такие как эндотелиальные капилляры и большие сосуды с внутривенными инъекциями lycopersicon esculentum agglutinin (томатный лектин)29. Техника была совместима с гистохимией и иммуноцитохимией и выявила сосудистые узоры и функциональные паренхимальные характеристики. Хотя, использование флуоресцентных лигандов было ограничено быстрой деградацией флуоресценции при инъекциях30. Как показано в протоколе IVIL, инъекция первичного антитела in vivo с последующей маркировкой ex vivo вторичным флуоресцентным антителом может быть более надежным подходом. Еще одно интересное применение этого типа in vivo IF окрашивания является маркировка внутрисосудистых лимфоцитов, как показано Андерсон и коллеги31. Внутривенно вводили антитела для обозначения лимфоцитов, локализованных в кровеносных сосудах, которые впоследствии были собраны и дополнительно обработаны для анализа цитометрии потока иммунологических маркеров. Наконец, для оценки доставки и гистологической локализации антител, которые были доставлены пациентам с плоскоклеточной карциномой головы и шеи (HNSCC), первое в человеке исследование распределения антител было выполнено с помощью системно вводят ближней инфракрасной флуоресцентно помечены терапевтических антител cetuximab-IRDye800CW32. Данные были сопоставлены с гистологическим анализом и показали, что флуоресцентный сигнал уменьшается с расстоянием от опухоли, подтверждающей специфичность. Хотя, терапевтическое антитело не достигло всех зон выражения антигена, специально наилучшим образом-дифференцированных зон тумора с высокими уровнями эпидермального приемного устройства фактора роста (EGFR) антигена. В современном контексте исследований рака упором на развитие целевых методов лечения и иммунотерапии, которые сталкиваются с сильной резистентностью и отсутствием эффективности, метод IVIL будет отличным инструментом для изучения распределения терапевтических антител таких как PD-1/PD-L-1 или HER233,34. Эти результаты чрезвычайно ценны для понимания того, почему целевая терапия эффективна в некоторых случаях, способствуя разработке новых подходов. В совокупности эти примеры подчеркивают потенциальную важность подхода IVIL.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим д-ра Эндрю Олсона (Стэнфордская служба микроскопии) за обсуждения и использование оборудования. Мы благодарим д-ра Juergen К. Виллманн за его наставничество. Это исследование было поддержано грантом NIH R21EB022214 (KEW), грантом на обучение NIH R25CA118681 (KEW) и NIH K99EB023279 (KEW). Служба микроскопии нейронауки в Стэнфорде была поддержана NIH NS069375.
Материалы
| Name | Company | Catalog Number | Comments |
| Animal Model | |||
| FVB/N-Tg(MMTV-PyMT)634Mul/J | The Jackson Laboratory | 002374 | Females, 4-6 weeks of age |
| Animal Handling Supplies | |||
| 27G Catheter | VisualSonics | Please call to order | Vevo MicroMarker Tail Vein Access Cannulation Kit |
| Alcohol Wipes | Fisher Scientific | 22-246073 | |
| Gauze Sponges (4" x 4" 16 Ply) | Cardinal Health | 2913 | |
| Heat Lamp | Morganville Scientific | HL0100 | |
| Isoflurane | Henry Schein Animal Health | 29404 | |
| Ophthalmic Ointment | Fisher Scientific | NC0490117 | |
| Surgical Tape | 3M | 1530-1 | |
| Tissue Collection | |||
| Disposable Base Molds | Fisher Scientific | 22-363-556 | |
| Optimal Cutting Temperature (OCT) Medium | Fisher Scientific | 23-730-571 | |
| Surgical London Forceps | Fine Science Tools | 11080-02 | |
| Surgical Scissors | Fine Science Tools | 14084-08 | |
| Antibodies | |||
| AlexaFluor-488 goat anti-rat IgG | Life Technologies | A-11006 | |
| AlexaFluor-546 goat anti-rabbit IgG | Life Technologies | A-11010 | |
| AlexaFluor-594 goat anti-human IgG | Life Technologies | A11014 | |
| Human IgG Isotype Control | Novus Biologicals | NBP1-97043 | |
| Humanized anti-netrin-1 antibody | Netris Pharma | contact@netrispharma.com | |
| Rabbit anti-Mouse CD276 (B7-H3) | Abcam | ab134161 | EPNCIR122 Clone |
| Rat anti-Mouse CD31 | BD Biosciences | 550274 | MEC 13.3 Clone |
| Reagents | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Clear Nail Polish | Any local drug store | ||
| Indocyanine Green - NHS | Intrace Medical | ICG-NHS ester | |
| Mounting Medium | ThermoFisher Scientific | TA-006-FM | |
| Normal Goat Serum | Fisher Scientific | ICN19135680 | |
| Paraformaldehyde (PFA) | Fisher Scientific | AAJ19943K2 | |
| Sterile Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 14190250 | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Supplies | |||
| Adhesion Glass Slides | VWR | 48311-703 | |
| Desalting Columns | Fisher Scientific | 45-000-148 | |
| Glass Cover Slips | Fisher Scientific | 12-544G | |
| Hydrophobic Barrier Pen | Ted Pella | 22311 | |
| Microcentrifuge Tubes | Fisher Scientific | 05-402-25 | |
| Slide Staining Tray | VWR | 87000-136 | |
| Software | |||
| FIJI | LOCI, UW-Madison. | Version 4.0 | https://fiji.sc/ |
Ссылки
- Forthal, D. N. Functions of Antibodies. Microbiology Spectrum. 2 (4), 1-17 (2014).
- Boder, E. T., Midelfort, K. S., Wittrup, K. D. Directed evolution of antibody fragments with monovalent femtomolar antigen-binding affinity. Proceedings of the National Academy of Sciences of the United States of America. 97 (20), 10701-10705 (2000).
- Köhler, G., Milstein, C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 256 (5517), 495-497 (1975).
- Lonberg, N., et al. Antigen-specific human antibodies from mice comprising four distinct genetic modifications. Nature. 368 (6474), 856-859 (1994).
- McCafferty, J., Griffiths, A. D., Winter, G., Chiswell, D. J. Phage antibodies: filamentous phage displaying antibody variable domains. Nature. 348 (6301), 552-554 (1990).
- Ferlay, J., et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer. 136 (5), E359-E386 (2015).
- Reichert, J. M., Valge-Archer, V. E. Development trends for monoclonal antibody cancer therapeutics. Nature Reviews Drug Discovery. 6 (5), 349-356 (2007).
- Kircher, M. F., Willmann, J. K. Molecular Body Imaging: MR Imaging, CT, and US. Part I. Principles. Radiology. 263 (3), 633-643 (2012).
- Fleuren, E. D. G., et al. Theranostic applications of antibodies in oncology. Molecular Oncology. 8 (4), 799-812 (2014).
- Forsström, B., Bisławska Axnäs, B., Rockberg, J., Danielsson, H., Bohlin, A., Uhlen, M. Dissecting Antibodies with Regards to Linear and Conformational Epitopes. PLoS ONE. 10 (3), (2015).
- Woof, J. M., Burton, D. R. Human antibody-Fc receptor interactions illuminated by crystal structures. Nature Reviews Immunology. 4 (2), 89-99 (2004).
- Brooks, J. D. Translational genomics: The challenge of developing cancer biomarkers. Genome Research. 22 (2), 183-187 (2012).
- Tabrizi, M., Bornstein, G. G., Suria, H. Biodistribution Mechanisms of Therapeutic Monoclonal Antibodies in Health and Disease. The AAPS Journal. 12 (1), 33-43 (2009).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry. Journal of Pharmacy & Bioallied Sciences. 4 (Suppl 2), S307-S309 (2012).
- Gambhir, S. S. Molecular imaging of cancer with positron emission tomography. Nature Reviews. Cancer. 2 (9), 683-693 (2002).
- Freise, A. C., Wu, A. M. In vivo Imaging with Antibodies and Engineered Fragments. Molecular Immunology. 67 (200), 142-152 (2015).
- Cilliers, C., Menezes, B., Nessler, I., Linderman, J., Thurber, G. M. Improved Tumor Penetration and Single-Cell Targeting of Antibody-Drug Conjugates Increases Anticancer Efficacy and Host Survival. Cancer Research. 78 (3), 758-768 (2018).
- Wilson, K. E., et al. Spectroscopic Photoacoustic Molecular Imaging of Breast Cancer using a B7-H3-targeted ICG Contrast Agent. Theranostics. 7 (6), 1463-1476 (2017).
- Wischhusen, J., et al. Ultrasound molecular imaging as a non-invasive companion diagnostic for netrin-1 interference therapy in breast cancer. Theranostics. 8 (18), 5126-5142 (2018).
- Guy, C. T., Cardiff, R. D., Muller, W. J. Induction of mammary tumors by expression of polyomavirus middle T oncogene: a transgenic mouse model for metastatic disease. Molecular and Cellular Biology. 12 (3), 954-961 (1992).
- Hober, S., Nord, K., Linhult, M. Protein A chromatography for antibody purification. Journal of Chromatography B. 848 (1), 40-47 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments JoVE. (65), (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bachawal, S. V., et al. Earlier detection of breast cancer with ultrasound molecular imaging in a transgenic mouse model. Cancer Research. 73, 1689-1698 (2013).
- Fitamant, J., et al. Netrin-1 expression confers a selective advantage for tumor cell survival in metastatic breast cancer. Proceedings of the National Academy of Sciences. 105 (12), 4850-4855 (2008).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Ryman, J. T., Meibohm, B. Pharmacokinetics of Monoclonal Antibodies. CPT: Pharmacometrics & Systems Pharmacology. 6 (9), 576-588 (2017).
- Scalia, C. R., et al. Antigen Masking During Fixation and Embedding, Dissected. Journal of Histochemistry and Cytochemistry. 65 (1), 5-20 (2017).
- Robertson, R. T., et al. Use of labeled tomato lectin for imaging vasculature structures. Histochemistry and Cell Biology. 143 (2), 225-234 (2015).
- Chen, C. Y., et al. Blood flow reprograms lymphatic vessels to blood vessels. The Journal of Clinical Investigation. 122 (6), 2006-2017 (2012).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9 (1), 209-222 (2014).
- de Boer, E., et al. In Vivo Fluorescence Immunohistochemistry: Localization of Fluorescently Labeled Cetuximab in Squamous Cell Carcinomas. Scientific Reports. 5, (2015).
- Jenkins, R. W., Barbie, D. A., Flaherty, K. T. Mechanisms of resistance to immune checkpoint inhibitors. British Journal of Cancer. 118 (1), 9-16 (2018).
- Rexer, B. N., Arteaga, C. L. Intrinsic and acquired resistance to HER2-targeted therapies in HER2 gene-amplified breast cancer: mechanisms and clinical implications. Critical Reviews in Oncogenesis. 17 (1), 1-16 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены