Method Article
在Vivo免疫荧光定位中用于评估癌症研究中的治疗和诊断抗体生物分布
摘要
体内免疫荧光定位(IVIL)方法可用于利用体内肿瘤靶向和体外免疫染色的组合,在活体中检测抗体和抗体结合物在体内的生物体中的抗体和抗体结合方法。
摘要
单克隆抗体 (mAbs) 是癌症检测、诊断和治疗的重要工具。它们用于解开蛋白质在肿瘤发生中的作用,可定向到癌症生物标志物,使肿瘤检测和表征,并可用于癌症治疗作为mAbs或抗体药物结合激活免疫效应细胞,以抑制信号通路,或直接杀死携带特定抗原的细胞。尽管在开发和生产新型和高度特异性的 mAbs 方面取得了临床进展,但肿瘤微环境的复杂性和异质性可能会损害诊断和治疗应用。因此,为了开发有效的基于抗体的疗法和诊断,评估基于抗体的偶联物与活肿瘤微环境的生物分布和相互作用至关重要。在这里,我们将 Vivo 免疫荧光定位 (IVIL) 描述为研究体内生理和病理条件下基于抗体的治疗和诊断的相互作用的新方法。在这项技术中,在体内静脉注射治疗或诊断抗原特异性抗体,并在隔离肿瘤中注射二级抗体。因此,IVIL反映了基于抗体的药物和靶向剂的体内生物分布。介绍了两种IVIL应用,用于评估基于抗体的造影剂在乳腺癌分子成像中的生物分布和可及性。该协议将允许未来的用户调整IVIL方法,以适应他们自己的基于抗体的研究应用。
引言
单克隆抗体(mAb)是免疫球蛋白超级家族的大糖蛋白(约150 kDa),由B细胞分泌,在免疫系统中具有识别和抑制生物功能的主要功能,或标记破坏,细菌或病毒病原体,并能识别癌细胞上的异常蛋白质表达1。抗体可以有极高的亲和力,其特定表位下降到女性聚类浓度,使他们在生物医学2中非常有前途的工具。随着米尔斯坦和克勒(1984年获得诺贝尔奖)的混合瘤技术的发展,mAbs的生产成为可能。后来,人类mAbs产生使用噬菌体显示技术或转基因小鼠菌株,并彻底改变了它们作为新的研究工具和治疗4,5。
癌症是一个世界性的健康问题,也是主要死亡原因,因此需要新的预防、发现和治疗方法。迄今为止,mAbs已经允许免除基因及其蛋白质在肿瘤发生中的作用,当针对癌症生物标志物时,可以促进肿瘤的检测和患者分层的表征。对于癌症治疗,双特异性mAbs,抗体药物结合,和较小的抗体片段正在开发作为治疗,并针对药物交付,以提高疗效7。此外,抗体还用于分子成像模式(如荧光引导手术、光声 (PA) 成像、超声 (US) 分子成像和临床使用正电子发射)的造影剂的生物标记靶向断层扫描 (PET) 或单光子发射计算机断层扫描 (SPECT)8.最后,抗体也可用作治疗剂,使患者分层和反应监测的靶向疗法9。因此,新型mAbs开始在癌症的检测、诊断和治疗中发挥关键作用。
尽管在开发和生产新型和高度特异性的 mAbs 方面取得了重大进展,但由于肿瘤环境的复杂性,诊断和治疗应用可能会变得无效。抗体相互作用取决于表位的类型,即,无论是线性的还是构象的10。除了抗原的识别,抗体需要克服自然障碍,如血管壁,基底膜和肿瘤频闪,以达到表达抗原的目标细胞。抗体不仅通过可变片段抗原结合(Fab)域与组织相互作用,而且通过恒定的晶体片段(Fc)与组织相互作用,从而进一步导致场外相互作用11。靶向也由于肿瘤标记物在整个肿瘤体积的异质表达和肿瘤血管化和淋巴系统12、13的异质性而变得复杂。此外,肿瘤微环境由支持肿瘤细胞的癌症相关成纤维细胞、抑制抗肿瘤免疫反应的肿瘤免疫细胞以及支持氧气和营养物质输送的肿瘤内皮组成,干扰基于抗体的治疗或诊断的渗透、分布和可用性。总体而言,这些考虑可以限制治疗或诊断效果,降低治疗反应,并可能导致肿瘤耐药性。
因此,为了开发有效的基于抗体的疗法和诊断,评估基于抗体的偶联在肿瘤微环境中的生物分布和相互作用至关重要。目前,在临床前研究中,通过肿瘤14节的免疫荧光(IF)染色,对肿瘤研究模型中的标记表达进行了分析。标准 IF 染色使用主要标记特异性抗体执行,然后通过从动物分离的体外肿瘤组织切片上的二级荧光标记抗体突出显示这些抗体。此技术突出显示标记在组织固定时的静态位置,并且无法深入了解基于抗体的治疗或诊断如何在生理条件下分布或相互作用。PET、SPECT、US和PA的分子成像可以提供有关活前临床模型8、15中抗体结合造影剂分布的信息。由于这些成像模式是非侵入性的,可以进行纵向研究,并且每组动物数量最少,可以收集时间敏感数据。然而,这些非侵入性分子成像方法不够敏感,没有足够的分辨率来定位细胞层面的抗体分布。此外,由于造影剂16的偶联,原抗体的物理和生物特性可能发生巨大变化。
为了考虑体内生理和病理状况,考虑基于抗体的治疗和诊断如何在肿瘤环境中相互作用,并获得高分辨率细胞甚至亚细胞分布非结合抗体的配置文件,我们提出了一个IF方法,被认为是在Vivo免疫荧光定位(IVIL),其中抗原特异性抗体静脉注射在体内。基于抗体的治疗或诊断,作为主要抗体,在功能性血管中循环,并在高精度、活的肿瘤环境中与其目标蛋白结合。用原抗体分离出体内标记的肿瘤后,使用二次抗体来本地化累积和保留的抗体结合。这种方法类似于前面描述的IF组织学方法注射荧光标记抗体17。虽然在这里,使用非结合抗体可以避免由抗体修饰引起的生物分布特性的潜在变化。此外,荧光二级抗体的外生应用可避免组织收集和处理过程中荧光信号的可能丢失,并提供荧光信号强度的放大。我们的贴标方法反映了抗体药物和目标药物的体内生物分布,可为新型诊断和治疗剂的开发提供重要见解。
在这里,我们描述了IVIL方法在以往研究中应用的两种应用,这些研究研究抗体基造影剂的生物分布和可及性用于乳腺癌检测的分子成像方法。首先,抗体近红外染料结合(抗B7-H3抗体结合近红外荧光染料,青黄绿,B7-H3-ICG)和等型对照剂(一等型控制剂)用于荧光和光声分子成像被探索18。该协议中介绍了此应用程序的方法。其次,对netrin-1的构象敏感抗体的生物分布结果,通常不能用传统的IF成像检测,用于超声分子成像,在具有代表性的结果19中量化和呈现。在本文结束时,读者应该对采用IVIL方法进行基于抗体的研究应用感到自在。
研究方案
本文描述的所有方法均已获得斯坦福大学实验室动物护理机构行政小组(APLAC)的批准。
1. 乳腺癌发育的转基因小鼠模型
- 在继续之前,通过触觉或卡钳测量,从所需的癌症模型中观察小鼠,以进行适当的肿瘤生长。
注:这里使用了乳腺癌发育的转基因鼠模型(FVB/N-Tg(MMTV-PyMT)634Mul/J(MMTV-PyMT)。这些动物自发地在每个乳腺20个6至12周的年龄之间发展侵入性乳腺癌。正常乳腺被用作从转基因阴性,年龄匹配的垃圾的对照。
2. 静脉注射特异性和非特异性抗体制剂
- 根据制造商的说明,在脱盐柱(例如 PD-10)上纯化兔子抗小鼠 B7-H3 和兔子 IgG 等型控制抗体,以去除防腐剂和储存缓冲液。
注:一些抗体可能需要进一步纯化与蛋白-A腺珠为基础的协议21。 - 在单个微离心管中,每种抗体的33μg的剂量。
注: 被施用剂的剂量可能因应用而异,并符合常规使用抗体结合的剂量。如果抗体溶液的体积超过100μL,为了动物安全,则需要抗体溶液的浓度。 - 在组织收集前的所需时间点,这里96小时,用2%的异黄素在2L/min的氧气中流动,麻醉肿瘤携带动物,并放置在37°C加热阶段。做脚趾捏,以确保在手术前达到适当的anesthsia水平。
- 为了准备对抗体溶液的尾静脉接种,用酒精擦拭三次对动物的尾巴进行消毒。用热垫加热大约30ss,使尾静脉稀释。避免加热整个动物。取出热垫后,再次用酒精擦拭尾部。
- 使用 27G 尾静脉导管,将蝴蝶针插入两个横向尾静脉之一,并用一块手术胶带小心地将插入的针头固定到舞台上。
注:可见的血液回流到导管中,表明针头在尾静脉内的正确位置。 - 用25μL无菌磷酸盐缓冲盐水(PBS)冲洗导管,然后使用胰岛素注射器将抗体溶液注射到导管中。再次用25 μL无菌PBS冲洗导管。
- 从尾部取出针头,并施加压力以阻止任何出血。
- 关闭麻醉,观察动物,直到完全清醒,是否有任何痛苦的迹象。
3. 靶性肿瘤组织的收集和制备
- 在所需时间点,按照可接受的机构程序人道地对动物实施安乐死,在这里,从室位移流量为10-30%体积/分钟的压缩气罐中逐渐吸入100%CO2。
注:IVIL技术的一些应用要求通过心脏灌注与PBS进行安乐死,以去除自由循环的抗体19,22。 - 通过停止呼吸和心脏运动、缺乏脚趾捏反应和粘膜变灰、使用手术剪刀和钳子切除肿瘤组织确认人道安乐死后,如下所示:
- 将鼠标放在上摆位置,用钳子将最接近尾部的乳腺(5)之间的皮肤外层抓住,用一把手术剪刀做一个小切口。
- 将封闭的剪刀引入切口,慢慢打开尖端,小心地将皮肤与底层腹壁膜分开,使其完好无损。
- 在腹部做一个垂直切口,继续将皮肤与内膜分开。在第三和第四乳腺之间,在腹部进行水平切割,以便收回皮肤和乳房腺的可视化。
注:乳腺肿瘤和腺体位于皮肤下表面。 - 用钳子抓住每个肿瘤或正常腺体,用手术剪刀仔细修剪附着的皮肤。
- 将切除的组织放入组织一次性基础模具中,预贴标签并填充最佳切割温度 (OCT) 嵌入介质,并通过放置在干冰上快速冻结模具。为了研究脱靶分娩,切除其他相关组织或器官(如肝脏或肺)。
注:要此时暂停协议,请将冷冻组织块存储在-80°C,直到准备好继续。 - 使用低温,截面冻结组织块在10μm厚度,并将相邻的部分放在预先标记的粘附玻璃玻片上。
注: 要此时暂停协议,请将幻灯片存储在 -80°C,直到准备好继续。
4. 体外染色协议
注:对于荧光显微镜图像之间的定量比较,所有幻灯片都同时使用相同的制备溶液进行染色。
- 用室温PBS冲洗冷冻组织幻灯片5分钟,以去除OCT。
- 使用疏水屏障笔划解组织部分,以减少染色过程中所需的溶液量。
注意:小心不要让笔在组织样本上运行,因为它可能会从幻灯片上取出组织或防止在受影响的组织部分正确染色。不要让组织部分在任何点脱水。 - 用4%的甲醛溶液固定组织部分5分钟。
- 在 PBS 中冲洗幻灯片 5 分钟。
- 在 PBS 中用 0.5% Triton-X 100 渗透组织部分 15 分钟。
- 在 PBS 中冲洗幻灯片 5 分钟。
- 在室温下,用3%的牛血清白蛋白(BSA)和5%v/v山羊血清,在PBS(阻断溶液)中,用3%的牛血清白蛋白(BSA)和5%v/v山羊血清阻断组织。
注:将阻断溶液血清与二级抗体宿主动物匹配。 - 在 PBS 中冲洗幻灯片 5 分钟。
- 根据需要用记录保持初级抗体孵育部分,可能是常见的核(如DAPI)、血管(如CD31)或细胞质标记物(例如,行为素)。在这里,大鼠抗小鼠CD31(血管标记)在1:100稀释使用根据制造商的说明在阻隔溶液过夜在4°C防止脱水的滑盘。
注:请勿添加额外的原抗体或抗体结合。注射并允许在体内组织中积累的偶联物作为主要抗体。 - 在 PBS 中冲洗幻灯片 5 分钟三次,每次更换 PBS。
- 用二级抗体孵育幻灯片,以标记原抗体。对于此应用,使用 AlexaFluor-546 偶联山羊抗兔子抗体(1:200 稀释,根据制造商说明进行优化)和 CD31 与 AlexaFluor-488 山羊抗鼠二级抗体 (1:200) 可视化抗 B7-H3 抗体稀释,根据制造商的说明)在阻隔溶液中优化,在室温下防止滑盘的光线和脱水,1小时。
注:二级抗体来自同一宿主动物,但次级抗体与相应原抗体的宿主物种的亲和力相匹配。从此点起,幻灯片不受光线照射。 - 在 PBS 中冲洗幻灯片 5 分钟三次,每次更换 PBS。
- 将安装介质的一滴放入组织切片的中心,并小心地放置盖玻片,避免气泡被卡住。
- 用透明指甲油密封盖玻片的边缘,然后晾干。
注: 要此时将协议暂停长达一周,请将幻灯片存储在 -20 °C,直到准备好继续。
5. 共聚焦显微镜成像和定量图像分析
注:准备共聚焦显微镜和成像参数将取决于所使用的共聚焦系统。此处使用的显微镜是商业购买的(例如蔡司 LSM 510 Meta 系统),并使用了相关的采集软件(例如,Zen 2009)。然而,许多这些步骤将适用于任何共聚焦显微镜,并承担基本的共聚焦显微镜知识。
- 系统打开并预热后,选择所需的目标;这里使用了20倍(数值光圈=0.8)的目标。
- 加载正控制滑块,盖玻片向下,以便设置最亮信号的优化。在红色通道中成像,在实时成像模式下将系统聚焦在样品上。
- 对于使用的每个激光通道,优化激光强度、主增益和针孔尺寸,如下所示:
- 切换到连续模式进行成像。
- 优化激光强度(控制激光功率)和增益(控制光电倍增管的电压)滑动条,同时监控查找表 (LUT) 直方图。调整这两个设置,直到直方图的动态范围填充而不饱和像素。
注:如果激光强度过高,将发生光漂白。如果增益(主)过高,图像将变得嘈杂。理想情况下,增益(主)将在其范围的中间。 - 将针孔设置为 1 个通风单元 (AU),从而提供最高的分辨率和最薄的 z 切片。
- 滑动数字偏移栏,将 LUT 直方图上的噪音底数降至最低,以获得真正的黑色背景。
注:针对每个激光通道和目标优化显微镜设置后,在整个成像会话和所有幻灯片的成像过程中保持其恒定,以便对幻灯片进行定量比较。
- 在"获取模式"选项卡下,在"平均"下,选择所需的"数量"和"位深度"。单击"最佳"按钮以设置最佳像素大小。
- 使用"捕捉采集"按钮收集高质量图像。在这里,随机视场是从肿瘤内部选择的,但其他感兴趣的领域可能适用于不同的应用(血管、肿瘤边缘、穿透深度等)
- 以共聚焦软件(此处为".lsm")使用的格式保存图像文件,以便进行离线处理和定量。
注: 如果不是在同一会话期间对所有幻灯片都进行映像,则保存设置并在后续访问时重新加载它们,但由于光漂白,不建议对同一幻灯片进行重新映像。 - 执行定量荧光强度测量。打开斐济(斐济只是图像J软件)19,23并通过拖动到状态栏加载.lsm图像文件。
- 拆分颜色通道数据。转到图像 > 堆栈 > 拆分通道。
- 根据需要预处理荧光图像,即减去背景信号(过程 > 减去背景)或通过滤波方法降低噪声。
- 通过设置信号强度的阈值(图像 > 调整 > 阈值),分割与参考蛋白(血管、核、细胞染色)对应的颜色通道。
注:手动阈值在图像分析中引入了主观性,因此,使用自动阈值算法或引用图像直方图可降低图像分析结果的偏差。 - 使用此阈值创建二进制掩码 (进程 > 二进制 > 转换为掩码)。
- 测量和标记掩模内的 ROIs(分析 > 分析粒子 > 检查添加到管理器 > 确定)。
- 将 ROI 应用于与感兴趣的抗体对应的颜色通道(单击通道图像,分析 > 工具 > ROI 管理器 > 测量)。这将将掩膜 ROIs 应用于抗体图像,并在"结果"窗口中提供标签部分的图像测量。保存结果窗口 (文件 > 保存)。
- 计算所需的感兴趣的统计量,如此处描述的平均荧光强度24。
- 执行与一组幻灯片中每个图像相同的所有处理步骤。创建一个宏,以自动对大型图像批处理23执行此操作。
- 对于仅在定量测量后的图像显示,应用定性图像调整,通过调整所有幻灯片上的最小、最大、亮度和对比度到相同级别来优化生物分布模式的可视化(图像> 调整> 亮度/对比度)。
- 转换图像类型 (图像 > 类型 > RGB 颜色)并保存文件在无损图像类型,如 .tiff (文件 > 保存为 > Tiff...) 用于演示文稿和出版物。
结果
IVIL 方法用于检查 B7-H3-ICG 和 Iso-ICG 的体内生物分布和组织相互作用,方法是允许制剂在静脉注射到活的动物体内后与目标组织相互作用 96 小时,然后一旦组织收获,在体外免疫染色过程中作为主要抗体。IVIL 方法还与 B7-H3 标记组织的标准体前 IF 染色进行了比较。正常乳腺不表示B7-H3标记,在体外确认,标准IF染色,不通过其他被动机制积累抗体,因此,未检测到B7-H3-ICG或一等ICG的积累,具有代表性负结果(图1,顶行)。然而,乳腺肿瘤确实在血管和上皮中表达B7-H3(标准IF染色确认),IVIL能够突出在血管上大量积累的B7-H3-ICG剂,并能够部分外溢从血管结合到癌细胞本身,虽然以异质的方式相比,在整个肿瘤的B7-H3标记均匀分布,也如图1,底部行所示。此外,尽管Iso-ICG剂没有分子特异性,但由于Fc相互作用、间质排水不良以及鼠母体内的渗透性和保留效应增强,它仍然以非特异性方式积累。肿瘤(图 1)。这一差异在两种制剂之间显示的生物分布模式中有所突出,并进一步增强了特定抗体剂的具体结合结果,并代表了阳性结果的两种可能结果。
B7-H3-ICG代表结果表明,IVIL方法如何作为定性方法来描述一般抗体/抗体结合生物分布。然而,有时可能需要更定量的解释,或者抗体可能具有高度敏感、构象特异性结合能力。在这些情况下,IVIL 还可以提供所需的信息。在第二个例子中,研究了内蛋白-1蛋白在肿瘤组织中的表现及其与CD31阳性肿瘤内皮球的共同定位,还成功地应用了IVIL技术。
Netrin-1是一种分泌的65 kDa蛋白质,在某些类型的癌症中过度表达,如转移性乳腺癌25,26。为了开发一种对netrin-1的分子成像方法,必须确定蛋白质在体内的可得性。此外,由于抗netrin-1抗体在组织固定后对其抗原没有足够的亲和力,因此需要经典免疫组织化学或IF染色的替代染色方案,并实施了IVIL。在心脏灌注和肿瘤采集前24小时静脉注射人用抗netrin-1抗体和人IgG等型对照抗体。心脏灌注用于减少血管中未特异性背景染色,并在靶表达受限时,与同型控制抗体信号相比,增强显著抗netrin-1抗体积累的检测。肿瘤部分被贴上前体标记,具有突出抗CD31抗体的血管(大鼠抗小鼠CD31抗体(材料表)和荧光二级抗体,Alexa 488耦合山羊抗鼠IgG,1:500稀释和Alexa Fluor 594-耦合山羊抗人IgG,分别为1:500稀释)用于揭示抗网林-1/等型和反CD31 mAbs。对抗netrin-1和异型对照抗体的荧光信号强度进行了量化,以确定与CD31共定分的染色差异。图2显示,在MMTV-PyMT乳腺肿瘤的上皮肿瘤室中专门积累的抗netrin-1抗体(阳性结果),而正常乳腺没有信号(阴性结果)。抗体进一步与内皮标记CD31共同本地化。与等型抗体注射肿瘤和正常腺体的比较表明,上皮积累对肿瘤组织是特定的。由于netrin-1结合(肿瘤)和非特异性Fc相互作用(肿瘤和正常乳腺)11,肿瘤和正常腺体内皮细胞中有信号积累。因此,需要使用基于CD31的二进制掩膜进行荧光信号定量,并证明抗netrin-1抗体信号明显高于肿瘤组织中的等型控制抗体信号,这表明netrin-1特别积聚在肿瘤内皮。

图 1: 具有代表性的共聚焦显微图,比较特定B7-H3抗体-ICG偶联和非特异性等型对照抗体-ICG结合定位在含有正常或癌组织中的母体乳腺。(顶部)从动物静脉注射33μg Iso-ICG或B7-H3-ICG(红色)和反染色CD31(绿色)显示抗体偶联物无染色的动物的正常乳腺。正常组织被标准体外IF染色显示没有B7-H3的表达。(底部)从动物静脉注射33μgB7-H3-ICG或Iso-ICG(红色)和血管反染色CD31(绿色)的侵入性乳腺肿瘤显示广泛,异质染色,虽然分布模式不同,无论是B7-H3-ICG和Iso-ICG 代理。B7-H3-ICG与血管强烈结合,这是体内的第一个接触点,然后能够从血管外附,异质染色肿瘤上皮。Iso-ICG显示肿瘤组织内的非特异性积累。标准前体 IF 染色显示上皮细胞和内皮细胞上 B7-H3 标记的统一表达。黄色表示共同本地化的红色和绿色通道信号。刻度条为 100 μm,面板之间一致。请点击此处查看此图的较大版本。
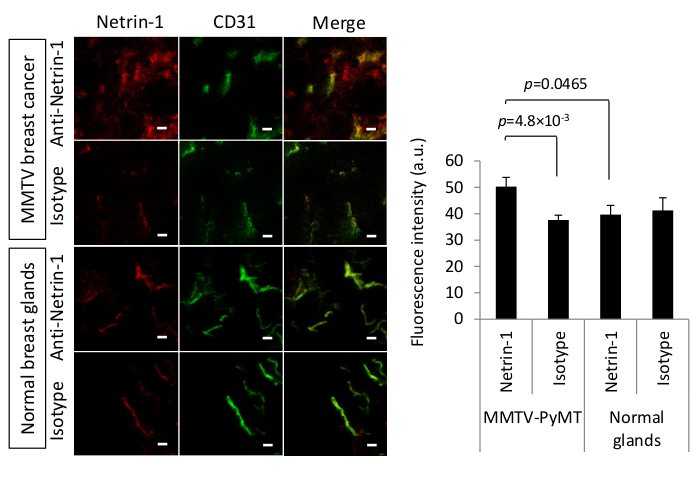
图 2:MMTV-PyMT乳腺肿瘤中网林-1的体内免疫定位。(左)IVIL 方法的代表性共聚焦显微图,用于检测小鼠癌和正常乳腺中的 netrin-1 表达式(红色)或同型控制表达式(红色)。IVIL确认MMTV-PyMT肿瘤中netrin-1的上皮信号,但不在正常乳腺中,在乳腺肿瘤的内皮细胞(CD31染色,绿色)上确认netrin-1信号,在正常乳腺中,netrin-1信号明显较弱。黄色表示共同本地化的红色和绿色通道信号。刻度条表示 20 μm。为检测肿瘤内皮中的netrin-1蛋白,在肿瘤采集前24小时静脉注射100μg原发性NET1-H-mAb或100μg人IgG等型对照抗体。自由循环的抗体通过心脏灌注与PBS去除,肿瘤组织被分离,闪光冷冻,并在低温上以15μm厚度切片。内皮细胞被标记与原发性大鼠抗小鼠CD31抗体,其次是继发Alexa 488耦合山羊抗鼠IgG。为了揭示针对netrin-1的主要抗体,使用了二级Alexa Fluor 594耦合山羊抗人IgG。为了避免山羊二次抗体的未特异性相互作用,组织样本被山羊血清阻断。(右)条形图突出显示了抗netrin-1或同型控制抗体信号的定量,该信号与抗CD31抗体信号共定。N=13肿瘤(两只小鼠)每组MMTV-PyMT和N=7乳腺(一只小鼠)每组正常腺体;存在 SEM 的错误条形图;两组比较与学生的 t 测试进行了比较。图从19下根据创意共享许可 CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/)重新打印。请点击此处查看此图的较大版本。
讨论
此方法有几个关键步骤,需要可能的修改以确保成功实施。首先,抗体/抗体结合静脉注射的剂量和时间必须针对具体应用进行定制。通常,应使用与抗体结合通常使用方式一致的剂量,即匹配治疗性抗体或基于抗体的造影剂的剂量。此外,应仔细考虑收集目标组织的时间。抗体和抗体结合剂比标准药物和造影剂具有更长的循环时间,但是,这些具有高度可变性,应针对所需应用进行优化,但建议至少允许 24 小时循环时间27.第二,在目标组织采集过程中,可能需要实施心内灌注技术,从血库中去除自由循环的抗体19。在观察B7-H3-ICG的肿瘤分布时,由于循环时间(96小时)和制剂的额外血管定位,发现没有必要。然而,对于IVIL方法的netrin-1应用,由于netrin-1的内皮表达及其相对较低的表达水平,心脏灌注被认为是相关的。第三,在体外组织染色期间,必须染色在同一会话期间定量比较的任何幻灯片,并采用相同的解决方案,以防止正常的批次间变化。确保幻灯片在台阶之间正确冲洗,并且疏水笔溶液不会与组织接触,以避免不理想的染色。最后,在共聚焦显微镜期间,在幻灯片之间保持相同的成像设置,以便进行相对定量,并快速工作,以防止幻灯片的光漂白。这些关键点将增加成功实施 IVIL 的可能性。
IVIL 方法有几个优点。首先,虽然该方法与标准 IF 技术类似,但两者提供的信息明显不同。IF 染色表示在给定时间点(当组织被收集和固定时)组织内分子标记的解剖位置。然而,IVIL提供了抗体或抗体结合的信息,如B7-H3-ICG的定位所证明,是特定或非特异性积累、内化还是保留目标组织。这对于药代动力学/动态和生物分布研究至关重要。其次,传统的IF方法有时受到组织固定的限制,这种固定方法会导致抗原变形或屏蔽,防止原抗体结合28。因此,当标准 IF 染色或免疫性化学失败时,IVIL 可能很有用。IVIL 技术可被视为一种补充方法,用于验证体内抗体活性,否则无法检测到。最后,熟悉传统IF染色技术的人会发现该方法在执行中非常简单,并且手头上将有足够的所需材料。
IVIL 方法有一些限制。首先,由于必须对动物实施安乐死以收获目标组织,IVIL仅在一个时间点提供生物相互作用信息。将原抗体或抗体在不同时间点结合注射到不同的动物体内,将允许一个更广泛的时间窗口,了解生物分布和体内相互作用。其次,如果用户不熟悉体内动物技术,如静脉尾静脉注射或潜在的心内灌注,这可能是该方法的限制。这些方法需要熟练的人员可靠执行。然而,在尾静脉注射期间使用导管可确保整个剂量的施用,因为注射前可以确认正确的针头放置。此外,可以考虑的尾静脉注射的一种替代方法是逆向轨道注射,这种注射通常具有较高的成功率,经验不足的人员。需要在同一批次中染色和图像所有组织幻灯片,以便进行定量评估,从而限制单个研究中可包括的样本和标记的数量。该研究可能需要在不同日期和相邻组织切片上组织成序列染色,以收集所需的信息。最后,在小鼠临床前模型中使用物种匹配抗体,即鼠类抗鼠抗体,提出了非特异性背景染色与二次抗体的问题。因此,在这项研究中,需要使用物种不匹配的初级抗体,或者必须使用荧光标记的物种匹配的主要抗体。
IVIL 技术可用于诊断和治疗抗体的生物分布分析,适用于许多应用。静脉抗体或配体注射和体外组织分析的不同应用已经报告之前,并确认兴趣广泛引入这种染色程序。罗伯逊及其同事用静脉注射莱科普森增谷蛋白(番茄叶酸)29标记血管元素,如内皮毛细血管和较大的血管。该技术与组化学和免疫细胞化学兼容,揭示了血管模式和功能性棘皮特征。虽然,荧光配体的使用受到注射30时荧光迅速降解的限制。如IVIL协议所示,在体内注射原抗体,然后用二级荧光抗体进行外体标记可能是一种更有力的方法。另一个有趣的应用,这种类型的体内IF染色是血管内淋巴细胞的标签,如安德森和同事31所示。静脉注射抗体用于标记血管中局部的淋巴细胞,随后收集并进一步处理,用于免疫标记物的流式细胞学分析。最后,为了评估提供给头颈部鳞状细胞癌(HNSCC)患者的抗体治疗的交付和组织定位,首次使用系统化进行了抗体分布的人工研究施用近红外荧光标记治疗抗体cetuximab-IRDye800CW32。数据与组织学分析进行了比较,结果表明荧光信号随着肿瘤确认特异性的距离而减小。虽然,治疗抗体没有到达抗原表达的所有区域,特别是表皮生长因子受体(EGFR)抗原水平高的分化肿瘤区域。在目前癌症研究的重点是开发具有强烈抗药性和缺乏疗效的靶向疗法和免疫疗法的背景下,IVIL方法将是研究治疗抗体分布的极好工具如 PD-1/PD-L-1 或 HER233,34。这些结果对于理解为什么靶向疗法在某些情况下促进新方法的发展是有效的非常有价值。综合起来,这些例子强调了IVIL方法的潜在重要性。
披露声明
作者没有什么可透露的。
致谢
我们感谢安德鲁·奥尔森博士(斯坦福神经科学显微镜服务)的讨论和设备使用。我们感谢尤尔根·威尔曼博士的导师。这项研究得到了NIH R21EB022214助学金(KEW)、NIH R25CA118681培训补助金(KEW)和NIH K99EB023279(KEW)的支持。斯坦福神经科学显微镜服务由NIH NS069375提供支持。
材料
| Name | Company | Catalog Number | Comments |
| Animal Model | |||
| FVB/N-Tg(MMTV-PyMT)634Mul/J | The Jackson Laboratory | 002374 | Females, 4-6 weeks of age |
| Animal Handling Supplies | |||
| 27G Catheter | VisualSonics | Please call to order | Vevo MicroMarker Tail Vein Access Cannulation Kit |
| Alcohol Wipes | Fisher Scientific | 22-246073 | |
| Gauze Sponges (4" x 4" 16 Ply) | Cardinal Health | 2913 | |
| Heat Lamp | Morganville Scientific | HL0100 | |
| Isoflurane | Henry Schein Animal Health | 29404 | |
| Ophthalmic Ointment | Fisher Scientific | NC0490117 | |
| Surgical Tape | 3M | 1530-1 | |
| Tissue Collection | |||
| Disposable Base Molds | Fisher Scientific | 22-363-556 | |
| Optimal Cutting Temperature (OCT) Medium | Fisher Scientific | 23-730-571 | |
| Surgical London Forceps | Fine Science Tools | 11080-02 | |
| Surgical Scissors | Fine Science Tools | 14084-08 | |
| Antibodies | |||
| AlexaFluor-488 goat anti-rat IgG | Life Technologies | A-11006 | |
| AlexaFluor-546 goat anti-rabbit IgG | Life Technologies | A-11010 | |
| AlexaFluor-594 goat anti-human IgG | Life Technologies | A11014 | |
| Human IgG Isotype Control | Novus Biologicals | NBP1-97043 | |
| Humanized anti-netrin-1 antibody | Netris Pharma | contact@netrispharma.com | |
| Rabbit anti-Mouse CD276 (B7-H3) | Abcam | ab134161 | EPNCIR122 Clone |
| Rat anti-Mouse CD31 | BD Biosciences | 550274 | MEC 13.3 Clone |
| Reagents | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Clear Nail Polish | Any local drug store | ||
| Indocyanine Green - NHS | Intrace Medical | ICG-NHS ester | |
| Mounting Medium | ThermoFisher Scientific | TA-006-FM | |
| Normal Goat Serum | Fisher Scientific | ICN19135680 | |
| Paraformaldehyde (PFA) | Fisher Scientific | AAJ19943K2 | |
| Sterile Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 14190250 | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Supplies | |||
| Adhesion Glass Slides | VWR | 48311-703 | |
| Desalting Columns | Fisher Scientific | 45-000-148 | |
| Glass Cover Slips | Fisher Scientific | 12-544G | |
| Hydrophobic Barrier Pen | Ted Pella | 22311 | |
| Microcentrifuge Tubes | Fisher Scientific | 05-402-25 | |
| Slide Staining Tray | VWR | 87000-136 | |
| Software | |||
| FIJI | LOCI, UW-Madison. | Version 4.0 | https://fiji.sc/ |
参考文献
- Forthal, D. N. Functions of Antibodies. Microbiology Spectrum. 2 (4), 1-17 (2014).
- Boder, E. T., Midelfort, K. S., Wittrup, K. D. Directed evolution of antibody fragments with monovalent femtomolar antigen-binding affinity. Proceedings of the National Academy of Sciences of the United States of America. 97 (20), 10701-10705 (2000).
- Köhler, G., Milstein, C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 256 (5517), 495-497 (1975).
- Lonberg, N., et al. Antigen-specific human antibodies from mice comprising four distinct genetic modifications. Nature. 368 (6474), 856-859 (1994).
- McCafferty, J., Griffiths, A. D., Winter, G., Chiswell, D. J. Phage antibodies: filamentous phage displaying antibody variable domains. Nature. 348 (6301), 552-554 (1990).
- Ferlay, J., et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer. 136 (5), E359-E386 (2015).
- Reichert, J. M., Valge-Archer, V. E. Development trends for monoclonal antibody cancer therapeutics. Nature Reviews Drug Discovery. 6 (5), 349-356 (2007).
- Kircher, M. F., Willmann, J. K. Molecular Body Imaging: MR Imaging, CT, and US. Part I. Principles. Radiology. 263 (3), 633-643 (2012).
- Fleuren, E. D. G., et al. Theranostic applications of antibodies in oncology. Molecular Oncology. 8 (4), 799-812 (2014).
- Forsström, B., Bisławska Axnäs, B., Rockberg, J., Danielsson, H., Bohlin, A., Uhlen, M. Dissecting Antibodies with Regards to Linear and Conformational Epitopes. PLoS ONE. 10 (3), (2015).
- Woof, J. M., Burton, D. R. Human antibody-Fc receptor interactions illuminated by crystal structures. Nature Reviews Immunology. 4 (2), 89-99 (2004).
- Brooks, J. D. Translational genomics: The challenge of developing cancer biomarkers. Genome Research. 22 (2), 183-187 (2012).
- Tabrizi, M., Bornstein, G. G., Suria, H. Biodistribution Mechanisms of Therapeutic Monoclonal Antibodies in Health and Disease. The AAPS Journal. 12 (1), 33-43 (2009).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry. Journal of Pharmacy & Bioallied Sciences. 4 (Suppl 2), S307-S309 (2012).
- Gambhir, S. S. Molecular imaging of cancer with positron emission tomography. Nature Reviews. Cancer. 2 (9), 683-693 (2002).
- Freise, A. C., Wu, A. M. In vivo Imaging with Antibodies and Engineered Fragments. Molecular Immunology. 67 (200), 142-152 (2015).
- Cilliers, C., Menezes, B., Nessler, I., Linderman, J., Thurber, G. M. Improved Tumor Penetration and Single-Cell Targeting of Antibody-Drug Conjugates Increases Anticancer Efficacy and Host Survival. Cancer Research. 78 (3), 758-768 (2018).
- Wilson, K. E., et al. Spectroscopic Photoacoustic Molecular Imaging of Breast Cancer using a B7-H3-targeted ICG Contrast Agent. Theranostics. 7 (6), 1463-1476 (2017).
- Wischhusen, J., et al. Ultrasound molecular imaging as a non-invasive companion diagnostic for netrin-1 interference therapy in breast cancer. Theranostics. 8 (18), 5126-5142 (2018).
- Guy, C. T., Cardiff, R. D., Muller, W. J. Induction of mammary tumors by expression of polyomavirus middle T oncogene: a transgenic mouse model for metastatic disease. Molecular and Cellular Biology. 12 (3), 954-961 (1992).
- Hober, S., Nord, K., Linhult, M. Protein A chromatography for antibody purification. Journal of Chromatography B. 848 (1), 40-47 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments JoVE. (65), (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bachawal, S. V., et al. Earlier detection of breast cancer with ultrasound molecular imaging in a transgenic mouse model. Cancer Research. 73, 1689-1698 (2013).
- Fitamant, J., et al. Netrin-1 expression confers a selective advantage for tumor cell survival in metastatic breast cancer. Proceedings of the National Academy of Sciences. 105 (12), 4850-4855 (2008).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Ryman, J. T., Meibohm, B. Pharmacokinetics of Monoclonal Antibodies. CPT: Pharmacometrics & Systems Pharmacology. 6 (9), 576-588 (2017).
- Scalia, C. R., et al. Antigen Masking During Fixation and Embedding, Dissected. Journal of Histochemistry and Cytochemistry. 65 (1), 5-20 (2017).
- Robertson, R. T., et al. Use of labeled tomato lectin for imaging vasculature structures. Histochemistry and Cell Biology. 143 (2), 225-234 (2015).
- Chen, C. Y., et al. Blood flow reprograms lymphatic vessels to blood vessels. The Journal of Clinical Investigation. 122 (6), 2006-2017 (2012).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9 (1), 209-222 (2014).
- de Boer, E., et al. In Vivo Fluorescence Immunohistochemistry: Localization of Fluorescently Labeled Cetuximab in Squamous Cell Carcinomas. Scientific Reports. 5, (2015).
- Jenkins, R. W., Barbie, D. A., Flaherty, K. T. Mechanisms of resistance to immune checkpoint inhibitors. British Journal of Cancer. 118 (1), 9-16 (2018).
- Rexer, B. N., Arteaga, C. L. Intrinsic and acquired resistance to HER2-targeted therapies in HER2 gene-amplified breast cancer: mechanisms and clinical implications. Critical Reviews in Oncogenesis. 17 (1), 1-16 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。