Method Article
Localización de Inmunofluorescencia In Vivo para la Evaluación de la Biodistribución de Anticuerpos Terapéuticos y Diagnóstico en la Investigación del Cáncer
En este artículo
Resumen
El método de localización de inmunofluorescencia in vivo (IVIL) se puede utilizar para examinar la biodistribución in vivo de anticuerpos y conjugados de anticuerpos con fines oncológicos en organismos vivos utilizando una combinación de segmentación tumoral in vivo e inmunostainización ex vivo Métodos.
Resumen
Los anticuerpos monoclonales (mAbs) son herramientas importantes en la detección, diagnóstico y tratamiento del cáncer. Se utilizan para desentrañar el papel de las proteínas en la tumorigenesis, se pueden dirigir a biomarcadores de cáncer que permiten la detección y caracterización de tumores, y se pueden utilizar para la terapia contra el cáncer como mAbs o conjugados de anticuerpos-drogas para activar las células efectoras inmunes, para inhibir señaldelas, o matar directamente las células que llevan el antígeno específico. A pesar de los avances clínicos en el desarrollo y producción de mAbs novedosos y altamente específicos, las aplicaciones diagnósticas y terapéuticas pueden verse afectadas por la complejidad y heterogeneidad del microambiente tumoral. Por lo tanto, para el desarrollo de terapias y diagnósticos eficientes basados en anticuerpos, es crucial evaluar la biodistribución y la interacción del conjugado basado en anticuerpos con el microambiente tumoral vivo. Aquí, describimos In Vivo Immunofluorescence Localization (IVIL) como un nuevo enfoque para estudiar las interacciones de la terapéutica basada en anticuerpos y el diagnóstico en las condiciones fisiológicas y patológicas in vivo. En esta técnica, se inyecta invivo un anticuerpo terapéutico o diagnóstico específico para antígenos in vivo y localizado ex vivo con un anticuerpo secundario en tumores aislados. Por lo tanto, IVIL refleja la biodistribución in vivo de fármacos a base de anticuerpos y agentes dirigidos. Se describen dos aplicaciones de IVIL que evalúan la biodistribución y la accesibilidad de agentes de contraste basados en anticuerpos para la toma de imágenes moleculares del cáncer de mama. Este protocolo permitirá a los futuros usuarios adaptar el método IVIL para sus propias aplicaciones de investigación basadas en anticuerpos.
Introducción
Los anticuerpos monoclonales (mAb) son grandes glicoproteínas (aproximadamente 150 kDa) de la superfamilia inmunoglobulina que son secretadas por células B y tienen una función primaria en el sistema inmunitario para identificar e inhibir la función biológica de, o marcar para patógenos bacterianos o virales, y puede reconocer la expresión anormal de proteínas en las células cancerosas1. Los anticuerpos pueden tener una afinidad extremadamente alta con sus epítopos específicos hasta las concentraciones femtomolares, lo que los convierte en herramientas altamente prometedoras en biomedicina2. Con el desarrollo de la tecnología de hibrioma por Milstein y K-hler (galardonado con el Premio Nobel en 1984), la producción de mAbs se hizo posible3. Más tarde, los mAbs humanos se generaron utilizando la tecnología de visualización de fagos o cepas de ratón transgénicas y revolucionaron su uso como nuevas herramientas de investigación y terapias4,5.
El cáncer es un problema de salud mundial y una de las principales causas de muerte, creando la necesidad de nuevos enfoques para la prevención, detección y terapia6. Hasta la fecha, los mAbs han permitido la extricación del papel de los genes y sus proteínas en la tumorigenesis y cuando se dirigen contra biomarcadores de cáncer, pueden permitir la detección y caracterización del tumor para la estratificación del paciente. Para la terapia oncológica, se están desarrollando como terapias los mAbs biespecíficos, los conjugados de anticuerpos y los anticuerpos más pequeños, y para la administración de fármacos dirigidos para mejorar la eficacia terapéutica7. Además, los anticuerpos sirven para la focalización de biomarcadores de agentes de contraste para modalidades de imágenes moleculares como cirugía guiada por fluorescencia, imágenes fotoacústicas (PA), imágenes moleculares por ultrasonido (EE. UU.) y emisión de positrones clínicamente utilizada tomografía (PET) o tomografía computarizada por emisión de fotones individuales (SPECT)8. Por último, los anticuerpos también se pueden utilizar como agentes ranosóticos que permiten la estratificación de los pacientes y el seguimiento de la respuesta para las terapias dirigidas9. Por lo tanto, los nuevos mAbs están empezando a desempeñar un papel crítico en la detección, diagnóstico y tratamiento del cáncer.
A pesar de los avances críticos en el desarrollo y producción de mAbs novedosos y altamente específicos, las aplicaciones diagnósticas y terapéuticas pueden hacerse ineficaces debido a la complejidad del entorno tumoral. Las interacciones de anticuerpos dependen del tipo de epítopo, es decir,desi es lineal o conformacional10. Además del reconocimiento de antígenos, los anticuerpos necesitan superar las barreras naturales como las paredes de los vasos, las membranas basales y el estroma tumoral para llegar a las células diana que expresan el antígeno. Los anticuerpos interactúan con el tejido no sólo a través del dominio de unión de antígeno de fragmento variable (Fab), sino también a través del fragmento cristalino constante (Fc) que conduce a las interacciones fuera del sitio11. La segmentación también se complica por la expresión heterogénea de los marcadores tumorales a lo largo del tumor a granel y la heterogeneidad en la vascularización tumoral y el sistema linfático12,13. Además, el microambiente tumoral se compone de fibroblastos asociados al cáncer que apoyan las células tumorales, células inmunitarias tumorales que suprimen las reacciones inmunitarias antitumorales, y el endotelio tumoral que apoya el transporte de oxígeno y nutrientes, todos que interfieren con la penetración, distribución y disponibilidad de terapias o diagnósticos basados en anticuerpos. En general, estas consideraciones pueden limitar la eficacia terapéutica o diagnóstica, reducir la respuesta al tratamiento y provocar resistencia a los tumores.
Por lo tanto, para el desarrollo de terapias y diagnósticos eficientes basados en anticuerpos, es crucial evaluar la biodistribución y la interacción del conjugado basado en anticuerpos dentro del microambiente tumoral. Actualmente, en estudios preclínicos, la expresión marcadora en modelos de investigación tumoral se analiza ex vivo mediante la tinción de inmunofluorescencia (IF) de las secciones14del tumor. La tinción IF estándar se realiza con anticuerpos específicos de marcadores primarios que luego se resaltan mediante anticuerpos separados fluorescentes mente capacitados en rodajas de tejido tumoral ex vivo que se han aislado del animal. Esta técnica destaca la ubicación estática del marcador en el momento de la fijación del tejido y no proporciona información sobre cómo las terapias o diagnósticos basados en anticuerpos podrían distribuirse o interactuar en condiciones fisiológicas. Las imágenes moleculares de PET, SPECT, US y PA pueden proporcionar información sobre la distribución de agentes de contraste conjugados con anticuerpos en los modelos preclínicos vivos8,15. Dado que estas modalidades de diagnóstico por imágenes no son invasivas, se pueden realizar estudios longitudinales y se pueden recopilar datos sensibles al tiempo con un número mínimo de animales por grupo. Sin embargo, estos enfoques de imágenes moleculares no invasivos no son lo suficientemente sensibles y no tienen suficiente resolución para la localización de la distribución de anticuerpos a nivel celular. Además, las características físicas y biológicas del anticuerpo primario pueden modificarse drásticamente por la conjugación de un agente de contraste16.
Con el fin de tener en cuenta las condiciones fisiológicas y patológicas in vivo de cómo interactúan y diagnostica la terapia basada en anticuerpos dentro del entorno tumoral y obtener una distribución celular e incluso subcelular de alta resolución perfiles de anticuerpos no conjugados, proponemos un enfoque IF, considerado In Vivo Immunofluorescence Localization (IVIL), en el que el anticuerpo específico del antígeno se inyecta in vivo por vía intravenosa. El tratamiento o diagnóstico basado en anticuerpos, que actúa como anticuerpo primario, circula en los vasos sanguíneos funcionales y se une a su proteína diana en el entorno tumoral vivo de alta precisión. Después del aislamiento de tumores in vivo-etiquetados con el anticuerpo primario, se utiliza un anticuerpo secundario para localizar conjugados de anticuerpos acumulados y retenidos. Este enfoque es similar a un enfoque histológico IF descrito anteriormente que inyecta anticuerpos etiquetados fluorescentemente17. Aunque aquí, el uso de anticuerpos no conjugados evita un cambio potencial en las características de biodistribución inducido por la modificación de anticuerpos. Además, la aplicación ex vivo de anticuerpos secundarios fluorescentes evita una posible pérdida de señal de fluorescencia durante la recolección y el procesamiento del tejido y proporciona amplificación de la intensidad de la señal de fluorescencia. Nuestro enfoque de etiquetado refleja la biodistribución in vivo de fármacos basados en anticuerpos y agentes específicos y puede proporcionar información importante para el desarrollo de nuevos agentes diagnósticos y terapéuticos.
Aquí, describimos dos aplicaciones del método IVIL aplicados en estudios anteriores que investigan la biodistribución y accesibilidad de agentes de contraste basados en anticuerpos para enfoques de imágenes moleculares para la detección del cáncer de mama. En primer lugar, la biodistribución de un conjugado de tinte infrarrojo cercano a los anticuerpos (anticuerpo anti-B7-H3 unido al tinte de fluorescencia infrarroja cercano, verde indocyanina, B7-H3-ICG) y el agente de control de isotipos (Iso-ICG) para fluorescencia y fotoacústica molecular imágenes se explora18. El método de esta aplicación se describe en el protocolo. A continuación, los resultados de la biodistribución de un anticuerpo sensible a la conformación a la netrina-1, normalmente no detectable con imágenes IF tradicionales, utilizadas con imágenes moleculares por ultrasonido, se cuantifican y presentan en los resultados representativos19. Al concluir este documento de protocolo, los lectores deben sentirse cómodos adoptando el método IVIL para sus propias aplicaciones de investigación basadas en anticuerpos.
Protocolo
Todos los métodos descritos aquí han sido aprobados por el Panel Administrativo Institucional sobre Cuidado de Animales de Laboratorio (APLAC) de la Universidad de Stanford.
1. Modelo de ratón transgénico de desarrollo de cáncer de mama
- Observe ratones del modelo de cáncer deseado para el crecimiento del tumor adecuado a través de la palpación o la medición de la pinza antes de proceder.
NOTA: Aquí se utilizó el modelo murino transgénico del desarrollo del cáncer de mama (FVB/N-Tg(MMTV-PyMT)634Mul/J) (MMTV-PyMT). Estos animales desarrollan espontáneamente carcinomas mamarios invasivos entre las 6 y 12 semanas de edad en cada glándula mamaria20. Las glándulas mamarias normales se utilizaron como controles de los habances transgénicos negativos y emparejados con la edad.
2. Inyección intravenosa de agentes de anticuerpos específicos e inespecíficos
- Purificar los anticuerpos de control de isotipo B7-H3 y IgG de conejo en una columna de desalación (por ejemplo, PD-10) para eliminar los conservantes y los tampones de almacenamiento siguiendo las instrucciones del fabricante.
NOTA: Algunos anticuerpos pueden necesitar una mayor purificación con el protocolo21basado en cuentas de agarosa en proteínas A. - Dosis alícuotas de 33 g de cada conjugado de anticuerpos en tubos de microcentrífuga individuales.
NOTA: La dosis del agente administrado puede variar dependiendo de la aplicación y coincide con las dosis en las que se utiliza rutinariamente el conjugado de anticuerpos. La concentración de las soluciones de anticuerpos es necesaria si el volumen es superior a 100 ml para la seguridad animal. - En el punto de tiempo deseado antes de la recolección de tejido, aquí 96 h, anestesiar al animal portador del tumor con 2% de isoflurano fluyendo en oxígeno a 2 L/min, y colocar en una etapa calentada de 37 oC. Haga un pellizco de dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo del de
- Para prepararse para la inoculación de la vena de cola de las soluciones de anticuerpos, desinfecte la cola del animal limpiando tres veces con una toallita de alcohol. Dilatar las venas de la cola calentando con una almohadilla de calor durante aproximadamente 30 s. Evite calentar todo el animal. Limpie la cola una vez más con una toallita de alcohol después de quitar la almohadilla de calor.
- Usando un catéter de vena de cola 27G, inserte la aguja de mariposa en una de las dos venas laterales de la cola y fije cuidadosamente la cola con la aguja insertada a la etapa con un pedazo de cinta quirúrgica.
NOTA: El retroceso visible de la sangre hacia el catéter indica la ubicación adecuada de la aguja dentro de la vena de la cola. - Enjuague el catéter con 25 ml de solución salina tamponada de fosfato estéril (PBS) y, a continuación, inyecte la solución de anticuerpos en el catéter utilizando jeringas de insulina. Enjuague el catéter una vez más con 25 ml de PBS estéril.
- Retire la aguja de la cola y aplique presión para detener cualquier sangrado.
- Apague la anestesia y observe al animal hasta que esté completamente despierto para detectar cualquier signo de angustia.
3. Recolección y preparación de tejidos tumorales diana
- En el momento deseado, eutanasia humanamente al animal de acuerdo con el procedimiento institucional aceptable, aquí, por inhalación gradual de 100% CO2 de un tanque de gas comprimido con un caudal de desplazamiento de cámara de 10-30% volumen/min.
NOTA: Algunas aplicaciones de la técnica IVIL requieren eutanasia por perfusión cardíaca con PBS para eliminar el anticuerpo circulante libremente19,22. - Después de la confirmación de la eutanasia humana a través del cese del movimiento respiratorio y cardíaco, la falta de respuesta de pellizcar de los dedos del dedo del dedo del dedo del tiempo y el encaneado de las membranas mucosas, excluya los tejidos tumorales utilizando tijeras quirúrgicas y fórceps de la siguiente manera:
- Coloque el ratón en la posición supina y agarrando sólo la capa externa de la piel entre el conjunto de glándulas mamarias más cercanas a la cola(5o) con fórceps, haga una pequeña incisión con un par de tijeras quirúrgicas.
- Introducir las tijeras cerradas en el corte y abrir lentamente la punta para separar cuidadosamente la piel de la membrana de la pared abdominal subyacente manteniéndola intacta.
- Hacer una incisión vertical por el abdomen, continuando para separar la piel de la membrana interna. Entre las glándulasmamarias 3rd y 4, haz un corte horizontal a través del abdomen para permitir la retracción de la piel y la visualización de las glándulas mamarias.
NOTA: Los tumores y glándulas mamarias se encuentran superficialmente debajo de la piel. - Agarrando cada tumor o glándula normal con fórceps, recorta cuidadosamente la piel adherida usando tijeras quirúrgicas.
- Coloque los tejidos extirpados en moldes base desechables de tejido, preetiquetados y llenos con un medio de incrustación de temperatura de corte óptima (OCT) y congele los moldes rápidamente mediante la colocación en hielo seco. Con el fin de estudiar la administración fuera de destino, exponer otros tejidos u órganos de interés(porejemplo, el hígado o los pulmones).
NOTA: Para pausar el protocolo en este punto, guarde los bloques de tejido congelado a -80 oC hasta que esté listo para continuar. - Con un criostato, seccione los bloques de tejido congelado con un grosor de 10 m y coloque secciones adyacentes en diapositivas de vidrio de adhesión preetiquetadas.
NOTA: Para pausar el protocolo en este punto, guarde las diapositivas a -80 oC hasta que estén listas para continuar.
4. Protocolo de tinción Ex vivo
NOTA: Para la comparación cuantitativa entre imágenes de microscopía de fluorescencia, todas las diapositivas se tiñen al mismo tiempo con las mismas soluciones preparadas.
- Enjuague los portaobjetos congelados con PBS a temperatura ambiente durante 5 min para eliminar los PTU.
- Demarca las secciones de tejido con una pluma de barrera hidrófoba para reducir el volumen de soluciones necesarias durante la tinción.
NOTA: Tenga cuidado de no permitir que la pluma corra por encima de las muestras de tejido, ya que puede extraer el tejido de la diapositiva o evitar manchas adecuadas en la parte del tejido afectada. No permita que las secciones tisulares se deshidraten en ningún momento. - Fijar las secciones de tejido con 4% de solución de paraformaldehído durante 5 min.
- Enjuague los portaobjetos en PBS durante 5 min.
- Permeabilizar secciones de tejido con 0.5% Triton-X 100 en PBS durante 15 min.
- Enjuague los portaobjetos en PBS durante 5 min.
- Bloquear los tejidos con 3% p/v albúmina sérica bovina (BSA) y 5% v/v suero de cabra, ambos en PBS (solución de bloqueo) durante 1 h a temperatura ambiente.
NOTA: Haga coincidir el suero de la solución de bloqueo con el animal huésped de anticuerpos secundarios. - Enjuague los portaobjetos en PBS durante 5 min.
- Incubar secciones con anticuerpos primarios que mantengan registros como se desee, posiblemente un marcador nuclear común (por ejemplo, DAPI), vascular (por ejemplo, CD31) o citoplasma (por ejemplo, actina). Aquí, la rata antiratón CD31 (marcador vascular) a una dilución 1:100 se utilizó de acuerdo con las instrucciones del fabricante en la solución de bloqueo durante la noche a 4 oC protegida de la deshidratación en una bandeja deslizante.
NOTA: No añada anticuerpos primarios adicionales ni conjugados de anticuerpos. El conjugado que se inyectó y se permitió que se acumulara en los tejidos in vivo actúa como el anticuerpo primario. - Enjuague las diapositivas en PBS durante 5 min tres veces, cambiando el PBS cada vez.
- Incubar diapositivas con anticuerpos secundarios para etiquetar anticuerpos primarios. Para esta aplicación, visualice el anticuerpo anti-B7-H3 utilizando el anticuerpo anticonejo de cabra conjugado AlexaFluor-546 (dilución 1:200, optimizado según las instrucciones del fabricante) y CD31 con anticuerpo secundario antirata de cabra AlexaFluor-488 (1:200 Dilución, optimizada según las instrucciones del fabricante) en solución de bloqueo, protegida de la luz y la deshidratación en una bandeja deslizante, durante 1 h a temperatura ambiente.
NOTA: Los anticuerpos secundarios son del mismo animal huésped, pero coinciden con la afinidad de los anticuerpos secundarios con las especies anfitrionas del anticuerpo primario respectivo. Las diapositivas están protegidas de la luz a partir de este punto. - Enjuague las diapositivas en PBS durante 5 min tres veces, cambiando el PBS cada vez.
- Aplique una gota del medio de montaje en el centro de la rebanada de tejido y coloque cuidadosamente un cubreobjetos evitando el atrapamiento de burbujas de aire.
- Selle los bordes de la cubierta con esmalte de uñas transparente y deje secar.
NOTA: Para pausar el protocolo durante un máximo de una semana en este punto, guarde las diapositivas a -20 oC hasta que estén listas para continuar.
5. Imágenes por microscopía confocal y análisis cuantitativo de imágenes
NOTA: La preparación del microscopio confocal y los parámetros de imagen dependerá del sistema confocal utilizado. El microscopio utilizado aquí se compró comercialmente (por ejemplo, el sistema Zeiss LSM 510 Meta) y se utilizó el software de adquisición asociado (por ejemplo, Zen 2009). Sin embargo, muchos de estos pasos se aplicarán a cualquier microscopio confocal y asumirán conocimientos básicos de microscopía confocal.
- Después de encender y calentar el sistema, seleccione el objetivo deseado; aquí se utilizó un objetivo de 20x (apertura numérica a 0,8).
- Cargue una diapositiva de control positivo, deslice hacia abajo, para permitir la optimización para la señal más brillante. Imágenes en el canal rojo, enfoque el sistema en la muestra en el modo de imagen en vivo.
- Para cada canal láser utilizado, optimice la intensidad del láser, la ganancia maestra y el tamaño del agujero de la siguiente manera:
- Cambie al modo continuo para la creación de imágenes.
- Optimice la intensidad láser (que controla la potencia del láser) y las barras deslizantes de ganancia (maestro) (que controla el voltaje del tubo fotomultiplicador) mientras supervisa el histograma de la tabla de búsqueda (LUT). Ajuste estos dos ajustes hasta que se llene el rango dinámico del histograma sin saturar píxeles.
NOTA: Si la intensidad del láser es demasiado alta, se producirá un fotoblanqueo. Si la Ganancia (Maestro) es demasiado alta, la imagen se volverá ruidoso. Idealmente, la Ganancia (Maestro) estará en el medio de su rango. - Ajuste el agujero en 1 unidad ventilada (AU), que proporciona la resolución más alta y la rebanada z más delgada.
- Deslice la barra de desplazamiento digital para minimizar el suelo de ruido en el histograma LUT para un fondo negro real.
NOTA: Una vez que los ajustes de microscopía estén optimizados para cada canal láser y objetivo, manténgalos constantes durante toda la sesión de imágenes y para la toma de imágenes de todas las diapositivas, para permitir la comparación cuantitativa entre diapositivas.
- En la ficha Modo de adquisición, en Promedio, seleccione el número y la profundidad de bits deseados . Haga clic en el botón Óptimo para establecer el tamaño de píxel óptimo.
- Utilice el botón Adquisición de Snap para recopilar una imagen de alta calidad. Aquí, se seleccionaron campos de visión aleatorios dentro del tumor, pero otras áreas de interés pueden aplicarse para diferentes aplicaciones (vasos, márgenes tumorales, profundidad de penetración, etc.)
- Guarde los archivos de imagen en el formato utilizado por el software confocal (aquí, ".lsm") para el procesamiento y cuantificación sin conexión.
NOTA: Si no todas las diapositivas se crean imágenes durante la misma sesión, guarde la configuración y vuelva a cargarla en visitas posteriores, aunque no se recomienda volver a crear una imagen de la misma diapositiva debido al fotoblanqueo. - Realice las mediciones cuantitativas de intensidad de fluorescencia. Abra Fiji (Fiji is Just ImageJ software)19,23 y cargue un archivo de imagen .lsm arrastrándolo a la barra de estado.
- Divida los datos del canal de color. Vaya a Imagen > Pilas > Canales divididos.
- Preprocesar las imágenes de fluorescencia según sea necesario, es decir, restar la señal de fondo (Proceso > Restar fondo) o reducir el ruido a través de un método de filtrado.
- Segmente el canal de color correspondiente a la proteína de referencia (vascular, nuclear, mancha celular) estableciendo un umbral en la intensidad de la señal (Imagen > Ajustar > Umbral).
NOTA: El umbral manual introduce la subjetividad en el análisis de imágenes, por lo tanto, el uso de un algoritmo de umbral automatizado o la referencia a histogramas de imagen hace que los resultados del análisis de imágenes sean menos sesgados. - Utilice este umbral para crear una máscara binaria (Proceso > Binario > Convertir en máscara).
- Mida y etiquete los ROI dentro de la máscara (Analizar > Analizar partículas > Comprobar agregar al administrador > Aceptar).
- Aplique LOS ROI al canal de color correspondiente al anticuerpo de interés (Haga clic en imagen de canal, Analizar > Herramientas > Administrador de ROI > Medir). Esto aplicará los ROI de máscara a la imagen de anticuerpos y proporcionará mediciones de imagen para las secciones de etiquetas en la ventana Resultados. Guardar ventana de resultados(Archivo > Guardar).
- Calcular la estadística de interés deseada, como la intensidad media de fluorescencia como se describe aquí24.
- Realice todos los pasos de procesamiento de forma idéntica a cada imagen dentro de un conjunto de diapositivas. Cree una macro para hacer esto automáticamente para lotes de imágenes grandes23.
- Para la visualización de imágenes solo después de mediciones cuantitativas, aplique ajustes cualitativos de imagen para optimizar la visualización de patrones de biodistribución ajustando el mínimo, el máximo, el brillo y el contraste a los mismos niveles en todas las diapositivas (Imagen > Ajustar > Brillo/Contraste).
- Convierta el tipo de imagen (Imagen > Texto > Color RGB) y guarde archivos en un tipo de imagen sin pérdidas como .tiff ( Archivo> Guardar como > Tiff...)para su uso en presentaciones y publicaciones.
Resultados
El método IVIL se utilizó aquí para examinar la biodistribución in vivo y la interacción tisular de B7-H3-ICG e Iso-ICG, permitiendo que los agentes, después de la inyección intravenosa en un animal vivo, interactúen con el tejido diana durante 96 h, y luego una vez que los tejidos cosechados, para actuar como los anticuerpos primarios durante la inmunomancha ex vivo. El método IVIL también se comparó con la tinción estándar ex vivo IF de los tejidos para el marcador B7-H3. Las glándulas mamarias murinas normales no expresan el marcador B7-H3, confirmado en el ex vivo, la tinción IF estándar, y no acumulan anticuerpos a través de otros mecanismos pasivos, y, por lo tanto, no se detectó acumulación de B7-H3-ICG o Iso-ICG, resultado negativo(Figura 1, fila superior). Sin embargo, los tumores mamarios murinos expresan B7-H3 tanto en la vasculatura como en el epitelio (como lo confirma la tinción IF estándar), y el IVIL fue capaz de resaltar el agente B7-H3-ICG que se había acumulado fuertemente en la vasculatura y fue capaz de extravasar parcialmente desde la vasculatura para unirse a las propias células cancerosas aunque de una manera heterogénea en comparación con la distribución uniforme del marcador B7-H3 a través de los tumores, también se muestra en la Figura 1,fila inferior. Además, a pesar de que el agente Iso-ICG no tiene especificidad molecular, todavía se demostró que se acumularía de manera inespecífica, debido a las interacciones fc, el drenaje intersticial deficiente, y el efecto de permeabilidad y retención mejorada dentro de la mamez murina tumores (Figura 1). Esta diferencia se destaca en los patrones de biodistribución mostrados entre los dos agentes, y mejora aún más los resultados de unión específicos del agente de anticuerpos específico, y representa dos posibles resultados de un resultado positivo.
Los resultados representativos de B7-H3-ICG demuestran cómo el método IVIL puede utilizarse como método cualitativo para describir la biodistribución general de anticuerpos/anticuerpos conjugados. Sin embargo, a veces puede ser necesaria una interpretación más cuantitativa, o un anticuerpo puede tener una capacidad de unión altamente sensible y específica de la conformación. En estas situaciones, IVIL también puede proporcionar la información deseada. En un segundo ejemplo, en el que se iba a estudiar la expresión de la proteína netrrina-1 en los tejidos tumorales y su colocalización con endotelio tumoral CD31 positivo, la técnica IVIL también se aplicó con éxito19.
Netrin-1 es una proteína secreta de 65 kDa que está sobreexpresada en ciertos tipos de cáncer como el cáncer de mama metastásico25,26. Con el fin de desarrollar un enfoque de imagen molecular para netrin-1, la disponibilidad in vivo de la proteína tuvo que determinarse19. Además, como el anticuerpo anti-netrin-1 no tiene suficiente afinidad para su antígeno después de la fijación del tejido, se requirió un protocolo de tinción alternativo a la inmunohistoquímica clásica o la tinción IF y se implementó IVIL. El anticuerpo anti-netrina-1 humanizado y un anticuerpo humano de control del isotipo IgG se inyectaron por vía intravenosa 24 horas antes de la perfusión cardíaca y la acumulación de tumores. La perfusión cardíaca se aplicó para reducir la tinción de fondo inespecífico en la vasculatura y para mejorar la detección de una acumulación significativa de anticuerpos anti-netrina-1 en comparación con la señal de anticuerpos de control de isotipo cuando la expresión objetivo es limitada. Las secciones tumorales fueron etiquetadas ex vivo con vasculatura destacando anticuerpo anti-CD31 (anticuerpo CD31 antiratón de rata(Tabla de Materiales)y anticuerpos secundarios fluorescentes, Alexa 488-coupled goat anti-rat IgG, 1:500 dilución y Alexa Fluor 594- igG antihumano de cabra acoplada, dilución 1:500 respectivamente) se utilizaron para revelar anti-netrin-1/isotipo y anti-CD31 mAbs. Las intensidades de la señal de fluorescencia del anticuerpo de control anti-netrina-1 e isotipo se cuantificaron para determinar las diferencias en la tinción colocalizadas con CD31. La Figura 2 muestra que el anticuerpo anti-netrin-1 se acumuló específicamente en el compartimiento tumoral epitelial de los tumores mamarios MMTV-PyMT (un resultado positivo), mientras que no había señal en las glándulas mamarias normales (un resultado negativo). El anticuerpo co-localicó aún más con el marcador endotelial CD31. La comparación con los tumores inyectados por anticuerpos con isotipos y las glándulas normales mostró que la acumulación epitelial era específica para el tejido tumoral. Hubo acumulación de señal en las células endoteliales de tumores y glándulas normales debido a la unión a la netrrina-1 (tumores) y las interacciones fc no específicas (tumores y glándulas mamarias normales)11. Por lo tanto, se requirió la cuantificación de la señal de fluorescencia utilizando una máscara binaria basada en CD31 y demostró que la señal de anticuerpos anti-netrina-1 era significativamente mayor que la señal de anticuerpo de control de isotipo en el tejido tumoral, lo que sugiere netrina-1 específicamente acumulado en el endotelio tumoral.

Figura 1 : Micrografías confocales representativas de la comparación de la localización conjugada conyugte-ICG de anticuerpos B7-H3 e icono conjugado de anticuerpos-ICG de control de isotipos no específicos en glándulas mamarias murinas que contienen tejidos normales o carcinomas. (Arriba) Glándulas mamarias murinas normales de un animal inyectado por vía intravenosa con 33 g de Iso-ICG o B7-H3-ICG (rojo) y contramanchado con CD31 (verde) sin manchas de los conjugados de anticuerpos. Se demostró que los tejidos normales no tenían expresión de B7-H3 por la tinción estándar ex vivo IF. (Abajo) Tumores mamarios invasivos de un animal inyectado por vía intravenosa con 33 g de B7-H3-ICG o Iso-ICG (rojo) y trompeote vascular CD31 (verde) que muestra una tinción extensa y heterogénea, aunque con diferentes patrones de distribución, tanto para el B7-H3-ICG como para el Agentes iso-ICG. B7-H3-ICG se une fuertemente a la vasculatura, el primer punto de contacto in vivo, y luego es capaz de extravasar de la vasculatura para manchar heterogéneamente el epitelio tumoral. El ISo-ICG muestra acumulación no específica dentro de los tejidos tumorales. La tinción IF ex vivo estándar muestra una expresión uniforme del marcador B7-H3 en células epiteliales y endoteliales. El color amarillo indica la señal de canal rojo y verde co-localizada. La barra de escala es de 100 m y es consistente entre los paneles. Haga clic aquí para ver una versión más grande de esta figura.
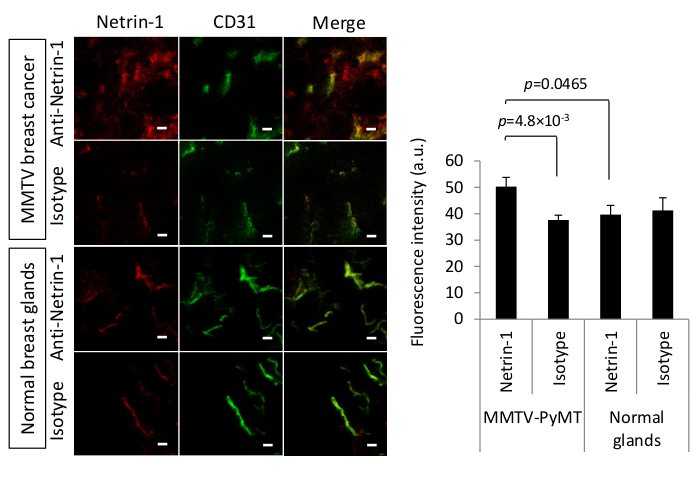
Figura 2 : Inmunolocalización in vivo de netrin-1 en tumores mamarios MMTV-PyMT. (Izquierda) Micrografías confocales representativas del método IVIL para detectar la expresión de netrina-1 (roja) o la expresión de control de isotipos (rojo) en el carcinoma murino y las glándulas mamarias normales. IVIL confirma la señal epitelial para la netrin-1 en los tumores MMTV-PyMT, pero no en las glándulas mamarias normales, y la señal de netrina-1 fuerte en las células endoteliales (tinción CD31, verde) en los tumores mamarios y la señal significativamente más débil de la netrina-1 en las glándulas mamarias normales. El color amarillo indica la señal de canal rojo y verde co-localizada. Las barras de escala indican 20 m. Para la detección de la proteína netrin-1 en el endotelio tumoral, se inyectaron por vía intravenosa 100 g de NET1-H-mAb humanizado primario o 100 g de anticuerpo de control de isotipo IgG humano 24 h antes de la recolección del tumor. Los anticuerpos circulantes libres se extirparon por perfusión cardíaca con PBS y el tejido tumoral fue aislado, congelado con flash y seccionado a 15 m de espesor en un criostato. Las células endoteliales fueron etiquetadas con anticuerpo primario CD31 antiratón de rata seguido de IgG antirvino de cabra con acoplamiento Alexa 488. Para revelar el anticuerpo primario dirigido a netrin-1, se utilizó el IgG antihumano de cabra con acoplamiento secundario Alexa Fluor 594. Para evitar la interacción inespecífica de los anticuerpos secundarios de la cabra, las muestras de tejido se bloquearon con suero de cabra. (Derecha) Gráfico de barras que destaca la cuantificación de la señal de anticuerpos de control de anti-netrina-1 o isotipo que coloca con la señal de anticuerpos anti-CD31. N-13 tumores (de dos ratones) por grupo de glándulas mamarias MMTV-PyMT y N-7 (de un ratón) por grupo de glándulas normales; Las barras de error presentan SEM; Se realizaron comparaciones de dos grupos con la prueba t de Student. Figura reimpresa con permiso de 19 bajo la licencia creative commons CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este método tiene varios pasos críticos y requiere posibles modificaciones para garantizar una implementación correcta. En primer lugar, la dosis y el momento de la inyección intravenosa conjugada con anticuerpos/anticuerpos deben adaptarse a la aplicación específica. Generalmente, se deben utilizar dosis que sean consistentes con la forma en que el conjugado de anticuerpos se utilizará típicamente, es decir, dosis coincidentes del anticuerpo terapéutico o agente de contraste basado en anticuerpos. Además, se debe considerar cuidadosamente el momento de la recolección de tejidos diana. Los anticuerpos y conjugados de anticuerpos tienen tiempos de circulación más largos que los medicamentos estándar y los agentes de contraste, sin embargo, estos son altamente variables y deben optimizarse para la aplicación deseada, pero se recomienda permitir al menos 24 h de tiempo de circulación27 . En segundo lugar, durante la recolección de tejido objetivo, puede ser necesario implementar una técnica de perfusión intracardiaca para eliminar los anticuerpos que circulan libremente del grupo sanguíneo19. Mientras miraba la distribución tumoral de B7-H3-ICG, se encontró innecesario debido a tiempos de circulación suficientemente largos (96 h) y la localización extravascular del agente. Sin embargo, para la aplicación de netrin-1 del método IVIL, la perfusión cardíaca se consideró pertinente debido a la expresión endotelial de la netrina-1 y su nivel de expresión relativamente bajo. En tercer lugar, durante la tinción de tejido ex vivo es imperativo manchar cualquier diapositiva que se comparará cuantitativamente durante la misma sesión y con las mismas soluciones para evitar variaciones normales entre lotes. Asegúrese de que las diapositivas se enjuagan correctamente entre los escalones y que la solución de pluma hidrófoba no entre en contacto con el tejido para evitar manchas subóptimas. Por último, durante la microscopía confocal, mantenga los mismos ajustes de imagen entre diapositivas para permitir la cuantificación relativa y trabaje rápidamente para evitar el fotoblanqueo de las diapositivas. Estos puntos clave aumentarán la probabilidad de una implementación exitosa de la IVIL.
Hay varias ventajas para el método IVIL. En primer lugar, si bien el método es similar a las técnicas IF estándar, las dos proporcionan información significativamente diferente. La tinción IF indica la ubicación anatómica de los marcadores moleculares dentro del tejido en un momento dado (cuando el tejido fue recogido y fijado). Sin embargo, IVIL proporciona información sobre cómo un conjugado de anticuerpos o anticuerpos, como lo demuestra la localización de B7-H3-ICG, está distribuyendo e interactuando, ya sea que sea una acumulación, internalización o retención específica o específica en el objetivo Tejido. Esto es crítico para los estudios farmacocinéticos/dinámicos y de biodistribución. En segundo lugar, los métodos IF tradicionales están, a veces, limitados por la fijación de los tejidos que pueden causar distorsión de antígeno o enmascaramiento que impide la unión por el anticuerpo primario28. Por lo tanto, IVIL puede ser útil cuando la tinción IF estándar o inmunohistoquímica fallan. La técnica IVIL puede considerarse un método complementario para verificar la actividad de anticuerpos in vivo que de otro modo sería indetectable. Por último, aquellos familiarizados con las técnicas tradicionales de tinción IF encontrarán el método sencillo en la ejecución y tendrán a mano la mayoría de los materiales requeridos.
El método IVIL tiene algunas limitaciones. En primer lugar, debido a la necesidad de eutanasia rinestés al animal para cosechar los tejidos diana, IVIL sólo proporciona información de interacción biológica en un solo punto de tiempo. La inyección del anticuerpo primario o conjugado de anticuerpos en diferentes momentos en diferentes animales permitirá una ventana de tiempo más amplia de información sobre la biodistribución y la interacción in vivo. En segundo lugar, si los usuarios no están familiarizados con las técnicas animales in vivo, como la inyección intravenosa de venas de cola o la posible perfusión intracardiaca, esto puede ser una limitación al método. Estos métodos requieren que el personal cualificado funcione de forma fiable. Sin embargo, el uso de un catéter durante la inyección de la vena de cola garantiza la administración de toda la dosis, ya que se puede confirmar la colocación adecuada de la aguja antes de la inyección. Además, una alternativa a la inyección de vena de cola que podría considerarse es la inyección retro-orbital, que normalmente tiene una mayor tasa de éxito con personal menos experimentado. La necesidad de manchar e imágenes de todas las diapositivas de tejido en el mismo lote para permitir una evaluación cuantitativa limita el número de muestras y marcadores que se pueden incluir en un solo estudio. El estudio podría necesitar ser organizado en tinción en serie en diferentes días y en rebanadas de tejido adyacentes para recopilar la información deseada. Por último, el uso de anticuerpos de origen emparejados con especies, es decir, anticuerpos antiratón murinos en modelos preclínicos murinos, plantea un problema de tinción de fondo no específica con anticuerpos secundarios. Por lo tanto, se requiere el uso de anticuerpos primarios no coincidentes con las especies como se presenta en este estudio, o se tendrían que utilizar anticuerpos primarios marcados fluorescentesmente con especies.
La técnica IVIL es útil para el análisis de biodistribución de anticuerpos diagnósticos y terapéuticos para muchas aplicaciones. Se han notificado previamente diferentes aplicaciones para el anticuerpo intravenoso o la inyección de ligando y el análisis de tejido ex vivo, que confirman el interés de introducir ampliamente este procedimiento de tinción. Robertson y sus colegas etiquetaron elementos vasculares como capilares endoteliales y vasos más grandes con inyecciones intravenosas de Lycopersicon esculentum aglutininina (lectina de tomate)29. La técnica era compatible con histoquímica e inmunocitoquímica y revelaba patrones vasculares y características parénquimas funcionales. Sin embargo, el uso de ligandos fluorescentes fue limitado por la rápida degradación de la fluorescencia tras la inyección30. Como se demuestra en el protocolo IVIL, la inyección de un anticuerpo primario in vivo seguido de etiquetado ex vivo con un anticuerpo fluorescente secundario podría ser un enfoque más robusto. Otra aplicación interesante de este tipo de tinción in vivo IF es el etiquetado de linfocitos intravasculares como lo demuestra Anderson y sus colegas31. El anticuerpo inyectado por vía intravenosa se utilizó para etiquetar linfocitos localizados en los vasos sanguíneos, que posteriormente fueron recogidos y procesados posteriormente para el análisis de citometría de flujo de marcadores inmunológicos. Por último, para evaluar la administración y localización histológica de las terapias de anticuerpos que se entregaron a pacientes con carcinoma de células escamosas de cabeza y cuello (HNSCC), se realizó un primer estudio en humanos de distribución de anticuerpos utilizando administrado sin título fluorescente mente flutático etiquetado como anticuerpo terapéutico cetuximab-IRDye800CW32. Los datos se compararon con los análisis histológicos y mostraron que la señal fluorescente disminuyó con la distancia del tumor confirmando la especificidad. Sin embargo, el anticuerpo terapéutico no llegó a todas las regiones de expresión de antígeno, especialmente las regiones tumorales bien diferenciadas con altos niveles del antígeno receptor del factor de crecimiento epidérmico (EGFR). En el contexto actual de la investigación oncológica centrada en el desarrollo de terapias e inmunoterapias dirigidas que se encuentran con una fuerte resistencia y falta de eficacia, el método IVIL sería una excelente herramienta para estudiar la distribución de anticuerpos terapéuticos como PD-1/PD-L-1 o HER233,34. Estos resultados son extremadamente valiosos para entender por qué las terapias dirigidas son eficaces en ciertos casos promoviendo el desarrollo de enfoques novedosos. En conjunto, estos ejemplos ponen de relieve la importancia potencial del enfoque IVIL.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al Dr. Andrew Olson (Stanford Neuroscience Microscopy Service) por las discusiones y el uso del equipo. Agradecemos al Dr. Juergen K. Willmann por su tutoría. Este estudio fue apoyado por la subvención NIH R21EB022214 (KEW), NIH R25CA118681 (KEW) y NIH K99EB023279 (KEW). El Servicio de Microscopía de Neurociencia de Stanford fue apoyado por NIH NS069375.
Materiales
| Name | Company | Catalog Number | Comments |
| Animal Model | |||
| FVB/N-Tg(MMTV-PyMT)634Mul/J | The Jackson Laboratory | 002374 | Females, 4-6 weeks of age |
| Animal Handling Supplies | |||
| 27G Catheter | VisualSonics | Please call to order | Vevo MicroMarker Tail Vein Access Cannulation Kit |
| Alcohol Wipes | Fisher Scientific | 22-246073 | |
| Gauze Sponges (4" x 4" 16 Ply) | Cardinal Health | 2913 | |
| Heat Lamp | Morganville Scientific | HL0100 | |
| Isoflurane | Henry Schein Animal Health | 29404 | |
| Ophthalmic Ointment | Fisher Scientific | NC0490117 | |
| Surgical Tape | 3M | 1530-1 | |
| Tissue Collection | |||
| Disposable Base Molds | Fisher Scientific | 22-363-556 | |
| Optimal Cutting Temperature (OCT) Medium | Fisher Scientific | 23-730-571 | |
| Surgical London Forceps | Fine Science Tools | 11080-02 | |
| Surgical Scissors | Fine Science Tools | 14084-08 | |
| Antibodies | |||
| AlexaFluor-488 goat anti-rat IgG | Life Technologies | A-11006 | |
| AlexaFluor-546 goat anti-rabbit IgG | Life Technologies | A-11010 | |
| AlexaFluor-594 goat anti-human IgG | Life Technologies | A11014 | |
| Human IgG Isotype Control | Novus Biologicals | NBP1-97043 | |
| Humanized anti-netrin-1 antibody | Netris Pharma | contact@netrispharma.com | |
| Rabbit anti-Mouse CD276 (B7-H3) | Abcam | ab134161 | EPNCIR122 Clone |
| Rat anti-Mouse CD31 | BD Biosciences | 550274 | MEC 13.3 Clone |
| Reagents | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Clear Nail Polish | Any local drug store | ||
| Indocyanine Green - NHS | Intrace Medical | ICG-NHS ester | |
| Mounting Medium | ThermoFisher Scientific | TA-006-FM | |
| Normal Goat Serum | Fisher Scientific | ICN19135680 | |
| Paraformaldehyde (PFA) | Fisher Scientific | AAJ19943K2 | |
| Sterile Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 14190250 | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Supplies | |||
| Adhesion Glass Slides | VWR | 48311-703 | |
| Desalting Columns | Fisher Scientific | 45-000-148 | |
| Glass Cover Slips | Fisher Scientific | 12-544G | |
| Hydrophobic Barrier Pen | Ted Pella | 22311 | |
| Microcentrifuge Tubes | Fisher Scientific | 05-402-25 | |
| Slide Staining Tray | VWR | 87000-136 | |
| Software | |||
| FIJI | LOCI, UW-Madison. | Version 4.0 | https://fiji.sc/ |
Referencias
- Forthal, D. N. Functions of Antibodies. Microbiology Spectrum. 2 (4), 1-17 (2014).
- Boder, E. T., Midelfort, K. S., Wittrup, K. D. Directed evolution of antibody fragments with monovalent femtomolar antigen-binding affinity. Proceedings of the National Academy of Sciences of the United States of America. 97 (20), 10701-10705 (2000).
- Köhler, G., Milstein, C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 256 (5517), 495-497 (1975).
- Lonberg, N., et al. Antigen-specific human antibodies from mice comprising four distinct genetic modifications. Nature. 368 (6474), 856-859 (1994).
- McCafferty, J., Griffiths, A. D., Winter, G., Chiswell, D. J. Phage antibodies: filamentous phage displaying antibody variable domains. Nature. 348 (6301), 552-554 (1990).
- Ferlay, J., et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer. 136 (5), E359-E386 (2015).
- Reichert, J. M., Valge-Archer, V. E. Development trends for monoclonal antibody cancer therapeutics. Nature Reviews Drug Discovery. 6 (5), 349-356 (2007).
- Kircher, M. F., Willmann, J. K. Molecular Body Imaging: MR Imaging, CT, and US. Part I. Principles. Radiology. 263 (3), 633-643 (2012).
- Fleuren, E. D. G., et al. Theranostic applications of antibodies in oncology. Molecular Oncology. 8 (4), 799-812 (2014).
- Forsström, B., Bisławska Axnäs, B., Rockberg, J., Danielsson, H., Bohlin, A., Uhlen, M. Dissecting Antibodies with Regards to Linear and Conformational Epitopes. PLoS ONE. 10 (3), (2015).
- Woof, J. M., Burton, D. R. Human antibody-Fc receptor interactions illuminated by crystal structures. Nature Reviews Immunology. 4 (2), 89-99 (2004).
- Brooks, J. D. Translational genomics: The challenge of developing cancer biomarkers. Genome Research. 22 (2), 183-187 (2012).
- Tabrizi, M., Bornstein, G. G., Suria, H. Biodistribution Mechanisms of Therapeutic Monoclonal Antibodies in Health and Disease. The AAPS Journal. 12 (1), 33-43 (2009).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry. Journal of Pharmacy & Bioallied Sciences. 4 (Suppl 2), S307-S309 (2012).
- Gambhir, S. S. Molecular imaging of cancer with positron emission tomography. Nature Reviews. Cancer. 2 (9), 683-693 (2002).
- Freise, A. C., Wu, A. M. In vivo Imaging with Antibodies and Engineered Fragments. Molecular Immunology. 67 (200), 142-152 (2015).
- Cilliers, C., Menezes, B., Nessler, I., Linderman, J., Thurber, G. M. Improved Tumor Penetration and Single-Cell Targeting of Antibody-Drug Conjugates Increases Anticancer Efficacy and Host Survival. Cancer Research. 78 (3), 758-768 (2018).
- Wilson, K. E., et al. Spectroscopic Photoacoustic Molecular Imaging of Breast Cancer using a B7-H3-targeted ICG Contrast Agent. Theranostics. 7 (6), 1463-1476 (2017).
- Wischhusen, J., et al. Ultrasound molecular imaging as a non-invasive companion diagnostic for netrin-1 interference therapy in breast cancer. Theranostics. 8 (18), 5126-5142 (2018).
- Guy, C. T., Cardiff, R. D., Muller, W. J. Induction of mammary tumors by expression of polyomavirus middle T oncogene: a transgenic mouse model for metastatic disease. Molecular and Cellular Biology. 12 (3), 954-961 (1992).
- Hober, S., Nord, K., Linhult, M. Protein A chromatography for antibody purification. Journal of Chromatography B. 848 (1), 40-47 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments JoVE. (65), (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bachawal, S. V., et al. Earlier detection of breast cancer with ultrasound molecular imaging in a transgenic mouse model. Cancer Research. 73, 1689-1698 (2013).
- Fitamant, J., et al. Netrin-1 expression confers a selective advantage for tumor cell survival in metastatic breast cancer. Proceedings of the National Academy of Sciences. 105 (12), 4850-4855 (2008).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Ryman, J. T., Meibohm, B. Pharmacokinetics of Monoclonal Antibodies. CPT: Pharmacometrics & Systems Pharmacology. 6 (9), 576-588 (2017).
- Scalia, C. R., et al. Antigen Masking During Fixation and Embedding, Dissected. Journal of Histochemistry and Cytochemistry. 65 (1), 5-20 (2017).
- Robertson, R. T., et al. Use of labeled tomato lectin for imaging vasculature structures. Histochemistry and Cell Biology. 143 (2), 225-234 (2015).
- Chen, C. Y., et al. Blood flow reprograms lymphatic vessels to blood vessels. The Journal of Clinical Investigation. 122 (6), 2006-2017 (2012).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9 (1), 209-222 (2014).
- de Boer, E., et al. In Vivo Fluorescence Immunohistochemistry: Localization of Fluorescently Labeled Cetuximab in Squamous Cell Carcinomas. Scientific Reports. 5, (2015).
- Jenkins, R. W., Barbie, D. A., Flaherty, K. T. Mechanisms of resistance to immune checkpoint inhibitors. British Journal of Cancer. 118 (1), 9-16 (2018).
- Rexer, B. N., Arteaga, C. L. Intrinsic and acquired resistance to HER2-targeted therapies in HER2 gene-amplified breast cancer: mechanisms and clinical implications. Critical Reviews in Oncogenesis. 17 (1), 1-16 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados