Method Article
In vivo localização de imunofluorescência para avaliação de anticorpo terapêutico e diagnóstico biodistribuição em pesquisa de câncer
Neste Artigo
Resumo
O método de localização de imunofluorescência in vivo (IVIL) pode ser usado para examinar a biodistribuição in vivo de anticorpos e conjugados de anticorpo para fins oncológicos em organismos vivos usando uma combinação de segmentação tumoral in vivo e imunocoloração ex vivo Métodos.
Resumo
Os anticorpos monoclonais (mAbs) são ferramentas importantes na deteção, no diagnóstico, e no tratamento do cancro. São usados para desvendar o papel das proteínas no tumorigenesis, podem ser dirigidos aos biomarcadores do cancro permitindo a deteção e a caracterização do tumor, e podem ser usados para a terapia do cancro como mAbs ou os conjugados da anticorpo-droga para ativar pilhas do efetoras imune, para inibir vias de sinalização, ou matar diretamente as células que transportam o antígeno específico. Apesar dos avanços clínicos no desenvolvimento e na produção de mAbs novos e altamente específicos, as aplicações diagnósticas e terapêuticas podem ser prejudicadas pela complexidade e pela heterogeneidade do microambiente do tumor. Assim, para o desenvolvimento de terapias e diagnósticos eficientes baseados em anticorpos, é crucial avaliar a biodistribuição e a interação do conjugado anticorpo-baseado com o microambiente vivo do tumor. Aqui, nós descrevemos in vivo a localização da imunofluorescência (IVIL) como uma aproximação nova para estudar interações da terapêutica e do diagnóstico anticorpo-baseados nas circunstâncias fisiológicas e patológicas in vivo. Nesta técnica, um anticorpo antígeno-específico terapêutico ou diagnóstico é injetado intravenosamente in vivo e ex vivo localizado com um anticorpo secundário em tumores isolados. O IVIL, portanto, reflete a biodistribuição in vivo de medicamentos à base de anticorpos e agentes de segmentação. Duas aplicações do IVIL são descritas avaliando a biodistribuição e a acessibilidade de agentes de contraste anticorpo-baseados para a imagem latente molecular do cancro da mama. Este protocolo permitirá que os usuários futuros adaptem o método de IVIL para suas próprias aplicações de pesquisa anticorpo-baseadas.
Introdução
Os anticorpos monoclonais (mAb) são grandes glicoproteínas (aproximadamente 150 kDa) da superfamília da imunoglobulina que são secretadas por pilhas de B e têm uma função preliminar no sistema imune para identificar e para inibir a função biológica de, ou a marca para destruição, bactérias ou agentes patogénicos virais, e pode reconhecer a expressão anormal da proteína em células cancerosas1. Os anticorpos podem ter uma afinidade extremamente elevada a seus resumos específicos para baixo às concentrações do femtomolar que fazem lhes ferramentas altamente prometedores na biomedicina2. Com o desenvolvimento da tecnologia de hibridoma por Milstein e Köhler (premiado com o prêmio Nobel em 1984), a produção de mAbs tornou-se possível3. Mais tarde, os mAbs humanos foram gerados usando a tecnologia de exibição de fago ou cepas de camundongo transgênico e revolucionaram seu uso como novas ferramentas de pesquisa e terapêutica4,5.
O câncer é uma questão de saúde mundial e uma das principais causas de morte, criando a necessidade de novas abordagens para prevenção, detecção e terapia6. Até o momento, os mAbs permitiram o desencarceramento do papel dos genes e de suas proteínas no tumorigênese e quando dirigidos de encontro aos Biomarkers do cancer, podem permitir a deteção e a caracterização do tumor para a estratificação paciente. Para a terapia do cancro, os mAbs anticorpos, os conjugados do anticorpo-droga, e os fragmentos menores do anticorpo estão sendo desenvolvidos como o Therapeutics, e para a entrega alvejada da droga para realçar a eficácia terapêutica7. Adicionalmente, os anticorpos servem para a segmentação do biomarcador de agentes de contraste para as modalidades da imagem latente molecular tais como a cirurgia fluorescência-guiada, a imagem latente fotoacústica (PA), a imagem latente molecular do ultra-som (e.u.), e a emissão clìnica usada do positrão (PET) ou tomografia computadorizada de emissão de fóton único (SPECT)8. Por fim, os anticorpos também podem ser usados como agentes teranosóticos possibilitando a estratificação dos pacientes e o monitoramento da resposta para terapias direcionadas9. Conseqüentemente, os mAbs novos estão começando a jogar um papel crítico na deteção, no diagnóstico, e no tratamento do cancro.
Apesar dos avanços críticos no desenvolvimento e na produção de mAbs novos e altamente específicos, as aplicações diagnósticas e terapêuticas podem ser tornadas ineficazes devido à complexidade do ambiente do tumor. As interações de anticorpos dependem do tipo de epítopo, ou seja, seé linear ou conformacional10. Além do reconhecimento de antígenos, os anticorpos precisam superar barreiras naturais, como paredes de vasos, membranas basais e o estroma tumoral para alcançar células-alvo expressando o antígeno. Os anticorpos interagem com o tecido não somente através do domínio da ligação do antígeno do fragmento variável (FAB) mas também através do fragmento cristalino constante (FC) que conduz mais às interações do fora-local11. A segmentação também é complicada pela expressão heterogênea de marcadores tumorais em todo o volume tumoral e heterogeneidade na vascularização tumoral e no sistema linfático12,13. Além, o microambiente do tumor é compor dos fibroblastos Cancer-associados que apoiam pilhas do tumor, pilhas imunes do tumor que suprimem reações imunes antitumorais, e o endotélio do tumor que suporta o transporte do oxigênio e dos nutrientes, todo que interferem na penetração, distribuição e disponibilidade de terapêuticas ou diagnósticos baseados em anticorpos. Globalmente, essas considerações podem limitar a eficácia terapêutica ou diagnóstica, reduzir a resposta ao tratamento e podem resultar em resistência tumoral.
Conseqüentemente, para o desenvolvimento de terapias e de diagnósticos anticorpo-baseados eficientes, é crucial avaliar a biodistribuição e a interação do conjugado anticorpo-baseado dentro do microambiente do tumor. Atualmente, em estudos pré-clínicos, a expressão de marcadores em modelos de pesquisa tumoral é analisada ex vivo pela coloração da imunofluorescência (IF) das secções tumorais14. A coloração padrão IF é realizada com anticorpos primários específicos de marcadores, que são então destacados por anticorpos secundários com rótulo fluorescentamente em fatias de tecido tumoral ex vivo que foram isoladas do animal. Esta técnica destaca a posição estática do marcador na altura da fixação do tecido e não fornece a introspecção em como a terapêutica ou o diagnóstico anticorpo-baseado podem distribuir ou interagir em circunstâncias fisiológicas. A imagem latente molecular por animal de estimação, SPECT, nós, e PA pode fornecer a informação sobre a distribuição anticorpo-conjugated do agente do contraste em modelos pré-clínicos vivos8,15. Como essas modalidades de imagem são não invasivas, estudos longitudinais podem ser realizados e dados sensíveis ao tempo podem ser coletados com um número mínimo de animais por grupo. Entretanto, estas aproximações moleculars não invasoras da imagem latente não são sensíveis bastante e não têm bastante definição para a localização da distribuição do anticorpo a nível celular. Adicionalmente, as características físicas e biológicas do anticorpo primário podem ser drasticamente alteradas pela conjugação de um agente de contraste16.
A fim de tomar as condições in vivo fisiológicas e patológicas em consideração de como a terapêutica baseada em anticorpos e diagnósticos interagem dentro do ambiente tumoral e para obter alta resolução celular e até mesmo distribuição subcelular perfis de anticorpos não conjugados, propomos uma abordagem IF, considerada in vivo immunofluorescence Localization (IVIL), na qual o anticorpo antígeno-específico é injetado intravenosamente in vivo. O anticorpo-baseado terapêutico ou diagnóstico, agindo como um anticorpo preliminar, circula em vasos sanguíneos funcionais e liga-se a sua proteína do alvo no ambiente altamente exato, vivo do tumor. Após a isolação de tumores in vivo-etiquetados com o anticorpo preliminar, um anticorpo secundário é usado para localizar conjugados acumulados e retidos do anticorpo. Esta aproximação é similar a uma aproximação previamente descrita da histologia de injetar anticorpos cDNAs etiquetados17. Embora aqui, o uso de anticorpos não conjugados evita uma mudança potencial nas características da biodistribuição induzidas pela modificação do anticorpo. Além disso, a aplicação ex vivo do anticorpo secundário fluorescente evita uma perda possível de sinal da fluorescência durante a coleção e o processamento do tecido e fornece a amplificação da intensidade do sinal da fluorescência. Nossa aproximação da rotulagem reflete in vivo a biodistribuição de drogas anticorpo-baseadas e de agentes alvejados e pode fornecer introspecções importantes para o desenvolvimento de agentes diagnósticos e terapêuticos novos.
Aqui, nós descrevemos duas aplicações do método de IVIL como aplicado em estudos precedentes que investigam a biodistribuição e a acessibilidade de agentes de contraste anticorpo-baseados para aproximações moleculares da imagem latente para a deteção do cancro da mama. Em primeiro lugar, a biodistribuição de um conjugado de corante infravermelho próximo (anticorpo anti-B7-H3 vinculado à tintura de fluorescência infravermelha próxima, verde de indocyanina, B7-H3-ICG) e o agente de controle isotipo (ISO-ICG) para fluorescência e fotoacústica molecular a imagem latente é explorada18. O método deste aplicativo é descrito no protocolo. Em seguida, os resultados da biodistribuição de um anticorpo conformacionalmente sensível a netrin-1, tipicamente não detectável com a imagem latente tradicional do se, usado com imagem latente molecular do ultra-som, são quantificados e apresentados nos resultados representativos19. Na conclusão deste papel do protocolo, os leitores devem sentir confortável adotar o método de IVIL para suas próprias aplicações de pesquisa anticorpo-baseadas.
Protocolo
Todos os métodos aqui descritos foram aprovados pelo painel administrativo institucional de cuidados com animais de laboratório (APLAC) da Universidade de Stanford.
1. modelo transgênico do rato do desenvolvimento do cancro da mama
- Observe os camundongos do modelo de câncer desejado para o crescimento tumoral apropriado por meio de palpação ou medição de paquímetro antes de prosseguir.
Nota: o modelo murino transgênico de desenvolvimento do câncer de mama (FVB/N-TG (MMTV-PyMT) 634Mul/J) (MMTV-PyMT) foi utilizado. Estes animais desenvolvem espontaneamente carcinomas de mama invasivos entre 6 e 12 semanas de idade em cada glândula mamária20. As glândulas mamária normais foram usadas como controles dos littermates transgene-negativos, idade-combinados.
2. injeção intravenosa de agentes de anticorpos específicos e não específicos
- Purify o coelho anti-rato B7-H3 e anticorpos do controle do isotipo do coelho IgG em uma coluna de dessalinização (por exemplo, PD-10) para remover conservantes e amortecedores de armazenamento depois das instruções do fabricante.
Nota: alguns anticorpos podem necessitar A purificação mais adicional com o protocolo baseado21das contas do agarose da proteína-A. - Dosagens alíquotas de 33 μg de cada conjugado de anticorpos em tubos de microcentrífuga individuais.
Nota: dosagem do agente administrado pode variar dependendo da aplicação e coincide com as dosagens em que o conjugado de anticorpos é usado rotineiramente. A concentração das soluções de anticorpos é necessária se o volume for superior a 100 μL para a segurança dos animais. - No ponto de tempo desejado antes da colheita do tecido, aqui 96 h, anestesiar o tumor que carrega o animal com o isoflurano de 2% que flui no oxigênio em 2 L/min, e coloc em um estágio aquecido de 37 ° c. Faça uma pitada do dedo do pé para certificar-se que o nível apropriado de anesthsia estêve alcangado antes do procedimento.
- Para se preparar para a inoculação da veia cauda das soluções de anticorpos, desinfete a cauda do animal limpando três vezes com uma limpeza de álcool. Dilatar as veias da cauda por aquecimento com uma almofada de calor para aproximadamente 30 s. Evite aquecer todo o animal. Limpe a cauda mais uma vez com uma limpeza de álcool depois de remover a almofada de calor.
- Usando um cateter da veia da cauda 27G, introduza a agulha da borboleta em uma das duas veias laterais da cauda e fixe-a com cuidado a cauda com a agulha introduzida ao estágio com uma parte de fita cirúrgica.
Nota: o refluxo de sangue visível no cateter indica a localização correcta da agulha na veia da cauda. - Lave o cateter com 25 μL de soro fisiológico tamponado com tampão fosfato (PBS) e, em seguida, injete a solução de anticorpos no cateter utilizando seringas de insulina. Lave o cateter mais uma vez com 25 μL de PBS estéril.
- Retire a agulha da cauda e aplique pressão para parar qualquer sangramento.
- Desligue a anestesia e observe o animal até que esteja totalmente acordado para qualquer sinal de angústia.
3. coleta e preparação de tecidos-alvo do tumor
- No ponto de tempo desejado, humanamente eutanizar o animal de acordo com o procedimento institucional aceitável, aqui, por inalação gradual de 100% CO2 de um tanque de gás comprimido com uma taxa de fluxo de deslocamento de câmara de 10-30% volume/min.
Nota: algumas aplicações da técnica do ivil exigem a eutanásia pela perfusão cardíaca com PBS para remover livremente o anticorpo19,22de circulação. - Após a confirmação da eutanásia humana através da cessação do movimento respiratório e cardíaco, falta de resposta pitada de dedo do pé, e envelhecimento de membranas mucosas, tecidos de tumor de consumo usando tesouras cirúrgicas e fórceps como segue:
- Coloque o mouse na posição supina e agarrando apenas a camada externa da pele entre o conjunto de glândulas mamárias mais próximas à cauda (5th) com fórceps, fazer uma pequena incisão com um par de tesouras cirúrgicas.
- Introduza a tesoura fechada no corte e abra lentamente a ponta para separar cuidadosamente a pele da membrana da parede abdominal subjacente mantendo-a intacta.
- Faça uma incisão vertical até o abdômen, continuando a separar a pele da membrana interna. Entre as glândulas mamárias 3RD e 4, faça um corte horizontal em todo o abdômen para permitir a retração da pele e visualização dasglândulas mamárias .
Nota: os tumores e as glândulas mammary são situados superficialmente a pele. - Agarrando cada tumor ou glândula normal com fórceps, corte com cuidado afastado a pele unida usando tesouras cirúrgicas.
- Coloc tecidos extirpados em moldes da base descartáveis do tecido, pré e enchido com o meio de incorporação ideal da temperatura de corte (OCT) e congele os moldes rapidamente pela colocação no gelo seco. A fim de estudar a entrega fora do alvo, o consumo de outros tecidos ou órgãos de interesse(por exemplo, o fígado ou pulmões).
Nota: para pausar o protocolo neste ponto, armazene blocos congelados do tecido em-80 ° c até que esteja pronto para prosseguir. - Usando um criostat, seção de blocos de tecido congelado a 10 μm de espessura e colocar seções adjacentes em slides de vidro de aderência pré-rotulados.
Observação: para pausar o protocolo neste ponto, armazene slides em-80 ° c até que esteja pronto para prosseguir.
4. protocolo de coloração ex vivo
Nota: para a comparação quantitativa entre as imagens de microscopia de fluorescência, todas as lâminas são manchadas ao mesmo tempo com as mesmas soluções preparadas.
- Enxágüe slides de tecido congelado com temperatura ambiente PBS por 5 min para remover OCT.
- Demarcar secções de tecido com uma caneta de barreira hidrofóbica para reduzir o volume de soluções necessárias durante a coloração.
Nota: tenha cuidado para não permitir que a caneta funcione sobre as amostras de tecido, pois pode remover o tecido do slide ou evitar a coloração adequada na porção do tecido afetado. Não permita que as secções de tecido se deshidratem a qualquer momento. - Fixar as secções de tecido com solução de paraformaldeído a 4% durante 5 min.
- Enxágüe slides em PBS por 5 min.
- Seções de tecido permeabilizar com 0,5% Triton-X 100 em PBS por 15 min.
- Enxágüe slides em PBS por 5 min.
- Bloqueie os tecidos com 3% p/v de albumina sérica bovina (BSA) e 5% v/v de soro de cabra, ambos em PBS (solução de bloqueio) por 1 h à temperatura ambiente.
Nota: Combine o soro da solução de obstrução ao animal secundário do anfitrião do anticorpo. - Enxágüe slides em PBS por 5 min.
- Incubar as seções com anticorpos primários de manutenção de registros como desejado, possivelmente um nuclear comum (por exemplo, DAPI), vascular (por exemplo, CD31), ou marcador citoplasmático (por exemplo, actina). Aqui, rato CD31 (marcador vascular) em uma diluição 1:100 foi usado de acordo com as instruções do fabricante na solução de bloqueio durante a noite a 4 ° c protegida da desidratação em uma bandeja deslizante.
Nota: Não adicione anticorpos primários ou conjugadas de anticorpos adicionais. O conjugado que foi injetado e permitiu acumular-se nos tecidos in vivo atuam como o anticorpo primário. - Enxágüe slides em PBS por 5 min três vezes, mudando o PBS cada vez.
- Incubar lâminas com anticorpos secundários para rotular anticorpos primários. Para esta aplicação, visualize o anticorpo anti-B7-H3 usando AlexaFluor-546 anticorpo anti-coelho de cabra conjugada (1:200 diluição, otimizado de acordo com as instruções do fabricante) e CD31 com AlexaFluor-488 cabra anti-Rat anticorpo secundário (1:200 diluição, otimizada de acordo com as instruções do fabricante) na solução de bloqueio, protegida da luz e desidratação em uma bandeja de slides, por 1 h à temperatura ambiente.
Nota: os anticorpos secundários são do mesmo animal hospedeiro, mas correspondem à afinidade dos anticorpos secundários às espécies hospedeiras do respectivo anticorpo primário. Os slides são protegidos da luz a partir deste ponto em diante. - Enxágüe slides em PBS por 5 min três vezes, mudando o PBS cada vez.
- Aplique uma gota do meio de montagem no centro da fatia do tecido e coloc com cuidado um lamela que evita o aprisionamento de bolhas de ar.
- Sele as bordas da lamínula com verniz de unha claro e deixe secar.
Observação: para pausar o protocolo por até uma semana neste momento, armazene slides em-20 ° c até que esteja pronto para prosseguir.
5. imagem de microscopia confocal e análise quantitativa de imagens
Nota: a preparação dos parâmetros de microscópio e imagem confocal dependerá do sistema confocal utilizado. O microscópio usado aqui foi comprado comercialmente (por exemplo, sistema de meta Zeiss LSM 510) e o software de aquisição associado foi usado (por exemplo, Zen 2009). Entretanto, muitas destas etapas aplicar-se-ão a todo o microscópio confocal e supõem o conhecimento básico da microscopia confocal.
- Depois que o sistema for ligado e aquecido, selecione o objetivo desejado; aqui foi utilizado um objetivo de 20x (abertura numérica = 0,8).
- Carregar um slide de controle positivo, lamela para baixo, para permitir a definição da otimização para o sinal mais brilhante. Imagem latente no canal vermelho, focalize o sistema na amostra no modo vivo da imagem latente.
- Para cada canal de laser usado, otimize a intensidade do laser, o ganho mestre, e o tamanho do furo de pino como segue:
- Mude para o modo contínuo para imagens.
- Otimize a intensidade do laser (que controla o poder do laser) e o ganho (Mestre) (que controla a tensão para o tubo do photomultiplicador) barras de corrediça ao monitorar o histograma da tabela de look up (LUT). Ajuste essas duas configurações até que o intervalo dinâmico do histograma seja preenchido sem saturar pixels.
Observação: se a intensidade do laser for muito alta, o fotobranqueamento ocorrerá. Se o ganho (Mestre) for muito alto, a imagem se tornará barulhenta. Idealmente, o ganho (Mestre) estará no meio de sua escala. - Ajuste o furo de pino a 1 unidade arejada (au), que dá a definição a mais elevada e a z-fatia a mais fina.
- Deslize a barra de deslocamento digital para minimizar o piso de ruído no histograma lut para um fundo preto verdadeiro.
Nota: uma vez que as configurações de microscopia são otimizadas para cada canal de laser e objetivo, mantê-los constantes durante a sessão de imagem e para a imagem de todos os slides, para permitir a comparação quantitativa entre slides.
- Na guia modo de aquisição , em média, selecione o número desejado e a profundidade de bits. Clique no botão optimal para definir o tamanho ideal do pixel.
- Use o botão de aquisição de snap para coletar uma imagem de alta qualidade. Aqui, campos de visão aleatórios foram selecionados de dentro do tumor, mas outras áreas de interesse podem se aplicar para diferentes aplicações (vasos, margens tumorais, profundidade de penetração, etc.)
- Salve arquivos de imagem no formato usado pelo software confocal (aqui, ". LSM") para processamento e quantificação offline.
Nota: se nem todos os slides são imaged durante a mesma sessão, salve as configurações e recarregá-los em visitas subsequentes, embora a reimagem do mesmo slide não é recomendado devido ao fotobranqueamento. - Realize as medições quantitativas de intensidade de fluorescência. Abra Fiji (Fiji é apenas ImageJ software)19,23 e carregar um arquivo de imagem. LSM arrastando para a barra de status.
- Divida os dados do canal de cores. Vá para Image ≫ Stacks ≫ dividir canais.
- Pré-processar as imagens de fluorescência conforme necessário, ou seja, subtrair o sinal de fundo (processo ≫ subtrair fundo) ou reduzir o ruído através de um método de filtragem.
- Segmente o canal de cor correspondente à proteína de referência (mancha vascular, nuclear, celular) definindo um limiar na intensidade do sinal (imagem ≫ ajustar ≫ limiar).
Nota: o limiarização manual introduz a subjetividade na análise de imagem, conseqüentemente, usando um algoritmo de limiarização automatizado ou fazer referência a histogramas da imagem faz resultados da análise da imagem menos tendenciosos. - Use esse limite para criar uma máscara binária (processo ≫ binário ≫ converter em máscara).
- Medir e rotular ROIs dentro da máscara (analisar ≫ analisar partículas ≫ verificar adicionar ao gerenciador > Ok).
- Aplique ROIs no canal de cores correspondente ao anticorpo de interesse (clique em imagem do canal, analisar ≫ ferramentas > ROI Manager ≫ Measure). Isto aplicará a máscara ROIs à imagem do anticorpo e fornecerá medidas da imagem para seções da etiqueta na janela dos resultados. Salvar janela de resultados (arquivo ≫ salvar).
- Calcule a estatística desejada de interesse, como a intensidade média de fluorescência, conforme descrito aqui24.
- Execute todas as etapas de processamento de forma idêntica a cada imagem dentro de um conjunto de slides. Crie uma macro para fazer isso automaticamente para lotes de imagem grande23.
- Para exibição de imagem somente após medições quantitativas, aplique ajustes qualitativos de imagem para otimizar a visualização de padrões de biodistribuição ajustando o mínimo, o máximo, o brilho e o contraste aos mesmos níveis em todos os slides (imagem ≫ ajustar > Brilho/contraste).
- Converta o tipo de imagem (imagem ≫ tipo ≫ cor RGB) e salve arquivos em um tipo de imagem sem perdas, como. TIFF (arquivo > salvar como > TIFF...) para uso em apresentações e publicações.
Resultados
O método de IVIL foi utilizado aqui para examinar a biodistribuição in vivo e a interação tecidual de B7-H3-ICG e ISO-ICG, permitindo que os agentes, após injeção intravenosa em um animal vivo, interajam com o tecido alvo por 96 h, e depois os tecidos são para atuar como os anticorpos primários durante a imunomarcação ex vivo. O método de IVIL também foi comparado com a coloração padrão ex vivo IF dos tecidos para o marcador B7-H3. As glândulas mamárias murinas normais não expressam o marcador B7-H3, confirmado na coloração ex vivo, padrão IF, e não acumulam anticorpos através de outros mecanismos passivos, e, portanto, não foi detectada acumulação de B7-H3-ICG ou ISO-ICG, representante de um resultado negativo (Figura 1, linha superior). Entretanto, os tumores mamária murino expressam B7-H3 no vasculatura e no epitélio (como confirmado pela mancha padrão de If), e o ivil podia destacar o agente de B7-H3-ICG que tinha acumulado fortemente na vasculatura e podia parcialmente extravasate da vasculatura para se vincular às próprias células cancerosas, embora de forma heterogênea em comparação com a distribuição uniforme do marcador B7-H3 ao longo dos tumores, também mostrado na Figura 1, linha de fundo. Além disso, mesmo que o agente de ISO-ICG não tenha nenhuma especificidade molecular, foi mostrado ainda para acumular em uma forma não específica, devido às interações de FC, à drenagem intersticial deficiente, e ao efeito realçado da permeabilidade e da retenção dentro mamária murino tumores (Figura 1). Esta diferença é destacada nos padrões de biodistribuição mostrados entre os dois agentes, e aumenta ainda mais os resultados de ligação específicos do agente de anticorpos específico, e representa dois resultados possíveis de um resultado positivo.
Os resultados representativos do B7-H3-ICG demonstram como o método de IVIL pode ser utilizado como método qualitativo para descrever a biodistribuição geral de anticorpos/anticorpos conjugadas. No entanto, às vezes, uma interpretação mais quantitativa pode ser necessária, ou um anticorpo pode ter altamente sensível, capacidade de ligação específica de conformação. Nessas situações, o IVIL também pode fornecer as informações desejadas. Em um segundo exemplo, em que a expressão da proteína de netrin-1 em tecidos do tumor e de sua colocalização com endotélio do tumor CD31-positive devia ser estudada, a técnica de ivil foi aplicada igualmente com sucesso19.
Netrin-1 é uma proteína 65 kDa secretada que é mais expressa em certos tipos de câncer, como o câncer de mama metastático25,26. A fim desenvolver uma aproximação molecular da imagem latente para netrin-1, a disponibilidade in vivo da proteína teve que ser determinada19. Também, porque o anticorpo anti-netrin-1 não tem a suficiente afinidade para seu antígeno após a fixação do tecido, um protocolo de mancha alternativo à imunohistoquímica clássica ou se a mancha foi exigida e o IVIL foi executado. O anticorpo anti-netrin-1 humanizado e um anticorpo humano do controle do isotipo de IgG foram injetados intravenosamente 24 h antes da perfusão cardíaca e da coleção do tumor. A perfusão cardíaca foi aplicada para reduzir a coloração inespecífica do fundo no vasculatura e para realçar a deteção do acúmulo significativo do anticorpo de anti-netrin-1 em comparação ao sinal do anticorpo do controle do isotipo quando a expressão do alvo é limitada. Secções tumorais foram rotuladas ex vivo com vasculatura destacando anticorpo anti-CD31 (rato anti-rato CD31 anticorpo (tabela de materiais) e anticorpos secundários fluorescentes, Alexa 488-acoplado cabra anti-Rat IgG, 1:500 diluição e Alexa fluor 594- a IgG anti-Human acoplado da cabra, diluição 1:500 respectivamente) foi usada para revelar o anti-netrin-1/Isotype e os mAbs CD31. As intensidades de sinal de fluorescência do anticorpo anti-netrin-1 e do controle isotipo foram quantificadas para determinar diferenças na coloração colocalizada com CD31. A Figura 2 mostra que o anticorpo anti-netrin-1 acumulou-se especificamente no compartimento do tumor epitelial dos tumores mamários de MMTV-pymt (um resultado positivo), enquanto não havia sinal em glândulas mamárias normais (um resultado negativo). O anticorpo mais adicional colocalizado com o marcador endothelial CD31. A comparação com o isotipo anticorpo-injetou tumores e as glândulas normais mostraram que a acumulação epithelial era específica para o tecido do tumor. Houve acúmulo de sinal nas células endoteliais de ambos os tumores e glândulas normais devido à ligação netrin-1 (tumores) e interações não específicas do FC (tumores e glândulas mamárias normais)11. Assim, a quantificação do sinal da fluorescência usando uma máscara binária CD31-based foi exigida e demonstrou que o sinal do anticorpo de anti-netrin-1 era significativamente mais elevado do que o sinal do anticorpo do controle do isotipo no tecido do tumor, que sugere netrin-1 especificamente acumulada no endotélio tumoral.

Figura 1 : Micrografias confocal representativos da comparação do conjugado específico do anticorpo-ICG de B7-H3 e do isotipo não específico que localizam o conjugado do anticorpo-ICG nas glândulas mamária murino que contêm os tecidos normais ou da carcinoma. (Em cima) As glândulas mamárias murinas normais de um animal injetaram intravenosamente com 33 μg de ISO-ICG ou B7-H3-ICG (vermelho) e contracoradas com CD31 (verde), não mostrando nenhuma coloração dos conjugados de anticorpos. Os tecidos normais foram mostrados para não ter nenhuma expressão de B7-H3 pela coloração ex vivo padrão de IF. (Parte inferior) Tumores mamários invasivos de um animal injetado intravenosamente com 33 μg de B7-H3-ICG ou ISO-ICG (vermelho) e vascular CD31 (verde) mostrando extensa, coloração heterogênea, embora com diferentes padrões de distribuição, tanto para o B7-H3-ICG e Agentes ISO-ICG. B7-H3-ICG liga-se fortemente à vasculatura, o primeiro ponto de contato in vivo, e então é capaz de extravasar da vasculatura para mancha heterogênea do epitélio tumoral. O ISO-ICG mostra a acumulação não específica dentro dos tecidos do tumor. O padrão ex vivo IF que mancha mostra a expressão uniforme do marcador B7-H3 em pilhas epithelial e endothelial. A cor amarela indica o sinal de canal vermelho e verde colocalizado. A barra de escala é 100 μm e consistente entre os painéis. Por favor clique aqui para ver uma versão maior desta figura.
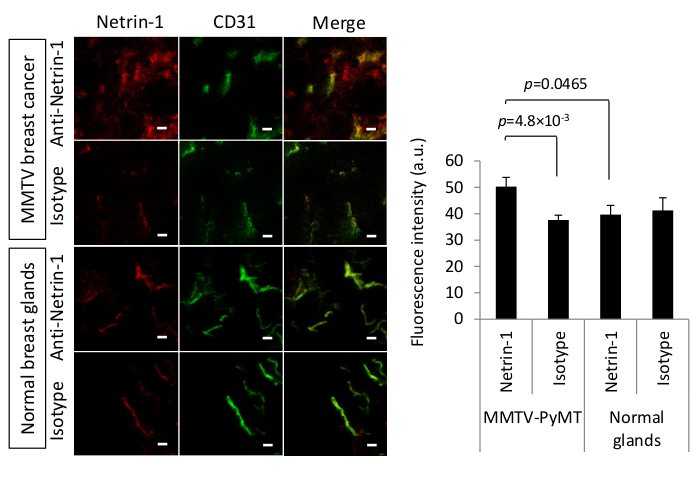
Figura 2 : In vivo immuno-Localization de netrin-1 em tumores mamária de MMTV-pymt. (Esquerda) Micrografias confocal representativos do método de ivil para detectar a expressão de netrin-1 (vermelho) ou a expressão do controle do isotipo (vermelho) na carcinoma murino e nas glândulas mamária normais. Ivil confirma o sinal epithelial para netrin-1 em tumores de MMTV-pymt mas não em glândulas mamária normais, e no sinal netrin-1 forte em pilhas endothelial (coloração CD31, verde) em tumores da mama e sinal significativamente mais fraco de netrin-1 em glândulas mamária normais. A cor amarela indica o sinal de canal vermelho e verde colocalizado. As barras de escala indicam 20 μm. Para a deteção da proteína de netrin-1 no endothelium do tumor, 100 μg do NET1-H-mAb humanizado preliminar ou 100 μg do anticorpo humano do controle do isotipo de IgG foram injetados intravenosamente 24 H antes da coleção do tumor. O anticorpo circulando livremente foi removido pela perfusão cardíaca com PBS e o tecido do tumor foi isolado, Flash congelado, e seccionado na espessura de 15 μm em um cryostat. As pilhas endothelial foram etiquetadas com o anticorpo preliminar do rato CD31 seguido pelo secundário Alexa 488-acoplado IgG do anti-rato da cabra. Para revelar o anticorpo preliminar que alvejou netrin-1, o secundário Alexa fluor 594-acoplado IgG anti-Human da cabra foi usado. Para evitar a interação inespecífica dos anticorpos secundários da cabra, as amostras de tecido foram bloqueadas com soro de cabra. (Direita) Gráfico de barra que destaca a quantificação do sinal do anticorpo do controle do anti-netrin-1 ou do isotipo que colocaliza com sinal do anticorpo CD31. N = 13 tumores (de dois ratos) por grupo de MMTV-PyMT e N = 7 glândulas mamárias (de um rato) por grupo de glândulas normais; Barras de erro apresentam SEM; Comparações de dois grupos foram realizadas com o teste t de Student. Figura reimpressa com permissão de 19 a licença Creative Commons CC by 4,0 (https://creativecommons.org/licenses/by/4.0/). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Este método tem várias etapas críticas e requer possíveis modificações para garantir a implementação bem-sucedida. Primeiramente, a dosagem e o sincronismo da injeção intravenosa conjugada do anticorpo/anticorpo devem ser costurados à aplicação específica. Geralmente, as dosagens devem ser usadas que são consistentes com a forma como o conjugado de anticorpos normalmente será usado, ou seja, dosagens de correspondência do anticorpo terapêutico ou agente de contraste baseado em anticorpos. Também, o sincronismo da coleção de tecidos do alvo deve ser considerado com cuidado. Os anticorpos e os conjugados do anticorpo têm uns tempos mais longos da circulação do que drogas padrão e os agentes de contraste, entretanto, estes são altamente variáveis e devem ser aperfeiçoados para a aplicação desejada, mas recomenda-se permitir pelo menos 24 horas de circulação h27 . Em segundo, durante a coleção do tecido do alvo, pode ser exigido para executar uma técnica intracardiac da perfusão para remover livremente o anticorpo de circulação do pool de sangue19. Ao olhar a distribuição do tumor de B7-H3-ICG, encontrou-se desnecessário devido aos tempos suficientemente longos da circulação (96 h) e à localização extravascular do agente. Entretanto, para a aplicação netrin-1 do método IVIL, a perfusão cardíaca foi considerada pertinente devido à expressão endotelial de netrin-1 e seu nível de expressão relativamente baixo. Em terceiro lugar, durante a coloração ex vivo do tecido é imperativo manchar todos os slides que serão comparados quantitativamente durante a mesma sessão e com as mesmas soluções para evitar variações entre lotes normais. Assegure-se de que as lâminas são enxaguadas corretamente entre as etapas e a solução de caneta hidrofóbica não entra em contato com o tecido para evitar a coloração suboptimal. Finalmente, durante a microscopia confocal, manter as mesmas configurações de imagem entre os slides para permitir a quantificação relativa e trabalhar rapidamente para evitar o fotobranqueamento das lâminas. Esses pontos-chave aumentarão a probabilidade de uma implementação bem-sucedida do IVIL.
Existem várias vantagens para o método IVIL. Primeiro, enquanto o método é semelhante ao padrão IF técnicas, os dois fornecem informações significativamente diferentes. SE a coloração indica a localização anatômica dos marcadores moleculares dentro do tecido em um determinado ponto de tempo (quando o tecido foi coletado e fixado). No entanto, o IVIL fornece informações sobre como um anticorpo ou conjugado de anticorpos, como demonstrado pela localização do B7-H3-ICG, está distribuindo e interagindo, seja esse acúmulo específico ou não específico, internalização ou retenção no alvo Tecido. Isto é crítico para estudos farmacocinéticos/dinâmicos e de biodistribuição. Em segundo, os métodos tradicionais do IF são, às vezes, limitados pela fixação dos tecidos que podem causar a distorção do antígeno ou a máscara impedindo a ligação pelo anticorpo preliminar28. Conseqüentemente, o IVIL pode ser útil quando o padrão se manchar ou immunohistochemistry falha. A técnica de IVIL pode ser considerada um método complementar para verificar a atividade de anticorpos in vivo que de outra forma seria indetectável. Finalmente, aqueles familiarizados com técnicas de coloração se tradicional vai encontrar o método direto na execução e terá a maioria dos materiais necessários na mão.
O método IVIL tem algumas limitações. Em primeiro lugar, devido à necessidade de eutanizar o animal para colher os tecidos-alvo, IVIL só fornece informações de interação biológica em um único ponto de tempo. A injeção do conjugado de anticorpos ou anticorpos primários em diferentes pontos de tempo em vários animais permitirá uma janela de tempo mais ampla de informações sobre a biodistribuição e interação in vivo. Em segundo lugar, se os usuários não estiverem familiarizados com as técnicas animais in vivo, como a injeção venosa da veia cauda ou a perfusão intracardíaca potencial, isso pode ser uma limitação ao método. Esses métodos exigem pessoal qualificado para executar de forma confiável. Entretanto, o uso de um cateter durante a injeção da veia de cauda assegura a administração da dose inteira porque a colocação apropriada da agulha pode ser confirmada antes da injeção. Adicionalmente, uma alternativa à injeção da veia de cauda que poderia ser considerada é injeção retro-orbital, que tem tipicamente uma taxa de sucesso mais elevada com pessoal menos experiente. A necessidade de manchar e imagem todos os slides de tecido no mesmo lote para permitir a avaliação quantitativa limita o número de amostras e marcadores que podem ser incluídos em um único estudo. O estudo pôde precisar de ser organizado na mancha de série em dias diferentes e em fatias adjacentes do tecido para recolher a informação desejada. Finalmente, o uso de anticorpos de espécie-combinados, isto é, anticorpos do anti-rato murino em modelos pré-clínicos murino, levanta uma edição da mancha de fundo não específica com anticorpos secundários. Assim, o uso de anticorpos primários incompatíveis com a espécie é necessário como apresentado neste estudo, ou anticorpos primários com correspondência de espécies fluorescentamente rotulados teriam que ser usados.
A técnica de IVIL é útil para a análise da biodistribuição de anticorpos diagnósticos e terapêuticos para muitas aplicações. As aplicações diferentes para a injeção intravenosa do anticorpo ou do ligante e a análise ex vivo do tecido foram relatadas previamente e confirmam o interesse para introduzir extensamente este procedimento de coloração. Robertson e colegas rotulados como elementos vasculares como capilares endoteliais e vasos maiores com injeções intravenosas de Lycopersicon esculentum aglutinina (lectina de tomate)29. A técnica foi compatível com histoquímica e Immunocytochemistry e revelou testes padrões vasculares e características parenquimatosas funcionais. No entanto, o uso de ligantes fluorescentes foi limitado pela rápida degradação da fluorescência após a injeção30. Como demonstrado no protocolo de IVIL, a injeção de um anticorpo preliminar in vivo seguido pela rotulagem ex vivo com um anticorpo fluorescente secundário pôde ser uma aproximação mais robusta. Uma outra aplicação interessante deste tipo de in vivo se manchar é a rotulagem de linfócitos intravascular como demonstrado por Anderson e por colegas31. O anticorpo intravenosamente injetado foi usado para etiquetar os linfócitos localizados nos vasos sanguíneos, que foram recolhidos subseqüentemente e processados mais para a análise da citometria do fluxo de marcadores imunológicos. Finalmente, para avaliar a entrega e a localização histológica da terapêutica do anticorpo que foram entregadas aos pacientes com carcinoma de pilha Squamous da cabeça e da garganta (HNSCC), um primeiro estudo em-humano da distribuição do anticorpo foi executado usando sistemicamente anticorpo terapêutico com rótulo cDNAs, administrado por infravermelho próximo, cetuximab-IRDye800CW32. Os dados foram comparados com as análises histológicas e mostraram que o sinal fluorescente diminuiu com a distância do tumor confirmando a especificidade. Embora, o anticorpo terapêutico não alcangue todas as regiões da expressão do antígeno, especial as regiões bem diferenciadas do tumor com níveis elevados do antígeno epidérmico do receptor do fator de crescimento (EGFR). No contexto atual da pesquisa oncológica com foco no desenvolvimento de terapias direcionadas e imunoterapias que se deparam com forte resistência e falta de eficácia, o método IVIL seria uma excelente ferramenta para estudar a distribuição de anticorpos terapêuticos como PD-1/PD-L-1 ou HER233,34. Estes resultados são extremamente valiosos para compreender porque as terapias alvejadas são eficazes em determinados casos que promovem o desenvolvimento de aproximações novas. Tomados em conjunto, estes exemplos destacam a importância potencial da abordagem do IVIL.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos ao Dr. Andrew Olson (serviço de microscopia de neurociência de Stanford) para discussões e uso de equipamentos. Agradecemos ao Dr. Juergen K. willmann pela sua orientação. Este estudo foi apoiado pela concessão de NIH R21EB022214 (KEW), pela concessão do treinamento de NIH R25CA118681 (KEW), e pelo NIH K99EB023279 (KEW). O serviço de microscopia de neurociência de Stanford foi apoiado pela NIH NS069375.
Materiais
| Name | Company | Catalog Number | Comments |
| Animal Model | |||
| FVB/N-Tg(MMTV-PyMT)634Mul/J | The Jackson Laboratory | 002374 | Females, 4-6 weeks of age |
| Animal Handling Supplies | |||
| 27G Catheter | VisualSonics | Please call to order | Vevo MicroMarker Tail Vein Access Cannulation Kit |
| Alcohol Wipes | Fisher Scientific | 22-246073 | |
| Gauze Sponges (4" x 4" 16 Ply) | Cardinal Health | 2913 | |
| Heat Lamp | Morganville Scientific | HL0100 | |
| Isoflurane | Henry Schein Animal Health | 29404 | |
| Ophthalmic Ointment | Fisher Scientific | NC0490117 | |
| Surgical Tape | 3M | 1530-1 | |
| Tissue Collection | |||
| Disposable Base Molds | Fisher Scientific | 22-363-556 | |
| Optimal Cutting Temperature (OCT) Medium | Fisher Scientific | 23-730-571 | |
| Surgical London Forceps | Fine Science Tools | 11080-02 | |
| Surgical Scissors | Fine Science Tools | 14084-08 | |
| Antibodies | |||
| AlexaFluor-488 goat anti-rat IgG | Life Technologies | A-11006 | |
| AlexaFluor-546 goat anti-rabbit IgG | Life Technologies | A-11010 | |
| AlexaFluor-594 goat anti-human IgG | Life Technologies | A11014 | |
| Human IgG Isotype Control | Novus Biologicals | NBP1-97043 | |
| Humanized anti-netrin-1 antibody | Netris Pharma | contact@netrispharma.com | |
| Rabbit anti-Mouse CD276 (B7-H3) | Abcam | ab134161 | EPNCIR122 Clone |
| Rat anti-Mouse CD31 | BD Biosciences | 550274 | MEC 13.3 Clone |
| Reagents | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Clear Nail Polish | Any local drug store | ||
| Indocyanine Green - NHS | Intrace Medical | ICG-NHS ester | |
| Mounting Medium | ThermoFisher Scientific | TA-006-FM | |
| Normal Goat Serum | Fisher Scientific | ICN19135680 | |
| Paraformaldehyde (PFA) | Fisher Scientific | AAJ19943K2 | |
| Sterile Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 14190250 | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Supplies | |||
| Adhesion Glass Slides | VWR | 48311-703 | |
| Desalting Columns | Fisher Scientific | 45-000-148 | |
| Glass Cover Slips | Fisher Scientific | 12-544G | |
| Hydrophobic Barrier Pen | Ted Pella | 22311 | |
| Microcentrifuge Tubes | Fisher Scientific | 05-402-25 | |
| Slide Staining Tray | VWR | 87000-136 | |
| Software | |||
| FIJI | LOCI, UW-Madison. | Version 4.0 | https://fiji.sc/ |
Referências
- Forthal, D. N. Functions of Antibodies. Microbiology Spectrum. 2 (4), 1-17 (2014).
- Boder, E. T., Midelfort, K. S., Wittrup, K. D. Directed evolution of antibody fragments with monovalent femtomolar antigen-binding affinity. Proceedings of the National Academy of Sciences of the United States of America. 97 (20), 10701-10705 (2000).
- Köhler, G., Milstein, C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 256 (5517), 495-497 (1975).
- Lonberg, N., et al. Antigen-specific human antibodies from mice comprising four distinct genetic modifications. Nature. 368 (6474), 856-859 (1994).
- McCafferty, J., Griffiths, A. D., Winter, G., Chiswell, D. J. Phage antibodies: filamentous phage displaying antibody variable domains. Nature. 348 (6301), 552-554 (1990).
- Ferlay, J., et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer. 136 (5), E359-E386 (2015).
- Reichert, J. M., Valge-Archer, V. E. Development trends for monoclonal antibody cancer therapeutics. Nature Reviews Drug Discovery. 6 (5), 349-356 (2007).
- Kircher, M. F., Willmann, J. K. Molecular Body Imaging: MR Imaging, CT, and US. Part I. Principles. Radiology. 263 (3), 633-643 (2012).
- Fleuren, E. D. G., et al. Theranostic applications of antibodies in oncology. Molecular Oncology. 8 (4), 799-812 (2014).
- Forsström, B., Bisławska Axnäs, B., Rockberg, J., Danielsson, H., Bohlin, A., Uhlen, M. Dissecting Antibodies with Regards to Linear and Conformational Epitopes. PLoS ONE. 10 (3), (2015).
- Woof, J. M., Burton, D. R. Human antibody-Fc receptor interactions illuminated by crystal structures. Nature Reviews Immunology. 4 (2), 89-99 (2004).
- Brooks, J. D. Translational genomics: The challenge of developing cancer biomarkers. Genome Research. 22 (2), 183-187 (2012).
- Tabrizi, M., Bornstein, G. G., Suria, H. Biodistribution Mechanisms of Therapeutic Monoclonal Antibodies in Health and Disease. The AAPS Journal. 12 (1), 33-43 (2009).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry. Journal of Pharmacy & Bioallied Sciences. 4 (Suppl 2), S307-S309 (2012).
- Gambhir, S. S. Molecular imaging of cancer with positron emission tomography. Nature Reviews. Cancer. 2 (9), 683-693 (2002).
- Freise, A. C., Wu, A. M. In vivo Imaging with Antibodies and Engineered Fragments. Molecular Immunology. 67 (200), 142-152 (2015).
- Cilliers, C., Menezes, B., Nessler, I., Linderman, J., Thurber, G. M. Improved Tumor Penetration and Single-Cell Targeting of Antibody-Drug Conjugates Increases Anticancer Efficacy and Host Survival. Cancer Research. 78 (3), 758-768 (2018).
- Wilson, K. E., et al. Spectroscopic Photoacoustic Molecular Imaging of Breast Cancer using a B7-H3-targeted ICG Contrast Agent. Theranostics. 7 (6), 1463-1476 (2017).
- Wischhusen, J., et al. Ultrasound molecular imaging as a non-invasive companion diagnostic for netrin-1 interference therapy in breast cancer. Theranostics. 8 (18), 5126-5142 (2018).
- Guy, C. T., Cardiff, R. D., Muller, W. J. Induction of mammary tumors by expression of polyomavirus middle T oncogene: a transgenic mouse model for metastatic disease. Molecular and Cellular Biology. 12 (3), 954-961 (1992).
- Hober, S., Nord, K., Linhult, M. Protein A chromatography for antibody purification. Journal of Chromatography B. 848 (1), 40-47 (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments JoVE. (65), (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bachawal, S. V., et al. Earlier detection of breast cancer with ultrasound molecular imaging in a transgenic mouse model. Cancer Research. 73, 1689-1698 (2013).
- Fitamant, J., et al. Netrin-1 expression confers a selective advantage for tumor cell survival in metastatic breast cancer. Proceedings of the National Academy of Sciences. 105 (12), 4850-4855 (2008).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Ryman, J. T., Meibohm, B. Pharmacokinetics of Monoclonal Antibodies. CPT: Pharmacometrics & Systems Pharmacology. 6 (9), 576-588 (2017).
- Scalia, C. R., et al. Antigen Masking During Fixation and Embedding, Dissected. Journal of Histochemistry and Cytochemistry. 65 (1), 5-20 (2017).
- Robertson, R. T., et al. Use of labeled tomato lectin for imaging vasculature structures. Histochemistry and Cell Biology. 143 (2), 225-234 (2015).
- Chen, C. Y., et al. Blood flow reprograms lymphatic vessels to blood vessels. The Journal of Clinical Investigation. 122 (6), 2006-2017 (2012).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9 (1), 209-222 (2014).
- de Boer, E., et al. In Vivo Fluorescence Immunohistochemistry: Localization of Fluorescently Labeled Cetuximab in Squamous Cell Carcinomas. Scientific Reports. 5, (2015).
- Jenkins, R. W., Barbie, D. A., Flaherty, K. T. Mechanisms of resistance to immune checkpoint inhibitors. British Journal of Cancer. 118 (1), 9-16 (2018).
- Rexer, B. N., Arteaga, C. L. Intrinsic and acquired resistance to HER2-targeted therapies in HER2 gene-amplified breast cancer: mechanisms and clinical implications. Critical Reviews in Oncogenesis. 17 (1), 1-16 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados