Method Article
Конфокальный живых изображений меристем апикальной стрелять из различных видов растений
В этой статье
Резюме
Этот протокол представляет как жить изображения и анализировать меристем апикальной стрелять из различных видов растений с помощью лазера, Сканирующая конфокальная микроскопия.
Аннотация
Стрелять апикальной Меристемы (SAM) функции как сохранение стволовых клеток водохранилище и он производит почти все наземные тканей во время постэмбрионального развития. Деятельности и морфология Самс определить важные агрономических признаков, таких как стрелять архитектуры, размер и количество репродуктивных органов и, самое главное, урожайность зерновых. Здесь мы предоставляем подробный протокол для анализа поверхности морфологии и внутреннюю клеточную структуру жизни Самс из различных видов через лазерный Сканирующий конфокальный микроскоп. Вся процедура от подготовки образца для приобретения трехмерные (3D) изображения с высоким разрешением может быть достигнуто в рамках как коротким 20 минут. Мы показываем, что этот протокол является очень эффективным для изучения не только соцветие Самс видов модели, но и вегетативных меристем из разных культур, обеспечивая простой, но мощный инструмент для изучения, Организации и развития меристем через различных видов растений.
Введение
Меристемы завод содержит пул недифференцированных стволовых клеток и постоянно поддерживает орган роста растений и разработка1. Во время постэмбрионального развития почти все наземные ткани растения являются производными от стрелять апикальной Меристемы (SAM). В посевах деятельности и размер Сэм и его производных цветочные меристем тесно связано с много агрономических признаков как стрелять архитектуры, производства фруктов и урожайность семян. Например в томате, расширенном Сэм вызывает увеличение стрелять и соцветия ветвления и таким образом приводит к генерации дополнительных цветов и фруктов органов2. В кукурузе увеличение размера Сэм приводит к выше начального числа и общая доходность3,4. В сои неопределенность Меристемы тесно связан также с архитектурой стрелять и выход5.
Морфология и Анатомия Самс можно охарактеризовать несколькими различными методами, включая гистологическое разрезания окрашивание и сканирование электронная микроскопия (SEM)6, оба из которых значительно продвинулись Меристемы исследований путем предоставления разрез или трехмерные (3D) вид поверхности МСОС. Однако оба метода отнимают много времени, с участием нескольких экспериментальных шагах от Пробоподготовка для сбора данных, и эти методы главным образом зависит от фиксированных выборок. Последние достижения в технику конфокальная микроскопия скеннирования лазера преодолеть эти ограничения и предоставить нам с мощным инструментом для расследования клеточная структура и процесс развития растений тканей и органов7,8. Через оптический вместо физической ткани резания, конфокальная микроскопия позволяет коллекции серии z стек изображений и последующих 3D-реконструкции образца через программное обеспечение для анализа изображения.
Здесь мы Опишите эффективной процедуры для расследования оба внутри и поверхности структуры живых Самс из разных видов, с помощью лазерного сканирования конфокальная микроскопия, который потенциально позволяет исследователям для выполнения всех экспериментальных растений процесс в рамках как коротким 20 минут. Отличается от других опубликованных методов для живой конфокальный изображений Arabidopsis соцветий Самс9,10,11,12,13,14, 15 и арабидопсиса цветы12,13, здесь мы продемонстрировать, что этот протокол является очень эффективным для изучения не только соцветие меристем видов модели, но и вегетативных стрелять апикальной меристем из разных культур, таких как помидоры и сои. Этот метод не полагаться на трансгенные флуоресцентные маркеры и потенциально могут быть применены для изучения меристем стрелять из многих различных видов и сортов. Кроме того мы также представить простой обработки шаги для просмотра и анализа различных МСОС в 3D виде изображений. Взятые вместе, этот простой метод будет способствовать исследователей, лучшего понимания структуры и процесс развития меристем от модельных организмов и культур.
протокол
1. средства массовой информации и изображений приготовление блюд
- Пластины MS: добавить 0.5 x фотосинтетическую & MS Скуг средние, 1% агар в деионизированную воду, а затем настроить pH 5,8, используя раствор гидроксида калия (опционально: добавить 1% сахарозы для долгосрочной растениеводства). Автоклавы и вылить пластины.
- Imaging блюда: заполнить пластиковых чашек Петри (шириной 6 см, глубина 1,5 см) до 0,5-0,8 см с 1,5% расплавленная агарозы.
2. рост растений
-
Арабидопсис роста
- Стерилизованные семена на MS пластины и поместите пластины под 4 ° C в течение двух дней. Затем переместите MS пластины в короткий день (8 h свет / 16 h темный), при 22 ° C в течение двух недель.
- Пересадка рассады в почву и вырастить их в короткий день (8ч. Светлый / темный 16 h) при 22 ° C в течение четырех недель.
- Передавать непрерывный свет, при 22 ° C, чтобы вызвать переход от вегетативной стадии репродуктивного и для визуализации соцветие Самс растений.
- Рост помидоров и сои
- Инкубируйте покрыты мокрый фильтр-бумаги до 28 ° C, пока они прорастают семена.
- Пересадка рассады в почву и вырастить их в один длинный день (16 h свет / 8 h темно) при 25 ° C на одну неделю или дольше для визуализации вегетативных МСОС.
3. рассечение стрелять Апекс
- Рассечение соцветия стрелять Апекс
- Отрежьте верхушки стрелять соцветия вместе с главного стебля 1-2 см от болтовых растения арабидопсис с лезвием бритвы. Подержите базальная часть главного стебля и удалять как многие пожилые цветок органов как можно от основного ствола, рассекает из плодоножек пинцетом ювелирных изделий.
Предостережение: Избегайте резки пальцы при использовании лезвия бритвы. Метод Dispose используется лезвия правильного Шарпс контейнер. - Держите прилагаемый стволовых стрелять Апекс ювелирных щипцами или пальцами в области стереомикроскопом, продолжить удаление остальных цветов до почти весь Сэм может рассматриваться от окуляров. Удаление цветоносах четко на стыке главного стебля.
- Отрежьте верхушки стрелять соцветия вместе с главного стебля 1-2 см от болтовых растения арабидопсис с лезвием бритвы. Подержите базальная часть главного стебля и удалять как многие пожилые цветок органов как можно от основного ствола, рассекает из плодоножек пинцетом ювелирных изделий.
- Рассечение верхушки вегетативных стрелять
- Чтобы просмотреть вегетативных Самс из помидоров или сои, вскрыть из семядоли, листья и корни растений.
- Держите гипокотиля растений под стереомикроскопом и дальнейшего изучения из листьев Примордия, охватывающих вегетативных Самс, используя пинцет ювелирные изделия.
4. Окрашивание
- Чтобы непосредственно визуализировать клетки в МСОС, используйте свежеприготовленные пропидий йодидом (PI) решение пятно клеточной стенки. Растворить порошок PI в стерильные, деионизированной воды, сделать окрашивание раствора 1 мл PI в концентрации 1 мг/мл и хранить решение PI в пробки microcentrifuge, покрытые алюминиевой фольги.
- Пипетка 50 мкл раствора PI в чистой и пустой чашке Петри и dip, разобрал весь стрелять Апекс в краситель для 2 минут промыть окрашенных стрелять Апекс дважды в стерильные, деионизированную воду. Во время процесса окрашивания погрузите весь соцветие Сэм или растительного Сэм в PI решение для достижения равномерное окрашивание.
5. изображения коллекции
Примечание: для этого метода, все МСОС отражаются с помощью вертикально конфокального микроскопа и с 20 x объектив с погружением в воду. Как описано в другие протоколы9,12,13,15, целесообразно также изображения с помощью инвертированного микроскопа МСОС. Кроме того живые изображения может быть достигнуто с помощью различных марок конфокальные микроскопы, с те же шаги подготовки образца. В этом исследовании в качестве примера подробно описаны шаги обработки изображений.
- Пробить отверстие в центре изображения блюдо, с помощью щипцов и придерживаться Апекс окрашенных стрелять вертикально в среде.
- Заполните изображений блюдо с стерильной, деионизированной воды полностью погрузиться в образце. Просмотр из стерео Микроскоп, Пипетка вверх и вниз, чтобы удалить пузырьки воздуха ловушку вокруг Меристемы. Затем отрегулируйте угол ствола в Агаре, чтобы убедиться, что Сэм полностью видна из прямо над.
- Место изображения блюдо на сцене образца конфокального микроскопа. Ниже воды окуная объектив и поднять образца микроскопа, чтобы кончик объектив погружение в воду.
- Откройте программное обеспечение конфокального микроскопа и найдите SAM в brightfield в окуляры. Переместить вправо SAM образец ниже объектива путем корректировки XY контроллер, а затем сосредоточиться на SAM от окуляров через осторожно регулируя Z контроллер.
- Действуют функцию приобретения программного обеспечения конфокального микроскопа (см. Таблицу материалы), начало в Live режиме просмотра образца от экрана компьютера, и настроить все параметры для лазерного сканирования эксперимент.
- Настраивая параметры, используйте Индикатор диапазона функции для определения, перегружена ли сигнал или нет.
- При необходимости примените функцию повторно перезагрузить все настройки параметров из выбранного файла конфокальный.
Примечание: Предложил изображений параметры: лазерные линии (возбуждение): 515 нм или 561 Нм; Выбросов 570-650 Нм; отверстие: 1 блок Эйри (АС); Усиления: 600-750, режим сканирования: рама; Размер кадра: 512 X 512 или 1024 X 1024; скорость сканирования: от 7 до Макс; Направление сканирования: bi направление; Усреднения номер: 2-4; Метод усреднения: означает; Разрядность: 16 бит; Интервал сканирования: 0.5-1 мкм. Кроме того Оптимизируйте все эти параметры, основанные на характере образцов различных растений и тепловизионные нуждам.
6. обработка изображений
- Для визуализации оптических ортогональные и поперечных разрезов, используйте же коммерческого программного обеспечения для обработки изображений приобретения. Откройте исходный файл конфокальный, орто меню, выберите "Орто". Затем выберите либо положение x, позиция y и z положение изображения и сохранить изображения в виде файлов tiff.
- При необходимости выберите функцию 3D расстояние определить физическое расстояние между двумя точками, которые были отобраны из стека конфокальный изображений.
- Кроме того Используйте J Фиджи/изображений, открытых ресурсов пакет обработки изображений для визуализации ортогональные и поперечных разрезов.
- Откройте исходный файл конфокальный с Фиджи, нажмите меню изображения, выберите стеки и выберите ортогональных.
- Выберите XY, YZи XZ самолеты в среднем положении и сохранить в виде изображений в формате Tiff.
- Для визуализации 3D проекции прозрачной, используйте то же программное обеспечение.
- Откройте исходный файл конфокальный, 3Dменю и выберите прозрачный сформировать представление 3D проекции.
- При необходимости нажмите кнопку 3D меню, выберите вид, а затем выберите прозрачности , чтобы настроить три параметра включая порогового, рамп и Максимальная прозрачность 3D проекции изображения.
- Нажмите меню 3D вид, и выберите и свет для регулировки яркости 3D изображения.
- Экспортируйте проецируемого изображения и сохранить их в виде файлов Tiff.
- Для визуализации 3D максимальная интенсивность проекции, откройте конфокальный файлы с то же программное обеспечение и нажмите в меню 3D.
- Выберите меню 3D и Максимальная.
- Кроме того Используйте J Фиджи/Image визуализировать 3D максимальная интенсивность проекции.
- Откройте исходный файл конфокальный с Фиджи, нажмите меню изображение и выберите стеки.
- Выберите 3D проект и сохранить в виде изображений в формате Tiff.
- Для визуализации глубина кодирования представление 3D изображения, используйте то же программное обеспечение.
- Нажмите 3D меню и выберите вид.
- Выберите Специальный и Глубина кодирования.
- Кроме того Используйте J Фиджи/изображение для визуализации глубина кодирования представление.
- Конфокальный файлы открыть, щелкните меню изображения, выберите Hyperstack.
- Выберите код височной-цвета и сохранить как изображения формата Tiff.
Примечание: Глубина кодирования z стека также можно достичь путем плагин Z код стека для Фиджи.
- Для визуализации 3D вращение мнение как показано (фильм 1 и 2 фильма), использовать то же программное обеспечение (см. Таблицу материалов).
- Конфокальный файлы открыть, щелкните 3D-менюи выберите серии.
- Выберите Отображать сериии выберите один из четырех вариантов, включая поворот вокруг x, повернуть вокруг y, Начало и конеци позицию списка.
- Сохраните серии визуализации как AVI-файлов.
- Кроме того Используйте J Фиджи/Image визуализировать вид 3D вращение.
- Откройте исходный файл конфокальный с Фиджи, нажмите меню изображенияи выберите стеки.
- Выберите 3D проект и сохранить как AVI видео формат.
Результаты
Для оценки эффективности нашего протокола и для изучения морфологии меристем из разных видов, мы выполнили конфокальный живых изображений эксперименты на Меристемы соцветие от Arabidopsis и вегетативных меристем от помидор и сои. В этом исследовании, Arabidopsis Экотип Ландсберг прямостоячая, помидор сорта микро-том и сорта сои Уильямс 82 использовались в качестве примеров.
Видно из ортогональных раздела через середину Arabidopsis Сэм, становится ясно, что PI смог пятно горизонтальной стены от почти всех клеток в несколько слоев клеток (Рисунок 1A). Показано от одного поперечного сечения через корпус соцветие Сэм, клетки от плоскости XY, также четко отражаться (рис. 1B). В представлении 3D проекции Меристемы соцветий образует купол как структура и находится в окружении развивающихся Примордия цветок, где клетки также витражи и образ (Рисунок 1 C-D) (фильм 1).
Видно из ортогональных секции через середину томата Сэм, становится ясно, что PI смог пятно горизонтальной стены от клеток в несколько слоев клеток, хотя PI сигнал от глубоких внутренних регионе несколько ниже. От одного поперечного сечения через глубокие слои вегетативного Сэм также четко отражаются клетки от плоскости XY, и граница между вегетативного меристема и листьев Примордия также образа (Рисунок 2Б). 3D проект далее может обеспечить всеобъемлющее представление о форме и организации растительного Меристемы из помидор (Рис. 2 C-D) (фильм 2).
В ортогональных мнению через середину сои Сэм мы можем видеть вегетативных Меристемы купол как и его производных Примордия новый лист (рис. 3A). В представлении 3D проекции как вегетативных Меристемы сои и помидор вегетативных Меристемы образуют купол как структура, однако, форма Меристемы растительного соевого отличается от помидор Меристемы, и организации и структуры Примордия листьев, окружающих эти два Самс являются собственный (Рис. 3B-C).

Рисунок 1: Live, визуализации и анализа соцветия Сэм арабидопсиса. A и Б. Оптическая ортогональных (ОРТ) и поперечные разрезы (Транс) средней плоскости же Сэм, PI (пропидий йодидом) пятно (фиолетовый). C. 3D проекция того же Сэм, Пи пятна (серый). Д. Глубина цветовое кодирование 3D проекции, с синим, указанием верхнего слоя поверхности и красный, представляющие глубокий слой. Стены клетки окрашивали PI. Масштаб бары: 20 µm (A, B); 50 мкм (C, D). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
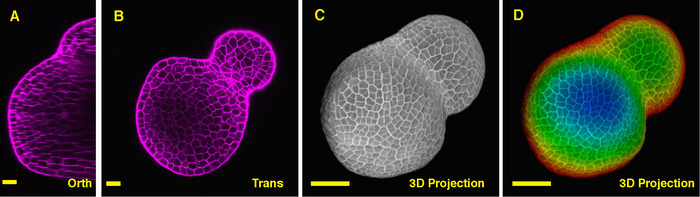
Рисунок 2: Live изображений и анализ растительных Сэм помидор. A и Б. Оптическая ортогональных (ОРТ) и поперечные (Транс) раздел вид средней плоскости же Сэм. C. 3D проекции же Сэм. Д. Глубина цветовое кодирование 3D проекции, с синим, указанием верхнего слоя поверхности и красный, представляющие глубокий слой. Стены клетки окрашивали PI. Масштаб бары: 20 µm (A, B); 50 мкм (C, D). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
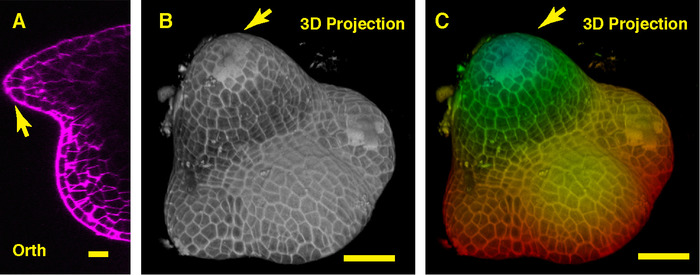
Рисунок 3: Жить визуализации и анализа вегетативного Сэм сои. А. оптический ортогональных (ОРТ) разрез средней плоскости вегетативного Сэм. Б. 3D проекции же Сэм. C. Глубина цветовое кодирование 3D проекции, с синим, указанием верхнего слоя поверхности и красный, представляющие глубокий слой. Стены клетки окрашивали PI. Масштаб бары: 20 µm (A); 50 мкм (B, C). Стрелка: Первобытная листьев. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Видео 1: 3D вращение Arabidopsis соцветия Меристемы на рисунке 1. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)

Видео 2: 3D вращение вегетативных Меристемы помидор на рисунке 2. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)
Обсуждение
Здесь мы опишем простой метод визуализации, который может быть применен к изучению меристем апикальной стрелять из различных растений с незначительными изменениями, открывая новые возможности для изучения Меристемы регулирование на этапах как растительного, так и репродуктивных модель растений и культур. В отличие от SEM и гистологической пятная методов этот протокол может помочь выявить вид поверхности и внутренними клеточными структурами МСОС, без необходимости для фиксации трудоемких образца и/или тканей, секционирование шаги. Этот протокол также совместим с установленным изображений метод для флуоресценции основе репортеров в МСОС, потенциально обеспечивая хороший сотовый резолюции, которая позволяет нам получить представление 3D моделей выражение ключевых генов и белков в SAM16 ,,1718,19. Кроме того связанное изображение, описанной здесь процедуры обработки будет существенно помочь исследователям анализировать и сравнивать Самс от различных видов в 3D, продвижение Биология эволюционного развития исследований и сельскохозяйственных исследований.
Есть несколько важных шагов в этой простой протокол. Первый, пробоподготовка и рассечение. Растение Сэм обычно скрыта путем разработки Примордия и молодых органов на кончике стрелять, и нельзя непосредственно воспроизведен образ под конфокального микроскопа. Для изображения вегетативных Сэм, необходимо удалить все листья и старше Примордия листьев, которые охватывают поверх SAM, используя пинцет ювелирных украшений. Для изображения соцветие Сэм, необходимо тщательно удалить все молодые цветы подвергать Сэм, также с помощью щипцов ювелирных украшений.
Во-вторых, живой клетки окрашивание с помощью решения PI. В этом протоколе мы используем свежеприготовленный раствор Пи (1 мг/мл) пятно стены клетки непосредственно визуализировать живой Самс, которые быстро, эффективно и легко выполнять. Хотя PI раствор можно хранить при 4 ° C в течение нескольких недель, свежеприготовленный раствор обычно дает лучшие пятнать результат для меристем апикальной стрелять. Хотя PI главным образом не пересекать мембраны клеток живых и пятна нетронутым клеток с четкой сотовой структуры, он может легко проникнуть через поврежденные/мертвые клетки и решительно пятно ядер и других внутренних мембранных систем в этих пострадавших районов, потенциально затрагивающих качество конфокальный изображений. Таким образом это будет необходимо избегать каких-либо физических повреждений при подготовке SAM образцов для окрашивания и жить изображений. С другой стороны PI в высокой концентрации показывает токсический эффект для растительных клеток, и таким образом, FM4-64 может использоваться как замена для Пи пятна живых клеток Сэм9. Однако FM4-64 этикетки плазматической мембраны, которые могут потенциально быть рассмотрены в ячейку интерьера путем эндоцитоза, что делает его трудно испачкать образцы с высоким разрешением сотовых.
В-третьих визуализации приобретения. 1). высокой численного отверстия (NA), объектив погружением в воду имеет решающее значение для живой съемки МСОС. Вода имеет высокий показатель преломления воздуха и высокий NA объектив помогает собирать сигнал фотонов, разбросанных через глубокие клеток слои МСОС. 2). параметры мощности лазера (Ватт или ватт на поверхности) может быть сильно варьируется между различными конфокальные микроскопы. Высокой мощности лазера может позволить лучше сигнал коллекции, но приводит к более фотоповреждения / Фотообесцвечивание на образцах. Существует компромисс между резолюции, отбеливания и визуализации времени. В общем выбрав больший размер кадра приводит к лучше XY резолюции, но больше изображений время и выбрав интервале меньше сканирования приводит к лучше резолюции Z, но также больше изображений времени. Больше изображений время потенциально вызывает больше фотоповреждения / Фотообесцвечивание
С помощью этого метода иногда он не может быть легко наблюдать сотовой детали в глубоких слоях тканей, вероятно, из-за ограничения конфокальный обнаружения и неэффективных PI пятнать во внутренних тканях. Основываясь на нашем опыте, повышение концентрации PI решения и/или окрашивания время может помочь получить лучшее пятно. Кроме того можно выполнить изменения в процедуре окрашивание. Например, изменение псевдо Шифф пропидий йодидом (м/с PI) метод хорошо работает для фиксированных тканей20. И это все еще необходимо найти альтернативные краски с лучшего окрашивания для живых тканей в будущем. Кроме того это также интересно проверить ли метод, описанный здесь обычно применяться к изучению Самс от всех других цветковых растений, учитывая тот факт, что некоторые виды растений имеют специальные клеточного содержимого или различных клеточной стенки композиции.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы признают Пердью Bindley Bioscience центр визуализации объекта, для доступа к лазерный Сканирующий конфокальный микроскоп и для технической поддержки, и авторы ценят помощь от Энди Schaber в объекте Bindley Imaging Purdue. Эта деятельность финансировалась Университет Пердью в рамках AgSEED перекрестке финансирование для поддержки Индиана сельского хозяйства и развития сельских районов.
Материалы
| Name | Company | Catalog Number | Comments |
| Agar Phyto | Dot Scientific Inc. | DSA20300-1000 | |
| Agarose | Dot Scientific Inc. | AGLE-500 | |
| Forceps | ROBOZ | RS-4955 | Dumont #5SF Super Fine Forceps Inox Tip Size .025 X .005mm, for dissecting shoot apices. |
| LSM 880 Upright Confocal Microscope | Zeiss | ||
| Murashige & Skoog MS medium | Dot Scientific Inc. | DSM10200-50 | |
| Plan APO 20x/1.1 water dipping lens | Zeiss | ||
| Plastic petri dishes 100 mm X 15 mm | CELLTREAT Scientific Products | 229694 | Use as making MS plates |
| Plastic petri dishes60 mm X 15 | CELLTREAT Scientific Products | 229665 | Use as imaging dishes |
| Propagation Mix | Sungro Horticulture | ||
| Propidium iodide | Acros Organics | 440300250 | 1 mg/mL solution in water, to stain the cell walls |
| Razor blade | PERSONNA | 62-0179 | For cutting shoot apex from plants |
| Stereomicroscope | Nikon | SMZ1000 | |
| Tissue | VWR | 82003-820 | |
| Zen black | Zeiss | Image acquisition software |
Ссылки
- Meyerowitz, E. M. Genetic control of cell division patterns in developing plants. Cell. 88 (3), 299-308 (1997).
- Xu, C., et al. A cascade of arabinosyltransferases controls shoot meristem size in tomato. Nature Genetics. 47 (7), 784-792 (2015).
- Bommert, P., Nagasawa, N. S., Jackson, D. Quantitative variation in maize kernel row number is controlled by the FASCIATED EAR2 locus. Nature Genetics. 45 (3), 334-337 (2013).
- Je, B. I., et al. Signaling from maize organ primordia via FASCIATED EAR3 regulates stem cell proliferation and yield traits. Nature Genetics. 48 (7), 785-791 (2016).
- Ping, J., et al. Dt2 is a gain-of-function MADS-domain factor gene that specifies semideterminacy in soybean. Plant Cell. 26 (7), 2831-2842 (2014).
- Vaughan, J. G., Jones, F. R. Structure of the angiosperm inflorescence apex. Nature. 171, 751 (1953).
- Sijacic, P., Liu, Z. Novel insights from live-imaging in shoot meristem development. Journal of Integrative Plant Biology. 52 (4), 393-399 (2010).
- Tax, F. E., Durbak, A. Meristems in the movies: live imaging as a tool for decoding intercellular signaling in shoot apical meristems. Plant Cell. 18 (6), 1331 (2006).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. Plant Cell. 16 (1), 74-87 (2004).
- Heisler, M. G., Ohno, C. Live-imaging of the Arabidopsis inflorescence meristem. Methods in Molecular Biology. 1110, 431-440 (2014).
- Tobin, C. J., Meyerowitz, E. M. Real-time lineage analysis to study cell division orientation in the Arabidopsis shoot meristem. Methods in Molecular Biology. 1370, 147-167 (2016).
- Prunet, N. Live confocal Imaging of developing Arabidopsis flowers. Journal of Visualized Experiments. (122), e55156 (2017).
- Prunet, N., et al. Live confocal imaging of Arabidopsis flower buds. Developmental Biology. 419, 114-120 (2016).
- Reddy, G. V., Heisler, M. G., Ehrhardt, D. W., Meyerowitz, E. M. Real-time lineage analysis reveals oriented cell divisions associated with morphogenesis at the shoot apex of Arabidopsis thaliana. Development. 131, 4225-4237 (2004).
- Nimchuk, Z. L., Perdue, T. D. Live Imaging of Shoot Meristems on an Inverted Confocal Microscope Using an Objective Lens Inverter Attachment. Frontiers in Plant Science. 8, 773 (2017).
- Zhou, Y., et al. HAIRY MERISTEM with WUSCHEL confines CLAVATA3 expression to the outer apical meristem layers. Science. 361 (6401), 502-506 (2018).
- Zhou, Y., et al. Control of plant stem cell function by conserved interacting transcriptional regulators. Nature. 517 (7534), 377-380 (2015).
- Nimchuk, Z. L., Zhou, Y., Tarr, P. T., Peterson, B. A., Meyerowitz, E. M. Plant stem cell maintenance by transcriptional cross-regulation of related receptor kinases. Development. 142 (6), 1043 (2015).
- Li, W., et al. LEAFY Controls Auxin Response Pathways in Floral Primordium Formation. Science Signaling. 6 (270), ra23 (2013).
- Truernit, E., et al. High-resolution whole-mount imaging of three-dimensional tissue organization and gene expression enables the study of phloem development and structure in Arabidopsis. Plant Cell. 20 (6), 1494-1503 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены