Method Article
不同植物种的射击顶端共聚焦活图
摘要
该协议介绍了如何利用激光扫描共聚焦显微镜对不同植物种类的芽顶端分生组织进行成像和分析。
摘要
芽顶端分生组织 (SAM) 作为一个保守的干细胞库发挥作用, 它在胚胎发育过程中产生几乎所有的地上组织。Sam 的活性和形态决定了重要的农艺性状, 如芽结构、生殖器官的大小和数量, 最重要的是粮食产量。在这里, 我们提供了一个详细的协议, 用于分析表面形态和内部细胞结构的生活 Sam 从不同的物种通过激光扫描共聚焦显微镜。从样品制备到获取高分辨率三维 (3D) 图像的整个过程可以在短短20分钟内完成。我们证明, 该方案不仅可以很有效地研究模型种的花序 sam, 还可以研究不同作物的营养分生, 为研究模型的组织和发展提供了一个简单而有力的工具。不同植物物种的分生组织。
引言
植物分生组织包含一个未分化的干细胞池, 并不断维持植物器官的生长和发育1。在胚胎后发育过程中, 植物的几乎所有地上组织都来源于茎顶端分生组织 (SAM)。在作物中, SAM 及其衍生花卉分型的活性和大小与许多农艺性状密切相关, 如芽结构、果实产量和种子产量。例如, 在番茄中, 扩大的 SAM 会导致芽和花序分枝的增加, 从而产生额外的花和水果器官2。在玉米中, sam 大小的增加导致种子数量和总产量增加3,4。在大豆中, 分生组织的不确定性也与芽的结构和产量密切相关。
Sam 的形态和解剖结构可以用几种不同的方法来表征, 包括组织学切片染色和扫描电镜 (SEM)6, 这两种方法都通过提供了分生组织的研究, 大大推进了分生组织的研究。截面视图或 sam 的三维 (3D) 表面视图。然而, 这两种方法都很耗时, 涉及从样品制备到数据采集的几个实验步骤, 这些方法主要依赖于固定样品。激光扫描共聚焦显微镜技术的最新进展克服了这些局限性, 为我们研究植物组织和器官的细胞结构和发育过程提供了一个强大的工具 7,8。通过光学而不是物理组织切片, 共聚焦显微镜允许收集一系列 z 堆栈图像, 并随后通过图像分析软件对样本进行3D 重建。
在这里, 我们描述了一个有效的程序, 用于利用激光扫描共聚焦显微镜研究不同植物物种的活体 Sam 的内部和表面结构, 这可能使研究人员能够完成所有的实验在短短20分钟内处理。不同于其他已出版的拟南芥花序 sam 9,10,11, 12,13,14的活共聚焦成像方法, 15和拟南芥花12,13, 这里我们证明了这个协议是高效的, 不仅研究了模型物种的花序分生子, 而且植物芽来自不同作物的顶端分生组织, 如西红柿和大豆。该方法不依赖转基因荧光标记, 有可能应用于研究来自许多不同种类和品种的幼苗分生组织。此外, 我们还介绍了在3D 视图中查看和分析不同 sam 的简单图像处理步骤。总之, 这种简单的方法将有助于研究人员更好地了解从模型生物和作物的分生组织的结构和发育过程。
研究方案
1. 介质和成像盘的准备
- MS 板: 添加 0.5倍 Murashige & Skoog ms 培养基, 1% 琼脂进入去离子水, 然后使用氢氧化钾溶液将 pH 值调整到 5.8 (可选: 为长期植物生长添加1% 的蔗糖)。高压灭菌器和倒板。
- 成像盘: 将塑料培养皿 (6 厘米宽, 1.5 厘米深) 灌满 0.5-0.8 厘米, 并有1.5% 的熔融琼脂糖。
2. 植物生长
-
拟南芥生长
- 将经过消毒的种子播种在 MS 板上, 并将其放置在4°c 下两天。然后, 将 MS 板移动到短的一天 (8小时轻/16小时暗), 在22°c 下两个星期。
- 将幼苗移植到土壤中, 在 22°c (8小时轻/16小时黑暗) 下在22°C 下生长四周。
- 在22°c 下将植物转移到连续的光线下, 以诱导从植物到生殖阶段的过渡, 并用于花序 sam 的成像。
- 番茄和大豆生长
- 在28°c 条件下用湿纸将种子孵化, 直到发芽。
- 将幼苗移植到土壤中, 在 25°c (16小时轻/8小时黑暗) 下长出一周或更长时间, 用于植物 Sam 的成像。
3. 茎尖的解剖
- 花序花期的解剖
- 用剃须刀片将花序花期花期与1-2 厘米长的主茎一起从螺栓上的拟南芥植物中切切。抓住主茎的基部, 用首饰钳解剖花梗, 尽可能多地从主茎中取出更多的老花器官。
注意: 使用剃须刀片时, 请避免切割手指。将使用过的剃须刀片放在适当的锋利器容器中。 - 在立体显微镜的野外用首饰钳或手指握住茎尖的附着茎, 继续去除其余的花, 直到几乎整个 sam 都能从目镜中看到。在主茎的交界处清楚地取出花梗。
- 用剃须刀片将花序花期花期与1-2 厘米长的主茎一起从螺栓上的拟南芥植物中切切。抓住主茎的基部, 用首饰钳解剖花梗, 尽可能多地从主茎中取出更多的老花器官。
- 植物茎尖的解剖
- 要从番茄或大豆中观察植物 sam, 可以从植物中分解子叶、叶子和根。
- 在立体显微镜下握住植物的下胚轴, 用首饰钳进一步解剖覆盖植物 Sam 的叶原基。
4. 染色
- 要直接可视化 Sam 中的细胞, 请使用新鲜制备的碘化物 (PI) 溶液来染色细胞壁。将 PI 粉末溶解在无菌、去离子水中, 在浓度为 1 mgml 的情况下制备 1mL PI 染色溶液, 并将 PI 溶液储存在覆盖铝箔的微离心管中。
- 移液器 50Μl PI 溶液在一个干净的和空的 Petri 盘中, 将整个解剖的芽先端浸入染料中 2分钟. 在无菌的去离子水中两次冲洗染色的茎尖。在染色过程中, 将整个花序 sam 或营养 SAM 浸入 PI 溶液中, 以实现均匀染色。
5. 图像收集
注: 对于这种方法, 所有 sam 都是使用直立共聚焦显微镜和20x 浸水镜片成像的。如其他协议 9、12、13、15所述, 使用倒置显微镜对 sam 进行成像也是可行的。此外, 使用不同品牌的共聚焦显微镜可以实现实时成像, 样品制备步骤相同。在本研究中, 成像步骤作为一个例子进行了详细的描述。
- 用钳子刺穿成像盘中心的洞, 并将染色的射门尖顶垂直贴在介质中。
- 用无菌、去离子化的水填充成像盘, 使样品完全浸水。从立体显微镜观察, 移液器上下删除气泡被困在分生组织周围。然后, 调整琼脂中的茎的角度, 以确保 SAM 是完全可见的, 从正上方。
- 将成像盘放置在共聚焦显微镜的样品阶段。降低浸水镜片, 提高显微镜样品级, 让镜片尖端浸入水中。
- 打开共聚焦显微镜软件, 定位目镜中明亮场中的 SAM。通过调整 XY 控制器, 将 SAM 样品直接移动到物镜下方, 然后通过谨慎调整 Z 控制器将焦点放在目镜上的 SAM。
- 在共聚焦显微镜软件中操作采集功能 (参见材料表), 启动live 模式, 从计算机屏幕查看样品, 并设置激光扫描实验的所有参数。
- 调整参数时, 使用范围指示器功能来定义信号是否饱和。
- (可选) 应用 "重用"函数重新加载所选的 conc集 g 文件中的所有参数设置。
注: 建议的成像参数: 激光线 (激发): 515 nm 或 515 nm;排放570-650 纳米;针孔: 1个通风单元 (AU);增益: 600-750, 扫描模式: 框架;帧大小: 512 X 512 或 1024 X 1024;扫描速度: 从7到最大;扫描方向: 双向;平均数: 2-4;平均法: 均值;位深度: 16位;扫描间隔: 0.5-1 微米。此外, 根据不同工厂样品的性质和特定的成像需求优化所有这些参数。
6. 图像处理
- 对于可视化光学正交和横向截面视图, 使用相同的商业软件进行成像采集。打开原始的共聚焦文件, 单击 "正交" 菜单, 选择 "正交"。然后选择图像的 x 位置、y 位置和 z 位置, 并将图像另存为 tiff 文件。
- (可选) 选择 3d距离函数以定义从共聚焦图像堆栈中选择的两个点之间的物理距离。
- 或者, 使用开放资源图像处理包 Fiji/mamage j 来可视化正交和横向截面视图。
- 打开与斐济的原始共聚焦文件, 单击 "图像" 菜单, 选择 "堆栈", 然后选择"正交视图"。
- 选择中间位置的xy、YZ和xz平面, 并另存为 tiff 格式图像。
- 要可视化3D 透明投影, 请使用相同的软件。
- 打开原始共聚焦文件, 单击 " 3d" 菜单, 然后选择"透明" 以生成3d 投影视图。
- (可选) 单击 " 3d" 菜单, 选择"外观" , 然后选择 "透明度" 以调整投影的三个参数, 包括阈值、 "坡道" 和"最大值", 以确保3d 的透明度图像。
- 单击 " 3d" 菜单, 选择 "外观",然后选择"光线" 以调整3d 图像的亮度。
- 导出投影图像并将其保存为 Tiff 文件。
- 要可视化3D 最大强度投影, 请使用相同的软件打开共聚焦文件, 然后单击3D 菜单。
- 选择"3D" 菜单, 然后选择 "最大值"。
- 或者, 使用 fijim送给 image j 可视化3D 最大强度投影。
- 打开与斐济的原始共聚焦文件, 单击 "图像" 菜单并选择堆栈。
- 选择3d 项目并另存为 tiff 格式图像。
- 要可视化3D 图像的深度编码视图, 请使用相同的软件。
- 单击 " 3D" 菜单, 然后选择 "外观"。
- 选择 "特殊", 然后选择 "深度编码"。
- 或者, 使用 Fiji/maj图姆 j 可视化深度编码视图。
- 打开共焦点文件, 单击"图像"菜单, 选择 "超堆栈"。
- 选择"时间颜色代码" , 并将其另存为 tiff 格式图像。
注: 深度编码 z 堆栈也可以通过斐济的插件 z 代码堆栈来实现。
- 要按照显示的显示可视化3d 旋转视图 (电影 1和影片 2), 请使用相同的软件 (请参阅材料表)。
- 打开共焦点文件, 单击 " 3d" 菜单, 然后选择 "系列"。
- 选择"渲染系列", 然后从四个选项中选择一个选项, 包括"旋转 x"、 "旋转 y"、 "开始和结束 " 以及 "位置" 列表.
- 将渲染系列另存为 AVI 文件。
- 或者, 使用 fijim送给 j 可视化3D 旋转视图。
- 打开与斐济一起的原始共聚焦文件, 单击 "图像" 菜单, 然后选择 "堆栈"。
- 选择3d 项目并保存为 avi 格式的视频。
结果
为了评价我们的协议的效率, 并探索来自不同物种的分生组织的形态, 我们对拟南芥的花序分生子和植物分生组织进行了共聚焦现场成像实验。西红柿和大豆。本研究以拟南芥生态型兰塞伯格、 番茄品种微汤姆和大豆品种威廉姆斯82为例。
从正交部分到拟南芥sam 中间, 很明显, pi 能够从多个细胞层的几乎所有细胞中染色水平壁 (图 1a)。 从一个横截面通过花序 sam 的主体显示, XY 平面上的细胞也被清楚地成像 (图 1b)。在3D 投影视图中, 花序分生组织形成一个圆顶状结构, 并被发育中的花原体包围, 细胞也被染色和成像 (图 1 C-D) (电影1)。
从正交部分到番茄 SAM 的中间, 很明显, PI 能够从多个细胞层的细胞中染色水平壁, 尽管来自深层内部区域的 PI 信号略低。从一个横截面穿过营养人 SAM 的深层, xy 平面的细胞也清晰地成像, 植物分生组织和叶原基之间形成的边界也被成像 (图 2b)。3D 项目视图可以进一步提供番茄植物分生组织的形状和组织的全面视图 (图 2C-D) (电影2)。
在通过大豆 SAM 中间的正交视图中, 我们可以看到圆顶状植物分生组织及其衍生的新叶原生 (图 3a)。在三维投影视图中, 大豆营养分生组织和番茄营养植物分生组织都形成了圆顶状结构, 而大豆营养分生组织的形状与番茄分生组织的形状不同, 其组织和模式也不同。这两个 Sam 周围的叶原基是不同的 (图 3B-C)。

图 1: 拟南芥花序圣节的实时成像和分析。A和b。光学正交 (Orth) 和横向 (Trans) 剖面视图的中间平面相同 sam, PI (碘化物) 染色 (紫色)。相同SAM、pi 染色 (灰色) 的3d 投影。d. 三维投影的深度颜色编码, 蓝色表示顶部表面层, 红色表示最深的图层。细胞壁被 PI 染色。刻度柱: 20μm (a, b);50微米 (c, d)。请点击这里查看此图的较大版本.
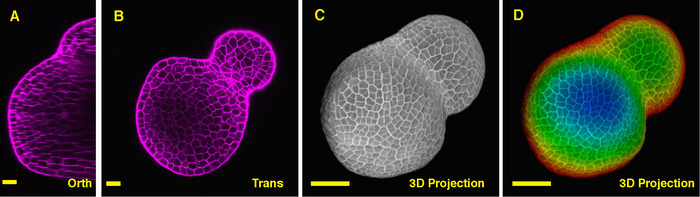
图 2:番茄植物 sam 的实时成像与分析。A和b。光学正交 (Orth) 和横向 (Trans) 剖面视图的中间平面的相同 sam。相同Sam 的3d 投影。d. 三维投影的深度颜色编码, 蓝色表示顶部表面层, 红色表示最深的图层。细胞壁被 PI 染色。刻度柱: 20μm (a, b);50微米 (c, d)。请点击这里查看此图的较大版本.
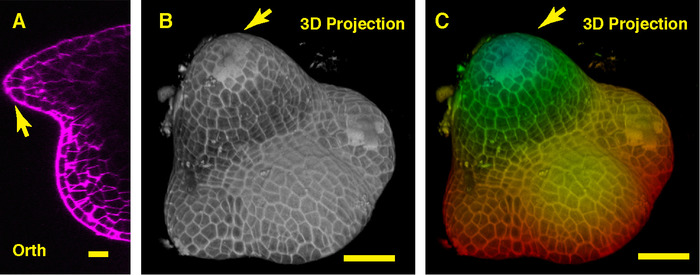
图 3:大豆植物 sam 的实时成像与分析.植物sam 中间平面的光学正交 (orth) 剖面视图。b. 相同 Sam 的3d 投影。c. 三维投影的深度颜色编码, 蓝色表示顶部表面层, 红色表示最深的图层。细胞壁被 PI 染色。刻度柱: 20μm (a);50微米 (b, c)。箭头: 叶原基。请点击这里查看此图的较大版本.

视频 1:3D 旋转的拟南芥花序分生组织在图 1。请点击这里观看此视频。(右键单击下载.

视频 2: 3d 旋转的番茄营养分生组织在图 2。请点击这里观看此视频。(右键单击下载.
讨论
本文介绍了一种简单的成像方法, 该方法可应用于不同植物的茎尖分生组织的研究, 并进行轻微的修饰, 为研究模型植物植物和生殖阶段的分生组织调控开辟了新的途径。作物。与扫描电镜和组织学染色方法不同, 该协议可以帮助揭示 Sam 的表面视图和内部细胞结构, 而不需要劳动密集型样品固定和组织切片步骤。该协议还与 Sam 中基于荧光的记者的既定成像方法兼容, 有可能提供良好的细胞分辨率, 使我们能够获得 SAM 16 中关键基因和蛋白质表达模式的3D 视图 ,17,18,19。此外, 这里描述的相关图像处理过程将能够极大地帮助研究人员分析和比较来自不同物种的 Sam 在 3D, 推进进化-发育生物学研究和农业研究。
这个简单的协议有几个关键的步骤。首先, 样品制备和解剖。植物 SAM 通常通过在芽尖发育原基和年轻器官而隐藏, 不能在共聚焦显微镜下直接成像。要想象植物 SAM, 有必要使用精美的珠宝钳去除所有覆盖在 SAM 顶部的叶子和较旧的叶子原基。要想象花序 sam, 有必要小心地去除所有的幼苗, 露出 sam, 也使用精美的珠宝钳。
其次, 使用 PI 溶液进行活细胞染色。在该协议中, 我们使用新准备的 PI 解决方案 (1 mg/mL) 来染色细胞壁, 以直接可视化实时 sam, 它快速、高效且易于执行。虽然 PI 溶液可以在4°c 下储存数周, 但新制备的溶液通常能给出最佳的染色效果。虽然 PI 主要不穿过活细胞的膜, 它用清晰的细胞轮廓玷污完整的细胞, 但它可以很容易地穿透受损的细胞, 并强烈污染受损地区的细胞核和其他内膜系统,有可能影响共聚焦图像的质量。因此, 在准备 SAM 样品进行染色和实时成像时, 必须避免任何物理损伤。另一方面, 高浓度的 PI 对植物细胞有毒性作用, 因此, FM4-64 可作为 PI 的替代品, 对活的 SAM 细胞进行染色。然而, FM4-64 标签质膜, 这可能会被带入细胞内部通过内吞, 使其具有挑战性的染色样品具有较高的细胞分辨率。
第三, 成像采集。1). 高数值孔径 (NA), 浸水镜对 Sam 的实时成像至关重要。水的折射率高于空气, 物镜的高 NA 有助于收集分散在 Sam 深层细胞层的信号光子。2). 激光功率 (每个表面的瓦特或瓦特) 的设置在不同的共聚焦显微镜之间可以高度可变。较高的激光功率可能允许更好的信号采集, 但会导致样品上有更多的光测量/光漂白。分辨率、漂白和成像时间之间存在权衡。通常, 选择更大的帧大小可提高 XY 分辨率, 但可获得更多的成像时间, 而选择较小的扫描间隔可获得更好的 Z 分辨率, 同时也会带来更多的成像时间。较长的成像时间可能会导致更多的光测量/光漂白
使用这种方法, 有时可能不容易观察到更深层组织层的细胞细节, 这可能是由于在内部组织中的共聚焦检测和效率低下的 PI 染色。根据我们的经验, 增加 PI 溶液的浓度和染色时间有助于获得更好的染色效果。或者, 也可以对染色过程进行修改。例如, 改进后的碘化假希夫丙基 (mPS-PI) 方法适用于固定组织20。今后仍有必要为活体组织寻找染色效果更好的替代染料。此外, 考虑到一些植物物种具有特殊的细胞含量或不同的细胞壁, 测试这里描述的方法是否可以普遍应用于所有其他开花植物的 Sam 研究也是一件有趣的事情成分。
披露声明
作者没有什么可透露的。
致谢
作者感谢 Purdue Bindley 生物科学中心成像设施访问激光扫描共聚焦显微镜和技术支持, 并感谢 Andy Schaber 在 Purdue Bindley 成像设备中提供的帮助。这项活动由普渡大学资助, 作为 AgSEED 十字路口资金的一部分, 以支持印第安纳州的农业和农村发展。
材料
| Name | Company | Catalog Number | Comments |
| Agar Phyto | Dot Scientific Inc. | DSA20300-1000 | |
| Agarose | Dot Scientific Inc. | AGLE-500 | |
| Forceps | ROBOZ | RS-4955 | Dumont #5SF Super Fine Forceps Inox Tip Size .025 X .005mm, for dissecting shoot apices. |
| LSM 880 Upright Confocal Microscope | Zeiss | ||
| Murashige & Skoog MS medium | Dot Scientific Inc. | DSM10200-50 | |
| Plan APO 20x/1.1 water dipping lens | Zeiss | ||
| Plastic petri dishes 100 mm X 15 mm | CELLTREAT Scientific Products | 229694 | Use as making MS plates |
| Plastic petri dishes60 mm X 15 | CELLTREAT Scientific Products | 229665 | Use as imaging dishes |
| Propagation Mix | Sungro Horticulture | ||
| Propidium iodide | Acros Organics | 440300250 | 1 mg/mL solution in water, to stain the cell walls |
| Razor blade | PERSONNA | 62-0179 | For cutting shoot apex from plants |
| Stereomicroscope | Nikon | SMZ1000 | |
| Tissue | VWR | 82003-820 | |
| Zen black | Zeiss | Image acquisition software |
参考文献
- Meyerowitz, E. M. Genetic control of cell division patterns in developing plants. Cell. 88 (3), 299-308 (1997).
- Xu, C., et al. A cascade of arabinosyltransferases controls shoot meristem size in tomato. Nature Genetics. 47 (7), 784-792 (2015).
- Bommert, P., Nagasawa, N. S., Jackson, D. Quantitative variation in maize kernel row number is controlled by the FASCIATED EAR2 locus. Nature Genetics. 45 (3), 334-337 (2013).
- Je, B. I., et al. Signaling from maize organ primordia via FASCIATED EAR3 regulates stem cell proliferation and yield traits. Nature Genetics. 48 (7), 785-791 (2016).
- Ping, J., et al. Dt2 is a gain-of-function MADS-domain factor gene that specifies semideterminacy in soybean. Plant Cell. 26 (7), 2831-2842 (2014).
- Vaughan, J. G., Jones, F. R. Structure of the angiosperm inflorescence apex. Nature. 171, 751 (1953).
- Sijacic, P., Liu, Z. Novel insights from live-imaging in shoot meristem development. Journal of Integrative Plant Biology. 52 (4), 393-399 (2010).
- Tax, F. E., Durbak, A. Meristems in the movies: live imaging as a tool for decoding intercellular signaling in shoot apical meristems. Plant Cell. 18 (6), 1331 (2006).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. Plant Cell. 16 (1), 74-87 (2004).
- Heisler, M. G., Ohno, C. Live-imaging of the Arabidopsis inflorescence meristem. Methods in Molecular Biology. 1110, 431-440 (2014).
- Tobin, C. J., Meyerowitz, E. M. Real-time lineage analysis to study cell division orientation in the Arabidopsis shoot meristem. Methods in Molecular Biology. 1370, 147-167 (2016).
- Prunet, N. Live confocal Imaging of developing Arabidopsis flowers. Journal of Visualized Experiments. (122), e55156 (2017).
- Prunet, N., et al. Live confocal imaging of Arabidopsis flower buds. Developmental Biology. 419, 114-120 (2016).
- Reddy, G. V., Heisler, M. G., Ehrhardt, D. W., Meyerowitz, E. M. Real-time lineage analysis reveals oriented cell divisions associated with morphogenesis at the shoot apex of Arabidopsis thaliana. Development. 131, 4225-4237 (2004).
- Nimchuk, Z. L., Perdue, T. D. Live Imaging of Shoot Meristems on an Inverted Confocal Microscope Using an Objective Lens Inverter Attachment. Frontiers in Plant Science. 8, 773 (2017).
- Zhou, Y., et al. HAIRY MERISTEM with WUSCHEL confines CLAVATA3 expression to the outer apical meristem layers. Science. 361 (6401), 502-506 (2018).
- Zhou, Y., et al. Control of plant stem cell function by conserved interacting transcriptional regulators. Nature. 517 (7534), 377-380 (2015).
- Nimchuk, Z. L., Zhou, Y., Tarr, P. T., Peterson, B. A., Meyerowitz, E. M. Plant stem cell maintenance by transcriptional cross-regulation of related receptor kinases. Development. 142 (6), 1043 (2015).
- Li, W., et al. LEAFY Controls Auxin Response Pathways in Floral Primordium Formation. Science Signaling. 6 (270), ra23 (2013).
- Truernit, E., et al. High-resolution whole-mount imaging of three-dimensional tissue organization and gene expression enables the study of phloem development and structure in Arabidopsis. Plant Cell. 20 (6), 1494-1503 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。