Method Article
다른 식물 종에서 촬영 정점 Meristems의 confocal 라이브 영상
요약
이 프로토콜 라이브 이미지 촬영 정점 meristems 레이저 스캐닝 confocal 현미경 검사 법을 사용 하 여 다른 식물 종에서 분석 하는 방법을 제공 합니다.
초록
줄기 세포 보존된 저수지와 그것으로 촬영 정점 분열 조직 (SAM) 함수 postembryonic 개발 하는 동안 거의 모든 지상 직물을 생성 합니다. 활동 및 SAMs의 형태학 생식 기관, 그리고 가장 중요 한 것은, 곡물 수확량의 촬영 아키텍처, 크기와 같은 중요 한 농경 특성을 결정합니다. 여기, 우리는 레이저 confocal 현미경 검사를 통해 표면 형태와 다른 종에서 살아있는 SAMs의 내부 세포의 구조를 분석 하기 위한 상세한 프로토콜을 제공 합니다. 내에서 높은 해상도의 3 차원 (3D) 이미지 수집 샘플 준비에서 모든 절차를 수행할 수 있습니다 짧은 20 분. 이 프로토콜은 고효율 화 서 조직과의 개발을 공부 하는 간단 하지만 강력한 도구를 제공 하는 모델 종 뿐만 아니라 다른 작물에서 식물 meristems의 SAMs 뿐만 아니라 공부에 대 한 설명 다른 식물 종에 걸쳐 meristems입니다.
서문
식물 분열 조직 미 분화 줄기 세포의 수영장을 포함 하 고 지속적으로 격려 하 고 식물의 기관 성장과 개발1. Postembryonic 개발 하는 동안 식물의 거의 모든 지상 직물은 싹 정점 분열 조직 (SAM)에서 파생 됩니다. 작물, 활동 및 SAM과 그 파생된 꽃 meristems의 크기는 촬영 아키텍처, 과일 생산, 씨 수확량 등 많은 농경 특성 밀접 하 게 연관 된다. 예를 들어 토마토, 확대 샘 하면 촬영 및 꽃이 핌 분기, 증가 하 고 따라서 여분의 꽃 및 과일 장기2생성 결과. 옥수수에서 SAM 크기 증가 더 높은 씨 수 및 총 수익률3,4이끌어 낸다. 콩, 분열 조직 불확정성 촬영 아키텍처에 밀접 하 게 연관 이며 또한5항복.
형태학 및 SAMs의 여러 가지 방법으로, 조직학 단면/얼룩 및 스캐닝 전자 현미경 (SEM)6를 포함 하 여 둘 다 크게 제공을 통해 분열 조직 연구 고급 나타낼 수 있다 중 단면 보기 또는 SAMs의 3 차원 (3D) 표면 보기. 그러나, 두 방법 모두 시간이 걸리고, 데이터 수집, 샘플 준비에서 몇 가지 실험 단계를 포함 되며 이러한 메서드는 주로 고정된 샘플에 따라 달라 집니다. 레이저 스캐닝 confocal 현미경 검사 법 기술에서에서의 최근 발전 이러한 한계를 극복 하 고 세포의 구조 및 식물 조직 및 장기7,8의 발달 과정을 조사 하는 강력한 도구를 제공. 통해 물리적 조직 보다 광 단면, confocal 현미경 검사 법 수 수 일련의 z-스택 이미지 및 이미지 분석 소프트웨어를 통해 샘플의 후속 3D 재구성의 컬렉션.
여기, 우리 둘 다 내부 조사에 대 한 효율적인 절차에 설명 하 고 다른 생활 SAMs의 표면 구조 식물 종 레이저 confocal 현미경 검사 법, 잠재적으로 모든 실험을 수행 하는 연구를 수 있는 스캔을 사용 하 여 프로세스 내에서 20 분으로 짧은. 애기 꽃이 핌 SAMs9,10,11,12,,1314의 라이브 confocal 영상에 대 한 다른 게시 된 방법에서 다른 15 와 애기 꽃12,13, 여기이 프로토콜은 매우 효율적인 모델 종 뿐만 아니라 식물 촬영의 꽃이 핌 meristems 뿐만 아니라 공부에 대 한 설명 토마토, 콩 등 다른 작물에서 정점 meristems. 이 방법은 유전자 변형 형광 표식에 의존 하지 않는 하 고 잠재적으로 많은 다른 종 및 재배 품 정에서 촬영 meristems 연구에 적용할 수 있습니다. 또한, 우리는 또한 간단한 이미지 보기 및 3D 뷰에서 다른 SAMs를 분석 하기 위한 단계를 처리 소개 합니다. 함께 찍은,이 간단한 방법을 더 나은 구조와 모형 유기 체 및 작물에서 meristems의 발달 과정을 이해 하는 연구를 촉진 한다.
프로토콜
1. 미디어와 이미징 요리 준비
- MS 판: 이온된 물으로 重 & Skoog MS 중간, 1% 천 x 0.5를 추가 하 고 다음 pH 5.8 수산화 칼륨 솔루션을 사용 하 여를 조정 (선택 사항: 장기 식물 성장에 대 한 1% 자당을 추가). 오토 클레이 브 및 부 접시입니다.
- 요리를 이미징: 0.5-0.8을 플라스틱 페 트리 접시 (6 c m, 깊이 1.5 c m)를 채우기 1.5% 녹은 agarose와 cm.
2. 식물 성장
-
애기 성장
- MS 판에 소독된 씨앗을 뿌리 다 고 2 일에 대 한 접시 4 ° C이 하를 배치 합니다. 그런 다음 짧은 데 MS 판 이동 (8 h 빛 / 어둠 16 h), 2 주 동안 22 ° C에서.
- 토양에 모 종을 이식 하 고 짧은 하루에 그들을 성장 (8 h 빛 / 어둠 16 h) 4 주 동안 22 ° C에서.
- 식물 생식 단계 및 꽃이 핌 SAMs 이미징는 식물에서 전환 유도에 22 ° C에서 연속 빛을 전송 합니다.
- 토마토와 콩 성장
- 그들은 발 아까지 젖은 필터 종이 28 ° C 미만으로 덮여 씨앗을 품 어.
- 토양에 모 종을 이식 하 고 긴 하루에 그들을 성장 (16 h 빛 / 8 h 어두운) 식물 SAMs 이미징에 대 한 1 주일 이상 25 ° C에서.
3입니다. 촬영 꼭대기의 해 부
- 화 서 촬영 꼭대기의 해 부
- 면도날으로 볼트 애기 식물에서 1-2 cm 주요 줄기와 함께 꽃이 핌 촬영 꼭대기를 잘라. 주요 줄기의 기저 부분 누른 보석 집게와는 peduncles 개 해 부에 의해 주요 줄기에서 가능한 많은 더 오래 된 꽃 장기를 제거 합니다.
주의: 면도날을 사용 하 여 절단 손가락을 피하십시오. 적절 한 sharps의 컨테이너를 사용된 하는 면도날의 처분. - 보석 포 셉 또는 분야는 stereomicroscope의 손가락 촬영 꼭대기의 연결 된 줄기를 잡고, 꽃의 나머지 부분을 제거 하는 거의 전체 SAM는 접 안경에서 볼 수 있습니다 때까지 계속. 주요 줄기의 교차점에서 명확 하 게 peduncles 제거 합니다.
- 면도날으로 볼트 애기 식물에서 1-2 cm 주요 줄기와 함께 꽃이 핌 촬영 꼭대기를 잘라. 주요 줄기의 기저 부분 누른 보석 집게와는 peduncles 개 해 부에 의해 주요 줄기에서 가능한 많은 더 오래 된 꽃 장기를 제거 합니다.
- 식물 촬영 꼭대기의 해 부
- 토마토 또는 콩 식물 SAMs를 보려면 cotyledons, 밖으로 해 부, 및 식물에서 뿌리.
- 아래는 stereomicroscope 식물의 hypocotyls 고 추가 취재 보석 집게를 사용 하 여 식물 SAMs 잎 primordia 밖으로 해 부.
4. 얼룩
- SAMs에 세포를 직접 시각화 하려면 갓된 propidium 요오드 화물 (PI) 솔루션을 사용 하 여 세포 벽 얼룩. 살 균 이온에 PI 분말 분해, 1 mL PI 얼룩 솔루션 1 mg/mL의 농도에서 만들고 알루미늄 호 일로 덮여 microcentrifuge 관에서 PI 솔루션을 저장.
- 50 µ L PI 솔루션에서 깨끗 한 플라스틱 하 고 빈 페 트리 접시와 딥 전체 해 부 촬영 정점 2 분 린스에 대 한 염료로 얼룩진된 촬영 정점 살 균, 이온을 제거 된 물에 두 번. 착 색 과정은 전체 화 서 샘 또는 식물 샘 균일 한 얼룩을 달성 하기 위해 PI 솔루션에 젖어.
5. 이미지 모음
물 담그고 렌즈 x 20는 SAMs는 똑바로 confocal 현미경을 사용 하 여 몇 군데는 모두이 방법에 대 한 참고:와. 다른 프로토콜9,12,,1315에 설명 된 대로 그것은 또한 가능한 이미지 SAMs는 거꾸로 한 현미경을 사용 하 여. 또한, 라이브 영상 같은 샘플 준비 단계 confocal 현미경의 다른 브랜드를 사용 하 여 얻을 수 있습니다. 이 연구에서 이미징 단계 예를 들어 자세히 설명 합니다.
- 집게를 사용 하 여 이미징 접시의 중앙에 구멍을 뚫 고 매체에 얼룩진된 촬영 꼭대기를 직 립 스틱.
- 샘플을 완전히 몰입할 수 살 균, 이온을 제거 된 물으로 이미징 접시를 채우십시오. 스테레오 현미경에서 보기, 피 펫 여기저기 기포를 제거 하는 분열 조직 주위 갇혀. 그런 다음, 샘 바로 위에 완벽 하 게 볼 수 있는지 확인 한 천에서 줄기의 각도 조정 합니다.
- 공초점 현미경의 샘플 단계에 이미징 접시를 놓습니다. 낮은 물 찍기 렌즈 하며 현미경 샘플 단 물으로 렌즈 딥의 팁을 하도록 합니다.
- 공초점 현미경 소프트웨어 열고는 접 안경에 명시에는 샘을 찾습니다. XY 컨트롤러 조정 통해 대물 렌즈 아래 샘 샘플 오른쪽 이동 후 Z 컨트롤러를 조심 스럽게 조정 통해 접 안경에서 샘에 초점.
- 공초점 현미경 소프트웨어에 인수 함수 작동는 라이브 모드 컴퓨터 화면에서 샘플을 확인 하 고 실험을 스캔 하는 레이저에 대 한 모든 매개 변수를 설정 하는 ( 테이블의 자료참조) 시작.
- 매개 변수를 조정할 때는 범위 표시기 기능을 사용 하 여 신호 포화 여부를 정의 하.
- 필요에 따라 선택한 confocal 파일에서 모든 매개 변수 설정을 다시 로드 하려면 다시 사용할 함수를 적용 합니다.
참고: 매개 변수를 이미징 제안: 선 (여기) 레이저: 515 nm 또는 561 nm; 방출 570-650 nm; 홀: 1 공기 단위 (AU); 이득: 600-750, 스캔 모드: 프레임; 프레임 크기: 512 X 512 또는 1024 X 1024; 스캔 속도: 최대; 7 검색 방향: 양방향-방향; 평균 번호: 2-4; 평균 방법: 의미; 비트 깊이: 16 비트; 스캔 간격: 0.5-1 µ M. 또한, 다른 식물 샘플 및 특정 이미징 요구의 성격에 따라 이러한 모든 매개이 변수를 최적화 합니다.
6. 이미지 처리
- 광학 직교 및 가로 섹션 보기 시각화, 영상 획득에 대 한 같은 상용 소프트웨어를 사용 합니다. 원래 confocal 파일을 열고, 수직 메뉴 클릭, 직교 선택. 다음 선택 중 하나 x 위치, y 위치 및 z 이미지의 위치 이미지를 tiff 파일로 저장.
- 3D 거리 함수 스택에서 공초점 이미지의 선정 된 두 점 사이의 실제 거리를 정의를 선택 합니다.
- 또는 피지/이미지 J, 직교 및 가로 섹션 보기를 시각화 하기 위해 오픈 리소스 이미지 처리 패키지를 사용 하 여.
- 피지와 원래 confocal 파일을 열고, 이미지 메뉴를 클릭, 스택 선택한 다음 직교 보기를 선택 하십시오.
- 중간 위치에 XY, YZ, 및 XZ 평면을 선택 하 고 이미지를 Tiff 형식으로 저장.
- 3D 투명 한 투영을 시각화에 대 한 동일한 소프트웨어를 사용 합니다.
- 원래 confocal 파일, 3D 메뉴를 클릭 열고 선택 투명 3D 투영 뷰를 생성 하.
- 필요에 따라 3D 메뉴를 클릭, 모양을 선택한 후 투명도 임계값, 램프 및 최대 를 포함 하 여 3D의 투명성에 대 한 투영의 3 개의 매개 변수를 조정 이미지입니다.
- 3D 메뉴 모양, 선택한 빛 3D 이미지의 밝기를 조정 하려면 선택 합니다.
- 영사 된 이미지를 내보내고 Tiff 파일로 그들을 저장.
- 3 차원 최대 강도 프로젝션, 시각화에 대 한 동일한 소프트웨어와 함께 confocal 파일을 열고 3D 메뉴를 클릭 합니다.
- 3D 메뉴 를 선택 하 고 최대선택 하십시오.
- 또는 피지/이미지 J를 사용 하 여 3D 최대 강도 투영을 시각화.
- 피지와 원래 confocal 파일을 열고, 이미지 메뉴 를 클릭 하 고 스택을 선택 합니다.
- 3D 프로젝트 를 선택 하 고 이미지를 Tiff 형식으로 저장 합니다.
- 3D 이미지의 보기를 코딩 하는 깊이 시각화에 대 한 동일한 소프트웨어를 사용 합니다.
- 3D 메뉴 를 클릭 하 고 선택 하는 모습.
- 특별 한 선택 하 고 깊이 코딩.
- 또는 피지/이미지 J을 사용 하 여 보기를 코딩 하는 깊이 시각화.
- 오픈 confocal 파일, 클릭 이미지 메뉴 Hyperstack선택합니다.
- 측 색 코드 를 선택 하 고 이미지를 Tiff 형식으로 저장.
참고: 깊이 코딩 z-스택 또한 얻을 수 있습니다 플러그인 Z 코드 스택 피지를 통해.
- 3D 시각화 표시 (영화 1 및 영화 2), 회전 보기 동일한 소프트웨어를 사용 ( 재료의 표참조).
- Confocal 파일을 열고, 3D 메뉴를 클릭 하 고 시리즈를 선택 합니다.
- 렌더링 시리즈를선택 하 고 x, y를 돌아서, 시작과 끝, 그리고 돌아서 위치 목록을 포함 하 여 4 개의 옵션 중 하나를 선택 합니다.
- AVI 파일로 렌더링 시리즈를 저장 합니다.
- 또는 피지/이미지 J를 사용 하 여 3D 회전 보기 시각화.
- 피지와 원래 confocal 파일을 열고, 이미지 메뉴를 클릭 하 고 스택을 선택 합니다.
- 3D 프로젝트 를 선택 하 고 AVI 포맷 비디오로 저장.
결과
우리의 프로토콜의 효율성을 평가 하 고 하 여는 meristems의 형태를 다른 종, 우리 애기 에서 화 서 분열 조직에서 식물 meristems에 confocal 라이브 이미징 실험을 수행 했습니다. 둘 다 토마토와 콩입니다. 이 연구, 애기 ecotype 란 츠 베르크 erecta, 토마토 품종 마이크로 톰, 콩 품종에서 윌리엄스 82 예제로 사용 되었습니다.
애기 샘의 중간을 통해 직교 섹션에서 볼 때, 그것은 분명 PI 여러 세포 층 (그림 1A)에서 거의 모든 세포에서 가로 벽 얼룩 수 있었습니다. 화 서 샘의 모음을 통해 한 횡 근 섹션에서 XY 평면에서 셀은 또한 명확 하 게 몇 군데 (그림 1B). 3D 투영 뷰에 화 서 분열 조직 구조 같이 돔 형성 하 고 개발 꽃 primordia, 셀 또한 스테인드 하 고 몇 군데 (그림 1 C D) (영화 1)에 의해 둘러싸여.
토마토 샘의 중간을 통해 직교 섹션에서 볼 때, 그것은 분명 PI 여러 세포 층에 세포에서 가로 벽 얼룩 수 있었습니다, PI에서 신호 이지만 깊은 인테리어 지역 약간 낮습니다. 식물 샘의 깊은 계층을 통해 한 횡 근 섹션에서 XY 평면에서 세포는 또한 명확 하 게 몇 군데, 그리고 식물 분열 조직 및 잎 primordia 사이 형성 하는 경계는 또한 군데 (그림 2B). 모양의 포괄적인 보기 및 토마토 (그림 2 C D) (영화 2)에서 식물 분열 조직 조직에 더 3D 프로젝트 보기 제공할 수 있습니다.
콩 샘의 중간을 통해 직교 보기에서 우리는 돔 모양의 식물 분열 조직 및 그것의 파생 된 새로운 잎 primordia (그림 3A)를 볼 수 있습니다. 그러나 3D 투영 뷰에서 모두 콩 식물 분열 조직 및 토마토 식물 분열 조직 형성 구조 같이 돔, 콩 식물 분열 조직 모양 토마토 분열 조직 및 조직 및의 패턴에서 다르다, 이러한 두 SAMs를 둘러싼 잎 primordia는 별개 (그림 3B-C).

그림 1: 라이브 이미징와 애기의 꽃이 핌 샘을 분석. A 와 B. 광학 직교 (Orth) 및 가로 (트랜스) 섹션 같은 샘, PI (propidium 요오드 화물)의 중간 비행기의 얼룩 (보라색). C. 같은 샘의 3D 투영, PI 얼룩 (회색). D. 깊이 최고 지상 층 및 깊은 층을 대표 하는 빨강을 나타내는 블루와 3D 투영의 색상 코딩. 세포 벽은 PI와 스테인드 했다. 스케일 바: 20 µ m (A, B); 50 마이크론 (C, D) 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
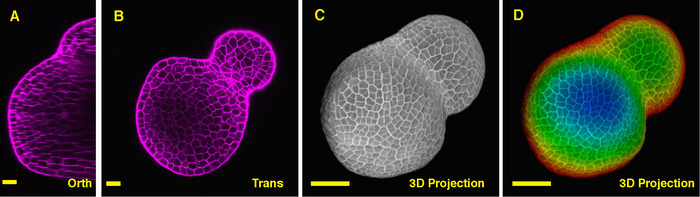
그림 2: 라이브 이미징와 토마토의 무성 한 샘을 분석 합니다. A 와 B. 광학 직교 (Orth) 및 가로 (트랜스) 같은 샘의 중간 비행기의 섹션. C. 같은 샘의 3D 투영. D. 깊이 최고 지상 층 및 깊은 층을 대표 하는 빨강을 나타내는 블루와 3D 투영의 색상 코딩. 세포 벽은 PI와 스테인드 했다. 스케일 바: 20 µ m (A, B); 50 마이크론 (C, D) 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
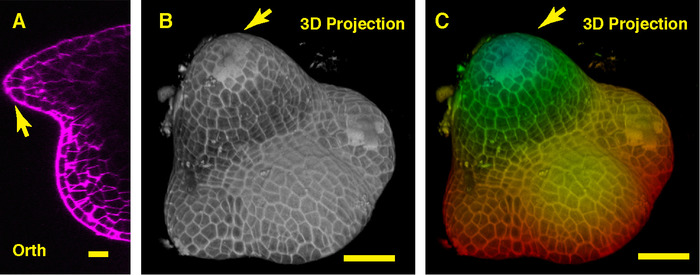
그림 3: 라이브 이미징 및 콩의 무성 한 샘을 분석. A. 식물 샘의 중간 비행기의 한 광학 직교 (Orth) 섹션 보기. B. 같은 샘의 3D 투영. C. 깊이 최고 지상 층 및 깊은 층을 대표 하는 빨강을 나타내는 블루와 3D 투영의 색상 코딩. 세포 벽은 PI와 스테인드 했다. 스케일 바: 20 µ m (A); 50 마이크론 (B, C) 화살표: 잎 primordium입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

비디오 1: 그림1에서 애기 화 서 분열 조직의 3D 회전. 이 비디오를 보려면 여기 클릭 하십시오 (다운로드 오른쪽 클릭.)

비디오 2: 토마토 식물 분열 조직 그림2에서의 3D 회전. 이 비디오를 보려면 여기 클릭 하십시오 (다운로드 오른쪽 클릭.)
토론
여기, 우리가 설명 사소한 수정, 다른 식물에서 촬영 정점 meristems의 연구에 적용할 수 있는 간단한 이미징 방법 모델 식물에서 식물 및 생식 단계에서 분열 조직 규칙을 공부 하는 새로운 길을 열기와 작물입니다. 현미경 및 조직학 얼룩 방법을 달리이 프로토콜 표면 보기와 노동 집약적인 샘플 고정 및/또는 단계를 구분 하는 조직에 대 한 필요 없이 SAMs의 내부 세포 구조를 공개 도울 수 있다. 이 프로토콜은 또한 잠재적으로 제공 하는 주요 유전자와 SAM16에서에서 단백질의 표정 패턴의 3 차원 보기를 얻을 수 있는 좋은 셀룰러 해상도 SAMs에 기반으로 하는 형광 기자에 대 한 설립된 이미징 방법에 호환 ,17,,1819. 또한, 여기에 설명 된 절차를 처리 하는 관련된 이미지 크게 도움이 연구원은 분석 하 고 3D, 진행 진화 개발 생물학 연구 및 농업 연구의 다른 종에서 SAMs를 비교할 수. 있습니다
이 간단한 프로토콜에서 몇 가지 중요 한 단계가 있습니다. 첫 번째, 샘플 준비와 해 부입니다. 식물 샘은 보통 primordia 및 촬영 끝에 젊은 장기를 개발 하 여 숨겨지고 confocal 현미경 직접 이미지 수 없습니다. 무성 한 샘을 이미지를 모든 잎 세 잎 primordia 괜 찮 보석 집게를 사용 하 여 SAM 위로 커버를 제거 하는 데 필요한입니다. 화 서 샘, 이미지를 신중 하 게 또한 괜 찮 보석 집게를 사용 하 여 SAM 노출 모든 젊은 꽃을 제거 하는 데 필요한입니다.
둘째, 라이브 셀 PI 솔루션을 사용 하 여 얼룩. 이 프로토콜을 사용 하 여 갓된 PI 솔루션 (1 mg/mL), 효율적인, 쉽고 빠르게 수행 하는 라이브 SAMs를 직접 시각화 하 세포 벽 얼룩. PI 솔루션 몇 주 동안 4 ° C에서 저장 될 수 있다, 비록 갓된 솔루션은 일반적으로 촬영 정점 meristems에 대 한 결과 얼룩이 지는 최고를 제공 합니다. 비록 PI 주로 살아있는 세포의 막을 교차 하지 않습니다 그리고 그것은 분명 셀룰러 윤곽선으로 그대로 셀 얼룩, 그것 쉽게 손상/죽은 세포를 관통 하 고 강하게 핵 및 다른 내부 막 시스템 그 손상 된 영역에 얼룩 잠재적으로 영향을 미치는 공초점 이미지의 품질. 따라서, 그것을 SAM는 얼룩에 대 한 샘플을 준비 하는 동안 물리적 손해를 피하기 위해 라이브 이미징 필수적인 것입니다. 다른 한편으로, 높은 농도에 PI 세포, 식물 독성 효과 보여줍니다 그리고 양측 검정 얼룩 생활 샘 셀9PI에 대 한 대용으로 FM4-64를 사용 하는 따라서. 그러나, FM4-64 라벨 수 있습니다 잠재적으로 채택 될 세포로 endocytosis를 통해 인테리어, 원형질 막 세포 고해상도 샘플 얼룩 도전 하기가.
셋째, 수집을 이미지입니다. 1). 높은 수 가늠 구멍 (NA), 물 찍기 렌즈는 SAMs의 라이브 이미징에 대 한 중요 하다. 물이 공기 보다 더 높은 인덱스의 굴절 그리고 객 관 렌즈의 높은 나 신호 광자 SAMs의 깊은 세포 층을 통해 흩어져를 수집 도움이 됩니다. 2). 레이저 힘 (와트 또는 표면 당)의 설정을 다른 confocal 현미경 사이 매우 다양 수 있습니다. 높은 레이저 전원 더 나은 신호 수집 하지만 더 photodamage에 리드 수 / 샘플에서 photobleaching. 해상도, 표백 및 시간 이미징 간에 있다. 일반적으로, 더 나은 XY 해상도로 연결 더 큰 프레임 크기를 선택 하지만 시간, 이미징 및 작은 검사 간격을 선택 하는 더 많은 것 더 나은 Z 해상도 더 많은 영상 시간을 리드. 더 이상 이미징 시간 잠재적으로 더 많은 photodamage 발생 / photobleaching
이 방법으로, 때로는 그것은 않을 수 있습니다 깊은 조직 레이어, 가능성이 confocal 탐지 및 내부 조직에 비효율적인 PI 얼룩의 한계 때문에 세포질 세부 관찰 하기 쉬운. 우리의 경험을 바탕으로, PI 솔루션 얼룩에의 농도 증가 수 있습니다 더 나은 얼룩을 얻을. 또는, 얼룩 절차를 수정 할 수 있다. 예를 들어 수정된 의사-Schiff propidium 요오드 화물 (mPS-PI) 메서드가 고정된 조직20잘 작동합니다. 그리고 그것은 여전히 더 나은 미래에 살아있는 조직에 대 한 얼룩과 대체 염료를 찾을 필요가. 또한, 그것은 또한 흥미로운 사실은 일부 종의 식물 특별 한 세포 내용 또는 다른 세포 벽을 고려 여기 설명 하는 방법을 적용할 수 있는 일반적으로 Sam의 연구에 모든 다른 꽃 식물에서 여부를 테스트 하 작곡입니다.
공개
저자는 공개 없다.
감사의 말
레이저 confocal 현미경 검사에 액세스 하기 위한 그리고 기술 지원에 대 한 저자 퍼듀 Bindley 생명과학 센터 이미징 시설을 인정 하 고 저자 앤디 Schaber 퍼듀 Bindley 이미징 시설에서에서 도움을 주셔서 감사 합니다. 이 활동은 Purdue 대학 인디애나의 농업 및 농촌 개발을 지원 하기 위해 자금 AgSEED 교차로의 한 부분으로에 의해 투자 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Agar Phyto | Dot Scientific Inc. | DSA20300-1000 | |
| Agarose | Dot Scientific Inc. | AGLE-500 | |
| Forceps | ROBOZ | RS-4955 | Dumont #5SF Super Fine Forceps Inox Tip Size .025 X .005mm, for dissecting shoot apices. |
| LSM 880 Upright Confocal Microscope | Zeiss | ||
| Murashige & Skoog MS medium | Dot Scientific Inc. | DSM10200-50 | |
| Plan APO 20x/1.1 water dipping lens | Zeiss | ||
| Plastic petri dishes 100 mm X 15 mm | CELLTREAT Scientific Products | 229694 | Use as making MS plates |
| Plastic petri dishes60 mm X 15 | CELLTREAT Scientific Products | 229665 | Use as imaging dishes |
| Propagation Mix | Sungro Horticulture | ||
| Propidium iodide | Acros Organics | 440300250 | 1 mg/mL solution in water, to stain the cell walls |
| Razor blade | PERSONNA | 62-0179 | For cutting shoot apex from plants |
| Stereomicroscope | Nikon | SMZ1000 | |
| Tissue | VWR | 82003-820 | |
| Zen black | Zeiss | Image acquisition software |
참고문헌
- Meyerowitz, E. M. Genetic control of cell division patterns in developing plants. Cell. 88 (3), 299-308 (1997).
- Xu, C., et al. A cascade of arabinosyltransferases controls shoot meristem size in tomato. Nature Genetics. 47 (7), 784-792 (2015).
- Bommert, P., Nagasawa, N. S., Jackson, D. Quantitative variation in maize kernel row number is controlled by the FASCIATED EAR2 locus. Nature Genetics. 45 (3), 334-337 (2013).
- Je, B. I., et al. Signaling from maize organ primordia via FASCIATED EAR3 regulates stem cell proliferation and yield traits. Nature Genetics. 48 (7), 785-791 (2016).
- Ping, J., et al. Dt2 is a gain-of-function MADS-domain factor gene that specifies semideterminacy in soybean. Plant Cell. 26 (7), 2831-2842 (2014).
- Vaughan, J. G., Jones, F. R. Structure of the angiosperm inflorescence apex. Nature. 171, 751 (1953).
- Sijacic, P., Liu, Z. Novel insights from live-imaging in shoot meristem development. Journal of Integrative Plant Biology. 52 (4), 393-399 (2010).
- Tax, F. E., Durbak, A. Meristems in the movies: live imaging as a tool for decoding intercellular signaling in shoot apical meristems. Plant Cell. 18 (6), 1331 (2006).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. Plant Cell. 16 (1), 74-87 (2004).
- Heisler, M. G., Ohno, C. Live-imaging of the Arabidopsis inflorescence meristem. Methods in Molecular Biology. 1110, 431-440 (2014).
- Tobin, C. J., Meyerowitz, E. M. Real-time lineage analysis to study cell division orientation in the Arabidopsis shoot meristem. Methods in Molecular Biology. 1370, 147-167 (2016).
- Prunet, N. Live confocal Imaging of developing Arabidopsis flowers. Journal of Visualized Experiments. (122), e55156 (2017).
- Prunet, N., et al. Live confocal imaging of Arabidopsis flower buds. Developmental Biology. 419, 114-120 (2016).
- Reddy, G. V., Heisler, M. G., Ehrhardt, D. W., Meyerowitz, E. M. Real-time lineage analysis reveals oriented cell divisions associated with morphogenesis at the shoot apex of Arabidopsis thaliana. Development. 131, 4225-4237 (2004).
- Nimchuk, Z. L., Perdue, T. D. Live Imaging of Shoot Meristems on an Inverted Confocal Microscope Using an Objective Lens Inverter Attachment. Frontiers in Plant Science. 8, 773 (2017).
- Zhou, Y., et al. HAIRY MERISTEM with WUSCHEL confines CLAVATA3 expression to the outer apical meristem layers. Science. 361 (6401), 502-506 (2018).
- Zhou, Y., et al. Control of plant stem cell function by conserved interacting transcriptional regulators. Nature. 517 (7534), 377-380 (2015).
- Nimchuk, Z. L., Zhou, Y., Tarr, P. T., Peterson, B. A., Meyerowitz, E. M. Plant stem cell maintenance by transcriptional cross-regulation of related receptor kinases. Development. 142 (6), 1043 (2015).
- Li, W., et al. LEAFY Controls Auxin Response Pathways in Floral Primordium Formation. Science Signaling. 6 (270), ra23 (2013).
- Truernit, E., et al. High-resolution whole-mount imaging of three-dimensional tissue organization and gene expression enables the study of phloem development and structure in Arabidopsis. Plant Cell. 20 (6), 1494-1503 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유