Method Article
Proyección de imagen confocal vivo de meristemos apicales de brotes de diferentes especies de plantas
En este artículo
Resumen
Este protocolo presenta cómo viven la imagen y analizar los meristemos apicales de brotes de diferentes especies de plantas mediante microscopía confocal de barrido láser.
Resumen
Las funciones de meristemo apical (SAM) de disparar como un reservorio de células madre conservadas y genera casi todos los tejidos sobre el suelo durante el Desarrollo postembrionario. La actividad y la morfología de SAMs determinan características agronómicas importantes, tales como arquitectura de disparar, el tamaño y número de órganos reproductivos y lo más importante, rendimiento de grano. Presentamos un protocolo detallado para el análisis de la morfología superficial y la estructura celular interna de la vida del SAMs de diferentes especies a través del microscopio confocal de barrido láser. Todo el procedimiento de la preparación de la muestra a la adquisición de imágenes (3D) tridimensionales de alta resolución puede lograrse dentro de tan corto como 20 minutos. Demostramos que este protocolo es muy eficiente para estudiar no sólo la inflorescencia SAMs de la especie modelo, sino los meristemos vegetativos de diferentes cultivos, proporcionando una herramienta simple pero poderosa para estudiar la organización y desarrollo de meristemos en diferentes especies de plantas.
Introducción
El meristemo de la planta contiene una reserva de células madre no diferenciadas y sostiene continuamente la planta órgano crecimiento y desarrollo1. Durante el Desarrollo postembrionario, casi todos los tejidos sobre el suelo de una planta se derivan desde el meristemo apical de brote (SAM). En los cultivos, la actividad y el tamaño del SAM y sus derivados meristemos florales están estrechamente asociadas con muchas características agronómicas tales como disparar arquitectura, producción de frutos y rendimiento de semilla. Por ejemplo, en tomate, un SAM ampliado causa un aumento en el brote y la ramificación de la inflorescencia y así resultados en la generación extra flor y fruta órganos2. En maíz, un aumento de tamaño de SAM lleva a un mayor número de semillas y rendimiento total3,4. En soja, la indeterminación del meristemo también está estrechamente relacionada con la arquitectura de disparar y rendimiento5.
La morfología y anatomía de Sam se caracteriza por varios métodos, incluyendo el seccionamiento, tinción histológica y exploración de la microscopia electrónica (SEM)6, los cuales han avanzado grandemente la investigación meristemo proporcionando la seccional vista o una tridimensional (3D) superficie de Sam. Sin embargo, ambos métodos son lentos, que implica varias medidas experimentales de la preparación de la muestra para la adquisición de datos, y estos métodos dependen principalmente de muestras fijadas. Avances recientes en la técnica de microscopía confocal de escaneo láser han superado estas limitaciones y nos proporcionan una herramienta poderosa para investigar la estructura celular y el proceso de desarrollo de la planta tejidos y órganos7,8. A través de óptica en lugar de tejido físico microscopia confocal, seccionamiento permite la colección de una serie de imágenes z-stack y la posterior reconstrucción 3D de la muestra a través de software de análisis de imagen.
Aquí, describimos un procedimiento eficiente para investigar tanto dentro de estructuras superficiales de la vida del SAMs de diferentes especies y vegetales mediante láser, microscopía confocal, que potencialmente permite a los investigadores para llevar a cabo la experimental proceso dentro de tan corto como 20 minutos. Diferente de otros métodos publicados para la proyección de imagen confocal vivo de Arabidopsis inflorescencia SAMs9,10,11,12,13,14, 15 y Arabidopsis flores12,13, aquí demostramos que este protocolo es muy eficiente para estudiar no sólo los meristemas de inflorescencia de la especie modelo, sino el brote vegetativo meristemos apicales de diferentes cultivos, como tomate y soja. Este método no se basa en marcadores fluorescentes transgénicos y potencialmente se puede aplicar para estudiar los meristems del lanzamiento de muchas especies y cultivares. Además, presentamos los pasos para ver y analizar las diferentes SAMs en una vista 3D de procesamiento de imágenes simple. Tomados en conjunto, este sencillo método facilitará a los investigadores comprender mejor la estructura y el proceso de desarrollo de los meristemos de organismos modelo y cultivos.
Protocolo
1. medios de comunicación y proyección de imagen de la preparación de platos
- Placas de MS: Añadir 0,5 x Murashige y Skoog MS medio, agar al 1% en agua desionizada y luego ajustar el pH a 5,8 con solución de hidróxido de potasio (opcional: agregar sacarosa al 1% para el crecimiento de la planta a largo plazo). Autoclave y vierta las placas.
- Platos de imagen: llenar de plástico platos de Petri (6 cm de ancho, 1,5 cm de profundidad) a 0.5-0.8 cm con 1.5% de agarosa fundida.
2. crecimiento de la planta
-
Crecimiento de Arabidopsis
- Sembrar semillas esterilizadas en las placas de EM y coloque las placas debajo de 4 ° C durante dos días. Entonces, mover placas MS a un día corto (8 h luz / oscuro 16 h), a 22 ° C durante dos semanas.
- Trasplante de las plántulas al suelo y crecer en un día corto (8 h luz / oscuro 16 h) a 22 ° C durante cuatro semanas.
- Transferencia de plantas a la luz continua, a 22 ° C para inducir la transición de la vegetativa a la etapa reproductiva y para la proyección de imagen la inflorescencia SAMs.
- Crecimiento de tomate y soja
- Incubar las semillas cubiertas con papel de filtro húmedo debajo de 28 ° C hasta que germinan.
- Trasplante de las plántulas al suelo y crecer en un día (16 h luz / 8 h oscuro) a 25 ° C durante una semana o más para el SAMs vegetativo la proyección de imagen.
3. la disección del ápice shoot
- Disección del ápice del brote de inflorescencia
- Cortar el ápice de disparar inflorescencia con tallo principal 1-2 cm de las plantas de Arabidopsis atornilladas con una cuchilla de afeitar. Mantenga la parte basal del tallo principal y saque tantos órganos de flor mayores posible del tallo principal por disección a los pedúnculos con pinzas para joyería.
PRECAUCIÓN: Evite los dedos de corte cuando se utiliza una cuchilla de afeitar. Deseche las cuchillas de afeitar usadas a un contenedor adecuado. - Sostenga el tallo adjunto del ápice disparar con joyería pinzas o los dedos en el campo del estereomicroscopio, continuar quitando el resto de las flores hasta que casi puede verse el conjunto SAM de los oculares. Retire los pedúnculos claramente en la Unión del tallo principal.
- Cortar el ápice de disparar inflorescencia con tallo principal 1-2 cm de las plantas de Arabidopsis atornilladas con una cuchilla de afeitar. Mantenga la parte basal del tallo principal y saque tantos órganos de flor mayores posible del tallo principal por disección a los pedúnculos con pinzas para joyería.
- Disección del ápice vegetativo shoot
- Para ver el SAMs vegetativo del tomate o la soja, disecar a los cotiledones, hojas y raíces de las plantas.
- Mantenga los hypocotyls de las plantas bajo el estereomicroscopio y más minuciosamente a los primordios foliares que cubren a los SAMs vegetativas con unas pinzas de joyería.
4. coloración
- Para visualizar directamente las células en SAMs, utilizar solución de yoduro (PI) de propidio recién preparados para teñir las paredes celulares. Disolver el polvo de la PI en agua estéril, desionizada, hacer PI de 1mL de solución de tinción en la concentración de 1 mg/mL y almacenar la solución de PI en tubo de microcentrífuga cubierto con papel de aluminio.
- Pipetee 50 μl PI solución de limpieza y plato de Petri vacío y dip todo disecado dispara apex en tinte para 2 minutos enjuagar el ápice manchado disparar dos veces en agua estéril, desionizada. Durante el proceso de tinción, sumerja la inflorescencia entera SAM o SAM vegetativa en la solución de PI para lograr la tinción uniforme.
5. colección de imágenes
Nota: para este método, todos los SAM son imágenes con un microscopio confocal vertical y con un 20 x lente de inmersión en agua. Como se describe en otros protocolos9,12,13,15, también es factible imagen SAMs usando un microscopio invertido. Además, la proyección de imagen de vivo se logra utilizando diferentes marcas de microscopios confocales, con los mismos pasos de preparación de muestra. En este estudio, los proyección de imagen pasos se describen con detalle como un ejemplo.
- Perforar un agujero en el centro de un plato de imagen con unas pinzas y palillo el ápice manchado disparar vertical en el medio.
- Llenar el plato de imagen con agua desionizada estéril para sumergir totalmente la muestra. Vista desde el microscopio estéreo, pipeta hacia arriba y hacia abajo para eliminar las burbujas de aire atrapado alrededor del meristemo. Luego, ajuste el ángulo del tronco en el agar para asegurarse de que el SAM es completamente visible desde directamente encima.
- Coloque el plato de imagen en el escenario de la muestra del microscopio confocal. Baje el lente de inmersión de agua y elevar la platina del microscopio muestra para que la punta del lente de inmersión en el agua.
- Abra el software del microscopio confocal y localice el SAM en la trasmitida en los oculares. Mover la SAM muestra la derecha debajo de la lente del objetivo mediante el ajuste del controlador XY, y luego centrarse en el SAM de oculares mediante el ajuste con cuidado el control Z.
- Utilice la función de adquisición en el software del microscopio confocal (véase Tabla de materiales), inicio el modo en vivo para ver la muestra de la pantalla del ordenador y configurar todos los parámetros para el experimento de escaneo láser.
- Al ajustar los parámetros, utilice la función de Indicador de rango para definir si la señal está saturada o no.
- Opcionalmente, aplicar la función reutilizar para volver a cargar todos los ajustes de parámetro desde el archivo seleccionado de confocal.
Nota: Sugieren parámetros de imagen: láser de línea (excitación): 515 nm o 561 nm; Emisión 570-650 nm; agujero de alfiler: 1 unidad de airy (AU); Ganancia: 600-750, modo de escaneo: marco; Tamaños: 512 X 512 o 1024 X 1024; velocidad de escaneado: del 7 al máximo; Análisis dirección: BI-dirección; Número promedio: 2-4; Promedio método: significa; Profundidad de bits: 16 bits; Intervalo de escaneo: 0.5-1 μm. Optimizar aún más, todos estos parámetros según la naturaleza de las muestras de plantas y las necesidades específicas de la imagen.
6. tratamiento de la imagen
- Para la visualización de vistas de corte ortogonal y transversal óptico, utilice el mismo software comercial para la adquisición de imágenes. Abra el archivo confocal original, haga clic en menú ortho, seleccione ortho. Continuación, seleccione cualquiera de las posiciones x, z y la posición y la posición de la imagen y guardar las imágenes como los archivos tiff.
- Seleccione opcionalmente función de distancia 3D para definir la distancia física entre dos puntos que han sido seleccionados de la pila de imágenes confocales.
- Como alternativa, utilizar imagen de Fiji J, el paquete de procesamiento de imagen de recurso abierto para visualizar las vistas de sección transversal y ortogonal.
- Abra el archivo original de confocal con Fiji, haz clic en el menú de la imagen, seleccionar las pilas y seleccione vistas ortogonales.
- Seleccione XY, YZy XZ planos en la posición media y guardar como imágenes en formato Tiff.
- Para la visualización de una proyección 3D transparente, utilizar el mismo software.
- Abra el archivo confocal original, haz clic en el menú 3Dy seleccione transparente para generar una vista de la proyección en 3D.
- Opcionalmente, haga clic en menú 3D, seleccione aparienciay seleccione transparencia para ajustar tres parámetros de la proyección como umbral, rampa máxima para la transparencia de las 3D imagen.
- Haz clic en el menú 3D, seleccione la apariencia y luz para ajustar el brillo de la imagen 3D.
- Exportar las imágenes proyectadas y guardarlas como archivos Tiff de la.
- Para la visualización de una proyección de intensidad máxima 3D, abra los archivos confocales con el mismo software y haga clic en el menú 3D.
- Seleccione menú 3D y máximo.
- Alternativamente, utilizar J Fiji/imagen para visualizar una proyección 3D de máxima intensidad.
- Abra el archivo original de confocal con Fiji, haz clic en el menú de la imagen y seleccionar las pilas.
- Seleccione proyecto 3D y guardar como imágenes en formato Tiff.
- Para la visualización de la profundidad de codificación ver de las imágenes 3D, utilice el mismo software.
- Haz clic en el menú 3D y seleccione aspecto.
- Seleccione especial y Profundidad de codificación.
- Alternativamente, utilizar J Fiji/imagen para visualizar la profundidad de codificación ver.
- Abra los archivos confocales, haz clic en el menú de la imagen, seleccione Hyperstack.
- Seleccione el código del Color Temporal y guardar como imágenes en formato Tiff.
Nota: La codificación de la profundidad z-pila también puede lograrse mediante el plugin Z código pila para Fiji.
- Para visualizar el 3D vista de rotación como se muestra (cine 1 y cine 2), utilizar el mismo software (véase la Tabla de materiales).
- Abra los archivos confocales, haz clic en el menú 3Dy seleccione la serie.
- Seleccione hacer seriesy seleccione una de las cuatro opciones incluyendo vuelta x vuelta y, inicial y finaly lista de posición.
- Guardar el render de la serie como los archivos AVI.
- Alternativamente, utilizar J Fiji/imagen para visualizar la vista de la rotación 3D.
- Abra el archivo original de confocal con Fiji, haz clic en el menú imageny seleccione pilas.
- Seleccione proyecto 3D y guardar como vídeos de formato AVI.
Resultados
Para evaluar la eficiencia de nuestro protocolo y explorar la morfología de los meristemos de diferentes especies, hemos realizado los experimentos de imagen vivo confocales en el meristemo de la inflorescencia de Arabidopsis y los meristemos vegetativos de tomate y la soja. En este estudio, ecotipo Landsberg erectade Arabidopsis , cultivar tomate Tom Micro y cultivar soja 82 Williams han utilizado como ejemplos.
Visto desde la sección ortogonal por en medio de la Arabidopsis SAM, es claro que PI era capaz de manchar las paredes horizontales desde casi todas las células en las múltiples capas de células (figura 1A). De una sección transversal a través de la recopilación de la inflorescencia SAM, las células del plano XY se muestran también claramente reflejada (figura 1B). En la vista de la proyección en 3D, el meristemo de la inflorescencia forma una cúpula como la estructura y está rodeado por los primordios de flores en desarrollo, donde las células se tiñen también y reflejada (Figura 1 C-D) (película 1).
Visto desde la sección ortogonal por en medio del tomate SAM, es claro que PI era capaz de manchar las paredes horizontales desde las células de las capas múltiples de la célula, aunque el PI de la señal de la región del profundo interior es ligeramente inferior. De una sección transversal a través de las capas profundas del SAM vegetativo, las células de los planos XY son también claramente reflejadas, y el límite entre el meristemo vegetativo y primordios foliares también es reflejada (figura 2B). La vista 3D proyecto más puede proporcionar una visión integral de la forma y organización del meristemo vegetativo del tomate (Figura 2 C-D) (película 2).
En la vista ortogonal por en medio de la soja SAM, podemos ver el meristemo vegetativo de cúpula y sus primordios foliares nuevo derivados (Figura 3A). En la vista de la proyección en 3D, tanto el meristemo vegetativo de la soja y el meristemo vegetativo del tomate forman la bóveda como estructura, sin embargo, la forma del meristemo vegetativo de la soja es diferente el meristemo de tomate, y la organización y los patrones de los primordios foliares que rodean a estos dos SAMs son distintas (Figura 3B-C).

Figura 1: En vivo la proyección de imagen y análisis de la inflorescencia SAM de Arabidopsis. A y B. Optical orthogonal (Orth) y transversal (Trans) sección vistas del plano medio del mismo SAM, PI (yoduro de propidio) manchan (morados). C. una proyección en 3D del mismo SAM, mancha de PI (gris). D. profundidad policromática de la proyección 3D, con azul que indica la capa superficie superior y rojo representando la capa más profunda. Paredes celulares fueron teñidas con PI. Barras de escala: 20 μm (A, B); 50 μm (C, D). Haga clic aquí para ver una versión más grande de esta figura.
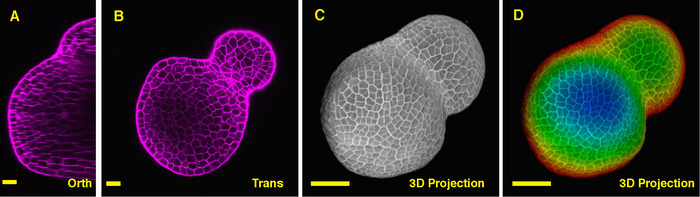
Figura 2: En vivo la proyección de imagen y análisis del SAM vegetativa del tomate. A y B. Optical orthogonal (Orth) y transversal (Trans) sección de vistas del plano medio del mismo SAM. C. una proyección en 3D del mismo SAM. D. profundidad policromática de la proyección 3D, con azul que indica la capa superficie superior y rojo representando la capa más profunda. Paredes celulares fueron teñidas con PI. Barras de escala: 20 μm (A, B); 50 μm (C, D). Haga clic aquí para ver una versión más grande de esta figura.
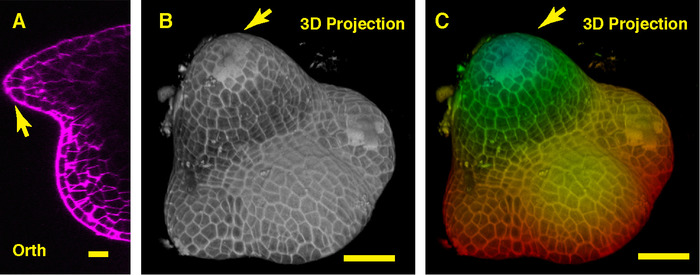
Figura 3: En vivo la proyección de imagen y análisis del SAM vegetativa de la soja. A. una óptica vista de sección (Orth) ortogonal del plano medio del SAM vegetativa. B. una proyección en 3D del mismo SAM. C. profundidad policromática de la proyección 3D, con azul que indica la capa superficie superior y rojo representando la capa más profunda. Paredes celulares fueron teñidas con PI. Barras de escala: 20 μm (A); 50 μm (B, C). Flecha: primordio de la hoja. Haga clic aquí para ver una versión más grande de esta figura.

Video 1: rotación 3D del meristemo de la inflorescencia de Arabidopsis en la figura 1. Por favor haga clic aquí para ver este video. (Clic derecho para descargar)

Video 2: rotación 3D del meristemo vegetativo del tomate en la figura 2. Por favor haga clic aquí para ver este video. (Clic derecho para descargar)
Discusión
Aquí, describimos un método simple de imágenes que se puede aplicar al estudio de los meristemos apicales de brotes de diversas plantas con modificaciones menores, abriendo una nueva vía para estudiar la regulación del meristemo en etapas vegetativas y reproductivas en plantas modelo y de los cultivos. En contraste con el SEM y los métodos de tinción histológicos, este protocolo puede ayudar a revelar más superficie y estructuras celulares internas de SAMs, sin necesidad de fijación de la muestra de mano de obra intensiva o tejidos o seccionamiento pasos. Este protocolo también es compatible con el método de proyección de imagen establecido para los reporteros de fluorescencia basada en el SAMs, proporcionando potencialmente una buena resolución de celular que nos permite obtener una visión 3D de los patrones de expresión de genes claves y proteínas en el SAM16 ,17,18,19. Además, la imagen asociada procesa procedimiento aquí descrito podrá ayudar enormemente a los investigadores analizar y comparar al SAMs de especies diferentes en 3D, avance de estudios de biología evolutiva del desarrollo y la investigación agrícola.
Hay algunos pasos críticos en este Protocolo simple. Primero, disección y preparación de la muestra. Una planta SAM se oculta generalmente mediante el desarrollo de primordios y órganos jóvenes en la punta del brote, y no puede ser reflejada directamente bajo un microscopio confocal. Para el SAM vegetativo de la imagen, es necesario eliminar todas las hojas y más primordios foliares que cubren en la parte superior del SAM con unas pinzas de joyería fina. Para la inflorescencia SAM de la imagen, es necesario retirar con cuidado todas las flores jóvenes para exponer el SAM, también con unas pinzas de joyería fina.
En segundo lugar, la tinción de células vivas usando la solución de PI. En este protocolo, utilizamos solución recién preparada de PI (1 mg/mL) para teñir las paredes celulares para visualizar directamente energizadas SAMs, que es rápido, eficiente y fácil de realizar. Aunque la solución de PI puede almacenarse a 4 ° C durante varias semanas, una solución recién preparada generalmente da los mejores resultados de los meristemos apicales de brotes de tinción. Aunque PI principalmente no cruza la membrana de las células vivas y tiñe las células intactas con el contorno celular claro, puede penetrar fácilmente las células muertas o dañadas y mancha fuertemente los núcleos y otros sistemas de membrana internos en las áreas dañadas, podrían afectar la calidad de las imágenes confocales. Por lo tanto, será esencial para evitar daños físicos mientras se prepara el SAM muestras para tinción y la proyección de imagen en vivo. Por otro lado, PI en una alta concentración muestra un efecto tóxico para las células de la planta, y así, FM4-64 se puede utilizar como sustituto de PI para teñir la vida de las células de SAM9. Sin embargo, FM4-64 etiquetas membrana del plasma, que puede potencialmente ser captada por las células interior a través de endocitosis, haciéndolo difícil de teñir las muestras con alta resolución de celular.
Tercero, adquisición de imágenes. 1). aberturas numéricas alta (NA), el lente de inmersión de agua es fundamental para la proyección de imagen viva de los SAM. El agua tiene un alto índice de refracción que el aire y el NA alto del objetivo ayuda a recoger los fotones de la señal por capas celulares profundas de Sam. 2). la configuración de energía del laser (watts o vatios por superficie) puede ser altamente variable entre diferentes microscopios confocales. Mayor potencia del láser puede permitir mejor colección señal pero conduce a más fotodaño / fotoblanqueo en las muestras. Hay ventajas y desventajas entre resolución, blanqueo y el tiempo de la proyección de imagen. En general, seleccionar un tamaño de fotograma mayor conduce a la mejor resolución XY pero más tiempo la proyección de imagen y seleccionando un intervalo más pequeño análisis conduce a una mejor resolución de Z, pero también más tiempo de la proyección de imagen. Tiempo ya de causas potencialmente más fotodaño / fotoblanqueo
Con este método, a veces puede no ser fácil de observar detalles celulares en capas más profundas de tejido, probablemente debido a la limitación de la detección confocal y la tinción ineficiente de PI en los tejidos internos. Basado en nuestras experiencias, aumentando la concentración de la solución de PI o el tiempo de tinción puede ayudar a conseguir un mejor tinte. Alternativamente, se pueden hacer las modificaciones en el procedimiento de tinción. Por ejemplo, el método de pseudo-Schiff modificado propidio yoduro (mPS-PI) funciona bien para los tejidos fijos20. Y es necesario encontrar tintes alternativos con la mejor coloración de los tejidos vivos en el futuro. Además, también es interesante probar si el método descrito aquí puede aplicarse generalmente al estudio de SAMs de todas las otras plantas de floración, teniendo en cuenta el hecho de que algunas especies de plantas tienen especial contenido celular o pared celular diferente composiciones.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen Purdue Bindley Bioscience Center imagen facilidad para acceder al microscopio confocal de escaneo láser y para el apoyo técnico, y los autores aprecian la ayuda de Andy Schaber en las instalaciones de la proyección de imagen de Bindley de Purdue. Esta actividad fue financiada por la Universidad de Purdue como parte del cruce de AgSEED fondos para apoyar la agricultura y Desarrollo Rural de Indiana.
Materiales
| Name | Company | Catalog Number | Comments |
| Agar Phyto | Dot Scientific Inc. | DSA20300-1000 | |
| Agarose | Dot Scientific Inc. | AGLE-500 | |
| Forceps | ROBOZ | RS-4955 | Dumont #5SF Super Fine Forceps Inox Tip Size .025 X .005mm, for dissecting shoot apices. |
| LSM 880 Upright Confocal Microscope | Zeiss | ||
| Murashige & Skoog MS medium | Dot Scientific Inc. | DSM10200-50 | |
| Plan APO 20x/1.1 water dipping lens | Zeiss | ||
| Plastic petri dishes 100 mm X 15 mm | CELLTREAT Scientific Products | 229694 | Use as making MS plates |
| Plastic petri dishes60 mm X 15 | CELLTREAT Scientific Products | 229665 | Use as imaging dishes |
| Propagation Mix | Sungro Horticulture | ||
| Propidium iodide | Acros Organics | 440300250 | 1 mg/mL solution in water, to stain the cell walls |
| Razor blade | PERSONNA | 62-0179 | For cutting shoot apex from plants |
| Stereomicroscope | Nikon | SMZ1000 | |
| Tissue | VWR | 82003-820 | |
| Zen black | Zeiss | Image acquisition software |
Referencias
- Meyerowitz, E. M. Genetic control of cell division patterns in developing plants. Cell. 88 (3), 299-308 (1997).
- Xu, C., et al. A cascade of arabinosyltransferases controls shoot meristem size in tomato. Nature Genetics. 47 (7), 784-792 (2015).
- Bommert, P., Nagasawa, N. S., Jackson, D. Quantitative variation in maize kernel row number is controlled by the FASCIATED EAR2 locus. Nature Genetics. 45 (3), 334-337 (2013).
- Je, B. I., et al. Signaling from maize organ primordia via FASCIATED EAR3 regulates stem cell proliferation and yield traits. Nature Genetics. 48 (7), 785-791 (2016).
- Ping, J., et al. Dt2 is a gain-of-function MADS-domain factor gene that specifies semideterminacy in soybean. Plant Cell. 26 (7), 2831-2842 (2014).
- Vaughan, J. G., Jones, F. R. Structure of the angiosperm inflorescence apex. Nature. 171, 751 (1953).
- Sijacic, P., Liu, Z. Novel insights from live-imaging in shoot meristem development. Journal of Integrative Plant Biology. 52 (4), 393-399 (2010).
- Tax, F. E., Durbak, A. Meristems in the movies: live imaging as a tool for decoding intercellular signaling in shoot apical meristems. Plant Cell. 18 (6), 1331 (2006).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. Plant Cell. 16 (1), 74-87 (2004).
- Heisler, M. G., Ohno, C. Live-imaging of the Arabidopsis inflorescence meristem. Methods in Molecular Biology. 1110, 431-440 (2014).
- Tobin, C. J., Meyerowitz, E. M. Real-time lineage analysis to study cell division orientation in the Arabidopsis shoot meristem. Methods in Molecular Biology. 1370, 147-167 (2016).
- Prunet, N. Live confocal Imaging of developing Arabidopsis flowers. Journal of Visualized Experiments. (122), e55156 (2017).
- Prunet, N., et al. Live confocal imaging of Arabidopsis flower buds. Developmental Biology. 419, 114-120 (2016).
- Reddy, G. V., Heisler, M. G., Ehrhardt, D. W., Meyerowitz, E. M. Real-time lineage analysis reveals oriented cell divisions associated with morphogenesis at the shoot apex of Arabidopsis thaliana. Development. 131, 4225-4237 (2004).
- Nimchuk, Z. L., Perdue, T. D. Live Imaging of Shoot Meristems on an Inverted Confocal Microscope Using an Objective Lens Inverter Attachment. Frontiers in Plant Science. 8, 773 (2017).
- Zhou, Y., et al. HAIRY MERISTEM with WUSCHEL confines CLAVATA3 expression to the outer apical meristem layers. Science. 361 (6401), 502-506 (2018).
- Zhou, Y., et al. Control of plant stem cell function by conserved interacting transcriptional regulators. Nature. 517 (7534), 377-380 (2015).
- Nimchuk, Z. L., Zhou, Y., Tarr, P. T., Peterson, B. A., Meyerowitz, E. M. Plant stem cell maintenance by transcriptional cross-regulation of related receptor kinases. Development. 142 (6), 1043 (2015).
- Li, W., et al. LEAFY Controls Auxin Response Pathways in Floral Primordium Formation. Science Signaling. 6 (270), ra23 (2013).
- Truernit, E., et al. High-resolution whole-mount imaging of three-dimensional tissue organization and gene expression enables the study of phloem development and structure in Arabidopsis. Plant Cell. 20 (6), 1494-1503 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados