Method Article
別の植物種から茎頂の共焦点のライブ イメージング
要約
このプロトコルは、live イメージをおよび共焦点レーザー顕微鏡を使用して別の植物種から茎頂を分析する方法を示します。
要約
保存された茎細胞の貯蔵所としてシュート頂端分裂組織 (SAM) 関数は、蛹の開発中にほぼすべての地上組織を生成します。活動と Sam の形態撮影アーキテクチャ、サイズおよび生殖器官と最も重要なことは, 子実収量の数などの重要な農業形質を決定します。ここでは、レーザー共焦点顕微鏡による表面の形態との異なる種から生きている Sam の内部細胞構造を分析するための詳しいプロトコルを提供します。内で高解像度三次元 (3 D) 画像の取得にサンプル準備から全体の手順を行うことができます最短で 20 分。このプロトコルが花房 Sam モデル種も異なる作物から植物の分裂組織との開発を検討するシンプルかつ強力なツールを提供するだけではなく勉強のため高効率であることを示す別の植物種に分裂。
概要
植物の分裂組織は未分化の幹細胞のプールが含まれています、植物器官の成長と開発1を継続的に支えます。蛹の開発中に植物のほぼすべての地上組織は、シュート頂端分裂組織 (SAM) から派生します。作物は、活動と SAM とその派生の花分裂のサイズは撮影アーキテクチャ、フルーツの生産および子実収量など多くの農業形質にしっかりと関連付けられます。たとえば、トマト、拡大のサムは、撮影と花房の分岐の増加そしてこうして、余分な花とフルーツの臓器2生成結果。トウモロコシ、SAM のサイズの増加は、高い種子数と収量3,4に します。大豆、分裂組織不確定性は撮影アーキテクチャと密接に関連しています、5をもたらします。
どちらが大きく分裂組織研究を提供し、高度な組織切片染色走査電子顕微鏡 (SEM)6など、いくつかの異なる方法によって特徴付けられる形態と Sam の解剖学断面図または Sam の三次元 (3 D) サーフェイス ビュー。ただし、どちらの方法も時間がかかり、データ集録サンプル準備からいくつかの実験手順を含む、これらのメソッドは、主に固定サンプルに依存します。レーザー走査型共焦点顕微鏡法の最近の進歩は、これらの制限を克服しているし、細胞構造と植物組織や臓器の7,のための8の発達過程を調査するための強力なツールを提供してくれる。物理的な組織ではなく光学セクショニング、共焦点顕微鏡により一連の z スタック画像やサンプル画像解析ソフトウェアの後続の 3次元再構成のコレクション。
ここでは、両方の内部を調査するための効率的な手順について述べるし、異なる生活 SAMs の表面構造解析植物種の共焦点レーザー顕微鏡、可能性のあるすべての実験的達成するために研究者を可能にするを使用してプロセス内で最短で 20 分。ライブの共焦点イメージングシロイヌナズナ花房 Sam9,10、11,12,13,14のための他の公開メソッドとは異なる 15とシロイヌナズナの花12,13、ここでこのプロトコルがモデル動物だけでなく植物のシュートの花房分裂だけでなく勉強のため高効率であることを示すトマトや大豆など、さまざまな作物から頂。このメソッドは、トランスジェニック蛍光マーカーに依存しないし、可能性のある多くの異なる種や品種から撮影分裂の研究に適用できます。さらに、簡易画像処理表示および 3 D ビューで異なる Sam を分析するための手順を紹介します。一緒に取られて、この単純な方法は構造とモデル生物や作物から分裂の発達過程の理解を深める研究を促進します。
プロトコル
1. メディアとイメージングの料理準備
- MS 板: 脱イオン水に 0.5 倍培地・培 MS の中 1% 寒天を追加し、水酸化カリウム溶液を用いた 5.8 に pH を調整 (オプション: 長期的な植物成長のための 1% ショ糖を追加)。オートクレーブと注ぐプレート。
- 料理をイメージング: 0.5 0.8 にプラスチック シャーレ (幅 6 cm、深さ 1.5 cm) を埋める 1.5% 溶融 agarose の cm。
2. 植物の成長
-
シロイヌナズナ成長
- MS プレート滅菌の種をまくし、2 日間プレート 4 ° C 以下を配置します。その後、MS プレートを短い日に移動 (8 h 光/暗い 16 h)、2 週間 22 ° C で。
- 土に苗を移植し、短い日のそれらを育てる (8 h 光/暗い 16 h) 22 ° c 4 週間。
- 植物を生長から生殖生長へと花房 SAMs のイメージングのための移行を誘導するための 22 の ° c の連続光に転送します。
- トマトと大豆の成長
- 湿式ろ紙 28 ° C 以下で覆われて彼らは発芽するまで種子を孵化させなさい。
- 土に苗を移植し、長い一日のそれらを育てる (16 h 光/暗い 8 h) 生長の Sam をイメージングのため 1 週間以上 25 ° c。
3. 茎頂の郭清
- 花房茎頂の解剖
- 一緒にかみそりの刃とボルトのシロイヌナズナ植物から 1-2 cm の主茎花房茎頂をカットします。主茎の根元部分を押しながらジュエリー鉗子で花柄を解剖によって主茎からできるだけ多くの古い花器を削除します。
注意: は、かみそりの刃を使用するときに、切断指を避けます。適切なシャープのコンテナーに使用されているかみそりの刃の処分します。 - ジュエリー鉗子や個人差のフィールドで指で茎頂の添付の幹を保持、接眼レンズからほぼ全体のサムを表示できるまで花の残りの部分の削除を続行します。主茎の接合部で明らかに花柄を削除します。
- 一緒にかみそりの刃とボルトのシロイヌナズナ植物から 1-2 cm の主茎花房茎頂をカットします。主茎の根元部分を押しながらジュエリー鉗子で花柄を解剖によって主茎からできるだけ多くの古い花器を削除します。
- 植物の茎頂の解剖
- トマトや大豆から栄養の Sam を表示するのには、子葉を分析、葉し、根の植物から。
- 顕微鏡の下で植物の胚軸を押し、ジュエリー鉗子を使用して植物の Sam を覆う葉原基をさらに分析します。
4. 染色
- Sam のセルを直接視覚化するには、細胞壁を染色するのに作りたて propidium ヨウ (PI) を使用します。滅菌、脱イオン水で PI 粉溶解する、1 Mg/ml の濃度で 1 mL PI 染色液を作成し、アルミ箔で覆われている微量遠心チューブに PI ソリューションを格納します。
- ピペットのきれいな 50 μ L PI ソリューションと空のシャーレと全体の解剖のディップを撃つアペックス 2 分リンスの染料に滅菌、脱イオン水で 2 回ステンド グラスの茎頂。染色の過程では、均一な染色を実現する PI ソリューションに全体花序 SAM または栄養サムを浸します。
5. 画像コレクション
注: このメソッドは、すべての Sam が直立した共焦点の顕微鏡を使用してイメージを作成と 20 倍レンズの水浸漬します。他プロトコル9,12,13,15に記載、また倒立顕微鏡を使用して Sam をイメージすることは不可能です。さらに、ライブ イメージングは、同じサンプル準備のステップと共焦点顕微鏡等のさまざまなブランドを使用して実現できます。本研究では画像処理の手順を例として詳しく説明します。
- 鉗子を用いたイメージングの皿の中央に穴を開けるし、中でステンド グラスの茎頂を直立スティックします。
- サンプルを完全に没頭する滅菌、脱イオン水でイメージングの皿を満たし。ステレオ顕微鏡から表示、ピペット、上下原基周りに閉じ込められた空気の泡を削除します。その後、SAM が真上から完全に表示されているかどうかを確認する寒天の幹の角度を調整します。
- 共焦点顕微鏡の試料ステージ上画像の皿を配置します。水浸漬レンズを下げ、水の中にディップをレンズの先端を聞かせ顕微鏡試料ステージを上げます。
- 共焦点顕微鏡のソフトウェアを開き、接眼レンズで明視野で SAM を探します。サム サンプル右 XY コント ローラーを調整することで対物レンズの下に移動し、Z コント ローラーを慎重に調整することを通して接眼レンズからサムに焦点を当てます。
- 共焦点顕微鏡のソフトウェアの取得機能の操作 (材料の表を参照)、開始、ライブ モードコンピューターの画面からサンプルを表示し、レーザースキャニング実験のすべてのパラメーターを設定します。
- パラメーターを調整するときは、か信号が飽和状態かどうかを定義するのに範囲インジケーター機能を使用します。
- 必要に応じて、選択した共焦点ファイルからすべてのパラメーター設定をリロードする再利用関数を適用します。
注: パラメーターをイメージングを提案した: レーザー ライン (励起): 515 nm または 561 nm;排出量 570 650 nm;ピンホール: 1 風通しの良い単位 (AU);ゲイン: 600-750、スキャン モード: フレーム;フレーム サイズ: 512 × 512 または 1024 X 1024;スキャン速度: 最大; 7 時から走査方向: 双方向;平均数: 2-4;平均法: 意味;ビット深度: 16 ビットスキャンの間隔: 0.5-1 μ M。さらに、異なる植物のサンプル、特定のイメージング ニーズの性質に基づいてすべてのこれらのパラメーターを最適化します。
6. 画像処理
- 光直交と横方向の断面を可視化画像の獲得のため同じ商用ソフトウェアを使用します。元共焦点ファイルを開く、[オルソビュー] メニューをクリックして、オルソを選択します。選択いずれかの x 位置、y 位置、z、画像の位置、画像を tiff ファイルとして保存します。
- 共焦点画像のスタックから選択されている 2 つの点の間の物理的な距離を定義する3D 距離関数を必要に応じて選択します。
- また、フィジー/画像 J、直交と横方向の断面を可視化するオープン リソース イメージ処理パッケージを使用します。
- フィジーで元共焦点ファイルを開き、イメージ メニューをクリックして、スタックを選択し、直交ビューを選択します。
- 中間位置でXY、YZ、およびXZ平面を選択し、Tiff 形式の画像として保存します。
- 3 D の透明な投影を可視化、同じソフトウェアを使用します。
- 元共焦点ファイルを開き3 D メニューをクリックして透明3 D 投影ビューを生成」を選択します。
- 必要に応じて3 D のメニューをクリックして、外観を選択し、透明度3 D の透明度のしきい値やランプ、最大を含む投影法の 3 つのパラメーターを調整するを選択イメージ。
- 3 D のメニューをクリックし、外観、 3 D 画像の明るさを調整する光を選択します。
- 投影画像をエクスポートし、Tiff ファイルとして保存します。
- 3 D の最大強度投影を可視化、同じソフトウェアで共焦点ファイルを開くし、 3 D のメニューをクリックします。
- 3 D のメニューを選択し、最大を選択します。
- また、フィジー/画像 J を使用して、3 D の最大強度投影を視覚化します。
- フィジーと元の共焦点ファイルを開く、 [イメージ] メニューをクリックし、スタックを選択します。
- 3 D プロジェクトを選択し、Tiff 形式の画像として保存します。
- 3 D 映像の表示をコーディング深さを可視化、同じソフトウェアを使用します。
- 3 D のメニューをクリックし、外観を選択します。
- 特別なし深さ符号化を選択します。
- また、フィジー/画像 J を使用して、ビューをコーディング深さを視覚化します。
- 共焦点のファイルを開けて、イメージ メニューをクリックして、 Hyperstackを選択します。
- 時間色コードを選択し、Tiff 形式の画像として保存します。
注: 深さ符号化 z スタックすることができますを介して実現するプラグイン フィジーのZ コードのスタック。
- 3 D を可視化すると示されている (映画 1 映画 2)、回転ビューは、同じソフトウェアを使用 (材料の表を参照してください)。
- 共焦点ファイルを開き、 3 D メニューをクリックして、系列を選択します。
- シリーズのレンダリングをを選択し、 x、 y を好転開始と終了、切り、位置リストを含む 4 つのオプションのいずれかを選択します。
- レンダリング シリーズを AVI ファイルとして保存します。
- また、フィジー/画像 J を使用して、3 D 回転ビューを視覚化します。
- フィジーと元の共焦点ファイルを開く、 [イメージ] メニューをクリックし、スタックを選択します。
- 3 D プロジェクトを選択し、AVI 形式の動画として保存します。
結果
シロイヌナズナから花序メリステムから植物の分裂で共焦点のライブ イメージング実験を行ったとプロトコルの効率を評価し、種から、分裂の形態を探るトマトと大豆の両方。本研究で、シロイヌナズナ生態ランツベルクエレクター、トマト品種マイクロトム ダイズ品種ウィリアムズ 82 は例として使用されています。
シロイヌナズナサムの真ん中を通る直交断面から見ると、それは明らかに PI は (図 1 a) 複数の細胞層でのほぼすべてのセルの水平方向の壁を染色することができます。 花房サムのコーパスを 2 つの横のセクションから示すように、XY 平面からの細胞はまた明確にイメージ (図 1 b)。3 D 投影ビューで花序メリステム ドーム状構造を形成し、発展途上の花原基細胞も染色し、イメージ (図 1 C D) (映画 1) に囲まれています。
トマト サムの中央を通る直交セクションから見ると、PI は複数の細胞層の細胞から水平の壁を染色することができた、PI 信号から深部領域が若干低いことは明らかです。栄養のサムの深い層を介して 1 つ横断、XY 平面からの細胞はイメージも明確と植物の分裂組織と葉原基の形成される境界はまたイメージ (図 2 b)。3 D のプロジェクト ビューは、図形の包括的なビューとトマト (図 2 の C D) (映画 2) から植物の分裂組織の組織にさらに提供できます。
大豆サムの真ん中を通って直交ビューで我々 はドームのような植物の分裂組織と派生の新しい葉原基 (図 3 a) を見ることができます。3 D 投影ビューで両方のダイズの生長メリステムとトマトの生長メリステム ドーム状構造を形成、ただし、大豆植物の分裂組織の形状はトマト分裂組織や組織とのパターンとは異なるこれらの 2 つのサムスを取り巻く葉原基が異なる (図 3 b C) です。

図 1: ライブ イメージングとシロイヌナズナの花茎サムを分析します。A 、 B。光直交 (オルソ) と同じサム、PI (propidium ヨウ化) の中央面の横断 (トランス) 断面を染色 (紫)。C. 同じサムの 3 D 投影、PI 染色 (灰色)。D. トップ表面層と深い層を表す赤を示す青で 3 D 投影の深さ色分け。細胞壁は、PI でよごれていた。スケール バー: 20 μ m (A, B)50 μ m (C, D)。この図の拡大版を表示するのにはここをクリックしてください。
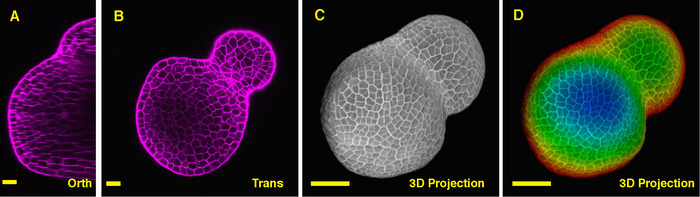
図 2:ライブ イメージングとトマトの栄養のサムを分析します。A 、 B。光直交 (オルソ) と横 (トランス) 同じサムの中央面のビューをセクションします。C. 同じサムの 3 D 投影。D. トップ表面層と深い層を表す赤を示す青で 3 D 投影の深さ色分け。細胞壁は、PI でよごれていた。スケール バー: 20 μ m (A, B)50 μ m (C, D)。この図の拡大版を表示するのにはここをクリックしてください。
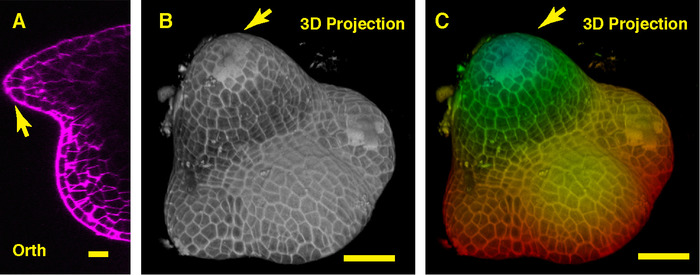
図 3:ライブ イメージングと大豆の栄養のサムを分析します。A. 栄養のサムの中央面の光直交 (オルソ) 断面図。B. 同じサムの 3 D 投影。C. トップ表面層と深い層を表す赤を示す青で 3 D 投影の深さ色分け。細胞壁は、PI でよごれていた。スケール バー: 20 μ m (A);50 μ m (B、C)。矢印: 葉の原基。この図の拡大版を表示するのにはここをクリックしてください。

ビデオ 1: 図1シロイヌナズナ花序メリステムの 3 D 回転します。してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)

ビデオ 2: 図2 トマト植物の分裂組織の 3 D 回転します。してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
ディスカッション
ここで、モデル植物の栄養生長と生殖段階で分裂組織規制の研究に新しい道を開くマイナーな変更と異なる植物から茎頂の研究に適用できる単純なイメージング法を説明し、作物。SEM と組織学的染色法と対照をなしてこのプロトコルはサーフェス ビューと労働集約的なサンプルの固定および/または組織の断面の手順を必要とせず、Sam の内部細胞構造を明らかに助けることができます。このプロトコルは潜在的サム16 の主要遺伝子そして蛋白質の発現パターンの 3 D ビューを取得することができます良い携帯電話の解像度を提供する SAMs に基づく蛍光レポーターのイメージング手法を確立する互換性のあるも ,17,18,19。さらに、ここで説明されている手順を処理関連のイメージは大幅進化発生生物学の研究と農業技術研究を進め、3 D での異なる種からサムスを比較分析の研究者を助けることができるになります。
この単純なプロトコルのいくつかの重要な手順があります。まず、試料調製及び郭清。通常植物サムはおよびシュート先端に若い器官原基を開発することにより非表示し、共焦点顕微鏡下で直接イメージすることはできません。栄養のサムをイメージさせるすべての葉や古い葉原基ファインジュエリー鉗子を使用して SAM 上にカバーするを削除する必要は。花房サムをイメージするには、もファインジュエリー鉗子を使用して、SAM を公開するすべての若い花を慎重に削除する必要は。
第二に、PI 溶液を用いた生細胞染色します。このプロトコルでは作りたての PI ソリューション (1 mg/mL) を使用して、高速で効率的、かつ簡単に実行であるライブの Sam を直接視覚化する細胞壁を染色します。PI ソリューションは、数週間の 4 ° C で保存できますが、新たに調製した溶液は通常茎頂の結果を汚すベストを与えます。PI は、主に細胞の膜を交差していません、それは携帯電話の概要とそのままなセル汚れ、それが簡単に破損している/死んだ細胞に浸透でき、核、それらの被災地の他の内部の膜システムを強く染色共焦点画像の品質に影響を与える可能性があります。したがって、それは SAM の染色サンプル準備中の物理的な損害を避けるために、ライブ イメージング不可欠になります。その一方で、高濃度 PI は植物、細胞への毒性作用を示し生活サム セル9を染色する PI の代用として FM4 64 を使用ことができますこのように。ただし、FM4 64 ラベル可能性があります可能性のあるとられる細胞にエンドサイトーシスを通じてインテリア、血しょう膜のそれ高い細胞分解能で試料を染色する挑戦を作るします。
第三に、イメージング買収。1). 高数値の開口数 (NA)、水浸漬レンズ SAMs のライブ イメージングにとって重要です。水は空気よりも高い屈折と高 NA 対物レンズの Sam の深い細胞の層を介して散在している信号光子を収集に役立ちます。2). レーザー電力 (ワットまたは表面当たりのワット数) の設定は別の共焦点顕微鏡の間非常に可変することができます。ハイパワー レーザーより良い信号収集がより多くの光損傷につながることができる/サンプルに退色します。漂白と時間を画像の解像度とのトレードオフがあります。一般より XY 解像度より大きいフレーム サイズの選択より Z の解像度が、またより多くの撮像時間につながるより多くの時間を画像と小さいスキャン間隔を選択します。もう撮像時間潜在的原因より多くの光損傷/退色
この方法では、時々 それされない簡単なより深い組織層、共焦点検出と内部組織の非能率的な PI 染色の制限可能性があります携帯電話の詳細を観察します。我々 の経験に基づいて、PI ソリューションや染色時間の濃度を増加させることができますより良い染色。また、汚損のプロシージャへの変更が可能です。たとえば、変更された擬似シフ propidium ヨウ化 (mPS PI) 方法は、固定組織20に適して。まだ将来的に生体組織のより良い染色染料代替を見つける必要があります。さらに、それもここで説明する方法は、他のすべての開花植物から Sam の研究に一般的に適用できるかどうかをテストして、いくつかの植物が特別な細胞内容または異なる細胞壁を持っているという事実を考慮した面白いです。組成。
開示事項
著者が明らかに何もありません。
謝辞
レーザー走査型共焦点顕微鏡へのアクセス、テクニカル サポート、著者はパーデュー大学 Bindley サイエンス センター イメージング施設を認めるし、著者アンディ シャバー パーデュー Bindley イメージング施設からの助けに感謝します。この活動は、インディアナ州の農業と農村開発をサポートするための資金調達 AgSEED 交差点の一部としてパデュー大学によって賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| Agar Phyto | Dot Scientific Inc. | DSA20300-1000 | |
| Agarose | Dot Scientific Inc. | AGLE-500 | |
| Forceps | ROBOZ | RS-4955 | Dumont #5SF Super Fine Forceps Inox Tip Size .025 X .005mm, for dissecting shoot apices. |
| LSM 880 Upright Confocal Microscope | Zeiss | ||
| Murashige & Skoog MS medium | Dot Scientific Inc. | DSM10200-50 | |
| Plan APO 20x/1.1 water dipping lens | Zeiss | ||
| Plastic petri dishes 100 mm X 15 mm | CELLTREAT Scientific Products | 229694 | Use as making MS plates |
| Plastic petri dishes60 mm X 15 | CELLTREAT Scientific Products | 229665 | Use as imaging dishes |
| Propagation Mix | Sungro Horticulture | ||
| Propidium iodide | Acros Organics | 440300250 | 1 mg/mL solution in water, to stain the cell walls |
| Razor blade | PERSONNA | 62-0179 | For cutting shoot apex from plants |
| Stereomicroscope | Nikon | SMZ1000 | |
| Tissue | VWR | 82003-820 | |
| Zen black | Zeiss | Image acquisition software |
参考文献
- Meyerowitz, E. M. Genetic control of cell division patterns in developing plants. Cell. 88 (3), 299-308 (1997).
- Xu, C., et al. A cascade of arabinosyltransferases controls shoot meristem size in tomato. Nature Genetics. 47 (7), 784-792 (2015).
- Bommert, P., Nagasawa, N. S., Jackson, D. Quantitative variation in maize kernel row number is controlled by the FASCIATED EAR2 locus. Nature Genetics. 45 (3), 334-337 (2013).
- Je, B. I., et al. Signaling from maize organ primordia via FASCIATED EAR3 regulates stem cell proliferation and yield traits. Nature Genetics. 48 (7), 785-791 (2016).
- Ping, J., et al. Dt2 is a gain-of-function MADS-domain factor gene that specifies semideterminacy in soybean. Plant Cell. 26 (7), 2831-2842 (2014).
- Vaughan, J. G., Jones, F. R. Structure of the angiosperm inflorescence apex. Nature. 171, 751 (1953).
- Sijacic, P., Liu, Z. Novel insights from live-imaging in shoot meristem development. Journal of Integrative Plant Biology. 52 (4), 393-399 (2010).
- Tax, F. E., Durbak, A. Meristems in the movies: live imaging as a tool for decoding intercellular signaling in shoot apical meristems. Plant Cell. 18 (6), 1331 (2006).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. Plant Cell. 16 (1), 74-87 (2004).
- Heisler, M. G., Ohno, C. Live-imaging of the Arabidopsis inflorescence meristem. Methods in Molecular Biology. 1110, 431-440 (2014).
- Tobin, C. J., Meyerowitz, E. M. Real-time lineage analysis to study cell division orientation in the Arabidopsis shoot meristem. Methods in Molecular Biology. 1370, 147-167 (2016).
- Prunet, N. Live confocal Imaging of developing Arabidopsis flowers. Journal of Visualized Experiments. (122), e55156 (2017).
- Prunet, N., et al. Live confocal imaging of Arabidopsis flower buds. Developmental Biology. 419, 114-120 (2016).
- Reddy, G. V., Heisler, M. G., Ehrhardt, D. W., Meyerowitz, E. M. Real-time lineage analysis reveals oriented cell divisions associated with morphogenesis at the shoot apex of Arabidopsis thaliana. Development. 131, 4225-4237 (2004).
- Nimchuk, Z. L., Perdue, T. D. Live Imaging of Shoot Meristems on an Inverted Confocal Microscope Using an Objective Lens Inverter Attachment. Frontiers in Plant Science. 8, 773 (2017).
- Zhou, Y., et al. HAIRY MERISTEM with WUSCHEL confines CLAVATA3 expression to the outer apical meristem layers. Science. 361 (6401), 502-506 (2018).
- Zhou, Y., et al. Control of plant stem cell function by conserved interacting transcriptional regulators. Nature. 517 (7534), 377-380 (2015).
- Nimchuk, Z. L., Zhou, Y., Tarr, P. T., Peterson, B. A., Meyerowitz, E. M. Plant stem cell maintenance by transcriptional cross-regulation of related receptor kinases. Development. 142 (6), 1043 (2015).
- Li, W., et al. LEAFY Controls Auxin Response Pathways in Floral Primordium Formation. Science Signaling. 6 (270), ra23 (2013).
- Truernit, E., et al. High-resolution whole-mount imaging of three-dimensional tissue organization and gene expression enables the study of phloem development and structure in Arabidopsis. Plant Cell. 20 (6), 1494-1503 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved