Method Article
В естественных условиях Целевые выражение Optogenetic белков с помощью шелка/AAV фильмы
В этой статье
Резюме
Здесь мы представляем метод доставки векторы экспрессии вирусных в мозга с помощью пленки Фиброин шелка. Этот метод позволяет адресности векторы выражения с использованием шелка/AAV покрытием оптического волокна, коническая оптических волокон и черепной windows.
Аннотация
Стремление понять как нейронных цепей, обрабатывать информацию в целях поведенческих мощность привода значительно способствовало недавно разработанных оптических методов для манипулирования и мониторинга активности нейронов в естественных условиях. Эти типы экспериментов полагаться на двух основных компонентов: 1) имплантируемых устройств, которые обеспечивают оптический доступ к мозгу и 2) светочувствительные белки, которые изменить возбудимости нейронов или предоставить индикация активности нейронов. Существует ряд способов выразить светочувствительные белков, но стереотаксического инъекции вирусных векторов в настоящее время наиболее гибкий подход, потому что выражение может управляться с точностью, генетические, анатомические и временных. Несмотря на большую полезность вирусных векторов доставлять вирус на сайт оптических имплантатов создает многочисленные проблемы. Стереотаксическая вирусом инъекции требуют хирургических операций, которые увеличивают время хирургических, увеличить стоимость исследований и представляют опасность для здоровья животных. Окружающие ткани могут быть физически повреждены путем инъекций шприц и иммуногенные воспаления, вызванного резким доставки болюс высокий титр вируса. Выравнивание инъекции с оптическим имплантаты особенно трудно, при таргетинге малых регионов глубоко в головном мозге. Чтобы преодолеть эти проблемы, мы описываем метод для покрытия различных типов оптических имплантатов с фильмов состоит из Фиброин шелка и аденоассоциированный вирусных векторов (AAV). Фиброин, полимер производный из кокона Тутовый шелкопряд, может инкапсулировать и защищать биомолекул и могут быть обработаны в формах, начиная от растворимых фильмов для керамики. При имплантированных в мозг, шелк/AAV покрытия выпустить вирус на стыке оптических элементов и окружающих мозг, вождение выражение точно, где она необходима. Этот метод легко реализуется и обещает значительно облегчить в vivo исследования нейронной цепи функции.
Введение
За последнее десятилетие подготовил взрыв инженерии светочувствительные белков для мониторинга и манипулирования нейронной активности1. Вирусы предлагают непревзойденную гибкость для выражения этих инструментов optogenetic в мозге. По сравнению с трансгенных животных, вирусы являются гораздо проще для производства, транспортировки и хранения, что позволяет быстрое внедрение новейших инструментов optogenetic. Выражение может быть выполнено генетически различных нейрональных популяций, и вирусы, предназначенные для ретроградного транспорта может использоваться даже для выражения на базе нейрональных подключения2.
Вирусы обычно вводятся с стереотаксического инъекции, которые может быть длительным и сложным. Именно против малых регионов может быть трудно, в то время как вождение выражение более широких областей часто требует много инъекции. Кроме того когда оптическое устройство впоследствии имплантированных в мозг, чтобы доставить свет в естественных условиях, имплантат должен быть должным образом выровнен с вирусной инъекции. Здесь мы описываем легко реализован метод доставки вирусных векторов в ткани вокруг имплантированного устройства использование Фиброин шелка фильмы3. Фиброин шелка коммерчески доступных, хорошо переносится нервных тканей и может использоваться для производства материалов с разнообразными свойствами. Шелковые фильмы могут быть применены к имплантатов с использованием общего лабораторного оборудования как микроинъекции пипетки или ручной пипетки. Шелк/AAV фильмы устранить требование о двух хирургических процедур и убедитесь, что вирус опосредованной выражение должным образом выравнивается оптический имплант. Результирующее выражение ограничивается кончик волокон и результаты в менее нежелательных выражение вдоль волокна трек чем стереотаксического инъекции.
В дополнение к производству целевых выражение на кончике мелких волокон, шелк/AAV пленки могут использоваться для привода широко (> 3 мм диаметром) корковых выражение под черепной windows. В естественных условиях 2-Фотон изображений датчиков флуоресцентные деятельность стала незаменимым инструментом для оценки роли нейронной активности в автошколах чувств и когнитивной обработки. Однако диск единообразных выражение более широких областей коры головного мозга, экспериментаторы часто выполняют множественные инъекции. Эти инъекции может быть очень много времени и может привести к несовместимым выражение через поле зрения. В отличие от этого шелк/AAV-покрытием черепной окна являются очень легко производить, значительно сократить время, необходимое для операции, и наиболее удивительно выражение сотен микрон ниже поверхности коры.
протокол
Все эксперименты с участием животных были проведены в соответствии с протоколами, утвержденных Постоянным комитетом Гарварда по животных уход следующие руководящие принципы, описанные в низ нас руководство по уходу и использованию лабораторных животных. Взрослых мышей C57BL/6 обоего пола (6-15 недель возраста) были использованы для всех экспериментов.
1. получить водный Фиброин шелка
- Подготовка или приобрести водный Фиброин шелка (5-7,5% w/v).
2. смешать водный шелка с векторы AAV выражение
- Выберите выражение вектора AAV водить optogenetic белка или флуоресцентный индикатор выбора.
Примечание: Чтобы свести к минимуму объем шелк/AAV, которые должны быть применены для имплантатов рулем надежные выражение по-прежнему рекомендуется фондовая титр AAV (бульон, титры, обычно получается из вектора ядер находятся вокруг ~ 1013 gc/мл). - Непосредственно перед покрытие имплантов оттепель Алиготе AAV и объединить с 5-7,5% водный Фиброин шелка (эта смесь будет именоваться шелк/AAV). В 200 мкл ПЦР-пробирку Смешайте в соотношении 1:1 (для использования черепной windows 1:4) водный Фиброин и AAV непосредственно перед применением. Аккуратно Пипетка решение и несколько раз тщательно смешать Фиброин и AAV.
- Держите шелк/AAV смесь на льду перед использованием.
3. Подготовка оборудования для изготовления и хранения шелк/AAV-покрытием устройств
- Закупить оборудование для покрытие оптических волокон и градиент-индекс (GRIN) линзы (рисунки 1, 2).
- Постройте стабильное обойма держателя. Провести керамические наконечники, отверстия 1,25 мм в блоке ¼" листовой акрил. Выпускных отверстий для вставки винты со стороны провести наконечники на месте.
Примечание: Для этой цели может использоваться любой зажим. - Позиция манипулятора с суб-миллиметровой точностью для перемещения оптических волокон (стереотаксического аппарата или других микроманипулятор точности).
- Соберите стабильного держатель для размещения microinjector.
- Позволяет визуализировать оптических волокон и шелковые капли стереоскоп.
- Положение источника света для освещения оптических волокон.
- Постройте стабильное обойма держателя. Провести керамические наконечники, отверстия 1,25 мм в блоке ¼" листовой акрил. Выпускных отверстий для вставки винты со стороны провести наконечники на месте.
- Подготовка оборудования для покрытия головы windows (Рисунок 3).
- Выберите любой P10 дозаторов.
- Получите контейнер с крышкой.
Примечание: Любой контейнер с дном силиконовые предлагается — мягкое дно способствует, подняв черепной windows.
- Подготовка оборудования для хранения готовой имплантатов (рис. 4).
- Получите небольшой (1-5 L) вакуумной камеры.
- Убедитесь, что есть пространство для хранения имплантатов в холодильнике 4 ° C.
4. Примените фильм шелк/AAV для устройств
- Покрытие оптических волокон диск фокуса выражение на кончике волокна
- Подготовьте хронический волокна имплантантов как описано4.
- Перед использованием промыть имплантаты с этанолом, а затем с ультрачистая вода для обеспечения того, чтобы чистые оптических волокон.
Примечание: Шелковые фильмов придерживаться более надежно очистить стеклянных поверхностей. - Подготовьте устройство провести волокна втулки. Для типичных 1,25 мм диаметр втулки использование блока ¼ дюйма акриловый, с ~1.3 мм отверстия и постучал стопорные винты, въезд со стороны отверстие имплантаты твердо в месте (Рисунок 1A).
- Крепление держателя обойма в стереотаксического аппарата (или раствор любые манипуляции с точностью субмиллиметровом) оснащены microinjector. Установите держатель обойма выше microinjector и применять смесь шелк/AAV снизу.
Примечание: Это потому, что приложения больших объемов сверху привело к шелк/AAV, который не был ограничен к кончику. Однако применение многих небольших последовательных томов сверху или снизу может производить AAV/шелк депозитов, которые приурочены к кончику (хотя мы предпочитаем применять ниже). - Вытащите Стандартный внутричерепных инъекций пипетку из боросиликатного стекла капилляров.
- Чтобы сделать его легче
- Производить инъекции наконечник с чистой плоским наконечником нужного диаметра, удерживая одной пипетки в каждой руке и использовать толще часть конуса на одной пипетки набрать другой пипеткой в месте желаемых перерыва.
- Аккуратно протрите взад и вперед в распиловки движения (метод забил на стекло).
- После забив пипеткой, приложите мягкое давление до кончика забил пипетку с телом другой дозатор для обеспечения порвать.
- Расположите стереоскоп дать четкое представление о волоконно-оптических лица.
Примечание: Увеличение должно быть достаточно точно позиционировать инъекции пипетку выше лицо оптических волокон. - Вставьте держатель с мозга стороной вниз волоконно-оптических волокна имплантатов.
- Загрузите инъекции пипетку с решением шелк/AAV, что касается любых стандартных внутричерепных инъекций5. Загрузите сумма, необходимая для количество имплантатов, предпринимаются, плюс ~ 30% дополнительно для размещения потери из-за засорения пипетки. Например если 10 имплантаты изготавливаются, затем загрузить с 100 nL депозиты и вывести мкл ~1.3.
Примечание: Шелк/AAV может сухой на наконечник пипетки между извержений, которые могут засорить пипеткой. Большого диаметра пипетки (50-100 мкм) имеют меньше шансов забить. Сабо могут быть смещены нежной чистки вниз кончиком пипетки с мокрой бумаге алкоголя или протрите тампоном. - Маневр инъекции пипетки, до тех пор, пока он трогательно или почти трогательно центре поверхности оптического волокна. Извлечь 10-20 nL шелк/AAV решения. Снять пипеткой.
Примечание: Стоимость доставки не является критическим, но типичный ставки являются 5-20 nL/сек. - Соблюдать болюс шелк/AAV на плоской поверхности, которая появляется в виде жидкого купол, который сохнет Плоская пленка в течение ~ 1 мин (рис. 1B).
- Повторите шаги 4.1.9-4.1.10 до тех пор, пока нужное количество шелка/AAV на хранение (в общей сложности 20-200 nL для большинства приложений). При подготовке нескольких имплантатов, применять шелк/AAV для одного имплантата и затем перейти к пальто других имплантантов, прежде чем вернуться к первой.
- Разрешить 1 h для сушки перед перемещением имплантатов.
- Вакуумные пересушивается ночлег в ~ 125 Торр (-25 в. Hg), 4 ° C. Сделать это, поместив весь обойма держателя в вакуумной камере.
- Оцените, форму и положение результате шелковые фильма под микроскопом мощных. Убедитесь, что фильмы, ограничиваются кончик поверхности оптического волокна, быть сравнительно тонкий (> 100 мкм) и симметрично (рис. 1 c).
Примечание: Большие или асимметричные шелк/AAV фильмов может выбить из волокна во время имплантации (рис. 1 d). Наиболее распространенной причиной проблем проистекает из применения единого больших объемов, вместо того, чтобы последовательное применение многих небольших объемов.
- Покрытие с коническими оптических волокон выражение езды вдоль оси волокна
- Получить конический волоконно-оптических имплантатов и выполнить шаги 4.1.2-4.1.8, за исключением того, что коническая волокна позиционируется боково, таким образом, что это перпендикулярно инжектор (рисунок 2A). Позиция форсунки выше конические волокна.
Примечание: Загрузкой жидких капель на конической волокна позы добавил проблем, потому что поверхностное натяжение, как правило, вызывают капельки перейти обратно на пипетку инъекций или мигрировать вверх конические волокна. Меньше инъекции пипетки (диаметр 30-50 мкм) помогают преодолеть эту проблему, но увеличить риск того, что инъекции пипетки будет забивать. Из-за поверхностного натяжения капельки склонны придерживаться области большой площади поверхности, поэтому оптимальный инъекции Пипетка размер зависит от размера конические волокна и один терпимость к иногда забивают. - Положение пипеткой шелк/AAV инъекции против стороны оптического волокна в начале конуса. Убедитесь, что инъекции пипеткой соприкасается оптического волокна.
- Извлечь 20 nL шелк/AAV для запуска процесса покрытия. Убедитесь, что капли придерживается волоконно-оптических и остается на стыке пипеткой волокна. Аккуратно фитиль капелька в конце кончика волокна как шелк/AAV высохнет (~ 45 s). Держите впрыскивая пипеткой контакт с сушки капли, чтобы избежать засорения наконечник пипетки.
Примечание: Каждый депозит должен покрыть примерно 400 мкм конические волокна (рис. 2B). - Когда почти полностью высохнет первый Болус, извлечь еще 20 nL и продолжить влагу капелька вдоль конуса.
Примечание: Жидкий шелк будет придерживаться сушеный Шелкового, анкерные один конец капельки виде дозатор перемещается вдоль конуса. - Повторите шаг 4.2.4 эжекционные небольшое количество шелка/AAV, и постепенно Рисование решение вверх в сторону конуса. 5-6 выбрасывания достаточно для прохождения поверхности 2,5 мм конус.
- Водить более равномерное выражение вокруг всех сторон волокна, поверните волокна и повторите шаги 4.2.2-4.2.5 до тех пор, пока необходимое количество шелка/AAV была передана.
- Если висит прядь из сушеный Шелкового/AAV выходит за пределы кончика волокна, тщательно стренгового с ножницами или используйте пипетку отстрела согнуть стренги обратно и придерживаться конусности волокна.
- Разрешить 1 h для сушки перед перемещением имплантатов.
- Вакуумные пересушивается ночь при 4 ° C. Держатель весь обойма могут быть помещены в вакуумной камере.
- Оцените, форму и положение результате шелковые фильма под микроскопом мощных.
Примечание: Пленки не должны быть полностью однородным, но не должны шишки, которые простираются более чем 100 мкм за пределами поверхности волокна для сведения к минимуму повреждения окружающих тканей во время имплантации (рис. 3 c). Чтобы свести к минимуму размер фильма, важно, что каждая капля полностью сухой, прежде чем последующие депозиты производятся.
- Получить конический волоконно-оптических имплантатов и выполнить шаги 4.1.2-4.1.8, за исключением того, что коническая волокна позиционируется боково, таким образом, что это перпендикулярно инжектор (рисунок 2A). Позиция форсунки выше конические волокна.
- Покрытие улыбкой объектив имплантаты
- Получить улыбкой линзы6,7 и повторите шаги 4.1.2-4.1.8. Инжектор может быть установлен выше.
- Месторождения шелк/AAV в одном отстрела (1 мкл для объектива диаметром 1,0 мм).
Примечание: Это даст купол жидкости, которая придерживается облик линзы и сушит произвести равномерную пленку (толщиной 100-200 мкм). Однако в случае, если один большой отстрел сохнет неравномерно и производит фильм, который толще по краям линзы улыбкой, попробуйте внести депозит, несколько мелких капель (100-200 nL) в центре поверхности объектива (позволяя каждой капли высохнуть до сдачи на хранение Далее), чтобы обеспечить, что фильм будет стимулировать выражение в центре поля зрения. - Разрешить 1 h для сушки перед перемещением имплантатов.
- Оцените, форму и положение результате шелковые фильма под микроскопом мощных обеспечить, что фильм покрывает поверхность объектива.
- Покрытие стекла черепа
- Подготовка стекла черепной windows путем присоединения двух диаметром 3 мм раунд coverslips (№ 1 толщина) для одного окна диаметром 5 мм с оптическим клей (подробности см. в Goldey et al. 20148).
- Сочетание шелка: вирус в соотношении 1:4, чтобы уменьшить общее количество шелка в фильме. Чрезмерное количество шелка не растворяются под черепной windows после имплантации. Титрование экспериментов может потребоваться определить отношение и объем, который дает профиль нужное выражение.
- Рука Пипетка 5 мкл капелька на поверхность coverslip 3 мм (мозг облицовки). Капелька следует разложить для покрытия всего стеклянной поверхности (рис. 3).
- Разрешить 2-3 ч для сушки перед перемещением windows.
5. хранение шелк/AAV-покрытием имплантатов
- Магазин шелка/AAV-покрытием оптических волокон в охлажденный вакуумного эксикатора (~ 125 Торр, 4 ° C) до использования (рис. 4A).
- Не храните черепной окон и линз Грина в вакууме, как большой шелковые фильмов, хранящихся под вакуумом не полностью растворить после имплантации. Имплантата черепной окон и линз улыбкой сразу после высыхания, или в течение дня производства, если хранится при атмосферном давлении и 4 ° C.
6. имплантации устройства
- Готовить животных для имплантации, как описано4.
- Кратко анестезировать мышей с внутрибрюшинного введения кетамина/Ксилазина (100/10 мг/кг) и проверьте глубину обезболивание с помощью щепотку нежные ноги. Брить черепа в области имплантата и очистить скальп с йодом и алкоголя.
- Гора животных в стереотаксического устройство и дополнения анестезии, используя смесь кислорода и изофлюрановая (1-2%). Сделать надрез в коже головы над районом интерес и выполнять краниотомии достаточно большим, чтобы вместить имплантата.
- Имплантат оптических волокон9 и microendoscope линзы10 согласно ранее опубликованных процедур. Ручка имплантатов с осторожностью, как шелк/AAV депозит можно сбил несовершенной краниотомии или имплантат, ловя на краю черепа. Медленно опустите имплантата в мозг (~ 2 мм/мин).
- Имплантат черепной windows, которые описывают ранее8. Не трогайте мелованной стороне окна и избежать промывки окна с жидкостью, если выполнение принудительного кормления, как это может смыть вирус. Для достижения максимального выражения, выполните durotomy.
7. оценки выражения и устранение неполадок
- Чтобы вычислить выражение вирусно выразил белков, позволяют ~ 2-3 недели для вируса привода выражение, а затем выполнить intracardial перфузии с параформальдегида 4% в фосфат буфер солевой раствор11 и процесс мозговой ткани для люминесцентных микроскопия12.
- Вычислить выражение с помощью флуоресцентной микроскопии изображений выражения с меткой Флюорофор optogenetic белков.
- Если уровень выражение является недостаточным, увеличьте количество вируса в покрытиях, увеличив общий объем покрытия шелк/AAV, или предпочтительно с помощью высокий титр вируса.
Результаты
Для оценки успеха шелк/AAV фильмов в автошколах выражение, мы увлажненную животных 2-3 недель после имплантации и подготовлен срезы мозга от региона интерес. Флуоресценции изображения с меткой Флюорофор optogenetic белков (ChR2-рекламы ЯФП) предоставил определенную степень самовыражения (рис. 1 d). Типичных световодов (диаметр 230 мкм) может легко вместить 200 nL шелк/AAV. С практикой экспериментаторов можно добиться высоконадежных выражение вокруг кончика имплантированных волокон (рис. 5).
Чтобы оценить выражение, движимый шелк/AAV-покрытием черепной windows, начните изображений, начиная с 7-10 дней после имплантации. Мы использовали два фотонных изображений для визуализации, но также быть использованы другие методы, такие как флуоресценции изображений с CCD. Два возможных проблем с покрытием черепной windows являются недостаточно выражения и шелковые фильмов, которые не растворяются и закрывают поле зрения. Чтобы увеличить выражение, мы предлагаем, выполняя durectomy до имплантации окна, и/или увеличения количества вируса в фильме. Мы достигли лучших выражение, используя смесь 1:4 шелка и фондовая титр AAV, соответственно. Хотя это значительно большее количество вирусных частиц, чем обычно используются в стереотаксического инъекции, сокращение времени хирургических счетчики предельной стоимости дополнительных вируса. Между тем если шелковой фильмов не раствориться под окном, далее уменьшить количество шелка, используется для покрытия окна. Общее количество шелка в покрытых оболочкой windows является 10 - 100 раз больше, чем на имплантатах волокна, и фильм является менее встроенных в ткани и таким образом не могут быть подвержены такого же уровня протеолитической активности чем может распустить шелковые фильмы13. Однако наличие шелка некоторые необходимо достижение выражение под windows3, вероятно, потому, что фильм, снятый вируса только является смыты межклеточной жидкости во время операции.

Рисунок 1: применение фильмы шелк/AAV для оптических волокон. (A) хронический волокна имплантаты помещаются волокна сторону вниз в держатель (вставка) монтируется на XYZ переводчик. Фиксированная microinjector ниже волокна распределяет шелк/AAV на советы волокна. Стереоскоп позволяет визуализировать процесс. (B) применять шелк/AAV для волокна советы в небольших объемах (10-20 nL). После извлечения Болус, отозвать пипетки и позволяют ~ 60 s для капли для сушки Плоская пленка. Повторите процесс, пока необходимый объем был применен к кончику волокна. (C) осмотрите шелковыми покрытия. Оптимального покрытия должна быть центризована на кончике волокна (слева), в то время как ненадлежащее покрытия продлить наружу от лица волокна, делая их более склонными к выбить из волокна (справа). (D) представитель волокон с покрытием 200 nL шелк/AAV и итоговый AAV-приводом ChR2-рекламы ЯФП выражение 2 недель после имплантации. Компактный шелк/AAV покрытие на левой стороне привели к надежной выражения, в то время как покрытие на право торчали мимо лицо волокна и привело к почти не выражение, вероятно потому что шелк/AAV не придерживались оптического волокна во время имплантации. Масштаб бары 0.2 мм (волокна) и 1,0 мм (срезы мозга). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: Установка для покрытия конические волокна имплантаты. (A) microinjector монтируется над держателя конические волокна, и коническая волокна расположены ортогонально к шприцу отстрела. (B) начало в широком точки (вставка) и извлечь небольшие объемы при перемещении отстрела шприц к точки конуса. Это приводит к непрерывной покрытие вдоль длины конуса. (C) представитель конические волокна, покрытые шелка смешанные с быстро зеленый для оказания помощи в визуализации. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
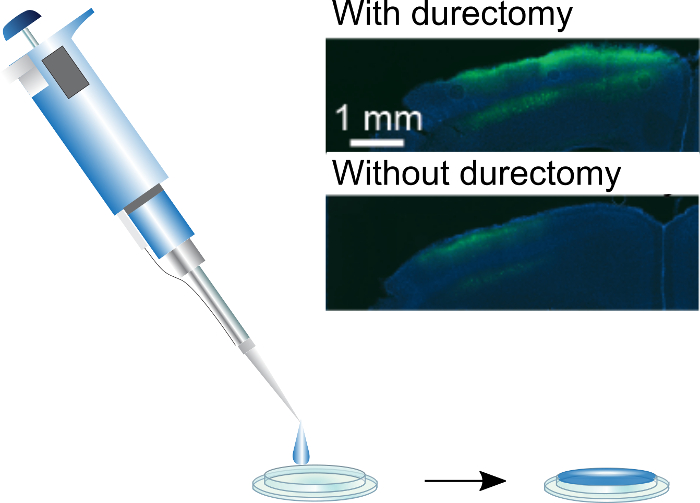
Рисунок 3: покрытие черепной windows. Шелк/AAV может быть прикладной черепной windows, с помощью пипетки руку. Стандартный 3 мм диаметр окна могут быть покрыты с 5 мкл капелька, который будет медленно сухой плоский фильм. Вставка: GCaMP6f выражение результате шелк/AAV-покрытием черепной windows имплантируются с и без durectomies. Этот показатель был адаптирован от Jackman и др. (2018) 3. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: хранение шелк/AAV покрытием имплантатов. (A) для удаления остаточной влаги и сохранить вирусные эффективности, имплантаты должны храниться в вакууме при температуре 4 ° C до тех пор, пока используется. Имплантаты, хранящиеся таким образом оставаться жизнеспособным для по крайней мере 7 дней. (Б) выражение результате 4 шелк/AAV покрытием волокна имплантированы после 7 дней хранения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
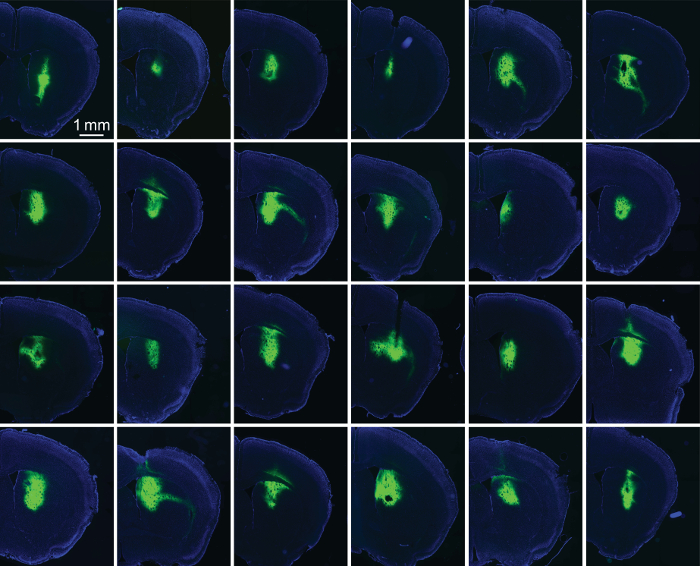
Рисунок 5: оптические волокна шелка/AAV-GFP с покрытием надежно диск выражение. Флуоресцентный изображения срезов от 24 последовательных полосатой имплантатов. Каждый имплантат был покрыт nL 100-400, 1:1 шелк/AAV-GFP. Этот когорты имплантатов указывает шелка способность ограничивать выражение на имплантат сайт (в данном случае спинной стриатума). GFP флуоресценции указывается в зеленый цвет; Пятнать DAPI показаны синим цветом. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Использование шелк/AAV для выражения optogentic белков преодолевает ограничения подходов, которые в настоящее время используются. Хотя многие исследования успешно использовать AAV инъекции, чтобы выразить optogenetic белков, это сложно выровнять выражение кончик оптических волокон, регионы вокруг длины конической волокон и к области просмотра объектив улыбкой. Из-за рассогласования оптических компонентов и optogenetic выражение Стереотаксическая инъекции могут быть недостоверными, и не много экспериментов. Шелк/AAV маркировки метод мы описали здесь решает эту проблему. Она также упрощает процедуру, устраняя второй хирургической шаг и в некоторых случаях, устраняя необходимость вторую операцию. Она также может быть трудно использовать для получения широкое выражение под черепной windows вирусов, и экспериментатор обычно выполняют длинные операции для внедрения вируса в нескольких местах. Возможность получать широкое выражение над большой корковых регионов, просто покрытие черепной windows с шелк/AAV является упрощение, что исключает необходимость для многих инвазивных инъекции.
Другим потенциальным преимуществом метода шелк/AAV является, что она может побудить меньше воспаления в нервных тканях, по сравнению с вирусной инъекции. Впрыскивать AAV высокого титра в мозг может вызвать воспалительные реакции например реактивный astrocytosis, которые имеют потенциал для изменения клеточного и схемы размещения14,15 (хотя, как правило, такие потенциальные осложнения игнорируется). Шелковые фильмов побудить мало иммуногенность ответ на их собственных13 и шелк/AAV фильмы, как ожидается, выпустить вирус в течение многих часов или дней16, который может снизить вирусную нагрузку в окружающие ткани и уменьшить иммуногенность ответы. С традиционные подходы, в которых имплантации устройства предшествует AAV инъекции воспалительные реакции могут возникнуть от имплантации и инъекции. В будущем это будет желательно систематически сравнивать традиционные подходы и шелк/AAV метод, чтобы определить ли фильмы шелк/AAV уменьшает общую воспалительных реакций.
Несколько шагов имеют решающее значение для успешного использования шелка/AAV фильмов. Самое главное покрытие оптических волокон должно быть сделано тщательно, как описано в методах и расположение высушенные пленки следует оценивать тщательно путем визуального осмотра под микроскопом, чтобы обеспечить компактный, фильмы в нужное место, и придерживаться лицо оптического волокна. Любое шёлк/AAV по бокам волоконно-оптических приведет к проявление интереса за пределами региона, и во время имплантации и привести к ненадежной или выражение не может разорвать вырабатывающей фильмов, которые выступают за лицом волокна. Методы, которые мы опишем для применения шелк/AAV имплантируемых устройств могут быть приспособлены для использования любых материалов, которые легко доступны и позволяют точное осаждения небольших объемов шелк/AAV.
Немного практики требуется обеспечить точные и воспроизводимые результаты. Если выражение наблюдается вдоль направления волокон, вполне вероятно, что шелковые фильм сушат на стороне волокна, вместо того, чтобы лицо волокна. Повторите процесс производства и внимательно осмотрите сушеные имплантаты для знаков, которые фильмы сушки на стороне волокна. Потому что шелк/AAV фильмы оптически прозрачным, это может помочь в практике применения шелка смешанные с красителем (быстро зеленый или же краситель), лучше визуализировать форму результирующей фильмов (рис. 2 c). Если выражение не, вполне вероятно, что шелковые фильм выбили из кончик волокна во время имплантации. Мы предлагаем использование запасов титр вируса при принятии имплантатов. Для оптических волокон это уменьшает общий объем, который должен быть применен к малого диаметра волокна. Если размер покрытия озабоченность считают, ждать больше между каждой 10 nL приложению полного высыхания хранение капли. Шелк/AAV капельки сохнут быстрее под лампой теплой. Для черепной windows высокий титр вируса может быть необходимо предоставить адекватные вирусной нагрузки через Пиа или Дура. Некоторые виды имплантатов может распустить шелка и отпустите AAV более легко, чем другие. Мы нашли, что черепных windows имплантирован над поверхностью мозга требуют меньше коэффициент шелк/вирус для достижения надежной выражение, возможно из-за различных мозговой спинномозговой гидродинамики или активности протеаз. Если выражение не может быть увеличена путем увеличения эффективной концентрации AAV, уменьшается объем водной шелк является правдоподобной альтернативой.
Наконец, важно правильно хранить оптических компонентов и имплантировать их довольно скоро после того, как они готовятся. Мы показали, что с покрытием волокна, которые являются холодильные под вакуумом могут храниться в течение многих дней до использования. Вакуумные хранилища удаляет остаточную влагу17 , который может уменьшить растворимость шелка фильмов, а также помогают поддерживать вирусные эффективности. В идеале оптических волокон должно быть имплантированы в течение 24 часов с момента изготовления. Однако мы находим, что волокна шелка/AAV-покрытием хранятся под вакуумного привода аналогичные уровни выражения при имплантации через 7 дней после изготовления (рис. 4B). В отличие от этого покрытые черепной окон и линз улыбкой вынудили самых надежных выражение когда они сушат при комнатной температуре и использовать в течение часов подготовки. Причиной для этого неравенство остается неясным. Дальнейшие исследования могут быть необходимы для уточнения условий подготовки и хранения продлить срок хранения.
Шелк/AAV-покрытием черепной windows имеют значительный потенциал, потому что они резко сократить хирургические раз и чрезвычайно просты в производстве, но в настоящее время этот метод имеет ограничения. Покрытые черепной windows равномерно ярлык большие участки коры и привод достаточно выражение в слое 2/3 для GCaMP обработки изображений, с несколько менее выражение в глубоких слоях. Однако Стереотаксическая инъекции диск более надежные выражение и обеспечивают больший контроль над слоями, предназначенных для выражения. Надежное выражение было достигнуто только когда Дура была удалена. Хотя для многих 2-фотонных изображений экспериментов для улучшения качества изображения8часто удаляется Дура, для многих экспериментов желательно получить маркировки в менее инвазивным способом. Поэтому мы изучили нашу способность использовать шелк/AAV для обозначения корковых регионах без удаления Дура. Мы получили некоторые маркировки, но вполне возможно, что это является следствием повреждения Дура в процессе подготовки краниотомии. Необходимы дальнейшие исследования для покрытием черепной windows должен использоваться для надежно ярлык коры без удаления Дура.
Подготовка водный Фиброин шелка из коконов Тутовый шелкопряд подробно описаны в Rockwood et al. (2011) 18. Водный Фиброин шелка в настоящее время коммерчески доступных (5% w/v). Хотя большинство наших экспериментов были проведены с использованием запасов водных Фиброин шелка, подготовлен в нашей лаборатории (5-7,5% w/v), мы получили аналогичные результаты с использованием коммерческих водный Фиброин. Водный Фиброин стабилизировано на 4 ° C на срок до 3 месяцев, после чего он спонтанно переходит из жидкого гидрогеля18. Мы рекомендуем разделить ~ 1 мл Алиготе Фиброин запасов и хранятся при температуре-80 ° C. 1 мл Рабочая Алиготе (достаточно для покрытия сотни имплантатов) можно хранить при 4 ° C и используется до тех пор, пока он начинает в гель. Будьте осторожны не трясти, вихревые, агитировать или агрессивно Пипетка водный Фиброин, перерезывающих сил может привести к гелеобразования19,20.
Шелк/AAV фильмы позволяют широкий спектр шаблонов выражений, от широко распространенной корковых выражение под черепной windows, точные подкорковых выражение на кончике оптических волокон малого диаметра. Эти методы были разработаны, чтобы воспользоваться общей векторы AAV выражение, но скорее всего могут быть использованы для разгона других векторов выражения как Lentiviruses или вирусы бешенства в мозг. Шелковые фильмов также может быть изготовлен в трехмерные формы для улучшения вирусный выпуска в ткани. Например для того чтобы диск сильное выражение под корковых windows без использования durotomy, черепной windows может покрытием с массивами шелка микроиглы, который бы пробить Дура и выпуска вируса в более глубокие слои коры21. Дальнейшее уточнение, скорее всего, приведет к улучшению свойств вируса выпуска, и новых приложений для шелка/AAV фильмов.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы поблагодарить J. Васкес для иллюстрации, D. Каплан и C. ПРЕДА для реагентов и полезные рекомендации и в лабораториях B. Сабатини и C. Харви для изображений в естественных условиях . Микроскопия стало возможным M. Ocana и центром визуализации нейробиологии, частично поддержаны центр томографии нейронные как часть Национальный институт неврологических расстройств и инсульта (NINDS) P30 основной центр Грант (NS072030). Эта работа была поддержана путем фонд GVR Ходадад семьи, Нэнси Лурье знаки и низ грантов, NINDS R21NS093498, U01NS108177 и NINDS R35NS097284 для W.G.R и низ докторской стипендии F32NS101889 C.H.C.
Материалы
| Name | Company | Catalog Number | Comments |
| Aqueous silk fibroin | Sigma | 5154-20ML | Aqueous Silk Fibroin (5% w/v) for making films |
| Microinjector to deposit silk/AAV | Drummond | 3-000-207 | Nanoject III nanoliter injector |
| Manipulator to hold implants | Narashige | MM-33 | Micromanipulator |
| Stereoscope to visualize silk deposits | AmScope | SM-6TX-FRL | 3.5X-45X Trinocular articulating zoom microscope with ring light |
| Vacuum chamber to store implants | Ablaze | N/A | 3.5 Quart Vacuum Vac Degassing Chamber |
| Optional, implant holder for storage | N/A | N/A | To store premade optical fibers, drill a grid of ~4 mm-deep holes with a diameter just larger than the ferrule diameter into a plastic block. |
| Optical fiber | Thorlabs | FT200EMT | Ø200 µm Core Multimode Optical Fiber for fiber implants |
| Ferrules | Kientec | FZI-LC-230 | LC Zirconia Ferrule for fiber implants |
| Various materials for manufacturing chronic fiber implants | Various | N/A | For detailed procedure, see Ung K, Arenkiel BR. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of visualized experiments: JoVE. 2012(68). |
| Tapered fiber implants | Optogenix | Lambda-B | Tapered fiber implants |
| GRIN lenses | GoFoton | CLH-100-WD002-002-SSI-GF3 | GRIN lenses |
| Small glass cranial windows | Warner | 64-0726 (CS-3R-0) | Small round cover glass, #0 thickness |
| Large glass cranial windows | Warner | 64-0731 (CS-5R-0) | Small round cover glass, #0 thickness |
| Various materials for manufacturing cranial windows | Various | N/A | For detailed procedure, see Goldey GJ et al. Removable cranial windows for long-term imaging in awake mice. Nature protocols. 2014 Nov;9(11):2515. |
Ссылки
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nature Methods. 11 (3), 338-346 (2014).
- Tervo, D. G., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Jackman, S. L., et al. Silk Fibroin Films Facilitate Single-Step Targeted Expression of Optogenetic Proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Ung, K., Arenkiel, B. R. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of Visualized Experiments. (68), e50004(2012).
- Lowery, R. L., Majewska, A. K. Intracranial injection of adeno-associated viral vectors. Journal of Visualized Experiments. (45), (2010).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocols. 7 (1), 12-23 (2011).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11 (3), 566-597 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Park, J. J., Cunningham, M. G. Thin sectioning of slice preparations for immunohistochemistry. Journal of Visualized Experiments. (3), 194(2007).
- Cao, Y., Wang, B. Biodegradation of silk biomaterials. International Journal of Molecular Sciences. 10 (4), 1514-1524 (2009).
- Jackman, S. L., Beneduce, B. M., Drew, I. R., Regehr, W. G. Achieving high-frequency optical control of synaptic transmission. Journal of Neuroscience. 34 (22), 7704-7714 (2014).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nature Neuroscience. 13 (5), 584-591 (2010).
- Hines, D. J., Kaplan, D. L. Mechanisms of controlled release from silk fibroin films. Biomacromolecules. 12 (3), 804-812 (2011).
- Hu, X., et al. Regulation of silk material structure by temperature-controlled water vapor annealing. Biomacromolecules. 12 (5), 1686-1696 (2011).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Yucel, T., Cebe, P., Kaplan, D. L. Vortex-induced injectable silk fibroin hydrogels. Biophysical Journal. 97 (7), 2044-2050 (2009).
- Wang, X., Kluge, J. A., Leisk, G. G., Kaplan, D. L. Sonication-induced gelation of silk fibroin for cell encapsulation. Biomaterials. 29 (8), 1054-1064 (2008).
- Lee, J., Park, S. H., Seo, I. H., Lee, K. J., Ryu, W. Rapid and repeatable fabrication of high A/R silk fibroin microneedles using thermally-drawn micromolds. European Journal of Biopharmaceutics. 94, 11-19 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены