Method Article
In Vivo Gezielte Expression von optogenetische Proteinen mit Seide/AAV Filme
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen eine Methode für die Bereitstellung von viralen Expressionsvektoren in das Gehirn mit Seide Fibroin Filme. Diese Methode ermöglicht die gezielte Bereitstellung von Expressionsvektoren mit beschichteten Glasfasern Seide/AAV, konische Lichtleitfasern und kranialen Fenster.
Zusammenfassung
Das Streben zu verstehen, wie neuronale Schaltkreise Prozessinformationen zu Verhaltensstörungen Antriebsleistung stark durch vor kurzem entwickelte optische Methoden zur Manipulation und Kontrolle der Tätigkeit der Neuronen in Vivounterstützt worden ist. Diese Art von Experimenten setzen auf zwei Hauptkomponenten: 1) implantierbare Geräte, die optischen Zugriff auf das Gehirn und (2) lichtempfindliche Proteine, die neuronale Erregbarkeit zu ändern oder eine Auslesen der neuronalen Aktivität. Es gibt eine Reihe von Möglichkeiten, lichtempfindliche Proteine auszudrücken, aber stereotaktischen Injektion von viralen Vektoren ist derzeit die flexibelste Ansatz, da Ausdruck mit genetischen, anatomische und zeitliche Präzision gesteuert werden kann. Trotz der großen Nutzen von viralen Vektoren liefert dem Virus auf der Website von optischen Implantate stellt zahlreiche Herausforderungen. Stereotaktischen Virus-Injektionen fordern Operationen, die OP-Dauer zu erhöhen, erhöhen die Kosten des Studiums und eine Gefahr für die Gesundheit des Tieres. Das umliegende Gewebe kann körperlich durch die Injektionsspritze und immunogen Entzündung verursacht durch die abrupte Lieferung eines Bolus von hoher Titer Virus beschädigt werden. Ausrichten von Injektionen mit optischen Implantate ist besonders schwierig, wenn Sie auf kleine Regionen tief im Gehirn. Um diese Herausforderungen zu bewältigen, beschreiben wir eine Methode zur Beschichtung von mehreren Arten von optischen Implantate mit Filmen aus Seide Fibroin und Adeno-assoziierte Virus (AAV) Vektoren. Fibroin, ein Polymer, abgeleitet aus dem Kokon der Bombyx Mori, kann Kapseln schützen Biomoleküle und kann in Form von löslichen Filme bis hin zu Keramik verarbeitet werden. Seide/AAV Beschichtungen lassen, wenn in das Gehirn implantiert, Virus an der Schnittstelle zwischen optischen Elementen und dem umliegenden Gehirn fahren Ausdruck genau da, wo es gebraucht wird. Diese Methode ist leicht umgesetzt und verspricht, in Vivo Studien der neuralen Schaltkreis-Funktion erheblich erleichtern.
Einleitung
Im vergangene Jahrzehnt hat eine Explosion von veränderter lichtempfindliche Proteine für die Überwachung und Manipulation neuronale Aktivität1produziert. Viren bieten unvergleichlichen Flexibilität für den Ausdruck dieser optogenetische Werkzeuge im Gehirn. Im Vergleich zu transgenen Tieren, sind Viren viel einfacher zu produzieren, zu transportieren und zu speichern, ermöglicht die schnelle Umsetzung der neuesten optogenetische Werkzeuge. Ausdruck kann auf unterschiedlichen neuronalen Populationen genetisch ausgerichtet sein, und Viren entwickelt für die retrograder Transport können auch Ausdruck basiert auf neuronalen Verbindungen2Ziel verwendet werden.
Viren sind in der Regel mit stereotaktischen Injektionen eingeführt, die zeitaufwändig und anspruchsvoll sein können. Präzise Ausrichtung auf kleine Regionen kann schwierig sein, während Ausdruck oft über weite Bereiche fahren viele Injektionen erfordert. Außerdem, wenn ein optisches Gerät anschließend in das Gehirn, um Licht in Vivoliefern implantiert ist, muss das Implantat richtig mit der viralen Injektion ausgerichtet sein. Hier beschreiben wir eine leicht implementiert Methode für die Bereitstellung von viraler Vektoren des Gewebes um eine implantierte Gerät mit Seide Fibroin Filme3. Seide Fibroin ist im Handel erhältlich, gut verträglich durch neuronale Gewebe und kann verwendet werden, um Materialien mit unterschiedlichen Eigenschaften zu produzieren. Seide Filme können auch auf Implantate mit gemeinsamen Laborgeräte wie Mikroinjektion Pipetten oder hand Pipetten. Seide/AAV Filme beseitigen die Forderung nach zwei chirurgische Eingriffe und sicherzustellen, dass Virus-vermittelten Expression mit dem optischen Implantat richtig ausgerichtet ist. Der resultierende Ausdruck wird auf die Spitze der Fasern und führt zu weniger unerwünschten Ausdruck entlang der Faser-Strecke als stereotaktischen Injektionen beschränkt.
Neben der Produktion von gezielten Ausdruck an der Spitze der kleinen Fasern, Seide/AAV Filme können verwendet werden, um weit verbreitete fahren (> 3 mm Durchmesser) kortikale Ausdruck unter kranialen Fenster. In Vivo 2-Photonen-Bildgebung von fluoreszierenden Bewegungssensoren ist ein unverzichtbares Instrument für die Bewertung der Rolle der neuronalen Aktivität im sensorischen und kognitiven Verarbeitung fahren geworden. Jedoch um einheitliche fahren Ausdruck über die kortikalen Bereichen Experimentatoren häufig mehrere Injektionen durchführen. Diese Injektionen können sehr zeitaufwändig sein und können zu inkonsistenten Ausdruck in das Sichtfeld führen. Im Gegensatz dazu sind Seide/AAV-beschichtete kranialen Fenster extrem einfach zu fertigen, erheblich reduzieren den Zeitaufwand für Operationen und fahren am bemerkenswertesten Ausdruck Hunderte von µm unterhalb der kortikalen Oberfläche.
Protokoll
Alle Experimente mit Tieren wurden gemäß Protokollen vom Harvard ständigen Ausschusses Animal Care folgende Leitlinien im US NIH Führer für die Pflege und Verwendung von Labortierenbeschrieben durchgeführt. Erwachsene C57BL/6 Mäusen beiderlei Geschlechts (6-15 Wochen alt) wurden für alle Experimente verwendet.
1. besorgen Sie wässrigen Seide Fibroin
- Vorbereiten oder wässrige Seide Fibroin (5-7,5 % w/V) zu erwerben.
2. Mischen Sie wässrigen Seide mit AAV Expressionsvektoren
- Wählen Sie ein AAV Expressionsvektor optogenetische Protein oder fluoreszierenden Indikator für Wahl zu fahren.
Hinweis: Um das Volumen der Seide/AAV zu minimieren, die Implantate während der Fahrt noch robuste Ausdruck angewendet werden muss, empfiehlt Lager-Titer AAV (Lager sind Titer von Vektor-Kerne in der Regel erhalten um ~ 1013 gc/mL). - Unmittelbar vor der Beschichtung Implantate tauen Sie ein Aliquot der AAV auf und kombinieren Sie mit 5-7,5 % wässrige Seide Fibroin (diese Mischung wird als Seide/AAV bezeichnet werden). Mischen Sie in einem 200 µL PCR-Röhrchen wässrigen Fibroin und AAV im Verhältnis 1:1 (für cranial Windows verwenden Sie 1:4) unmittelbar vor dem Auftragen. Die Lösung pipette vorsichtig ein-und mehrfach Fibroin und AAV gründlich mischen.
- Halten Sie Seide/AAV-Mischung auf dem Eis vor dem Gebrauch.
3. bereiten Sie Anlagen zur Herstellung und Lagerung von Seide/AAV-beschichtete Geräte
- Ausrüstung für Beschichtung optische Fasern und Gradienten-Index (Grinsen) Linsen (Abbildungen 1, 2) beschaffen.
- Inhaber eines stabilen zwinge zu konstruieren. Keramische Aderendhülsen halten, Bohrungen Sie 1,25 mm, in einem Block von ¼" Blatt Acryl. Tippen Sie auf Löcher um Schrauben von der Seite, Aderendhülsen festzuhalten einzufügen.
Hinweis: Jede Klammer kann für diesen Zweck verwendet werden. - Positionieren Sie einen Manipulator mit Sub-Millimeter Präzision, die Lichtleitfasern (stereotaktischen Apparat oder andere Präzision Mikromanipulator) zu bewegen.
- Montieren Sie eine stabile Halterung um die Microinjector zu positionieren.
- Verwenden Sie ein Stereoskop, um optische Fasern und Seide Tröpfchen zu visualisieren.
- Positionieren Sie eine Lichtquelle zur Beleuchtung der optischen Fasern.
- Inhaber eines stabilen zwinge zu konstruieren. Keramische Aderendhülsen halten, Bohrungen Sie 1,25 mm, in einem Block von ¼" Blatt Acryl. Tippen Sie auf Löcher um Schrauben von der Seite, Aderendhülsen festzuhalten einzufügen.
- Bereiten Sie die Ausrüstung für die Beschichtung von kranialen Fenster (Abbildung 3).
- Wählen Sie jede P10-Pipette.
- Erhalten Sie einen Behälter mit Deckel.
Hinweis: Alle Behälter mit einem Silikon-Boden wird vorgeschlagen – die weichen Unterseite erleichtert kranialen Fenster anheben.
- Bereiten Sie Ausrüstung, fertige Implantate (Abbildung 4) zu speichern.
- Erhalten Sie eine kleinen (1-5 L) Vakuumkammer.
- Stellen Sie sicher, dass gibt es Platz zum Aufbewahren im Kühlschrank 4 ° C Implantate.
4. tragen Sie Seide/AAV Film, Geräte
- Beschichtung von optischen Fasern auf Laufwerk fokale Ausdruck an der Faserspitze
- Chronische Faser Implantate als zuvor beschriebenen4vorbereiten.
- Vor dem Gebrauch spülen Implantate mit Ethanol, dann mit Reinstwasser um sicherzustellen, dass die Glasfasern sind sauber.
Hinweis: Silk Folien haften, zuverlässiger um Glasflächen reinigen. - Bereiten Sie ein Gerät Faser Aderendhülsen zu halten. Für typische 1,25 mm Durchmesser Aderendhülsen verwenden Sie einen Block ¼ Zoll klaren Acryl, mit ~1.3 mm Löcher, und tippte Stellschrauben auf Loch Implantate fest im Ort (Abbildung 1A) von der Seite eingeben.
- Berg die Endhülse Halter in einem stereotaktischen Apparat (oder Manipulation Lösung mit Submillimeter Präzision) mit einer Microinjector ausgestattet. Setzen Sie die Zwinge Halterung oberhalb der Microinjector und wenden Sie die Seide/AAV-Mischung von unten an.
Hinweis: Dies ist, da Seide/AAV Anwendungen großer Mengen von oben geführt, die nicht auf die Spitze beschränkt war. Allerdings kann die Anwendung von vielen sequenziellen Kleinmengen von oben oder unten AAV/Seide-Einlagen führen, die an der Spitze beschränkt sind (obwohl wir lieber von unten anwenden). - Ziehen Sie eine standard intrakraniellen Injektion Pipette aus Borosilikatglas Kapillare.
- Um es einfacher zu
- Um eine Injektion Tipp mit einer sauberen flachen Spitze des gewünschten Durchmessers zu produzieren, halten Sie eine Pipette in jeder Hand zu und verwenden Sie den dickeren Teil des Kegels auf einer Pipette, um die andere Pipette an der gewünschten Position zu erzielen.
- Reiben Sie vorsichtig hin und her in einer Sägen Bewegung (der Glas-scoring-Methode).
- Üben Sie nach der Wertung der Pipette sanften Druck auf die erzielte Pipettenspitze mit dem Körper der Pipette, einen sauberen Schnitt zu erreichen.
- Positionieren Sie ein Stereoskop um einen klaren Überblick über die LWL-Gesichter zu geben.
Hinweis: Vergrößerung sollte ausreichen, um die Injektion Pipette über das Gesicht von optischen Fasern genau zu positionieren. - Einsetzen Sie Faser-Implantate in Halter mit der Gehirn-Seite des Lichtleiters nach unten.
- Laden Sie die Injektion-Pipette mit Seide/AAV-Lösung für alle standard intrakraniellen Injektion5. Laden Sie die Füllmenge für die Anzahl der Implantate gemacht, plus ~ 30 % zusätzliche Verluste aufgrund von Pipetten Verstopfung unterzubringen. Beispielsweise wenn 10 Implantate gemacht werden, dann laden mit 100 nL Einlagen und ~1.3 µL zurückzuziehen.
Hinweis: Seide/AAV kann bei der Pipettenspitze zwischen Ejections, trocknen die Pipette verstopfen können. Großem Durchmesser Pipetten (50-100 µm) sind weniger wahrscheinlich zu verstopfen. Clogs können durch sanfte Bürsten Sie die Pipettenspitze mit einem feuchten Papier wischen oder Alkohol-Tupfer verdrängt werden. - Die Injektion Pipette zu manövrieren, bis es berühren oder beinahe berührt die Mitte der LWL-Oberfläche. Werfen Sie 10-20 nL Seide/AAV-Lösung. Die Pipette zurückziehen.
Hinweis: Der Preis der Lieferung ist nicht kritisch, aber typische Preise sind 5-20 nL/s. - Beobachten der Bolus von Seide/AAV auf der flachen Oberfläche erscheint wie eine flüssige Kuppel, das trocknet zu einem flachen Film innerhalb von ~ 1 min (Abbildung 1 b).
- Wiederholen Sie die Schritte 4.1.9-4.1.10, bis die gewünschte Menge an Seide/AAV ist hinterlegt (insgesamt 20-200 nL für die meisten Anwendungen). Wenn Sie mehrere Implantate vorbereiten, gelten Seide/AAV für ein Implantat und fahren Sie dann mit anderen Implantaten vor der Rückkehr zu beschichten, die erste.
- Ermöglichen Sie 1 h zum Trocknen vor dem Umzug Implantate.
- Vakuum desiccate Übernachtung im ~ 125 mm Hg (-25 in. (Hg), 4 ° C. Dies, indem der gesamte zwinge Inhaber in eine Vakuumkammer tun.
- Die Form und Position der daraus resultierenden Seide Film unter einem Hochleistungs-Mikroskop zu bewerten. Sicherzustellen, dass die Filme auf der Spitze der LWL-Oberfläche beschränkt sind, relativ dünn sein (> 100 µm), und symmetrisch (Abbildung 1).
Hinweis: Große oder asymmetrisch Seide/AAV-Filme können von der Faser während der Implantation (Abbildung 1) verdrängen. Die häufigste Ursache von Problemen ergibt sich aus der Anwendung der einzelnen große Mengen anstatt der sequentiellen Anwendung von vielen kleinen Mengen.
- Beschichtung konisch Lichtleitfasern Laufwerk Ausdruck entlang der Faser-Achse
- Erhalten Sie konische LWL-Implantate und führen Sie Schritte 4.1.2-4.1.8, außer dass die konische Faser seitlich positioniert ist, so dass es senkrecht zum Injektor (Abbildung 2A). Positionieren Sie den Injektor über die konischen Faser.
Hinweis: Laden Flüssigkeitströpfchen auf konischen Fasern Posen Herausforderungen, hinzugefügt, weil Oberflächenspannung tendenziell dazu führen, dass Tröpfchen springt wieder auf die Injektion Pipette oder Migrieren der konischen Faser. Kleinere Injektion Pipetten (30-50 µm Durchmesser) dazu beitragen, dieses Problem zu überwinden, sondern erhöhen das Risiko, das die Injektion Pipette verstopfen. Aufgrund der Oberflächenspannung Tropfen sind in der Regel auf den Bereich der größten Fläche zu halten, so dass die optimale Einspritzung pipette Größe ist abhängig von der Größe der konischen Faser und die Toleranz für die gelegentliche Verstopfung. - Positionieren Sie die Seide/AAV Injektion Pipette gegen die Seite des Lichtleiters am Anfang der Verjüngung. Stellen Sie sicher, dass die Injektion Pipette die optische Faser berührt.
- Auswerfen 20 nL von Seide/AAV um die Beschichtung zu starten. Sicherstellen Sie, dass das Tröpfchen hält sich an die optische Faser und an der Schnittstelle von der Faser/Pipette bleibt. Sanft Docht Tropfen gegen Ende der Faserspitze wie Seide/AAV trocknet (~ 45 s). Halten Sie die Injektion Pipette in Kontakt mit der Trocknung Tropfen zu vermeiden, verstopfen die Pipettenspitze.
Hinweis: Jede Einzahlung sollte ca. 400 µm der konischen Faser (Abb. 2 b) bestreichen. - Wenn der erste Bolus fast vollständig getrocknet ist, werfen Sie noch 20 nL und weiter Feuchtigkeitstransport des Tropfens entlang der Verjüngung.
Hinweis: Die flüssige Seide die getrockneten Seide haften an Verankerung ein Ende der Tropfen als die Pipette bewegt sich entlang der Verjüngung. - Wiederholen Sie Schritt 4.2.4 durch Auswerfen geringe Mengen an Seide/AAV, und allmählich zeichnen die Lösung an der Seite des Kegels. 5-6 Ejections sind ausreichend, um die Oberfläche von 2,5 mm Konus zu durchqueren.
- Um mehr einheitliche Ausdruck um alle Seiten der Faser zu fahren, drehen Sie die Faser und wiederholen Sie Schritte 4.2.2-4.2.5, bis die gewünschte Menge an Seide/AAV niedergelegt worden ist.
- Wenn eine hängen der Aktionsbereich getrocknete Seide/AAV erstreckt sich über die Faserspitze, sorgfältig den Strang mit einer Schere geschnitten oder verwenden die Auswurf-Pipette auf den Strang zurück zu biegen und die Verjüngung der Faser einhalten.
- Ermöglichen Sie 1 h zum Trocknen vor dem Umzug Implantate.
- Vakuum desiccate über Nacht bei 4 ° C. Der gesamte zwinge-Inhaber kann in eine Vakuumkammer platziert werden.
- Die Form und Position der daraus resultierenden Seide Film unter einem Hochleistungs-Mikroskop zu bewerten.
Hinweis: Filme müssen nicht völlig einheitlich sein sollte, nicht jedoch Unebenheiten, die mehr als 100 µm über die Oberfläche der Faser, Beschädigung der umgebenden Gewebe während der Implantation (Abbildung 3) zu minimieren erweitern. Um Filmgröße zu minimieren, ist es wichtig, dass jeder Tropfen vollständig trocken ist, bevor nachfolgende Einzahlungen getätigt werden.
- Erhalten Sie konische LWL-Implantate und führen Sie Schritte 4.1.2-4.1.8, außer dass die konische Faser seitlich positioniert ist, so dass es senkrecht zum Injektor (Abbildung 2A). Positionieren Sie den Injektor über die konischen Faser.
- Beschichtung Grinsen Objektiv Implantate
- Erhalten Sie GRIN-Linsen-6,-7 , und wiederholen Sie die Schritte 4.1.2-4.1.8. Der Injektor kann oben montiert werden.
- Seide/AAV in einem einzigen Auswurf (1 µL für eine 1,0 mm Durchmesser Objektiv) einzahlen.
Hinweis: Dies wird eine Kuppel aus Flüssigkeit hervorbringen, die hält sich an das Gesicht des Objektivs und trocknet um ein gleichmäßiger Film (100-200 µm dick) zu produzieren. Jedoch den Fall, dass eine einzelne große Auswurf ungleichmäßig trocknet und produziert einen Film, der am Rand der Linse Grinsen dicker ist, versuchen Sie mehrere kleinere Tröpfchen (100-200 nL) Hinterlegung in der Mitte der Oberfläche der Linse (so dass jeder Tropfen vor Hinterlegung trocknen die nächste) um sicherzustellen, dass der Film in der Mitte des Sichtfeldes Ausdruck fahren wird. - Ermöglichen Sie 1 h zum Trocknen vor dem Umzug Implantate.
- Bewerten Sie die Form und Position der resultierenden Seide Film unter einem Hochleistungs-Mikroskop um sicherzustellen, dass der Film die Linsenoberfläche deckt.
- Kranialen Fenster Beschichtung
- Bereiten Sie Glas kranialen Fenster von anhaftenden zwei 3 mm Durchmesser Runde Deckgläsern (Nr. 1-Dicke) auf einem 5 mm Durchmesser Fenster mit optischen Kleber (Näheres siehe Goldey Et Al. 20148).
- Mischen Sie Seide: Virus in einem Verhältnis von 1:4, den Gesamtbetrag der Seide in den Film zu reduzieren. Übermäßige Mengen an Seide auflösen unter kranialen Fenster nach der Implantation nicht. Titration Experimente müssen gegebenenfalls bestimmen das Verhältnis und die Lautstärke, die das gewünschten Profil gibt.
- Hand pipette 5 µL Tröpfchen auf der Oberfläche von 3 mm (Gehirn-Einfassung) Deckglas. Die Tropfen sollten zur Deckung der gesamten Glasfläche (Abbildung 3) verteilt.
- 2-3 h zum Trocknen vor dem Verschieben von Fenstern zu ermöglichen.
5. Speicherung von Seide/AAV-beschichtete Implantate
- Speichern Sie Seide/AAV-beschichtete Glasfasern in einem gekühlten Vakuum Exsikkator (~ 125 Torr, 4 ° C) vor der Verwendung (Abb. 4A).
- Speichern Sie keine kranialen Fenster und GRIN-Linsen unter Vakuum, wie große Seide Filme gespeichert unter Vakuum nicht vollständig nach der Implantation zu lösen. Implantat-kranialen Fenster und GRIN-Linsen sofort nach dem Trocknen oder innerhalb eines Tages der Herstellung wenn bei atmosphärischem Druck und 4 ° c gelagert
6. implantiert die Geräte
- Implantat-Chirurgie Tiere als zuvor beschriebenen4vorbereiten.
- Kurz gesagt, betäuben Sie Mäuse mit einer intraperitonealen Injektion von Ketamin/Xylazin (100/10 mg/kg) zu und prüfen Sie die Tiefe der Narkose mit einer sanften Zehe-Klemme. Den Schädel in der Umgebung des Implantats zu rasieren und Reinigen der Kopfhaut mit Jod und Alkohol.
- Tiere in einem stereotaktischen Gerät montieren und Narkose mit einem Gemisch aus Sauerstoff und Isofluran (1-2 %) zu ergänzen. Machen Sie einen Einschnitt in der Kopfhaut über den gewünschten Bereich zu, und führen Sie eine Kraniotomie groß genug für das Implantat.
- Implantat Lichtleitfasern9 und Microendoscope Linsen10 gemäß den zuvor veröffentlichten Verfahren. Griff-Implantate mit Sorgfalt, wie die Seide/AAV Kaution durch eine unvollkommene Kraniotomie oder durch das Implantat fangen am Rande des Schädels abgeschlagen kann. Senken Sie das Implantat in das Gehirn langsam (~ 2 mm/min).
- Implantat kranialen Fenster wie bisher8beschrieben. Berühren Sie die beschichtete Seite des Fensters nicht und vermeiden Sie das Fenster mit Flüssigkeit spülen, falls Magensonde, durchführen, wie dies das Virus wegwaschen kann. Um maximalen Ausdruck zu erreichen, führen Sie eine Durotomy.
7. Auswertung des Ausdrucks und Fehlerbehebung
- Um Expression von Proteinen Viral ausgedrückt zu bewerten, lassen ~ 2-3 Wochen für das Virus zu Ausdruck zu fahren, dann führen Sie Intracardial Perfusion mit 4 % Paraformaldehyd in Phosphat gepufferte Salzlösung11 und Prozess Hirngewebe für Leuchtstofflampen Mikroskopie-12.
- Werten Sie den Ausdruck mithilfe von Fluoreszenz-Mikroskopie, die Muster des Ausdrucks der Fluorophor-Tags optogenetische Proteine Bild.
- Wenn die Ebene des Ausdrucks nicht ausreicht, erhöhen Sie der Virusmenge in Beschichtungen indem man entweder das Gesamtvolumen der Seide/AAV Beschichtung, oder vorzugsweise mit einem höheren Titer-Virus.
Ergebnisse
Um den Erfolg der Seide/AAV Filme in Fahrt Ausdruck zu beurteilen, wir Tiere 2 bis 3 Wochen nach der Implantation durchblutet und bereiteten Gehirnscheiben aus der Region von Interesse. Fluoreszenzbilder Fluorophor-Tags optogenetische Proteine (ChR2-YFP) zur Verfügung gestellt ein Maß für den Umfang des Ausdrucks (Abbildung 1). Typische optische Fasern (230 µm Durchmesser) können ohne weiteres Platz für 200 nL Seide/AAV. Mit etwas Übung können Experimentatoren hochzuverlässige Ausdruck um die Spitze des implantierten Fasern (Abbildung 5) erreichen.
Angetrieben von Seide/AAV-beschichtete kranialen Fenster Ausdruck zu bewerten, beginnen Sie Bildgebung ab ca. 7-10 Tage nach der Implantation. Wir haben zwei-Photonen-Bildgebung zur Visualisierung verwendet, aber auch andere Methoden wie Fluoreszenz imaging mit einem CCD genutzt werden. Zwei mögliche Probleme mit beschichteten kranialen Fenster sind nicht genügend Ausdruck und Seide Filme, die nicht auflösen und das Sichtfeld zu verschleiern. Um Ausdruck zu erhöhen, empfehlen wir die Durchführung eines Durectomy vor der Implantation des Fensters und/oder Erhöhung der Menge der Viren im Film. Den besten Ausdruck mit einer 1:4 Mischung aus Seide und Lager-Titer AAV, bzw. haben wir erreicht. Während dies eine wesentlich größere Anzahl von Viruspartikel repräsentiert als normalerweise in stereotaktischen Injektionen verwendet werden, kontert die verminderte OP-Dauer zusätzliche Grenzkosten des Virus. Unterdessen wenn Seide Filme nicht unterhalb des Fensters auflösen, weiter zu reduzieren die Menge an Seide verwendet, um das Fenster zu beschichten. Der Gesamtbetrag der Seide in beschichteten Fenstern ist 10 - 100 Mal mehr als auf Faser-Implantate, und der Film ist weniger im Gewebe eingebettet und somit nicht ausgesetzt sein kann auf dem gleichen Niveau der proteolytischen Aktivität als Seide Film13auflösen kann. Die Anwesenheit von einigen Seide ist jedoch Voraussetzung für das erreichen Ausdruck unter Windows3, wahrscheinlich, weil ein Film aus der Virus allein während der Operation vom interstitielle Flüssigkeit abgespült werden.

Abbildung 1: Anwendung von Seide/AAV Filme auf optischen Fasern. (A) chronische Faser Implantate sind Faser Seite nach unten in eine Halterung (kleines Foto) montiert auf ein XYZ-Übersetzer. Eine feste Microinjector unter die Fasern verzichtet Seide/AAV auf die Faser-Tipps. Ein Stereoskop ermöglicht Visualisierung des Prozesses. Gelten Sie (B) Seide/AAV, Faser-Tipps in kleinen Mengen (10-20 nL). Nach dem Auswerfen eines Bolus, die Pipette zurückziehen und erlauben ~ 60 s für das Tröpfchen zu einem flachen Film trocknen. Wiederholen Sie den Vorgang, bis das erforderliche Volumen an der Faserspitze angewendet wurde. Inspizieren Sie (C) Seide Beschichtungen. Optimale Beschichtungen sollte auf der Faserspitze (links), zentriert sein, während unsachgemäße Beschichtungen nach außen von der Faser-Gesicht macht sie anfälliger für von der Faser zu vertreiben (rechts) zu verlängern. (D) repräsentative Fasern beschichtet mit 200 nL Seide/AAV, und die daraus resultierende AAV-driven ChR2-YFP Ausdruck 2 Wochen nach der Implantation. Die kompakten Seide/AAV-Beschichtung auf der linken Seite führte robuste Ausdruck, während die Beschichtung auf der rechten Seite hinter das Gesicht der Faser ragte und fast kein Ausdruck, wahrscheinlich, führte weil die Seide/AAV während der Implantation nicht auf die optische Faser befolgten. Skala bars 0,2 mm (Fasern) und 1,0 mm (Gehirnscheiben). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Setup für Beschichtung konischen Faser Implantate. (A) der Microinjector wird über den konischen Faser-Halter montiert, und konische Fasern sind orthogonal positioniert, um die Auswurf-Spritze. (B) beginnen an der breitesten Punkt (kleines Foto) und Auswerfen Kleinmengen während der Bewegung der Auswurf-Spritze zum Punkt der Verjüngung. Dies führt zu einer kontinuierlichen Beschichtung entlang der Länge des Kegels. (C) repräsentative konischen Faser beschichtet mit Seide gemischt mit schnell grün um Visualisierung zu unterstützen. Bitte klicken Sie hier für eine größere Version dieser Figur.
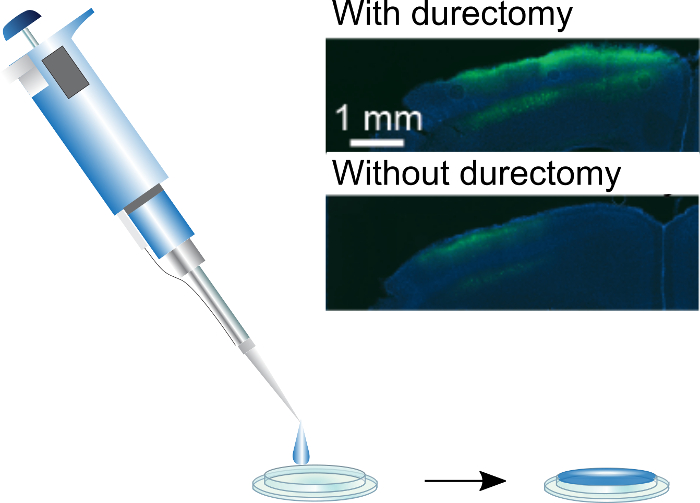
Abbildung 3: Beschichtung kranialen Fenster. Seide/AAV können angewandte kranialen Fenster mit einer Pipette Hand sein. Ein standard 3 mm Durchmesser-Fenster kann mit einem 5 µL Tröpfchen, die langsam zu einem flachen Film trocknen wird beschichtet werden. Einschub: GCaMP6f Ausdruck aus Seide/AAV-beschichtete kranialen Fenster implantiert, mit und ohne Durectomies. Diese Zahl wurde angepasst von Jackman Et al. (2018) 3. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Speichern von Seide/AAV beschichtete Implantate. (A), um Restfeuchtigkeit zu entfernen und zu bewahren viralen Wirksamkeit Implantate unter Vakuum bei 4 ° C bis verwendet gespeichert werden soll. Implantate, die auf diese Weise gespeichert bleiben für mindestens 7 Tage lebensfähig. (B) Ausdruck aus 4 Seide/AAV beschichtete Fasern nach 7 Tagen Lagerung implantiert. Bitte klicken Sie hier für eine größere Version dieser Figur.
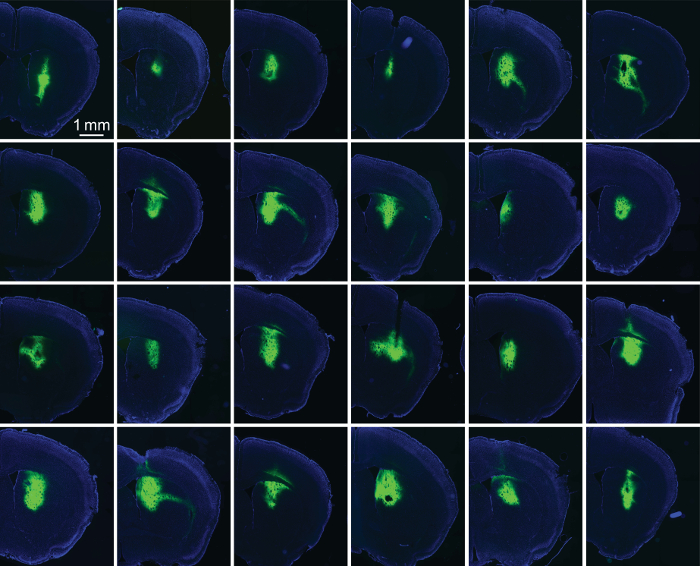
Abbildung 5: Seide/AAV-GFP beschichtete Glasfasern fahren zuverlässig Ausdruck. Fluoreszierende Bilder von Scheiben von 24 aufeinander folgenden striatalen Implantate. Jedes Implantat wurde mit 100-400 nL 1:1 Seide/AAV-GFP beschichtet. Diese Kohorte von Implantaten bezeichnet die Fähigkeit von Seide, Ausdruck der Implantationsstelle (in diesem Fall die dorsalen Striatum) zu beschränken. GFP-Fluoreszenz wird in grün angezeigt; DAPI-Färbung wird blau dargestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die Verwendung von Seide/AAV, die Expression von Optogentic Proteinen Ziel überwindet Grenzen von Ansätzen, die derzeit im Einsatz sind. Obwohl viele Studien erfolgreich AAV Injektionen verwenden optogenetische Proteine zum Ausdruck zu bringen, ist es schwierig, Ausdruck bis zur Spitze von optischen Fasern, Regionen rund um die Länge der konischen Fasern und ein Grinsen Objektiv betrachten und Umgebung auszurichten. Wegen der Fehlstellung zwischen optischer Komponenten und optogenetische Ausdruck stereotaktischen Injektionen können unzuverlässig sein, und viele Experimente nicht. Die Seide/AAV Kennzeichnung Methode, die wir hier beschreiben löst dieses Problem. Es vereinfacht auch den Vorgang, durch den Wegfall eines zweiten chirurgischen Schritt und in einigen Fällen, wodurch die Notwendigkeit für eine zweite Operation. Es kann auch schwierig sein, Viren zu verwenden, um weit verbreitete Ausdruck unter kranialen Fenster zu erhalten, und Experimentator in der Regel lange Operationen Virus an mehreren Standorten zu injizieren. Die Fähigkeit, weit verbreitete Ausdruck über große kortikalen Regionen durch einfach Beschichtung kranialen Fenster mit Seide/AAV zu erhalten ist eine Vereinfachung, die die viele invasiven Injektionen überflüssig macht.
Ein weiterer potenzieller Vorteil der Seide/AAV-Methode ist, dass es weniger Entzündungen in den neuralen Geweben im Vergleich zur viralen Injektionen verursachen könnte. Injektion von hoher Titer AAV in das Gehirn kann Entzündungsreaktionen wie reaktive Astrocytosis verursachen, die haben das Potenzial, Mobilfunk- und Schaltung Eigenschaften14,15 ändern (obwohl solche Komplikationen in der Regel sind (ignoriert). Seide Filme induzieren wenig immunogen Reaktion auf ihre eigenen13 und Seide/AAV Filme werden voraussichtlich Virus im Laufe der vielen Stunden oder Tagen16, freigeben, die möglicherweise die Viruslast in das umliegende Gewebe zu senken und immunogenen Reaktionen. Bei herkömmlichen Ansätzen in denen Implantation eines Geräts AAV Injektion vorangestellt ist, können durch die Implantation und die Injektion Entzündungsreaktionen entstehen. In Zukunft wird es wünschenswert, systematisch zu vergleichen, konventionelle Ansätze und die Seide/AAV-Methode, um festzustellen, ob Seide/AAV Filme reduziert insgesamt Entzündungsreaktionen.
Mehrere Schritte sind entscheidend für den erfolgreichen Einsatz von Seide/AAV Filme. Am wichtigsten ist, die Beschichtung von optischen Fasern muss sorgfältig beschriebenen Methoden ausgeführt werden und die Lage der getrockneten Filme sollten sorgfältig beurteilt werden, durch Sichtkontrolle unter dem Mikroskop um sicherzustellen, dass die Filme kompakte, an der richtigen Stelle sind, und halten uns an das Gesicht des Lichtleiters. Jedes Seide/AAV an den Seiten des Lichtleiters führt zur Interessenbekundung außerhalb der Region, und deformierte Filme, die über das Gesicht der Faser herausragen können während der Implantation und führen zu unzuverlässig oder kein Ausdruck abbrechen. Die Techniken, die wir beschreiben für implantierbare Geräte Seide/AAV zuweisen kann angepasst, alle Materialien zu verwenden sind, die sind leicht zugänglich und ermöglichen die präzise Ablagerung von kleinen Mengen an Seide/AAV.
Ein bisschen Übung ist erforderlich, um genaue und reproduzierbare Ergebnisse zu erzielen. Wenn Ausdruck entlang der Strecke der Faser beobachtet wird, ist es wahrscheinlich, dass die Seide Film auf der Seite der Faser, anstatt die Faser Gesicht getrocknet. Wiederholen Sie den Herstellungsprozess und untersuchen Sie eng getrocknete Implantate auf Anzeichen, die Filme sind auf der Seite der Faser trocknen. Da Seide/AAV Filme optisch transparent sind, kann es helfen, Praxis anwenden Seide gemischt mit Farbstoff (schnell grün oder ein ähnlicher Farbstoff), die Form der daraus resultierenden Filme (Abbildung 2) besser zu visualisieren. Wenn es kein Ausdruck ist, ist es wahrscheinlich, dass die Seide Film aus der Faserspitze während der Implantation verdrängt. Wir empfehlen die Verwendung von Lager-Titer Virus bei Implantaten. Für optische Fasern reduziert dies die Gesamtmenge, die mit kleinem Durchmesser Fasern angewendet werden muss. Die Größe der Beschichtung ist ein Anliegen sollten zwischen jede 10 nL-Anwendung ermöglicht die vollständige Trocknung des hinterlegten Tropfens länger zu warten. Seide/AAV Tröpfchen trocken schneller unter einer warmen Lampe. Für cranial Windows möglicherweise hoher Titer Virus notwendig, angemessene Viruslast über die Pia oder Dura zu liefern. Bestimmte Arten von Implantaten können Seide auflösen und loslassen AAV leichter als andere. Wir haben festgestellt, dass die kranialen Fenster über der Oberfläche des Gehirns implantiert erfordern ein niedrigeres Verhältnis der Seide/Virus, zuverlässigen Ausdruck, vielleicht wegen verschiedene zerebralen spinalen Flüssigkeit Dynamik oder Protease-Aktivität zu erreichen. Wenn Ausdruck durch eine Erhöhung der wirksame AAV-Konzentrationen erhöht werden kann, ist verringert das Volumen des wässrigen Seide eine plausible Alternative.
Schließlich ist es wichtig, die optischen Komponenten ordnungsgemäß zu speichern und implantieren sie ziemlich bald nachdem sie zubereitet werden. Wir haben gezeigt, dass beschichtete Fasern, die unter Vakuum gekühlt werden für viele Tage vor dem Gebrauch gespeichert werden können. Vakuum-Speicher entfernt Restfeuchte17 die kann die Löslichkeit von Seide Filme, und auch virale Wirksamkeit zu erhalten. Im Idealfall sollten Glasfasern innerhalb von 24 Stunden nach der Herstellung implantiert werden. Allerdings finden wir, dass Seide/AAV-beschichtete Fasern unter Vakuum Antrieb ähnliche Niveaus der Ausdruck gespeichert wenn 7 Tage nach der Herstellung (Abbildung 4 b) implantiert. Im Gegensatz dazu fuhren beschichtete kranialen Fenster und GRIN-Linsen den zuverlässigsten Ausdruck als sie bei Raumtemperatur getrocknet und innerhalb von Stunden der Vorbereitung verwendet. Der Grund für diese Diskrepanz bleibt unklar. Weitere sein Studien erforderlich, um die Zubereitung und Lagerung Bedingungen erweitern die Lagerzeit zu verfeinern.
Seide/AAV-beschichtete kranialen Fenster haben erhebliches Potenzial, weil sie drastisch chirurgische verkürzen und sind extrem einfach in der Herstellung, aber diese Methode derzeit Einschränkungen hat. Beschichtete kranialen Fenster gleichmäßig große Bereiche des Kortex beschriften und genügend Ausdruck in Schicht 2/3 für GCaMP imaging, mit etwas weniger Ausdruck in tieferen Schichten zu fahren. Allerdings stereotaktischen Injektionen robuster Ausdruck zu fahren und bieten mehr Kontrolle über den Layern, die gezielt für den Ausdruck. Zuverlässige Ausdruck wurde nur erreicht, wenn die Dura entfernt wurde. Obwohl die Dura oft für viele 2-Photon imaging Experimente zur Verbesserung der Bild Qualität8entfernt wird, ist es für viele Experimente wünschenswert, Etikettierung in schonender Weise zu erhalten. Wir haben daher unsere Fähigkeit, Seide/AAV, um kortikale Regionen zu kennzeichnen, ohne dass die Dura erforscht. Wir erhalten einige Kennzeichnung, aber es ist möglich, dass dies war eine Folge die Dura im Prozess der Vorbereitung der Kraniotomie zu beschädigen. Weitere Studien sind erforderlich für beschichtete kranialen Fenster verwendet werden, um zuverlässig die Kortex beschriften ohne Entfernen der Dura.
Die Vorbereitung der wässrigen Seide Fibroin aus Kokons von Bombyx Mori ist ausführlich in Rockwood Et Al. beschrieben. (2011) 18. wässrige Seide Fibroin ist jetzt im Handel erhältlich (5 % w/V). Obwohl die meisten unserer Experimente mit wässrigen Seide Fibroin Bestände in unserem Labor (5-7,5 % w/V) vorbereitet durchgeführt wurden, haben wir ähnliche Ergebnisse mit kommerziellen wässrigen Fibroin erhalten. Wässrige Fibroin liegt stabil bei 4 ° C für bis zu 3 Monate, nach denen es von Flüssigkeit in Hydrogel18spontan übergeht. Wir empfehlen, dass Fibroin Aktien ~ 1 mL Aliquot unterteilt und bei-80 ° c gelagert werden Eine 1 mL arbeiten aliquoten (ausreichend für die Beschichtung von Hunderten von Implantaten) kann bei 4 ° C gelagert und verwendet, bis sie anfängt zu gelieren. Seien Sie vorsichtig, nicht schütteln, Wirbel, schütteln oder aggressiv pipette wässrigen Fibroin Scherkräfte zu Gelierung19,20führen können.
Seide/AAV Filme erlauben eine Vielzahl von Expressionsmuster, vom weit verbreiteten kortikalen Ausdruck unter kranialen Fenster, präzise subkortikale Ausdruck an der Spitze von einem kleinem Durchmesser optischen Fasern. Diese Techniken wurden entwickelt, um gemeinsame AAV Expressionsvektoren nutzen aber könnte wahrscheinlich verwendet werden, um andere Expressionsvektoren wie Lentiviren oder Tollwut-Viren ins Gehirn zu zerstreuen. Seide Filme konnten auch in dreidimensionale Formen, virale Freisetzung in Gewebe zu verbessern hergestellt werden. Beispielsweise könnte um zu starken Ausdruck Laufwerk unter kortikalen Windows ohne den Einsatz von einem Durotomy, kranialen Fenster mit Arrays von Seide Mikronadeln beschichtet werden, die der Dura und Freigabe Virus in tiefer kortikalen Schichten21durchbohren würde. Weitere Verfeinerung führt wahrscheinlich zu verbesserten Eigenschaften des Virus Release und neue Anwendungen für Seide/AAV Folien.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren wollen J. Vazquez für Illustrationen, D. Kaplan und C. Preda für Reagenzien und hilfreiche Hinweise und den Labors von B. Sabatini und C. Harvey für in-Vivo Bildgebung zu danken. Mikroskopie wurde ermöglicht durch M. Ocana und Neurobiologie Imaging Center, teilweise unterstützt durch die neuralen Imaging Center als Teil einer National Institute of Neurological Disorders und Schlaganfall (NINDS) P30 Kernzentrum gewähren (NS072030). Diese Arbeit wurde durch die GVR Khodadad Familienstiftung, die Nancy Lurie Marks Foundation und NIH-Stipendien, NINDS R21NS093498, U01NS108177 und NINDS R35NS097284, W.G.R, und ein NIH postdoctoral Fellowship F32NS101889, C.H.C. unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Aqueous silk fibroin | Sigma | 5154-20ML | Aqueous Silk Fibroin (5% w/v) for making films |
| Microinjector to deposit silk/AAV | Drummond | 3-000-207 | Nanoject III nanoliter injector |
| Manipulator to hold implants | Narashige | MM-33 | Micromanipulator |
| Stereoscope to visualize silk deposits | AmScope | SM-6TX-FRL | 3.5X-45X Trinocular articulating zoom microscope with ring light |
| Vacuum chamber to store implants | Ablaze | N/A | 3.5 Quart Vacuum Vac Degassing Chamber |
| Optional, implant holder for storage | N/A | N/A | To store premade optical fibers, drill a grid of ~4 mm-deep holes with a diameter just larger than the ferrule diameter into a plastic block. |
| Optical fiber | Thorlabs | FT200EMT | Ø200 µm Core Multimode Optical Fiber for fiber implants |
| Ferrules | Kientec | FZI-LC-230 | LC Zirconia Ferrule for fiber implants |
| Various materials for manufacturing chronic fiber implants | Various | N/A | For detailed procedure, see Ung K, Arenkiel BR. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of visualized experiments: JoVE. 2012(68). |
| Tapered fiber implants | Optogenix | Lambda-B | Tapered fiber implants |
| GRIN lenses | GoFoton | CLH-100-WD002-002-SSI-GF3 | GRIN lenses |
| Small glass cranial windows | Warner | 64-0726 (CS-3R-0) | Small round cover glass, #0 thickness |
| Large glass cranial windows | Warner | 64-0731 (CS-5R-0) | Small round cover glass, #0 thickness |
| Various materials for manufacturing cranial windows | Various | N/A | For detailed procedure, see Goldey GJ et al. Removable cranial windows for long-term imaging in awake mice. Nature protocols. 2014 Nov;9(11):2515. |
Referenzen
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nature Methods. 11 (3), 338-346 (2014).
- Tervo, D. G., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Jackman, S. L., et al. Silk Fibroin Films Facilitate Single-Step Targeted Expression of Optogenetic Proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Ung, K., Arenkiel, B. R. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of Visualized Experiments. (68), e50004(2012).
- Lowery, R. L., Majewska, A. K. Intracranial injection of adeno-associated viral vectors. Journal of Visualized Experiments. (45), (2010).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocols. 7 (1), 12-23 (2011).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11 (3), 566-597 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Park, J. J., Cunningham, M. G. Thin sectioning of slice preparations for immunohistochemistry. Journal of Visualized Experiments. (3), 194(2007).
- Cao, Y., Wang, B. Biodegradation of silk biomaterials. International Journal of Molecular Sciences. 10 (4), 1514-1524 (2009).
- Jackman, S. L., Beneduce, B. M., Drew, I. R., Regehr, W. G. Achieving high-frequency optical control of synaptic transmission. Journal of Neuroscience. 34 (22), 7704-7714 (2014).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nature Neuroscience. 13 (5), 584-591 (2010).
- Hines, D. J., Kaplan, D. L. Mechanisms of controlled release from silk fibroin films. Biomacromolecules. 12 (3), 804-812 (2011).
- Hu, X., et al. Regulation of silk material structure by temperature-controlled water vapor annealing. Biomacromolecules. 12 (5), 1686-1696 (2011).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Yucel, T., Cebe, P., Kaplan, D. L. Vortex-induced injectable silk fibroin hydrogels. Biophysical Journal. 97 (7), 2044-2050 (2009).
- Wang, X., Kluge, J. A., Leisk, G. G., Kaplan, D. L. Sonication-induced gelation of silk fibroin for cell encapsulation. Biomaterials. 29 (8), 1054-1064 (2008).
- Lee, J., Park, S. H., Seo, I. H., Lee, K. J., Ryu, W. Rapid and repeatable fabrication of high A/R silk fibroin microneedles using thermally-drawn micromolds. European Journal of Biopharmaceutics. 94, 11-19 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten