Method Article
生体内でシルク/AAV 膜を用いた光遺伝学的タンパク質の発現
要約
絹フィブロイン膜を用いた脳にウイルス発現ベクターを配信する方法を紹介します。このメソッドは、シルク/AAV 被覆光ファイバー、光ファイバー、・頭蓋の windows を使用しての表現のベクトルのターゲットを絞った配信できます。
要約
順番にドライブ行動出力のプロセス情報を大きく操作およびニューロンの生体内の活動を監視するための光学的手法の最近開発されたに助けられたがどのように神経回路を理解するクエスト。これらの種類の実験の 2 つの主要なコンポーネントに頼る: 脳に光アクセスを提供する 1) 植込み型デバイスと神経活動の読み出しを提供したり神経細胞の興奮を変更 2) 光感応蛋白質。光感応蛋白質を表現する方法の数がありますが、式は、遺伝的、解剖学的、および時間の精度で制御できるためウイルスのベクトルの脳定位固定装置の注入は現在最も柔軟なアプローチ。ウイルスのベクトルの偉大なユーティリティ、にもかかわらず光インプラント ポーズのサイトに多くの課題にウイルスを提供します。定位ウイルス注射手術手術時間を高め、研究のコストは増大し動物の健康に危険をもたらす要求しています。注射器、高力価ウイルスの塊の突然の配信によって引き起こされる免疫原性炎症、周囲の組織を物理的に損傷することができます。小地域をターゲットにする場合の光インプラントと注射の整列は特に難しい脳の深い。これらの課題を克服するために、絹フィブロインとアデノ随伴ウイルス (AAV) ベクターから成るフィルムと光学インプラントの複数種類をコーティングする方法をについて説明します。フィブロイン、カイコ、繭由来のポリマーをカプセル化でき、生体分子を保護、水溶性フィルムからセラミックスに至るまでの形態に処理することができます。脳に注入、シルク/AAV コーティングは運転式が必要な場所に正確に光学素子と周囲の脳との間のインターフェイスでウイルスをリリースします。このメソッドは、簡単に実装し、大きく生体内神経回路機能の研究を促進することを約束します。
概要
過去 10 年間は、監視および神経活動1を操作するために設計された光に敏感な蛋白質の爆発を生産しています。ウイルスは、脳のこれらの光遺伝学的ツールを表現するための比類のない柔軟性を提供しています。トランスジェニック動物と比較して、ウイルスが生成し、輸送、保管、最新の光遺伝学的ツールの高速実装を許可するはるかに簡単。式は異なる神経細胞の集団を遺伝的対象とすることができます、逆行の輸送用に設計されたウイルスは神経接続2に基づいた式を対象にも使用できます。
ウイルスは通常時間がかかり、困難なことができる定位注射で紹介しています。小領域を正確にターゲットは、多くの注射が必要ですが幅広い分野に式を頻繁運転困難。また、光デバイス、光生体内で提供する脳に植えられたその後ウイルス注入で、インプラントを正しく配置する必要があります。ここでは、絹フィブロイン膜3を使用して注入デバイス周りの組織にウイルスのベクトルを提供するための簡単に実装手法について述べる。絹フィブロインは市販、神経組織をよく容認を様々 な特性を持つ素材を生成する使用ことができます。絹フィルム マイクロインジェクション ピペットのような一般的な検査機器を使用してインプラントに適用することができます。 またはピペットを手します。シルク/AAV フィルム 2 つの外科プロシージャのための要件を排除し、ウイルスによる発現は光のインプラントに正しく配置されていることを確認します。結果の式は、繊維と定位注射よりも繊維のトラックに沿って以下の不要な式の結果の先端に制限されます。
小さな繊維の先端に対象式に加え、シルク/AAV 映画を広範なドライブを使用できます (> 直径 3 mm) 頭蓋窓下に皮質表現。センサー蛍光活動 2 光子励起イメージング体内運転感覚と認知処理における神経活動の役割を評価するため不可欠なツールとなっています。しかし、制服を運転する多くの実験者の広範な皮質上式で複数の注射を実行します。これらの注射は非常に時間がかかることができ、ビューのフィールド間で一貫性のない表現につながることができます。対照的に、頭蓋 windows のシルク/AAV コーティングが製造し、手術に必要な時間を大幅に削減、最も著しくドライブ式数百ミクロン皮質表面の下の非常に簡単です。
プロトコル
次のガイドライン、米国 NIHのケアおよび実験動物の使用のためのガイドで説明されている動物のケアに関するハーバード大学常任委員会によって承認されたプロトコルに従い動物を含むすべての実験を行った。どちらの性別 (6-15 週齢) の大人の c57bl/6 マウスは、すべての実験に使用されました。
1. 水溶液の絹フィブロインを取得します。
- 準備または水溶液絹フィブロイン (5 7.5 %w/v) を購入します。
2. 式の AAV のベクトルを持つ水性シルクをミックスします。
- 光遺伝学的タンパク質や好みの蛍光指示薬を駆動する AAV 発現ベクターを選択します。
注: シルク/AAV インプラントまだ堅牢な式を運転中に適用する必要がありますの量を最小限に抑える株式価 AAV (在庫通常ベクター コアから得られた抗体は周辺 10 ~13 gc/mL) お勧めします。 - 直前のコーティングのインプラント、AAV の因数を解凍し、5 7.5% 水溶液絹フィブロイン (この混合物があるというシルク/AAV と組み合わせます。200 μ L PCR チューブに水溶性フィブロイン、AAV を直前のアプリケーション (頭蓋 windows 使用 1:4) 1:1 の比率で混ぜます。フィブロイン、AAV を徹底的にミックスするソリューションに数回軽くピペットします。
- 氷の上のシルク/AAV の混合物は使用前に保ちます。
3. 作製とシルク/AAV コーティング デバイスのストレージの機器を準備します。
- 被覆光ファイバーの屈折率分布 (笑) レンズ (図 1 2) 機器を購入します。
- 安定したフェルール ホルダーを構築します。セラミック フェルールを保持するには、¼"シート アクリルのブロックで 1.25 mm の穴をドリルします。場所でフェルールを保持する側からのセットのネジを挿入する穴をタップします。
注:この目的のため、クランプを使用できます。 - 光ファイバー (脳定位固定装置またはその他の精度マイクロマニピュレーター) を移動するサブミリ精度を有するマニピュレーターを位置します。
- ガラスシリンジの位置に安定したホルダーを組み立てます。
- 堅実を使用して、光ファイバーとシルクの液滴を視覚化します。
- 光ファイバーを照らす光源を配置します。
- 安定したフェルール ホルダーを構築します。セラミック フェルールを保持するには、¼"シート アクリルのブロックで 1.25 mm の穴をドリルします。場所でフェルールを保持する側からのセットのネジを挿入する穴をタップします。
- 頭蓋ウィンドウ (図 3) をコーティングする装置を準備します。
- 任意の P10 pipettor を選択します。
- 蓋付きコンテナーを取得します。
注: シリコーンの下で任意のコンテナーが示唆された、柔らかい底を容易に頭蓋の windows を持ち上げます。
- 完成したインプラント (図 4) を格納する機器を準備します。
- 小型 (1 5 L) 真空チャンバーを取得します。
- 4 ° C の冷却装置でインプラントを格納する領域があることを確認します。
4. シルク/AAV フィルムをデバイスに適用します。
- 光ファイバー先端にドライブ焦点式に光ファイバーをコーティング
- 前述4として慢性的な繊維インプラントを準備します。
- 使用前にリンスはエタノール、インプラントし、確実に超純水と光ファイバーはきれい。
注: 絹フィルムはガラスの表面をきれいにより確実に従います。 - フェルールを保持するデバイスを準備します。典型的な 1.25 mm 径フェルール、1/4 インチ ~1.3 で、透明なアクリル ブロックの使用は mm 穴とネジ穴 (図 1 a) の場所にしっかりとインプラント側から入力をタップします。
- 脳定位固定装置 (またはサブミリ精度で任意の操作ソリューション) にフェルール ホルダーの装備、マイクロインジェクター マウント。上記のガラスシリンジ フェルール ホルダーを置き、下からシルク/AAV の混合物を適用します。
注: これは上から大量のアプリケーションが先端に制限されなかったシルク/AAV になるためにです。ただし、しかし、多くの小さな連続ボリューム上からまたは下のアプリケーションは、先端に限られている (我々 は下から適用することを好む) AAV/シルク預金を生成できます。 - キャピラリー ホウケイ酸ガラスから標準的な頭蓋内インジェクション ピペットを引き出します。
- やすくには
- 希望の直径のきれいなフラット チップの注入ヒントを生成、それぞれの手で 1 つのピペットなどを保持し、必要な休憩場所で他のピペットをスコアに 1 ピペットに厚くテーパー部を使用します。
- 鋸の動き (ガラス-ガラスのスコアリング方法) で前後をこすり。
- ピペットを得点した後に、決別を達成するために他のピペットのボディと得点のピペットの先端に穏やかな圧力を適用されます。
- 光面の明確なビューを提供する万国実体写真を配置します。
注: 倍率は光ファイバーの顔上インジェクション ピペットを正確に配置するための十分なはずです。 - 下向きの光ファイバーの脳側のホルダーに繊維のインプラントを挿入します。
- シルク/AAV のソリューションは、任意の標準的な頭蓋内注入5に関してはインジェクション ピペットをロードします。ピペットの目詰まりに起因する損失に対応する余分な 〜 30% プラス、作られているインプラントの数に必要な金額をロードします。たとえば、10 のインプラントが行われる場合 100 nL 預金を読み込んで、~1.3 μ L を撤回します。
注: ピペットを詰まらせることができますの噴出の間にピペット チップでシルク/AAV の乾燥があります。大径のピペット (50-100 μ m) が目詰まりしにくいです。下駄は、湿紙のワイプまたはアルコール綿棒でピペットの先端を優しくブラッシングで外れていることができます。 - 触れる、またはほぼ光ファイバーの表面の中心に触れるまで、インジェクション ピペットを操縦します。シルク/AAV ソリューションの 10-20 nL を取り出します。ピペットを撤回します。
注: 配信レートは、重要ではありませんが、典型的な率は 5-20 nL/s。 - フラット フィルム 〜 1 分以内に乾燥する液体のドームのように平らな面にシルク/AAV の塊を観察(図 1 b)。
- 手順 4.1.9-4.1.10 シルク/AAV の希望の金額まで堆積 (20-200 nL ほとんどのアプリケーションのための合計) を繰り返します。複数のインプラントを準備するとき 1 つインプラントにシルク/AAV を適用し、コートに戻る前に他のインプラントに移動最初に。
- 1 h は、インプラントを移動する前に乾燥を可能にします。
- ~ 125 Torr (で-25 宿泊の真空乾燥。Hg)、4 ° C真空チャンバー内に全体フェルール ホルダーを置くことによってこれを行います。
- 高倍率の顕微鏡の下で得られた絹フィルムの位置や形状を評価します。フィルムが光ファイバー表面の先端に限られていることを確保するため、比較的薄く (> 100 μ m)、および対称 (図 1)。
注: 大規模または非対称のシルク/AAV 映画を注入 (図 1) の中に繊維から取り除く場合があります。問題の最も一般的な原因は、多くの小さなボリュームの逐次適用ではなく、単一の大きなボリュームのアプリケーションから発生します。
- コーティング テーパ光ファイバーを光軸に沿ってドライブ式
- テーパ光ファイバー インプラントを入手し、インジェクター (図 2 a) に直角になるように、テーパー光ファイバーが横方向に配置されていることを除いて、手順 4.1.2-4.1.8 を実行します。テーパー光ファイバー上のインジェクターを配置します。
注: は、表面張力をインジェクション ピペットに戻ってジャンプまたはテーパー光ファイバーに移行する水滴が発生する傾向があるので、課題を追加テーパファイバー ポーズに液滴を読み込みします。この問題を克服するインジェクション ピペットが詰まらせるリスクが増加することも小さくインジェクション ピペット (30-50 μ m 径)。表面張力により液滴表面面積の領域に付着する傾向があるので、最適なインジェクション ピペット サイズ テーパー光ファイバーと時折詰まらせるのため、自分の許容範囲のサイズに依存です。 - テーパの初めに光ファイバーの側面に対してシルク/AAV インジェクション ピペットを配置します。インジェクション ピペットは、光ファイバーを触れているかどうかを確認します。
- 20 を取り出しシルク/AAV の nL をコーティング プロセスを開始します。液滴が光ファイバーを遵守し、繊維/ピペットのインターフェースのままを確認します。シルク/AAV 乾燥としてファイバー先端の終わりに向かって液滴を優しく芯 (~ 45 s)。注入ピペット ピペット チップの目詰まりを避けるために乾燥の液滴との接触を保ちます。
注: 各預金テーパファイバー (図 2 b) の約 400 μ m をコートする必要があります。 - 最初の塊は、ほぼ完全に乾燥している、別の 20 をイジェクト nL コンティニュのテーパーに沿って液滴をウィッキングします。
注: 液体のシルクに準拠します乾燥シルク ピペットと液滴のアンカーの一方の端は、テーパに沿って移動します。 - シルク/AAV の少量を取り出しとテーパの側をソリューションを徐々 に引くことによって 4.2.4 のステップを繰り返します。5-6 噴出で 2.5 mm のテーパー面を走査する十分です。
- 繊維のすべての辺の周囲より一貫した式をドライブするには、光ファイバーを回転させるし、手順 4.2.2-4.2.5 を繰り返して、シルク/AAV の希望の金額を預託されています。
- 吊り鎖の乾燥した絹/AAV を超えた先端、慎重にストランドをはさみでカットか戻ってストランドを曲げるし、ファイバーのテーパに付着する放出ピペットを使用します。
- 1 h は、インプラントを移動する前に乾燥を可能にします。
- 4 ° C で真空乾燥一晩全体フェルール ホルダーは、真空チャンバー内に配置できます。
- 高倍率の顕微鏡の下で得られた絹フィルムの位置や形状を評価します。
注: 映画は制服に完全にする必要はありませんが、バンプ注入 (図 3) の間に周囲の組織への損傷を最小限に抑えるために、ファイバーの表面を越えて以上 100 μ m を拡張する必要はありません。フィルムのサイズを最小限に抑えるため、後続の預金を行う前に各液滴が完全に乾くことが重要です。
- テーパ光ファイバー インプラントを入手し、インジェクター (図 2 a) に直角になるように、テーパー光ファイバーが横方向に配置されていることを除いて、手順 4.1.2-4.1.8 を実行します。テーパー光ファイバー上のインジェクターを配置します。
- コーティング GRIN レンズをインプラントします。
- GRIN レンズ6,7を取得し、手順 4.1.2-4.1.8 を繰り返します。インジェクターは、上記マウントできます。
- 単一の放出 (1.0 mm 径レンズ用 1 μ L) にシルク/AAV を入金します。
注: これは、レンズの表面に付着、均一な膜 (100-200 μ m 厚) を生成する乾燥液体のドームになります。ただし、単一の大規模な放出がない均等に乾燥、GRIN レンズの端に近い厚いフィルムを作り出すことを試みる複数小さい液滴 (100-200 nL) を堆積 (入金前に乾燥する各液滴が可能レンズの表面の中央に次には) フィルムが視野の中心に式を駆動することを確認します。 - 1 h は、インプラントを移動する前に乾燥を可能にします。
- フィルムがレンズの表面を覆うように高倍率の顕微鏡の下で得られた絹フィルムの位置や形状を評価します。
- 頭蓋窓からすをコーティング
- 準備のガラスの付着の 2 つの 3 mm 径で頭蓋 windows ラウンド coverslips (第 1 厚さ) 光学接着剤と 1 つの 5 mm 径ウィンドウ (詳細については、ゴールディら20148を参照してください)。
- シルク: ウイルス映画の絹の総量を減らすために 1:4 の割合でミックスします。絹の余分な量は注入後頭蓋窓下には溶解しません。滴定実験比および目的の発現プロファイルを与える量を確認する必要があります。
- 手のピペット 3 mm (脳向き) カバーガラスの表面に 5 μ L の液滴。液滴は全体のガラス表面 (図 3) をカバーする広がる必要があります。
- 2-3 h は、ウィンドウを移動する前に乾燥を可能にします。
5. シルク/AAV コーティングのインプラント
- (図 4 a) を使用する前に冷却真空デシケータ (4 ° C ~ 125 Torr) でシルク/AAV コート光ファイバーを格納します。
- 注入後完全に溶解する大きな絹フィルム真空下で保存が失敗するように頭蓋窓と真空下で GRIN レンズを格納しないようにします。インプラント頭蓋 windows とにやにや笑いレンズの乾燥、直後後や製造大気圧および 4 ° C で保存されている場合の日以内
6. 注入デバイス
- インプラント手術のため前述4として動物を準備します。
- 簡単に、ケタミン ・ キシラジン 100/10 mg/kg の腹腔内注入マウスを麻酔し、穏やかなつま先ピンチを使用して麻酔の深さを確認します。インプラント部の頭蓋骨を削るし、きれいにヨードとアルコール頭皮。
- 脳定位固定装置で動物をマウントし、酸素とイソフルラン (1-2%) の混合物を用いた麻酔を補います。関心の領域に頭皮の切開をするし、開頭術、インプラントを収容できる大きさを実行します。
- インプラント光ファイバー9と microendoscope は、以前公開された手順に従って10をレンズします。ハンドル インプラント、注意して, 不完全な開頭手術することによって頭蓋骨の端に引くインプラント シルク/AAV 預金をノックすることができます。ゆっくりと脳にインプラントを下げる (~ 2 mm/分)。
- インプラント頭蓋 windows8を以前説明したよう。ウィンドウのコーティング面に触れるし、強制経口投与を実行している場合、これはウイルスを洗い流すことができる流体でウィンドウを洗浄を避けるためしません。最大の表現を達成するために、痛覚を実行します。
7. 式の評価とトラブルシューティング
- 2 ~ 3 を許可するウイルス発現タンパク質の発現を評価する式をドライブし、リン酸の 4% パラホルムアルデヒドで intracardial 潅流を実行するウイルスの週間バッファー蛍光の食塩11とプロセス脳組織顕微鏡12。
- 光の蛍光タグ付きタンパク質の発現パターンをイメージさせる蛍光顕微鏡を使用して、式を評価します。
- 表現のレベルが不足している場合は、シルク/AAV コーティングの容量を高めるか、または可能であれば高い力価のウイルスを使用してコーティングのウイルスの量を増やします。
結果
式の運転でシルク/AAV の映画の成功を評価するためには、動物に注入後 2-3 週間を灌流し、関心の領域から脳切片を作製しました。光の蛍光タグ付きタンパク質 (ChR2 YFP) の蛍光画像には、式 (図 1) の範囲のメジャーが用意されています。典型的な光ファイバー (230 μ m 径) は 200 を容易に収容することができますシルク/AAV の nL。練習では、実験者は注入された線維 (図 5) の先端周り信頼性の高い表現を実現できます。
シルク/AAV コーティング頭蓋 windows によって駆動式を評価するために注入後 7-10 日から始まるイメージングを開始します。可視化、2 光子イメージングを使用しているが、蛍光を CCD イメージングなど他の方法も使えます。コーティングされた頭蓋窓 2 つの可能な問題は不十分な表現と溶解し、フィールドのビューを隠してしまう失敗絹フィルム。式を増やすには、埋め込みウィンドウ、および/または映画の中のウイルスの量を増やす前に durectomy を実行することをお勧めします。シルクと株式価 AAV の 1:4 の混合物をそれぞれ使用して最高の表現を実現しました。これ、ウイルス粒子数定位注射で使用される通常よりも大幅に大きいが、手術時間が減少カウンター ウイルスの限界の追加費用です。一方、絹フィルムがウィンドウの下に溶解する場合は、ウィンドウを塗るに使用するシルクの量をさらに削減します。コーティングされた windows の絹の総量は 10-100 倍繊維インプラントよりも、映画は少ないが組織に埋め込まれ、従っていない可能性がありますプロテアーゼ活性レベルが同じ絹フィルム13を溶かすことができますよりも。ただし、いくつかのシルクの存在はウイルスだけで作られた映画は手術中に間質性の液体によって洗い流さので windows3、可能性があります下に式を達成するために不可欠です。

図 1: 絹/AAV 膜を光ファイバーに適用します。(A)慢性繊維インプラント配置ファイバー側ダウン ホルダー (インセット) に XYZ の訳者にマウントされています。繊維以下固定マイクロインジェクター分配シルク/AAV 繊維のヒントにするため。堅実では、プロセスの可視化をことができます。(B)は、少量 (10-20 nL) の光ファイバー先端にシルク/AAV を適用します。ボーラスを取り出し後、ピペットを撤回でき、〜 60 フラット フィルムを乾燥する液滴の s。必要なボリュームがファイバー先端に適用されるまで、プロセスを繰り返します。(C)検査シルク コーティングです。最適なコーティング繊維顔をそれらの繊維から取り除くになりやすい (右) からフロアタム不適切なコーティング中に (左) ファイバー先端に集中。(D)代表的な繊維膜 200 シルク/AAV の nL と結果 AAV 駆動の ChR2-YFP 式注入後 2 週間。左側のコンパクトなシルク/AAV コーティングを右側コーティング繊維の顔過去突出してシルク/AAV は、注入中に光ファイバーに付着しなかったのでほとんどない式、可能性が高い結果、堅牢な式になったスケール バー 0.2 mm (繊維) と 1.0 mm (脳スライス)。この図の拡大版を表示するのにはここをクリックしてください。

図 2: インプラント テーパファイバーをコーティングするためのセットアップします。(A)ガラスシリンジ テーパファイバー ホルダーの上にマウントされて、テーパファイバーは取り出し注射器を直交に配置されます。最も広いの(B)の開始は (インセット) をポイントし、テーパのポイントに向かって放出注射器を移動させながら小さなボリュームを排出します。テーパの長さに沿って連続塗装でこの結果します。(C)代表的なテーパー繊維混合の可視化を支援する高速グリーン シルクでコーティングします。この図の拡大版を表示するのにはここをクリックしてください。
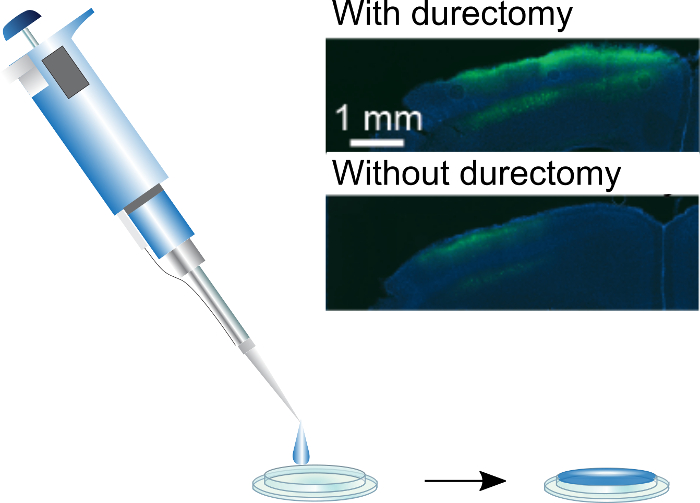
図 3: 頭蓋 windows を塗装します。シルク/AAV は手ピペットを使用して適用済みの頭蓋 windows をすることができます。標準 3 mm 径の] ウィンドウは、5 μ L の液滴は、フラット フィルムをゆっくりと乾燥でコーティングすることができます。Inset: GCaMP6f 式シルク/AAV コーティング頭蓋 windows durectomies と注入に起因。この図は、ジャックマンらから適応されています。(2018)3.この図の拡大版を表示するのにはここをクリックしてください。

図 4: インプラントをコーティングしたシルク/AAV を格納します。(A) 残留水分を除去し、ウイルスの有効性を保持するインプラントは 4 ° C まで使用、真空下で格納する必要があります。このように保存されているインプラントは、少なくとも 7 日間実行可能に残る。4 シルク/AAV の結果 (B) 式は貯蔵 7 日後注入繊維をコーティングしました。この図の拡大版を表示するのにはここをクリックしてください。
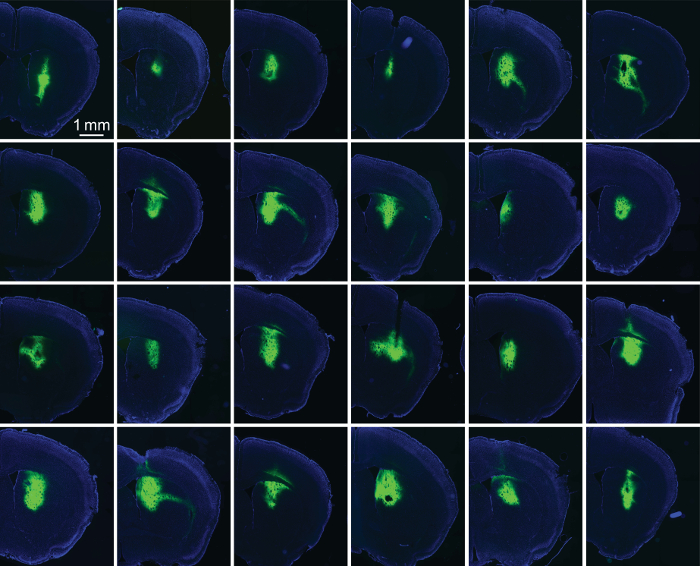
図 5: シルク/AAV-GFP 被覆光ファイバー確実にドライブ式。24 連続線条体からのスライスの蛍光画像のインプラントします。各インプラントは 1:1 の 100-400 nL とシルク/AAV-GFP をコーティングしました。このコホートのインプラントは、インプラント サイト (この場合は背側線条体) で式を制限するシルクの機能を示します。GFP 蛍光は緑色で示されますDAPI 染色が青色で表示されます。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
シルク/AAV の optogentic 蛋白質の表現を対象とするは、現在使用しているアプローチの限界を克服します。多くの研究は、正常に光遺伝学的蛋白質を表現する AAV 注射を使用して、式光ファイバーの先端にテーパーの繊維の長さの周りの地域に、GRIN レンズの表示領域に合わせて挑戦です。光学部品、光式芯ズレ、ため定位注射が信頼性の高い、することができ、多くの実験は失敗します。ここで述べる方法をラベリング シルク/AAV は、この問題を解決します。2 番目の手術手順を排除することによって、場合によっては 2 回目の手術の必要性を排除することで、手順も簡単になります。それは困難な頭蓋窓下に広範な表現を取得するウイルスを使用することができ、実験者は通常、複数の場所でウイルスを注入する長い手術を実行します。シルク/AAV コーティング頭蓋窓単に大規模な皮質領域に広範な表現を取得する機能は、多くの侵襲的な注射の必要性を排除する簡素化です。
シルク/AAV メソッドのもう一つの潜在的な利点はそれがウイルス注射と比較して神経組織における以下の炎症を誘発する可能性があります。(ただし、このような潜在的な合併症は、通常、細胞、回路プロパティ14,15を変更する可能性のある反応性アストロサイトーシスなどの炎症反応を引き起こす可能性が高価 AAV を脳に注入無視)。絹フィルム独自の13にほとんど免疫反応を誘発する、シルク/AAV 映画が多く時間または数日間の16、周囲の組織にウイルスの負荷を下げるし、免疫原性応答を減らす可能性のあるコース上ウイルスを解放する予定です。デバイスの注入が AAV 注入による先行は、従来のアプローチと注入し注射から炎症反応が生じます。従来のアプローチとシルク/AAV 全体的なシルク/AAV 膜を低減するかどうかを決定する方法を体系的に比較することが望ましいことが将来的に炎症性応答。
いくつかの手順は、シルク/AAV フィルムの使用の成功にとって重要です。最も重要なは、光ファイバーのコーティングは前述の方法で慎重に行う必要があり。、正しい場所に映画がコンパクトであることを確認するには顕微鏡下で目視による乾燥のフィルムの場所を慎重に評価する必要があります。・光ファイバーの表面に付着します。光ファイバーの両側に任意のシルク/AAV は興味、地域外の表現につながるし、繊維の顔の外へはみ出て不格好のフィルムがない式や信頼性につながる注入中に離れる可能性があります。シルク/AAV を植込み型デバイスに適用することができる任意の材料の使用に適応について述べる方法は、すぐに利用できる、シルク/AAV の小さなボリュームの正確な成膜を可能です。
少し練習は、正確で再現性のある結果を達成するために必要です。繊維のトラックに沿って表現が見られる場合は、絹フィルム乾燥繊維顔ではなく、光ファイバーの側面にあることそうです。製造工程を繰り返し、膜は繊維の側面に乾燥症状の乾燥したインプラントを密接に検査します。シルク/AAV 薄膜は光学的に透明なので、シルク染料 (高速グリーンまたは同じような染料) より良い結果フィルム (図 2) の形状を視覚化すると混合を適用することの練習を助けるかもしれない。式がない場合、絹フィルムが注入の間にファイバー先端から剥がれと考えられます。インプラントの際株式高力価ウイルスの使用をお勧めします。光ファイバーのこれは細径ファイバーに適用する必要があります合計音量を下げます。コーティングのサイズが場合の懸念は、蒸着液滴の完全乾燥を許可する各 10 nL アプリケーション間より長く待っている検討してください。シルク/AAV 液滴は暖かいランプの下でより速く乾燥します。頭蓋の windows 用高力価ウイルスぴあまたは硬膜に適切なウイルス負荷を供給する必要があります。特定の種類のインプラントがシルクを溶解し、AAV を他よりもより容易にリリースします。我々 は、脳の表面に注入した頭蓋の windows がおそらくおかげで異なる脳脊髄流体またはプロテアーゼ活性の信頼性の高い表現を達成するためにシルク/ウイルスの割合を必要とすることを発見しました。水性シルクのボリュームを下げる式ことはできません効果的な AAV の濃度の増加によって増加する場合は説得力のある選択肢です。
最後に、それは重要な光学部品を適切に格納し、それらを非常にすぐにインプラント後、準備が整います。私たちを使用する多くの日前に真空下で冷蔵がコーティングされた繊維を格納できることを示しています。真空貯蔵装置は、残留水分17絹フィルムの溶解度を減らすとまたウイルス有効性を維持するためを削除します。理想的には、光ファイバーは、製造後 24 時間以内注入する必要があります。しかし、我々 はシルク/AAV 被覆繊維が作製 (図 4 b) 後 7 日を注入したときの式の真空ドライブと同様のレベルで格納されているを見つけます。対照的に、コーティングされた頭蓋 windows と GRIN レンズは、室温で乾燥され、準備の時間の内で使用されるとき最も信頼性の高い式を行なった。この格差の理由は不明します。さらなる研究は、保管期間をさらに延長するための準備・条件を絞り込む必要があります。
彼らは大幅に手術時間を短縮し、製造に非常に簡単ですが、現時点では、このメソッドは制限、シルク/AAV コーティング頭蓋 windows からかなりの可能性があります。コーティング頭蓋 windows は一様に皮質の広い領域にラベルを付けるし、GCaMP イメージング、ややより少ない表現のより深い層でのレイヤー 2/3 で十分な式をドライブします。定位注射より強力な式をドライブし、式のターゲット層をより細かく制御を提供します。信頼性の高い表現は、硬膜が削除されたときにのみ達成されました。硬膜は8イメージ品質を改善するために多くの 2 光子イメージング実験のため削除されます多くの場合、多くの実験だ低侵襲の方法でラベルを取得することが望ましい。そのため硬膜を削除せず皮質領域をラベルにシルク/AAV を使用する当社の能力について解説しました。いくつかの分類を行い、開頭手術の準備の過程で硬膜の損傷の結果今回も可能です。さらなる研究は、確実に硬膜を削除せず皮質をラベルに使用する被覆頭蓋 windows に必要です。
カイコの繭から水性絹フィブロインの準備は、ロックウッドらで詳しく説明します。(2011 年)18. 水性絹フィブロインは今市販 (5 %w/v)。我々 の実験のほとんどは、ラボ (5 7.5 %w/v) で作製した水溶性シルクフィブロイン株式を使用して行ったが商業水フィブロインを使用して同様の結果を得た。水溶性フィブロインは、最大 3 ヶ月, その後自発的に液体からに遷移ハイドロゲル184 ° C で安定です。フィブロイン株式が 〜 1 mL の約数に分けられ、-80 ° C で保存をお勧めします(コーティングのインプラントの何百もの十分な) 1 mL 作業因数は 4 ° C で保存し、ゲル化開始まで使用できます。気をつけて振る、渦、扇動またはせん断力は、ゲル化19,20につながる可能性として積極的に水溶性フィブロインをピペットします。
シルク/AAV の映画は、細径光ファイバーの先端に正確な皮質下式に頭蓋の windows の下で広範な皮質表現から表現パターンの広い範囲を許可します。これらの技術は、共通 AAV 発現ベクターの利点を取るために開発されましたが、脳にレンチや狂犬病ウイルスのような他の表現のベクトルを分散させるためにされる可能性が高い可能性があります。絹フィルムは、組織へのウイルスのリリースを改善するために三次元の形状に製造できます。たとえば、ドライブ、痛覚の使用なしにウィンドウを皮質下に強い表現するために、頭蓋 windows は深い皮質層21硬膜とリリースのウイルスを書き入れないシルク マイクロニードルの配列でコーティングする可能性があります。さらなる改良は、ウイルスのリリース、およびシルク/AAV フィルム用の新しいアプリケーションの改良されたプロパティに可能性があります。
開示事項
著者が明らかに何もありません。
謝辞
著者試薬と有用なガイダンス、および生体内イメージングのサバティーニ B. と c. ハーヴェイのラボ イラスト j. バスケス、d. カプラン、C. オイゲンプレダを感謝したいです。M. Ocana ・一部、国立研究所の神経疾患として神経イメージング研究センター部分で支え神経イメージング センターによって可能になった顕微鏡とストローク (NINDS) P30 コア センター (NS072030) を与えます。この仕事を受けました GVR 帰れない家族財団、ナンシー Lurie マーク財団と NIH の補助金、NINDS R21NS093498、U01NS108177、W.G.R に組織プラスミノーゲンアクテベータ R35NS097284、F32NS101889 C.H.C. に NIH ポスドク研究員プログラム
資料
| Name | Company | Catalog Number | Comments |
| Aqueous silk fibroin | Sigma | 5154-20ML | Aqueous Silk Fibroin (5% w/v) for making films |
| Microinjector to deposit silk/AAV | Drummond | 3-000-207 | Nanoject III nanoliter injector |
| Manipulator to hold implants | Narashige | MM-33 | Micromanipulator |
| Stereoscope to visualize silk deposits | AmScope | SM-6TX-FRL | 3.5X-45X Trinocular articulating zoom microscope with ring light |
| Vacuum chamber to store implants | Ablaze | N/A | 3.5 Quart Vacuum Vac Degassing Chamber |
| Optional, implant holder for storage | N/A | N/A | To store premade optical fibers, drill a grid of ~4 mm-deep holes with a diameter just larger than the ferrule diameter into a plastic block. |
| Optical fiber | Thorlabs | FT200EMT | Ø200 µm Core Multimode Optical Fiber for fiber implants |
| Ferrules | Kientec | FZI-LC-230 | LC Zirconia Ferrule for fiber implants |
| Various materials for manufacturing chronic fiber implants | Various | N/A | For detailed procedure, see Ung K, Arenkiel BR. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of visualized experiments: JoVE. 2012(68). |
| Tapered fiber implants | Optogenix | Lambda-B | Tapered fiber implants |
| GRIN lenses | GoFoton | CLH-100-WD002-002-SSI-GF3 | GRIN lenses |
| Small glass cranial windows | Warner | 64-0726 (CS-3R-0) | Small round cover glass, #0 thickness |
| Large glass cranial windows | Warner | 64-0731 (CS-5R-0) | Small round cover glass, #0 thickness |
| Various materials for manufacturing cranial windows | Various | N/A | For detailed procedure, see Goldey GJ et al. Removable cranial windows for long-term imaging in awake mice. Nature protocols. 2014 Nov;9(11):2515. |
参考文献
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nature Methods. 11 (3), 338-346 (2014).
- Tervo, D. G., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Jackman, S. L., et al. Silk Fibroin Films Facilitate Single-Step Targeted Expression of Optogenetic Proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Ung, K., Arenkiel, B. R. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of Visualized Experiments. (68), e50004(2012).
- Lowery, R. L., Majewska, A. K. Intracranial injection of adeno-associated viral vectors. Journal of Visualized Experiments. (45), (2010).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocols. 7 (1), 12-23 (2011).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11 (3), 566-597 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Park, J. J., Cunningham, M. G. Thin sectioning of slice preparations for immunohistochemistry. Journal of Visualized Experiments. (3), 194(2007).
- Cao, Y., Wang, B. Biodegradation of silk biomaterials. International Journal of Molecular Sciences. 10 (4), 1514-1524 (2009).
- Jackman, S. L., Beneduce, B. M., Drew, I. R., Regehr, W. G. Achieving high-frequency optical control of synaptic transmission. Journal of Neuroscience. 34 (22), 7704-7714 (2014).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nature Neuroscience. 13 (5), 584-591 (2010).
- Hines, D. J., Kaplan, D. L. Mechanisms of controlled release from silk fibroin films. Biomacromolecules. 12 (3), 804-812 (2011).
- Hu, X., et al. Regulation of silk material structure by temperature-controlled water vapor annealing. Biomacromolecules. 12 (5), 1686-1696 (2011).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Yucel, T., Cebe, P., Kaplan, D. L. Vortex-induced injectable silk fibroin hydrogels. Biophysical Journal. 97 (7), 2044-2050 (2009).
- Wang, X., Kluge, J. A., Leisk, G. G., Kaplan, D. L. Sonication-induced gelation of silk fibroin for cell encapsulation. Biomaterials. 29 (8), 1054-1064 (2008).
- Lee, J., Park, S. H., Seo, I. H., Lee, K. J., Ryu, W. Rapid and repeatable fabrication of high A/R silk fibroin microneedles using thermally-drawn micromolds. European Journal of Biopharmaceutics. 94, 11-19 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved