Method Article
אין ויוו יישוב ביטוי של חלבונים Optogenetic באמצעות סרטי משי/AAV
In This Article
Summary
כאן, אנו מציגים שיטה להעברת נגיפי ביטוי וקטורים למוח באמצעות סרטי משי fibroin. שיטה זו מאפשרת משלוח ממוקד של וקטורים ביטוי באמצעות סיבים אופטיים מצופים משי/AAV, סיבים אופטיים מחודדות וחלונות הגולגולת.
Abstract
המסע להבין את המעגלים העצביים כמה פרטי התהליך על מנת כונן התנהגות פלט בגילויים במידה רבה על ידי שיטות אופטי שפותחה לאחרונה עבור טיפול ומעקב אחר הפעילות של הנוירונים vivo בתוך. סוגים אלה של ניסויים מסתמכים על שני מרכיבים מרכזיים: 1) מושתלת מכשירים המספקים גישה אופטי אל המוח, וחלבונים 2) רגישים לאור משנה דעתנית עצביים או לספק readout פעילות. עצבית. ישנן מספר דרכים לבטא חלבונים רגישים לאור, אך הזרקת stereotaxic של וקטורים ויראלי היא כיום הגישה הגמישה ביותר כי הביטוי יכול להיות נשלט עם דיוק גנטי אנטומי, זמני. למרות השירות נהדר של וקטורים ויראלי, העברת הוירוס לאתר של שתלים אופטי מציבה אתגרים רבים. וירוס stereotaxic זריקות דורשים ניתוחים להגדיל את זמן הניתוח, להגדיל את העלות של מחקרים, ולא להוות סיכון לבריאות של החיה. הרקמה שמסביב, אליו יכול להיפגע פיזית על ידי המזרק הזרקה, ועל ידי immunogenic דלקת הנגרמת על ידי מסירה פתאומי של סיילין וירוס כייל גבוה. יישור זריקות עם שתלים אופטי הוא קשה במיוחד כאשר המיקוד אזורים קטנים עמוקים במוח. כדי להתגבר על האתגרים הללו, אנו מתארים שיטה ציפוי מספר סוגים של שתלים אופטי עם סרטים מורכב fibroin משי ווקטורים Adeno-הקשורים ויראלי (AAV). Fibroin, פולימר נגזר מן הגולם של טוואי המשי, ניתן לכמס להגן על מולקולות ואני יכול להיות מעובד לצורות ועד סרטים מסיסים קרמיקה. מושתל לתוך המוח, משי/AAV ציפויים שחרר וירוס על הממשק בין רכיבים אופטיים המוח שמסביב, נהיגה ביטוי בדיוק איפה הוא נחוץ. שיטה זו מתבצעת בקלות, ומבטיח להקל במידה רבה על ויוו מחקרים של מעגל עצבי פונקציה.
Introduction
בעשור האחרון יצר פיצוץ של חלבונים רגישים לאור מהונדסים עבור ניטור וטיפול פעילות עצבית1. וירוסים מציעים לו גמישות מרבית לביטוי כלים אלה optogenetic במוח. בהשוואה לבעלי חיים מהונדס, וירוסים הם הרבה יותר קל לייצר להעביר, לאחסן, המאפשר יישום מהיר של הכלים optogenetic החדש. ניתן לפלח ביטוי גנטי לאוכלוסיות עצביים שונים, וירוסים תוכנן עבור העברת רטרוגרדית ואפילו יכולה לשמש למטרה הביטוי מבוסס על קישוריות עצביים2.
הנגיפים מוחדרים בדרך כלל עם זריקות stereotaxic, אשר יכול להיות זמן רב ומאתגר. בדיוק פילוח אזורי קטן יכול להיות קשה, בזמן נהיגה ביטוי מעל אזורים רחבים לעיתים קרובות דורש זריקות רבות. יתר על כן, כאשר מכשיר אופטי לאחר מכן מושתל לתוך המוח כדי לספק אור ויוו, השתל חייב כראוי ליישר עם הזריקה ויראלי. כאן, אנו מתארים שיטה ליישם בקלות להעברת נגיפי וקטורים לרקמות מסביב התקן מושתל באמצעות סרטי משי fibroin3. Fibroin משי זמינים מסחרית, נסבל היטב על ידי רקמות עצביות, והוא יכול לשמש כדי לייצר חומרים עם מאפיינים מגוונים. סרטי משי שניתן להחיל על שתלים בעזרת ציוד מעבדה נפוץ כמו פיפטות microinjection או יד מדי סוכר. סרטי משי/AAV לחסל את הדרישה שני ניתוחים ולהבטיח כי הביטוי וירוס בתיווך מיושר כראוי השתל אופטי. הביטוי שנוצר מוגבלת עד הקצה של סיבים, ותוצאות פחות ביטוי לא רצויות לאורך המסלול סיבים מאשר זריקות stereotaxic.
בנוסף לייצור ביטוי יישוב בקצה של סיבים קטנים, סרטי משי/AAV יכול לשמש כדי לנהוג נרחבת (> בקוטר 3 מ מ) ביטוי קורטיקלית מתחת windows הגולגולת. In vivo פוטון 2 הדמיה של פעילות פלורסנט חיישנים הפך להיות כלי חיוני להעריך את התפקיד של פעילות. עצבית נהיגה עיבוד חושי קוגניטיבית. אולם, לנהוג אחיד הביטוי על פני שטחים נרחבים קורטיקלית, ניסויים לעיתים קרובות לבצע זריקות מרובות. זריקות אלה פקוקה מאוד והוא יכול להוביל ביטוי לא עקביים על-פני שדה הראייה. לעומת זאת, משי/AAV-מצופה חלונות הגולגולת הם מאוד קל לייצר, להפחית באופן משמעותי את הזמן הנדרש עבור ניתוחים, ולנסוע ביותר להפליא ביטוי מאות מיקרונים מתחת לפני השטח קורטיקלית.
Protocol
כל הניסויים המערבות בעלי חיים בוצעו על פי פרוטוקולים אושרה על ידי הוועדה המתמדת הרווארד על החיה אכפת בהנחיות הבאות תיאר ב NIH לנו מדריך על טיפוח ועל שימוש של חיות מעבדה. עכברים בוגרים C57BL/6 של מין או (מגיל 6-15 שבועות) שימשו עבור כל הניסויים.
1. לקבל מימית Fibroin משי
- להכין או לרכוש fibroin משי מימית (5-7.5% w/v).
2. מערבבים משי מימית עם AAV ביטוי וקטורים
- לבחור וקטור ביטוי AAV להסיע את החלבון optogenetic או מחוון פלורסנט של בחירה.
הערה: כדי למזער את עוצמת הקול של משי/AAV עליך להחיל על שתלים כשנסע עדיין ביטוי חזקים, מלאי-כייל AAV (מניות titers המתקבל בדרך כלל וקטור ליבות נמצאים ~ 1013 gc/mL) מומלץ. - מייד לפני ציפוי השתלים, להפשיר aliquot של AAV ומשלבים עם 5-7.5% fibroin משי מימית (תערובת זו יכונו כמו משי/AAV). בשפופרת 200 µL PCR, לערבב fibroin מימית AAV ביחס 1:1 (לשימוש windows הגולגולת 1:4) מייד לפני היישום. בעדינות pipette הפתרון שם מספר פעמים כדי לערבב ביסודיות את fibroin ואת AAV.
- שמור משי/AAV תערובת על הקרח לפני השימוש.
3. מכינים את ציוד ייצור ואחסון של התקנים משי/AAV-מצופה
- רכישת ציוד עבור ציפוי סיבים אופטיים ועדשות הדרגתי-Index (חיוך) (מספרים 1, 2).
- לבנות בעל ferrule יציב. להחזיק ferrules קרמיקה, קודחים חורים 1.25 מ מ גוש ¼" גיליון אקרילי. הקש על חורים כדי להוסיף ערכת ברגים מהצד כדי להחזיק ferrules במקום.
הערה: קלאמפ שום יכול לשמש למטרה זו. - הצב תחמן בדייקנות מילימטר כדי להזיז את סיבים אופטיים (מכשיר stereotaxic או אחרים micromanipulator דיוק).
- להרכיב בעל יציב כדי למקם את microinjector.
- השתמש סטריאוסקופ להמחיש סיבים אופטיים, משי droplet.
- הצב מקור אור כדי להאיר את סיבים אופטיים.
- לבנות בעל ferrule יציב. להחזיק ferrules קרמיקה, קודחים חורים 1.25 מ מ גוש ¼" גיליון אקרילי. הקש על חורים כדי להוסיף ערכת ברגים מהצד כדי להחזיק ferrules במקום.
- הכינו ציוד עבור ציפוי חלונות גולגולתי (איור 3).
- לבחור כל pipettor P10.
- להשיג מיכל עם מכסה.
הערה: שום מיכל עם חלק תחתון סיליקון הוא הציע — התחתון רך מקלה על הרמת חלונות הגולגולת.
- הכינו ציוד לאחסון סיים שתלים (איור 4).
- להשיג תא ואקום קטנים (1-5 L).
- ודא כי יש מקום לאחסון שתלים במקרר 4 ° C.
4. החל את סרט משי/AAV התקנים
- ציפוי סיבים אופטיים לביטוי מוקד נסיעה בקצה סיבים
- הכנת שתלים סיבים כרונית כמו שתואר לעיל4.
- לפני השימוש, יש לשטוף שתלים עם אתנול, ולאחר מכן עם מים הנדסה גנטית כדי להבטיח כי הסיבים אופטיים נקיים.
הערה: סרטי משי לדבוק בצורה מהימנה יותר לנקות משטחי זכוכית. - הכנת התקן להחזיק סיבים ferrules. עבור טיפוסי 1.25 מ מ קוטר ferrules, שימוש בלוק ברור אקריליק, עם ~1.3 ¼ אינץ ממ חורים, וטפח על הברגים הגדר כניסה מהצד כדי חור שתלים בחוזקה במקום (איור 1 א').
- הר בעל ferrule לתוך מנגנון stereotaxic (או כל פתרון מניפולציה בדייקנות submillimeter) מצוידים microinjector. המקום בעל ferrule מעל microinjector, החל את התערובת משי/AAV מלמטה.
הערה: זה בגלל יישומים כמויות גדולות מלמעלה, גרמו משי/AAV שלא היה מוגבל עד הקצה. עם זאת, היישום של כמה כרכים רציפים קטנים מ מעל או מתחת יכול לייצר פיקדונות AAV/משי זה מרותקים עד הקצה (למרות שאנחנו מעדיפים ליישם מלמטה). - משוך על פיפטה הזרקה תוך-גולגולתי סטנדרטי של זכוכית בורוסיליקט נימי.
- כדי להקל על
- כדי לייצר עצה הזרקה עם טיפ נקי ושטוח לקוטר הרצוי, להחזיק פיפטה אחת בכל יד ולהשתמש החלק עבה של טייפר על פיפטה אחד להבקיע את פיפטה אחרים במיקום הרצוי הפסקה.
- יש לשפשף בעדינות אחורה וקדימה בתנועות ניסור (שיטת הניקוד של זכוכית על-זכוכית).
- לאחר הבקיע את פיפטה, חלים לחץ עדין קצה פיפטה הצליחו עם הגוף של פיפטה אחרים כדי להשיג את הפרידה.
- הצב סטריאוסקופ לתת תצוגה ברורה של הפרצופים סיב אופטי.
הערה: הגדלה צריך להיות מספיק למקם במדויק את פיפטה הזרקת מעל הפנים של סיבים אופטיים. - להוסיף סיבים שתלים מחזיק עם הצד-המוח של סיבים אופטיים מופנות כלפי מטה.
- לטעון על פיפטה הזרקה עם פתרון משי/AAV, באשר כל הזרקה תוך-גולגולתי תקן5. לטעון את הסכום הנדרש עבור מספר שתלים נעשים, בנוסף ~ 30% יותר כדי להכיל את ההפסדים עקב פיפטות סתימת. לדוגמה, אם שתלים 10 נעשים, אז לטעון עם 100 nL הפקדות ולסגת ~1.3 µL.
הערה: ייתכן משי/AAV יבש בקצה פיפטה בין פליטות, אשר יכולים להיסתם על פיפטה. קוטר גדול מדי סוכר (50-100 מיקרומטר) הן הסבירות לסתום. הקבקבים. יכול להיות ניתק על ידי צחצוח עדין למטה את קצה פיפטה עם מקלון לנגב או אלכוהול נייר רטוב. - לתמרן את פיפטה הזרקת עד לגעת או כמעט נגיעה מהמרכז של המשטח סיב אופטי. הוצאה 10-20 nL של משי/AAV פתרון. למשוך את פיפטה.
הערה: קצב משלוח אינה קריטית, אבל התעריפים טיפוסי 5-20 nL/s. - לצפות את בולוס של משי/AAV על משטח שטוח המופיע ככיפה נוזלי זה מתייבש סרט שטוח בתוך דקות ~ 1 (איור 1B).
- חזור על צעדים 4.1.9-4.1.10 עד הסכום הרצוי של משי/AAV שהופקדו (סך של 20-200 nL עבור רוב יישומי). בעת הכנת מספר שתלים, חלות משי/AAV שתל אחד ולהמשיך הלאה כדי להרגיע שתלים אחרים לפני שחזר את הראשון.
- לאפשר 1 h לייבוש לפני העברת השתלים.
- לילה desiccate ואקום-טנדר של גוה של ~ 125 (--25 ב. Hg), 4 מעלות צלזיוס. לעשות זאת על ידי הצבת המחזיק ferrule כולו לתוך תא ואקום.
- להעריך את הצורה ואת המיקום של הסרט המשי המתקבל דרך מיקרוסקופ רב. להבטיח כי סרטים מרותקים עד הקצה של פני השטח סיב אופטי, להיות דק יחסית (> 100 מיקרומטר), וסימטרי (איור 1C).
הערה: סרטי משי/AAV גדולים או סימטרית עשוי לסלק מן הסיבים במהלך ההשתלה (איור 1D). הגורם הנפוץ ביותר לבעיות נובע היישום של יחיד בנפחים גדולים יותר מאשר יישום רציף של כמה כרכים קטנים.
- ציפוי צמצום סיבים אופטיים לביטוי נסיעה לאורך הציר סיבים
- להשיג סיב אופטי מחודדות השתלים ולבצע שלבים 4.1.2-4.1.8, חוץ מזה סיבים ישרים ממוקם רוחבית כזה הוא בניצב מזרק (איור 2 א). מקם את מזרק מעל סיבים ישרים.
הערה: טעינת טיפות נוזל על תנוחות סיבים ישרים הוסיף אתגרים, כי מתח הפנים נוטה לגרום טיפות כדי לקפוץ חזרה על פיפטה הזרקה או להעביר את סיבים ישרים. הזרקת קטנים יותר מדי סוכר (30-50 מיקרומטר קוטר) לעזור להתגבר על בעיה זו אך להגביר את הסיכון פיפטה הזרקת יסתום. בשל מתח, טיפות נוטים לדבוק האזור של שטח הפנים הגדול, אז הזריקה אופטימלית פיפטה גודל תלויה בגודל של סיבים ישרים וסובלנות אחד בשביל להדביק מדי פעם. - מקם את פיפטה משי/AAV הזרקת כנגד הצד של סיבים אופטיים בתחילת טייפר. ודא שפיפטה הזרקת נוגעת סיבים אופטיים.
- הוצא 20 nL של משי/AAV כדי להתחיל את תהליך ציפוי. ודא ה-droplet דבקה סיב אופטי נשאר הממשק של הסיבים/פיפטה. בעדינות לפתיל ה-droplet לקראת הסוף של קצה סיבים כפי המשי/AAV מתייבש (~ 45 s). שמור על פיפטה שהזרקת בקשר עם ה-droplet הייבוש כדי למנוע סתימת הטיפ פיפטה.
הערה: כל הפקדה צריך מעיל כ 400 מיקרומטר של סיבים ישרים (איור 2B). - כאשר בולוס הראשון התייבש כמעט לחלוטין, להוציא עוד 20 nL ולהמשיך הפתילה ה-droplet לאורך טייפר.
הערה: המשי הנוזלי דוגלים המשי מיובשים, עגינת קצה אחד של ה-droplet כפי פיפטה נע לאורך של טייפר. - חזור על שלב 4.2.4 על ידי הוצאת כמויות קטנות של משי/AAV וציור בהדרגה את הפתרון מעלה טפר. 5-6 פליטות מספיקים לחצות את פני השטח של להתחדד 2.5 מ מ.
- לנהוג ביטוי אחיד יותר מכל צד של הסיבים, לסובב הסיבים, חזור על השלבים 4.2.2-4.2.5 עד הסכום הרצוי של משי/AAV הופקדה.
- אם תלייה לנטישה של משי מיובשים/AAV חורג הטיפ סיבים, לחתוך בזהירות סטרנד עם מספריים, או להשתמש על פיפטה הוצאה סטרנד בחזרה ואז לדבוק זה לנר של סיבי.
- לאפשר 1 h לייבוש לפני העברת השתלים.
- ואקום desiccate לילה ב- 4 מעלות צלזיוס. המחזיק ferrule כולו ניתן להציב לתוך תא ואקום.
- להעריך את הצורה ואת המיקום של הסרט המשי המתקבל דרך מיקרוסקופ רב.
הערה: סרטים לא צריך להיות אחיד לגמרי אבל לא צריך בליטות שבולטים יותר מ-100 מיקרומטר מעבר השטח של סיבים כדי למזער את הנזק לרקמות במהלך ההשתלה (איור 3C). כדי למזער את גודל הסרט, זה קריטי כי לכל droplet הוא יבש לחלוטין לפני ההפקדות הבאים עשויים.
- להשיג סיב אופטי מחודדות השתלים ולבצע שלבים 4.1.2-4.1.8, חוץ מזה סיבים ישרים ממוקם רוחבית כזה הוא בניצב מזרק (איור 2 א). מקם את מזרק מעל סיבים ישרים.
- ציפוי העדשה חיוך שתלים
- להשיג חיוך עדשות6,7 וחזור על שלבים 4.1.2-4.1.8. יכול להיות מותקן על מזרק לעיל.
- להפקיד משי/AAV ב הוצאה יחיד (1 µL עבור 1.0 מ מ קוטר עדשה).
הערה: זו תניב כיפה של נוזל לאנאפוליס הפנים של העדשה, והוא מתייבש להפקת סרט אחיד (100-200 מיקרומטר עבה). עם זאת, במקרה בו הוצאה גדולה אחת מתייבש לצר ומפיקה סרט עבה יותר ליד הקצוות של העדשה חיוך, נסה הפקדת מספר טיפות קטנות יותר (100-200 nL) במרכז השטח עדשה (המאפשר לכל droplet להתייבש לפני הפקדת הבא) כדי להבטיח כי הסרט יהיה כונן ביטוי במרכזו של שדה הראייה. - לאפשר 1 h לייבוש לפני העברת השתלים.
- להעריך את הצורה ואת המיקום של הסרט המשי המתקבל דרך מיקרוסקופ רב כדי להבטיח כי הסרט מכסה את פני השטח של העדשה.
- ציפוי חלונות זכוכית הגולגולת
- להכין זכוכית חלונות הגולגולת על ידי דבקות בקוטר 3 מ מ שתי סיבוב coverslips (מס ' 1 עובי) חלון אחד בקוטר 5 מ מ עם דבק אופטי (לפרטים, ראה Goldey et al. . 20148).
- מערבבים משי: וירוס על יחס של 1:4 כדי להפחית את הסכום הכולל של משי בסרט. כמויות מוגזמות של משי אינם מתמוססים מתחת לגולגולת windows לאחר ההשתלה. טיטור הניסויים עשויים להידרש כדי לקבוע את היחס ואת נפח שנותן את הפרופיל הביטוי הרצוי.
- יד pipette droplet 5 µL על פני coverslip 3 מ מ (מול מוח). ה-droplet צריך להתפזר כדי לכסות את המשטח כולו זכוכית (איור 3).
- לאפשר 2-3 h לייבוש לפני הזזת חלונות.
5. אחסון משי/AAV-מצופה שתלים
- חנות משי/AAV-מצופה סיבים אופטיים ב desiccator ואקום מקורר (~ 125 טנדר של גוה של, 4 ° C) לפני השימוש (איור 4A).
- אל תאחסן windows הגולגולת ועדשות חיוך תחת ואקום, כמו גדול סרטי משי המאוחסנים תחת ואקום להיכשל מתמוסס לחלוטין לאחר ההשתלה. שתל windows הגולגולת ועדשות חיוך מיד לאחר הייבוש, או בתוך יום של ייצור אם מאוחסנים הלחץ האטמוספרי, 4 מעלות צלזיוס.
6. השתלת המכשירים
- להכין חיות ניתוח שתל כפי שתואר לעיל4.
- בקצרה, עזים ומתנגד עכברים עם זריקה בקרום הבטן של קטמין/חריגות השירותים הווטרינריים (100/10 מ"ג/ק"ג), בדוק את עומק ההרדמה באמצעות הבוהן-קמצוץ עדין. לגלח את הגולגולת באזור של השתל ולנקות את הקרקפת עם יוד ואלכוהול.
- הר חיות התקן stereotaxic, תוספת של הרדמה בעזרת תערובת של חמצן, איזופלוריין (1-2%). אעשה חתך בקרקפת על פני השטח של עניין, ולבצע גולגולת גדולה מספיק כדי להכיל את השתל.
- השתל סיבים אופטיים9 ו- microendoscope עדשות10 על פי הנהלים שפורסמו בעבר. ידית שתלים עם טיפול, ההפקדה משי/AAV יכול להיות המם גולגולת לא מושלם, או על ידי שתל לתפוס על הקצה של הגולגולת. הנמך את השתל לתוך המוח באיטיות (~ 2 מ מ/דקה).
- השתל הגולגולת של windows כמתואר קודם לכן8. לא לגעת בצידי החלון מצופה ולהימנע שטיפה את החלון עם נוזל אם מבצע gavage, כמו זה עלול לשטוף את הנגיף. כדי להשיג ביטוי מכסימלי, לבצע את durotomy.
7. הערכת הביטוי ופתרון בעיות
- כדי להעריך ביטוי של חלבונים הביע לשווק, לאפשר ~ 2-3 שבועות לוירוס ביטוי, ואז לבצע זלוף intracardial עם 4% paraformaldehyde פוספט buffered תמיסת11 ותהליך רקמת המוח עבור פלורסנט מיקרוסקופ12.
- להעריך את הביטוי באמצעות מיקרוסקופ פלואורסצנטי לשיקוף הדפוס ביטוי של חלבונים מתויג fluorophore optogenetic.
- אם הרמה של הביטוי אינה מספיקה, להגדיל את כמות וירוס ב ציפויים על ידי הגדלת הנפח הכולל של הציפוי משי/AAV, או רצוי באמצעות וירוס כייל נוגדנים גבוה יותר.
תוצאות
כדי להעריך את ההצלחה של סרטי משי/AAV נהיגה ביטוי, אנו perfused חיות 2-3 שבועות לאחר ההשתלה, המוכן פרוסות המוח מאזור עניין. קרינה פלואורסצנטית תמונות של חלבונים מתויג fluorophore optogenetic (ChR2-YFP) סיפק אמצעי מדידה של מידת הביטוי (איור 1D). סיבים אופטיים טיפוסי (קוטר מיקרומטר 230) בקלות יכול להכיל 200 nL של משי/AAV. עם התרגול, ניסויים ניתן להשיג ביטוי ואמינים סביב הקצה של מושתל סיבים (איור 5).
כדי להעריך ביטוי מונע על ידי משי/AAV-מצופה windows הגולגולת, להתחיל הדמיה מתחיל 7-10 ימים לאחר ההשתלה. השתמשנו שני הפוטונים ההדמיה לתצוגה חזותית, אך גם ניתן להשתמש בשיטות אחרות כגון קרינה פלואורסצנטית הדמיה עם CCD. שתי בעיות אפשריות עם ציפוי חלונות הגולגולת הם ביטוי לא מספיקות, סרטי משי להיכשל להתמוסס, מטשטשים את שדה הראיה. כדי להגביר את הביטוי, אנו מציעים מבצע של durectomy לפני השתלת החלון ו / או להגדיל את כמות וירוס בסרט. . השגנו את הביטוי הטוב ביותר באמצעות תערובת 1:4 של משי AAV מניות-כייל נוגדנים, בהתאמה. בזמן זה מייצג מספר גדול יותר באופן משמעותי של נגיפים מאשר נמצאים בדרך כלל בשימוש זריקות stereotaxic, הפעם כירורגי ירד מוני העלות הנוספת שולית של וירוס. בינתיים, אם סרטי משי לא לפזר מתחת לחלון, לצמצם עוד יותר את כמות משי המשמשת את החלון. הסכום הכולל של משי ב- windows מצופה הוא 10 - 100 פעמים יותר מאשר על שתלים סיבים, הסרט הוא פחות מוטבע בתוך הרקמה, ובכך עלול לא להיות חשוף לרמות זהה של פעילות הפרוטאוליטי ממה יכול להמיס סרטי משי13. עם זאת, הנוכחות של משהו ממשי חיוני להשגת ביטוי מתחת windows3, סביר כי סרט העשוי וירוס לבד הוא נשטף על ידי נוזל בין-תאי במהלך הניתוח.

איור 1: החלת משי/AAV סרטים על סיבים אופטיים. (א) כרונית סיבים השתלים ממוקמים סיבים לצד השני לתוך בעל (פנימי) רכוב על מתרגם XYZ. Microinjector קבוע מתחת הסיבים dispenses משי/AAV אל קצות הסיבים. סטריאוסקופ מאפשר הדמיה של התהליך. (B) חלות משי/AAV סיבים טיפים בכמויות קטנות (nL 10-20). לאחר הוצאת מזון לעוס, תמשוך את פיפטה ולאפשר ~ 60 s עבור ה-droplet להתייבש לסרט שטוח. חזור על התהליך עד האחסון הנדרש הוחל לקצה סיבים. (ג) בדיקת ציפוי משי. צריך להיות מרוכז ציפויים אופטימלית על הטיפ סיבים (משמאל), ואילו הפסולה ציפוי להאריך החוצה מעל פני סיבים שהופך אותם נוטים יותר מכך של הסיבים (מימין). (ד) נציג סיבי מצופה עם 200 nL של משי/AAV ולאחר את וכתוצאה מכך מונחה AAV ChR2-YFP ביטוי 2 שבועות לאחר ההשתלה. ציפוי משי/AAV קומפקטי בצד השמאל הביא בביטוי חזקים, ואילו הציפוי בצד הימין וצווארי את הפנים של סיבי והביאה כמעט ללא הבעה, סביר להניח כי המשי/AAV לא לדבוק סיבים אופטיים במהלך ההשתלה. גודל ברים 0.2 מ מ (סיבים), 1.0 מ מ (פרוסות המוח). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: התקנה עבור ציפוי סיבים ישרים שתלים. (א) microinjector, מותקן מעל בעל סיבים ישרים, סיבים ישרים ממוקמות orthogonally את המזרק הפליטה. (B) מתחיל ב הגדול ביותר הצבע (פנימי) והוצא כרכים קטנים תוך כדי תנועה המזרק הוצאה כלפי נקודת טייפר. התוצאה ציפוי רציף לאורך טייפר. (ג) סיבים ישרים נציג מצופים משי מעורב עם מהר ירוק כדי לסייע להדמיה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
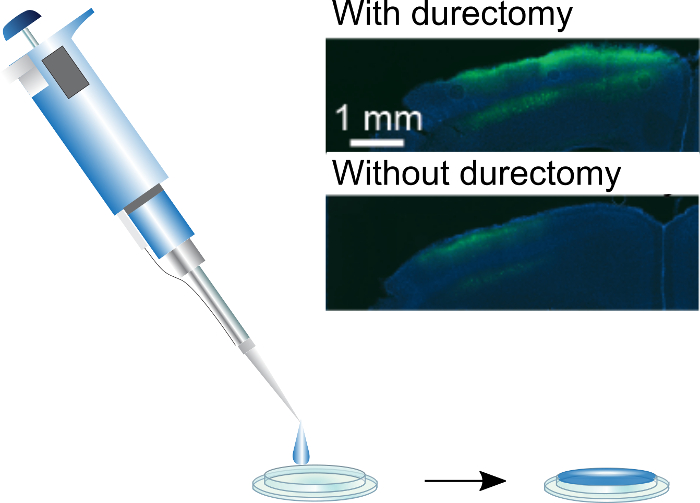
איור 3: ציפוי חלונות הגולגולת. משי/AAV ניתן יישומי windows הגולגולת באמצעות פיפטה של היד. חלון בקוטר 3 מ מ סטנדרטי יכול להיות מצופה droplet µL 5, אשר יתייבש לאט לסרט שטוח. שיבוץ: ביטוי GCaMP6f הנובע משי/AAV-מצופה windows הגולגולת מושתל עם ובלי durectomies. איור זה כבר ממאמרו של ג'קמן. et al. (2018) 3. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: אחסון משי/AAV מצופה שתלים. (א) כדי להסיר שאריות לחות ולשמר יעילות ויראלי, שתלים צריך להיות מאוחסן תחת ואקום ב 4 ° C עד בשימוש. שתלים המאוחסנים בדרך זו מורדם לפחות 7 ימים. הביטוי (B) הנובע משי 4/AAV מצופה סיבים לאחר 7 ימים של אחסון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
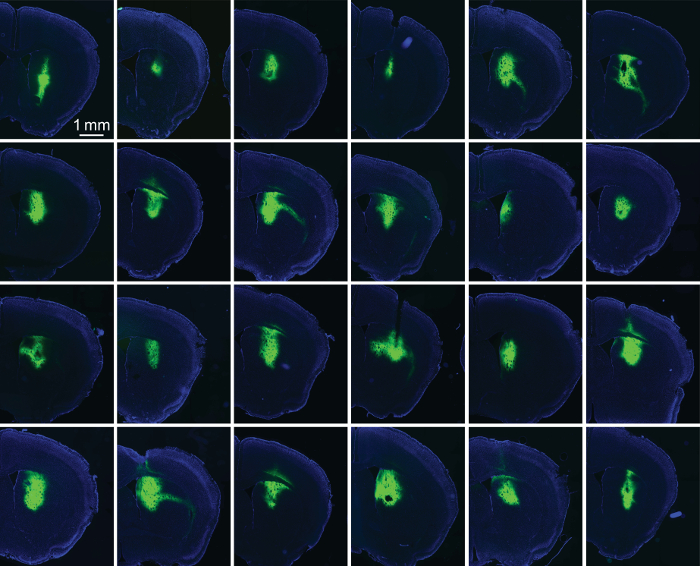
איור 5: סיבים אופטיים משי/AAV-GFP מצופה לנהוג בצורה אמינה ביטוי. פלורסנט תמונות של פרוסות striatal ברציפות 24 שתלים. כל שתל היה מצופה 100-400 nL של 1:1 משי/AAV-GFP. זה קוהורטה של שתלים מציין את היכולת של משי להגבלת ביטוי לאתר השתל (במקרה זה סטריאטום הגבי). קרינה פלואורסצנטית GFP מסומן בירוק; דאפי מכתים מוצג בצבע כחול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
השימוש של משי/AAV למקד את הביטוי של חלבונים optogentic גוברת על המגבלות של גישות הנמצאים כיום בשימוש. למרות מחקרים רבים להשתמש בהצלחה AAV זריקות כדי להביע optogenetic חלבונים, זה מאתגר כדי ליישר את הביטוי עד הקצה של סיבים אופטיים באזורים סביב אורך סיבים ישרים, לאזור הצפייה של עדשה חיוך. בגלל חוסר התאמה בין רכיבים אופטיים ביטוי optogenetic, זריקות stereotaxic יכול להיות לא אמין, ניסויים רבים נכשלים. המשי/AAV labelling שיטת שנתאר כאן פותר בעיה זו. זה גם מפשט את ההליך על-ידי ביטול שלב כירורגי שני ובחלק מן המקרים ומבטלת את הצורך עבור ניתוח נוסף. זה גם יכול להיות קשה להשתמש וירוסים כדי לקבל ביטוי נרחב מתחת windows הגולגולת, הנסיין בדרך כלל לבצע ניתוחים רב להחדיר וירוס במיקומים מרובים. היכולת לקבל ביטוי נרחב מעל אזורים קורטיקליים גדולים על ידי פשוט ציפוי חלונות הגולגולת עם משי/AAV היא הפשטה המבטל את הצורך על הזריקות פולשנית רבים.
יתרון נוסף פוטנציאלי של שיטת המשי/AAV הוא כי זה עלול לגרום פחות דלקת ברקמות עצביות לעומת זריקות ויראלי. הזרקת כייל גבוה AAV לתוך המוח עלול לגרום תגובות דלקתיות כגון astrocytosis תגובתי כי יש פוטנציאל לשנות את הסלולרי, מעגל מאפיינים14,15 (למרות סיבוכים פוטנציאליים כאלה בדרך כלל התעלם). סרטי משי זירוז התגובה immunogenic הקטן על משלהם,13 , משי/AAV סרטים צפויים לשחרר את הוירוס במשך הרבה שעות או ימים16, אשר עשוי להוריד את המטען הנגיפי ברקמה שמסביב ולהפחית את התגובות immunogenic. עם גישות קונבנציונליות שבו השרשה של התקן קודם זריקה AAV, תגובות דלקתיות יכול לנבוע ההשתלה והן את הזריקה. בעתיד זה יהיה רצוי להשוות באופן שיטתי גישות קונבנציונליות ואת שיטת המשי/AAV כדי לקבוע אם סרטי משי/AAV מפחית הכוללת תגובות דלקתיות.
מספר צעדים חיוניים לשימוש מוצלח של משי/AAV סרטים. והכי חשוב, הציפוי של סיבים אופטיים חייב להיעשות בזהירות כפי שמתואר השיטות, וצריך להעריך את המיקום של הסרטים מיובשים בזהירות על ידי בדיקה חזותית תחת מיקרוסקופ כדי להבטיח כי הסרטים קומפקטי, במיקום הנכון, לדבוק הפנים של סיבים אופטיים. כל משי/AAV בצדדים של סיבים אופטיים יוביל לביטוי מחוץ לאזור עניין, סרטים גילחה החורגות מעבר הפנים של הסיבים עשויים להתפצל במהלך ההשתלה, להוביל לא אמינים או אף ביטוי. טכניקות שאנו מתארים כי החלת משי/AAV למכשירים מושתלת ניתן להתאים לשימוש של כל חומר הם זה זמינים ומאפשרים בתצהיר מדויקת של כמויות קטנות של משי/AAV.
קצת להתאמן נדרש על מנת להשיג תוצאות מדויקות, לשחזור. אם הביטוי הוא ציין לאורך המסלול של סיבי, סביר להניח כי הסרט משי מיובשים בצד של הסיבים ולא הפנים סיבים. חזור על תהליך הייצור ולבדוק מקרוב את השתלים מיובשים סימנים סרטים מתייבשים בצד של הסיבים. בגלל סרטי משי/AAV שטיחות שקופה, היא עשויה לסייע לאימון החלת משי מעורב עם צבע (ירוק מהר או צבע דומה) כדאי להמחיש את צורת המתקבלת סרטים (איור 2C). אם אין ביטוי, סביר להניח כי הסרט משי רופף מהקצה סיבים במהלך ההשתלה. אנו מציעים השימוש במלאי-כייל וירוס בעת ביצוע שתלים. על סיבים אופטיים, זה מפחית את הנפח הכולל עליך להחיל על סיבים בקוטר קטן. אם הגודל של הציפוי דאגה שקול מחכה עוד בין כל יישום nL 10 כדי לאפשר ייבוש מלא של ה-droplet הופקדו. טיפות משי/AAV יבש יותר מהר תחת מנורה חמים. עבור windows הגולגולת, וירוס כייל גבוה ייתכן שיהיה צורך לספק המטען הנגיפי נאותה על-פני פיה או דורא. סוגים מסוימים של שתלים יכול להמיס משי ולשחרר AAV בקלות רבה יותר מאשר לאחרים. מצאנו כי windows הגולגולת מושתל על פני השטח של המוח דורשים יחס נמוך של משי או הווירוס להשיג ביטוי אמין, אולי בשל שונים במוח השדרה דינמיקה של נוזלים או פעילות פרוטאז. אם הביטוי לא יכול להיות מוגברת על ידי הגדלת ריכוזים AAV יעיל, הקטנת הנפח של משי מימית הוא חלופה סבירה.
לבסוף, חשוב לאחסן את רכיבים אופטיים כראוי ולאחר להשתיל אותם די מהר אחרי שהם מוכנים. אנחנו הראו כי ניתן לאחסן מצופה הסיבים נמצאים בקירור תחת ואקום לפני ימים רבים לשימוש. אחסון ואקום מסיר לחות שיורית17 אשר עשוי להפחית את המסיסות של סרטי משי, וכן עוזרים לשמור על יעילות ויראלי. באופן אידיאלי, סיבים אופטיים צריך להיות מושתלים תוך 24 שעות מרגע פבריקציה נוספת. עם זאת, אנו מוצאים כי סיבי משי/AAV-מצופה המאוחסנים תחת ואקום נסיעה רמות דומות של הביטוי כאשר השתילו 7 ימים לאחר ייצור (איור 4B). לעומת זאת, windows הגולגולת מצופה ועדשות חיוך נסע הביטוי הכי אמין כאשר הם יבשים בטמפרטורת החדר, בשימוש בתוך שעות הכנה. הסיבה פער עדיין לא ברור. עוד מחקרים עשוי להיות נחוץ כדי לחדד הכנה ותנאי אחסון על מנת להרחיב את זמן האחסון.
משי/AAV-מצופה windows הגולגולת יש פוטנציאל ניכר כי הם באופן דרסטי לקצר פעמים כירורגיים פשוטים מאוד לייצור, אבל כיום לשיטה זו יש מגבלות. מצופה גולגולתי בצורה אחידה תווית שטחים גדולים של קליפת וחלונות לנהוג ביטוי מספקת שכבה 2/3 GCaMP הדמיה, עם קצת פחות ביטוי ברבדים עמוקים יותר. עם זאת, זריקות stereotaxic לנהוג ביטוי עמידים יותר ומספקים יותר שליטה על הרבדים ממוקד עבור הביטוי. ביטוי אמין הושגה רק כאשר השכבה הקשה של המוח הוסר. למרות השכבה הקשה של המוח הוא הסיר לעיתים קרובות עבור ניסויים רבים של הדמיה 2-פוטון לשפר את איכות התמונה8, עבור ניסויים רבים רצוי להשיג labelling בצורה פחות פולשנית. לכן בחנו את היכולת להשתמש משי/AAV לסמן אזורים קורטיקליים מבלי להסיר את השכבה הקשה של המוח. השגנו כמה תוויות, אך יתכן שזו תוצאה של פגיעה השכבה הקשה של המוח בתהליך הכנת את הניתוח. מחקר נוסף נדרש עבור windows הגולגולת מצופה לשמש באופן אמין תווית קליפת מבלי להסיר את השכבה הקשה של המוח.
הכנת fibroin משי מימית של פקעות של טוואי המשי מתואר בפירוט Rockwood. et al. (2011) 18. fibroin משי מימית הוא עכשיו זמינים מסחרית (5% w/v). אמנם רוב הניסויים שלנו בוצעו באמצעות מניות מימית fibroin משי שהוכן במעבדה שלנו (5-7.5% w/v), לנו יש להשיג תוצאות דומות שימוש מסחרי fibroin מימית. Fibroin מימית יציב ב 4 ° C עד 3 חודשים, לאחר מכן זה באופן ספונטני המעברים של נוזל כדי הידרוג18. אנו ממליצים כי מניות fibroin להיות מחולק aliquot ~ 1 מ"ל, המאוחסנים ב- 80 ° c Aliquot העבודה 1 מ"ל (מספיק עבור ציפוי מאות שתלים) יכול להיות מאוחסן ב 4 ° C ולא להשתמש בו עד שיתחיל ג'ל. להיזהר לא רעדו, מערבולת, להתסיס או באגרסיביות פיפטה fibroin מימית, כמו כוחות גזירה יכול להוביל gelation19,20.
סרטי משי/AAV היתר מגוון רחב של דפוסי ביטוי, נפוץ הביטוי קורטיקלית תחת windows הגולגולת, ביטוי מדויק subcortical בקצה של סיבים אופטיים בקוטר קטן. טכניקות אלה פותחו כדי לנצל את היתרון של וקטורים ביטוי AAV נפוץ אבל סביר יכול לשמש כדי לפזר וקטורים אחרים ביטוי כמו Lentiviruses או וירוסים כלבת לתוך המוח. גם יכול להיות מיוצר סרטי משי לתוך צורות תלת-ממדיות כדי לשפר את פרסום ויראלי לתוך רקמות. לדוגמה, כדי ביטוי חזק נסיעה מתחת windows בקליפת המוח ללא השימוש durotomy, הגולגולת windows יכול להיות מצופה מערכים של משי microneedles כי פירס הווירוס דורא ושחרור שכבות קורטיקלית עמוק21. עידון נוספת צפויה להוביל מאפיינים משופרים של שחרור וירוס ויישומים חדשים משי/AAV הסרטים.
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצים להודות ג'יי וזקאוז לאיורים, קפלן ד ו ג Preda עבור ריאגנטים הדרכה מועילה, ואת המעבדות של ב' סבאטיני והארווי ג עבור הדמיה ויוו . מיקרוסקופ התאפשרה על ידי מ Ocana ומרכז נוירוביולוגיה הדמיה, נתמך בחלקה על ידי המרכז לדימות העצבי כחלק של לאומי המכון של הפרעות נוירולוגיות ולהעניק מרכז הליבה P30 שבץ (NINDS) (NS072030). עבודה זו נתמכה על ידי קרן נבון Khodadad המשפחה, קרן ננסי לוריא סימני, ו על ידי מענקים NIH, NINDS R21NS093498, U01NS108177 ו- NINDS R35NS097284 כדי W.G.R, ועל ידי של NIH בתר F32NS101889 כדי C.H.C.
Materials
| Name | Company | Catalog Number | Comments |
| Aqueous silk fibroin | Sigma | 5154-20ML | Aqueous Silk Fibroin (5% w/v) for making films |
| Microinjector to deposit silk/AAV | Drummond | 3-000-207 | Nanoject III nanoliter injector |
| Manipulator to hold implants | Narashige | MM-33 | Micromanipulator |
| Stereoscope to visualize silk deposits | AmScope | SM-6TX-FRL | 3.5X-45X Trinocular articulating zoom microscope with ring light |
| Vacuum chamber to store implants | Ablaze | N/A | 3.5 Quart Vacuum Vac Degassing Chamber |
| Optional, implant holder for storage | N/A | N/A | To store premade optical fibers, drill a grid of ~4 mm-deep holes with a diameter just larger than the ferrule diameter into a plastic block. |
| Optical fiber | Thorlabs | FT200EMT | Ø200 µm Core Multimode Optical Fiber for fiber implants |
| Ferrules | Kientec | FZI-LC-230 | LC Zirconia Ferrule for fiber implants |
| Various materials for manufacturing chronic fiber implants | Various | N/A | For detailed procedure, see Ung K, Arenkiel BR. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of visualized experiments: JoVE. 2012(68). |
| Tapered fiber implants | Optogenix | Lambda-B | Tapered fiber implants |
| GRIN lenses | GoFoton | CLH-100-WD002-002-SSI-GF3 | GRIN lenses |
| Small glass cranial windows | Warner | 64-0726 (CS-3R-0) | Small round cover glass, #0 thickness |
| Large glass cranial windows | Warner | 64-0731 (CS-5R-0) | Small round cover glass, #0 thickness |
| Various materials for manufacturing cranial windows | Various | N/A | For detailed procedure, see Goldey GJ et al. Removable cranial windows for long-term imaging in awake mice. Nature protocols. 2014 Nov;9(11):2515. |
References
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nature Methods. 11 (3), 338-346 (2014).
- Tervo, D. G., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Jackman, S. L., et al. Silk Fibroin Films Facilitate Single-Step Targeted Expression of Optogenetic Proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Ung, K., Arenkiel, B. R. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of Visualized Experiments. (68), e50004(2012).
- Lowery, R. L., Majewska, A. K. Intracranial injection of adeno-associated viral vectors. Journal of Visualized Experiments. (45), (2010).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocols. 7 (1), 12-23 (2011).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11 (3), 566-597 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Park, J. J., Cunningham, M. G. Thin sectioning of slice preparations for immunohistochemistry. Journal of Visualized Experiments. (3), 194(2007).
- Cao, Y., Wang, B. Biodegradation of silk biomaterials. International Journal of Molecular Sciences. 10 (4), 1514-1524 (2009).
- Jackman, S. L., Beneduce, B. M., Drew, I. R., Regehr, W. G. Achieving high-frequency optical control of synaptic transmission. Journal of Neuroscience. 34 (22), 7704-7714 (2014).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nature Neuroscience. 13 (5), 584-591 (2010).
- Hines, D. J., Kaplan, D. L. Mechanisms of controlled release from silk fibroin films. Biomacromolecules. 12 (3), 804-812 (2011).
- Hu, X., et al. Regulation of silk material structure by temperature-controlled water vapor annealing. Biomacromolecules. 12 (5), 1686-1696 (2011).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Yucel, T., Cebe, P., Kaplan, D. L. Vortex-induced injectable silk fibroin hydrogels. Biophysical Journal. 97 (7), 2044-2050 (2009).
- Wang, X., Kluge, J. A., Leisk, G. G., Kaplan, D. L. Sonication-induced gelation of silk fibroin for cell encapsulation. Biomaterials. 29 (8), 1054-1064 (2008).
- Lee, J., Park, S. H., Seo, I. H., Lee, K. J., Ryu, W. Rapid and repeatable fabrication of high A/R silk fibroin microneedles using thermally-drawn micromolds. European Journal of Biopharmaceutics. 94, 11-19 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved