Method Article
In Vivo Mirati espressione delle proteine di optogenetica utilizzando seta/AAV film
In questo articolo
Riepilogo
Qui, presentiamo un metodo per la distribuzione di vettori di espressione virale nel cervello utilizzando seta fibroin film. Questo metodo consente la somministrazione mirata di vettori di espressione utilizzando fibre ottiche rivestite di seta/AAV, fibre ottiche coniche e windows cranica.
Abstract
La ricerca per comprendere i circuiti neurali come informazioni di processo in ordine per pilotare l'uscita comportamentale sono stata notevolmente facilitate da recentemente sviluppato metodi ottici per manipolare e monitoraggio dell'attività dei neuroni in vivo. Questi tipi di esperimenti si basano su due componenti principali: 1) impiantabili che forniscono accesso ottico al cervello e proteine 2) sensibili alla luce che cambiare l'eccitabilità neuronale o forniscono una lettura dell'attività neuronale. Ci sono un certo numero di modi per esprimere proteine sensibili alla luce, ma iniezione stereotassica di vettori virali attualmente è l'approccio più flessibile perché espressione può essere controllato con precisione genetica, anatomica e temporale. Nonostante la grande utilità di vettori virali, consegnando il virus al sito di ottica impianti pone numerose sfide. Iniezioni di virus stereotassiche chiedono interventi che aumentano il tempo chirurgico, aumentano il costo degli studi e costituiscono un rischio per la salute dell'animale. Il tessuto circostante può essere fisicamente danneggiato dalla siringa di iniezione e da immunogeno infiammazione causata dalla brusca somministrare un bolo di alto-titolo virus. Allineando le iniezioni con gli impianti ottici è particolarmente difficile quando la destinazione è piccole regioni profondità nel cervello. Per superare queste sfide, descriviamo un metodo per il rivestimento di più tipi di protesi ottiche con film composto di seta fibroin e Adeno-associato di vettori virali (AAV). Fibroina, un polimero derivato dal bozzolo del Bombyx mori, possibile incapsulare e proteggere biomolecole e possono essere trasformati in forme che vanno dalle pellicole solubile alla ceramica. Quando sono impiantati nel cervello, seta/AAV rivestimenti rilasciare virus all'interfaccia tra elementi ottici e cervello circostante, guida espressione proprio dove serve. Questo metodo viene implementato facilmente e promette di facilitare notevolmente gli studi in vivo della funzione del circuito neurale.
Introduzione
Nell'ultimo decennio ha prodotto un'esplosione di proteine ingegnerizzate sensibili alla luce per il monitoraggio e manipolare l'attività neurale1. Virus offrono una flessibilità senza paragoni per esprimere questi strumenti optogenetica nel cervello. Confrontato agli animali transgenici, virus sono molto più facili da produrre, trasportare e conservare, garantendo una rapida implementazione dei più recenti strumenti optogenetica. Espressione può essere mirata geneticamente distinte popolazioni neuronali, e virus progettato per il trasporto retrogrado può essere utilizzato anche per espressione basata su connettività neuronale2di destinazione.
Virus di solito vengono introdotti con iniezioni stereotassiche, che possono essere lungo e impegnativo. Targeting con precisione piccole regioni può essere difficile, mentre guidando espressione sopra vasti settori spesso richiede molte iniezioni. Inoltre, quando un dispositivo ottico viene successivamente impiantato nel cervello per fornire luce in vivo, l'impianto deve essere correttamente allineato con l'iniezione virale. Qui, descriviamo un metodo facilmente implementati per la distribuzione di vettori virali per il tessuto intorno un dispositivo impiantato utilizzando seta fibroin film3. Seta fibroin è commercialmente disponibile, ben tollerato dai tessuti neurali e può essere usato per produrre materiali con proprietà diverse. Seta film può essere applicato agli impianti utilizzando attrezzature di laboratorio comuni come microiniezione pipette o pipette a mano. Seta/AAV film eliminare il requisito per due interventi chirurgici e garantire che espressione virus-mediate è correttamente allineato all'impianto ottico. L'espressione risultante è vincolato all'estremità delle fibre e risultati in meno espressione indesiderate lungo la pista di fibra rispetto iniezioni stereotassiche.
Oltre a produrre espressione mirata all'estremità di piccole fibre, seta/AAV film può essere utilizzato per guidare diffusa (> 3 mm di diametro) espressione corticale sotto windows cranica. In vivo imaging 2 fotoni di sensori di movimento fluorescente è diventato uno strumento indispensabile per valutare il ruolo dell'attività neuronale nel guidare l'elaborazione sensoriale e cognitivo. Tuttavia, per guidare uniforme espressione sopra le vaste aree corticali, sperimentatori spesso eseguire iniezioni multiple. Queste iniezioni possono essere estremamente che richiede tempo e possono portare all'espressione incoerente in tutto il campo visivo. Al contrario, seta/AAV-rivestito cranica windows sono estremamente facili da produrre, ridurre notevolmente il tempo richiesto per interventi chirurgici e guidare il più notevolmente espressione centinaia di micron sotto la superficie corticale.
Protocollo
Tutti gli esperimenti che coinvolgono gli animali sono stati eseguiti secondo protocolli approvati dal comitato permanente di Harvard su Animal Care seguenti linee guida descritte nella NIH ci Guida per la cura e l'uso di animali da laboratorio. Per tutti gli esperimenti sono stati utilizzati topi C57BL/6 adulti di entrambi i sessi (6-15 settimane di età).
1. ottenere acquosa seta Fibroin
- Preparare o acquistare acquosa seta fibroin (5-7,5% w/v).
2. Mix seta acquosa con vettori di espressione di AAV
- Scegliere un vettore di espressione di AAV per guidare la proteina optogenetica o indicatore fluorescente di scelta.
Nota: Per ridurre al minimo il volume di seta/AAV che devono essere applicate agli impianti durante la guida ancora espressione robusta, stock-titolo AAV (magazzino titoli in genere ottenuti dai nuclei di vettore sono intorno a 10 ~13 gc/mL) è consigliabile. - Immediatamente prima della protesi di rivestimento, scongelare un'aliquota dell'AAV e combinare con 5-7,5% acquosa seta fibroin (questa miscela verrà denominata a come seta/AAV). In un tubo PCR 200 µ l, mescolare fibroina acquosa e AAV in un rapporto di 1:1 (uso windows cranica 1:4) immediatamente prima dell'applicazione. Delicatamente dispensare la soluzione dentro e fuori più volte per mescolare accuratamente la fibroina e AAV.
- Mantenere la miscela di seta/AAV sul ghiaccio prima dell'uso.
3. preparare attrezzature per la lavorazione e conservazione dei dispositivi di seta/AAV-rivestito
- Procurarsi attrezzature per rivestimento fibre ottiche e sfumatura-indice (GRIN) lenti (figure 1, 2).
- Costruire un supporto stabile puntale. Per tenere boccole in ceramica, praticare fori di 1,25 mm in un blocco di ¼" acrilico foglio. Fori per inserire viti dal lato per tenere i puntali sul posto.
Nota: Qualsiasi morsetto può essere utilizzato per questo scopo. - Posizionare un manipolatore con precisione sub-millimetrica per spostare le fibre ottiche (apparato stereotassica o altri micromanipolatore di precisione).
- Montare un supporto stabile per posizionare il microinjector.
- Utilizzare uno stereoscopio per visualizzare fibre ottiche e gocciolina di seta.
- Posizionare una fonte di luce per illuminare le fibre ottiche.
- Costruire un supporto stabile puntale. Per tenere boccole in ceramica, praticare fori di 1,25 mm in un blocco di ¼" acrilico foglio. Fori per inserire viti dal lato per tenere i puntali sul posto.
- Preparare l'apparecchiatura per la verniciatura di finestre craniche (Figura 3).
- Scegliere qualsiasi pipettatore P10.
- Ottenere un contenitore con coperchio.
Nota: Qualsiasi contenitore con fondo in silicone è suggerito — fondo morbido facilita il sollevamento Windows cranica.
- Preparare l'apparecchiatura per memorizzare gli impianti finiti (Figura 4).
- Ottenere una piccola camera a vuoto (1-5 L).
- Assicurarsi che ci sia spazio per memorizzare gli impianti in un frigorifero a 4 ° C.
4. applicare seta/AAV Film ai dispositivi
- Rivestimento fibre ottiche per l'espressione focale unità presso la punta della fibra
- Preparare gli impianti fibra cronica come descritto in precedenza4.
- Prima dell'uso risciacquare gli impianti con etanolo, quindi con acqua ultrapura per garantire che le fibre ottiche sono pulite.
Nota: Film seta aderire in modo più affidabile per la pulizia di superfici in vetro. - Preparare un dispositivo per tenere i puntali della fibra. Per puntali di diametro tipico 1,25 mm, utilizzare un blocco di acrilico trasparente, con ~1.3 ¼ di pollice mm fori e tappata viti entrando dal lato foro sugli impianti saldamente in posizione (Figura 1A).
- Monte titolare del puntale in un apparato stereotassica (o qualsiasi soluzione di manipolazione con precisione submillimeter) dotato di un microinjector. Collocare il supporto puntale sopra il microinjector e applicare la miscela di seta/AAV dal basso.
Nota: Questo è perché le applicazioni di grandi volumi dall'alto ha provocato seta/AAV che non si è limitato alla punta. Tuttavia, l'applicazione di molti piccoli volumi sequenziali dall'alto o basso può produrre depositi AAV/seta che sono confinati alla punta (anche se noi preferiamo applicare dal basso). - Tirare una pipetta di iniezione intracranica standard da vetro borosilicato capillare.
- Per renderlo più facile da
- Per produrre una punta di iniezione con una punta piana e pulita del diametro desiderato, tenere una pipetta in ogni mano e utilizzare la parte più spessa del cono su una pipetta a segnare altre pipetta nella posizione desiderata pausa.
- Strofinare delicatamente avanti e indietro in un movimento della sega (il metodo segnante il vetro).
- Dopo aver segnato la pipetta, applicare una leggera pressione alla punta della pipetta ha ottenuta con il corpo di altri pipetta per ottenere un taglio netto.
- Posizionare uno stereoscopio per dare una visione chiara delle facce fibra ottica.
Nota: Ingrandimento dovrebbe essere sufficiente per posizionare con precisione la pipetta di iniezione sopra il volto di fibre ottiche. - Inserire gli impianti della fibra nel supporto con il cervello-lato della fibra ottica rivolta verso il basso.
- Caricare la pipetta di iniezione con soluzione di seta/AAV, come per qualsiasi iniezione intracranica standard5. Caricare l'importo richiesto per il numero di impianti effettuati, più ~ 30% extra per ospitare le perdite dovute a Pipette intasamento. Ad esempio, se si fanno 10 impianti, quindi caricare con 100 nL depositi e prelevare ~1.3 µ l.
Nota: Seta/AAV può asciugare presso la punta della pipetta tra espulsioni, che possono ostruire la pipetta. Pipette di grande diametro (50-100 µm) sono meno probabilità di intasare. Zoccoli possono essere sloggiati spazzolandolo giù la punta della pipetta con un tampone di carta bagnata wipe o alcool. - Manovrare la pipetta di iniezione fino a quando è toccare o toccare quasi al centro della superficie della fibra ottica. Espulsione del 10-20 nL di seta/AAV soluzione. Ritirare la pipetta.
Nota: Il tasso di consegna non è critico, ma i tassi tipici sono di 5-20 nL/s. - Osservare il bolo di seta/AAV sulla superficie piana che appare come una cupola di liquida che si asciuga per una pellicola piana all'interno di ~ 1 min (Figura 1B).
- Ripetere i passaggi 4.1.9-4.1.10 fino a quando la quantità desiderata di seta/AAV è depositato (un totale di 20-200 nL per la maggior parte delle applicazioni). Durante la preparazione impianti multipli, applicare seta/AAV per un impianto e poi passare a ricoprire altri impianti prima di tornare al primo.
- Consentire 1 h per l'asciugatura prima di spostare gli impianti.
- Essiccare sottovuoto pernottamento a ~ 125 Torr (-25 a. Hg), 4 ° C. Farlo inserendo il titolare puntale intero in una camera a vuoto.
- Valutare la forma e la posizione del film seta risultante sotto un microscopio ad alta potenza. Garantire che i film sono confinati alla punta della fibra ottica superficie, essere relativamente sottile (> 100 µm) e simmetrica (Figura 1).
Nota: Asimmetrici o grandi pellicole di seta/AAV possono sloggiare dalla fibra durante l'impianto (Figura 1). La causa più comune dei problemi nasce dall'applicazione di singole grandi volumi anziché l'applicazione sequenza di molti piccoli volumi.
- Rivestimento conico fibre ottiche per espressione di unità lungo l'asse della fibra
- Ottenere gli impianti conici fibra ottica ed eseguire passaggi 4.1.2-4.1.8, tranne per il fatto che la fibra conica è posizionata lateralmente, tale che è perpendicolare all'iniettore (Figura 2A). Posizionare l'iniettore sopra la fibra conica.
Nota: Goccioline di liquide sul pose fibre conici di carico aggiunto sfide, perché la tensione superficiale tende a causare le goccioline saltare indietro sulla pipetta iniezione o migrare fino la fibra conica. Pipette di iniezione più piccoli (30-50 micron di diametro) aiutano a superare questo problema ma aumenta il rischio che si intasa la pipetta di iniezione. A causa della tensione superficiale, goccioline tendono ad aderire all'area della superficie più grande, quindi l'iniezione ottima Pipettare dimensione è dipende dalla dimensione della fibra conico e la tolleranza per l'impedimento occasionale. - Posizionare la pipetta di seta/AAV iniezione contro il lato della fibra ottica all'inizio del cono. Assicurarsi che la pipetta di iniezione sta toccando la fibra ottica.
- Espellere 20 nL di seta/AAV per avviare il processo di rivestimento. Assicurarsi che la gocciolina aderisce alla fibra ottica e rimane a livello di interfaccia della fibra/pipetta. Stoppino delicatamente la gocciolina verso la fine della punta della fibra come la seta/AAV asciuga (~ 45 s). Tenere la pipetta d'iniezione a contatto con la goccia di essiccazione per evitare l'intasamento il puntale della pipetta.
Nota: Ogni deposito deve rivestire circa 400 µm della fibra conico (Figura 2B). - Quando il primo bolo è quasi completamente asciutto, espellere un altro 20 nL e continuare la goccia lungo il cono di wicking.
Nota: La seta liquida aderirà alla seta secco, ancoraggio a un'estremità della goccia come la pipetta si muove lungo il cono. - Ripetere il passaggio 4.2.4 espulsione di piccole quantità di seta/AAV, e disegnando gradualmente la soluzione fino al lato del cono. espulsioni di 5-6 sono sufficienti per attraversare la superficie di un cono di 2,5 mm.
- Per guidare più espressione uniforme su tutti i lati della fibra, ruotare la fibra e ripetere i passaggi 4.2.2-4.2.5 fino a quando la quantità desiderata di seta/AAV è stata depositata.
- Se un appeso filo di seta/AAV secchi si estende oltre la punta della fibra, attentamente tagliata il filo con le forbici, o usare la pipetta di espulsione per piegare il filo indietro e farlo aderire alla rastremazione della fibra.
- Consentire 1 h per l'asciugatura prima di spostare gli impianti.
- Essiccare sottovuoto overnight a 4 ° C. Titolare del puntale intero possa essere inserito in una camera a vuoto.
- Valutare la forma e la posizione del film seta risultante sotto un microscopio ad alta potenza.
Nota: Il film non deve essere completamente uniforme ma non dovrebbe avere urti che si estendono oltre 100 µm oltre la superficie della fibra per minimizzare i danni ai tessuti circostanti durante l'impianto (Figura 3). Per ridurre le dimensioni della pellicola, è fondamentale che ogni goccia sia completamente asciutto prima che i depositi successivi vengano apportati.
- Ottenere gli impianti conici fibra ottica ed eseguire passaggi 4.1.2-4.1.8, tranne per il fatto che la fibra conica è posizionata lateralmente, tale che è perpendicolare all'iniettore (Figura 2A). Posizionare l'iniettore sopra la fibra conica.
- Gli impianti di lente GRIN rivestimento
- Ottenere smorfia lenti6,7 e ripetere i passi 4.1.2-4.1.8. L'iniettore può essere montato sopra.
- Cassetta di seta/AAV in una singola espulsione (1 µ l per una lente di diametro 1,0 mm).
Nota: Questo consente di ottenere una cupola di liquido che aderisce alla faccia della lente e si asciuga per produrre una pellicola uniforme (100-200 µm di spessore). Tuttavia, nel caso in cui una singola espulsione di grandi dimensioni si asciuga in modo non uniforme e produce un film che è più spesso vicino ai bordi della lente GRIN, prova del deposito più più piccole goccioline (100-200 nL) nel centro della superficie della lente (consentendo ogni gocciolina asciugare prima di depositare il prossimo) per garantire che il film guidare espressione al centro del campo visivo. - Consentire 1 h per l'asciugatura prima di spostare gli impianti.
- Valutare la forma e la posizione del film seta risultante sotto un microscopio ad alta potenza per garantire che il film copre la superficie della lente.
- Rivestimento di vetro cranica windows
- Preparare il vetro windows cranica di diametro 3 mm due aderente turno coprioggetti (n ° 1 di spessore) a una finestra di diametro 5 mm con adesivo ottico (per informazioni dettagliate, vedere Goldey et al 20148).
- Mescolare la seta: virus in un rapporto di 1:4 per ridurre la quantità totale di seta nel film. Quantità eccessive di seta non si dissolvono sotto windows cranica dopo l'impianto. Esperimenti di titolazione possono essere necessaria per determinare il rapporto e il volume che dà il profilo desiderato espressione.
- Mano una pipetta una goccia di 5 µ l sulla superficie del coprivetrino 3mm (verso il cervello). La goccia dovrebbe stendere per coprire la superficie di vetro intero (Figura 3).
- Consentire 2-3 h per l'asciugatura prima di passare a windows.
5. come conservare innesti seta/AAV-rivestiti
- Negozio di seta/AAV-rivestito di fibre ottiche in un essiccatore sotto vuoto raffreddato (~ 125 Torr, 4 ° C) prima dell'uso (Figura 4A).
- Non conservare windows cranica e lenti GRIN sotto vuoto, come grandi pellicole seta memorizzati sotto vuoto non riescono a sciogliere completamente dopo l'impianto. Windows cranica e smorfia lenti dell'impianto subito dopo l'asciugatura, o entro un giorno di fabbricazione se conservati a pressione atmosferica e a 4 ° C.
6. l'impianto di dispositivi
- Preparare gli animali per la chirurgia implantare come descritto in precedenza4.
- Brevemente, anestetizzare topi con un'iniezione intraperitoneale di chetamina/xilazina (100/10 mg/kg) e controllare la profondità dell'anestesia utilizzando un pizzico di punta delicato. Rasatura del cranio nella zona dell'impianto e pulire il cuoio capelluto con iodio e alcool.
- Montare gli animali in un dispositivo stereotassica e integrare l'anestesia usando una miscela di ossigeno e isoflurano (1-2%). Fare un'incisione nel cuoio capelluto sopra l'area di interesse ed eseguire una craniotomia sufficientemente ampia per accogliere l'impianto.
- Impianto di lenti9 e del microendoscope del fibre ottiche10 secondo procedure pubblicate in precedenza. Gestire gli impianti con cura, come il deposito di seta/AAV può essere buttato giù da una craniotomia imperfetta, o dall'impianto di cattura sul bordo del cranio. Abbassare lentamente l'impianto nel cervello (~ 2 mm/min).
- Impianto cranica windows come descritto in precedenza8. Non toccare il lato patinato della finestra ed evitare la finestra con il liquido di risciacquo se eseguendo "gavage", come questo può lavare via il virus. Per raggiungere la massima espressione, eseguire un durotomy.
7. valutazione dell'espressione e risoluzione dei problemi
- Per valutare l'espressione delle proteine espresse viralmente, consentire ~ 2-3 settimane per il virus guidare l'espressione, quindi eseguire perfusione intracardiaca con paraformaldeide al 4% in fosfato tampone del tessuto di cervello11 e processo di soluzione salina per fluorescente la microscopia12.
- Valutare l'espressione tramite microscopia fluorescente per il modello di espressione delle proteine optogenetica fluorophore-tag di immagine.
- Se il livello di espressione è insufficiente, aumentare la quantità di virus nei rivestimenti aumentando il volume totale del rivestimento seta/AAV, o preferibilmente utilizzando un virus titolo superiore.
Risultati
Per valutare il successo delle pellicole di seta/AAV in espressione di guida, abbiamo irrorato animali 2-3 settimane dopo l'impianto e preparato fette del cervello dalla regione di interesse. Immagini di fluorescenza del fluoroforo-etichetta optogenetica proteine (ChR2-YFP) fornirono una misura del grado di espressione (Figura 1). Fibre ottiche tipiche (230 µm di diametro) può facilmente ospitare 200 nL di seta/AAV. Con la pratica, gli sperimentatori possono raggiungere espressione altamente affidabile intorno alla punta delle fibre impiantati (Figura 5).
Per valutare l'espressione guidato da seta/AAV-rivestito cranica windows, iniziare inizio 7-10 giorni dopo l'impianto di formazione immagine. Abbiamo utilizzato due fotoni imaging per la visualizzazione, ma potrebbero anche essere usati altri metodi quali la fluorescenza di imaging con un CCD. Due possibili problemi con windows craniche rivestiti sono espressione insufficiente e seta film che non riescono a sciogliere e oscurare il campo visivo. Per aumentare l'espressione, suggeriamo di eseguire un durectomy prima di impiantare la finestra, e/o aumentando la quantità di virus nel film. Abbiamo raggiunto la migliore espressione utilizzando una miscela di 1:4 di seta e stock-titolo AAV, rispettivamente. Mentre questo rappresenta un numero sostanzialmente più grande di particelle virali che sono di solito utilizzati nelle iniezioni stereotassiche, il tempo chirurgico in diminuzione contatori il costo aggiuntivo marginale del virus. Nel frattempo, se seta film non riescono a sciogliere sotto la finestra, ridurre ulteriormente la quantità di seta usato per rivestire la finestra. La quantità totale di seta in windows rivestito è 10 - 100 volte più su impianti di fibra, e il film è meno incorporati nel tessuto e quindi non può essere esposti ai livelli di attività proteolitica che può dissolversi seta film13. Tuttavia, la presenza di alcuni seta è essenziale per il raggiungimento di espressione sotto windows3, probabilmente perché un film fatto di virus da solo è lavato via dal fluido interstiziale durante la chirurgia.

Figura 1: applicazione di seta/AAV film a fibre ottiche. (A) cronica fibra gli impianti sono posizionati fibra verso il basso in un supporto (inserto) montato su un traduttore XYZ. Un microinjector fisso sotto le fibre dispensa seta/AAV sulle punte della fibra. Uno stereoscopio permette la visualizzazione del processo. (B) applicare seta/AAV a suggerimenti di fibra in piccole quantità (10-20 nL). Dopo l'espulsione di un bolo, ritrarre la pipetta e consentire ~ 60 s per la goccia a secco per una pellicola piana. Ripetere il processo fino a quando il volume richiesto è stato applicato alla punta della fibra. (C) controlli rivestimenti seta. Rivestimenti ottimali devono essere centrati sulla punta della fibra (a sinistra), mentre i rivestimenti impropri si estendono verso l'esterno dalla faccia della fibra che li rende più inclini a sloggiare dalla fibra (a destra). (D) rappresentante fibre rivestite con 200 nL di seta/AAV e il risultante AAV-driven ChR2-YFP espressione 2 settimane dopo l'impianto. Il rivestimento di seta/AAV compatto sulla sinistra ha provocato robusta espressione, mentre il rivestimento sulla destra ha sporto passato il volto della fibra e non portato quasi nessuna espressione, probabilmente perché la seta/AAV non aderì alla fibra ottica durante l'impianto. Scala bar 0,2 mm (fibre) e 1,0 mm (fettine di cervello). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: installazione di rivestimento conica fibra impianti. (A) il microinjector è montato sopra il supporto conico in fibra e fibre conici sono posizionati ortogonalmente alla siringa di espulsione. Begin (B) nel punto più largo punto (nel riquadro) e piccoli volumi di espulsione mentre si muove la siringa di espulsione verso il punto del cono. In questo modo un rivestimento continuo lungo la lunghezza del cono. (C) rappresentanza conica fibra ricoperta di seta miscelato con Fast Green per facilitare la visualizzazione. Clicca qui per visualizzare una versione più grande di questa figura.
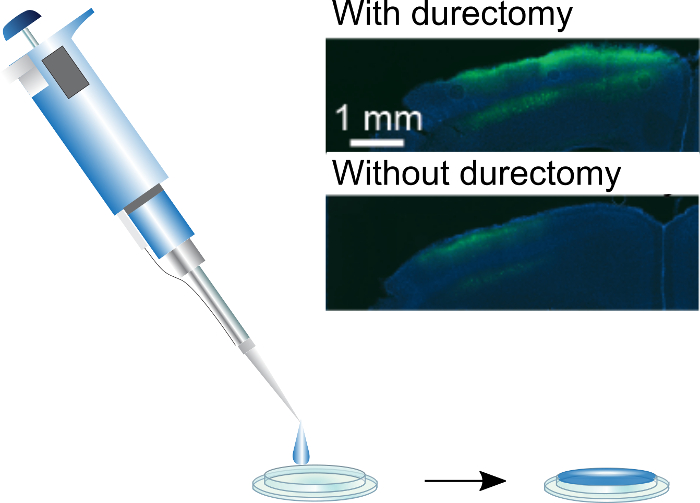
Figura 3: rivestimento cranica windows. Seta/AAV può essere windows cranica applicata usando una pipetta a mano. Una finestra di diametro standard 3 mm possa essere rivestita con una goccia 5 µ l, che si asciuga lentamente per una pellicola piana. Inserto: Espressione di GCaMP6f risultante da windows cranica seta/AAV-rivestito impiantato con e senza durectomies. Questa figura è stata adattata da Jackman et al. (2018) 3. per favore clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: memorizzazione di seta/AAV rivestito impianti. (A) per rimuovere l'umidità residua e preservare l'efficacia virale, gli impianti devono essere conservati sotto vuoto a 4 ° C fino a quando non utilizzato. Gli impianti memorizzati in questo modo rimangono vitali per almeno 7 giorni. (B) espressione risultante da seta/AAV 4 fibre rivestiti impiantati dopo 7 giorni di deposito. Clicca qui per visualizzare una versione più grande di questa figura.
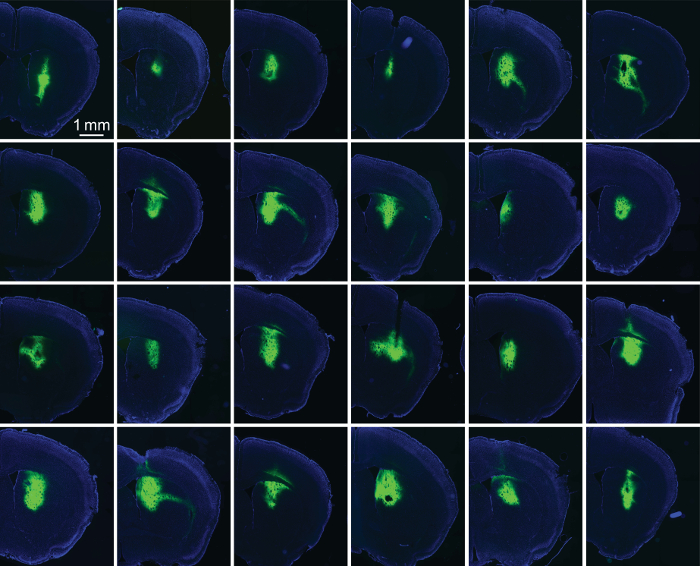
Figura 5: seta/AAV-GFP rivestito fibre ottiche in modo affidabile guidare espressione. Immagini fluorescenti delle fette da 24 striatal consecutivi gli impianti. Ogni impianto è stato rivestito con 100-400 nL di 1:1 seta/AAV-GFP. Questa coorte degli innesti indica la capacità di seta per limitare l'espressione al sito dell'impianto (in questo caso nello striato dorsale). Fluorescenza GFP è indicata in verde; Macchiatura di DAPI è indicata in blu. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'uso di seta/AAV per indirizzare l'espressione delle proteine optogentic supera i limiti degli approcci che sono attualmente in uso. Anche se molti studi correttamente utilizzano iniezioni di AAV per esprimere proteine optogenetica, è difficile da allineare espressione fino alla punta delle fibre ottiche, alle regioni intorno alla lunghezza delle fibre conici e nella regione di visualizzazione di una lente GRIN. A causa di disallineamento tra componenti ottici ed espressione optogenetica, iniezioni stereotassiche possono essere inaffidabile, e molti esperimenti fallire. La seta/AAV etichettatura metodo che descriviamo qui risolve questo problema. Semplifica inoltre la procedura eliminando una seconda fase chirurgica e in alcuni casi eliminando la necessità di un secondo intervento chirurgico. Può anche essere difficile utilizzare i virus per ottenere espressione diffusa sotto windows cranica e sperimentatore in genere eseguire lunghi interventi chirurgici per iniettare il virus in più posizioni. La capacità di ottenere espressione diffusa sulle grandi regioni corticali da semplicemente windows cranica di rivestimento con seta/AAV è una semplificazione che elimina la necessità per le molte iniezioni invasive.
Un altro potenziale vantaggio del metodo seta/AAV è che esso potrebbe indurre meno infiammazione nei tessuti neurali rispetto alle iniezioni virale. Iniezione di alto-titolo AAV nel cervello può causare le risposte infiammatorie quali astrocytosis reattivo che hanno il potenziale di alterare cellular e circuito proprietà14,15 (anche se tali complicazioni potenziali sono solitamente ignorato). Seta film indurre risposta poco immunogeno su proprio13 e seta/AAV film dovrebbero rilasciare il virus nel corso di molte ore o giorni16, che potrebbe abbassare il carico virale nel tessuto circostante e riducono le risposte immunogeniche. Con gli approcci convenzionali in cui l'impianto di un dispositivo è preceduta da un'iniezione di AAV, le risposte infiammatorie possono derivare da sia l'impianto e l'iniezione. In futuro sarà opportuno confrontare sistematicamente gli approcci convenzionali e il metodo di seta/AAV per determinare se la seta/AAV film nel complesso riduce le risposte infiammatorie.
Diversi passaggi sono fondamentali per il riuscito uso di seta/AAV film. La cosa più importante, il rivestimento delle fibre ottiche deve essere fatto con attenzione, come descritto nei metodi e la posizione dei film secchi deve essere valutata attentamente mediante ispezione visiva sotto un microscopio per garantire che i film sono compatti, nella posizione corretta, e aderire alla faccia della fibra ottica. Qualsiasi seta/AAV sui lati della fibra ottica porteranno all'espressione di fuori della regione di interesse e misshaped film che sporgono oltre il fronte della fibra può staccarsi durante l'impianto e portano a inaffidabili o alcuna espressione. Le tecniche che descriviamo per applicare seta/AAV ai dispositivi impiantabili possono essere adattati all'uso di tutti i materiali sono che sono prontamente disponibili e consentono la precisa deposizione di piccoli volumi di seta/AAV.
Un po' di pratica è necessaria per ottenere risultati accurati e riproducibili. Se l'espressione è osservata lungo la pista della fibra, è probabile che il seta film essiccato dal lato della fibra piuttosto che il volto di fibra. Ripetere il processo di fabbricazione e controllare attentamente secchi gli impianti per i segni che film stanno asciugando sul lato della fibra. Perché i film di seta/AAV sono otticamente trasparenti, può contribuire alla pratica applicazione di seta miscelato con colorante (veloce verde o un colorante simile) per visualizzare meglio la forma delle pellicole risultante (Figura 2). Se non è un'espressione, è probabile che il film seta sloggiato dalla punta della fibra durante l'impianto. Suggeriamo l'uso di magazzino-titolo virus quando si effettuano gli impianti. Per fibre ottiche, questo riduce il volume totale che deve essere applicato alle fibre di piccolo diametro. Se la dimensione del rivestimento è una preoccupazione considera di attesa più lunghi tra ogni applicazione nL 10 per consentire la completa asciugatura della goccia depositata. Seta/AAV goccioline si asciugano più rapidamente sotto una lampada calda. Per windows cranica, alto-titolo virus può essere necessario fornire un'adeguata carica virale attraverso la pia o dura. Alcuni tipi di protesi possono sciogliere seta e rilasciare più facilmente di altri AAV. Abbiamo trovato che windows cranica impiantato sopra la superficie del cervello richiedono un rapporto più basso di seta/virus raggiungere espressione affidabile, forse a causa di diverse dinamiche di liquido spinale cerebrale o l'attività della proteasi. Se l'espressione non può essere aumentata aumentando le concentrazioni efficaci di AAV, diminuendo il volume di seta acquosa è un'alternativa plausibile.
Infine, è importante conservare correttamente i componenti ottici e impiantarli abbastanza presto dopo che sono preparati. Abbiamo dimostrato che rivestite con fibre che sono refrigerati sottovuoto possono essere conservati per molti giorni prima di utilizzare. Stoccaggio di vuoto rimuove l'umidità residua17 che può ridurre la solubilità di seta film e anche aiutare a mantenere l'efficacia virale. Idealmente, le fibre ottiche devono essere impiantate entro 24 ore dalla fabbricazione. Tuttavia, troviamo che fibre di seta/AAV-rivestito memorizzati sotto vuoto gestire simili livelli di espressione quando sono impiantati 7 giorni dopo la fabbricazione (Figura 4B). Al contrario, windows craniche rivestiti e lenti GRIN ha guidato l'espressione più affidabile quando sono stati essiccati a temperatura ambiente e utilizzati entro ore di preparazione. La ragione di questa disparità rimane poco chiara. Ulteriori studi possono essere necessari per perfezionare le condizioni di preparazione e stoccaggio estendere ulteriormente il tempo di stoccaggio.
Seta/AAV-rivestito cranica windows hanno un notevole potenziale perché hanno drasticamente abbreviare i tempi chirurgici e sono estremamente semplici da produrre, ma attualmente questo metodo presenta limitazioni. Windows cranica rivestito uniformemente etichetta ampie aree della corteccia e guidare sufficiente espressione in layer 2/3 per GCaMP di imaging, con un po ' meno espressione negli strati più profondi. Tuttavia, iniezioni stereotassiche guidare espressione più robusto e forniscono più controllo sopra gli strati mirati per l'espressione. Espressione affidabile è stata realizzata soltanto quando la dura madre è stato rimosso. Sebbene il dura viene spesso rimosso per molti 2-fotone imaging esperimenti migliorare la qualità di immagine8, per molti esperimenti è auspicabile per ottenere l'etichettatura in modo meno invasivo. Pertanto abbiamo esplorato nostra capacità di utilizzare seta/AAV per etichettare regioni corticali senza rimuovere la dura madre. Abbiamo ottenuto alcuni etichettatura, ma è possibile che questa era una conseguenza di danneggiare la dura madre in procinto di preparare il craniotomy. Ulteriore studio è necessario per windows cranica rivestito da utilizzarsi per etichettare in modo affidabile la corteccia senza rimuovere la dura madre.
La preparazione di acquosa seta fibroin dai bozzoli di Bombyx Mori è descritto in dettaglio in Rockwood et al. (2011) 18. acquosa seta fibroin è ora disponibile in commercio (5% p/v). Anche se la maggior parte dei nostri esperimenti sono stata eseguita utilizzando scorte acquosa seta fibroin preparate nel nostro laboratorio (5-7,5% w/v), abbiamo ottenuto risultati simili utilizzando commerciale della fibroina acquosa. Fibroina acquosa è stabile a 4 ° C fino a 3 mesi, dopo di che spontaneamente passa da liquido a idrogel18. Si consiglia di scorte di fibroina essere diviso in parte aliquota ~ 1 mL e conservate a-80 ° C. Un'aliquota di lavoro di 1 mL (sufficiente per centinaia di impianti di rivestimento) può essere conservata a 4 ° C e utilizzata fino a quando comincia a gel. Essere attenti a non scuotere, vortice, agitare o aggressivamente Pipettare fibroina acquosa, come le forze di taglio possono portare a gelificazione19,20.
Seta/AAV film permettono una vasta gamma di modelli di espressione, dall'espressione corticale diffusa sotto windows cranica, di espressione precisa subcortical all'estremità di una fibra ottica di piccolo diametro. Queste tecniche sono state sviluppate per sfruttare i vantaggi di vettori di espressione comune AAV ma probabilmente potrebbero essere usate per disperdere altri vettori di espressione come lentivirus o virus di rabbia nel cervello. Seta film potrebbe anche essere realizzati in forme tridimensionali per migliorare il rilascio virale nel tessuto. Ad esempio, in ordine all'espressione forte unità sotto corticale windows senza l'uso di un durotomy, windows cranica potrebbe rivestire con matrici di seta microaghi che avrebbero trafitto il virus dura e rilascio nel più profondo strati corticali21. Ulteriore affinamento porteranno probabilmente a una migliore proprietà di rilascio di virus e nuove applicazioni per i film di seta/AAV.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori desiderano ringraziare J. Vazquez per illustrazioni, d. Kaplan e C. Preda per reagenti e indicazioni utili e i laboratori del B. Sabatini e C. Harvey per l'imaging in vivo . La microscopia è stato reso possibile da M. Ocana e il centro di formazione immagine di neurobiologia, sostenuta in parte dal centro di Imaging neurale come parte di un Istituto nazionale dei disordini neurologici e colpo (NINDS) P30 Core Center concedere (NS072030). Questo lavoro è stato sostenuto il GVR Khodadad Family Foundation, la Fondazione di Nancy Lurie Marks e dalle sovvenzioni NIH, NINDS R21NS093498, U01NS108177 e R35NS097284 di NINDS a W.G.R e da un postdoctoral fellowship di NIH F32NS101889 a C.H.C.
Materiali
| Name | Company | Catalog Number | Comments |
| Aqueous silk fibroin | Sigma | 5154-20ML | Aqueous Silk Fibroin (5% w/v) for making films |
| Microinjector to deposit silk/AAV | Drummond | 3-000-207 | Nanoject III nanoliter injector |
| Manipulator to hold implants | Narashige | MM-33 | Micromanipulator |
| Stereoscope to visualize silk deposits | AmScope | SM-6TX-FRL | 3.5X-45X Trinocular articulating zoom microscope with ring light |
| Vacuum chamber to store implants | Ablaze | N/A | 3.5 Quart Vacuum Vac Degassing Chamber |
| Optional, implant holder for storage | N/A | N/A | To store premade optical fibers, drill a grid of ~4 mm-deep holes with a diameter just larger than the ferrule diameter into a plastic block. |
| Optical fiber | Thorlabs | FT200EMT | Ø200 µm Core Multimode Optical Fiber for fiber implants |
| Ferrules | Kientec | FZI-LC-230 | LC Zirconia Ferrule for fiber implants |
| Various materials for manufacturing chronic fiber implants | Various | N/A | For detailed procedure, see Ung K, Arenkiel BR. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of visualized experiments: JoVE. 2012(68). |
| Tapered fiber implants | Optogenix | Lambda-B | Tapered fiber implants |
| GRIN lenses | GoFoton | CLH-100-WD002-002-SSI-GF3 | GRIN lenses |
| Small glass cranial windows | Warner | 64-0726 (CS-3R-0) | Small round cover glass, #0 thickness |
| Large glass cranial windows | Warner | 64-0731 (CS-5R-0) | Small round cover glass, #0 thickness |
| Various materials for manufacturing cranial windows | Various | N/A | For detailed procedure, see Goldey GJ et al. Removable cranial windows for long-term imaging in awake mice. Nature protocols. 2014 Nov;9(11):2515. |
Riferimenti
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nature Methods. 11 (3), 338-346 (2014).
- Tervo, D. G., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Jackman, S. L., et al. Silk Fibroin Films Facilitate Single-Step Targeted Expression of Optogenetic Proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Ung, K., Arenkiel, B. R. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. Journal of Visualized Experiments. (68), e50004(2012).
- Lowery, R. L., Majewska, A. K. Intracranial injection of adeno-associated viral vectors. Journal of Visualized Experiments. (45), (2010).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocols. 7 (1), 12-23 (2011).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11 (3), 566-597 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Park, J. J., Cunningham, M. G. Thin sectioning of slice preparations for immunohistochemistry. Journal of Visualized Experiments. (3), 194(2007).
- Cao, Y., Wang, B. Biodegradation of silk biomaterials. International Journal of Molecular Sciences. 10 (4), 1514-1524 (2009).
- Jackman, S. L., Beneduce, B. M., Drew, I. R., Regehr, W. G. Achieving high-frequency optical control of synaptic transmission. Journal of Neuroscience. 34 (22), 7704-7714 (2014).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nature Neuroscience. 13 (5), 584-591 (2010).
- Hines, D. J., Kaplan, D. L. Mechanisms of controlled release from silk fibroin films. Biomacromolecules. 12 (3), 804-812 (2011).
- Hu, X., et al. Regulation of silk material structure by temperature-controlled water vapor annealing. Biomacromolecules. 12 (5), 1686-1696 (2011).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Yucel, T., Cebe, P., Kaplan, D. L. Vortex-induced injectable silk fibroin hydrogels. Biophysical Journal. 97 (7), 2044-2050 (2009).
- Wang, X., Kluge, J. A., Leisk, G. G., Kaplan, D. L. Sonication-induced gelation of silk fibroin for cell encapsulation. Biomaterials. 29 (8), 1054-1064 (2008).
- Lee, J., Park, S. H., Seo, I. H., Lee, K. J., Ryu, W. Rapid and repeatable fabrication of high A/R silk fibroin microneedles using thermally-drawn micromolds. European Journal of Biopharmaceutics. 94, 11-19 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon