Method Article
Вся ячейка электрофизиологии первичного культивировали мышиных Enterochromaffin клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
Enterochromaffin (EC) клетки составляют небольшую часть желудочно-кишечного тракта эпителиальных клеток. EC клетки электрически возбудимых и освобождение серотонина, но трудности в культивировании и выявления EC клетки имеют ограниченный физиологические исследования. Представленные здесь метод устанавливает основной культуры модель для изучения единичных клеток EC по электрофизиологии.
Аннотация
Enterochromaffin (EC) клетки в эпителии желудочно-кишечного тракта (ЖКТ) составляют самая большая субпопуляция enteroendocrine клеток. Как специализированные Сензорные клетки клетки EC смысл Люминал стимулы и конвертировать их в серотонина (5-hyroxytryptamine, 5-HT) релиз события. Однако электрофизиологии эти клетки плохо понимают, потому что они трудны для культуры и определения. Метод, представленные в этой бумаги очертания первичной EC клеточных культур оптимизирован для одной ячейки электрофизиологии. Этот протокол использует репортером трансгенных голубой флуоресцентный белок (СЛП) для идентификации клеток мыши EC в смешанных первичных культур, развитии подход для получения высокого качества записи клеточных электрофизиологии в режимах напряжения и тока клещи.
Введение
Желудочно-кишечного эпителия (Ги) является разнообразное сообщество, состоящее из нескольких типов клеток. Enteroendocrine клетки составляют примерно 1% от всех эпителиальных клеток, и клетки enterochromaffin (EC) являются крупнейшим enteroendocrine клеток населения1. Недавние исследования показывают, что enteroendocrine2 и3,EC4 клетки электрически возбудимых. Мы заинтересованы в понимании основной EC клеток электрофизиологии. Таким образом целью данного исследования было установить первичных культур клеток EC, оптимизированный для клеточных электрофизиологии.
Существующие ячейки EC линии, которые производят и выделяют 5-HT (например, QGP-15, Бон6,7KRJ-1) и были использованы для изучения электрофизиологии5,8 обычно создаются из увековечен опухолевой тканей. В то время как информация, полученные от этих клеточных линий ценные5,8, исследования электрофизиологии главной ячейки необходимы для правильного понимания физиологии клетки ЕС. Электрофизиологии первичных клеток ЕС требует изоляции и культуры одного эпителиальных клеток, которая ограничивается низкой жизнеспособности эпителиальных культур.
Метод культуры, представленные в настоящем исследовании опирается на трансгенных мышей с дневно обозначенные EC клетки, как Tph1-CFP9, используемые в данном исследовании. Этот метод оптимизирует смешанных начальных эпителиальных культур разработаны ранее10 2,для одной ячейки электрофизиологии3. Предыдущие методы используемые комбинации трипсина/ЭДТА плюс коллагеназы A или ЭДТА и DTT для ферментативного пищеварения и используемые градиенты плотности специально изолировать и культуры свинка11 и крыса EC клетки12. Совсем недавно кишечные organoids были созданы и механически нарушается для электрофизиологических записи4. Культур, используя эти методы хорошо подходят серотонина релиз эксперименты, RT-ПЦР анализа и, хотя они могут быть использованы для электрофизиологии, зависят от успеха времени органоид поколения, градиенты плотности для выявления EC клетки и Сотовый деструктивные последствия трипсина и ЭДТА. Напротив протокол, описанные здесь повышает ферментативную и механических методов лечения, оптимизирует культивирования условий и упрощает процедуры для производства одного и здоровой клетки EC подходит для высоких сотовых стандартов, необходимых для электрофизиологии.
Этот метод будет полезным для ученых, которые хотят работать на основной EC клетки в смешанных культур, а не увековечен культур и хотят расследовать электрофизиологии одиночных клеток. Однако она может оказаться менее подходящим для изучения клеточных популяций, требующих сортировки или долгосрочный культур, которые требуют выживания прошлых 72 ч.
протокол
Все методы, описанные здесь были одобрены институциональный уход животных и использование Комитет (IACUC) клиники Майо. Часть культуры главной ячейки этот протокол основан на опубликованных ранее методы, которые могут ссылаться для дальнейших деталей10. Все экспериментальные процедуры должны быть одобрены (IACUC), и все эксперименты должны выполняться в соответствии с соответствующих руководящих принципов и правил.
1. Культура подготовка
-
Средства массовой информации.
- Подготовить EC клеток, полный культуры средств массовой информации с высокой глюкозы [4500 мг/Л] Дульбекко изменение средних орла (DMEM) дополнены 5% плода Bovine сыворотки (ФБС), 1% L-глютамина и 1% пенициллин-стрептомицином (Таблица 1).
Примечание: Средства массовой информации могут храниться при температуре 4 ° C на срок до одного месяца. - Фильтр EC клеток полный культуры средств массовой информации и место 25 мл СМИ в Тюбик 50 мл при 37 ° C.
- Подготовить пищеварение СМИ с высоким глюкозы [4500 мг/Л] DMEM дополнена 0,1% бычьим сывороточным альбумином (БСА) (Таблица 1).
- Фильтр пищеварение средства массовой информации и место четыре 10 мл аликвоты СМИ в отдельные 50 мл трубки и инкубировать в ванну воды 37 ° C.
Примечание: Средства массовой информации могут храниться при температуре 4 ° C на срок до одного месяца.
- Подготовить EC клеток, полный культуры средств массовой информации с высокой глюкозы [4500 мг/Л] Дульбекко изменение средних орла (DMEM) дополнены 5% плода Bovine сыворотки (ФБС), 1% L-глютамина и 1% пенициллин-стрептомицином (Таблица 1).
-
Фермент.
- Вес 4 мг (для тощая кишка) или 24 мг (для Колон) XI коллагеназа [≥800 единиц/мг] в пробки microcentrifuge 1,5 мл.
Примечание: Коллагеназа стабильным на уровне-20 ° C на срок до одного года. - Ресуспензируйте коллагеназы аликвота в 1 мл холодного льда PBS с Ca2 + и Mg2 +. Вихрь решение тщательно объединить и место на льду.
- Вес 4 мг (для тощая кишка) или 24 мг (для Колон) XI коллагеназа [≥800 единиц/мг] в пробки microcentrifuge 1,5 мл.
-
Покрытие плиты культуры.
- Оттепель 150 мкл внеклеточная матрица на ночь при 4 ° c на льду.
- Сделайте раствор 5% w/v внеклеточного матрикса, смешивая 100 мкл талой внеклеточная матрица с 2 мл ледяной DMEM сыворотки Бесплатные высокого глюкозы.
Примечание: Внеклеточная матрица затвердевает при комнатной температуре и должны быть обработаны с предварительно охлажденные пипетки, труб и СМИ до готовности блюд пальто. - Сразу же Герб стекла внутренний круг стекло дно блюда 35 мм с 250 мкл раствора внеклеточная матрица 5%. Этот рецепт будет охватывать до 8 блюд.
- Место стекло дно блюда в инкубаторе 37 ° C в течение оставшихся шагов изоляции культуры клеток. Внеклеточная матрица занимает как минимум 1 час для установки, но может инкубированы для до 2,5 ч при выполнении других шагов изоляции.
Примечание: Инкубаций дольше, чем 3 h можно создать наращивание внеклеточного матрикса, который может препятствовать уплотнение образование в течение всей ячейки электрофизиологии.
2. ткань изоляции
- Согласно этические принципы, жертву 3Для 6 недельных мужского или женского пола Tph1-CFP трансгенные мыши (складе Лаборатория Джексон: 028366)9 или другой штамм репортер.
Примечание: Мы используем смертельную дозу повышение уровня углекислого газа и шейки матки дислокации, как дополнительного средства для обеспечения смерти. АВАМ Комитет по эвтаназии также считает шейки матки дислокации метод допустимый первичный эвтаназии лицами подготовку в его использования, если животные сначала седативные. - Закрепите Усыпленных мыши вне на сцене рассечение пенополистирола с помощью иглы 21 G. Обеззараживанию мыши живота с 70% этиловом спирте.
- Потяните кожу мыши тугой с помощью микро рассечение щипцы (#5), и затем используйте острые хирургические ножницы сделать поперечный разрез в нижней части живота мыши подвергать внутрибрюшинного полости. Сделайте еще один разрез вертикально вверх живота до тех пор, пока грудная клетка подвергается.
- Используйте микро рассечение щипцы для перемещения слепой кишки в левую кнопку мыши, чтобы получить четкое представление о двоеточие.
- Использование микро Рассечение ножницами вырезать наиболее Дистальная часть толстой кишки (но по-прежнему проксимальнее прямой кишки) и сделать второй сократить дистальной части желудка. Место, извлеченные кишечника в 100 x 15 мм2 Петри заполнены с 20 мл ледяной фосфата в буфер солевой раствор (PBS).
- Используйте небольшой линейки для измерения и вырезать 10 см либо середины толстой кишки и тощей кишки. Экстракт толстой кишки путем измерения 10 см сегмент расположен проксимально первого пропила, принятые выше прямой кишки кишечника. Определите тощей кишки, складывающиеся весь кишечник в половину и делая первый надрез в середине и второй надрез 10 см проксимальнее первый сократить.
Примечание: По-прежнему выполнять все последующие изоляции шаги на льду. - Заполните 6 мл шприц с лед холодной PBS и поместите иглу шприца в Люмене извлеченные кишечных сегмента. Используйте корнцанг микро рассечение зажим и печатью кишечника вокруг иглы шприца и осторожно промойте 10 мл PBS через просвет полоскать прочь фекалиями.
- Инвертируйте кишечных тканей, нежно ткачество микро рассечение щипцы через просвет, щипать кишечной стенки и втягивания проксимальнее кончик щипцы ткани. Повторите этот процесс до тех пор, пока сегмент изнутри наружу с люмен, наружу.
- Использование микро Рассечение ножницами в сегмент ткани нарезают кусочками по 1 см.
- Используйте микро рассечение щипцы для передачи ткани сегментов в 50 мл стакан, наполненный 5 мл стерильной PBS. Используйте ножницы микро рассечение, чтобы фарш куски ткани до консистенции сжиженные.
- Поместите фарш из ткани и 15 мл холодного льда PBS в чистой 50 мл трубки, передачи пипеткой. Нарезанных 2 раза с пипеткой передачи, ждать ткани, чтобы урегулировать, удалить 15 мл супернатант PBS и заменить свежим PBS. Повторите этот процесс в три раза, пока не ясно, PBS.
- Место 50 мл трубки с кусочками ткани промывают на льду и принести ведро льда в культуре ткани капюшоном.
3. ферментативные и механические пищеварение
-
Первый пищеварение
- Из водяной бани получить один из 50 мл пробирки с 10 мл подогретым пищеварение средства массовой информации. В Тюбик 50 мл 250 мкл PBS коллагеназы решения и кусочки рубленого кишечных тканей.
Примечание: позаботьтесь, чтобы избежать, включая любые PBS из предыдущих шагов стирки. - Место Тюбик 50 мл на водяной бане 5 минут (толстой кишки или тощей кишки) при 37 ° C. Встряхнуть трубки 2 x в минуту.
Примечание: Оптимальные сроки и интенсивность механических пищеварение может варьироваться и должны быть определены пользователем. Для определения условий оптимального пищеварения, 10 мкл Алиготе клеток может рассматриваться после каждого пищеварение. Во время пищеварения 1 супернатанта должен состоять из скопления клеток. - Медленно нарезанных ткани один раз с 10 мл Серологические Пипетки. Кратко пусть ткани, которую штук урегулировать, а затем использовать пипетку передачи для удаления всего 10 мл супернатант.
- Из водяной бани получить один из 50 мл пробирки с 10 мл подогретым пищеварение средства массовой информации. В Тюбик 50 мл 250 мкл PBS коллагеназы решения и кусочки рубленого кишечных тканей.
- Второй пищеварения: Повторите шаги 3.1.1 до 3.1.3. Увеличить время инкубации до 10 мин, если переваривание Колон и сохранить время инкубации в 5 мин для тощей кишки.
Примечание: После наблюдения, супернатанта должно по-прежнему состоят из большого скопления клеток. -
Третий пищеварение
- Повторите шаг 3.1.1
- Место 50 мл трубки в 37 градусов водяной бане 10 минут (толстой кишки или небольших тощей кишки). Встряхните трубки 2-3 x / мин в более высокой интенсивностью, чем пищеварения 1 и 2.
- Медленно Пипетка ткани вверх и вниз с Серологические Пипетки 10-мл. Разрешить куски ткани поселиться на короткое время.
Примечание: Супернатант должен состоять из комбинации одиночных клеток и небольшие сгустки. - Использование пипетки передачи место 10 мл супернатант в новом 15 мл трубку, добавить 2 мл утепленные EC клеток полный культуры средств массовой информации, и инвертируем раз смешивать.
- Спина на 100 x g 5 мин при комнатной температуре, а затем использовать передачи пипетку, чтобы удалить супернатант. Используйте передачу пипетки для Ресуспензируйте оставшиеся таблетки по 2,5 мл утепленные EC клеток полный культуры средств массовой информации.
- Четвертый пищеварения: Повторите шаги 3.3.1 до 3.3.5. Увеличить время инкубации до 15 мин для Колон и остаются в 10 мин на тощей кишки.
Примечание: Супернатант теперь должен состоять из одной клетки.
4. клеточная культура
- Используйте передачу пипетки для объединения клеточных суспензий, собранных от пищеварения 3 и 4 в новой трубки 15 мл (5 мл общий объем).
- Удаление 10 мкл Алиготе клеток для подсчета с Горяева и спина оставшиеся суспензию клеток на 100 x g 5 мин при комнатной температуре.
Примечание: Суспензию клеток окончательный будет состоять из небольшой пряди и одиночных клеток. - Удалить супернатант с передачей пипетки и Ресуспензируйте гранулы в ЕС клеток полный культуры СМИ на плотности 1,000,000 клеток / мл.
Примечание: Окончательный объем суспензии клеток будет зависеть окончательный мобильный граф. Типичные клетки подсчитывает колеблются от 2 000 000 до 4000000. - Удалите с покрытием стекло дно культуры блюда из инкубатора. Используйте P1000 пипетки для замены внеклеточная матрица от каждой культуры блюдо с 250 мкл суспензии окончательного клеток.
Примечание: Внеклеточная матрица покрытие имеет тенденцию прилипать к краям стекло дно тарелки. Особое внимание необходимо снять покрытие от вдоль края для предотвращения накопления гель. - Сделайте раствором штока ингибитора Y-27632 рок на 1 мм. 2.5 мкл Стоковый раствор, чтобы каждое блюдо дно стекла для достижения рабочей концентрации ингибитора рок 10 мкм в каждое блюдо.
Примечание: Этот шаг имеет решающее значение для выживания тощую культур, но является необязательным для Колон. - Место каждой культуры блюдо в 37 ° C и 5% CO2 инкубатора для 24-72 ч (рис. 1).
5. Подготовка EC клеток для клеточных электрофизиологии
- Линия внутренний диаметр микроскопа с двумя полосками 5 x 0.5 см воск фильм создать кольцо. Смонтируйте 35-мм ячейку культуры блюдо в кольцо (рис. 2A-B).
-
Промывайте обе плавающего мусора, такие как неприсоединенной внеклеточная матрица или мертвые клетки и культуральных сред сыворотки полностью от EC клеток, чтобы предотвратить либо препятствовали печать формирования между ЕС и электрода. Использование трех следующих вариантов для достижения тщательного клеток стирки достаточно для электрофизиологии:
- Вариант 1: Обмен решение является более эффективным в камере длиной больше, чем циркуляр камеры. Поскольку ЕС клетки были культивировали в раунде 35 мм блюда, создайте пластиковые эллиптическая вставка для блюдо.
- Создайте Вставка 3D печать или традиционных фрезерных методами. Вставка, мы использовали мололи из акрилового пластика с следующие размеры (в мм): внешний диаметр, 34,5; внутреннего эллипса, 20 x 9; Высота наружная, 10; Внутренняя высота, 1,5; пролетом моста, 3 x 3; ватерлинией, 1,5; вход и выход, 4 x 4.
- Нижний Вкладыш в культуры блюдо (A-BРисунок 2) и зафиксируйте его в верхней части микроскопа с двумя блоками 0,15 – 0,2 g пластилин вдавлен в 1.2 x 0.3 x 0,1 см прямоугольники (рис. 2A-C).
- С пипетки пластиковые передачи медленно добавьте внеклеточного решение одной стороне блюдо (вход) во время аспирационных от другой стороны (выход).
- Вариант 2: Без инженерных пластиковые вставки, добавьте внеклеточного решение путем передачи пипетки с одной стороны блюдо (впускной) во время аспирационных с противоположной стороны (выход). Медленно поверните расположение передачи пипеткой (например, N – E – S) во время зеркального отображения размещение аспирационная игла на противоположной стороне (например, S к W-N).
- Вариант 3: Пальто внеклеточная матрица на прямоугольной coverslips шаге 1.3.3. и культура суспензию клеток на эти coverslips на шаге 4.4. Передать этот coverslip прямоугольной камеры заполнены с внеклеточного решение, опуская шаг 5.1 и пропустить шаг 5.3. Промойте отсек с внеклеточного решения от пипетки пластиковые передачи, как описано в вариант 1 (5.2.1.3).
- Вариант 1: Обмен решение является более эффективным в камере длиной больше, чем циркуляр камеры. Поскольку ЕС клетки были культивировали в раунде 35 мм блюда, создайте пластиковые эллиптическая вставка для блюдо.
- Повторно присоедините сцену с клеточной культуры выше инвертированным микроскопом (Рисунок 2D). Инкубации клеточной культуры ЕС в сыворотки бесплатно внеклеточного решения при комнатной температуре.
- После 4 часов промойте культуры снова с внеклеточного решение, как описано выше. Продолжите клеточных электрофизиологии.
6. вся ячейка электрофизиологии EC клеток от основной культуры
-
Достижение клеточных гига печать
- Тяните один десяток электроды сопротивления 1 – 5 MΩ.
Примечания: Пипетки 1 – 2 MΩ сопротивления, которые дают 10-100 GΩ уплотнения работать лучше. Огонь, шлифовальные советы электрода не является необходимым для достижения GΩ тюленей. - Равномерно пальто носовой конус всех пипеток с полимера. Держите горизонтальный пипетки на землю и перпендикулярно к передней части тепловой пушки. Медленно поверните дозатор пока отвердевает полимер.
- Залейте Алиготе внутриклеточных раствора в 15 мл Конические трубки. Перевод 1.2 мл этого раствора в пробки microcentrifuge 1,5 мл через 1 мл шприц. Вывести другой 0,7 мл внутриклеточных раствора в шприц. Рассеять воздух от конца шприца. Присоединить гибкий 34 G, 67 мм иглу в шприц и вымывать любой оставшийся воздух от этой иглы.
- Определить Tph1-CFP + ячейки, которая не находится в контакте с любой другой ячейки или мусора.
- Заполните электрода с внутриклеточной решения. Засыпки пипетку в шприц. Осторожно проведите пипетку с ногтем развеять интерфейс пузырь воздуха.
- С плунжера, составлен с 0,3 мл воздуха Прикрепите 6 мл шприц на выходе из держателя трубы. Смонтируйте в держатель электрода.
Примечание: Подключение шприц трубок до электрода входит баня решение поддерживать нейтральный или положительный давление внутри внутриклеточных решения до уплотнения. - Загрузите двухэтапный мембраной протокол, который записывает устойчивого состояния активации токи по лестнице напряжения на первом шаге и записи доступны токи одного напряжения на втором шаге. Откройте печать тест (5 мВ на 50 кГц).
- Опустите электрода в раствор для ванн. С микроманипуляторы маневр электрода подсказка в плоскости с и непосредственно горизонтальных из ячейки. Высылать 0,3 мл воздуха из шприца.
- Аккуратно переместите электрода горизонтально вдоль оси x для сенсорных клеток. Часы для Димпл появляться на EC клеток и/или увеличения сопротивления мембраны на печать тест. При необходимости, скорректировать электрод вниз вдоль оси z и/или горизонтально вдоль оси x, не движется мимо средней ячейки.
- Применить 0,1 – 0,2 мл всасывания на 6-мл шприц. Удерживать поршень до 100 MΩ достигается, затем отпустите ручки от поршень. Ждать для ячейки гига печать. Аккуратно отсоедините шприц с отвинчивания движения.
Примечание: Если EC ячейки не первоначально уплотнения, это может быть возможность вновь запечатать его с последующей попыткой. Для этого осторожно потяните электрода от EC клеток с < 20 MΩ уплотнение сопротивление. Руководящий отработанного электрод с микроманипуляторы, обогнуть целевой ячейки EC вручную убрать матрицы или мусора. Затем попытка уплотнение EC ячейки с свежий электрода.
- Тяните один десяток электроды сопротивления 1 – 5 MΩ.
-
Запись клеточных напряжения закрытом Na+ текущей.
- Присоединить шприц 3 мл с 0,5 – 1,0 мл воздуха. Применение быстрого крана всасывания (0,1 – 0,5 мл) на шприц 3 мл. Повторяйте, пока не достигается клеточных доступ, а затем осторожно Отсоедините шприц.
Примечание: как производительность шприц может варьироваться первоначально и постепенно меняться со временем и использовать, практика заранее с шприц 3 мл (уплотнения конца с указательным пальцем) для обеспечения, что поршень будет отдача в пределах 0,1 – 0,2 мл его начальную позицию. Если нет, то обмен шприцев для новое одного. - Включите клеточных емкостной компенсации. Настройка емкости и серии сопротивления. Включите компенсация сопротивления серии. С лагом в 60 мс Отрегулируйте предсказал тогда исправленный компенсация сопротивления серии. Закройте печать тест.
- Запись в среднем 5 работает поклеточного закрытого напряжения тока Na+ (рисA).
- Быстро принять к сведению два параметра закрытого напряжения тока Na+ : напряжение на текущее окно (Рисунок 3B, красные символы, пересечение кривых устойчивого состояния активации и инактивации) и пиковый ток Na+ плотность.
Примечание: ЕС клетки с пик Na+ течения более чем-50 ПА в режиме напряжение зажим обычно будет идти огонь вызвал потенциалов в текущем режиме зажим. Кроме того, токи больше-200 Па в напряжение зажим (рис. 3А), то обычно пожар потенциалы действия спонтанно в текущей зажим от мембранных потенциалов (красная линия, Рисунок 3D) вблизи напряжения окно текущей (красные символы, Рисунок 3B).
- Присоединить шприц 3 мл с 0,5 – 1,0 мл воздуха. Применение быстрого крана всасывания (0,1 – 0,5 мл) на шприц 3 мл. Повторяйте, пока не достигается клеточных доступ, а затем осторожно Отсоедините шприц.
-
Запись вызвал потенциалы действия.
- Выключите компенсация сопротивления серии. Выключите внешней команды. Переключите режим от V-образный зажим фиксатор. Отрегулируйте коэффициент усиления. Загрузите эпизодические текущий протокол зажим. Регулировать количество проведения текущего 0 Па. Включите внешней команды.
ВНИМАНИЕ: Не включайте от V-образный зажим зажим (или наоборот) без первого выключения внешней команды. - Обратите внимание, мембранный потенциал покоя. Отрегулируйте проведение текущего ввода чтобы мембранного потенциала читает ниже текущего окна (например, -80 до -100 МВ). Отрегулируйте эпизодические зажим протокола таким образом, чтобы шаг интервал текущего ввода меньше, чем значение текущей холдинга (рис. 3C врезные, шаги ПА + 2-3 Па проведение текущего).
- Запись вызвал потенциалы действия. Обратите внимание, наименьшее количество тока, вводят выстрелить потенциал действия (рис. 3C, развертки 3, 5, + 4 Па шаг от-3 Па Холдинг = + 1 ПА).
- Выключите компенсация сопротивления серии. Выключите внешней команды. Переключите режим от V-образный зажим фиксатор. Отрегулируйте коэффициент усиления. Загрузите эпизодические текущий протокол зажим. Регулировать количество проведения текущего 0 Па. Включите внешней команды.
-
Запись спонтанное потенциалы действия.
- Выключите внешней команды. Загрузите текущий протокол зажим разрыв бесплатно (не эпизодическая).
Примечание: Не включите внешней команды до тех пор, пока количество проведения тока в протоколе бесплатно разрыв текущих зажим была проверена пригодны для ячейки. - Изменить текущий быть сумма текущих, вводят в последнего прохода в протоколе вызвал, что не огонь потенциал действия проведение (Рисунок 3D, текущий вход во время второго прохода, ПА + 2 шаг от-3 Па Холдинг =-1 ПА).
- Включите внешней команды. Дважды проверьте, что предсказал текущее проведение приносит мембранного потенциала ниже порога огонь потенциал действия. При необходимости отрегулируйте проведение текущего. Запись спонтанной активности.
- Выключите внешней команды. Загрузите текущий протокол зажим разрыв бесплатно (не эпизодическая).
Результаты
Культуры:
Основная мышиных эпителиальных клеток, сделанные из трансгенные модели Tph1-CFP придают блюдам после 4 часов и готовы для физиологических опытов между 24-72 ч. Когда культура условия не оптимизированы, эпителиальных клеток культуры состоял из больших сгустков, плавающие сотовой мусора, поврежденные мембраны и слабый сигнал СЛП в ЕС клеток (рис. 1А). Культур, которые были оптимизированы для электрофизиологии состоял из одной клетки и небольшие сгустки. Здоровые клетки ЕС были легко определить по ярко CFP флуоресценции и еще присоединились блюдо после энергичной стирки (рис. 1Б).
Электрофизиологии:
EC всей клетки были получены только 15% ±4 попыток от двоеточия культур без рок ингибитора (29 всей клетки из 182 попытки из 22 культур) но 30 попыток от двоеточия культур с рок ингибитора (27 всей клетки из 102 попытки из 50 культур) ±7% (< C1 > рисунок 4A; p < 0,05, непараметрические двустороннее t-теста, Колон культур без против с рок ингибитора). Аналогично, тощей кишки EC клетки без рок ингибитора не выжить достаточно долго, для электрофизиологии, а ЕС всей клетки были получены на 41 ±3% попыток от тощей кишки культуры с рок ингибитора (186 всей клетки из 447 попытки из 50 культур) (Рисунок 4A; p > 0,05, непараметрические двустороннее t-тест, тощая кишка vs. толстой кишки с рок ингибитора).
В клеточных электрофизиологии Na+ токи были записаны в режиме мембраной и потенциалы действия (AP) в режиме ток зажим. Na+ токи были записаны с 81,3% ±4.0 TPH1-CFP + клетки от тощей кишки или 64,1% ±9.2 от толстой кишки3. 59 EC клеток из тощей кишки культур, подтверждается напряжения зажим, чтобы иметь Na+ максимальный ток больше, чем ПА-25 19 EC клетки в режиме ток зажим уволен спонтанное AP («спонтанное»), 29 EC клетки произвели AP только тогда, когда вызвали шаг протоколом в ток зажим режим («вызвало только») и 11 EC клетки не огонь AP спонтанно или шаг протокол («не стрельбы») (рис. 4B). Спонтанное клетки были среднем пик Na+ плотность тока (Iпик) о-108.0 ±19.3 Па/pF, клетки только вызвал бы япик -60.2 ±9.2 Па/pF, хотя без обжига клетки япик -43.3 ±14 ПА/pF (рис. 4 B; p < 0,05, спонтанное против только вызвал или номера для стрельбы группы; p > 0,05 только вызвало против номера для стрельбы группы). Разница в плотности тока не является отражением клеточных емкости, как спонтанное (3.3 ПФ ±0, 2), только вызвал (2.9 ±0, 2 pF) и без обжига (3.1 ±0, 3 пикофарада) клетки были аналогичные целом мобильных емкостей (P > 0,05). EC клеток Na+ течений и вызвал AP были чувствительны к концентрацииo [Na+] и 1.3 ингибированием NaV3.

Рисунок 1 : Представитель диапазона результатов культуры. DIC с изображениями эпифлуоресцентного первичного эпителия тощую культуры от Tph1-CFP мыши покрытием на блюдо дно стекла и культивировали в течение 24 ч. Эти два изображения демонстрируют широкий спектр культуры результатов от этого протокола. CFP флуоресцентные клетки (белый) – enterochromaffin (EC) клетки. (A) представитель изображение от культуры, которая является низкое качество для электрофизиологии. Культура состоит из большого скопления, поврежденных клеточных мембран, сигнал низкой флуоресценции и плавающей групп мертвых клеток. (B) представитель изображение от культуры, которая была оптимизирована для электрофизиологии. Культуры состоит в основном из единого, здоровые клетки и небольшие сгустки, которые присоединились к пластине. EC клетки в этой культуре поддерживать сильная флуоресценция сигнал. Шкалы бар = 100 мкм; панели являются масштабируется 1:1. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Подготовка клетки культуры для электрофизиологии. Стратегии для эффективного и тщательного полоскания EC клеточных культур сыворотки бесплатно внеклеточного раствором имеет решающее значение для сокращения внеклеточного матрикса и сыворотки, которая будет препятствовать печать формирования. (A) материалы. По часовой стрелке, начиная слева сверху: этап, двумя полосками шириной 5 мм, воск фильма, два кусочка 200 мг моделирования глины, пипетки пластиковые передачи, #5 щипцы, эллиптические запись камеры, 35 мм культуры блюдо с стекла дном. (B) придерживаются воск фильм внутренний диаметр стадии, эллиптические палата нижней в культуре блюдо и придавить глины на прямоугольные полоски. (C) осторожно нажмите культуры блюдо в стадию облицованная фильм воск и иммобилизации записи камеры путем растяжения глина моделирования над краем блюдо из камеры на сцену. Промойте EC клетки с несколько томов внеклеточного решения. (D) возвращение стадии кронштейны выше инвертированным микроскопом. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : Результаты представитель электрофизиологии. (A) клеточных Na+ токи, записанный двухэтапный протокол мембраной (Отступ). 50 мс depolarizations от -120 МВ активировать каналы во время шага 1 (●), пока еще деполяризации 0 mV во время шага 2 (○) активирует каналы, которые еще не имели инактивированных (то есть, по-прежнему доступны для открытия). Красный след, тока с напряжением шагах от -120 для от -40 до 0 mV. (B)-амперных отношение пик Na+ токов от группы A, шаг 1 (●, устойчивого состояния активации) или шаг 2 (○, установившегося инактивации). Пересечение устойчивого состояния активации и инактивации кривых показывает небольшое окно текущей на -40 мВ (красные символы). (C) потенциалы действия с расшатывания текущего раздражителей. Потенциал действия может вести огонь в прошлом 0 mV (.серая линия) когда мембранного потенциала достигает напряжения Na+ окна текущего (красная линия, -40 МВ). Врезные, ток зажим протокол, в котором был введен 0 + 8 ПА для 50-ms depolarizations от базового-3 Па. (D) потенциалы действия огонь на вершине спонтанное события, которые деполяризованный, к -40 мВ. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
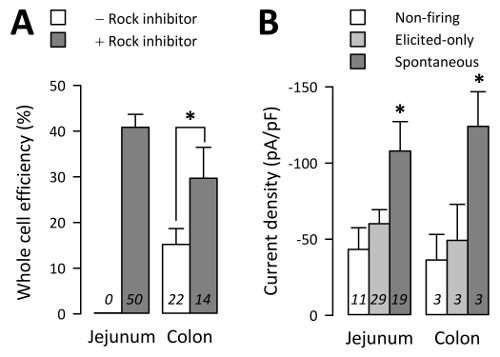
Рисунок 4 : Пропускная способность клеточных электрофизиологии. (A) средний процент клеток всего за попытку для n дней работы в отсутствие (-) или наличие (+) ингибитор рок (10 мкм). EC клетки из тощей кишки не выжить 24 h в культуре без добавления ингибитора рок. (B) Na+ плотностях тока измеряется в мембраной из n EC клеток, в которых потенциалы действия не огонь (Non огонь), произвели только тогда, когда вызвали эпизодические протоколом ток зажим (только для Elicited), или произвели спонтанно в режиме свободной разрыв ток зажим (спонтанное) (планки погрешностей, SEM). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Полностью понимая EC клеточной функции требует высокого качества первичной культуре метод для создания клетки для клеточных электрофизиологии. Основных культур эпителия GI традиционно затруднен из-за низкой выживаемости. Облегчение этот смешанным фактором, нынешний метод дает культур сингулярных клеток EC от большого или малого кишечника, которые способны выжить в течение нескольких дней.
Мы обнаружили, что решающее значение для повышения качества культуры пригодны для электрофизиологии были следующие: (1) инвертирование слизистой оболочки, а не пилинга он, (2) добавление небольшого количества BSA пищеварение средства массовой информации и FBS в культуре средств массовой информации, (3) снижение Коллагеназы XI концентрации, (4) Регулировка продолжительности и интенсивности механических агитации для увеличения числа и здоровья единичных клеток, (5) покрытие внеклеточного матрикса в низкой концентрации и (6) культивирование с ингибитором рок.
Аналогичным образом, следующие приспособления имеют решающее значение для получения всей клетки во время патч зажима: (1) тщательно полоскать культур сыворотки бесплатно внеклеточного раствором, (2) давая ЕК клетки стоят в внеклеточной решение для по крайней мере 4 ч, (3). вновь purposing любой провел электроды как те, от неудачных тюленей-чтобы убрать мусор пути к следующей ячейке EC, (4) Добавление 10 мкм Gd3 + внеклеточного решение блокировать токов утечки (если присутствует) и для облегчения присоединения mammalian клетки подвесы для стекла. Мы, однако, предостеречь, что Gd3 + может блокировать напряжения закрытого Ca2 + и/или mechanosensitive каналы в ЕС клеток.
Несмотря на тщательно оптимизированы культивирования условий, мы нашли несколько ограничений: EC клетки нуждаются в 24 часа полностью придают еще истекает после ~ 72 h в культуре; Таким образом они имеют 48-часового окна, когда они будут пригодны для электрофизиологических экспериментов. Потому что скомканным клетки часто вводить емкость переходные процессы, которые не могут быть компенсированы из записей, поколение одиночных клеток ЕС имеют решающее значение. Однако разделяя EC клетки эпителия, клетки затем жить в не носителями среде (то есть, высокой глюкозы СМИ с плода бычьим сывороточным и ингибитор рок на вершине внеклеточная матрица как искусственные базальной мембраны) и могут отвечать не полностью стимулов представитель ЕК ячейки функцию в естественных условиях. Несмотря на эти ограничения по-прежнему основной культивирования клеток ЕС обеспечивает проницательность в их физиологии.
EC клетки играют важнейшую роль в поддержании отлаженных желудочно-Кишечного тракта и тело и таким образом, там было много методов, разработанных чтобы получить представление о EC клеток электрофизиологии. Enteroendocrine и EC электрофизиологии клеток изучался на увековечен ячейки модели5,8,13, первичных культур клеток EC от свинки11и мыши3,4, наши метод использует ячейки сохранения качества методы для создания культуры, минимально обработано и отражает родной EC клетки. Мы используем модель трансгенные мыши, Tph1-CFP, который показывает голубой флуоресценцией в цитоплазме, когда Tph1 настоящее время9. Этот метод может также использоваться для других репортер или проследить родословную enteroendocrine типов клеток. Наш метод также выполняет изоляции одиночных клеток EC в минимальное время и ферментативная обработка, как клетки подвергаются только нежный коллагеназы XI в минимальный, но эффективные концентрации 0,1 мг/мл (тощей кишки) и 0,6 мг/мл (двоеточие) для менее одного часа. В результате этих изменений — это культура, которая оптимизирована для электрофизиологических исследований ЕС клеток.
Мы успешно использовали этот метод для исследования электрофизиологии и серотонин релиз в мышиных EC клетки3. Способность успешно изолировать, определить, и культура единого ЕС клетки облегчает важные будущие направления исследований по физиологии клетки ЕС. Этот метод может использоваться для дальнейшего определения критических путей и каналов участвует в ЕС клеток экзоцитоз серотонина и другие EC клеток конкретных приемник. Метод также может быть изменен изолировать и характеризуют физиологии EC клеток человека наряду с использованием акридин оранжевый для идентификации ячейки ЕС13.
Как и в случае с наиболее научные разработки протокола, коммуникации и объективные замечания были критических неполадок Этот протокол. Когда мы проверили новые методы культуры для выживания наших культур, было бы полезно подсчитать количество люминесцентные клеток как показатель жизнеспособности, оценить плотность клеток в каждом блюдо и собирать представитель фотографии и видео культур через много времени очки. После того, как клетки смогли выжить в прошлом 24 h в культуре, мы работали на изменении наших культур для экспериментов электрофизиологии. Наряду с сбора изображений и подробные замечания, важно поддерживать четкую связь между персоналом лаборатории относительно изменения механических пищеварение и дополнения и/или концентрации субстрата, так что здоровые клетки ЕС были готовы для электрофизиологических характеристик.
Раскрытие информации
Нет
Благодарности
Авторы благодарят г-жа Линдсей Басби для административной помощи и г-н Роберт Хайет из Майо клиника отдел инженерного дизайна и 3D печати вставить блюдо культуры. Эта работа была поддержана NIH K08 AB (DK106456), пилот и осуществимости Грант АБ из клиники Майо центр для клеток сигнализации в гастроэнтерологии (низ P30DK084567) и 2015 американской гастроэнтерологической ассоциации исследования ученый премии (Ага RSA) AB и низ R01 GF (DK52766).
Материалы
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm culture dish | Corning (Falcon) | 351029 | |
| Transfer Pipette | Fisherbrand | 13-711-7M | |
| 10 mL serological pipette | Corning (Falcon) | 357551 | |
| 50 mL Conical | Corning (Falcon) | 352098 | |
| 15 mL Conical | Corning (Falcon) | 352097 | |
| 1,000 mL Barrier Pipet Tips | Thermo Scientific (Art) | 2079E | Keep sterile |
| MatTek Glass Bottom Dishes | MatTek Corporation | P35G-1.5-14-C | Keep sterile |
| Micro-dissection Forceps - Very Fine, Extra-Long Points | Fine Science Tools | SB12630M | |
| Surgical Scissors-Sharp | Nasco | 14002-14 | |
| Micro-Dissection Scissors | Nasco | SB46568M | |
| Monoject Hypo Needle, 21 G x 1" A, 100/BX | Covidien | 8881250172 | |
| Tg(Tph1-CFP)1Able/J Mice | Jackson | Stock # 028366 | Use male or female mice between the ages of 4-7 weeks |
| Microfil nonmetallic syringe needles (34 gauge, 67 mm) | World Precision Instruments | MF34G-5 | |
| Parafilm "M" Laboratory Film | Pechiney Plastic Packaging | ||
| R6101 | Dow Corning | ||
| 6 mL syringe with regular luer tip | Monoject | ||
| 3 mL syringe with regular luer tip | Monoject | ||
| Electrophysiology Equipment | |||
| Amplifier | Molecular Devices | Axopatch 200B | |
| Data acquisition system (daq) | Molecular Devices | Digidata 1440A | |
| Signal conditioner | Molecular Devices | CyberAmp 320 | |
| Software | Molecular Devices | pClamp 10.6 |
Ссылки
- Rindi, G., Leiter, A. B., Kopin, A. S., Bordi, C., Solcia, E. The "normal" endocrine cell of the gut: changing concepts and new evidences. Annals of the New York Academy of Sciences. 1014, 1-12 (2004).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. The Journal of Physiology. 589, 1081-1093 (2011).
- Strege, P. R., et al. Sodium channel NaV1.3 is important for enterochromaffin cell excitability and serotonin release. Scientific Reports. 7 (15650), (2017).
- Bellono, N. W., et al. Enterochromaffin cells are gut chemosensors that couple to sensory neural pathways. Cell. 170 (1), 185-198 (2017).
- Alcaino, C., Knutson, K., Gottlieb, P. A., Farrugia, G., Beyder, A. Mechanosensitive ion channel Piezo2 is inhibited by D-GsMTx4. Channels. 11 (3), 245-253 (2017).
- Kim, M., Javed, N. H., Yu, J. G., Christofi, F., Cooke, H. J. Mechanical stimulation activates Galphaq signaling pathways and 5-hydroxytryptamine release from human carcinoid BON cells. Journal of Clinical Investigation. 108 (7), 1051-1059 (2001).
- Modlin, I. M., Kidd, M., Pfragner, R., Eick, G. N., Champaneria, M. C. The functional characterization of normal and neoplastic human enterochromaffin cells. The Journal of Clinical Endocrinology and Metabolism. 91 (6), 2340-2348 (2006).
- Wang, F., et al. Mechanosensitive ion channel Piezo2 is important for enterochromaffin cell response to mechanical forces. The Journal of Physiology. 595 (1), 79-91 (2017).
- Li, H. J., et al. Distinct cellular origins for serotonin-expressing and enterochromaffin-like cells in the gastric corpus. Gastroenterology. 146 (3), 754-764 (2014).
- Psichas, A., Tolhurst, G., Brighton, C. A., Gribble, F. M., Reimann, F. Mixed primary cultures of murine small intestine intended for the study of gut hormone secretion and live cell imaging of enteroendocrine cells. Journal of Visualized Experiments. (122), 55687 (2017).
- Raghupathi, R., et al. Identification of unique release kinetics of serotonin from guinea-pig and human enterochromaffin cells. The Journal of Physiology. 591, 5959-5975 (2013).
- Nozawa, K., et al. TRPA1 regulates gastrointestinal motility through serotonin release from enterochromaffin cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3408-3413 (2009).
- Reimann, F., et al. Characterization and functional role of voltage gated cation conductances in the glucagon-like peptide-1 secreting GLUTag cell line. The Journal of Physiology. 563, 161-175 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены