Method Article
一次培養マウス腸クロム親和性細胞のセル全体を電気生理学
* これらの著者は同等に貢献しました
要約
(EC) 腸クロム親和性細胞は、消化管上皮細胞の小さなサブセットを構成します。EC 細胞は電気的興奮性、まだ養殖と EC 細胞を識別する難しさは、生理学的研究を限られているセロトニンを解放します。ここで紹介した方法は、電気生理学によって初代培養モデル単一の EC 細胞の検査を受けやすいを確立します。
要約
腸クロム親和性 (EC) 胃腸の (GI) 粘膜上皮細胞 enteroendocrine 細胞の最も大きい subpopulation を構成します。専門にされた感覚的な細胞として EC 細胞内腔刺激を感知し、セロトニン (5-hyroxytryptamine、5 HT) リリース イベントに変換します。ただし、文化と特定することは困難であるために、これらの細胞の電気生理学はよくわかっていません。この論文概要主な EC 細胞培養の手法は、単一細胞の電気生理学の最適化されています。このプロトコルでは、電圧と電流クランプ モードでセル全体を電気生理学の高品質の録音を取得するアプローチを進める混合の初代培養マウス EC 細胞を識別するために遺伝子組換えシアン蛍光蛋白質 (CFP) 記者を利用しています。
概要
胃腸の (GI) 上皮は、いくつかの細胞の種類から成る多様なコミュニティです。Enteroendocrine 細胞を構成するほぼすべての上皮細胞の 1%、(EC) クロム親和細胞 enteroendocrine 細胞人口1の最大。最近の研究では、enteroendocrine2と EC3,4細胞が電気的興奮を示します。主な EC 細胞電気生理学を理解することに興味を持っております。したがって、本研究の目的は、全細胞の電気生理学のために最適化されたプライマリ EC 細胞培養を確立するだった。
生産 5-HT (例えばQGP 15BON6:KRJ 17) を分泌すると電気生理学5,8を調べるに使用されている行は、通常から生成されます既存の EC 細胞不死化腫瘍組織。これらの細胞から得られる情報は貴重な5,8一次電池電気生理学の研究が EC 細胞生理学を正しく理解する必要です。一次の EC 細胞の電気生理学には、分離と上皮文化の低い生存率によって制限されており、単一の上皮細胞の培養が必要です。
本論文で示した培養法は、Tph1 CFP9、この研究で使用されるのような蛍光に分類された EC 細胞を持つトランスジェニック マウスに依存します。メソッドの最適化混合プライマリ上皮文化を開発した単一細胞の電気生理学32,10 。以前の方法酵素消化のトリプシン EDTA/プラス コラゲナーゼ A または EDTA と DTT の組み合わせ、特に特定し文化11モルモットおよびラット EC 細胞12密度勾配を使用します。もっと最近、腸 organoids が生成され、機械的に電気生理学的記録4中断します。セロトニン Rt-qpcr 分析実験をリリースし、生理、使用できる時間がかかる organoid 世代、EC 細胞を識別するために密度勾配の成功に依存して、これらのメソッドを使用してカルチャが適していて、トリプシンと EDTA の細胞の破壊的な効果。対照的に、ここで説明されているプロトコルは、酵素、力学的処理を向上し、培養条件を最適化、シングルと健全な EC 細胞電気生理学に必要な高い携帯電話規格に適合を生成するための手順を合理化します。
このメソッドは、プライマリ EC 細胞不死化文化よりもむしろ混合文化の仕事をしたいし、単一細胞の電気生理学を調査する科学者の役に立つでしょう。ただし、並べ替えまたは長期的な文化サバイバル過去 72 時間を必要とする必要がありますセル人口の勉強はあまり適して証明するかもしれない。
プロトコル
ここで説明するすべての方法は、制度的動物ケアおよび使用委員会 (IACUC) メイヨー クリニックのによって承認されています。このプロトコルの一次電池文化の一部は、さらに詳細10参照できる以前に公開された方法に基づいています。実験のすべてのプロシージャは (IACUC)、によって承認されなければならない、すべての実験は関連するガイドラインと規則に従って行う必要があります。
1. 文化準備
-
メディア。
- EC 細胞の完全な培養基の準備高グルコースと [4500 mg/L] ダルベッコの変更イーグル培地 (DMEM) 補足 5% ウシ胎児血清 (FBS)、1 %l-グルタミンと 1% ペニシリン-ストレプトマイシン (表 1)。
注: メディアが 4 ° C で最大 1 ヶ月間保存できます。 - EC 細胞の完全な文化メディアをフィルター処理し、37 ° C で 50 mL のチューブに 25 mL の培
- 高グルコース [4,500 mg/L] 0.1 %dmem で消化メディアを準備ウシ血清アルブミン (BSA) (表 1)。
- 濾紙の消化と別の 50 mL チューブにメディアの 4 つの 10 mL の因数を置き、37 ° C の水浴で孵化させなさい。
注: メディアが 4 ° C で最大 1 ヶ月間保存できます。
- EC 細胞の完全な培養基の準備高グルコースと [4500 mg/L] ダルベッコの変更イーグル培地 (DMEM) 補足 5% ウシ胎児血清 (FBS)、1 %l-グルタミンと 1% ペニシリン-ストレプトマイシン (表 1)。
-
酵素。
- 4 mg (腸) のうち、24 mg (コロン) のコラゲナーゼ XI [≥800 単位/mg] 1.5 mL 遠心チューブに重量を量る。
注: コラゲナーゼは 1 年間、-20 ° C で安定しました。 - 1 ml の氷冷 PBS Ca2 +と Mg2 +の因数のコラゲナーゼを再懸濁します。渦徹底的に結合、および氷の場所を解決します。
- 4 mg (腸) のうち、24 mg (コロン) のコラゲナーゼ XI [≥800 単位/mg] 1.5 mL 遠心チューブに重量を量る。
-
コーティング培養皿。
- 氷の上の 4 ° C で一晩細胞外マトリックスの 150 μ L を解凍します。
- 2 ml の冷たい無血清高グルコース DMEM の解凍の細胞外マトリックスの 100 μ L を混合することによって 5 %w/v 細胞外マトリックス ソリューションを作る。
注: 細胞外マトリックスは室温で凝固し、コート料理する準備ができるまで中古冷蔵ピペット ・ チューブ ・ メディアで処理する必要があります。 - すぐにコートはガラス底 35 mm 料理のガラス内側の円 5% 細胞外マトリックス ソリューションの 250 μ L で。このレシピは 8品までをカバーします。
- 細胞培養分離手順中に 37 ° C の定温器にガラス底培養皿を置きます。細胞外マトリックスを設定する 1 時間の最小値を取る他の分離手順を実行しながら 2.5 h まで培養することができますが。
注: 孵化 3 h 妨げる可能性が細胞外マトリックスの集結を作成することがより長くシール全細胞電気生理中に形成。
2. 組織分離
- 倫理的なガイドラインに従って犠牲、3to 6 週齢雄または雌 Tph1 CFP トランスジェニック マウス (のジャクソン研究所株式: 028366)9または別のレポーターの歪み。
注: 我々 は、二酸化炭素と頚部転位の上昇のレベルの致命的な線量を使用してセカンダリの死を確保する手段として。AVAM 委員会は、安楽死も頚部転位に動物はまず鎮静されている場合、その使用の訓練を受けて個人によって許容されるプライマリ安楽死法を考慮します。 - 21 G の針を使用して発泡スチロール解離ステージ上を euthanized マウスを固定します。70% エタノールでマウスの腹部を消毒します。
- マイクロ剥離鉗子 (#5) を使用するピンと張ったマウス皮膚を引っ張るし、腹腔を公開するマウスの腹部の下部横切開する手術用はさみを使用します。胸郭が公開されるまでは、腹部を垂直方向の別の切開を確認します。
- マイクロ剥離鉗子を使用すると、盲腸をコロンの明確なビューを達成するためにマウスの左に移動します。
- (しかし、まだ直腸に近位) コロンの最も遠位部分をカットし、2 番目の胃に遠位カットするミクロ解剖はさみを使用します。100 × 15 mm2シャーレに抽出された腸の溢れる冷たいリン酸 20 mL 緩衝生理食塩水 (PBS)。
- 小さな定規を使用して測定し、結腸や空腸半ばいずれかの 10 cm をカットします。直腸の上撮影最初のカットに近位に位置する腸の 10 cm セグメントを測定することによって大腸を抽出します。小腸全体を半分に折ると、中間点での最初の切開とカット目切開 10 cm 最初に近位空腸を識別します。
注: 引き続き氷の上それに続く分離のすべての手順を実行します。 - 氷冷 PBS で 6 mL シリンジを入力し、抽出した腸管の内腔に注射針を配置します。クランプし、注射針の周りの腸をシールするマイクロ剥離鉗子を使用し、そっと離れて糞便を洗浄する内腔を 10 mL の PBS をフラッシュします。
- 優しく内腔を介してマイクロ剥離鉗子を織り、腸の壁をつまんで、鉗子の先端に近位の組織を取り消し、腸の組織を反転します。セグメントがインサイド アウトになるまでこのプロセスを繰り返しますを外側に向けルーメンと。
- ミクロ解剖はさみを使用すると、組織のセグメントを 1 cm に切る。
- マイクロ剥離鉗子を使用すると、転送 5 mL 滅菌 PBS で 50 mL ビーカー内の組織のセグメント。液化の一貫性に組織部分をミンチにミクロ解剖はさみを使用します。
- 転送ピペットでクリーン 50 mL のチューブにみじん切りにした組織と 15 mL の氷冷 PBS を配置します。転送ピペットで 2 回をカップ刻んだ、解決、PBS 清 15 mL を削除し、新鮮な PBS に置き換えるにティッシュを待ちます。PBS がクリアされるまで、このプロセスを 3 回繰り返します。
- 氷の上洗浄ティッシュ部分と 50 mL のチューブを置き、ティッシュ文化フードに氷のバケツ。
3. 酵素および機械的消化
-
最初の消化
- 水の風呂に予め温めておいた消化メディアの 10 mL を含む 50 の mL の管の 1 つを取得します。50 mL チューブ 250 μ L の PBS コラゲナーゼの解決とみじん切りにした腸組織部分を追加します。
注: 前の洗浄のステップから任意の PBS を含むを避けるために注意してください。 - 37 ° C で 5 分間 (結腸や空腸) 水のお風呂に 50 mL のチューブを配置します。2 管を振る毎分 x。
注: 最適なタイミングと強度機械的消化の異なる場合があります、ユーザーが決定する必要があります。最適な消化条件を決定するには、各消化後細胞の 10 μ L の因数を表示できます。消化 1 中の細胞の塊の上清を含みます。 - ゆっくりと組織を 10 mL の血清ピペットで 1 回カップ刻んだ。簡単に作品を解決、組織し転送ピペットを使用して上清中の全体の 10 mL を削除します。
- 水の風呂に予め温めておいた消化メディアの 10 mL を含む 50 の mL の管の 1 つを取得します。50 mL チューブ 250 μ L の PBS コラゲナーゼの解決とみじん切りにした腸組織部分を追加します。
- 2 番目の消化力: 3.1.1 に 3.1.3 の手順を繰り返します。コロンを消化する場合 10 分インキュベーション時間が長く、空腸の 5 分でインキュベーション時間を保ちます。
注: 観測、上澄み成るべきであるまだ細胞の大きな塊。 -
第 3 回消化
- 3.1.1 の手順を繰り返します
- 37 ° C の水浴 (コロンまたは小さい腸) 10 分間に 50 mL のチューブを配置します。消化力 1 と 2 よりもより高い強度で毎分 2-3 x がチューブを振る。
- ゆっくりピペット組織の 10 mL の血清ピペットと上下に。短い時間のために解決する組織の部分を許可します。
メモ: 単一細胞と小さな塊の組み合わせの上澄みを含みます。 - 新しい 15 mL チューブに上清の 10 mL を配置温め EC 細胞の完全な文化メディア、2 mL を追加し、ミックスに一度反転転送ピペットを使用します。
- 100 × g室温で 5 分間で回転し、上清を除去する転送ピペットを使用します。転送ピペットを使って温めた EC 細胞完全な文化媒体の 2.5 mL の残りのペレットを再懸濁します。
- 第 4 回消化: 3.3.1 に 3.3.5 の手順を繰り返します。コロンの 15 分インキュベーション時間を増加し、腸を 10 分のままに。
注: 上清今単一のセルで構成されます。
4. 細胞培養
- 転送ピペットを使用して新しい 15 mL チューブ (5 mL 容量) に消化力 3 と 4 から収集した細胞懸濁液を組み合わせます。
- 診断とカウントし、室温で 5 分間 100 x gで残りの細胞懸濁液をスピンするセルの 10 μ L の因数を削除します。
メモ: 最終的な細胞懸濁液が小さな塊と単一のセルで構成します。 - 転送ピペットで上澄みを除去し、EC セル完全培地 1 mL あたり 1,000,000 セルの密度でペレットを再懸濁します。
注: 細胞懸濁液の最終巻は、最後のセル数に依存します。一般的なセルは、2,000,000 からの 4,000,000 までをカウントします。 - インキュベーターからコーティング ガラス底培養皿を削除します。P1000 ピペットを使用して、各培養皿から細胞外マトリックスを置き換えて最終的な細胞懸濁液を 250 μ l 添加します。
注: 細胞外マトリックスのコーティングは、ガラス底皿の端に固執する傾向があります。ゲルの蓄積を防ぐために縁からコーティングを除去する特別な注意が必要です。 - 1 mM で ROCK 阻害剤 Y-27632 の原液を作る。各皿に 10 μ M の ROCK 阻害剤の作業濃度を達成するために各ガラス底皿に原液の 2.5 μ L を追加します。
注: この手順は、空腸文化の生存のために重要ですが、コロンは省略可能。 - 72 に 24 h (図 1) の 37 ° C、5% CO2インキュベーターで各培養皿を配置します。
5. 全細胞電気生理学の EC 細胞の調製
- O リングを作るためにワックス フィルムの 2 つの 5 × 0.5 cm ストリップと顕微鏡ステージの内径を行します。O リング (図 2A B) 内 35 mm 細胞培養ディッシュをマウントします。
-
両方の浮かんでいる残骸を洗い流し、未接続の細胞外マトリックスや死んだ細胞、EC から完全に培地の血清などを妨げるからどちらかを防ぐために細胞シール EC 細胞と電極の形成。徹底的な細胞の電気生理学のための十分な洗浄を実現する 3 つの次のオプションを使用:
- オプション 1: ソリューション exchange より効率的な長い室内楽円形より商工会議所します。EC 細胞培養丸 35 mm 料理で、料理用プラスチック製楕円の挿入を作成します。
- 3 D プリントすることによって伝統的な加工方法は、挿入を作成します。用いて挿入 (mm) で次の次元を持つアクリル樹脂から粉砕された: 外径 34.5;内側の楕円、20 x 9;外側の高さ、10;内側の高さ、1.5;橋のスパン、3 x 3;橋のクリアランス、1.5;入口と出口、4 × 4。
- 培養皿 (図 2の B) に挿入を下げ、0.1 cm 四角形 (図 2の C) x 0.3 x 1.2 に押された粘土の 2 つの 0.15、0.2 g で顕微鏡ステージの上部に固定します。
- プラスチック転送ピペットをゆっくりと反対側 (コンセント) から吸引しながら皿 (入口) の片側に細胞外ソリューションを追加します。
- オプション 2: エンジニア リング プラスチック製インサートなしソリューションを追加細胞外転送ピペットで料理 (入口) の片側から反対側 (コンセント) から吸引しながら。ゆっくりと反対側 (例えばS w n) 吸引針の配置をミラーリングしながら転送ピペット (例えばN s e) の位置を回転させます。
- オプション 3: ステップ 1.3.3 で長方形のカバーガラス上細胞外基質のコート。、4.4 の手順でこれらの coverslips に細胞懸濁液を文化。この coverslip を細胞外液、5.1 のステップを省略して、ステップ 5.3 をスキップでいっぱいの四角い部屋に転送します。オプション 1 (5.2.1.3) で説明したようにチャンバー内にプラスチック転送ピペットから細胞外の溶液をすすいでください。
- オプション 1: ソリューション exchange より効率的な長い室内楽円形より商工会議所します。EC 細胞培養丸 35 mm 料理で、料理用プラスチック製楕円の挿入を作成します。
- 培養倒立顕微鏡 (図 2D) 上でステージを接続し直します。室温で無血清細胞外の溶液の EC 細胞培養を孵化させなさい。
- 4 時間後に、上記のように再び細胞外溶液による文化をすすいでください。全細胞電気生理学を続行します。
6 EC 細胞初代培養からのセル全体電気生理学
-
セル全体のギガ シールを達成します。
- 1-5 MΩ の抵抗に 1 ダースの電極を引き出します。
ノート: 10 100 GΩ シールをもたらす 1-2 MΩ 抵抗のピペットを発揮します。研磨電極ヒント火は GΩ シールを達成するために必要ではありません。 - ポリマーとすべてピペットの鼻の円錐形を均等にコートします。地面にピペット水平および垂直熱銃の前面に保持します。ポリマーを硬くなるまでピペットをゆっくりと回転します。
- 細胞内の溶液の因数を 15 mL の円錐管に注ぐ。1 mL 注射器経由で 1.5 mL 遠心チューブにこのソリューションの 1.2 mL を転送します。注射器に別 0.7 mL の細胞内の溶液を撤回します。注射器の端から空気を払拭します。柔軟な 34 G、67 mm 針、注射器を添付、この針から残りの空気を洗い流します。
- 識別、Tph1-CFP + セル他のセルまたは破片との接触ではないです。
- 細胞内の溶液で電極先端部を入力します。バックフィル シリンジ、ピペット。慎重に空気気泡界面を払拭するために指の爪でピペットをフリックします。
- 空気の 0.3 ml 策定プランジャー、6 mL の注射器をチューブ ホルダーのアウトレットに接続します。ホルダーに電極をマウントします。
注: は、電極シーリング前に細胞内のソリューション内で中立または正圧を維持するためにお風呂のソリューションに入る前にチューブに注射器を接続します。 - 最初のステップの電圧はしご定常活性化電流を記録し、2 番目の手順の単一電圧で使用できる電流を記録する二段階電圧クランプ プロトコルを読み込みます。シール テストを開きます (5 50 kHz で mV)。
- 浴液に電極を下げます。、マニピュレーターで、電極先端の面と水平に直接セルからを操縦します。0.3 mL シリンジから空気を排出します。
- 優しくタッチする x 軸に沿って水平方向に電極を移動します。シール試験における膜抵抗に EC 細胞および/または増加に登場するディンプルを監視します。必要な場合は、過去のセルの正中線を動かさず、x 軸に沿って水平方向におよび/または z 軸に沿ってにダウン電極を調整してください。
- 適用 0.1 – 0.2 mL 6 mL の注射器に吸引します。100 MΩ が達成されるまでプランジャーを安定した保持し、ピストンからのグリップを解放します。ギガ シールにセルを待ちます。そっと忍び込んでモーションと注射器を外します。
注: EC 細胞は最初に密閉されない場合があります再後続の試行でそれを封印することが可能。これを行うには、ゆっくりと EC 細胞から電極を引き出します < 20 MΩ シール抵抗。マニピュレーターの使用済み電極をステアリング、手動で明確な距離行列やゴミにターゲットを絞った EC 細胞を一周します。新鮮な電極を用いた EC 細胞をシールを試みます。
- 1-5 MΩ の抵抗に 1 ダースの電極を引き出します。
-
レコード全体細胞電位依存性 Na+現在。
- 0.5-1.0 策定 3 mL シリンジを添付 mL 空気。吸引のクイック タップを適用 (0.1 – 0.5 mL) 3 mL シリンジに。、全体のセルへのアクセスを達成するまでを繰り返し、ゆっくり注射器を切断します。
注記: 注射器のパフォーマンスすることができます最初に変わるし、プランジャー 0.1 – 0.2 内で反動することを確保するためと使用、(人差し指の端シール) 3 mL シリンジであらかじめ練習時間とともに徐々 に変化、その開始の mL を配置します。されていない場合は、新しい 1 つの注射器を交換します。 - 全セル容量補正を入れます。容量や直列抵抗を調整します。シリーズ抵抗補正を入れます。60 ms で設定、遅れで予測し、修正のシリーズ抵抗補正を調整します。シールのテストを終了します。
- 全細胞電位依存性 Na+電流 (図 3A) の 5 失点の平均を記録します。
- すぐに電位依存性 Na+電流の 2 つのパラメーターのメモを取る: 現在] ウィンドウ (図 3B、赤のシンボル、交差点の定常状態の活性化と不活性化のカーブ) や Na+現在のピーク電圧密度です。
注: EC 細胞 Na+電流よりも現在のクランプ モードにおける誘発電位を発生させる電圧クランプ モード一般的で-50 pA 行きます。また、-200 pA クランプ電圧 (図 3A)、通常より大きい電流発生電位膜電位 (赤い線、図 3D) の電圧付近から現在のクランプで自発的に、ウィンドウの現在の (赤い記号、図 3B)。
- 0.5-1.0 策定 3 mL シリンジを添付 mL 空気。吸引のクイック タップを適用 (0.1 – 0.5 mL) 3 mL シリンジに。、全体のセルへのアクセスを達成するまでを繰り返し、ゆっくり注射器を切断します。
-
レコードには、活動電位が誘発されます。
- シリーズ抵抗補正をオフにします。外部コマンドをオフにします。・ クランプする V クランプからモードを切り替えます。ゲインを調整します。エピソードの現在クランプ プロトコルを読み込みます。保持 0 に電流の量を調整するペンシルバニア州外部コマンドをオンにします。
注意: から切り替えないでください V クランプ ・ クランプ (またはその逆) 外部コマンドをオフ最初になし。 - 静止膜電位を注意してください。入力ウィンドウの現在の下膜電位が読み取られるように保持電流を調整する (例えば、 -100-80 mV)。電流入力のステップ間隔が (図 3Cはめ込み、+2 pA について-3 pA が現在保持している) 現在の持株の値よりも小さいので、エピソードの現在のクランプ プロトコルを調整します。
- レコードには、活動電位が誘発されます。活動電位の発射を電流の最小量に注意してください (図 3C、掃引を保持-3 pA から +4 pA ステップ 5 の 3 + 1 pA =)。
- シリーズ抵抗補正をオフにします。外部コマンドをオフにします。・ クランプする V クランプからモードを切り替えます。ゲインを調整します。エピソードの現在クランプ プロトコルを読み込みます。保持 0 に電流の量を調整するペンシルバニア州外部コマンドをオンにします。
-
レコードの自発的な活動電位。
- 外部コマンドをオフにします。ギャップ フリー (間欠的) 現在クランプ プロトコルを読み込みます。
注: セルに合うようにギャップのない現在のクランプ プロトコルの保持電流の量を確認するまで、背面外部コマンドを切らないでください。 - 活動電位は発生した誘発プロトコルで前回のスイープで電流量が現在の持株を変更 (図 32 番目のスイープ中にD、現在の入力、保持-3 pA から +2 pA ステップ-1 pA を =)。
- 外部コマンドをオンにします。ダブル予測保持電流が膜電位活動電位を発生させる閾値以下をもたらすことを確認します。必要な場合は、保持電流を調整します。自発的な活動を記録します。
- 外部コマンドをオフにします。ギャップ フリー (間欠的) 現在クランプ プロトコルを読み込みます。
結果
文化:
トランスジェニック Tph1 CFP モデルから作られた一次マウス上皮細胞は、4 時間後料理に接続し、24 に 72 h 間生理学実験の準備が整いました。培養条件が最適化されていない、大きな塊、浮遊細胞の残骸、破損した膜および EC 細胞 (図 1A) で CFP 微弱の上皮細胞培養が成っていた。電気生理学のために最適化されている文化は単一細胞の小さな塊から成っていた。健康な EC 細胞は明るい CFP の蛍光によって容易に識別され、積極的な洗浄 (図 1B) 後皿にまだ付いていた。
電気生理学:
ROCK 阻害剤 (50 の文化からの 102 の試みのうち 27 全体細胞) とコロン文化からの試み 30 ± 7% が、EC 全体セル ROCK 阻害剤 (22 文化からの 182 の試みのうち 29 全体細胞) なしコロン文化からの試みだけ 15 ± 4% であった ( 図 4A;p < 非パラメトリック 2 尾tによって 0.05-テスト、対ROCK 阻害剤でなくコロン文化)。同様に、ROCK 阻害剤を十分な長さの電気生理学生存しなかったない EC セルは空腸、ROCK 阻害剤 (50 文化から 447 の試行のうち 186 全体細胞) と空腸の文化からの試み 41 ± 3% の得られた全体セル EC 中 (図4Ap > 非パラメトリック 2 尾tによって 0.05-テスト、空腸結腸対ROCK 阻害剤)。
全細胞電気生理学、Na+電流クランプ電圧モードと電流クランプ モードにおける活動電位 (AP) で記録されました。TPH1 81.3 ±4.0% から記録された Na+電流-CFP + 空腸や結腸3から 64.1 ±9.2% から細胞。Na+ピーク電流-25 pA より大きな電流に電圧クランプによって確認された空腸文化から 59 EC 細胞の電流クランプ モードで 19 EC 細胞自発 AP (「自然な」) を解雇した、29 EC 細胞発生電流クランプでステップのプロトコルによって誘発されるときのみ APモード (「誘発のみ」) 11 の EC 細胞 AP 自発的に火もなかったによってステップ プロトコル (「無焼成」) (図 4B)。自発的な細胞が、ピーク時の平均的ナ+電流密度 (Iピーク)-108.0 ±19.3 pA/pF の - だけで誘発される細胞いた-60.2 のピーク±9.2 pA/pF の非焼成セル I-43.3 のピークがあった ±14 pA/pF (図 4 B;p < 0.05、自発的な対誘発専用または非焼成グループ;p > 0.05 を引き出しただけ対非焼成グループ)。電流密度の違いセル全体容量の反射がなければ、自発 (3.3 ± 0.2 pF), 誘発だけ (2.9 ± 0.2 pF), 非焼成 (3.1 ± 0.3 pF) と細胞が似たような全体容量のセル (P > 0.05)。EC 細胞の Na+電流と誘発 AP「ナ+]o濃度、NaV1.3 抑制3に敏感だった。

図 1: 培養結果の代表的な範囲です。Tph1 CFP マウスからプライマリ上皮空腸文化の落射蛍光画像と DIC は、ガラス底皿の上めっきし、24 時間培養します。これらの 2 つの画像は、このプロトコルから文化の結果の範囲を示しています。CFP の蛍光セル (白) 腸クロム親和性 (EC) セルです。(A) 電気生理学の質の悪いの文化から代表的なイメージ。大きな塊、損傷した細胞膜、低蛍光信号、およびフローティングから成っている文化の死んだ細胞のグループ。(B) 電気生理学のために最適化された文化からの代表的なイメージ。文化は単一で、健康な細胞とプレートを遵守して小さな塊から主に成っています。この文化の EC 細胞は、強い蛍光シグナルを維持します。スケールバー = 100 μ m;パネルは、縮尺 1:1 です。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 電気生理学培養細胞の準備。細胞外マトリックスとシールの形成を妨害する血清を低減する効率的かつ徹底的に無血清細胞外溶液と EC 細胞培養のための戦略が欠かせません。(A) 材料。左上から時計回りに: ガラス底のステージ、ワックス膜、モデリング粘土、プラスチック転送ピペット、#5 鉗子、楕円記録室、35 mm 文化 2 200 mg 個の 5 mm 幅のストリップを 2 皿します。(B) ステージの内径にワックス膜を付着培養皿にだ円空胴を下げる、長方形の短冊状に粘土を平らにします。(C) 優しくワックスの薄膜で覆われたステージに培養皿を押すし、ステージに商工会議所から、皿の端にモデリング粘土を伸ばして記録室を固定します。EC 細胞細胞外ソリューションの複数のボリュームをすすいでください。(D) 倒立顕微鏡上ブラケットにステージを戻されます。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 代表的な電気生理学の結果。(A) セル全体の Na+電流、2 段階電圧クランプ プロトコル (インセット) によって記録されました。50 ms したり-120 mV が 0 mVステップ 2 (○) の間に持っていたまだ不活化しないチャンネルをアクティブにさらに脱分極しながらステップ 1 (●) の間にチャンネルをアクティブにする (すなわちが開くにはまだ使用可能)。赤のトレース、電流電圧によって誘発される手順を 0 に-40-120 mV。(B) 電流-電圧特性からパネル、電流 Na+のステップ 1 (● は、定常状態のアクティベーション) またはステップ 2 (○、定常状態不活性化)。定常状態の活性化と不活性化のカーブの交差点を明らかに小窓-40 で現在 mV (赤い記号)。(C) 活動電位脱分極電流刺激によって誘発されます。0 過去活動電位が発射できる mV (灰色の線) 膜電位が Na+ウィンドウの現在の電圧に達したら (赤い線、-40 mV)。はめ込み、電流クランプ プロトコル、+8 pA に 0 が投与-3 のベースラインから 50 ms したりのペンシルバニア(D) 活動電位は-40 に脱分極が自発的なイベントの上に火災から mV。この図の拡大版を表示するのにはここをクリックしてください。
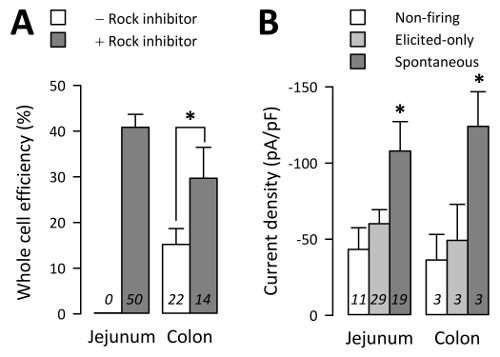
図 4: 全細胞電気生理学のスループット。(A)、(-) (+) の有無 ROCK 阻害剤 (10 μ M) での仕事の n 日間の試みごとのセル数全体の平均割合です。腸の EC 細胞は文化 ROCK 阻害剤なしで 24 h を存続させなかった。(B) Na+ n EC 細胞活動電位が (非焼成) をされなかったから電圧クランプで測定される電流密度解雇エピソード電流クランプ プロトコルによって誘発されるときのみ (抽出されたのみ)、またはギャップのない電流クランプ モード (自然) で自発的に発射 (誤差は、SEM)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
完全に EC 細胞機能を理解すると、全細胞電気生理学のための細胞を生成する高品質培養法が必要です。消化管上皮初代培養は、低い生存のため従来難しかった。この交絡要因を緩和する、現在メソッドは、数日間存続が可能な小規模または大規模な腸から単数形の EC 細胞の培養を生成します。
次が電気生理学に合うように文化の質の向上にとって重要なことが分かった: (1) 粘膜を反転ではなく剥離 (2) 文化メディアに消化メディアと FBS に BSA の少量を追加する、(3) を下げることで、コラゲナーゼ XI の濃度、(4) 期間と数を増やす機械攪拌の強度と ROCK 阻害剤と、培養 (6) 低濃度で細胞外マトリックスをめっき (5) 単一細胞の健康を調整します。
同様に、次の適応されたパッチを固定しながら全体のセルを取得するため重要な: (1) (2) させる EC 無血清細胞外の溶液で文化とすすぐ細胞、少なくとも 4 時間のため細胞外の溶液に立つ (3)電極のようないずれかを転用過ごした失敗したシールからのそれら-次の EC のセルは、(4) 10 μ M Gd3 +細胞外ソリューション (存在) する場合、リーク電流をブロックし、哺乳類の細胞の付着を容易にするために追加するのに向かう途中のゴミを一掃するにはガラスに懸濁液。ご注意、ただし、Gd3 +がブロックする電位依存性 Ca2 +および/または機械受容チャネル EC 細胞で発現します。
培養条件を慎重に最適化にもかかわらず、我々 はいくつかの制限を発見した: EC 細胞が必要完全にアタッチまだ文化 〜 72 時間後に期限切れに 24 hしたがって、彼らは彼らは電気生理学的実験に適しただろうとき 48 時間ウィンドウを持っています。細胞をしばしば群生するので、単一の EC 細胞の生成に欠かせない録音から償うことができない容量の過渡現象をご紹介します。ただし、上皮から EC 細胞を区切ってセル (すなわち、ウシ胎児血清と人工基底膜と細胞外のマトリックス上に ROCK 阻害剤と高グルコース メディア) にネイティブでない環境に住んでいるし、対応することが刺激する完全 EC 細胞の代表は生体内で機能します。これらの制限にもかかわらず EC 細胞の主な養殖まだ自分の生理機能への洞察力を提供します。
EC 細胞はよく機能している消化管と体を維持する上で重要な役割を再生など、EC 細胞電気生理学について理解を得るために開発された多くの方法されています。不死化細胞モデル5,8,13モルモットの11、およびマウス3,4から主な EC 細胞培養 Enteroendocrine と EC 細胞電気生理学を調べた私たちメソッドは、最小限の処理が完了し、ネイティブの EC 細胞を反映している文化を作成する細胞の品質保持方法を利用しています。我々 は、トランスジェニック マウス モデル、Tph1 CFP、Tph1 は現在9時、細胞質にシアンの蛍光を示すを使用します。このメソッドは、他の記者やリネージュ トレース enteroendocrine 細胞型も使用できます。セルのみ 1 時間未満 0.1 mg/mL (腸) と 0.6 mg/mL (コロン) の最小限はまだ効果的な濃度で穏やかなコラゲナーゼ XI に公開されて私たちのメソッドも最小限の時間と酵素処理で単一の EC 細胞の分離を実現します。これらの変更の結果は、EC 細胞の電気生理学的研究のために最適化された文化です。
正常にマウス EC 細胞3電気生理学とセロトニン放出を検討するこのメソッドを使いました。正常に分離する機能し細胞単一 EC EC 細胞生理学的研究の重要な将来の方向性が容易になります。このメソッドを使用して、さらに重要な経路を判断できます、セル固有の送信機のセロトニンと他 EC EC 細胞分泌に関与しているチャンネル。分離し EC 細胞識別13アクリジン オレンジの使用と共にヒト EC 細胞の生理学を特徴付ける方法を修正も可能性があります。
最も科学的なプロトコル開発、通信と公平な観察はこのプロトコルのトラブルシューティングで重要だった。それは生存の手段として蛍光セルの数をカウント、料理をし多くの時間にわたって文化の代表的な写真やビデオを収集、各細胞の密度を推定する有用だった私たちは私たちの文化の生存のための新しい培養方法をテストしたときポイント。セルが過去の文化で 24 時間生き残ることができる、我々 は電気生理学実験のための私たちの文化を変更することに取り組みました。画像や詳細な観察を収集、一緒だった機械的消化とサプリメントおよび/または基質濃度の調整に関するラボ スタッフ間の明確なコミュニケーションを維持するために重要な健康な EC 細胞は準備ができていたので、電気生理学的特性。
開示事項
どれも
謝辞
著者は、行政支援のため夫人リンゼイ バズビーとメイヨー クリニック部門のエンジニア リング設計と文化料理挿入の 3 D プリントから氏ロバート感じてありがとうございます。この作品は、AB と NIH 消化器 (NIH P30DK084567) と 2015 アメリカ消化器病協会研究学者賞 (AGA RSA) における細胞シグナル伝達の NIH K08 AB (DK106456)、パイロット、メイヨー クリニックから AB に可能性の助成金によって支えられました。GF (DK52766) に R01。
資料
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm culture dish | Corning (Falcon) | 351029 | |
| Transfer Pipette | Fisherbrand | 13-711-7M | |
| 10 mL serological pipette | Corning (Falcon) | 357551 | |
| 50 mL Conical | Corning (Falcon) | 352098 | |
| 15 mL Conical | Corning (Falcon) | 352097 | |
| 1,000 mL Barrier Pipet Tips | Thermo Scientific (Art) | 2079E | Keep sterile |
| MatTek Glass Bottom Dishes | MatTek Corporation | P35G-1.5-14-C | Keep sterile |
| Micro-dissection Forceps - Very Fine, Extra-Long Points | Fine Science Tools | SB12630M | |
| Surgical Scissors-Sharp | Nasco | 14002-14 | |
| Micro-Dissection Scissors | Nasco | SB46568M | |
| Monoject Hypo Needle, 21 G x 1" A, 100/BX | Covidien | 8881250172 | |
| Tg(Tph1-CFP)1Able/J Mice | Jackson | Stock # 028366 | Use male or female mice between the ages of 4-7 weeks |
| Microfil nonmetallic syringe needles (34 gauge, 67 mm) | World Precision Instruments | MF34G-5 | |
| Parafilm "M" Laboratory Film | Pechiney Plastic Packaging | ||
| R6101 | Dow Corning | ||
| 6 mL syringe with regular luer tip | Monoject | ||
| 3 mL syringe with regular luer tip | Monoject | ||
| Electrophysiology Equipment | |||
| Amplifier | Molecular Devices | Axopatch 200B | |
| Data acquisition system (daq) | Molecular Devices | Digidata 1440A | |
| Signal conditioner | Molecular Devices | CyberAmp 320 | |
| Software | Molecular Devices | pClamp 10.6 |
参考文献
- Rindi, G., Leiter, A. B., Kopin, A. S., Bordi, C., Solcia, E. The "normal" endocrine cell of the gut: changing concepts and new evidences. Annals of the New York Academy of Sciences. 1014, 1-12 (2004).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. The Journal of Physiology. 589, 1081-1093 (2011).
- Strege, P. R., et al. Sodium channel NaV1.3 is important for enterochromaffin cell excitability and serotonin release. Scientific Reports. 7 (15650), (2017).
- Bellono, N. W., et al. Enterochromaffin cells are gut chemosensors that couple to sensory neural pathways. Cell. 170 (1), 185-198 (2017).
- Alcaino, C., Knutson, K., Gottlieb, P. A., Farrugia, G., Beyder, A. Mechanosensitive ion channel Piezo2 is inhibited by D-GsMTx4. Channels. 11 (3), 245-253 (2017).
- Kim, M., Javed, N. H., Yu, J. G., Christofi, F., Cooke, H. J. Mechanical stimulation activates Galphaq signaling pathways and 5-hydroxytryptamine release from human carcinoid BON cells. Journal of Clinical Investigation. 108 (7), 1051-1059 (2001).
- Modlin, I. M., Kidd, M., Pfragner, R., Eick, G. N., Champaneria, M. C. The functional characterization of normal and neoplastic human enterochromaffin cells. The Journal of Clinical Endocrinology and Metabolism. 91 (6), 2340-2348 (2006).
- Wang, F., et al. Mechanosensitive ion channel Piezo2 is important for enterochromaffin cell response to mechanical forces. The Journal of Physiology. 595 (1), 79-91 (2017).
- Li, H. J., et al. Distinct cellular origins for serotonin-expressing and enterochromaffin-like cells in the gastric corpus. Gastroenterology. 146 (3), 754-764 (2014).
- Psichas, A., Tolhurst, G., Brighton, C. A., Gribble, F. M., Reimann, F. Mixed primary cultures of murine small intestine intended for the study of gut hormone secretion and live cell imaging of enteroendocrine cells. Journal of Visualized Experiments. (122), 55687 (2017).
- Raghupathi, R., et al. Identification of unique release kinetics of serotonin from guinea-pig and human enterochromaffin cells. The Journal of Physiology. 591, 5959-5975 (2013).
- Nozawa, K., et al. TRPA1 regulates gastrointestinal motility through serotonin release from enterochromaffin cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3408-3413 (2009).
- Reimann, F., et al. Characterization and functional role of voltage gated cation conductances in the glucagon-like peptide-1 secreting GLUTag cell line. The Journal of Physiology. 563, 161-175 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved