Method Article
原代培养小鼠肠嗜铬细胞的全细胞电生理
* 这些作者具有相同的贡献
摘要
肠嗜铬 (EC) 细胞包括一个小的胃肠上皮细胞子集。ec 细胞是电兴奋和释放血清素, 但培养和鉴定 EC 细胞的困难是有限的生理学研究。本文提出的方法建立了一种能通过电生理学检查单个 EC 细胞的主要培养模型。
摘要
肠嗜铬 (EC) 细胞在胃肠道 (胃肠) 上皮构成最大亚群的 enteroendocrine 细胞。作为专门的感官细胞, EC 细胞感知腔内刺激并转化成血清素 (5-hyroxytryptamine, 5 HT) 释放事件。然而, 这些细胞的电生理学被理解得很差, 因为它们很难培养和识别。本文提出的方法概述了对单细胞电生理进行优化的主 EC 细胞培养。该协议利用转基因蓝荧光蛋白 (CFP) 记者在混合原代培养中识别小鼠 EC 细胞, 推进了在电压和电流钳模模式下获得全细胞电生理学高质量记录的方法。
引言
胃肠道上皮是由多种细胞类型组成的多种群落。Enteroendocrine 细胞约占所有上皮细胞的 1%, 肠嗜铬 (EC) 细胞是最大的 Enteroendocrine 细胞种群1。最近的研究表明, enteroendocrine2和 EC3,4细胞是电兴奋。我们有兴趣了解初级 EC 细胞电生理学。因此, 本研究旨在建立对全细胞电生理学进行优化的主 EC 细胞培养。
现有的 EC 细胞系, 产生和分泌 5 HT (例如, QGP-15, 苯6, KRJ-17), 并已用于检查电生理学5,8通常由永生化的肿瘤产生组织。虽然从这些细胞系获得的信息是宝贵的5,8, 研究的主要细胞电生理学是必要的, 以正确理解 EC 细胞生理学。原发性 EC 细胞的电生理要求单上皮细胞的分离和培养, 由于上皮培养的低生存能力而受到限制。
本研究提出的培养方法依赖于转基因小鼠的荧光标记 EC 细胞, 如 Tph1-CFP9, 用于本研究。该方法优化前2,10为单细胞电生理学3发展的混合原发上皮培养。以前的方法使用胰蛋白酶/edta 加胶原酶 A 或 edta 和德勤进行酶消化和使用密度梯度专门分离和培养豚鼠11和大鼠 EC 细胞12。最近, 肠道 organoids 的产生和机械中断的电生理记录4。使用这些方法的文化非常适合于血清素释放实验, RT-qPCR 分析, 虽然它们可以用于电生理学, 但依赖于耗时 organoid 生成、密度梯度识别 EC 细胞的成功, 以及胰蛋白酶和 EDTA 对细胞的破坏性作用。相比之下, 这里描述的协议改善酶和机械治疗, 优化培养条件, 并简化程序, 以生产单一和健康的 EC 细胞, 适合于高细胞标准的电生理学需要。
这种方法对于那些希望在混合培养中的初级 EC 细胞而不是永生化的文化中工作的科学家来说是有用的, 并希望研究单细胞的电生理学。然而, 这可能证明不太适合研究需要排序或长期文化的细胞群体, 需要生存过去72小时。
研究方案
这里描述的所有方法都已通过梅奥诊所的机构动物护理和使用委员会 (IACUC) 批准。此协议的主要单元格区域性部分基于以前发布的方法, 可供进一步详细信息10参考。所有实验程序必须经 (IACUC) 批准, 所有实验必须按照相关的指导方针和规定进行。
1. 文化准备
-
媒体。
- 用高葡萄糖制备 EC 细胞完整培养基 [4500 毫克/升] Dulbecco 的改良鹰培养基 (DMEM) 辅以5% 胎牛血清 (血清)、1% l-谷氨酰胺和1% 青霉素-链霉素 (表 1)。
注: 介质可存储在摄氏4摄氏度, 长达一个月。 - 过滤 EC 细胞完整的培养基, 并将25毫升的介质放入50毫升管中37摄氏度。
- 制备高葡萄糖消化培养基 [4500 毫克/升] DMEM 补充0.1% 牛血清白蛋白 (BSA) (表 1)。
- 过滤消化介质, 将四10毫升的介质整除数到单独的50毫升管中, 在37摄氏度的水浴中孵化。
注: 介质可存储在摄氏4摄氏度, 长达一个月。
- 用高葡萄糖制备 EC 细胞完整培养基 [4500 毫克/升] Dulbecco 的改良鹰培养基 (DMEM) 辅以5% 胎牛血清 (血清)、1% l-谷氨酰胺和1% 青霉素-链霉素 (表 1)。
-
酶。
- 4毫克 (空肠) 或24毫克 (结肠) 胶原酶 [≥800单位/毫克] 在1.5 毫升离心管。
注: 胶原酶稳定在-20 摄氏度, 长达一年。 - 并用重悬胶原酶整除在1毫升冰冷 PBS 与 Ca2 +和镁2 +。漩涡的解决方案, 彻底结合, 并放置在冰上。
- 4毫克 (空肠) 或24毫克 (结肠) 胶原酶 [≥800单位/毫克] 在1.5 毫升离心管。
-
涂层培养板。
- 将150µL 的细胞外基质解冻, 在4˚C 冰上过夜。
- 将100µL 解冻细胞外基质与2毫升冰冷无血清高葡萄糖 DMEM 混合, 制作 5% w/v 细胞外基质溶液。
注: 细胞外基质固化在室温下, 应处理与预冷吸管, 管, 和媒体, 直到准备涂菜。 - 立即将玻璃内圈涂上玻璃-底部35毫米菜肴与5% 胞外基质溶液的250µL。这个食谱将覆盖多达8道菜。
- 在剩余的细胞培养隔离步骤中, 将玻璃底菜放在37摄氏度的孵化器中。细胞外基质需要至少1小时的时间来设置, 但在执行其他隔离步骤时, 可在2.5 小时内孵化。
注: 孵化长于3小时, 可以建立细胞外基质, 在整个细胞电生理过程中会阻碍密封的形成。
2. 组织隔离
- 根据道德准则, 牺牲一个 3to 6 周的男性或女性 Tph1-CFP 转基因老鼠 (杰克逊实验室股票: 028366)9或另一个记者菌株。
注意: 我们使用致命剂量的二氧化碳和颈椎脱位作为辅助手段, 以确保死亡。AVAM 安乐死委员会还认为, 如果动物是第一次镇静剂, 则在使用训练的个体中, 宫颈脱位是一种允许的原发性安乐死方法。 - 用21克针将安乐死的老鼠钉在聚苯乙烯泡沫解剖台上。用70% 乙醇净化老鼠腹部。
- 用微解剖钳 (#5) 拉紧小鼠皮肤, 然后用锋利的手术剪刀在小鼠腹部底部进行横切口, 露出腹腔腔。将另一切口垂直向上腹部, 直到肋骨保持外露。
- 使用微解剖钳将盲肠移动到鼠标的左侧, 以获得结肠的清晰视图。
- 使用微解剖剪刀剪断结肠的最远端部分 (但仍然接近直肠), 并作出第二切口远端胃。将提取的肠道放入 100 x 15 毫米2培养皿中, 填充20毫升的冰寒磷酸盐缓冲盐水 (PBS)。
- 用小尺子测量和切开10厘米的中结肠或空肠。通过测量位于直肠上方的第一切口上的10厘米肠段, 提取结肠。通过将整个小肠折叠成两半, 并在中途切开第一切口, 并在第一个切口的近端10厘米处, 确定空肠。
注意: 继续执行所有随后在冰上的隔离步骤。 - 用冰冷的 PBS 填充6毫升注射器, 然后将注射器针插入到提取的肠道段的腔内。使用微解剖钳夹住注射器针周围的肠道, 并通过流明轻轻冲洗10毫升的 PBS, 冲洗掉粪便物质。
- 通过在腔内轻轻地编织微解剖钳, 捏一只肠道壁, 并将组织的末端缩回到镊子的尖端, 从而逆转肠道组织。重复这个过程, 直到该段是内出与腔向外。
- 用微解剖剪刀将组织段切成1厘米。
- 用微解剖钳转移50毫升的烧杯中填充5毫升无菌 PBS 的组织段。用微解剖剪刀把纸巾切成一条液化的稠度。
- 将碎组织和15毫升冰冷 PBS 放在清洁的50毫升管中, 通过转移吸管。Triturate 2 倍的转移吸管, 等待组织解决, 删除15毫升的 pbs 上清, 并取代新鲜 PBS。重复这个过程三次, 直到 PBS 是明确的。
- 将50毫升管与洗涤过的组织片放在冰上, 将冰桶放入组织培养罩中。
3. 酶和机械消化
-
第一消化
- 从水浴中, 检索含有10毫升预热消化介质的50毫升管之一。对50毫升管, 添加250µL 的 PBS 胶原酶溶液和碎肠组织片。
注意: 小心避免包括任何 PBS 从以前的洗涤步骤。 - 将50毫升管放在水浴中5分钟 (结肠或空肠) 37 摄氏度。摇管每分钟2x。
注意: 机械消化的最佳时间和强度可能会有所不同, 需要由用户来决定。为了确定最佳的消化条件, 每消化后可以观察到10µL 整除细胞。消化1时, 上清应由细胞团簇组成。 - 用10毫升血清吸管慢慢 triturate 组织一次。简单地让组织片断安定, 然后使用转移的吸管去除整个10毫升上清。
- 从水浴中, 检索含有10毫升预热消化介质的50毫升管之一。对50毫升管, 添加250µL 的 PBS 胶原酶溶液和碎肠组织片。
- 第二消化: 重复步骤3.1.1 到3.1.3。如果消化结肠, 将潜伏期提高到10分钟, 使空肠的潜伏期保持在5分钟。
注: 经观察, 清液仍应由大量细胞组成。 -
第三消化
- 重复步骤3.1。1
- 将50毫升管放置在37˚C 水浴中10分钟 (结肠或小空肠)。摇动管2-3x 每分钟的强度高于消解1和2。
- 用10毫升的血清吸管慢慢地将组织向上和向下吸管。让纸巾在短时间内安定下来。
注: 上清应由单个细胞和小团簇组合而成。 - 使用转移吸管放置10毫升的上清到一个新的15毫升管, 加入2毫升的温暖 EC 细胞完整的培养基, 并反转一次混合。
- 在室温下旋转 100 x g 5 分钟, 然后使用转移吸管去除上清液。使用转移吸管并用重悬2.5 毫升的加热 EC 细胞中的剩余颗粒, 完成培养培养基。
- 第四消化: 重复步骤3.3.1 到3.3.5。增加潜伏期为15分钟结肠和保持在10分钟的空肠。
注: 上清液现在应由单细胞组成。
4. 细胞培养
- 使用转移吸管将从消解3和4收集的细胞悬浮物组合成一个新的15毫升管 (5 毫升总容积)。
- 去除10µL 整除细胞计数与 hemocytometer 和旋转剩余的细胞悬浮在 100 x g在室温下5分钟。
注: 最后细胞悬浮液将由小团簇和单细胞组成。 - 用转移吸管移除上清液, 在 EC 细胞中并用重悬颗粒, 在每毫升100万个细胞的密度下完成培养培养基。
注: 最终细胞悬浮量将取决于最终细胞计数。典型的细胞计数范围从200万到400万不等。 - 从孵化箱中取出镀膜玻璃底培养皿。用 P1000 吸管替换每种培养皿中的细胞外基质, 并将最终细胞悬浮液的250µL。
注: 细胞外基质涂层倾向于粘在玻璃底菜的边缘。必须特别注意去除沿边缘的涂层, 以防止凝胶的积聚。 - 在1毫米的岩石抑制剂 Y-27632 的库存解决方案。添加2.5 µL 的库存解决方案, 每一个玻璃底菜, 以达到工作浓度10µM 岩石抑制剂在每道菜。
注意: 这一步对空肠培养的生存至关重要, 但对于结肠是可选的。 - 将每种文化菜放在37°c 和 5% CO2孵化器为24到 72 h (图 1)。
5. 全细胞电生理学 EC 细胞的制备
- 线的显微镜阶段的内径与两个 5 x 0.5 厘米条蜡膜, 以创建 O 形环。在 O 形环内安装35毫米细胞培养皿 (图 2A B)。
-
冲洗两个漂浮的碎片, 如未连接的细胞外基质或死细胞, 以及培养培养基血清完全远离 ec 细胞, 以防止任何阻碍在欧共体细胞和电极之间的密封形成。使用三以下选项, 以实现彻底的细胞冲洗足够的电生理学:
- 备选案文 1: 解决方案交换比圆形硐室更有效。由于 EC 细胞被培养在圆的35毫米菜, 创造一个塑料椭圆形插入为盘。
- 通过3D 打印或传统铣削方法创建插入。我们使用的插入是从丙烯酸塑料铣削的, 其尺寸如下 (毫米): 外径, 34.5;内椭圆, 20x9;外部高度, 10;内部高度, 1.5;桥梁跨度, 3x3;桥梁清除, 1.5;入口和出口, 每 4 x 4。
- 将插入到培养皿中 (图 2a B), 并将其固定在显微镜阶段的顶部, 其中两个0.15 到0.2 克的模型粘土被压成 1.2 x 0.3 x 0.1 厘米矩形 (图 2A C)。
- 用塑料转移吸管, 慢慢地在盘子 (入口) 的一侧添加细胞外溶液, 同时从另一侧 (出口) 吸入。
- 备选方案 2: 如果不采用工程塑料插入, 则在从另一侧 (出口) 吸入时, 从盘子 (入口) 一侧的转移吸管中添加胞外溶液。慢慢地旋转转移吸管的位置 (例如, N 到 e 到 S), 同时镜像在另一侧的吸入针的放置 (例如, S 到 W 到 N)。
- 选项 3: 在步骤1.3.3 中, 将胞外基质涂在矩形盖玻片上, 并在步骤4.4 中培养细胞悬浮在这些盖玻片上。将此盖玻片转移到填充胞外溶液的矩形腔室, 省略步骤5.1 并跳过步骤5.3。如选项 1 (5.2.1.3) 所述, 用塑料转移吸管冲洗腔内的胞外溶液。
- 备选案文 1: 解决方案交换比圆形硐室更有效。由于 EC 细胞被培养在圆的35毫米菜, 创造一个塑料椭圆形插入为盘。
- 用倒置显微镜以上的细胞培养重新连接舞台 (图 2D)。在室温下培养无血清细胞外液的 EC 细胞培养基。
- 4小时后, 再次冲洗的文化与细胞外溶液如上文所述。进行全细胞电生理学。
6. 原代培养的 EC 细胞的全细胞电生理学
-
实现全细胞千兆密封
- 拉一打电极, 以抵抗 1–5 MΩ。
注: 吸管 MΩ抗性, 产量 10-100 GΩ密封性能最佳。火焰抛光电极提示不需要达到 GΩ密封。 - 将所有吸管的鼻锥均匀地涂上聚合物。把吸管水平地放在地面上, 垂直于热枪的前面。慢慢旋转吸管直到聚合物硬化。
- 将整除的细胞内溶液倒入15毫升锥形管中。通过1毫升注射器将这个溶液的1.2 毫升转移到一个1.5 毫升的离心管中。在注射器中取出另外0.7 毫升细胞内溶液。从注射器的末端驱散空气。将一个灵活的34克, 67 毫米针连接到注射器, 并冲洗出任何剩余的空气从这个针头。
- 标识不与任何其他单元格或碎片接触的 Tph1-CFP+ 单元格。
- 用细胞内溶液填充电极尖端。用注射器回填吸管。用指甲小心地轻拍吸管, 驱散气泡界面。
- 与0.3 毫升空气的柱塞, 附上6毫升注射器到插座的持有人油管。将电极装入支架。
注: 在电极进入浴缸溶液前, 将注射器连接到导管, 以保持细胞内溶液在密封前的中性或正压。 - 加载一个两步电压钳协议, 记录稳态激活电流由一个电压梯在第一步, 并记录可用电流的一个单一的电压在第二步。打开密封测试 (5 mV 在50赫)。
- 将电极降低到浴缸溶液中。与并联, 机动电极尖端在平面上与直接水平的细胞。从注射器中排出0.3 毫升的空气。
- 轻轻地沿 x 轴水平移动电极以接触细胞。观察在 EC 细胞上出现的酒窝和/或在密封试验中增加膜电阻。如有必要, 沿 z 轴和/或水平沿 x 轴调整电极, 而不是穿过单元格中线。
- 在6毫升的注射器上应用0.1–0.2 毫升吸力。保持活塞稳定, 直到 100 MΩ达到, 然后释放抓地力从活塞。等待细胞的千兆封印。用拧的动作轻轻地拔下注射器。
注: 如果 EC 单元最初不密封, 则可能会在随后的尝试中重新密封它。要做到这一点, 轻轻地拉电极远离 EC 细胞与 < 20 MΩ密封电阻。将所用的电极转向并联, 环游目标 EC 细胞, 手动清除基体或碎片。然后, 尝试用一个新电极封住 EC 细胞。
- 拉一打电极, 以抵抗 1–5 MΩ。
-
记录整个电池电压-门控 Na+电流。
- 附上一个3毫升注射器与0.5–1.0 毫升空气。在3毫升的注射器上应用快速吸入 (0.1–0.5 毫升)。重复, 直到整个细胞访问达到, 然后轻轻地断开注射器。
注: 由于注射器的性能会随着时间和使用的变化而逐渐改变, 提前练习3毫升注射器 (用食指密封末端), 以确保柱塞在其起始位置0.1–0.2 毫升内会反冲。如果没有, 然后换一个新的注射器。 - 打开整个电池电容补偿。调整电容和串联电阻。打开系列电阻补偿。与滞后设置在60毫秒, 调整预测然后纠正系列电阻补偿。关闭密封试验。
- 记录平均5运行的全电池电压门控 Na+电流 (图 3A)。
- 快速注意电压门控 Na+电流的两个参数: 窗口电流的电压 (图 3B, 红色符号, 稳态活化和失活曲线的交集) 和峰值 Na+电流密度。
注: 在电压钳模模式下, 具有峰值 Na+电流的 EC 电池通常会在电流钳模模式下继续着火。另外, 电流大于-200 pA 在电压钳 (图 3A) 然后通常射击行动电位自发地在当前夹子从膜电位 (红色线,图 3D) 附近的电压窗口电流 (红色符号,图 3B)。
- 附上一个3毫升注射器与0.5–1.0 毫升空气。在3毫升的注射器上应用快速吸入 (0.1–0.5 毫升)。重复, 直到整个细胞访问达到, 然后轻轻地断开注射器。
-
记录诱发动作电位。
- 关闭系列电阻补偿。关闭外部命令。将该模式从 V 形夹具切换到 I 型夹具。调整增益。加载一个幕式电流钳协议。将保持电流的量调整为 0 pA。打开外部命令。
注意: 在不关闭外部命令的情况下, 不要从 V 钳切换到 I 钳 (反之亦然)。 - 注意休息膜电位。调整保持电流输入, 使膜电位读数低于窗口电流 (例如, -80 到-100 mV)。调整场景电流钳协议, 使当前输入的步长间隔小于保持电流的值 (图 3C嵌入, +2 pa 步骤为-3 pa 保持电流)。
- 记录诱发动作电位。注意当前注入的最少数量的动作电位 (图 3C, 扫 3 5, +4 pa 步骤从-3 pa 持有 = +1 pa)。
- 关闭系列电阻补偿。关闭外部命令。将该模式从 V 形夹具切换到 I 型夹具。调整增益。加载一个幕式电流钳协议。将保持电流的量调整为 0 pA。打开外部命令。
-
记录自发动作电位。
- 关闭外部命令。加载无间隙 (非幕式) 电流钳协议。
注意: 不要将外部命令重新打开, 直到无间隙电流钳协议中的保持电流量被验证为适合该单元格。 - 将保持电流更改为被引出协议中最后一次扫描中未发射动作电位的电流量 (图 3D, 在第二次扫描期间的当前输入, +2 pa 步骤从-3 pa 持有 =-1 pa)。
- 打开外部命令。双重检查, 预测保持电流带来的膜电位低于阈值, 以激发动作电位。如有必要, 调整保持电流。记录自发活动。
- 关闭外部命令。加载无间隙 (非幕式) 电流钳协议。
结果
文化:
由转基因 Tph1-CFP 模型制成的小鼠上皮细胞在4小时后附着在菜肴上, 并准备在24至 72 h 之间进行生理实验。当培养条件尚未优化时, 上皮细胞培养由大团簇、漂浮的细胞碎片、受损的细胞膜和 EC 细胞中微弱的 CFP 信号组成 (图 1A)。为电生理学优化的文化由单细胞和小团簇组成。健康的 EC 细胞很容易被明亮的 CFP 荧光识别, 并且在剧烈洗涤后仍然坚持在盘子里 (图 1B)。
电 生理:
欧共体整体细胞在尝试仅15±4% 获得了从结肠文化, 不用岩石抑制剂 (29 个整体细胞182企图从22文化), 但30±7% 企图从结肠文化与岩石抑制剂 (27 个整体细胞从102个文化尝试50个) (c1>Figure 4A;p < 0.05 由非参数两尾t检验, 结肠培养, 不与岩石抑制剂 )。同样, 没有岩石抑制剂的空肠 ec 细胞在电生理方面的生存时间不够长, 而 ec 全细胞则是在41±3% 的空肠培养和岩石抑制剂 (186 个全细胞447次尝试从50种文化) 中获得的 (图4A;p > 0.05 由非参数双尾t检验, 空肠与结肠与岩石抑制剂)。
通过全细胞电生理, 在电流钳模式下, 以电压钳型和动作电位 (AP) 记录了 Na+电流。Na+电流记录从81.3 ±4.0% 的 TPH1-CFP+ 细胞从空肠或64.1 ±9.2% 从结肠3。通过电压钳确认的 59 ec 细胞具有 Na+峰值电流大于-25 pA, 19 ec 细胞在电流钳模式下激发自发 ap ("自发"), 29 EC 细胞仅在电流钳中的阶跃协议引起时激发 ap模式 ("仅引起"), 和 11 EC 细胞没有自发地或通过步骤协议 ("不开火") (图 4B) 发射 AP。自发细胞的平均峰值 Na+电流密度 (I峰值) 的-108.0 ±19.3 pa/pf, 仅诱发细胞有 i峰值-60.2 ±9.2 pa/pf, 而非发射细胞有 i峰值-43.3 ±14 pa/pf (图 4 B;p < 0.05, 自发与诱发的或非射击组;p > 0.05 只被诱发的与非射击组)。电流密度的差异不是整个细胞电容的反映, 因为自发 (3.3 ±0.2 pf), 仅诱发 (2.9 ±0.2 pf), 非发射 (3.1 ±0.3 pf) 细胞具有类似的全细胞电容 (P > 0.05)。EC 细胞 Na+电流和诱发 AP 对 [na+]o浓度和 NaV1.3 抑制3敏感。

图 1: 文化结果的代表性范围.DIC 与荧光的初步上皮空肠培养的图像从一个 Tph1-CFP 的小鼠镀在玻璃底菜和培养24小时。这两个图像显示了该协议的一系列文化结果。CFP 荧光细胞 (白色) 是肠嗜铬 (EC) 细胞。(a) 来自于电生理质量较差的文化的代表性形象。这种养殖由大团簇、受损细胞膜、低荧光信号和漂浮的死细胞组成。(B) 已为电生理学优化的文化中具有代表性的形象。文化主要由单一的、健康的细胞和粘在盘子里的小团簇组成。欧共体细胞在这个文化保持一个强的荧光信号。刻度条 = 100 µm;面板的规模为1:1。请单击此处查看此图的较大版本.

图 2: 为电生理学制备细胞培养物.一种有效和彻底冲洗无血清细胞外液的 EC 细胞培养的策略, 对于减少细胞外基质和血清将阻碍海豹形成至关重要。材料。顺时针方向, 从左上: 舞台, 两个5毫米宽条蜡膜, 两个200毫克的造型粘土, 塑料转移吸管, #5 钳, 椭圆形记录室, 35 毫米培养皿与玻璃底部。(B) 将蜡膜粘附到舞台的内径内, 将椭圆形腔板降低成培养皿, 并将粘土平整成长方形的长条。(C) 将培养皿轻轻按在蜡膜内衬的阶段, 并通过将建模粘土伸展到盘子的边缘, 从腔室到舞台, 固定录音室。用几卷胞外溶液冲洗 EC 细胞。(D) 将舞台恢复到倒置显微镜上方的安装托架上。请单击此处查看此图的较大版本.

图 3: 代表电生理结果.(a) 整个细胞 Na+电流, 由两步电压钳协议 (嵌入) 记录。50 ms depolarizations 从-120 mv 激活通道在步骤 1 () 中, 而在步骤 2 (0) 中进一步极化到 0 mv 激活尚未灭活的通道 (即仍可打开)。红色迹线, 电流由-120 到-40 到 0 mV 的电压步骤引起。(B) 从面板 A、步骤 1 (稳态激活) 或步骤 2 (0、稳态失活) 中峰值 Na+电流的电流电压关系。稳态活化和失活曲线的交集揭示了一个小窗口电流在-40 mV (红色符号)。(C) 去极化型电流刺激诱发的动作电位。当膜电位达到 Na+窗口电流 (红线,-40 mV) 的电压时, 动作电位可能会在 0 mV (灰色线) 上点火。嵌入式, 电流钳协议, 其中0至 +8 pa 被注入 50-ms depolarizations 从基线-3 pA。(D) 动作电位从顶部自发事件偏振光到-40 mV。请单击此处查看此图的较大版本.
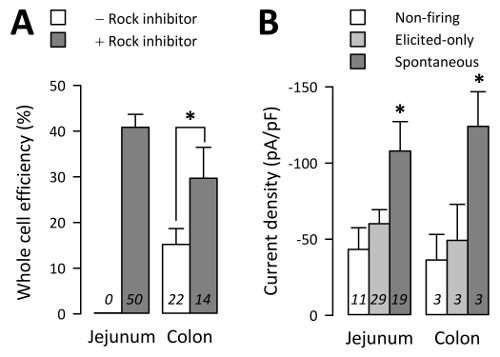
图 4: 全细胞电生理学的吞吐量.(A) 在岩石抑制剂缺席 (-) 或存在 (+) 的情况下, 每个尝试 n 天工作的全细胞平均百分比 (10 µM)。在无岩石抑制剂的培养中, 空肠中的 EC 细胞不能存活24小时。(B) 由n EC 单元测量的电压钳中的 Na+电流密度, 其中动作电位不开火 (不开火), 仅在发生幕式电流钳协议 (仅引起) 时激发, 或自发地发射在无间隙电流钳模式 (自发) (误差条是 SEM)。请单击此处查看此图的较大版本.
讨论
充分理解 EC 细胞功能需要一个高质量的原生培养方法来生成细胞的全细胞电生理学。传统的胃肠上皮原代培养由于生存率低而较为困难。为了缓解这一混杂因素, 目前的方法产生了来自于小肠或大肠的奇异 EC 细胞的培养, 能够存活数天。
我们发现以下对提高适合于电生理的培养质量是至关重要的: (1) 反转粘膜而不是剥离它, (2) 在消化介质中加入少量 BSA 并对培养基进行血清, (3) 降低胶原酶 XI 浓度, (4) 调整机械搅拌的持续时间和强度, 增加单细胞的数量和健康, (5) 在低浓度下电镀细胞外基质, (6) 用岩石抑制剂培养。
同样, 以下适应是关键的获得整个细胞, 而补丁夹紧: (1) 彻底冲洗的文化与无血清细胞外液, (2) 让 EC 细胞在细胞外溶液中至少 4 h, (3)重新用途任何消耗的电极-像那些从失败的封印-清除碎片, 在路由到下 EC 细胞, (4) 添加10µM Gd3 +到细胞外的解决方案, 以阻止泄漏电流 (如果存在), 并促进哺乳动物细胞的黏附悬浮到玻璃上。然而, 我们警告, Gd3 +可以阻止电压门控 Ca2 +和/或 mechanosensitive 通道表达的 EC 细胞。
尽管仔细地优化了培养条件, 我们发现了一些限制: EC 细胞需要24小时完全附加, 但在 72 h 的文化后过期;因此, 他们有一个48小时的窗口, 当他们将适合的电生理实验。由于集群细胞经常引入无法从录音中获得补偿的电容瞬变, 所以生成单个 EC 细胞是至关重要的。然而, 通过将 EC 细胞从上皮细胞中分离出来, 它们就生活在非本土的环境中 (即, 高葡萄糖培养基与胎牛血清和岩石抑制剂在细胞外基质上作为人工基底膜), 并能反应刺激不完全代表 EC 细胞在体内的功能。尽管有这些限制, EC 细胞的主要培养仍然能洞察他们的生理。
ec 细胞在维持一个功能良好的胃肠道和身体方面起着关键的作用, 因此, 已经有许多方法来了解 ec 细胞电生理学。Enteroendocrine 和 EC 细胞电生理学研究在永生化细胞模型5,8,13, 初级 EC 细胞培养从豚鼠11, 和老鼠3,4, 我们的方法利用细胞质量保留的方法来创建一个已被最小处理并反映本机 EC 细胞的文化。我们使用的转基因小鼠模型, Tph1-CFP, 这表明在细胞质中的青色荧光, 当 Tph1 存在9。此方法还可用于其他记者或沿袭跟踪的 enteroendocrine 单元格类型。我们的方法也完成了在最短时间和酶治疗的单一 EC 细胞的隔离, 因为细胞只接触到一个温和的胶原酶 XI 在极小但有效浓度的0.1 毫克/毫升 (空肠) 和0.6 毫克/毫升 (结肠) 少于一小时。这些修改的结果是一种为 EC 细胞的电生理研究而优化的文化。
我们已经成功地用这种方法研究了小鼠 EC 细胞的电生理和血清素释放3。成功分离、识别和培养单一 ec 细胞的能力促进了欧共体细胞生理学研究的重要未来方向。该方法可用于进一步确定欧共体细胞胞吐作用血清素和其他 ec 细胞特异发射机所涉及的关键通路和通道。该方法也可以被修改, 以分离和表征人类 ec 细胞的生理和使用吖啶橙为 EC 细胞鉴定13。
与大多数科学协议的开发一样, 通信和无偏见的观察对于解决此协议至关重要。当我们测试新的文化方法, 以生存我们的文化, 这是有助于计算的数量的荧光细胞作为衡量的生存能力, 估计细胞密度在每道菜, 并收集代表性的图片和视频的文化跨越许多时间点。在细胞能够在24小时的文化生存后, 我们致力于改变我们的文化进行电生理学实验。除了收集图像和详细的观察, 重要的是要保持实验室人员之间的明确沟通, 对机械消化和补充和/或基质浓度的调整, 使健康的 EC 细胞准备就绪用于电生理特性。
披露声明
没有
致谢
作者感谢 Lyndsay 夫人为行政协助和罗伯特海耶特先生从梅奥诊所工程设计和3D 印刷的文化碟插入。这项工作得到了美国国立卫生研究院 K08 (DK106456) 的支持, 从梅奥临床中心向 ab (nih P30DK084567) 的细胞信号传递实验和可行性赠款, 以及2015个美国人胃肠协会研究学者奖 (AGA RSA) 到 ab 和 NIH。R01 到 GF (DK52766)。
材料
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm culture dish | Corning (Falcon) | 351029 | |
| Transfer Pipette | Fisherbrand | 13-711-7M | |
| 10 mL serological pipette | Corning (Falcon) | 357551 | |
| 50 mL Conical | Corning (Falcon) | 352098 | |
| 15 mL Conical | Corning (Falcon) | 352097 | |
| 1,000 mL Barrier Pipet Tips | Thermo Scientific (Art) | 2079E | Keep sterile |
| MatTek Glass Bottom Dishes | MatTek Corporation | P35G-1.5-14-C | Keep sterile |
| Micro-dissection Forceps - Very Fine, Extra-Long Points | Fine Science Tools | SB12630M | |
| Surgical Scissors-Sharp | Nasco | 14002-14 | |
| Micro-Dissection Scissors | Nasco | SB46568M | |
| Monoject Hypo Needle, 21 G x 1" A, 100/BX | Covidien | 8881250172 | |
| Tg(Tph1-CFP)1Able/J Mice | Jackson | Stock # 028366 | Use male or female mice between the ages of 4-7 weeks |
| Microfil nonmetallic syringe needles (34 gauge, 67 mm) | World Precision Instruments | MF34G-5 | |
| Parafilm "M" Laboratory Film | Pechiney Plastic Packaging | ||
| R6101 | Dow Corning | ||
| 6 mL syringe with regular luer tip | Monoject | ||
| 3 mL syringe with regular luer tip | Monoject | ||
| Electrophysiology Equipment | |||
| Amplifier | Molecular Devices | Axopatch 200B | |
| Data acquisition system (daq) | Molecular Devices | Digidata 1440A | |
| Signal conditioner | Molecular Devices | CyberAmp 320 | |
| Software | Molecular Devices | pClamp 10.6 |
参考文献
- Rindi, G., Leiter, A. B., Kopin, A. S., Bordi, C., Solcia, E. The "normal" endocrine cell of the gut: changing concepts and new evidences. Annals of the New York Academy of Sciences. 1014, 1-12 (2004).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. The Journal of Physiology. 589, 1081-1093 (2011).
- Strege, P. R., et al. Sodium channel NaV1.3 is important for enterochromaffin cell excitability and serotonin release. Scientific Reports. 7 (15650), (2017).
- Bellono, N. W., et al. Enterochromaffin cells are gut chemosensors that couple to sensory neural pathways. Cell. 170 (1), 185-198 (2017).
- Alcaino, C., Knutson, K., Gottlieb, P. A., Farrugia, G., Beyder, A. Mechanosensitive ion channel Piezo2 is inhibited by D-GsMTx4. Channels. 11 (3), 245-253 (2017).
- Kim, M., Javed, N. H., Yu, J. G., Christofi, F., Cooke, H. J. Mechanical stimulation activates Galphaq signaling pathways and 5-hydroxytryptamine release from human carcinoid BON cells. Journal of Clinical Investigation. 108 (7), 1051-1059 (2001).
- Modlin, I. M., Kidd, M., Pfragner, R., Eick, G. N., Champaneria, M. C. The functional characterization of normal and neoplastic human enterochromaffin cells. The Journal of Clinical Endocrinology and Metabolism. 91 (6), 2340-2348 (2006).
- Wang, F., et al. Mechanosensitive ion channel Piezo2 is important for enterochromaffin cell response to mechanical forces. The Journal of Physiology. 595 (1), 79-91 (2017).
- Li, H. J., et al. Distinct cellular origins for serotonin-expressing and enterochromaffin-like cells in the gastric corpus. Gastroenterology. 146 (3), 754-764 (2014).
- Psichas, A., Tolhurst, G., Brighton, C. A., Gribble, F. M., Reimann, F. Mixed primary cultures of murine small intestine intended for the study of gut hormone secretion and live cell imaging of enteroendocrine cells. Journal of Visualized Experiments. (122), 55687 (2017).
- Raghupathi, R., et al. Identification of unique release kinetics of serotonin from guinea-pig and human enterochromaffin cells. The Journal of Physiology. 591, 5959-5975 (2013).
- Nozawa, K., et al. TRPA1 regulates gastrointestinal motility through serotonin release from enterochromaffin cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3408-3413 (2009).
- Reimann, F., et al. Characterization and functional role of voltage gated cation conductances in the glucagon-like peptide-1 secreting GLUTag cell line. The Journal of Physiology. 563, 161-175 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。