Method Article
Ganze Zelle Elektrophysiologie des primären kultivierten murinen Enterochromaffinen Zellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Enterochromaffinen (EG) Zellen umfassen eine kleine Teilmenge der Magen-Darm-Epithelzellen. EG-Zellen elektrisch erregbar sind und Serotonin, noch Schwierigkeiten bei der Kultivierung und Identifizierung von EG-Zellen physiologische Studien beschränkt haben. Die hier vorgestellte Methode stellt eine Primärkultur Modell zur Untersuchung von Einzelzellen EG zugänglich durch Elektrophysiologie.
Zusammenfassung
Enterochromaffinen (EG) Zellen in der gastro-intestinale (GI) Epithel bilden die größte Subpopulation von Enteroendocrine Zellen. Als spezialisierte Sinneszellen EC-Zellen spüren luminalen Reize und wandeln sie in Serotonin (5-Hyroxytryptamine, 5-HT) Release Events. Allerdings ist die Elektrophysiologie dieser Zellen schlecht verstanden, weil sie schwer zu Kultur und zu identifizieren sind. In diesem Papier Umrisse primären EG Zellkulturen vorgestellte Methode optimiert für einzelne Zelle Elektrophysiologie. Dieses Protokoll nutzt einen transgene Cyan fluoreszierenden Proteins (GFP) Reporter um EG Mauszellen in primären Mischkulturen, Förderung des Ansatzes auf die Erlangung von qualitativ hochwertigen Aufnahmen der ganzen Zelle Elektrophysiologie in Spannung und Strom-Klemme Modi zu identifizieren.
Einleitung
Das gastro-intestinale (GI) Epithel ist eine vielfältige Gemeinschaft, bestehend aus mehreren Zelltypen. Enteroendocrine Zellen umfassen etwa 1 % aller epithelialen Zellen, und enterochromaffinen (EG) Zellen sind die größten Enteroendocrine Cell Bevölkerung1. Neuere Studien zeigen, dass Enteroendocrine2 und EG3,4 Zellen elektrisch erregbar sind. Wir interessieren uns für das Verständnis der primären EG Zelle Elektrophysiologie. Somit war der Zweck dieser Studie primären EG Zellkulturen für ganze Zelle Elektrophysiologie optimiert.
Bestehende EG-Zelle, die Linien, die produzieren und sezernieren 5-HT (z. B. QGP-15, BON6, KRJ-1-7) und wurden verwendet, um die Elektrophysiologie5,8 prüfen in der Regel aus generiert werden verewigt neoplastischen Gewebe. Zwar die Informationen von diesen Zelllinien wertvolle5,8, sind Studien der Primärzelle Elektrophysiologie notwendig, um richtig zu verstehen, EG Zellphysiologie. Die Elektrophysiologie des primären EG-Zellen erfordert die Isolierung und Kultur einzelner epithelialen Zellen, die durch geringe Tragfähigkeit des epithelialen Kulturen begrenzt wurde.
In dieser Studie vorgestellten Kultur-Methode stützt sich auf Transgene Mäuse mit Gewebekulturen beschrifteten EG-Zellen, wie Tph1-GFP9, in dieser Studie verwendet. Die Methode optimiert gemischte primäre epitheliale Kulturen entwickelte bereits2,10 für einzelne Zelle Elektrophysiologie3. Bisherige Methoden verwendet Kombinationen von Trypsin/EDTA plus Collagenase A oder EDTA und DVB-t für die enzymatische Verdauung und Dichtegradienten speziell isolieren und Kultur Meerschweinchen11 und Ratte EG Zellen12. Vor kurzem wurden Darm Organellen generiert und mechanisch für elektrophysiologische Aufnahmen4gestört. Kulturen, die mit diesen Methoden eignen sich gut für Serotonin lassen Sie Experimente, RT-qPCR Analyse und, während sie für Elektrophysiologie, verwendet werden können sind angewiesen auf den Erfolg der Zeit raubende organoide Generation, Dichtegradienten, EG-Zellen zu identifizieren und die zelluläre störende Wirkung von Trypsin und EDTA. Im Gegensatz dazu das hier beschriebene Protokoll verbessert die enzymatische und mechanische Behandlungen Kultivierung Bedingungen optimiert und rationalisiert Verfahren um Einzel- und gesunde EG-Zellen für die hohen zellulären Standards für Elektrophysiologie benötigt zu produzieren.
Diese Methode ist nützlich für Wissenschaftler, die primären EG-Zellen in Mischkulturen statt verewigt Kulturen arbeiten möchten und die Elektrophysiologie einzelner Zellen untersuchen möchten. Es könnte jedoch weniger geeignet für das Studium Zell-Populationen, die Sortier- oder langfristige Kulturen benötigen, die letzten 72 h Überleben benötigen.
Protokoll
Alle hier beschriebene Methoden wurden von den institutionellen Animal Care und Nutzung Committee (IACUC) der Mayo-Klinik genehmigt. Der Primärzelle Kultur Teil dieses Protokolls basiert auf zuvor veröffentlichten Methoden, auf die verwiesen werden können für weitere Details10. Alle experimentelle Verfahren müssen von der (IACUC) genehmigt werden, und alle Experimente müssen im Einklang mit geltenden Richtlinien und Vorschriften durchgeführt werden.
1. Kultur-Vorbereitung
-
Medien.
- Bereiten Sie komplette Zellkulturmedien EG mit hoher Glucose [4500mg/L] Dulbecco geändert Eagle Medium (DMEM) ergänzt mit 5 % fetalen Bovine Serum (FBS), 1 % L-Glutamin und 1 % Penicillin-Streptomycin (Tabelle 1).
Hinweis: Datenträger kann bis zu einen Monat lang bei 4 ° C aufbewahrt werden. - Filtern der EG komplette Zellkulturmedien und Platz 25 mL von Medien in ein 50 mL Röhrchen bei 37 ° C.
- Bereiten Sie Verdauung Medien mit hoher Glucose [4.500 mg/L] DMEM mit 0,1 % ergänzt Bovine Serum Albumin (BSA) (Tabelle 1).
- Die Verdauung Filtermedien und vier 10 mL-aliquoten Medien in separaten 50 mL Röhrchen und im Wasserbad 37 ° C inkubieren.
Hinweis: Datenträger kann bis zu einen Monat lang bei 4 ° C aufbewahrt werden.
- Bereiten Sie komplette Zellkulturmedien EG mit hoher Glucose [4500mg/L] Dulbecco geändert Eagle Medium (DMEM) ergänzt mit 5 % fetalen Bovine Serum (FBS), 1 % L-Glutamin und 1 % Penicillin-Streptomycin (Tabelle 1).
-
Enzym.
- Wiegen Sie, 4 mg (für Jejunum) oder 24 mg (Doppelpunkt) von Kollagenase XI [≥800 Einheiten/mg] in einem 1,5 mL Microcentrifuge Schlauch.
Hinweis: Kollagenase ist stabil bei-20 ° C bis zu einem Jahr. - Die Kollagenase aliquoten in 1 mL Eis kaltem PBS mit Ca2 + und Mg2 +aufzuwirbeln. Wirbel die Lösung gründlich zu kombinieren, und auf Eis legen.
- Wiegen Sie, 4 mg (für Jejunum) oder 24 mg (Doppelpunkt) von Kollagenase XI [≥800 Einheiten/mg] in einem 1,5 mL Microcentrifuge Schlauch.
-
Lackplatten Kultur.
- 150 µL der extrazellulären Matrix über Nacht bei 4 ° c auf dem Eis Auftauen.
- Machen Sie eine 5 % w/V extrazelluläre Matrixlösung durch Mischen 100 µL der aufgetauten extrazelluläre Matrix mit 2 mL eiskaltes serumfreien High-Glukose DMEM.
Hinweis: Extrazellulärer Matrix verfestigt sich bei Raumtemperatur und sollte erst unmittelbar vor Mantel Gerichte mit vorgekühlt Pipetten, Schläuche und Medien behandelt werden. - Sofort zu beschichten glaskreis der Glasboden 35 mm Schalen mit 250 µL der extrazellulären Matrix-Lösung 5 %. Dieses Rezept wird bis zu 8 Gerichte umfassen.
- Legen Sie die Glasboden Gerichte in einem Inkubator 37 ° C während der restlichen Zelle Kultur isoliert Schritte. Die extrazelluläre Matrix dauert mindestens 1 Stunde einstellen, aber beim Ausführen der Schritte andere Isolierung bis zu 2,5 h inkubiert werden können.
Hinweis: Inkubationen länger als 3 h ein Aufbau der extrazellulären Matrix erstellen können, die behindern könnte dichten Formation während ganze Zelle Elektrophysiologie.
(2) Gewebe isoliert
- Nach ethischen Richtlinien zu Opfern einer 3bis 6 Wochen alten männlichen oder weiblichen Tph1-GFP transgenen Maus (The Jackson Labor Stock: 028366)9 oder eine andere Reporter Belastung.
Hinweis: Wir verwenden eine tödliche Dosis von steigenden Niveaus von Kohlendioxid und eine zervikale Dislokation, als eine sekundäre bedeutet Tod sicherzustellen. AVAM über Sterbehilfe nach Ansicht des Ausschusses auch zervikale Dislokation eine zulässige primäre Euthanasie-Methode von Personen ausgebildet in seiner Verwendung, wenn die Tiere zunächst sediert werden. - PIN der euthanasierten Maus heraus auf einer Polystyrol-Hartschaum-Dissektion-Bühne mit 21 G Nadeln. Die Maus-Bauch mit 70 % Ethanol zu dekontaminieren.
- Ziehen Sie die Maus Haut straff mit Mikro-Dissektion Pinzette (#5), und dann verwenden Sie scharfe chirurgische Scheren zu einem Quereinschnitt an der Unterseite des Bauches Maus, intraperitonealen Hohlraum verfügbar zu machen. Machen Sie einen anderen Schnitt senkrecht auf den Bauch, bis den Brustkorb ausgesetzt ist.
- Verwenden Sie die Mikro-Dissektion Zange um der Blinddarm auf der linken Seite der Maus, um eine klare Sicht auf den Dickdarm erreichen zu verschieben.
- Verwenden Sie die Mikro-Dissektion Schere zum Schneiden des distalsten Teils des Dickdarms (aber immer noch proximal zu den Mastdarm) und einen zweiten in den Magen distalen geschnitten. Ort der extrahierten Darm in ein 100 x 15 mm2 Petrischale mit 20 mL eiskaltes Phosphat gefüllt gepufferte Kochsalzlösung (PBS).
- Verwenden Sie ein kleines Lineal zu messen und schneiden Sie 10 cm entweder Mitte Doppelpunkt oder Jejunum. Extrahieren Sie Doppelpunkt durch Messen 10 cm Segment des Darmes befindet sich nach proximal bis zum ersten Schnitt genommen über den Enddarm. Identifizieren Sie das Jejunum durch den gesamten Dünndarm in der Hälfte falten und macht einen ersten Schnitt in der Mitte und einen zweiten Schnitt 10 cm proximal zum ersten Schnitt.
Hinweis: Weiterhin alle isoliert-Schritte auf dem Eis. - Füllen einer 6 mL-Spritze mit Eis kaltem PBS und der Spritzennadel in das Lumen des Segments extrahierten Darm. Verwenden Sie der Mikro-Dissektion Zange zum Spannen und verschließen den Darm um die Spritzennadel, und spülen Sie sanft 10 mL PBS durch das Lumen entfernt Fäkalien spülen.
- Invertieren Sie das Darmgewebe sanft weben die Mikro-Dissektion Zange durch das Lumen Kneifen eine Darmwand und das Gewebe an der Spitze der Zange proximalen zurückziehen. Wiederholen Sie diesen Vorgang, bis das Segment innen nach außen ist mit dem Lumen nach außen.
- Mit Mikro-Dissektion einer Schere Segment Gewebe in 1 cm lange Stücke schneiden.
- Verwenden Sie Mikro-Dissektion Zange, um die Gewebe-Segmente in ein 50 mL Becherglas gefüllt mit 5 mL sterilem PBS übertragen. Verwenden Sie die Mikro-Dissektion Schere, um die Gewebe-Stücke zu einem verflüssigte Konsistenz zerkleinern.
- Legen Sie die Hackfleisch / Gewebe und 15 mL Eis kaltem PBS in einer sauberen 50 mL Tube von transferpipette. 2 Mal mit der transferpipette genannte, warten auf das Gewebe zu begleichen, 15 mL PBS überstand zu entfernen und ersetzen Sie durch neue PBS. Wiederholen Sie diesen Vorgang dreimal, bis die PBS klar ist.
- Die 50 mL-Tube mit gewaschenen Gewebe Stücke auf dem Eis und bringen Sie den Eiskübel in einer Gewebekultur-Haube.
(3) enzymatische und mechanische Verdauung
-
Erste Verdauung
- Rufen Sie aus dem Wasserbad eines der 50 mL Röhrchen mit 10 mL vorgewärmten Verdauung Medien ab. Die 50 mL-Tube fügen Sie 250 µL PBS Kollagenase Lösung und gehacktem Darmgewebe Stücke hinzu.
Hinweis: darauf achten Sie, um zu vermeiden, einschließlich alle PBS aus früheren Waschschritte. - Legen Sie die 50 mL-Tube in einem Wasserbad für 5 Minuten (Doppelpunkt oder Jejunum) bei 37 ° C. Schütteln Sie die Röhre 2 X pro Minute.
Hinweis: Den optimalen Zeitpunkt und die Intensität der mechanischen Verdauung können variieren und müssen vom Benutzer bestimmt werden. Um die optimale Verdauung Bedingungen zu ermitteln, ist eine Aliquote 10 µL Zellen nach jedem Verdauung einsehbar. Während der Verdauung 1 sollte der Überstand der Klumpen von Zellen bestehen. - Das Gewebe genannte langsam einmal mit einer serologischen 10 mL-Pipette. Kurz lassen Sie das Gewebe, die Stücke zu begleichen, dann verwenden Sie eine transferpipette, um die gesamte 10 mL überstand zu entfernen.
- Rufen Sie aus dem Wasserbad eines der 50 mL Röhrchen mit 10 mL vorgewärmten Verdauung Medien ab. Die 50 mL-Tube fügen Sie 250 µL PBS Kollagenase Lösung und gehacktem Darmgewebe Stücke hinzu.
- Zweite Verdauung: Wiederholen Sie die Schritte 3.1.1 bis 3.1.3. Erhöhen Sie die Inkubationszeit, 10 min zu, wenn Darm Verdauung und halten Sie die Inkubationszeit bei 5 min für Jejunum.
Hinweis: Bei der Beobachtung, sollte der überstand noch große Klumpen von Zellen bestehen. -
Dritte Verdauung
- Wiederholen Sie Schritt 3.1.1
- Legen Sie die 50-mL-Tube im Wasserbad 37 ° c für 10 min (Doppelpunkt oder kleine Jejunum). Schütteln Sie dem Rohr 2-3 X / min. bei einer höheren Intensität als Verdauung 1 und 2.
- Das Gewebe pipette langsam nach oben und unten mit einer serologischen 10-mL-Pipette. Lassen Sie die Gewebe-Stücke für eine kurze Zeit zu begleichen.
Hinweis: Der Überstand sollte aus einer Kombination von Einzelzellen und kleine Klümpchen bestehen. - Verwenden Sie eine transferpipette 10 mL des Überstands setzen Sie eine neue 15 mL Tube, fügen Sie 2 mL erwärmten EG komplette Zellkulturmedien und invertieren einmal um zu mischen.
- Spin 100 X g für 5 min bei Raumtemperatur, dann verwenden Sie ein transferpipette, um den überstand zu entfernen. Verwenden Sie eine transferpipette, um die restlichen Pellets in 2,5 mL erwärmten EG komplette Zellkulturmedien aufzuwirbeln.
- 4. Verdauung: Wiederholen Sie die Schritte 3.3.1 auf 3.3.5. Die Inkubationszeit bis 15 min für Darmkrebs erhöhen und bleiben bei 10 min für Jejunum.
Hinweis: Der Überstand sollte nun von einzelnen Zellen bestehen.
4. die Zellkultur
- Verwenden Sie eine transferpipette um die Zellsuspensionen gesammelt von Verdauung 3 und 4 in eine neue 15 mL Tube (5 mL Gesamtvolumen) kombinieren.
- Entfernen einer 10 µL Aliquot der Zellen zu zählen mit einer Hemocytometer und drehen Sie die restlichen Zellsuspension bei 100 X g für 5 min bei Raumtemperatur.
Hinweis: Die endgültige Zellsuspension besteht aus kleinen Klumpen und Einzelzellen. - Entfernen Sie den Überstand mit einer transferpipette und Aufschwemmen der Pellets im EG komplett Zellkulturmedien bei einer Dichte von 1.000.000 Zellen pro mL.
Hinweis: Der letzte Band der Zellsuspension hängt die endgültige Zellenzahl. Typische Zelle zählt reichen von 2.000.000 bis 4.000.000. - Beschichtete Glasboden Kultur Gerichte aus dem Inkubator zu entfernen. Verwenden einer Pipette P1000 extrazellulären Matrix aus jeder Kulturschale mit 250 µL der endgültigen Zellsuspension zu ersetzen.
Hinweis: Extrazelluläre Matrix Beschichtung neigt dazu, an den Rändern der Glasboden Schale zu halten. Besondere Sorgfalt muss zum Entfernen der Beschichtung von entlang der Kante, Gel Anhaftungen zu verhindern. - Machen Sie eine Stammlösung ROCK-Inhibitor Y-27632 bei 1 mM. Fügen Sie 2,5 µL der Stammlösung auf jeder Unterseite Glasschale, eine arbeiten-Konzentration von 10 µM-ROCK-Inhibitor in jedes Gericht zu erreichen.
Hinweis: Dieser Schritt ist entscheidend für das Überleben des Jejunum Kulturen aber ist optional für Darmkrebs. - Platzieren Sie jedes Kulturschale in einem 37 ° C und 5 % CO2 Inkubator für 24 bis 72 h (Abbildung 1).
5. Vorbereitung des EG-Zellen für die ganze Zelle Elektrophysiologie
- Den Innendurchmesser des Mikroskoptisch mit zwei 5 x 0,5 cm Streifen aus Wachs Film erstelle ich einen o-Ring-Linie. Montieren Sie die 35-mm-Zelle Kulturschale innerhalb der o-Ring (Abb. 2A-B).
-
Spülen Sie beide Treibgut, wie ungebunden extrazelluläre Matrix oder abgestorbenen Zellen und Kulturmedien Serum vollständig vom EG Siegel Zellen entweder von Behinderung zu verhindern Bildung zwischen den EG-Zelle und Elektrode. Verwendung der drei folgenden Optionen, um zu erreichen, gründliche Zelle Waschen ausreichend für Elektrophysiologie:
- Option 1: Lösung Austausch ist effizienter als lange Kammer Kammer-um so mehr, als ein Rundschreiben. Da die EG-Zellen in Runde 35 mm Schalen kultiviert wurden, erstellen Sie eine elliptische Kunststoffeinsatz für das Gericht.
- Erstellen Sie die Einlage durch 3D-Druck oder traditionellen Fräsen Methoden. Die Einlage, die wir verwendet wurde gefräst aus Acryl mit folgenden Abmessungen (in mm): Außendurchmesser, 34,5; inneren Ellipse, 20 x 9; äußere Höhe, 10; Innenhöhe 1,5; Brücke Span, 3 x 3; Brücke-Clearance, 1,5; Einlass und Auslass, 4 x 4.
- Senken Sie die Einlage in der Kulturschale (Abbildung 2A-B) und sichern Sie ihn an die Spitze der Mikroskoptisch mit zwei 0,15 bis 0,2 g Stück Knetmasse in 1,2 x 0,3 x 0,1 cm Rechtecke (Abbildung 2A-C) gedrückt.
- Fügen Sie mit einer Pipette aus Kunststoff Übertragung langsam extrazelluläre Lösung zu einer Seite des Tellers (Eingang hinzu) beim Absaugen von der anderen Seite (Steckdose).
- Option 2: Ohne ein veränderter Kunststoffeinsatz fügen Sie extrazelluläre Lösung durch transferpipette von einer Seite des Tellers (Einlass hinzu) beim Absaugen von der gegenüberliegenden Seite (Steckdose). Drehen Sie langsam den Speicherort der transferpipette (z. B. N, E, S) und spiegeln die Platzierung der Aspiration-Nadel auf der gegenüberliegenden Seite (z. B. S, W, N).
- Option 3: Mantel extrazelluläre Matrix auf rechteckigen Deckgläsern in Schritt 1.3.3., und die Zellsuspension auf diese Deckgläsern in Schritt 4.4 Kultur. Übertragen Sie das Deckglas zu einer rechteckigen Kammer gefüllt mit extrazelluläre Lösung auslassen Schritt 5.1 und 5.3 Schritt überspringen. Spülen Sie die Kammer mit extrazelluläre Lösung aus Kunststoff transferpipette, wie in Option 1 (5.2.1.3) beschrieben.
- Option 1: Lösung Austausch ist effizienter als lange Kammer Kammer-um so mehr, als ein Rundschreiben. Da die EG-Zellen in Runde 35 mm Schalen kultiviert wurden, erstellen Sie eine elliptische Kunststoffeinsatz für das Gericht.
- Befestigen Sie wieder die Bühne mit der Zellkultur oberhalb der inversen Mikroskop (Abb. 2D). Inkubieren Sie die EG-Zellkultur in serumfreien extrazelluläre Lösung bei Raumtemperatur.
- Spülen Sie nach 4 Stunden die Kultur wieder mit extrazelluläre Lösung wie oben beschrieben. Fahren Sie mit der ganzen Zelle Elektrophysiologie.
6. ganze Zelle Elektrophysiologie der EC-Zellen aus Primärkultur
-
Erreichung einer ganzen Zelle Giga-Dichtung
- Ziehen Sie ein Dutzend Elektroden zu einem Widerstand von 1 – 5 MΩ.
Hinweise: Pipetten von 1 – 2 MΩ Widerstand, die 10-100 GΩ Dichtungen liefern am besten durchführen. Feuer der elektrodenspitzen Polieren ist nicht notwendig, GΩ Dichtungen zu erreichen. - Die bugnase alle Pipetten mit Polymer gleichmäßig zu beschichten. Halten Sie die Pipette Horizontal auf den Boden und senkrecht nach vorne von einer Heißluftpistole. Drehen Sie langsam die Pipette bis das Polymer härtet.
- Gießen Sie ein Aliquot des intrazellulären Lösung in eine 15 mL konische Rohr. Übertragen Sie 1,2 mL dieser Lösung zu einem 1,5 mL Microcentrifuge Schlauch über 1-mL-Spritze. Ziehen Sie ein weiteres 0,7 mL der intrazellulären Lösung in die Spritze. Luft aus dem Ende der Spritze zu zerstreuen. Befestigen Sie eine flexible 34 G, 67 mm Nadel der Spritze und spülen Sie alle verbleibenden Luft aus dieser Nadel.
- Identifizieren einer Tph1-GFP + Zelle, die nicht in Kontakt mit einer anderen Zelle oder Schutt.
- Füllen Sie die Elektrodenspitze mit intrazellulären Lösung. Abgleich der Pipette mittels Spritze. Streichen Sie sorgfältig die Pipette mit einem Fingernagel auf die Luftschnittstelle Blase zu zerstreuen.
- Anbringen Sie mit den Kolben mit 0,3 mL Luft erarbeitet eine 6 mL Spritze an den Auslass des Inhabers Schläuche. Montieren Sie die Elektrode in die Halterung.
Hinweis: Schließen Sie die Spritze den Schlauch vor die Elektrode die Bad-Lösung, um neutral oder positiv Druck innerhalb der intrazellulären Lösung vor dem versiegeln aufrecht zu erhalten. - Eine zweistufiger Voltage-Clamp-Protokoll, die zeichnet stationären aktivierende Strömungen durch eine Spannung Leiter auf der ersten Stufe und zeichnet die verfügbaren Ströme durch eine einzige Spannung auf den zweiten Schritt zu laden. Öffnen Sie die Robben-Test (5 mV bei 50 kHz).
- Senken Sie die Elektrode in die Bad-Lösung. Mit der Mikromanipulatoren Manövrieren der Elektrode Tipp in der Ebene mit und direkt horizontal aus der Zelle. Die 0,3 mL Luft aus der Spritze zu vertreiben.
- Sanft bewegen die Elektrode horizontal entlang der x-Achse, die Zelle zu berühren. Achten Sie auf ein Grübchen auf der EG-Zelle und/oder eine Erhöhung im Widerstand der Membran auf die Robben-Test angezeigt werden. Ggf. nachjustieren der elektrodendurchmessers nach unten entlang der z-Achse und/oder horizontal entlang der x-Achse, vorbei an der Mittellinie der Zelle nicht bewegt.
- Anwenden von 0,1-0,2 mL Saugleistung auf der 6-mL-Spritze. Halten Sie den Kolben stetig, bis 100 MΩ erreicht ist, dann lassen Sie Griff von den Kolben. Warten Sie, bis die Zelle auf Giga-Siegel. Trennen Sie vorsichtig die Spritze mit einer abschrauben Bewegung.
Hinweis: Wenn eine EG-Zelle zunächst nicht dicht, kann es mit einem anschließenden Versuch neu versiegeln möglich. Um dies zu tun, ziehen Sie die Elektrode von einem EG-Zelle mit < 20 MΩ Dichtung Widerstand. Lenkung der abgebrannten Elektrode mit der Mikromanipulatoren, umrunden Sie die gezielte EG Zelle manuell wegzuräumen Matrix oder Schutt. Versuchen Sie, die EG-Zelle mit einer frischen Elektrode zu versiegeln.
- Ziehen Sie ein Dutzend Elektroden zu einem Widerstand von 1 – 5 MΩ.
-
Rekord ganze Zelle Spannung-gated Na+ aktuelle.
- Befestigen Sie eine 3 mL Spritze mit 0.5-1.0 erstellt mL Luft. Einem schnellen Hahn saugen anzuwenden (0,1-0,5 mL) auf eine 3 mL Spritze. Wiederholen Sie, bis die ganze Zelle Zugang erreicht ist, dann trennen Sie vorsichtig die Spritze.
Hinweis: da die Leistung einer Spritze kann zunächst variieren und allmählich mit der Zeit und Einsatz, Praxis im Voraus mit der 3 mL Spritze (Abdichtung am Ende mit einem Zeigefinger) zu ändern, um sicherzustellen, dass der Kolben innerhalb von 0,1 – 0,2 Rückstoß wird mL seine Ausgangsposition position. Wenn dies nicht der Fall ist, dann die Spritze gegen eine neue austauschen. - Schalten Sie über die ganze Zelle Kapazität Entschädigung. Kapazität und Serie Widerstand einstellen. Schalten Sie Serie Widerstand Entschädigung. Passen Sie mit Verzögerung bei 60 ms eingestellt vorhergesagten dann korrigierte Reihe Widerstand Entschädigung. Schließen Sie die Robben-Test.
- Zeichnen Sie einen Durchschnitt von 5 läuft der ganze Zelle Spannung gated Na+ Strom(Abbildung 3).
- Beachten Sie schnell zwei Parameter der Voltage-gated Na+ Strom: die Spannung im aktuellen Fenster (Abbildung 3B, rote Symbole, im Schnittpunkt der Steady-State Aktivierung und Inaktivierung Kurven) und der Spitzenstrom Na+ Dichte.
Hinweis: EG-Zellen mit Na+ Spitzenströme mehr als-50 pA im Spannungsmodus Klemme allgemein weitergeht herausbekommene Potenziale im Strombetrieb Klemme ausgelöst. Darüber hinaus Ströme größer als-200 pA in Spannung Klemme(Abbildung 3)dann in der Regel Feuer Aktionspotentiale spontan in Stromzange Membran Potenziale (rote Linie, Abbildung 3D) in der Nähe der Spannung von der Fenster aktuelle (rote Symbole, Abbildung 3B).
- Befestigen Sie eine 3 mL Spritze mit 0.5-1.0 erstellt mL Luft. Einem schnellen Hahn saugen anzuwenden (0,1-0,5 mL) auf eine 3 mL Spritze. Wiederholen Sie, bis die ganze Zelle Zugang erreicht ist, dann trennen Sie vorsichtig die Spritze.
-
Rekord löste Aktionspotentiale.
- Schalten Sie die Reihe Widerstand Entschädigung. Schalten Sie den externen Befehl. Wechseln Sie den Modus von V-Clamp-Schelle. Passen Sie die Verstärkung. Laden Sie eine episodische aktuellen Klemme-Protokoll. Passen Sie die Höhe der Haltestrom auf 0 PA. Schalten Sie den externen Befehl.
Achtung: Schalten Sie nicht aus V-Clamp-Klemme (oder umgekehrt) ohne ersten Abschalten des externen Befehls. - Beachten Sie die Membran-Ruhepotential. Anpassen der Haltestrom Eingang, so dass das Potenzial der Membran unterhalb des aktuellen Fensters liest (z. B. -80 bis-100 mV). Einstellen Sie das episodische aktuelle Klemme Protokoll so, dass das Schrittintervall der Stromeingang ist kleiner als der Wert der Haltestrom (Abbildung 3C Einschub, + 2 pA Schritte für-3 pA Haltestrom).
- Rekord löste Aktionspotentiale. Beachten Sie die geringste Menge an Strom injiziert, um ein Aktionspotential abfeuern (Abbildung 3C, fegen 3 von 5, ein + 4 pA Schritt von-3 pA halten = + 1 pA).
- Schalten Sie die Reihe Widerstand Entschädigung. Schalten Sie den externen Befehl. Wechseln Sie den Modus von V-Clamp-Schelle. Passen Sie die Verstärkung. Laden Sie eine episodische aktuellen Klemme-Protokoll. Passen Sie die Höhe der Haltestrom auf 0 PA. Schalten Sie den externen Befehl.
-
Rekord spontan Aktionspotentiale.
- Schalten Sie den externen Befehl. Laden Sie eine spaltfreie (nicht episodisch) aktuelle Klemme Protokoll.
Hinweis: Schalten Sie nicht den externen Befehl zurück bis die Menge an Strom in das derzeitige spaltfreie Klammer-Protokoll hält überprüft worden ist, für die Zelle geeignet. - Ändern der Haltestrom um die Menge an Strom injiziert in die letzte Austragung in der Gender-Protokoll, das kein Aktionspotential ausgelöst werden (Abbildung 3D, die aktuelle Eingabe während des zweiten Sweeps, + 2 pA Schritt von-3 pA halten =-1 pA).
- Schalten Sie den externen Befehl. Überprüfen Sie bitte, dass die vorhergesagten Haltestrom bringt das Membranpotential unterhalb der Schwelle ein Aktionspotential ausgelöst. Nachstellen Sie der Haltestrom ggf.. Rekord spontane Aktivität.
- Schalten Sie den externen Befehl. Laden Sie eine spaltfreie (nicht episodisch) aktuelle Klemme Protokoll.
Ergebnisse
Kulturen:
Primären murine Epithelzellen gebildet aus einem transgenen Tph1-GFP-Modell beimessen Gerichte nach 4 Stunden und sind bereit für physiologische Experimente zwischen 24 bis 72 h. Wenn Kulturbedingungen nicht optimiert wurde, bestand die Epithelzelle Kultur große Horste, schwebenden zelltrümmer, beschädigte Membranen und GFP-schwach in den EG-Zellen (Abb. 1A). Kulturen, die für Elektrophysiologie optimiert wurden bestand aus einzelnen Zellen und kleine Klümpchen. Gesunde EG-Zellen wurden durch helle GFP Fluoreszenz leicht identifiziert und hatte noch das Gericht nach dem kräftigen waschen (Abbildung 1B) eingehalten werden.
Elektrophysiologie:
EG-ganze Zellen wurden auf nur 15 ±4 % der Versuche von Doppelpunkt Kulturen ohne ROCK-Inhibitor (29 ganze Zellen von 182 Versuche aus 22 Kulturen) aber 30 ±7 % der Versuche von Doppelpunkt Kulturen mit ROCK-Inhibitor (27 ganze Zellen aus 102 Versuche aus 50 Kulturen) erhalten (< C1 > Abbildung 4A; p < 0,05 durch eine nicht-parametrische zweiseitigen t-test, Doppelpunkt Kulturen ohne vs. mit ROCK-Hemmer). In ähnlicher Weise Jejunum EG Zellen ohne ROCK-Hemmer nicht lang genug für Elektrophysiologie überlebten, während EG wurden ganze Zellen auf 41 ±3 % der Versuche von Jejunum Kultur mit ROCK-Inhibitor (186 ganze Zellen von 447 Versuche aus 50 Kulturen) erhalten (Abbildung 4A; p > 0,05 durch eine nicht-parametrische zweiseitigen t-Test, Jejunum vs. Doppelpunkt mit ROCK-Hemmer).
Durch die ganze Zelle Elektrophysiologie verzeichneten Na+ Strömungen Voltage-Clamp-Modus und Aktionspotentiale (AP) im Strom-Clamp-Modus. Na+ Strömungen wurden aufgenommen von 81,3 % der ±4.0 des TPH1-GFP + Zellen aus Jejunum oder 64,1 % der ±9.2 von Colon3. 59 EG Zellen aus Jejunum Kulturen durch Spannung-Clamp Na+ Spitzenströme größer als-25 pA haben bestätigt 19 EG-Zellen im Strom-Clamp-Modus gebrannt spontane AP ("spontan"), 29 EG-Zellen feuerte AP nur dann, wenn durch ein Schritt-Protokoll im Strom-Zange ausgelöst Modus ("entlockte-only") und 11 EG-Zellen nicht Feuer AP spontan oder durch Schritt Protokoll ("non-Brand") (Abbildung 4B). Spontane Zellen hatten eine durchschnittliche Peak Na+ Stromdichte (IPEAK)-108.0 ±19.3 pA/pF, nur entlockte Zellen hatten ein IPEAK -60.2 ±9.2 pA/pF, während nicht feuern Zellen hatte ichPEAK -43.3 ±14 pA/pF (Abbildung 4 B; p < 0,05, spontane vs. nur ausgelöst oder nicht-schießen Gruppen; p > 0,05 nur entlockte vs. nicht-schießen Gruppen). Der Unterschied in der Stromdichten waren kein Spiegelbild der ganzen Zelle Kapazität, als spontane (3,3 ±0.2 pF), nur ausgelöst (2,9 ±0.2 pF) und nicht-schießen (3.1 ±0.3 pF) Zellen hatte ähnliche ganze Zelle Kapazitäten (P > 0.05). EG-Zelle Na+ Strömungen und provozierten AP waren empfindlich auf [Na+]o Konzentration und NaV1.3 Hemmung3.

Abbildung 1 : Repräsentative Auswahl an Kultur Ergebnisse. DIC mit Epifluoreszenz Bilder einer primären epithelialen Jejunum-Kultur von einer Tph1-GFP-Maus auf einer Glasschale unten verchromt und für 24 h kultiviert. Diese beiden Bilder zeigen eine Reihe von Kultur-Ergebnisse aus diesem Protokoll. Enterochromaffinen (EG) sind fluoreszierende Zellen GFP (weiß). (A) repräsentatives Bild aus einer Kultur, die schlechte Qualität für Elektrophysiologie ist. Die Kultur besteht aus großen Klumpen, beschädigte Zellmembranen, niedrige Fluoreszenzsignal und schwimmende Gruppen von abgestorbenen Zellen. (B) repräsentatives Bild aus einer Kultur, die für Elektrophysiologie optimiert wurde. Kultur besteht hauptsächlich aus einzelnen, gesunden Zellen und kleine Klumpen, die die Platte eingehalten haben. EC-Zellen in dieser Kultur pflegen eine starke Fluoreszenz-Signal. Maßstabsleiste = 100 µm; Panels sind skaliert 1:1. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Vorbereitung der Zelle Kulturen für Elektrophysiologie. Eine Strategie für eine effiziente und gründliche Spülung von EG-Zellkulturen mit serumfreien extrazelluläre Lösung ist entscheidend für die Reduzierung der extrazellulären Matrix und Serum, Dichtung Bildung behindern würde. (A) Materialien. Von oben links im Uhrzeigersinn: Bühne, zwei 5 mm breite Streifen aus Wachs Film, 200 mg zweiteilig modellieren, Ton, Kunststoff transferpipette, #5 Pinzetten, elliptische Aufnahme Kammer 35 mm Kultur Schale mit Glasboden. (B) haften Wachs Film dem Innendurchmesser der Bühne, senken die elliptische Kammer in der Kulturschale und glätten Sie den Ton in rechteckige Streifen. (C) sanft drücken der Kulturschale in Wachs Film gesäumten Bühne und die Aufnahme Kammer durch Dehnung der Modelliermasse über den Rand der Schale, aus dem Saal auf die Bühne zu immobilisieren. Spülen Sie EC-Zellen mit mehreren Bänden extrazelluläre Lösung. (D) Rückkehr der Bühne in die Halterungen oberhalb der inversen Mikroskop. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Repräsentative Elektrophysiologie Ergebnisse. (A) ganze Zelle Na+ Strömungen, aufgenommen durch ein zweistufiges Voltage-Clamp-Protokoll (Einschub). 50 ms Depolarizations von-120 mV aktivieren Kanäle bei Schritt 1 (●), während eine weitere Depolarisation auf 0 mV bei Schritt 2 (○) aktiviert Kanäle, die noch nicht deaktiviert hatte (d.h. zum Öffnen noch verfügbar sind). Rote Spur, hervorgerufen durch Spannung Strom Schritte von-120 bis-40 bis 0 mV. (B) Strom-Spannungs-Beziehung von Na+ Spitzenströme von Panel A, Schritt 1 (●, Steady-State Aktivierung) oder Schritt 2 (○, Steady-State Inaktivierung). Der Schnittpunkt der Steady-State Aktivierung und Inaktivierung Kurven zeigt ein kleines Fenster aktuelle bei-40 mV (rote Symbole). (C) Aktionspotentiale ausgelöst durch depolarisierende aktuelle Reize. Ein Aktionspotential kann Feuer vorbei 0 mV (graue Linie) erreicht das Membranpotential die Spannung des aktuellen Na+ Fenster (rote Linie,-40 mV). Inset, Strom-Clamp-Protokoll, in dem für 50 ms Depolarizations von einem Ausgangswert von-3 0 bis + 8 pA injiziert wurde PA. (D) Aktionspotentiale Feuer von oben auf spontane Ereignisse, die zu-40 depolarisiert haben mV. Bitte klicken Sie hier für eine größere Version dieser Figur.
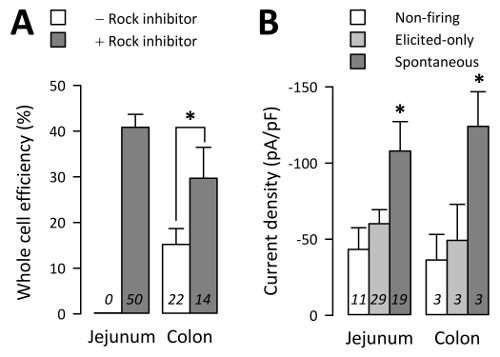
Abbildung 4 : Durchsatz der gesamten Zelle Elektrophysiologie. (A) durchschnittliche Prozentsatz ganzer Zellen pro Versuch für n Tage Arbeit in die (-) oder Abwesenheit (+) der ROCK-Inhibitor (10 µM). EC-Zellen aus Jejunum überlebten nicht 24 h in der Kultur ohne ROCK-Inhibitor. (B) Na+ Stromdichten in Voltage-Clamp aus n EG Zellen, in denen Aktionspotentiale nicht ausgelöst, (Non-Brand), gemessen ausgelöst, nur, wenn durch eine episodische Strom-Clamp-Protokoll ausgelöst (nur Elicited), oder spontan in spaltfreie Strom-Clamp-Modus (spontan) abgefeuert (Fehlerbalken sind SEM). Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
EG-Zell-Funktion vollständig zu verstehen erfordert eine qualitativ hochwertige Primärkultur Methode, Zellen für die ganze Zelle Elektrophysiologie zu generieren. Primärkulturen von GI Epithel hatte traditionell schwierig, da niedrige überleben. Linderung dieser verwirrende Faktor, ergibt das vorliegende Verfahren Kulturen der singulären EG Zellen entweder kleiner oder großer Darm, die für mehrere Tage überleben können.
Wir fanden, dass die folgenden kritischen zur Verbesserung der Qualität der Kulturen für Elektrophysiologie geeignet: (1) Umkehrung der Schleimhaut statt schälen, (2) Zugabe einer kleinen Menge der BSA an die Verdauung Medien und FBS, die Kultur, Medien, (3) Senkung der Kollagenase XI Konzentration, (4) einstellen der Dauer und Intensität der mechanische Agitation, die Zahl zu erhöhen und die Gesundheit der Einzelzellen, (5) Beschichtung der extrazellulären Matrix bei einer niedrigen Konzentration und (6) Kultivierung mit ROCK-Inhibitor.
Ebenso wurden folgenden Anpassungen für ganze Zellgewinnung während Patch Spannen von entscheidender Bedeutung: (1) gründlich spülen der Kulturen mit serumfreien extrazelluläre Lösung (2) lassen die EG Zellen stehen in der extrazellulären Lösung für mindestens 4 h (3). Alle Re-purposing verbrachte Elektroden-wie diejenigen von fehlerhaften Dichtungen-wegzuräumen Schutt auf dem Weg in die nächste Zelle EG, (4) hinzufügen 10 µM Gd3 + die extrazelluläre Lösung Leck Strömungen (falls vorhanden) blockieren und Einhaltung von Säugetierzellen zu erleichtern Suspensionen auf Glas. Wir warnen jedoch, dass Gd3 + Voltage-gated Ca2 + und/oder Mechanosensitive Kanäle in EG-Zellen exprimiert blockieren könnten.
Trotz sorgfältig optimiert die Kultivierung Bedingungen fanden wir ein paar Einschränkungen: EG-Zellen brauchen 24 h voll legen noch verfallen nach ~ 72 h in Kultur; Deshalb haben sie ein Zeitfenster von 48 Stunden, wenn sie für elektrophysiologische Experimente geeignet wären. Da aufgehäuften Zellen oft Kapazität Transienten einführen, die aus Aufnahmen ausgeglichen werden kann, Erzeugung von Einzelzellen EG sind entscheidend. Aber durch die Trennung zwischen EG-Zellen das Epithel, die Zellen dann Leben in einer fremden Umgebung (d.h., hohe Glukose Medien mit fötalen Rinderserum und ROCK-Inhibitor auf die extrazelluläre Matrix als eine künstliche Basalmembran) und reagieren könnten funktionieren Sie auf Reize nicht ganz repräsentativ für EG-Zelle in Vivo. Trotz dieser Einschränkungen bietet die primäre Kultivierung der EC-Zellen noch Einblick in ihre Physiologie.
EG-Zellen spielen eine entscheidende Rolle bei der Aufrechterhaltung einer gut funktionierenden GI-Trakt und Körper, und als solche wurden viele Methoden entwickelt, um ein Verständnis über EG Zelle Elektrophysiologie. Enteroendocrine und EG Zelle Elektrophysiologie wurde untersucht, in verewigt Zelle Modelle5,8,13, EG Zelle Primärkulturen von Meerschweinchen11und Maus3,4, unsere Methode verwendet Zelle Qualität Erhaltung Methoden, um eine Kultur zu schaffen, die minimal verarbeitet wurde und spiegelt die native EG-Zellen. Wir verwenden ein transgenen Mausmodell Tph1-GFP, das zeigt eine Cyan Fluoreszenz im Zytoplasma, wenn Tph1 vorhanden9ist. Diese Methode kann auch für andere Reporter oder Abstammung verfolgt Enteroendocrine Zellen-Typen verwendet werden. Unsere Methode führt auch die Isolation der einzelnen EG-Zellen in kürzester Zeit und enzymatischen Behandlung, da die Zellen nur eine sanfte Collagenase XI in einer minimalen, aber effektive Konzentration von 0,1 mg/mL (Jejunum) und 0,6 mg/mL (Doppelpunkt) weniger als eine Stunde lang ausgesetzt sind. Das Ergebnis dieser Änderungen ist eine Kultur, die für Elektrophysiologische Untersuchungen der EC-Zellen optimiert wurde.
Wir haben diese Methode erfolgreich verwendet, um die Elektrophysiologie und Serotonin Release im murinen EC Zellen3zu studieren. Die Fähigkeit, erfolgreich zu isolieren, zu identifizieren und Kultur Einzelzellen EG erleichtert die wichtige zukünftige Richtungen in Studien über EG Zellphysiologie. Diese Methode kann verwendet werden, um weitere kritische Wege bestimmen und Kanäle beteiligt EG Zelle Exozytose von Serotonin und andere EG-zellspezifische Sender. Die Methode könnte auch zu isolieren und zu charakterisieren die Physiologie der menschlichen Zelle EG zusammen mit der Verwendung von Acridin Orange für EC Zelle Identifikation13geändert werden.
Wie bei den meisten wissenschaftlichen Protokollentwicklung waren Kommunikations- und unvoreingenommene Beobachtungen kritisch bei der Problembehandlung dieses Protokolls. Wenn wir neue Kulturmethoden für das Überleben unserer Kulturen getestet, war es hilfreich, die Anzahl der fluoreszierenden Zellen als Maß für die Rentabilität, Zelldichten in jedem Gericht und repräsentative Bilder und Videos von den Kulturen zu sammeln, über die viele Zeit zu schätzen Punkte. Nachdem die Zellen über 24 h in Kultur überleben konnten, arbeiteten wir an unserer Kulturen für Elektrophysiologie Experimente zu ändern. Zusammen mit Bildern und genauen Beobachtungen zu sammeln, war es wichtig, klaren Kommunikation zwischen Laborpersonal über Anpassungen an mechanische Verdauung und Ergänzung bzw. Substrat-Konzentrationen zu erhalten, so dass Krebszellen EG bereit waren für elektrophysiologische Charakterisierung.
Offenlegungen
Keine
Danksagungen
Die Autoren danken Frau Lyndsay Busby für Amtshilfe und Herr Robert Highet von Mayo Clinic Division of Engineering bei Design und 3D Druck des Kultur-Gericht-Einsatzes. Diese Arbeit wurde von NIH K08 AB (DK106456), Pilot und Machbarkeit Grant an AB von Mayo Clinic Center für Zelle signalisieren in Gastroenterologie (NIH P30DK084567) und 2015 amerikanischen gastroenterologischen Association Research Scholar Award (AGA RSA) AB und NIH unterstützt. R01, GF (DK52766).
Materialien
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm culture dish | Corning (Falcon) | 351029 | |
| Transfer Pipette | Fisherbrand | 13-711-7M | |
| 10 mL serological pipette | Corning (Falcon) | 357551 | |
| 50 mL Conical | Corning (Falcon) | 352098 | |
| 15 mL Conical | Corning (Falcon) | 352097 | |
| 1,000 mL Barrier Pipet Tips | Thermo Scientific (Art) | 2079E | Keep sterile |
| MatTek Glass Bottom Dishes | MatTek Corporation | P35G-1.5-14-C | Keep sterile |
| Micro-dissection Forceps - Very Fine, Extra-Long Points | Fine Science Tools | SB12630M | |
| Surgical Scissors-Sharp | Nasco | 14002-14 | |
| Micro-Dissection Scissors | Nasco | SB46568M | |
| Monoject Hypo Needle, 21 G x 1" A, 100/BX | Covidien | 8881250172 | |
| Tg(Tph1-CFP)1Able/J Mice | Jackson | Stock # 028366 | Use male or female mice between the ages of 4-7 weeks |
| Microfil nonmetallic syringe needles (34 gauge, 67 mm) | World Precision Instruments | MF34G-5 | |
| Parafilm "M" Laboratory Film | Pechiney Plastic Packaging | ||
| R6101 | Dow Corning | ||
| 6 mL syringe with regular luer tip | Monoject | ||
| 3 mL syringe with regular luer tip | Monoject | ||
| Electrophysiology Equipment | |||
| Amplifier | Molecular Devices | Axopatch 200B | |
| Data acquisition system (daq) | Molecular Devices | Digidata 1440A | |
| Signal conditioner | Molecular Devices | CyberAmp 320 | |
| Software | Molecular Devices | pClamp 10.6 |
Referenzen
- Rindi, G., Leiter, A. B., Kopin, A. S., Bordi, C., Solcia, E. The "normal" endocrine cell of the gut: changing concepts and new evidences. Annals of the New York Academy of Sciences. 1014, 1-12 (2004).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. The Journal of Physiology. 589, 1081-1093 (2011).
- Strege, P. R., et al. Sodium channel NaV1.3 is important for enterochromaffin cell excitability and serotonin release. Scientific Reports. 7 (15650), (2017).
- Bellono, N. W., et al. Enterochromaffin cells are gut chemosensors that couple to sensory neural pathways. Cell. 170 (1), 185-198 (2017).
- Alcaino, C., Knutson, K., Gottlieb, P. A., Farrugia, G., Beyder, A. Mechanosensitive ion channel Piezo2 is inhibited by D-GsMTx4. Channels. 11 (3), 245-253 (2017).
- Kim, M., Javed, N. H., Yu, J. G., Christofi, F., Cooke, H. J. Mechanical stimulation activates Galphaq signaling pathways and 5-hydroxytryptamine release from human carcinoid BON cells. Journal of Clinical Investigation. 108 (7), 1051-1059 (2001).
- Modlin, I. M., Kidd, M., Pfragner, R., Eick, G. N., Champaneria, M. C. The functional characterization of normal and neoplastic human enterochromaffin cells. The Journal of Clinical Endocrinology and Metabolism. 91 (6), 2340-2348 (2006).
- Wang, F., et al. Mechanosensitive ion channel Piezo2 is important for enterochromaffin cell response to mechanical forces. The Journal of Physiology. 595 (1), 79-91 (2017).
- Li, H. J., et al. Distinct cellular origins for serotonin-expressing and enterochromaffin-like cells in the gastric corpus. Gastroenterology. 146 (3), 754-764 (2014).
- Psichas, A., Tolhurst, G., Brighton, C. A., Gribble, F. M., Reimann, F. Mixed primary cultures of murine small intestine intended for the study of gut hormone secretion and live cell imaging of enteroendocrine cells. Journal of Visualized Experiments. (122), 55687 (2017).
- Raghupathi, R., et al. Identification of unique release kinetics of serotonin from guinea-pig and human enterochromaffin cells. The Journal of Physiology. 591, 5959-5975 (2013).
- Nozawa, K., et al. TRPA1 regulates gastrointestinal motility through serotonin release from enterochromaffin cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3408-3413 (2009).
- Reimann, F., et al. Characterization and functional role of voltage gated cation conductances in the glucagon-like peptide-1 secreting GLUTag cell line. The Journal of Physiology. 563, 161-175 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten