Method Article
Eletrofisiologia celular de células enterocromafins murino culta primário
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Células enterocromafins (CE) compõem um pequeno subconjunto de células epiteliais gastrointestinais. Células de CE são eletricamente excitáveis e liberam serotonina, ainda dificuldades no cultivo e identificação de células CE limitados estudos fisiológicos. O método apresentado aqui estabelece um modelo de cultura primária favorável ao exame de células únicas CE por eletrofisiologia.
Resumo
Células enterocromafins (CE) no epitélio gastrointestinal (GI) constituem a maior subpopulação de células enteroendócrina. Como células sensoriais especializadas, CE células sentem estímulos luminal e convertê-los em eventos de liberação de serotonina (5-hyroxytryptamine, 5-HT). No entanto, a eletrofisiologia destas células é mal compreendida porque eles são difíceis para cultura e identificar. O método apresentado em culturas de células de CE primário este papel contornos otimizado para eletrofisiologia única célula. Este protocolo utiliza um repórter de proteína fluorescente ciano transgénicos (PCP) para identificar células de CE rato em culturas primárias mistas, avançando a abordagem para obtenção de gravações de alta qualidade de eletrofisiologia da célula inteira em modos de grampo de tensão e de corrente.
Introdução
Epitélio gastrointestinal (GI) é uma comunidade diversificada, consistindo de vários tipos de células. Células enteroendócrina compreendem aproximadamente 1% de todas as células epiteliais e células enterocromafins (CE) são a maior população do enteroendócrina célula1. Estudos recentes mostram que enteroendócrina2 e4 células de3,CE são eletricamente excitáveis. Estamos interessados em compreender a eletrofisiologia de célula primária CE. Assim, o objetivo deste estudo foi estabelecer culturas primárias de células CE otimizadas para eletrofisiologia da célula inteira.
Célula de CE existente linhas que produzem e secretam 5-HT (por exemplo, QGP-15, BON6, KRJ-17) e têm sido usadas para examinar a eletrofisiologia5,8 normalmente geradas a partir de imortalizado tumorais. tecidos. Enquanto as informações adquiridas destas linhas de célula são valioso5,8, estudos de eletrofisiologia da célula primária são necessários compreender corretamente a fisiologia celular de CE. A eletrofisiologia das células primárias do CE requer o isolamento e a cultura de células epiteliais única, que tem sido limitada pela baixa viabilidade das culturas epiteliais.
O método de cultura apresentado neste estudo se baseia em ratos transgénicos com células fluorescente etiquetadas do CE, como Tph1-PCP9, utilizado neste estudo. O método otimiza primária mista epiteliais culturas anteriormente desenvolveram2,10 para única célula eletrofisiologia3. Métodos anteriores combinações de tripsina/EDTA além de A colagenase ou de EDTA e de TDT para digestão enzimática e costumavam especificamente isolar e cultura cobaia11 e rato CE células12gradientes de densidade. Mais recentemente, organoids intestinais foram gerados e mecanicamente interrompidos para gravações eletrofisiológicos4. Culturas usando estes métodos são adequadas para serotonina liberar experimentos, análise de RT-qPCR e, enquanto eles poderiam ser usados para eletrofisiologia, são dependente do sucesso da geração de organoides demorado, gradientes de densidade para identificar células da CE e o celulares efeitos pertubadores da tripsina e EDTA. Por outro lado, o protocolo descrito aqui melhora a tratamentos mecânicos e enzimáticos, otimiza as condições de cultivo e simplifica procedimentos para produzir células única e saudáveis de CE apropriadas para os altos padrões celulares necessários para eletrofisiologia.
Este método será útil para os cientistas que querem trabalhar em células primárias de CE em culturas mistas, em vez de culturas imortalizadas e deseja investigar a eletrofisiologia das células únicas. No entanto, pode ser menos apropriado para o estudo de populações de células que necessitam de classificação ou a longo prazo as culturas que exigem sobrevivência passado 72 h.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo cuidado institucional do Animal e Comissão de utilização (IACUC) da clínica Mayo. A parte de cultura de célula primária do presente protocolo é baseada em métodos anteriormente publicados que podem ser referenciados por mais detalhes10. Todos os procedimentos experimentais devem ser aprovados pela (IACUC), e todos os experimentos devem ser realizados em conformidade com os regulamentos e orientações pertinentes.
1. cultura preparação
-
Meios de comunicação.
- Preparar meios de cultura CE celular completo com a glicose alta médio de Eagle modificado [4500mg/L] Dulbecco (DMEM) suplementado com 5% soro Fetal bovino (FBS), 1% L-glutamina e 1% penicilina-estreptomicina (tabela 1).
Nota: A mídia pode ser armazenada a 4 ° C por até um mês. - Os meios de cultura do CE célula completo do filtro e colocar 25 mL de mídia em um tubo de 50ml a 37 ° C.
- Preparar a mídia de digestão com glicose alta [4.500 mg/L] DMEM suplementado com 0,1% albumina de soro bovino (BSA) (tabela 1).
- Os digestão meios de filtro e coloque quatro alíquotas de 10 mL de mídia para tubos de 50ml separado e incubar em banho maria a 37 ° C.
Nota: A mídia pode ser armazenada a 4 ° C por até um mês.
- Preparar meios de cultura CE celular completo com a glicose alta médio de Eagle modificado [4500mg/L] Dulbecco (DMEM) suplementado com 5% soro Fetal bovino (FBS), 1% L-glutamina e 1% penicilina-estreptomicina (tabela 1).
-
Enzima.
- Pese 4 mg (para o jejuno) ou 24mg (para cólon) de colagenase XI [≥800 unidades/mg] em um tubo de microcentrifugadora de 1,5 mL.
Nota: Colagenase é estável a-20 ° C por até um ano. - Ressuspender o colagenase alíquota em 1 mL de PBS frio do gelo com Ca2 + e Mg2 +. Vórtice a solução completamente combinar, e colocar no gelo.
- Pese 4 mg (para o jejuno) ou 24mg (para cólon) de colagenase XI [≥800 unidades/mg] em um tubo de microcentrifugadora de 1,5 mL.
-
Placas de cultura de revestimento.
- Descongele a 150 µ l de matriz extracelular durante a noite a 4 ˚ c no gelo.
- Fazer uma solução de matriz extracelular 5% w/v misturando-se 100 µ l de matriz extracelular descongelada com 2 mL de DMEM de alta-glicose livre de soro gelado.
Nota: Matriz extracelular se solidifica à temperatura ambiente e deve ser manipulada com pre-refrigeradas pipetas, tubos e mídia até estar pronto para pratos de casaco. - Cubra imediatamente o círculo interno de vidro de pratos de vidro-fundo 35 mm com 250 µ l da solução de matriz extracelular de 5%. Esta receita irá cobrir até 8 pratos.
- Coloque os pratos de vidro-fundo numa incubadora 37 ° C durante as etapas de isolamento de cultura de células restantes. A matriz extracelular leva no mínimo 1 h para definir, mas pode ser incubadas por até 2,5 h durante a execução de outras medidas de isolamento.
Nota: Incubação do mais do que 3 h pode criar um acúmulo de matriz extracelular que poderia impedir a sela formação durante a eletrofisiologia da célula inteira.
2. tecido isolamento
- De acordo com as diretrizes éticas, sacrificar um 3Para 6 semanas de idade macho ou fêmea Tph1-PCP transgénicos rato (o estoque de laboratório Jackson: 028366)9 ou outra estirpe de repórter.
Nota: Nós usamos uma dose fatal de aumento dos níveis de dióxido de carbono e um deslocamento cervical como um secundário significa assegurar a morte. A Comissão AVAM eutanásia também considera deslocamento cervical um método de eutanásia primário permissível por indivíduos treinados em seu uso, se os animais são primeiro sedados. - Pin o mouse euthanized fora num palco de dissecação de espuma de poliestireno usando agulhas G 21. Descontaminar o abdômen de rato com etanol a 70%.
- Puxar a pele do rato esticada usando fórceps micro-dissecção (#5) e em seguida, use tesouras cirúrgicas afiadas tornar-se uma incisão transversa na parte inferior do abdome para expor a cavidade intraperitoneal do mouse. Fazer outra incisão verticalmente acima do abdômen até a caixa torácica é exposta.
- Use a pinça de micro-dissecção para mover o ceco à esquerda do mouse para alcançar uma visão clara do cólon.
- Use a tesoura de micro-dissecção cortar a porção mais distal do cólon (mas ainda proximal do reto) e fazer um segundo corte distal ao estômago. Lugar dos intestinos extraídos em um 100 x 15 mm2 placa de Petri preenchidos com 20 mL de fosfato gelado tampão salino (PBS).
- Use uma pequena régua para medir e cortar 10 cm de qualquer meados do cólon ou do jejuno. Extraia o cólon medindo fora do segmento de 10 cm do intestino localizado proximalmente no primeiro corte tomadas acima do reto. Identifica o jejuno dobrando o intestino inteiro ao meio e fazer uma primeira incisão na metade e uma segunda incisão de 10 cm proximal ao primeiro corte.
Nota: Continue a executar todas as etapas de isolamento subsequentes no gelo. - Encher uma seringa 6 mL com PBS frio gelo e coloque a agulha da seringa no lúmen do segmento intestinal extraído. Use a pinça de micro-dissecção para fixar e selar os intestinos ao redor da agulha da seringa e lave delicadamente 10 mL de PBS através do lúmen para enxaguar fora matéria fecal.
- Inverta o tecido intestinal suavemente a pinça de micro-dissecção através do lúmen de tecelagem, beliscar uma parede intestinal, e retraindo o tecido proximal à ponta da pinça. Repita este processo até que o segmento é de dentro para fora com o lúmen virada para fora.
- Use micro-dissecção tesoura para cortar o segmento de tecido em pedaços de 1 cm.
- Uso de fórceps de micro-dissecção para transferir os segmentos de tecido em um copo de 50 mL cheio com 5 mL PBS estéril. Use a tesoura de micro-dissecção para picar os pedaços de tecido para uma consistência liquefeito.
- Coloque o tecido picado e 15 mL de PBS frio gelo em um tubo limpo 50 mL com uma pipeta de transferência. Triture 2 vezes com a pipeta de transferência, aguardar o tecido resolver, 15 mL do sobrenadante PBS de remover e substituir com PBS fresco. Repita este processo 3 vezes até o PBS é claro.
- Coloque o tubo de 50 mL com pedaços de tecido lavado no gelo e trazer o balde de gelo em uma capa de cultura de tecidos.
3. enzimática e mecânica da digestão
-
Primeira digestão
- Do banho de água, recupere um dos tubos de 50 mL contendo 10 mL de mídia digestão previamente aquecido. Para o tubo de 50 mL, adicione 250 µ l da solução de PBS colagenase e pedaços de tecido intestinal picada.
Nota: tenha cuidado para evitar incluindo qualquer PBS de etapas de lavagem anterior. - Coloque o tubo de 50 mL em um banho de água por 5 minutos (cólon ou jejuno) a 37 ° C. Agitar o tubo 2 x por minuto.
Nota: O tempo ideal e na intensidade da digestão mecânica podem variar e precisarão ser determinado pelo usuário. Para determinar as condições ideais de digestão, uma alíquota de 10 µ l de células pode ser vista após cada digestão. Durante a digestão 1, o sobrenadante deve consistir de aglomerados de células. - Lentamente, Triture o tecido uma vez com uma pipeta sorológica 10ml. Brevemente deixa o tecido peças resolver e, em seguida, usar uma pipeta de transferência para remover o inteiro 10 mL do sobrenadante.
- Do banho de água, recupere um dos tubos de 50 mL contendo 10 mL de mídia digestão previamente aquecido. Para o tubo de 50 mL, adicione 250 µ l da solução de PBS colagenase e pedaços de tecido intestinal picada.
- Segundo a digestão: Repita as etapas 3.1.1 a 3.1.3. Aumentar o tempo de incubação de 10 min se digerindo o cólon e manter o tempo de incubação em 5 min para o jejuno.
Nota: Após a observação, o sobrenadante deve ainda consistem em grandes aglomerações de células. -
Digestão de terceiro
- Repita a etapa 3.1.1
- Coloque o tubo de 50 mL em um banho de água de 37 ˚ c por 10 min (dois-pontos ou pequeno jejuno). Agite o tubo 2-3x / min em uma intensidade mais elevada do que digestões 1 e 2.
- Pipete lentamente o tecido acima e para baixo com uma pipeta de 10 mL serológica. Permitir que as peças de tecido que se contentar em um curto espaço de tempo.
Nota: O sobrenadante deve consistir de uma combinação de células individuais e pequenos grupos. - Use uma pipeta de transferência para colocar 10 mL do sobrenadante para um novo tubo de 15 mL, adicionar 2 mL de aquecido CE célula completa cultura mídia e inverter uma vez para misturar.
- Girar a 100 x g durante 5 min à temperatura ambiente e, em seguida, usar uma pipeta de transferência para remover o sobrenadante. Use uma pipeta de transferência para Ressuspender o restante em 2,5 mL de aquecido CE célula completo meios de cultura.
- Quarta digestão: Repita os passos 3.3.1 para 3.3.5. Aumentar o tempo de incubação de 15 min para cólon e permanecem em 10 min para o jejuno.
Nota: O sobrenadante agora deve consistir de células únicas.
4. cultura de células
- Use uma pipeta de transferência para combinar as suspensões de células coletadas de digestões 3 e 4 para um novo tubo de 15 mL (volume total de 5 mL).
- Retire uma alíquota de 10 µ l de células de contar com um hemocytometer e girar a suspensão de células restantes 100 x g durante 5 min à temperatura ambiente.
Nota: A suspensão de célula final consistirá em pequenos grupos e células únicas. - Remover o sobrenadante com uma pipeta de transferência e resuspenda o pellet em CE célula completo meios de cultura em uma densidade de 1.000.000 células / mL.
Nota: O volume final de suspensão celular dependerá a contagem final de célula. Célula típica conta variam de 2.000.000 até 4.000.000. - Pratos de vidro revestido-fundo cultura remova a incubadora. Use uma pipeta P1000 para substituir a matriz extracelular de cada prato de cultura com 250 µ l de suspensão de final de célula.
Nota: Revestimento de matriz extracelular tende a ficar com as bordas do prato fundo de vidro. Deve ter especial cuidado para remover o revestimento ao longo da borda para evitar o acúmulo de gel. - Fazer uma solução stock de inibidor ROCK Y-27632 em 1 mM. Adicione 2,5 µ l da solução estoque para cada prato fundo de vidro para conseguir uma trabalho de concentração de inibidor ROCK 10 µM em cada prato.
Nota: Este passo é fundamental para a sobrevivência das culturas de jejuno mas é opcional para o cólon. - Coloque cada prato de cultura numa incubadora de2 CO 37 ° C e 5% por 24 a 72 h (Figura 1).
5. preparação de células de CE para eletrofisiologia celular
- Linha do diâmetro interno da fase de microscópio com duas tiras de 5 x 0,5 cm de filme de cera para criar um-Ring. Monte o prato de cultura celular de 35 mm dentro do anel-o (Figura 2A-B).
-
Enxágue ambos os detritos flutuantes, tais como matriz extracelular desanexada ou células mortas e soro de meios de cultura completamente longe de CE células para evitar ou de impedir Selem formação entre a célula de CE e eletrodo. Uso das seguintes três opções para atingir a célula completa lavagem suficiente para eletrofisiologia:
- Opção 1: Troca de solução é mais eficiente em uma câmara muito mais assim do que uma circular de câmara. Uma vez que as células de CE foram cultivadas em pratos redondos 35mm, crie uma inserção plástica elíptica para o prato.
- Crie a inserção por impressão 3D ou por métodos de moagem tradicional. A inserção que usamos foi moída de plástico acrílico com as seguintes dimensões (em mm): diâmetro exterior, 34,5; elipse interna, 20 x 9; Altura externa, 10; altura interior, 1.5; extensão da ponte, 3 x 3; apuramento de ponte, 1.5; entrada e saída, 4 x 4.
- Baixe a inserção dentro do prato de cultura (Figura 2A-B) e fixá-lo ao topo da fase de microscópio com dois pedaços de 0,15 a 0,2 g de modelagem barro prensado em 1,2 x 0,3 x 0,1 retângulos cm (Figura 2A-C).
- Com uma pipeta de transferência plástica, adicione lentamente solução extracelular para o lado do prato (entrada) durante a aspiração do outro lado (tomada).
- Opção 2: Sem uma inserção plástica projetada, adicione solução extracelular com uma pipeta de transferência de um lado do prato (entrada) durante a aspiração do lado oposto (saída). Lentamente gire o local da pipeta de transferência (por exemplo, N e s) enquanto a colocação da agulha do lado oposto (por exemplo, S w a N) aspiração de espelhamento.
- Opção 3: Matriz extracelular casaco em lamelas retangulares na etapa 1.3.3. e a suspensão de eritrócitos nestas lamelas na etapa 4.4 de cultura. Transferi esta lamela para uma câmara retangular cheia de solução extracelular, omitindo passo 5.1 e pular a etapa 5.3. Lave a câmara com solução extracelular de uma pipeta de transferência plástica, conforme descrito na opção 1 (5.2.1.3).
- Opção 1: Troca de solução é mais eficiente em uma câmara muito mais assim do que uma circular de câmara. Uma vez que as células de CE foram cultivadas em pratos redondos 35mm, crie uma inserção plástica elíptica para o prato.
- Re-anexe o palco com a cultura de pilha acima o microscópio invertido (Figura 2D). Incube a cultura de célula CE na solução extracelular isento de soro à temperatura ambiente.
- Após 4 horas, enxágue a cultura novamente com a solução extracelular como descrito acima. Prossiga com a eletrofisiologia da célula inteira.
6. toda célula eletrofisiologia de CE células de cultura primária
-
Alcançar um célula inteira Giga-selo
- Puxe uma dúzia de eletrodos para uma resistência de 1 – 5 MΩ.
Notas: Pipetas de resistência de 1 – 2 MΩ que rendem 10-100 GΩ selos executam melhor. Polimento das pontas de eletrodo de fogo não é necessário para alcançar GΩ selos. - Revesti uniformente o cone de nariz de todas as pipetas com polímero. Mantenha a pipeta horizontal ao chão e perpendicular à frente de um injetor de calor. Gire lentamente a pipeta até o polímero endurece.
- Despeje um tubo cônico de 15 mL uma alíquota da solução intracelular. Transferência 1,2 mL desta solução num tubo 1,5 mL microcentrifuga via seringa de 1 mL. Retire outra 0,7 mL de solução intracelular para a seringa. Dissipe o ar da extremidade da seringa. Anexar um flexível 34g, agulha de 67mm para a seringa e expulsar todo o ar restante esta agulha.
- Identificar um Tph1-PCP + célula que não está em contacto com qualquer outra célula ou detritos.
- Encha a ponta do eletrodo com solução intracelular. Aterramento da pipeta por seringa. Cuidadosamente agite a pipeta com uma unha para dissipar a interface de bolha de ar.
- Com o êmbolo elaborado com 0,3 mL de ar, prenda uma seringa 6 mL para a saída do titular da tubulação. Monte o eletrodo no suporte.
Nota: Conecte a seringa para o tubo antes do eletrodo entra a solução de banho para manter a pressão neutra ou positiva dentro da solução intracelular antes da selagem. - Carrega um protocolo de tensão-braçadeira de duas etapas que registra o estado estacionário ativando correntes por uma escada de tensão no primeiro degrau e registra as correntes disponíveis por uma única tensão na segunda etapa. Abra o teste do selo (5 mV a 50 kHz).
- Baixe o eléctrodo da solução do banho. Com os Micromanipuladores, manobre o eletrodo ponta no plano com e diretamente na horizontal da célula. Expulse os 0,3 mL de ar da seringa.
- Mova o eletrodo horizontalmente ao longo do eixo x para tocar o celular. Relógio para uma covinha aparecer na célula CE e/ou um aumento na resistência de membrana no teste de vedação. Se necessário, reajuste o eletrodo para baixo ao longo do eixo z e/ou horizontalmente ao longo do eixo x, não passando da linha mediana da célula.
- Aplicar 0,1-0,2 sucção mL na seringa 6 mL. Segurem o êmbolo até 100 MΩ é alcançado e, em seguida, liberar a aderência do êmbolo. Espere que a célula de giga-seal. Delicadamente, desconecte a seringa com um movimento desenroscando.
Nota: Se uma célula de CE não foca inicialmente, é possível re-selá-lo com uma tentativa subsequente. Para fazer isso, puxe cuidadosamente o eletrodo longe de uma célula de CE com < 20 resistência de selo MΩ. Direção do eléctrodo gasto com os Micromanipuladores, circunavegar a célula alvo CE matriz manualmente remover ou detritos. Em seguida, tente selar a célula CE com um eletrodo de fresco.
- Puxe uma dúzia de eletrodos para uma resistência de 1 – 5 MΩ.
-
Registro celular dependente de voltagem at+ atual.
- Anexar uma seringa de 3 mL, elaborada com 0,5 m a 1,0 ar mL. Aplicar um toque rápido de sucção (0.1-0.5 mL) em uma seringa de 3 mL. Repetir até é atingido o acesso de toda célula e, em seguida, delicadamente, desconecte a seringa.
Nota: como o desempenho de uma seringa pode variar inicialmente e mudar gradualmente com o tempo e uso, prática previamente com a seringa de 3 mL (vedação final com um dedo indicador) para garantir que o êmbolo vai recolhimento dentro de 0,1-0,2 mL de sua partida de posição. Se não, então, trocar a seringa por uma nova. - Vire na compensação de capacitância de célula inteira. Ajuste a resistência série e capacitância. Vire na compensação de resistência de série. Com atraso de 60 ms, ajuste compensação de resistência série previsto então corrigido. Feche o teste de vedação.
- Grave uma média de 5 corridas de corrente de at+ de voltagem-dependente célula inteira(Figura 3).
- Rapidamente, tome nota dos dois parâmetros de corrente de at+ de voltagem-dependentes: a tensão na janela atual (Figura 3B, símbolos vermelhos, a interseção das curvas de ativação e inativação de estado estacionário) e a corrente de pico Na+ densidade.
Nota: CE as células com correntes de pico at+ mais do que o pA-50, na modalidade de braçadeira da tensão comumente vai continuar a disparar eliciadas potenciais no atual modo de braçadeira. Além disso, correntes superiores a pA-200 no grampo de tensão(Figura 3), em seguida, geralmente fogo potenciais de ação espontaneamente na braçadeira atual de potenciais de membrana (linha vermelha, Figura 3D) perto da tensão do janela atual (símbolos vermelhos, Figura 3B).
- Anexar uma seringa de 3 mL, elaborada com 0,5 m a 1,0 ar mL. Aplicar um toque rápido de sucção (0.1-0.5 mL) em uma seringa de 3 mL. Repetir até é atingido o acesso de toda célula e, em seguida, delicadamente, desconecte a seringa.
-
Registro suscitou potenciais de ação.
- Desative a compensação de resistência de série. Desative o comando externo. Alterne para o modo de V-braçadeira para-braçadeira. Ajuste o ganho. Carrega um protocolo atual episódica do grampo. Ajustar a quantidade de exploração atual a 0 PA. Ative o comando externo.
Atenção: Não ligue de V-braçadeira para-braçadeira (ou vice-versa) sem primeiro desligar o comando externo. - Observe o potencial de membrana de repouso. Ajustar a exploração atual de entrada para que o potencial de membrana lê abaixo da janela atual (por exemplo, -80 a -100 mV). Ajuste o protocolo atual episódica do grampo para que o intervalo do passo de entrada atual é menor que o valor da exploração atual (Figura 3C baixo-relevo, + 2 etapas de pA para pA-3 segurando atual).
- Registro suscitou potenciais de ação. Observe a menor quantidade de corrente injetado para disparar um potencial de ação (Figura 3C, varrer 3 dos 5, um passo de + 4 pA do pA-3 segurando = pA + 1).
- Desative a compensação de resistência de série. Desative o comando externo. Alterne para o modo de V-braçadeira para-braçadeira. Ajuste o ganho. Carrega um protocolo atual episódica do grampo. Ajustar a quantidade de exploração atual a 0 PA. Ative o comando externo.
-
Recorde os potenciais de ação espontâneos.
- Desative o comando externo. Carrega um protocolo atual lacuna livre (não-episódico) do grampo.
Nota: Não ligue o comando externo até que a quantidade de segurando corrente no protocolo atual sem lacunas braçadeira foi verificada para ser apropriado para a célula. - Mudar a exploração atual ser a quantidade de corrente injetado na última varredura no protocolo eliciada que não disparou um potencial de ação (Figura 3D, a intensidade absorvida durante a segunda varredura, um passo de + 2 pA do pA-3 segurando = pA-1).
- Ative o comando externo. Verifique que a exploração prevista atual traz a membrana potencial abaixo do limiar para disparar um potencial de ação. Se necessário, reajustar a exploração atual. Registro atividade espontânea.
- Desative o comando externo. Carrega um protocolo atual lacuna livre (não-episódico) do grampo.
Resultados
Culturas:
Primárias células epiteliais murino, feitas a partir de um modelo de Tph1-PCP transgénico anexar aos pratos após 4 horas e estão prontas para experiências fisiológicas entre 24 a 72 h. Quando as condições de cultura não tinham sido otimizadas, a cultura de pilha epithelial consistia de grandes aglomerações, flutuante restos celulares, membranas danificadas e sinal fraco do PCP nas células CE (Figura 1A). Culturas que foram otimizadas para eletrofisiologia consistiam em células individuais e pequenos grupos. Células saudáveis do CE foram prontamente identificadas por fluorescência de PCP e ainda tinham aderido ao prato após a lavagem vigorosa (Figura 1B).
Eletrofisiologia:
Células toda CE foram obtidas em apenas 15 ± 4% das tentativas de culturas de cólon sem inibidor ROCK (29 células toda fora 182 tentativas de 22 culturas), mas 30% de ±7 de tentativas de culturas de cólon com inibidor ROCK (27 células toda fora 102 tentativas de 50 culturas) (< C1 > Figura 4A; p < 0.05 por um não-paramétricos bicaudal t-teste, culturas de cólon sem vs com inibidor ROCK). Da mesma forma, jejuno CE células sem inibidor ROCK não sobreviveu tempo suficiente para eletrofisiologia, enquanto CE células toda foram obtidas em 41 ± 3% das tentativas de cultura de jejuno com inibidor ROCK (186 células toda fora 447 tentativas de 50 culturas) (Figura 4; p > 0,05 por um não-paramétricos bicaudal t-teste, jejuno vs cólon com inibidor ROCK).
Por eletrofisiologia da célula inteira, correntes at+ foram gravadas em modo de tensão-braçadeira e potenciais de ação (AP) em modo de corrente-braçadeira. Correntes de at+ foram gravadas de 81,3% de ±4.0 de TPH1-PCP + células de jejuno ou 64,1% de ±9.2 de cólon3. De 59 CE as células provenientes de culturas de jejuno, confirmadas pela tensão-braçadeira ter correntes de pico at+ maiores do que o pA-25, 19 células CE no modo corrente-braçadeira despedida espontânea AP ("espontânea"), 29 células CE demitido AP somente quando provocada por um protocolo de etapa no corrente-braçadeira modo ("suscitou somente") e 11 células CE não fogo AP espontaneamente ou pelo etapa protocolo ("não queima") (Figura 4B). Células espontâneas tinham uma pico médio at+ densidade de corrente (Ipico) de-108.0 ±19.3 pA/pF, suscitou somente células teve umpico de-60.2 ±9.2 pA/pF, enquanto as células não-acionamento tivesse umpico de-43.3 ±14 pA/pF (Figura 4 B; p < 0.05, espontânea vs suscitou somente ou não acionamento do grupos; p > 0,05 suscitou somente vs não-acionamento grupos). A diferença em densidades de corrente não fosse um reflexo da capacidade de toda célula, como o espontâneo (3,3 ± 0,2 pF), suscitou somente (2,9 ± 0,2 pF) e não-acionamento (3,1 ± 0,3 pF) células tinham todo similar Interelectrode de pilha (P > 0,05). Correntes de at+ de célula CE e AP eliciada eram sensíveis à concentração deó [Na+] e NaV1.3 inibição3.

Figura 1 : Gama representativa dos resultados de cultura. DIC com epifluorescência imagens de uma cultura de jejuno epitelial primária de um rato Tph1-PCP banhado em um prato fundo de vidro e cultivadas por 24 h. Estas duas imagens demonstram uma variedade de resultados de cultura do presente protocolo. PCP de células fluorescente (branca) é células enterocromafins (CE). (A) imagem representativa de uma cultura que é de má qualidade para eletrofisiologia. A cultura consiste em grandes grupos, as membranas das células danificadas, sinal de baixa fluorescência e flutuante grupos de células mortas. (B) imagem representativa de uma cultura que foi otimizada para eletrofisiologia. Cultura consiste principalmente em células simples, saudáveis e pequenos aglomerados que tenham aderido à placa. Células de CE nesta cultura mantenham um sinal forte fluorescência. Barra de escala = 100 µm; os painéis são escala 1:1. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Preparação da célula culturas para eletrofisiologia. Uma estratégia eficiente e completa a lavagem das culturas de células CE com solução extracelular isento de soro é fundamental para a redução da matriz extracelular e soro, cuja divulgação possa impedir a formação de selo. (A) materiais. No sentido horário, do topo à esquerda: palco, duas tiras de 5 mm largura do filme de cera, dois pedaços de 200 mg de modelagem argila pipeta de transferência plástica, fórceps #5, câmara de gravação elíptico, cultura de 35 mm prato com fundo de vidro. (B) aderir a película de cera para o diâmetro interno do palco, abaixe a câmara elíptica para o prato de cultura e achatar a argila em tiras retangulares. (C) delicadamente pressione a placa de cultura para a fase de película-revestidas de cera e imobilizar a câmara de gravação, estendendo-se a argila de modelagem sobre a borda do prato, da câmara para o palco. Enxague as células CE com vários volumes de solução extracelular. (D) retorno do palco para os suportes de montagem acima o microscópio invertido. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Resultados representativos de eletrofisiologia. (A) célula inteira at+ as correntes, gravadas por um protocolo de tensão-braçadeira em duas fases (Inserir). 50 ms depolarizations de -120 mV ativar canais durante a etapa 1 (●), enquanto uma despolarização mais a 0 mV durante a etapa 2 (○) ativa canais que ainda não tinham sido inativado (ou seja, estão ainda disponíveis para abrir). Traço vermelho, provocada pela tensão de corrente passos de -120 de -40 a 0 mV. Relação de corrente-tensão (B) das correntes de pico at+ do painel A, etapa 1 (●, ativação de estado estacionário) ou etapa 2 (○, inativação de estado estacionário). A interseção das curvas de ativação e inativação do estado estacionário revela uma pequena janela atual em -40 mV (símbolos vermelhos). (C) os potenciais de ação eliciados despolarizantes estímulos atuais. Um potencial de ação pode demitir passado 0 mV (linha cinza) quando o potencial de membrana atinge a tensão de janela at+ atual (linha vermelha, -40 mV). Baixo-relevo, corrente-braçadeira de protocolo, no qual 0 PA + 8 foi injetado para 50-ms depolarizations de uma linha de base de -3 PA. Potenciais de ação (D) fogo de em cima de eventos espontâneos que têm despolarizada a -40 mV. Clique aqui para ver uma versão maior desta figura.
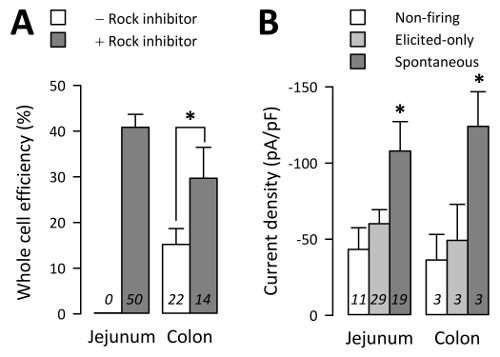
Figura 4 : Taxa de transferência de eletrofisiologia celular. (A) percentagem média de células toda por tentativa de n dias de trabalho na ausência (-) ou presença (+) de inibidor ROCK (10 µM). Células de CE de jejuno não sobreviveu 24h em cultura sem inibidor ROCK. (B) at+ densidades de corrente medidas em tensão-braçadeira de células de CE n , em que potenciais de ação não disparou (Non-fogo), acionado somente quando provocada por um protocolo de corrente-braçadeira episódico (somente Elicited), ou despediu-se espontaneamente em modo de corrente-braçadeira sem lacunas (espontânea) (barras de erro são SEM). Clique aqui para ver uma versão maior desta figura.
Discussão
Compreender plenamente a função de célula CE requer um método de cultura primária de alta qualidade para gerar células para eletrofisiologia da célula inteira. Culturas primárias de epitélio GI tinham sido tradicionalmente difícil devido a baixa sobrevivência. Atenuar este fator de confundimento, o presente método produz culturas de células de CE singular do intestino pequeno ou grande que são capazes de sobreviver por vários dias.
Nós achamos que encontravam-se crítico para melhorar a qualidade das culturas para ser apropriado para eletrofisiologia: (1) invertendo a mucosa ao invés de descascá-la, (2) adicionando uma pequena quantidade de BSA para a mídia de digestão e FBS para os meios de cultura, (3) reduzir a Concentração de colagenase XI, (4) ajuste a duração e a intensidade de agitação mecânica para aumentar o número e a saúde das células únicas, (5) chapeamento da matriz extracelular em baixa concentração e (6) cultivo com inibidor ROCK.
Da mesma forma, as seguintes adaptações foram fundamentais para a obtenção de células toda enquanto remendo de aperto: (1) completamente enxaguando as culturas com solução extracelular isento de soro, (2) deixar o CE células ficar na solução extracelular pelo menos 4 h, (3). redirecionamento qualquer gasto eletrodos, como aqueles de focas falhadas-para limpar os detritos no caminho para a próxima célula de CE, (4) adicionando 10 µM Gd3 + para a solução extracelular para bloquear as correntes de fuga (se presente) e para facilitar a aderência de células de mamíferos suspensões de vidro. Alertamos, no entanto, que Gd3 + poderia bloquear dependente de voltagem Ca2 + e/ou mechanosensitive canais expressados nas células de CE.
Apesar de ter cuidadosamente otimizada para as condições de cultivo, encontramos algumas limitações: CE células precisam de 24h para totalmente anexar ainda expiram após ~ 72 h na cultura; Portanto, eles têm uma janela de 48 horas, quando eles seriam adequados para experimentos eletrofisiológicos. Porque células agrupadas frequentemente introduzirem transientes da capacidade que não podem ser compensados de gravações, a geração de células únicas CE são críticos. No entanto, por separar CE células do epitélio, as células então vivem em um ambiente de não-nativos (isto é, meios de glicose alta com soro fetal bovino e inibidor de rocha no topo da matriz extracelular como uma membrana basal artificial) e podem responder a estímulos não inteiramente representante da célula CE funcionar na vivo. Apesar dessas limitações, a cultura primária de células CE ainda fornece insights sobre sua fisiologia.
CE células desempenham um papel fundamental na manutenção de um bom funcionamento do trato GI e corpo e como tal, há muitos métodos desenvolvidos para obter uma compreensão sobre eletrofisiologia celular de CE. Enteroendócrina e CE eletrofisiologia celular foi investigada em célula imortalizado modelos5,8,13, culturas de células primárias CE de cobaia11e rato3,4, nosso método utiliza métodos de preservação da qualidade de célula para criar uma cultura que tenha sido minimamente processada e reflete as células CE nativas. Nós usamos um modelo do rato transgénico, Tph1-PCP, que mostra uma fluorescência ciana no citoplasma, quando Tph1 estiver presente9. Esse método também pode ser usado para outro repórter ou tipos de células enteroendócrina tracejamento de linhagem. Nosso método também realiza o isolamento de células únicas CE no menor tempo possível e tratamento enzimático, como as células apenas estão expostas a um gentil XI de colagenase em uma concentração mínima, mas eficaz de 0,1 mg/mL (jejuno) e 0,6 mg/mL (dois pontos) para menos de uma hora. O resultado destas modificações é uma cultura que foi otimizada para Estudos eletrofisiológicos das células CE.
Com sucesso usamos este método para estudar a liberação de eletrofisiologia e serotonina murino CE células3. Identificar a capacidade de isolar com êxito, e células de CE cultura única facilita a direções futuras importantes em estudos sobre a fisiologia celular de CE. Esse método pode ser usado para determinar mais caminhos críticos e canais envolveram na exocitose de célula CE de serotonina e outro CE transmissores de célula específica. O método também pode ser modificado para isolar e caracterizar a fisiologia da célula humana CE, juntamente com o uso de laranja de acridina para CE celular identificação13.
Como com desenvolvimento de protocolo mais científico, comunicação e imparciais observações foram fundamentais para a solução de problemas do presente protocolo. Quando testamos novos métodos de cultura para a sobrevivência de nossas culturas, foi útil para contar o número de células fluorescentes como uma medida de viabilidade, estimativa de densidades de célula em cada prato e coletar representante fotos e vídeos das culturas ao longo do tempo muitos pontos. Depois que as células foram capazes de sobreviver por 24 h na cultura, trabalhamos sobre a modificação de nossas culturas para experimentos de eletrofisiologia. Juntamente com a coleta de imagens e observações detalhadas, era importante manter uma comunicação clara entre o pessoal de laboratório sobre ajustes de digestão mecânica e suplemento e/ou concentrações de substrato, para que as células saudáveis do CE estavam prontas para a caracterização eletrofisiológica.
Divulgações
Nenhum
Agradecimentos
Os autores Obrigado Sra. Lyndsay Busby para assistência administrativa e Sr. Robert Highet da Mayo Clinic divisão de engenharia para design e impressão 3D da inserção da cultura de prato. Este trabalho foi financiado pelo NIH K08 AB (DK106456), piloto e subvenção de viabilidade para AB da Mayo Clinic Center para sinalização celular em Gastroenterologia (NIH P30DK084567) e 2015 gastroenterológica Association Research Scholar Award da American (AGA RSA) para AB e NIH R01 para GF (DK52766).
Materiais
| Name | Company | Catalog Number | Comments |
| 100 mm x 15 mm culture dish | Corning (Falcon) | 351029 | |
| Transfer Pipette | Fisherbrand | 13-711-7M | |
| 10 mL serological pipette | Corning (Falcon) | 357551 | |
| 50 mL Conical | Corning (Falcon) | 352098 | |
| 15 mL Conical | Corning (Falcon) | 352097 | |
| 1,000 mL Barrier Pipet Tips | Thermo Scientific (Art) | 2079E | Keep sterile |
| MatTek Glass Bottom Dishes | MatTek Corporation | P35G-1.5-14-C | Keep sterile |
| Micro-dissection Forceps - Very Fine, Extra-Long Points | Fine Science Tools | SB12630M | |
| Surgical Scissors-Sharp | Nasco | 14002-14 | |
| Micro-Dissection Scissors | Nasco | SB46568M | |
| Monoject Hypo Needle, 21 G x 1" A, 100/BX | Covidien | 8881250172 | |
| Tg(Tph1-CFP)1Able/J Mice | Jackson | Stock # 028366 | Use male or female mice between the ages of 4-7 weeks |
| Microfil nonmetallic syringe needles (34 gauge, 67 mm) | World Precision Instruments | MF34G-5 | |
| Parafilm "M" Laboratory Film | Pechiney Plastic Packaging | ||
| R6101 | Dow Corning | ||
| 6 mL syringe with regular luer tip | Monoject | ||
| 3 mL syringe with regular luer tip | Monoject | ||
| Electrophysiology Equipment | |||
| Amplifier | Molecular Devices | Axopatch 200B | |
| Data acquisition system (daq) | Molecular Devices | Digidata 1440A | |
| Signal conditioner | Molecular Devices | CyberAmp 320 | |
| Software | Molecular Devices | pClamp 10.6 |
Referências
- Rindi, G., Leiter, A. B., Kopin, A. S., Bordi, C., Solcia, E. The "normal" endocrine cell of the gut: changing concepts and new evidences. Annals of the New York Academy of Sciences. 1014, 1-12 (2004).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. The Journal of Physiology. 589, 1081-1093 (2011).
- Strege, P. R., et al. Sodium channel NaV1.3 is important for enterochromaffin cell excitability and serotonin release. Scientific Reports. 7 (15650), (2017).
- Bellono, N. W., et al. Enterochromaffin cells are gut chemosensors that couple to sensory neural pathways. Cell. 170 (1), 185-198 (2017).
- Alcaino, C., Knutson, K., Gottlieb, P. A., Farrugia, G., Beyder, A. Mechanosensitive ion channel Piezo2 is inhibited by D-GsMTx4. Channels. 11 (3), 245-253 (2017).
- Kim, M., Javed, N. H., Yu, J. G., Christofi, F., Cooke, H. J. Mechanical stimulation activates Galphaq signaling pathways and 5-hydroxytryptamine release from human carcinoid BON cells. Journal of Clinical Investigation. 108 (7), 1051-1059 (2001).
- Modlin, I. M., Kidd, M., Pfragner, R., Eick, G. N., Champaneria, M. C. The functional characterization of normal and neoplastic human enterochromaffin cells. The Journal of Clinical Endocrinology and Metabolism. 91 (6), 2340-2348 (2006).
- Wang, F., et al. Mechanosensitive ion channel Piezo2 is important for enterochromaffin cell response to mechanical forces. The Journal of Physiology. 595 (1), 79-91 (2017).
- Li, H. J., et al. Distinct cellular origins for serotonin-expressing and enterochromaffin-like cells in the gastric corpus. Gastroenterology. 146 (3), 754-764 (2014).
- Psichas, A., Tolhurst, G., Brighton, C. A., Gribble, F. M., Reimann, F. Mixed primary cultures of murine small intestine intended for the study of gut hormone secretion and live cell imaging of enteroendocrine cells. Journal of Visualized Experiments. (122), 55687 (2017).
- Raghupathi, R., et al. Identification of unique release kinetics of serotonin from guinea-pig and human enterochromaffin cells. The Journal of Physiology. 591, 5959-5975 (2013).
- Nozawa, K., et al. TRPA1 regulates gastrointestinal motility through serotonin release from enterochromaffin cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3408-3413 (2009).
- Reimann, F., et al. Characterization and functional role of voltage gated cation conductances in the glucagon-like peptide-1 secreting GLUTag cell line. The Journal of Physiology. 563, 161-175 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados