Method Article
Проверка ячейки механики с шарик бесплатно Оптический пинцет в зародыша дрозофилы
В этой статье
Резюме
Мы представляем установки Оптический пинцет, в сочетании с микроскопом света лист и ее осуществление зонда клеток механика без бисера в зародыша дрозофилы .
Аннотация
Морфогенез требует координации между генетическими кучность и механических сил надежно формировать клеток и тканей. Таким образом чтобы понять морфогенетических процессов задача непосредственно измерить сотовой сил и механических свойств в vivo во время эмбриогенеза. Здесь мы представляем установки Оптический пинцет, в сочетании с микроскопом света лист, который позволяет непосредственно применять силы на ячейке контактов раннего зародыша дрозофилы , хотя изображений со скоростью несколько кадров в секунду. Этот метод имеет то преимущество, что она не требует инъекции бусины в эмбрион, обычно используются как промежуточные зондов, на которые оказывается оптической силы. Мы подробно, шаг за шагом, осуществление установки и предложить инструменты для извлечения механических информации из экспериментов. Путем мониторинга перемещения ячеек контактов в режиме реального времени, можно выполнить измерения напряженности и исследовать ячейку контакты реологии.
Введение
Эмбриональное развитие является весьма воспроизводимый процесс, во время которой клетки и ткани деформировать формировать будущее животного. Показано, что таких деформаций, требуют активного поколения сил на уровне ячейки уровня1,2. Чтобы понять морфогенетических процессов, во время которых клетки и ткани изменить их форму, это поэтому ключ для оценки механических свойств клеток, участвующих и для измерения силы внутри ткани во время процесса3,4 . Эпителиального слоя, особенно у дрозофилы, были широко изучены вследствие их квази 2D геометрии и их легко манипулировать.
Ряд методов были разработаны таким образом, нас и другие оценки эпителиальных механики в vivo во время разработки. Мы дадим краткий обзор трех основных методов, используемых в эпителиальных тканях. Лазерная абляция, широко используемый метод, позволяет выявить местные механических напряжений в ячейку развязок5,6,,78 или в более крупных масштабах9,10,11 , выполняя местных сокращений, которые нарушают механическую целостность целевого объекта. Динамика открытия после разреза предоставляет информацию как на абляции предварительного напряжения, так и на реологические свойства ткани12,13. Недостатком лазерной абляции является, что это инвазивными, как это требует местной нарушение клетки коры. Следовательно один можно выполнять только ограниченное количество аблаций если один хочет, чтобы сохранить целостность ткани. Еще одним недостатком является аблаций только обеспечить относительной оценки напряженности в ячейку контакты, так как скорость открытия зависит вязкого трения, которые как правило не известна. Магнитные манипуляции также разработана и используется в дрозофилы, с участием либо использование магнитных жидкостей14 или15ultramagnetic липосом. Они могут обеспечить абсолютные измерения16,17, но также инвазивные в том смысле, что они требуют введения зонды в нужное место. Это может быть очень сложно, в зависимости от системы, которая не всегда поддаются точной инъекции. Третий метод, полностью неинвазивным,-силы вывод18,19,20. Вывод сил основывается на предположении о механических равновесия в три раза больше очков (tricellular развязок, или вершин) и позволяет вывести напряженности на всех ячеек контактов (и, возможно, давление во всех клетках), решения обратной задачи. Для напряженности каждая вершина предоставляет два уравнения (X и Y). Это дает большой системы линейных уравнений, которые могут быть инвертированы при некоторых условиях оценить напряжение на всех клеток контактов. Хотя этот метод является очень привлекательным, поскольку он требует только сегментирована изображения и без дополнительных эксперимент или установки, ее точность еще определить, и снова он предоставляет только относительные значения, если измерение абсолютной калибровки.
Чтобы преодолеть некоторые из этих ограничений, мы представляем в этой статье установки Оптический пинцет в сочетании с микроскопом света лист применять контролируемых силами в масштабе ячеек в эпителии эмбриональных Drosophila melanogaster. Оптический пинцет были использованы для многочисленных биологических приложений, включая измерения на одном белков и манипуляции органеллы и клетки21. Здесь, мы приводим прикладной силы в диапазоне от нескольких десятков pN, который является небольшим еще достаточно, чтобы побудить местные деформации клетки контактов и выполнить механические измерения в естественных условиях. Как правило мы используем перпендикулярно прогиб клеток контактов, через анализ kymographs, контроль за относиться силы к деформации. Важно отметить, что наши установки не требует инъекции бусы на нужное место в ткани, как Оптический пинцет способны непосредственно оказывают силы на ячейке контактов. Муфта Оптический пинцет для Микроскоп свет листа позволяет выполнять быстрое изображений (несколько кадров в секунду), который является очень заметны для механического анализа на короткое время весы и с сокращением Фототоксичность, поскольку освещение Образец является ограниченной плоскости изображения22.
В целом, оптические пинцеты являются неинвазивный способ применить контролируемых силами в ячейку контакты in vivo в зародыша дрозофилы и для извлечения механических информации например, жесткость и напряженности в ячейку контакты23, реологические свойства 24и градиент или анизотропии напряженности23.
протокол
1. Создание Микроскоп свет лист
- Обратитесь к описанию установки в предыдущей публикации25.
Примечание: Установка состоит из вертикально микроскопа и легкие лист модуль производит легкие лист в горизонтальной плоскости. 10 X возбуждения объектива направляет свет лист Кювета стеклянная (рис. 4). Обнаружение объектив имеет высокий NA (1.1), которая необходима для эффективного бровей (см. ниже).
2. Настройка пути Оптический пинцет
Примечание: На рисунке 1 дает общая схема оптические установки.
- Поместите блок лазера 1070 Нм и исправить волокна на таблицы оптики с V-образный зажим горе. Убедитесь, что волокна коллиматор параллельно таблицы оптики (следовательно, горизонтальные) и что высота выбранного здесь будет высоту для всех оптических компонентов выровнены на таблицы оптики.
Примечание: 100 мм может быть хорошим выбором для этой высоты. - Поверните ключ инфракрасный лазерный блок и нажмите кнопку «Выбрать» для включения выравнивания указателя. Свет должен быть горизонтальной исходящие волокна.
- Установите затвор в оптического пути и исправить его в таблице оптических, так что инфракрасный лазерный луч проходит через отверстие затвора. Убедитесь, что расстояние между таблицы оптики и центр отверстие затвора — высота, выбранный на шаге 2.1.
- Поверните ключ затвора контроллера, выберите ручной режим с помощью стрелок и нажмите кнопку «Включить», чтобы открыть затвор.
- Место, выравнивания и исправить первое зеркало гальванометра.
Примечание: Два зеркала гальванометра должны конъюгированных задней диафрагмы обнаружения цели, так что когда одно из зеркал вращается, лазерный луч не выходят обратно диафрагмы цели. Обратите внимание, что расстояние между первым гальванометра и обратно цели должен рассчитываться для оценки позиции этой гальванометра связи с целью (f1 f1 + f2 + f2 + f3 + f3 + f4 + f4 = 30 + 30 + 30 + 30 + 30 + 200 + 200 + 500 + 500 = 1550 мм; fi = Фокусное расстояние объектива n ° я). - Включите блок питания гальванометра. Убедитесь, что Гальванометры питание для остальной части протокола выравнивание.
- Гальванометры присвоено нулевое отклонение (NIMAX или Оптический пинцет программного обеспечения - см. шаг 3 для гальванометра соединений).
- Место, выравнивания и исправления реле телескоп состоит из двух линз с фокусным расстоянием 30 мм.
- Место, выравнивания и исправления второй зеркальный гальванометр. Обратите внимание, что расстояние между двумя Гальванометры 4f = 4 x 30 мм = 120 мм (f = фокусного расстояния).
- Место и исправить телескоп.
Примечание: Телескоп состоит из двух линз, которые расширяют луча шириной по крайней мере равным диаметру задней диафрагмы объектива. Объектив с фокусным расстоянием наименьший должен прийти первым. - Место, выравнивания и исправления перископ, принося вверх оптического пути ближе к входу железнодорожных дихроичное зеркало.
- Исправить горячей зеркало в железнодорожном, рельс в Микроскоп. Убедитесь, что железнодорожные пилится на правой стороне, чтобы разрешить вход инфракрасного лазера (рис. 2).
- Проверьте, что лазерный луч выходит из микроскопом, сначала без цели, а затем с целью. Правильное положение лазера до цели с нижней зеркального перископа. Правильное положение лазерного после цели с верхней зеркального перископа.
- Положите 1 мкл 500 Нм флуоресцентные бусины в Кювета стеклянная и добавьте 10 мл дистиллированной воды. Поместите кювету под цели в держатель кювет и настроить фокус цели (Z положение), так что цель касается поверхности воды.
- Начните приобретение домашнее программное обеспечение, управление AOTF, камеры и пьезоэлектрические стадии. Свободное программное обеспечение таких как micromanager может также использоваться. Включите режим живой приобретения, нажав кнопки «Live».
- Отрегулируйте мощность лазера ИК 1 Вт.
-
Надеть очки (и не удаляйте его до конца эксперимента) и включите лазер. Шарик следует захваченных на лазерный фокус.
- Если не шарик в ловушке на лазерный фокус, проверьте, если красный лазерная указка (которая коллинеарных с ИК лазер) выходит из цели. Если нет, снова начать выравнивание шаги, в частности шаг 2.13. Или увеличить мощность лазера ИК.
- Если шарик в ловушке из фокуса (из плоскости изображения), осторожно переместить позицию последнего линзы последнего телескоп (L4 на рис. 1) вдоль оптической оси принести шарик в фокусе с плоскостью изображения. Если не достаточно, шаг первый объектив последнего телескоп (L3 на рис. 1) вдоль оптической оси.
- Если не захваченных шарик центрируется в изображении, используйте зеркала 2 Перископ регулировать положение ловушку. Если позиция шарик изменяется, изменив угол первого зеркала, также компенсировать направление пучка, изменив соответствующий угол второго зеркала. Правильное положение X только (1 винт для каждого зеркала), а затем исправить положение по оси Y (1 винт для каждого зеркала).
- При необходимости отрегулируйте положение объектива телескопа 2nd соблюдать шарик в фокусе.
- При необходимости, отрегулируйте угол зеркала Перископ иметь шарик по центру изображения.
3. взаимодействие инструмент
Примечание: На рисунке 3 дает общая схема подключения национальных Instruments (NI) карты.
- Вставьте карту вывода (NI-9263) в первом слоте шасси (cDAQ-9178). Обратите внимание, что могут использоваться другие модели NI карт с по крайней мере 2 аналоговых выходов и 3 аналоговых входов.
- Вставьте карту ввода (NI-9215) во второй слот шасси.
- Подключите первый гальванометра аналоговый выход AO0 и аналоговый входной AI0 с BNC кабелей. Обратите внимание, что T адаптер может использоваться для подключения 2 BNC кабелей к одному. Обратитесь к руководству гальванометра локализовать контактов на плате драйвера гальванометра.
- В то же время Подключите второй гальванометра AO1 и AI1.
- Подключите PFI1 к спусковой крючок затвора (задней контроллер).
- Подключите PFI0 в огонь камеры и AI2.
- Соединить AI3 триггер из затвора (задней контроллер).
- Настройте параметры контроллера затвора. Используйте стрелки, чтобы изменить значения параметров и нажмите кнопку «Выбрать», чтобы подтвердить выбор и перейти к следующему параметру. Поставьте параметр «время открытой sec» до 000.000, «время закрыты sec» до 000.000, «режим» сингл и «триггер» доб. разрешить управления затвора, нажав на кнопку «Включить».
- Открыть QtCreator (скачать с https://www.qt.io/, Бесплатная версия).
Примечание: QtCreator является интегрированной среды разработки, используемый для разработки на C++ Оптический пинцет программного обеспечения. Библиотека Qt используется здесь для создания виджетов. - Откройте файл OT.pro (предоставляется в файлах кода Qt). Это действие откроет проект. Изменить имя ввода и вывода в файле AOGenerator.cpp по карте (картам) NI используется.
- Скомпилируйте и запустите программное обеспечение OT.
4. Калибровка позиции оптические ловушки с бисером
-
Запись фильма калибровки
- Положите 1 мкл 500 нм красный флуоресцентные бусины в Кювета стеклянная, а затем заполнить кювета с 10 мл дистиллированной воды. Рисунок 4 дает представление о кювета в контексте наблюдения.
- Исправьте кювет на пьезоэлектрический сцене.
- Отрегулируйте положение Z кювета, так что цель обнаружения опускается в воду.
- Включите инфракрасный лазер и установить мощность 1 Вт.
- Включите программное обеспечение приобретения изображений.
- Чтобы получить изображения промежуток времени, выберите время экспозиции, усиление, время между двумя изображениями, количество изображений, которые должны быть приобретены и мощность лазера. Обратите внимание, что для калибровки Оптический пинцет с бисером, освещение лазерные (561 Нм) не требуется. Эффект 2-фотон, вызванного инфракрасный лазерный достаточно, чтобы возбудить флуоресцирование захваченных шарик.
- Запустите программу домашний Оптический пинцет.
- Установите оптический пинцет параметры трассировки круг. Задать SamplingRate, как 250 samp/s, bufferSize как 1000, Waveform1 параметры (гальво 1) как синусоидальная, nbPeriod 1, амплитуда 0,5 V, этап 0.0 rad, 0.0 V, параметры сигнала 2 (гальво 2) синусоидальная, nbPeriod 1, амплитуда 0,5 V, фаза 1,57 rad, смещение 0.0 V.
- Проверьте поле «AI параметров» и «Ожидание для его для»... поле.
- Начало захвата изображений (500 или 1000 изображений с высокой частота, например 10 fps).
- Переключение на Оптический пинцет, нажав на кнопку «Генерирующая!».
- Разрешить захваченных шарик, чтобы завершить по крайней мере два полного круга и остановить Оптический пинцет по ООН неотложных «генерирующая!» кнопку.
- Остановка загрузки изображений. Обратите внимание, что фильм tiff и текстовый файл с гальванометра напряжений создаются по умолчанию «C:/TEMP /» папку (если не указано пользовательское местоположение). Обратите внимание, что несколько калибровки фильмы с файлами данных могут быть созданы, если необходимо.
- Если кружок не является полным, шарик теряется во время круга траектории. Может быть скорость слишком высока. Уменьшите его, уменьшив частоту выборки в OT программного обеспечения. Или, используя красный лазерный указатель инфракрасного лазера, проверьте, если лазер выходит из цели в течение всего круга траектории. Если нет, то гальванометра зеркала не может быть проспряганное с обратно фокальной плоскости объектива. Исправьте позиции Гальванометры обратно фокальной плоскости цели, начиная снова шаги выравнивание с шагом 2.5.
- Амплитуд равным нулю и включите лазер поймать шарик в исправить положение. Место ориентир на месте ловушку.
-
Интерполяция позиции с анализа изображений
- Откройте Matlab, перейдите к папке, калибровки и запустите сценарий «position2tension» (представлена в файлах кода Matlab). Этот сценарий вычисляет интерполяции функция перевода гальванометра напряжений оптические ловушки позиции.
- Выберите количество калибровочных фильмов будет использоваться. Несколько фильмов может быть выбран с разные траектории, например два перпендикулярных эллипса. Как правило одна калибровка фильм с круговой траектории достаточно.
- Предоставить первый и последний образ чисел в диалоговом окне (одно диалоговое окно за фильм), последовательности с четкой траектории и хорошее соотношение сигнал-шум.
- Предоставить путь текстового файла, содержащего напряжения во время приобретения для каждого фильма. Обратите внимание, что сценарий читает файл и вычисляет среднее напряжение двух Гальванометры для каждого изображения.
- Предоставить путь соответствующей калибровки фильма.
Примечание: Скрипт обнаруживает шарик для каждого кадра с субпиксельной резолюции путем установки 2D Гаусса для шарика, с помощью пользовательских функций и функций, извлеченные из МТТ26. Он содержит график, отображающий траектории шарика. - Исключите любой плохо обнаруженной точке (выбросы), щелкнув его.
- Проверка если интерполяции карта для x и лазерной позиции y вычисляется и отображается сценарий, полным. Если есть много недостающих значений (белый регионов в карте), повторите операцию с новой калибровки фильм, с лучшее соотношение сигнал-шум, или / и с более низкой скоростью Гальванометры.
Примечание: Эти образы и интерполяции значений автоматически сохраняются в той же папке, что и изображение с именем convertFct.mat.
5. Монтаж дрозофилы эмбрионов27
- Собирать дрозофилы эмбрионов из клетки, инкубировали при 25 ° C.
- Удаление дрожжи, передавая содержимое плита через сито (размер пор должно быть около 100 мкм).
- Вымойте эмбрионов с хлоркой (2,6% гипохлорита натрия) 100% для 45 s для удаления хориона.
- Вымойте эмбрионов с водой на 2 мин.
- Положите эмбрионы на площадку агар с помощью кисти.
- Выберите около 10 эмбрионов в зависимости от желаемого этапа и выровняйте эмбрионов с щука или влажной кистью.
Примечание: Выравнивания должно быть сделано в зависимости от региона интерес (регион интерес как можно ближе к цели обнаружения). - С помощью пера алмаз маркировка, вырежьте кусок стекла слайд из 10 x 20 x 1 мм3.
- Добавить клей на одной стороне отрезанный кусок и дайте ему высохнуть на 20 s.
- Переверните отрезанный кусок и поместите его на линии эмбрионов, придерживаться его на краю слайда.
- Установить этот препарат в держателе образца и поместите его в кювет. Рисунок 4 дает представление о кювета в контексте наблюдения.
- Положите кювет на пьезоэлектрический сцене.
6. перехват эксперимент в естественных условиях
-
Треппинг клетки контактов — колебания (рис. 5)
- Найти местоположение интерес в ткани.
Примечание: Использование мухи, в которые помечены cadherins может быть полезно, если необходимо работать в плоскости adherens стыков. - Переместить середину перекрестка целевой позиции ловушки (ориентир на шаге 4.1.14) с использованием пьезоэлектрических стадии.
- Задайте параметры треппинга для достижения колебания перпендикулярно линии соприкосновения. Задайте этапов как ноль. Значение амплитуды в X и Y направления движения перпендикулярно линии соприкосновения. Амплитуда обычно должно быть 0,1 V.
- Начните приобретение (с высокой частоте кадров, например 10 fps).
- Переключитесь на Оптический пинцет, нажав на кнопку «Генерирующая!».
- Когда это сделано, выключите пинцета и остановка загрузки изображений. Фильм и текстовый файл, содержащий гальванометра напряжения во время приобретения теперь должен появиться в указанной папке.
- Треппинг клетки контактов — тянуть релиз (рис. 6)
- Найти местоположение интерес в ткани.
- Перемещение целевого соединения с использованием пьезоэлектрических стадии, таким образом, чтобы его середина обычно 1 мкм от ловушки позиции (ориентир на шаге 4.1.14).
- Значение амплитуды 0 иметь устойчивый ловушку.
- Начало захвата изображений (с высокой частоте кадров, например 10 fps).
- Переключитесь на Оптический пинцет, нажав на кнопку «Генерирующая!».
- После желаемого времени выключите ловушки и ждать для релаксации происходят.
- Остановка загрузки изображений. Фильм и текстовый файл, содержащий гальванометра напряжения во время приобретения теперь должен появиться в указанной папке.
- Найти местоположение интерес в ткани.
-
Полуавтоматический кимограф поколения и обнаружение интерфейса позиции.
- В командной строке Matlab, загрузить карту интерполяции, созданные во время процедуры калибровки (4b): load('convertFct.mat'). Это обеспечивает fx и fy переменных.
- В командной строке Matlab запустите autokymo(fx,fy), представила в файлах кода Matlab. Целью этой функции является сформировать кимограф вдоль траектории лазера и определить положение линии соприкосновения с субпиксельной резолюции для каждого кадра.
- Выберите путь к файлу появится текст, содержащий значения напряжения.
- Выберите первый и последний кадр номера фильма, чтобы быть проанализированы.
- Выберите файл фильма tiff. Будет отображаться два новых фигур: первый из них является изображение кимограф. Вторая — это граф обнаружения контактной линии и лазерной позиций, против номер изображения.
Примечание: Функция сохраняет граф, представляющих положение образца и положение лазерного против номер изображения (рисунок matlab, jpg), кимограф (изображение tiff) и кимограф с позицией лазер (изображение tiff). Для экспериментов устойчивый ловушку кимограф должно быть сделано вручную, например с помощью ImageJ. Определение интерфейса от кимограф затем может быть сделано с помощью такого же алгоритма.
7. механические измерения
-
Жесткость и напряжение измерения
- Выполнение эксперимента колебаний (шаг 6.1) и соответствующего анализа (шаг 6.3) фильма промежуток времени.
- Участок интерфейса позиции
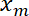 как функции ловушки позиции
как функции ловушки позиции  с использованием Matlab график функции или любых данных, построения программного обеспечения.
с использованием Matlab график функции или любых данных, построения программного обеспечения.
Примечание: Это должно быть приблизительно линейной. - Выполнение линейной подходят, используя Matlab «ezfit» бесплатный инструментарий или любого программного обеспечения, позволяя подходит. Обратная ФМП склона обеспечивает среднее соотношение
 .
. - Выполнение оценки очевидной изгиб жесткость интерфейса, который, при условии мелких деформаций и квадратичные потенциал для треппинга, дается
 .
. 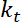 это ловушка жесткость (см. шаг 8 для калибровки жесткость ловушки).
это ловушка жесткость (см. шаг 8 для калибровки жесткость ловушки). - Выполнение оценки напряженности, которая может быть определена как23:
 .
.
-
Реологические измерения
- Вытяните релиз экспериментов (шаг 6.2) и соответствующего анализа (шаг 6.3)
- Соответствовать результирующая кривая с пользовательские реологической модели.
8. Калибровка ловушку жесткость
Примечание: Определение абсолютной силы требует знания ловушку жесткость на интерфейсах. Это могут быть доступны с использованием бисера через двухэтапная процедура.
-
Определение вязкости цитозоль
- Эмбрионы в галоидоуглеводородов нефти и ввести их с помощью установки микроинъекции с флуоресцентные шарики полистироля (1:1, 000 акций разрежения, диаметром 0,46 мкм)23,27.
- Место эмбрионы вводят под микроскопом.
- Отслеживать движение одного бусин, найденных в цитозоль. Извлечение квадратного перемещения бисер (использовать большое количество траекторий > 100 бусы). Определите диффузии из бисера от склона среднеквадратичной перемещения. Касающиеся диффузии вязкости по формуле Стокса-Эйнштейн, вывести эффективную вязкость цитозоль. В начале эмбриона вязкость примерно 3,5 Pa.s — сообщил23.
-
Определение жёсткости ловушку на бусины
- Ловушка одного бисер в цитозоле с Оптический пинцет.
- Переместить шарик в ступенчатой моды между двумя позициями ловушку, разделенные 0,5 мкм
- Определите жесткость ловушку на бусы, как соотношение между аэродинамического и время релаксации шарик из одного ловушку позиции к другой.
Примечание: Коэффициент аэродинамического сопротивления-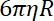 , где
, где 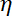 вязкость определяется в (8.1) и
вязкость определяется в (8.1) и  из бисера радиус. Время релаксации получается из экспоненциального приступы шарик позиции, используя Matlab или любого программного обеспечения, позволяя подходит. Типичные значения жесткости ловушки-120 ±50 pN.µm-1 на 200 МВт лазерного возбуждения.
из бисера радиус. Время релаксации получается из экспоненциального приступы шарик позиции, используя Matlab или любого программного обеспечения, позволяя подходит. Типичные значения жесткости ловушки-120 ±50 pN.µm-1 на 200 МВт лазерного возбуждения.
-
Определение жёсткости ловушку на интерфейсе ячейки
- Фокус лазера на линии соприкосновения и отвлекать его (как описано в шаге 6). Измерение амплитуды деформации. Это должно повторяться на нескольких контактных линий для получения представительной среднем.
- Сравните производимых деформации с этим индуцированных бусы, толкнул контактной линии. Так как деформация пропорциональна ловушку жесткость, вывести ловушку жесткость на ячейку контакты.
Примечание: Жесткость ловушку на ячейку контакты обычно найден 2 - 3 раза меньше, чем на бусины (0,46 диаметр мкм).
Результаты
Рисунок 5 показывает экспериментальных данных, полученных путем введения синусоидальные движения в ловушку. Ловушка производит отклонения интерфейса, что подтверждается 3 снимки, показаны 3 последовательных интерфейса позиции (Рисунок 5A)23. Записанные фильмы используются для создания кимограф (Рисунок 5B) и далее анализируются, чтобы определить, что позиция интерфейса с субпиксельной резолюции, с использованием Гаусса подходящими вдоль оси x для каждого кадра. В режиме малых деформаций, пропорциональны позиций в ловушку и интерфейс (рис. 5 c). Амплитуда смещения интерфейс по сравнению с ловушки (рис. 5 d) дает доступ к интерфейс напряженности или жесткость (см. шаг 7.1).
Рисунок 6 показывает, экспериментальные данные, полученные в результате тянуть релиз экспериментов. Оптическая ловушка включается примерно 1 мкм от медианы интерфейса между двумя ячейками, которые вызывает интерфейс отвлечь сторону ловушки положение (рис. 6A)24. Ловушка затем выключается после нужное количество времени. Xm позицию интерфейса (Рисунок 6B) получается из kymographs (рис. 6 c), снова используя Гаусса подходит вдоль оси x для каждого кадра. Получившийся график можно сравнить с предположил реологической модели, например, модель Максвелла (рис. 6 d).
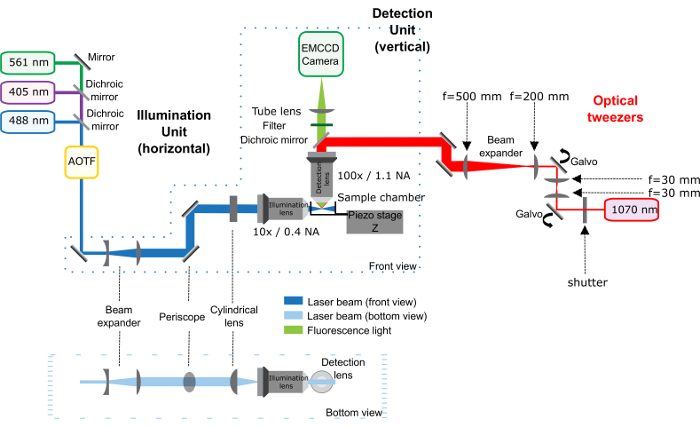
Рисунок 1: схема установки Оптический пинцет (красный путь) в сочетании с Микроскоп свет лист. Этот рисунок был изменен с Bambardekar, K. et al. 23. Микроскоп свет лист, составленный блоком освещения и детектирования, описанное ранее25. Оптический пинцет соответствуют красную часть схемы: инфракрасный лазер проходит через оптический затвор и 2 Гальванометры, которые контролируют положение ловушку в образце. Секционное телескоп помещается между 2 Гальванометры держать сопряжения между ними. Затем телескоп увеличивает размер луча в 2,5 раза и Перископ приносит его на высоту микроскопа. Инфракрасный лазерный входит обнаружение цели Микроскоп благодаря дихроичное зеркало. Непосредственно в рисунке даны важные расстояния между оптических элементов. Расстояние между последней объектива (Фокусное расстояние 500 мм) и обратно Апертура цель-500 мм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: домашнее изменение железнодорожных Холдинг дихроичное зеркало зеркало горячей и. Дихроичное зеркало железнодорожных микроскопа была сокращена с левой стороны, чтобы разрешить вход инфракрасного лазера. Дихроичное зеркало отражает инфракрасное излучение и пропускает видимый свет (флуоресценции). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
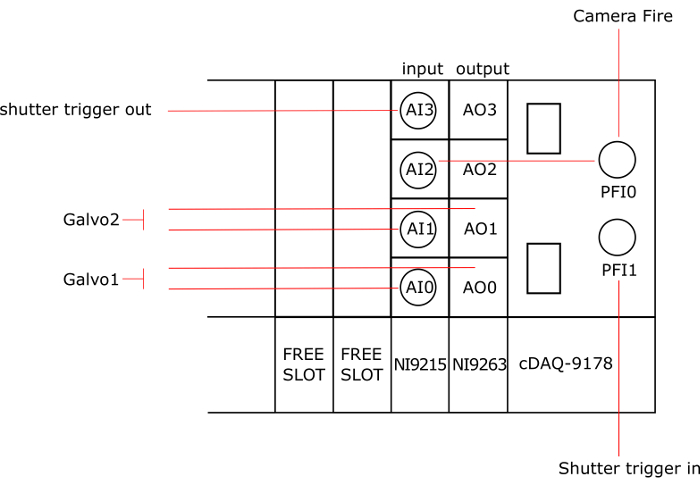
Рисунок 3: подключение документов к картам NI. АО: аналоговый выход, AI: аналоговый вход, AO0 и AI0 связаны с galvo1, AO1 и AI1 подключены к galvo2, PFI0 подключен к огонь камеры, AI2 и PFI1 подключен к триггеру в затвора и AI3 подключен к спусковой крючок из затвора. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: держатель образца в контексте наблюдения. Этот рисунок был изменен с Chardès, C., и др. 25. эмбрионы иммобилизованных на стекло coverslip. Слайд проводится держателя образца. Держателя образца вставляется в Кювета стеклянная, удерживаемые держатель крепится к стадии пьезоэлектрический. Свет лист горизонтальных и освещает эмбрионов со стороны. Обнаружения объектива Вертикальный, выше образец и окунает в кювет.
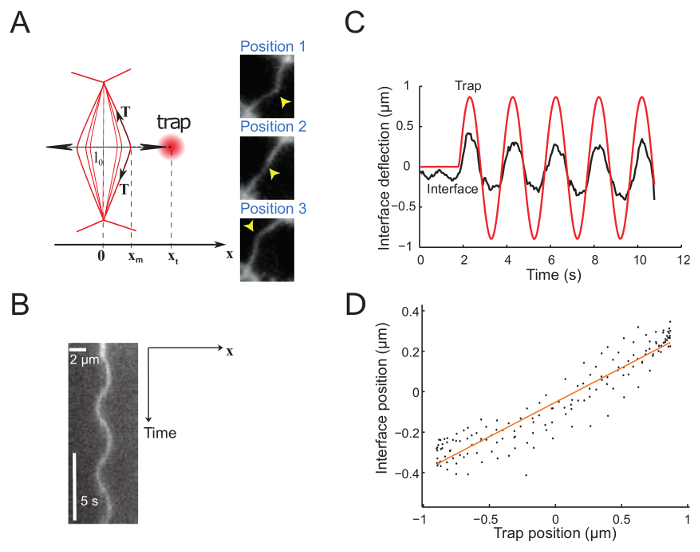
Рисунок 5: интерфейс прогиб, введенных движением синусоидального ловушки. Этот рисунок был изменен с Bambardekar, K. et al23. (A) ловушку перемещается синусоидально перпендикулярно к интерфейсу. Ловушки и интерфейс позиции являются xt и xm, соответственно. Правой панели показывают три изображения интерфейса на разных позициях. Лазерные ловушки позиция характеризуется желтая стрелка. Интерфейс, помечены с маркером мембраны (GAP43::mcherry). (B) кимограф вдоль оси определяется направление движения (линией, перпендикулярной к интерфейсу) ловушка (Period = 5 s). (C) представитель участок прогиб против время показаны ловушки (красная сплошная линия) и интерфейс позиции (черная сплошная линия). (D) интерфейс позиции как функции ловушки позиции в течение нескольких циклов колебаний лазер (амплитуда = 0,5 мкм, период = 2 s). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
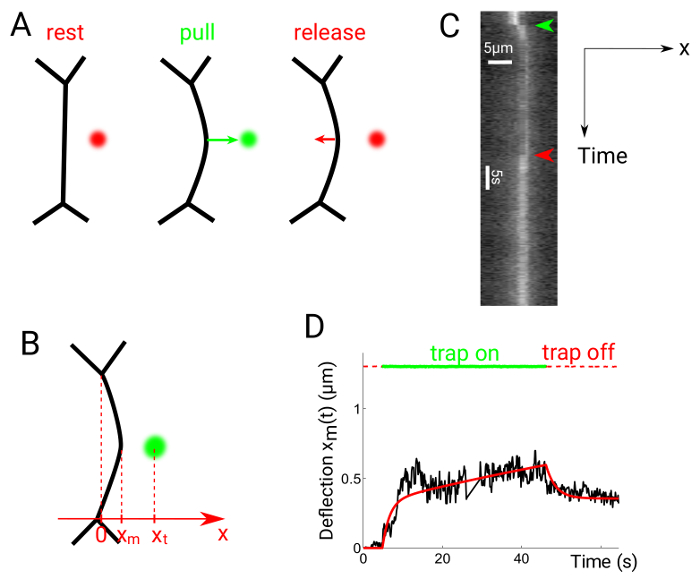
Рисунок 6: интерфейс прогиб в тянуть релиз экспериментов. Эта цифра была изменена от Serge, а., и др. 24. (A) ловушку включен на расстоянии от медианы интерфейса, а затем снова выключен. (B) положения ловушки и интерфейса являются xt и xm, соответственно. Kymographs создаются вдоль оси x, перпендикулярно линии соприкосновения медианы. (C) кимограф тянуть релиз эксперимента. Мобильные контакты помечены с Utrophin::GFP. (D) представитель участок прогиб против время показаны ловушки (пунктирные линии красный/зеленый) и интерфейс позиции (черная сплошная линия). Сплошной красная линия показывает покрой, полученные с помощью Максвелл как модель реологическая24. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Дополнительные фильм 1: Бровей эксперимент. Размер пикселя = 194 Нм, 10 fps, период колебаний ловушку = 2 s, маркировки: Gap43::mCherry. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Оптический пинцет позволяют выполнять абсолютной механические измерения непосредственно в эпителии развивающихся зародышевых неинвазивным способом. В этом смысле он представляет преимущества перед другими методами, например лазерной абляции, которые являются инвазивными и предоставлять относительные измерения, магнитные силы, которые требуют инъекции, или силы вывод, который опирается на сильные предположения и также обеспечивают относительную измерения.
Протокол включает в себя несколько важных шагов. Во-первых поскольку объектив может показать хроматических аберраций и лазерные ловушки помещает объект «по течению», это важно, чтобы проверить, что ИК лазерные ловушки шарик в плоскости изображения и в конечном итоге правильным для него (шаг 2.18). Во-вторых метод полагается на измерения позиции ячейки контактов. Таким образом, важно использовать флуоресцентный маркером высокой контрастности.
Качество объектива и лазерный луч имеют решающее значение для эффективного улавливания. Числовая апертура объектива должен превышать 1.0. Если треппинг является неэффективным, убедитесь, что лазерный луч заполняет задние диафрагмы объектива.
Наш метод поставляется с некоторыми ограничениями. Во-первых не ясно, что именно обеспечивает поддержку для оптических треппинга. Хотя обнаруживается несоответствие показателя преломления, его происхождение остается определить. Во-вторых процесс калибровки, если кто-то заинтересован в абсолютных измерений, может быть немного утомительно, как требует пассивной микрореологию экспериментов и калибровки ловушку жесткости на бусины. Важно признать, что калибровка жесткость на ячейку контакты подлежит экспериментальных неопределенности: он опирается на измерения жесткости ловушку на бусы, которые могут быть измерены только в цитозоле, но не вблизи ячейку контакты. В-третьих, неясно, как универсальный Оптический пинцет может быть. Хотя они способны исказить клетки зародыша дрозофилы , другие ткани может представить более трудным доступ (например, пройдя через кутикулу) или высокаяа напряженность и поэтому менее поддаются оптических бровей.
Оптической силы невелики (< несколько десятков pN) и таким образом может быть недостаточно для деформации структуры жесткой или очень напряженные. Магнитные пинцеты на крупных частиц, вероятно, будет более эффективной в данном случае.
Мы описали здесь муфты оптические Пинцеты для Микроскоп свет лист, однако Оптический пинцет может сочетаться в другие типы микроскопов, например эпифлуоресцентного или микроскопом диска конфокальный спиннинг. Введение ИК лазер треппинга в Микроскоп зависит от конфигурации микроскопа. Это главным образом требует возможность добавления дихроичное зеркало для объединения пути для изображений и оптических манипуляции. Большинство компаний микроскопии предлагаем модульный освещение систем, с двухслойной модулем, которые позволяют этой комбинации.
Несколько направлений существуют в том, чтобы улучшить или модернизировать технику. Возможность состоит в том, чтобы разделить время пребывания лазер среди нескольких позиций или использовать более передовые голографические методы, производить несколько ловушек. Это может позволить создать более сложные шаблоны силы на целевой ячейки или ячейки контактов. Еще одно улучшение может быть дизайн реального времени обратной связи между причиной отклонения и положение ловушку. Это может позволить надлежащего ползучести эксперименты, в которых усилие поддерживается постоянной на протяжении всего эксперимента.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана FRM Equipe Грант FRM DEQ20130326509, Agence Nationale де ла Recherche АНР-Blanc Грант, Morfor ANR-11-BSV5-0008 (для P.-ф.л.). Мы признаем Франции-BioImaging инфраструктуры, поддержке французского национального исследования агентства (АНР-10-INBS-04-01, «Инвестиции в будущее»). Мы благодарим Брис Detailleur и Клод Moretti от PICSL-ФБР инфраструктуры для оказания технической помощи.
Материалы
| Name | Company | Catalog Number | Comments |
| Ytterbium Fiber Laser LP, 10 W, CW | IPG Laser | YLM-10-LP-SC | including collimator LP : beam D=1.6 mm and red guide laser |
| Ø1/2" Optical Beam Shutter | Thorlabs | SH05 | |
| Small Beam Diameter Galvanometer Systems | Thorlabs | GVS001 | 1 for X displacement, 1 for Y displacement |
| 1D or 2D Galvo System Linear Power Supply | Thorlabs | GPS011 | galvanometers power supply |
| 2 lenses f = 30mm | Thorlabs | LB1757-B | relay telescope between 2 galva |
| Lens f = 200mm | Thorlabs | LB1945-B | 2.5X telescope |
| Lens f = 500mm | Thorlabs | LB1869-B | 2.5X telescope |
| Right-Angle Kinematic Elliptical Mirror Mount with Tapped Cage Rod Holes | Thorlabs | KCB1E | Periscope |
| Laser Safety Glasses, Light Green Lenses, 59% Visible Light Transmission, Universal Style | Thorlabs | LG1 | |
| 45° AOI, 50.0mm Diameter, Hot Mirror | Edmund Optics | #64-470 | |
| Multiphoton-Emitter HC 750/S | AHF | HC 750/SP | |
| CompactDAQ Chassis | National Instruments | cDAQ-9178 | |
| C Series Voltage Output Module | National Instruments | NI-9263 | Analog output module |
| C Series Voltage Input Module | National Instruments | NI-9215 | Analog input module |
| FluoSpheres Carboxylate-Modified Microspheres, 0.5 µm, red fluorescent (580/605), 2% solids | ThermoFisher Scientific | F8812 | calibration beads |
| C++ (Qt) home made optical tweezers software | developed by Olivier Blanc and Claire Chardès. Alternative solution: labview |
Ссылки
- Lecuit, T., Lenne, P. -. F., Munro, E. Force generation, transmission, and integration during cell and tissue morphogenesis. Annual review of cell and developmental biology. 27 (1), 157-184 (2011).
- Heisenberg, C. -. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Sugimura, K., Lenne, P. -. F., Graner, F. Measuring forces and stresses in situ in living tissues. Development. 143 (2), 186-196 (2016).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in cell & developmental biology. 55, 119-130 (2016).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. Journal of Cell Biology. 149 (2), 471-490 (2000).
- Farhadifar, R., Roper, J. C., Aigouy, B., Eaton, S., Julicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Rauzi, M., Verant, P., Lecuit, T., Lenne, P. F. Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell biology. 10 (12), 1401-1410 (2008).
- Ma, X., Lynch, H. E., Scully, P. C., Hutson, M. S. Probing embryonic tissue mechanics with laser hole drilling. Physical Biology. 6 (3), 036004 (2009).
- Hutson, M. S., Tokutake, Y., et al. Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science. 300 (5616), 145-149 (2003).
- Bonnet, I., Marcq, P., Bosveld, F., Fetler, L., Bellaïche, Y., Graner, F. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface / the Royal Society. 9 (75), 2614-2623 (2012).
- Etournay, R., Popović, M., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current topics in developmental biology. 95, 93-144 (2011).
- Saha, A., Nishikawa, M., Behrndt, M., Heisenberg, C. -. P., Jülicher, F., Grill, S. W. Determining Physical Properties of the Cell Cortex. Biophysical journal. 110 (6), 1421-1429 (2016).
- Desprat, N., Supatto, W., Pouille, P. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental cell. 15 (3), 470-477 (2008).
- Mitrossilis, D., Röper, J. -. C., et al. Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation. Nature Communications. 8, 13883 (2017).
- Campàs, O., Mammoto, T., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2013).
- Serwane, F., Mongera, A., et al. In vivo quantification of spatially varying mechanical properties in developing tissues. Nature Methods. 14 (2), 181-186 (2017).
- Chiou, K. K., Hufnagel, L., Shraiman, B. I. Mechanical stress inference for two dimensional cell arrays. PLoS computational biology. 8 (5), e1002512 (2012).
- Ishihara, S., Sugimura, K. Bayesian inference of force dynamics during morphogenesis. Journal of theoretical biology. 313, 201-211 (2012).
- Brodland, G. W., Veldhuis, J. H., Kim, S., Perrone, M., Mashburn, D., Hutson, M. S. CellFIT: a cellular force-inference toolkit using curvilinear cell boundaries. PLoS ONE. 9 (6), e99116 (2014).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23, 247-285 (1994).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. -. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. , (2015).
- Clément, R., Dehapiot, B., Collinet, C., Lecuit, T., Lenne, P. -. F. Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis. Current biology: CB. 27 (20), (2017).
- Chardès, C., Ménélec, P., Bertrand, V., Lenne, P. -. F. Setting-up a simple light sheet microscope for in toto imaging of C. elegans development. Journal of visualized experiments. 87, e51342 (2014).
- Serge, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nature Methods. 5 (8), 687-694 (2008).
- Cavey, M., Lecuit, T. Imaging Cellular and Molecular Dynamics in Live Embryos Using Fluorescent Proteins. Drosophila. 420, 219-238 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены