Method Article
Tastatura meccanica delle cellule con pinzette ottiche senza tallone nell'embrione della drosofila
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Presentiamo una configurazione di pinzette ottiche accoppiate al microscopio un foglio leggero e la sua attuazione a sonda meccanica delle cellule senza perline nell'embrione della drosofila .
Abstract
Morfogenesi richiede un coordinamento tra genetica patterning e forze meccaniche per modellare robustamente cellule e tessuti. Quindi, una sfida di comprendere processi morfogenetici è misurare direttamente le forze cellulari e proprietà meccaniche in vivo durante l'embriogenesi. Qui, presentiamo una configurazione di pinzette ottiche accoppiate al microscopio foglio leggero, che permette di applicare direttamente le forze su contatti cellula-cellula dell'embrione della drosofila precoce, mentre la formazione immagine ad una velocità di diversi fotogrammi al secondo. Questa tecnica ha il vantaggio che non richiede l'iniezione di perline in embrione, solitamente usato come sonde intermedi in cui vengono esercitate forze ottiche. Siamo in dettaglio passo dopo passo l'attuazione del programma di installazione e proporre strumenti per estrarre informazioni meccaniche dagli esperimenti. Monitorando gli spostamenti di contatti cellula-cellula in tempo reale, è possibile eseguire misure di tensione e indagare la reologia i contatti cellula.
Introduzione
Lo sviluppo embrionale è un processo altamente riproducibile, durante il quale le cellule e tessuti deformano per plasmare il futuro animale. Tali deformazioni sono stati indicati per richiedere la generazione attiva delle forze al livello1,cella2. Per comprendere processi morfogenetici, durante il quale le cellule e tessuti cambiano la loro forma, pertanto è chiave per valutare le proprietà meccaniche delle cellule coinvolte e per misurare le forze all'interno del tessuto durante il processo3,4 . Strati epiteliali, soprattutto in Drosophila, ampiamente sono stati studiati a causa della loro geometria quasi-2D e alla loro manipolazione facile.
Una serie di tecniche è state così sviluppata da noi e gli altri per valutare epiteliali meccanica in vivo durante lo sviluppo. Daremo una rapida panoramica delle tre principali tecniche utilizzate in tessuti epiteliali. Ablazione laser, un metodo ampiamente utilizzato, permette di rivelare lo stress meccanico locale a cella giunzioni5,6,7,8 o a più grande scala9,10,11 eseguendo tagli locali che interrompono l'integrità meccanica del bersaglio. La dinamica di apertura dopo il taglio fornisce informazioni sull'ablazione previo lo stress sia sulla reologia del tessuto12,13. Uno svantaggio dell'ablazione laser è che è invasivo, in quanto richiede l'interruzione locale della corteccia delle cellule. Quindi, uno può eseguire solo un numero limitato di ablazioni se si vuole preservare l'integrità del tessuto. Un altro svantaggio è che ablazioni forniscono solo stime relative di tensione a contatti cellula, poiché la velocità di apertura dipende dall'attrito viscoso, che non è generalmente noto. Manipolazione magnetica inoltre è stato sviluppato e utilizzato in Drosophila, che coinvolgono l'utilizzo di ferrofluidi14 o liposomi ultramagnetic15. Essi possono fornire misure assolute16,17, ma sono anche invasivi nel senso che richiedono l'iniezione di sonde nella posizione desiderata. Questo può essere molto difficile a seconda del sistema, che non è sempre suscettibile di iniezioni di precise. Una terza tecnica, completamente non-invasiva, è forza inferenza18,19,20. Inferenza di forza si basa sull'ipotesi di equilibrio meccanico presso punti tripli (giunzioni tricellular, o vertici) e permette di dedurre le tensioni affatto cellulare contatti (e possibilmente, pressioni in tutte le cellule) di risolvere un problema inverso. Per le tensioni, ogni vertice fornisce due equazioni (X e Y). Questo produce un grande sistema di equazioni lineari che possono essere invertiti in alcune condizioni per valutare la tensione a tutti i contatti delle cellule. Mentre questo metodo è molto attraente, in quanto non richiede solo un'immagine segmentata e nessun esperimento supplementare o setup, sua precisione è ancora da determinare, e ancora fornisce solo valori relativi, a meno che non viene eseguita una misurazione di calibratura assoluta.
Per superare alcune di queste limitazioni, vi presentiamo in questo articolo un setup di pinzette ottiche accoppiato ad un microscopio foglio leggero applicare forze controllate alla scala delle cellule nell'epitelio embrionale di Drosophila melanogaster. Pinzette ottiche sono state utilizzate per numerose applicazioni biologiche compreso le misure sulle singole proteine e la manipolazione di cellule e organelli21. Qui, segnaliamo le forze applicate nel range di pochi dozzina pN, che è piccola ma sufficiente per indurre deformazioni locali di contatti cellula ed eseguire misure meccaniche in vivo. In genere, usiamo flessione perpendicolare di contatti cellula, monitorati attraverso l'analisi di chimografi, di relazionarsi forza alla deformazione. D'importanza, il nostro programma di installazione non richiede l'iniezione di perline nella posizione desiderata nel tessuto, come pinzette ottiche sono in grado di esercitare direttamente le forze su contatti cellula-cellula. L'accoppiamento delle pinzette ottiche ad un microscopio foglio leggero permette di eseguire la rappresentazione rapida (diversi fotogrammi al secondo), che è molto apprezzabile per un'analisi meccanica alle scale di breve tempo e con ridotta fototossicità, dato che l'illuminazione della il campione è limitato al piano del22di imaging.
Nel complessive, ottiche pinzette sono un modo non-invasivo per applicare forze controllate a contatti cellula in vivo l'embrione di Drosophila e per estrarre informazioni meccaniche come rigidità e tensione a cella contatti23, proprietà reologiche 24e gradiente o anisotropia di tensione23.
Protocollo
1. messa a punto il microscopio foglio leggero
- Fare riferimento alla descrizione del programma di installazione nella precedente pubblicazione25.
Nota: L'installazione è composta da una fase di microscopio dritto e un modulo di foglio leggero producendo un foglio leggero sul piano orizzontale. Un eccitazione obiettivo obiettivo 10x dirige il foglio leggero in una cuvetta di vetro (Figura 4). L'obiettivo di rilevazione ha un alta NA (1.1), che è necessario per efficiente tweezing (Vedi sotto).
2. messa a punto il percorso di pinzette ottiche
Nota: La figura 1 dà uno schema generale dell'apparato ottico.
- Collocare l'apparecchio laser di 1070 nm e fissare la fibra sul tavolo ottico con un Monte di V-clamp. Verificare che il collimatore di fibra sia parallelo alla tabella ottica (quindi, orizzontale) e che l'altezza selezionata qui sarà l'altezza per tutti i componenti ottici allineati sul tavolo ottico.
Nota: 100 mm può essere una buona scelta per questa altezza. - Girare la chiave dell'unità laser a infrarossi e premere il tasto "Select" per attivare il puntatore di allineamento. La luce deve essere orizzontale in uscita della fibra.
- Posizionare il pulsante di scatto nel percorso ottico e fissarla al tavolo ottico, in modo che il raggio laser passa attraverso l'apertura dell'otturatore. Verificare che la distanza tra la tabella ottica e il centro dell'apertura dell'otturatore è l'altezza selezionato nel passaggio 2.1.
- Girare la chiave del controller dell'otturatore, selezionare la modalità manuale con le frecce e premere il pulsante "Attiva" per aprire l'otturatore.
- Posizionare, allineare e fissare il primo mirror di galvanometro.
Nota: I due specchi di galvanometro necessario essere coniugato all'apertura posteriore dell'obiettivo di rilevamento, di modo che quando uno degli specchi è in rotazione, il fascio laser non andare fuori l'apertura posteriore dell'obiettivo. Nota che la distanza tra il primo galvanometro e l'apertura posteriore dell'obiettivo deve essere calcolata per valutare la posizione di questo galvanometro rispetto all'obiettivo (f1 + f1 + f2 + f2 + f3 + f3 + f4 + f4 = 30 + 30 + 30 + 30 + 30 + 200 + 200 + 500 + 500 = 1550 mm; fi = lunghezza focale dell'obiettivo n ° ho). - Accendere l'alimentazione del galvanometro. Garantire che i galvanometri sono alimentati per il resto del protocollo allineamento.
- Impostare galvanometri a zero deflessione (con NIMAX o pinzette ottiche software - vedere il passaggio 3 per le connessioni galvanometro).
- Posizionare, allineare e fissare il telescopio di relè composto da due lenti con una lunghezza focale di 30mm.
- Posizionare, allineare e fissare il secondo mirror di galvanometro. Si noti che la distanza tra due galvanometri è 4f = 4 x 30 mm = 120 mm (f = lunghezza focale).
- Posizionare e fissare il telescopio.
Nota: Il telescopio è composto da due lenti che espandere il raggio di una larghezza almeno uguale al diametro dell'apertura posteriore dell'obiettivo. L'obiettivo con la focale più piccola dovrebbe venire prima. - Posizionare, allineare e fissare il periscopio portando verso l'alto il percorso ottico più vicino all'entrata del binario specchio dicroico.
- Difficoltà lo specchio caldo nel rail, posizionare la rotaia nel microscopio. Assicurarsi che la guida è segata sul lato destro per consentire l'ingresso del laser infrarosso (Figura 2).
- Controllare che la luce laser sta andando fuori al microscopio, in primo luogo senza l'obiettivo allora con l'obiettivo. Correggere la posizione del laser prima l'obiettivo con lo specchio di fondo del periscopio. Correggere la posizione del laser dopo l'obiettivo con lo specchietto superiore del periscopio.
- Mettere 1 µ l di 500 perline fluorescenti nm nella cuvetta di vetro e aggiungere 10 mL di acqua distillata. Mettere la provetta nell'ambito dell'obiettivo nel supporto per cuvette e regolare la messa a fuoco dell'obiettivo (posizione Z) in modo che l'obiettivo non tocchi la superficie dell'acqua.
- Avviare il software di acquisizione fatti in casa controllo il AOTF, la fotocamera e la fase piezoelettrica. Utilizzabile anche un software gratuito come micromanager. Attivare la modalità di acquisizione diretta premendo il pulsante "Live".
- Regolare la potenza del laser IR 1 w.
-
Mettere gli occhiali (e non rimuoverlo prima della fine dell'esperimento) e accendere il laser. Una perlina dovrebbe essere intrappolata al fuoco del laser.
- Se nessun tallone è intrappolato al fuoco del laser, verifica se il puntatore laser rosso (che è collineare con il laser IR) è venuta fuori l'obiettivo. Se non, avviare nuovamente la procedura di allineamento, in particolare passo 2.13. In alternativa, è possibile aumentare la potenza del laser IR.
- Se il tallone è intrappolato fuori fuoco (dell'aereo imaging), delicatamente spostare la posizione dell'obiettivo ultimo dell'ultimo lungo l'asse ottico per portare il tallone a fuoco con il piano di formazione immagine del telescopio (L4 nella Figura 1). Se non basta, spostare il primo obiettivo dell'ultimo lungo l'asse ottico del telescopio (L3 nella Figura 1).
- Se intrappolato perlina non è centrata nell'immagine, è possibile utilizzare gli specchi 2 periscopio per regolare la posizione della trappola. Se è cambiata la posizione del tallone modificando l'angolo dello specchio primo, anche di compensare la direzione del fascio modificando l'angolo corrispondente dello specchio secondo. Correggere solo la posizione X (1 vite per ogni singolo specchio), quindi correggere la posizione Y (1 vite per ogni singolo specchio).
- Se necessario, regolare la posizione della lente 2nd telescopio per osservare il tallone a fuoco.
- Se necessario, regolare l'angolazione degli specchi periscopio per avere il tallone centrato nell'immagine.
3. l'interfaccia dello strumento
Nota: Nella figura 3 fornisce uno schema generale delle connessioni scheda National Instruments (NI).
- Inserire la scheda di output (NI-9263) nel primo slot del telaio (cDAQ-9178). Nota che altri modelli di carte di NI con almeno 2 uscite analogiche e 3 ingressi analogici possono essere utilizzati.
- Inserire la scheda di input (NI-9215) nel secondo slot del telaio.
- Collegare il primo galvanometro all'analogico uscita AO0 e il AI0 ingresso analogico con cavi BNC. Si noti che un adattatore di T può essere utilizzato per collegare 2 cavi BNC a uno. Consultare il manuale di galvanometro per localizzare i pin sulla scheda driver galvanometro.
- Allo stesso modo, collegare il secondo galvanometro AO1 e AI1.
- Collegare PFI1 al grilletto IN dell'otturatore (sul retro del controller).
- Collegare PFI0 a fuoco della fotocamera e alla AI2.
- Collegare AI3 al trigger fuori l'otturatore (sul retro del controller).
- Regolare le impostazioni del controller dell'otturatore. Utilizzare le frecce per modificare i valori di parametro e premere il pulsante "Select" per convalidare la scelta e passare al parametro successivo. Mettere il parametro "tempo aperto sec" a 000.000, "sec tempo chiuso" a 000.000, "modalità" SINGLE e "trigger" su EXT. Consenti il controllo dell'otturatore premendo il pulsante "Attiva".
- Aprire QtCreator (scaricato da https://www.qt.io/, versione gratuita).
Nota: QtCreator è l'ambiente di sviluppo integrato utilizzato per sviluppare in C++ il software pinzette ottiche. Libreria Qt è usata qui per creare widget. - Aprire il file OT.pro (fornito nei file di codice Qt). Questa azione aprirà il progetto. Cambiare il nome di input e output nel file AOGenerator.cpp secondo le schede NI utilizzato.
- Compilare ed eseguire il software di OT.
4. taratura della posizione ottico trappola con perline
-
Registrazione di un filmato di calibrazione
- Mettere 1 µ l di 500 perline fluorescenti nm rosso in vetro cuvetta, poi riempire la cuvetta con 10 mL di acqua distillata. Figura 4 offre una vista della cuvetta nel contesto di osservazione.
- Difficoltà la cuvetta sul palco piezoelettrico.
- Regolare la posizione Z della provetta in modo che l'obiettivo di rilevazione si tuffa in acqua.
- Accendere il laser a raggi infrarossi e impostare la potenza di 1 w.
- Attivare il software di acquisizione immagine.
- Per acquisire immagini di lasso di tempo, selezionare il tempo di esposizione, il guadagno, il tempo tra due immagini, il numero di immagini da acquisire e la potenza del laser. Si noti che per la calibrazione di pinzette ottiche con perline, l'illuminazione laser (561 nm) non è necessaria. L'effetto di 2-fotone indotto dal laser a raggi infrarossi è sufficiente per eccitare la fluorescenza di un cordone di intrappolati.
- Avviare il software di pinzette ottiche fatte in casa.
- Impostare i parametri di pinzette ottiche per tracciare un cerchio. Impostare SamplingRate come 250 samp/s, bufferSize come 1000, Waveform1 parametri (galvo 1) come sinusoidale, nbPeriod 1, ampiezza 0,5 V, fase 0.0 rad, Offset 0.0 V, forma d'onda 2 parametri (galvo 2) come sinusoidale, nbPeriod 1, ampiezza 0,5 V, fase 1,57 rad, Offset 0.0 V.
- Controllare la casella "AI parametri" e il "attesa per esso"... casella.
- Avviare l'acquisizione di immagini (500 o 1000 immagini con un frame rate elevato, ad esempio 10 fps).
- Accendere la pinzetta ottica premendo il pulsante "Generazione!".
- Consentire il tallone intrappolato completare almeno due cerchi pieni e interrompere la pinzetta ottica di ONU-pressante la "generazione!" pulsante.
- Interrompere l'acquisizione dell'immagine. Si noti che un film di tiff e un file di testo con tensioni di galvanometro vengono creati nel predefinito "c: / TEMP /" cartella (se non è specificato un percorso personalizzato). Si noti che diversi film di calibrazione con file di dati associati può essere creato se necessario.
- Se il cerchio non è completo, il tallone viene perso durante la traiettoria del cerchio. Forse la velocità è troppo elevata. Ridurlo diminuendo la frequenza di campionamento nel software OT. Oppure, utilizzando il puntatore laser rosso del laser infrarosso, verificare se il laser è venuta fuori l'obiettivo durante la traiettoria di tutto il cerchio. In caso contrario, gli specchi di galvanometro non possono essere coniugati con il piano focale posteriore dell'obiettivo. Correggere le posizioni di galvanometri rispetto al piano focale posteriore dell'obiettivo, a partire ancora una volta la procedura di allineamento dal punto 2.5.
- Impostare le ampiezze a zero e accendere il laser per intrappolare una perlina in una posizione di correzione. Inserire un punto di riferimento nella posizione di trappola.
-
Interpolazione di posizione con analisi dell'immagine
- Aprire Matlab, passare alla cartella di calibrazione ed eseguire lo script "position2tension" (fornito nei file di codice Matlab). Questo script calcola la funzione di interpolazione traducendo tensioni galvanometro a posizione ottico trappola.
- Scegliere che il numero di taratura film verrà utilizzato. Diversi film possono essere selezionati con traiettorie diverse, come due ellissi perpendicolare. In genere, un film di calibrazione singola con una traiettoria circolare è sufficiente.
- La prima e l'ultima immagine di fornire numeri nella finestra di dialogo (una finestra di dialogo per il film), sequenze con un buon rapporto segnale-rumore e chiara traiettoria.
- Fornire il percorso del file di testo contenente le tensioni durante l'acquisizione per ogni film. Si noti che lo script legge il file e calcola le tensioni medie di due galvanometri per ogni immagine.
- Fornire il percorso del film di calibrazione corrispondente.
Nota: Lo script rileva il tallone per ogni fotogramma con una risoluzione di subpixel inserendo una gaussiana 2D per il tallone, utilizzando funzioni personalizzate e funzioni estratte da MTT26. Visualizza un grafico che mostra la traiettoria della perla. - Eliminare qualsiasi punto scarsamente rilevato (outlier) facendo clic su esso.
- Controllare se l'interpolazione mappa per x e y laser posizioni calcolate e visualizzate dallo script, è completa. Se c'è un sacco di valori mancanti (bianche regioni nella mappa), ripetere l'operazione con un nuovo film di calibrazione, con un migliore rapporto segnale-rumore, o / e con una velocità più lenta di galvanometri.
Nota: I valori di interpolazione e queste immagini vengono salvati automaticamente nella stessa cartella come l'immagine, con il nome convertFct.mat.
5. montaggio della drosofila embrioni27
- Raccogliere embrioni della drosofila da una gabbia, incubata a 25 ° C.
- Rimuovere il lievito, il contenuto di piastra passante al setaccio (dimensione dei pori dovrebbe essere circa 100 µm).
- Lavare gli embrioni con candeggina al 100% (2,6% ipoclorito di sodio) per 45 s rimuovere il corion.
- Lavare gli embrioni con acqua per 2 min.
- Mettere gli embrioni su un cuscinetto di agar con un pennello.
- Selezionare circa 10 embrioni secondo la fase desiderata e allineare gli embrioni con un luccio o una spazzola umida.
Nota: L'allineamento deve essere eseguita secondo la regione di interesse (regione di interesse più vicino possibile all'obiettivo di rilevamento). - Utilizzando una penna di diamante-marcatura, tagliare un pezzo di una lastra di vetro di 10 x 20 x 1 mm3.
- Aggiungere la colla su un lato del pezzo ottenuto e lasciarla asciugare per 20 s.
- Capovolgere il pezzo tagliato e posizionarlo sulla linea degli embrioni, per attaccarlo al bordo della diapositiva.
- Installare questa preparazione in supporto del campione e inserirlo nella cuvetta. Figura 4 offre una vista della cuvetta nel contesto di osservazione.
- Mettere la provetta sul palco piezoelettrico.
6. intrappolamento esperimento In Vivo
-
Intrappolando i contatti cellula — oscillazioni (Figura 5)
- Trovare la posizione di interesse nel tessuto.
Nota: Utilizzando mosche in cui caderine sono etichettati può essere utile se uno ha bisogno di lavorare sul piano di giunzioni intermedie. - Spostare il punto medio di svincolo destinazione sulla posizione trappola (limite fissato a passo 4.1.14) utilizzando il palcoscenico di piezo.
- Impostare i parametri di trappola per raggiungere le oscillazioni perpendicolari alla linea di contatto. Impostare le fasi come zero. Impostare le ampiezze in X e Y le indicazioni per avere un movimento perpendicolare alla linea di contatto. L'ampiezza è in genere consigliabile 0.1 V.
- Avviare l'acquisizione (con una frequenza di fotogrammi veloci, ad esempio 10 fps).
- Accendere la pinzetta ottica premendo il pulsante "Generazione!".
- Al termine, spegnere l'acquisizione di immagini di pinzette e stop. Un film e un file di testo contenenti tensioni galvanometro durante l'acquisizione dovrebbe ora apparire nella cartella specificata.
- Intrappolando i contatti cellula — tirare-rilascio (Figura 6)
- Trovare la posizione di interesse nel tessuto.
- Spostare la giunzione di destinazione utilizzando il palcoscenico di piezo in modo che il suo punto medio è in genere di 1 µm dalla posizione trappola (limite fissato a passo 4.1.14).
- Impostare le ampiezze su 0 per avere una costante trappola.
- Avviare l'acquisizione dell'immagine (con un veloce frame rate, ad esempio 10 fps).
- Accendere la pinzetta ottica premendo il pulsante "Generazione!".
- Dopo il tempo desiderato, spegnere la trappola e attendere per il relax si verifichi.
- Interrompere l'acquisizione dell'immagine. Un film e un file di testo contenenti tensioni galvanometro durante l'acquisizione dovrebbe ora apparire nella cartella specificata.
- Trovare la posizione di interesse nel tessuto.
-
Generazione di kymograph semi-automatica e rilevamento della posizione di interfaccia.
- Nella finestra di comando di Matlab, caricare la mappa di interpolazione generata durante la procedura di calibrazione (4b): load('convertFct.mat'). Questo fornisce le variabili fx e fy.
- Nella finestra di comando Matlab, eseguire autokymo(fx,fy), fornite nei file di codice Matlab. Lo scopo di questa funzione è per generare un kymograph lungo la traiettoria del laser e per rilevare la posizione della linea di contatto con risoluzione dei subpixel per ogni fotogramma.
- Selezionare il percorso del file di testo richiesto contenente i valori di tensione.
- Selezionare i numeri del primo e l'ultimo frame del filmato per essere analizzati.
- Selezionare il file del filmato di tiff. Verranno visualizzati due nuove figure: il primo è un'immagine della kymograph. Il secondo è un grafico della rilevazione delle posizioni laser e linea di contatto, contro il numero di immagine.
Nota: La funzione Salva il grafico che rappresenta la posizione del campione e la posizione del laser contro il numero di immagine (figura di matlab, jpg), kymograph (immagine tiff) e il kymograph con la posizione del laser (immagine tiff). Per esperimenti di trappola costante, il kymograph deve essere fatto manualmente, per esempio usando ImageJ. La rilevazione dell'interfaccia dal kymograph quindi può essere fatto utilizzando lo stesso algoritmo.
7. misure meccaniche
-
Misure di rigidità e tensioni
- Eseguire un esperimento di oscillazione (punto 6.1) e l'analisi corrispondente (punto 6.3) del film lasso di tempo.
- La posizione di interfaccia
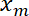 in funzione della posizione trappola
in funzione della posizione trappola  utilizzando Matlab trama funzione o qualsiasi dati tramando software.
utilizzando Matlab trama funzione o qualsiasi dati tramando software.
Nota: Questo dovrebbe essere approssimativamente lineare. - Eseguire un lineare adatta, utilizzando Matlab toolbox gratuito di "ezfit" o qualsiasi software permettendo si adatta. L'inverso della pendenza della fit fornisce il rapporto medio
 .
. - Eseguire stime dell'apparente rigidità alla flessione dell'interfaccia, che, supponendo che piccole deformazioni e un quadratica potenziali per il trapping, è dato da
 .
. 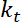 è la rigidità della trappola (vedere il passaggio 8 per la calibrazione di rigidità trappola).
è la rigidità della trappola (vedere il passaggio 8 per la calibrazione di rigidità trappola). - Eseguire stime di tensione, che può essere definito come23:
 .
.
-
Misure reologiche
- Eseguire esperimenti di pull rilascio (punto 6.2) e l'analisi corrispondente (punto 6.3)
- Misura la curva risultante con il modello reologico personalizzato.
8. calibrazione della rigidezza trappola
Nota: La determinazione delle forze assolute richiede la conoscenza della rigidezza trappola sulle interfacce. Questo può avvenire utilizzando perline attraverso una procedura in due fasi.
-
Determinazione della viscosità del citosol
- Posizionare gli embrioni in olio halocarbone e iniettare loro utilizzando un programma di installazione di microiniezione con perle di polistirolo fluorescente (1:1, 000 stock diluizione, 0,46 micron di diametro)23,27.
- Posizionare gli embrioni iniettati sotto il microscopio.
- Tracciare il movimento di singole perle trovato nel citosol. Estrarre lo spostamento quadratico di perline (utilizzare un gran numero di perle di traiettorie > 100). Determinare la costante di diffusione della perla dal versante dello spostamento quadratico. Concernente la costante diffusione viscosità mediante l'equazione di Stokes-Einstein, dedurre la viscosità effettiva del citosol. Nell'embrione precoce, una viscosità di circa 3,5 PA. s è segnalato23.
-
Determinazione della rigidità trappola su perline
- Trappola singole perline nel citosol con pinzette ottiche.
- Spostare il tallone in un modo graduale tra due posizioni di trappola separati da 0,5 µm
- Determinare la rigidezza di trappola perline, come il rapporto tra il coefficiente di resistenza aerodinamica e il tempo di rilassamento di tallone dalla posizione di una trappola per gli altri.
Nota: Il coefficiente di resistenza aerodinamica è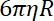 , dove
, dove 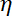 è la viscosità determinata (8.1) e
è la viscosità determinata (8.1) e  il raggio della perla. Il tempo di rilassamento è ottenuto dalle misure esponenziale della posizione della perla, utilizzando Matlab o qualsiasi software permettendo si adatta. I valori tipici della rigidezza trappola sono 120 ± 50-pN.µm-1 all'eccitazione di laser 200 mW.
il raggio della perla. Il tempo di rilassamento è ottenuto dalle misure esponenziale della posizione della perla, utilizzando Matlab o qualsiasi software permettendo si adatta. I valori tipici della rigidezza trappola sono 120 ± 50-pN.µm-1 all'eccitazione di laser 200 mW.
-
Determinazione della rigidità trappola su interfaccia cella
- Focalizzare il laser su una linea di contatto e deviare (come descritto nel passaggio 6). Misurare l'ampiezza di deformazione. Questo dovrebbe essere ripetuto su diverse linee di contatto per ottenere una media rappresentativa.
- Confrontare la deformazione prodotta con quella indotta da perline spinti contro linee di contatto. Poiché la deformazione è inversamente proporzionale alla rigidità della trappola, dedurre la rigidità di trappola sui contatti del cellulare.
Nota: La rigidità di trappola su contatti cellula era in genere trovata 2 - 3 volte più piccolo di quello sui branelli (0,46 micron di diametro).
Risultati
La figura 5 Mostra dati sperimentali ottenuti imponendo un movimento sinusoidale alla trappola. La trappola produce una deflessione dell'interfaccia, come esemplificato dai 3 istantanee risultati 3 successivi interfaccia posizioni (Figura 5A)23. Filmati registrati vengono utilizzati per generare un kymograph (figura 5B) e vengono ulteriormente analizzati per determinare la posizione dell'interfaccia con risoluzione dei subpixel, utilizzando una gaussiana in forma lungo la direzione x per ogni fotogramma. Nel regime di piccole deformazioni, le posizioni trappola e interfaccia sono proporzionali (Figura 5). L'ampiezza della deflessione interfaccia rispetto a quella della trappola (Figura 5) dà accesso alla tensione di interfaccia o rigidità (Vedi punto 7.1).
Figura 6 spettacoli dati sperimentali ottenuti eseguendo tirare esperimenti di rilascio. La trappola ottica è acceso circa 1 µm dal punto centrale dell'interfaccia tra due cellule, che provoca l'interfaccia deviare verso la trappola posizione (Figura 6A)24. La trappola è poi spento dopo il periodo di tempo desiderato. La xm posizione dell'interfaccia (Figura 6B) è ottenuto da chimografi (Figura 6), utilizzando nuovamente gaussiana si inserisce lungo la direzione x per ogni fotogramma. Il grafico risultante può essere paragonato al supposto modelli reologici, per esempio, un modello di Maxwell (Figura 6).
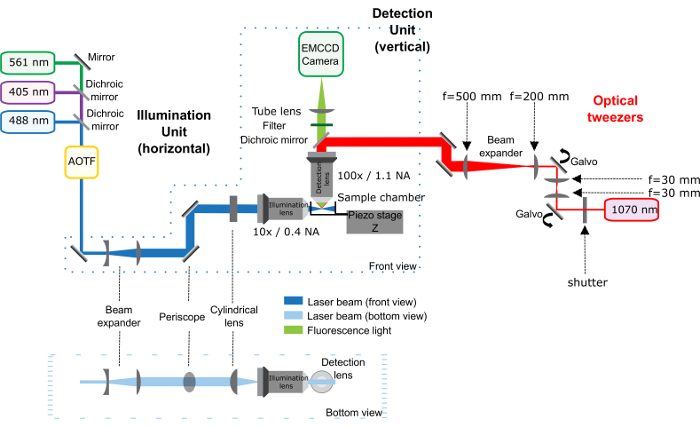
Figura 1: schema del setup pinzette ottiche (percorso rosso) combinato con il microscopio di foglio leggero. Questa figura è stata modificata da Bon, K. et al. 23. Il microscopio di foglio leggero, composto da unità di illuminazione e l'unità di rilevamento, è descritto in precedenza25. La pinzetta ottica corrisponda alla parte rossa dello schema: il laser infrarosso passa attraverso un otturatore ottico e 2 galvanometri che controllano la posizione della trappola nel campione. Un 1-fold telescopio viene inserito tra 2 galvanometri per mantenere la coniugazione tra di loro. Un telescopio aumenta la dimensione del raggio di 2,5 volte, quindi il periscopio porta all'altezza del microscopio. Il laser infrarosso entra l'obiettivo di rilevazione del microscopio grazie ad uno specchio dicroico. Importanti distanze tra gli elementi ottici sono date direttamente nella figura. Distanza tra l'ultima lente (lunghezza focale 500 mm) e l'apertura posteriore dell'obiettivo è 500 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: fissaggio allo specchio dicroico e lo specchio caldo fatto in casa Guida modificata. La rotaia di specchio dicroico del microscopio è stata tagliata sul lato sinistro per consentire l'ingresso del laser infrarosso. Lo specchio dicroico riflette la luce infrarossa e trasmette la luce visibile (fluorescenza). Clicca qui per visualizzare una versione più grande di questa figura.
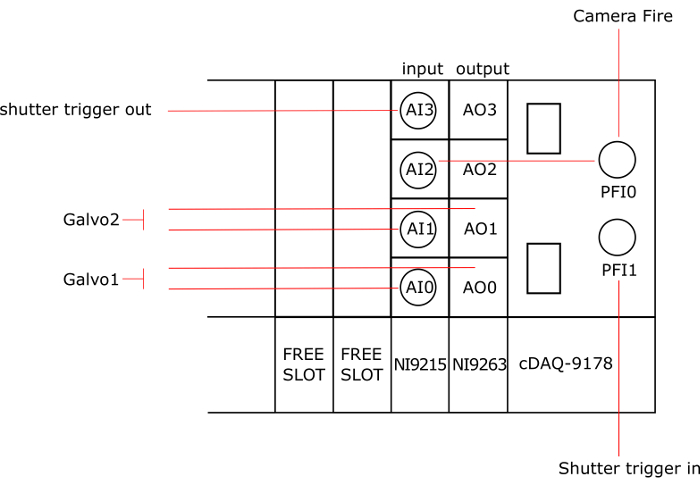
Figura 3: collegamento degli strumenti per le schede NI. AO: uscita analogica, AI: analog input, AO0 e AI0 connessi a galvo1, AO1 e AI1 connessi a galvo2, PFI0 è collegata al fuoco della telecamera, AI2 e PFI1 è collegato al grilletto dell'otturatore e AI3 è collegato al grilletto fuori l'otturatore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: supporto del campione nel contesto osservazione. Questa figura è stata modificata dal Chardès, C., et al. 25. gli embrioni sono immobilizzati su vetrino coprioggetti. La diapositiva è detenuta dal supporto del campione. Il portacampioni viene inserito nella provetta vetro, tenuta dal titolare fissato alla fase piezoelettrica. Il foglio leggero è orizzontale e illumina gli embrioni dal lato. L'obiettivo di rilevazione è verticale, sopra il campione e si tuffa nella cuvetta.
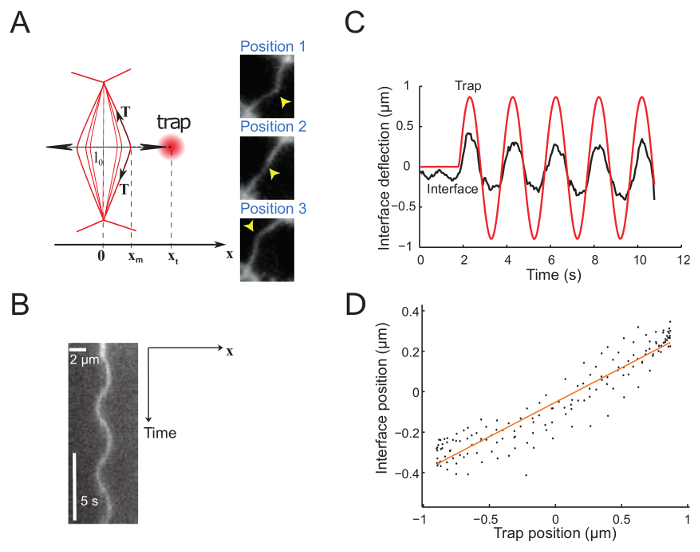
Figura 5: interfaccia deflessione imposte dal movimento sinusoidale della trappola. Questa figura è stata modificata da Bon, K. et al.23. (A) la trappola viene spostato sinusoidalmente perpendicolare all'interfaccia. Le posizioni trappola e interfaccia sono xt e xm, rispettivamente. I pannelli di destro mostrano tre immagini dell'interfaccia in posizioni diverse. La posizione di trappola laser è contrassegnata da una freccia gialla. Interfaccia sono etichettati con un marker di membrana (GAP43::mcherry). Kymograph (B) lungo l'asse definito dalla direzione del movimento trappola (perpendicolare all'interfaccia) (Period = 5 s). (C) rappresentante trama di deflessione rispetto al tempo mostrando sia trappola (linea tinta rossa) e posizioni di interfaccia (linea nera continua). Interfaccia (D) posizione in funzione della posizione di trappola durante alcuni cicli di oscillazione laser (ampiezza = 0,5 µm, periodo = 2 s). Clicca qui per visualizzare una versione più grande di questa figura.
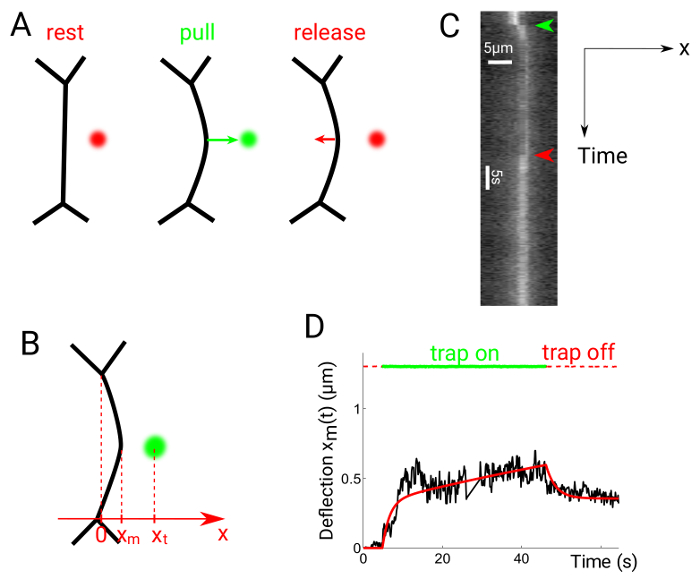
Figura 6: interfaccia deflessione negli esperimenti del pull-rilascio. Questa figura è stata modificata da Serge, r., et al. 24. (A), la trappola è acceso ad una distanza dal punto medio dell'interfaccia, poi nuovamente disattivata. (B) le posizioni trappola e interfaccia sono xt e xm, rispettivamente. Chimografi vengono generati lungo la direzione x, perpendicolare al punto medio della linea di contatto. Kymograph (C) di un esperimento di tiro-rilascio. Contatti cellula sono etichettati con Utrophin::GFP. (D) rappresentante trama di deflessione rispetto al tempo mostrando la trappola (linee punteggiate di rosso/verde) e posizione di interfaccia (linea nera continua). La solida linea rossa indica una misura ottenuta utilizzando un modello reologico Maxwell-come24. Clicca qui per visualizzare una versione più grande di questa figura.
Complementare Movie 1: Esperimento di tweezing. Dimensione pixel = 194 nm, 10 fps, periodo di oscillazione di trappola = 2 s, etichettatura: Gap43::mCherry. Per favore clicca qui per scaricare questo file.
Discussione
Pinzette ottiche permettono di effettuare misure meccaniche assolute direttamente nell'epitelio embrionale in via di sviluppo in maniera non invasiva. In questo senso, presenta vantaggi rispetto ad altri metodi, come l'ablazione laser, che sono invasive e forniscono misure relative, forze magnetiche, che richiedono iniezioni, o forzare l'inferenza, che si basa su ipotesi forte e anche forniscono relativa misurazioni.
Il protocollo comprende alcuni passaggi critici. In primo luogo, come la lente dell'obiettivo può mostrare le aberrazioni cromatiche e che il laser trappola spinge l'oggetto "a valle", è importante controllare che il laser IR intrappola il tallone nel piano imaging e alla fine corretto per esso (punto 2.18). In secondo luogo, il metodo si basa sulle misurazioni della posizione dei contatti delle cellule. È quindi cruciale utilizzare un marcatore fluorescente ad alto contrasto.
La qualità della lente dell'obiettivo e il raggio laser sono fondamentali per intrappolamento efficace. L'apertura numerica della lente dell'obiettivo deve superare 1,0. Se l'intrappolamento è inefficace, assicurarsi che il raggio laser riempie l'apertura posteriore dell'obiettivo.
Il nostro metodo è dotato di diverse limitazioni. In primo luogo, non è chiaro cosa esattamente fornisce il supporto per optical trapping. Anche se viene rilevata una mancata corrispondenza dell'indice di rifrazione, la sua origine rimane essere determinato. In secondo luogo, il processo di calibrazione, se uno è interessato a misure assolute, può essere un po' noioso, come richiede esperimenti microrheology passiva e calibrazione della rigidezza trappola sui branelli. È importante riconoscere che la calibrazione della rigidezza su contatti cellula è soggette a incertezza sperimentale: essa si basa sulle misurazioni della rigidezza trappola perline, che può essere misurato solo nel citosol, ma non vicino a contatti cellula. In terzo luogo, non è chiaro quanto possono essere versatile pinzette ottiche. Anche se sono in grado di deformare le cellule nell'embrione della drosofila , altri tessuti potrebbero presentare più alto tensionamento o più difficile accesso (ad esempio passando attraverso una cuticola) e quindi essere meno suscettibili di depilare ottico.
Le forze ottiche sono piccole (< poche decine di pN) e può così essere insufficiente per deformare strutture rigide o altamente tese. Pinzetta magnetica su particelle di grandi dimensioni sarebbe probabilmente più efficace in questo caso.
Abbiamo descritto qui l'accoppiamento delle pinzette ottiche al microscopio foglio leggero, ma Pinzetta ottica può essere accoppiata ad altri tipi di microscopi, ad esempio un epifluorescenza o un microscopio confocale filatura a disco. L'introduzione del laser IR intrappolamento nel microscopio dipende dalla configurazione microscopio. Richiede soprattutto la possibilità di aggiungere uno specchio dicroico per combinare i percorsi per la manipolazione di imaging e ottico. Maggior parte delle aziende di microscopia proporre sistemi di illuminazione modulare, con un modulo di due-strato, che permettono questa combinazione.
Diverse direzioni esistano per migliorare o aggiornare la tecnica. Una possibilità è quella di dividere il tempo di permanenza di laser tra diverse posizioni o per utilizzare le più avanzate tecniche olografiche, per produrre diverse trappole. Questo potrebbe consentire di creare modelli più complessi di forza su cellule bersaglio o contatti cellula. Un altro miglioramento potrebbe essere quello di progettare un feedback in tempo reale tra la deflessione causata e la posizione della trappola. Questo potrebbe consentire allo scorrimento corretto esperimenti in cui la forza applicata è mantenuta costante in tutto l'esperimento.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato da un FRM Equipe Grant FRM DEQ20130326509, Agence Nationale de la Recherche ANR-Blanc Grant, Morfor ANR-11-BSV5-0008 (a P.-F.L.). Riconosciamo la Francia-bioimmagini infrastruttura supportata dal French National Research Agency (ANR-10-INBS-04-01, «Investimenti per il futuro»). Ringraziamo Detailleur Brice e Claude Moretti dall'infrastruttura PICSL-FBI per l'assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| Ytterbium Fiber Laser LP, 10 W, CW | IPG Laser | YLM-10-LP-SC | including collimator LP : beam D=1.6 mm and red guide laser |
| Ø1/2" Optical Beam Shutter | Thorlabs | SH05 | |
| Small Beam Diameter Galvanometer Systems | Thorlabs | GVS001 | 1 for X displacement, 1 for Y displacement |
| 1D or 2D Galvo System Linear Power Supply | Thorlabs | GPS011 | galvanometers power supply |
| 2 lenses f = 30mm | Thorlabs | LB1757-B | relay telescope between 2 galva |
| Lens f = 200mm | Thorlabs | LB1945-B | 2.5X telescope |
| Lens f = 500mm | Thorlabs | LB1869-B | 2.5X telescope |
| Right-Angle Kinematic Elliptical Mirror Mount with Tapped Cage Rod Holes | Thorlabs | KCB1E | Periscope |
| Laser Safety Glasses, Light Green Lenses, 59% Visible Light Transmission, Universal Style | Thorlabs | LG1 | |
| 45° AOI, 50.0mm Diameter, Hot Mirror | Edmund Optics | #64-470 | |
| Multiphoton-Emitter HC 750/S | AHF | HC 750/SP | |
| CompactDAQ Chassis | National Instruments | cDAQ-9178 | |
| C Series Voltage Output Module | National Instruments | NI-9263 | Analog output module |
| C Series Voltage Input Module | National Instruments | NI-9215 | Analog input module |
| FluoSpheres Carboxylate-Modified Microspheres, 0.5 µm, red fluorescent (580/605), 2% solids | ThermoFisher Scientific | F8812 | calibration beads |
| C++ (Qt) home made optical tweezers software | developed by Olivier Blanc and Claire Chardès. Alternative solution: labview |
Riferimenti
- Lecuit, T., Lenne, P. -. F., Munro, E. Force generation, transmission, and integration during cell and tissue morphogenesis. Annual review of cell and developmental biology. 27 (1), 157-184 (2011).
- Heisenberg, C. -. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Sugimura, K., Lenne, P. -. F., Graner, F. Measuring forces and stresses in situ in living tissues. Development. 143 (2), 186-196 (2016).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in cell & developmental biology. 55, 119-130 (2016).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. Journal of Cell Biology. 149 (2), 471-490 (2000).
- Farhadifar, R., Roper, J. C., Aigouy, B., Eaton, S., Julicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Rauzi, M., Verant, P., Lecuit, T., Lenne, P. F. Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell biology. 10 (12), 1401-1410 (2008).
- Ma, X., Lynch, H. E., Scully, P. C., Hutson, M. S. Probing embryonic tissue mechanics with laser hole drilling. Physical Biology. 6 (3), 036004 (2009).
- Hutson, M. S., Tokutake, Y., et al. Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science. 300 (5616), 145-149 (2003).
- Bonnet, I., Marcq, P., Bosveld, F., Fetler, L., Bellaïche, Y., Graner, F. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface / the Royal Society. 9 (75), 2614-2623 (2012).
- Etournay, R., Popović, M., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current topics in developmental biology. 95, 93-144 (2011).
- Saha, A., Nishikawa, M., Behrndt, M., Heisenberg, C. -. P., Jülicher, F., Grill, S. W. Determining Physical Properties of the Cell Cortex. Biophysical journal. 110 (6), 1421-1429 (2016).
- Desprat, N., Supatto, W., Pouille, P. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental cell. 15 (3), 470-477 (2008).
- Mitrossilis, D., Röper, J. -. C., et al. Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation. Nature Communications. 8, 13883 (2017).
- Campàs, O., Mammoto, T., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2013).
- Serwane, F., Mongera, A., et al. In vivo quantification of spatially varying mechanical properties in developing tissues. Nature Methods. 14 (2), 181-186 (2017).
- Chiou, K. K., Hufnagel, L., Shraiman, B. I. Mechanical stress inference for two dimensional cell arrays. PLoS computational biology. 8 (5), e1002512 (2012).
- Ishihara, S., Sugimura, K. Bayesian inference of force dynamics during morphogenesis. Journal of theoretical biology. 313, 201-211 (2012).
- Brodland, G. W., Veldhuis, J. H., Kim, S., Perrone, M., Mashburn, D., Hutson, M. S. CellFIT: a cellular force-inference toolkit using curvilinear cell boundaries. PLoS ONE. 9 (6), e99116 (2014).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23, 247-285 (1994).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. -. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. , (2015).
- Clément, R., Dehapiot, B., Collinet, C., Lecuit, T., Lenne, P. -. F. Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis. Current biology: CB. 27 (20), (2017).
- Chardès, C., Ménélec, P., Bertrand, V., Lenne, P. -. F. Setting-up a simple light sheet microscope for in toto imaging of C. elegans development. Journal of visualized experiments. 87, e51342 (2014).
- Serge, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nature Methods. 5 (8), 687-694 (2008).
- Cavey, M., Lecuit, T. Imaging Cellular and Molecular Dynamics in Live Embryos Using Fluorescent Proteins. Drosophila. 420, 219-238 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon