Method Article
Palpage mécanique cellulaire avec des pinces optiques exempt de perle dans l’embryon de drosophile
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons un programme d’installation de pinces optiques couplées à un microscope de nappe de lumière et sa mise en œuvre pour sonder la mécanique cellulaire sans billes dans l’embryon de drosophile .
Résumé
Morphogenèse nécessite une coordination entre la structuration génétique et des forces mécaniques à façonner avec force les cellules et les tissus. Un défi de comprendre les processus morphogénétiques est donc de mesurer directement les forces cellulaires et propriétés mécaniques in vivo au cours de l’embryogenèse. Nous présentons ici une configuration de pinces optiques couplées à un microscope de nappe de lumière, qui permet d’appliquer directement les forces sur les contacts des cellules de l’embryon de drosophile au début, tout en imagerie à une vitesse de plusieurs images par seconde. Cette technique a l’avantage qu’il ne nécessite pas l’injection de perles dans l’embryon, habituellement utilisé comme sondes intermédiaires sur lequel sont exercent les forces optiques. Nous détailler étape par étape la mise en œuvre de l’installation et proposer des outils pour extraire des informations mécaniques à l’expérimentation. En surveillant les déplacements des contacts de cellules en temps réel, on peut effectuer des mesures de tension et d’enquêter sur la rhéologie des contacts cellule.
Introduction
Le développement embryonnaire est un processus hautement reproductible au cours de laquelle les cellules et les tissus se déforment pour façonner le futur animal. Ces déformations ont démontré que nécessitent la génération active des forces à la cellule de niveau1,2. Pour comprendre les processus morphogénétiques au cours de laquelle les cellules et les tissus changent leur forme, il est donc essentielle pour évaluer les propriétés mécaniques des cellules impliquées et pour mesurer les forces dans les tissus durant le processus3,4 . Les couches épithéliales, surtout chez la drosophile, ont été largement étudiés en raison de leur géométrie quasi-2D et à leur manipulation facile.
Un certain nombre de techniques ont donc été mis au point par nous et d’autres pour évaluer épithéliales mécanique in vivo au cours du développement. Nous allons donner un aperçu rapide des trois principales techniques utilisées dans les tissus épithéliaux. Ablation de laser, une méthode largement utilisée, permet de révéler les contraintes mécaniques locales à cellules jonctions5,6,7,8 , ou à plus grande échelle9,10,11 en effectuant des coupes locales qui perturbent l’intégrité mécanique de la cible. La dynamique de l’ouverture après la coupe fournit des informations sur l’ablation préalable de stress et sur la rhéologie des tissus12,13. L’inconvénient de l’ablation laser est qu’il est envahissante, car elle exige la perturbation locale du cortex cellulaire. Par conséquent, on ne peut effectuer un nombre limité d’ablations si l'on veut préserver l’intégrité des tissus. Un autre inconvénient est que les ablations seulement des estimations relatives de tension aux contacts cellulaires, puisque la vitesse d’ouverture dépend de frottement visqueux, ce qui n’est généralement pas connue. Manipulation magnétique a également été développée et utilisée chez la drosophile, impliquant l’utilisation de garnissages14 ou liposomes ultramagnetic15. Ils peuvent fournir des mesures absolues16,17, mais sont aussi envahissantes en ce sens qu’ils nécessitent l’injection des sondes à l’endroit désiré. Cela peut être très difficile selon le système, ce qui n’est pas toujours favorable aux injections précises. Une troisième technique, totalement non invasive, est force inférence18,19,20. Inférence de force repose sur l’hypothèse d’équilibre mécanique à triples points (jonctions tricellular, ou des sommets) et permet d’en déduire les tensions à toutes les cellules contacts (et éventuellement, les pressions dans toutes les cellules) de résoudre un problème inverse. Pour les tensions, chaque sommet a fournit deux équations (X et Y). Cela donne un grand système d’équations linéaires qui peuvent être inversés dans certaines conditions afin d’évaluer la tension à tous les contacts de la cellule. Alors que cette méthode est très séduisante, car elle ne nécessite seulement une image segmentée et aucune expérience supplémentaire ou configuration, sa précision est encore à déterminer, et encore une fois il fournit seulement des valeurs relatives, à moins qu’une mesure d’étalonnage absolu est effectuée.
Pour remédier à certaines de ces limitations, nous présentons dans cet article une configuration de pinces optiques couplée à un microscope de nappe de lumière pour appliquer des forces contrôlées à l’échelle de la cellule dans l’épithélium embryonnaire de Drosophila melanogaster. Des pinces optiques ont été utilisés pour de nombreuses applications biologiques, y compris les mesures sur des protéines simples et manipulation des cellules et organites21. Nous rapportons ici les forces appliquées dans l’ordre de quelques pN douzaines, ce qui est petit encore suffisant à provoquer des déformations locales de contacts cellule mécanique mesures in vivo. En général, nous utilisons déviation perpendiculaire des contacts cellulaires, surveillés par le biais de l’analyse de kymographs, faire le pour lien entre la force de déformation. Important, notre programme d’installation ne nécessite pas l’injection de perles à l’emplacement désiré dans le tissu, comme des pinces optiques sont en mesure d’exercer directement les forces de contacts cellule-cellule. L’accouplement des pinces optiques d’un microscope de nappe de lumière permet d’effectuer l’imagerie rapide (plusieurs images par seconde), qui est très appréciable pour une analyse mécanique à des échelles de temps court et avec la phototoxicité réduite, depuis l’éclairage de la échantillon est limitée au plan de l’imagerie22.
Pince à épiler dans l’ensemble, les optiques est un moyen non invasif d’appliquer des forces contrôlées aux contacts cellulaire in vivo chez l’embryon de drosophile et pour extraire des informations mécaniques tels que la rigidité et la tension à la cellule contacts23, propriétés rhéologiques 24et dégradé ou anisotropie de tension23.
Protocole
1. mise en place au Microscope de la nappe de lumière
- Se reporter à la description de l’installation dans la précédente publication25.
Remarque : L’installation est composée d’un stade de microscope vertical et un module de nappe de lumière produisant une nappe de lumière dans le plan horizontal. Une 10 X objectif d’excitation ordonne la nappe de lumière dans une cupule de verre (Figure 4). L’objectif de détection a une haute NA (1.1), qui est nécessaire pour efficace tweezing (voir ci-dessous).
2. configurer le chemin d’accès de pinces optiques
Remarque : La Figure 1 donne un régime général de la configuration optique.
- Placez l’appareil à laser 1070 nm et fixer la fibre sur la table optique avec une monture V-bride. S’assurer que le collimateur de la fibre est parallèle à la table optique (donc horizontal) et que la hauteur choisie ici sera à la hauteur de tous les composants optiques alignés sur la table optique.
Remarque : 100 mm peut être un bon choix pour cette hauteur. - Tourner la clé de l’unité de laser infrarouge et appuyez sur la touche « Select » pour activer le pointeur de l’alignement. La lumière doit être horizontal sortant de la fibre.
- Placer l’obturateur dans le chemin optique et le fixer à la table optique, afin que le faisceau laser infrarouge passe à travers l’ouverture de l’obturateur. Veiller à ce que la distance entre la table optique et le centre de l’ouverture de l’obturateur est la hauteur choisie à l’étape 2.1.
- Tourner la clé de la commande de l’obturateur, sélectionnez le mode manuel avec les flèches et appuyez sur le bouton « Activer » pour ouvrir l’obturateur.
- Placer, aligner et fixer le premier miroir du galvanomètre.
NOTE : Les deux miroirs du galvanomètre doivent se conjuguer à l’ouverture arrière de l’objectif de détection, afin que si un des miroirs est en rotation, le faisceau laser ne va pas sortir l’ouverture arrière de l’objectif. Notez que la distance entre le premier galvanomètre et l’ouverture arrière de l’objectif doit être calculé pour évaluer la position de cette galvanomètre par rapport à l’objectif (f1 + f1 + f2 + f2 + f3 + f3 + f4 + f4 = 30 + 30 + 30 + 30 + 30 + 200 + 200 + 500 + 500 = 1550 mm ; fi = distance focale de l’objectif n ° j’ai). - Allumez l’alimentation du galvanomètre. Assurez vous que les galvanomètres sont branchés pour le reste du protocole de l’alignement.
- Définir les galvanomètres à zéro la déflexion (NIMAX ou logiciel pince optique - Voir l’étape 3 pour les connexions de galvanomètre).
- Placer, aligner et fixer le télescope de relais composé de deux lentilles avec une focale de 30 mm.
- Placer, aligner et fixer le second miroir galvanomètre. Notez que la distance entre les deux galvanomètres est 4f = 4 x 30 mm = 120 mm (f = focale).
- Placer et fixer le télescope.
Remarque : Le télescope est composé de deux lentilles qui élargissent la poutre sur une largeur au moins égale au diamètre de l’ouverture arrière de la lentille de l’objectif. La lentille avec la plus petite focale doit venir en premier. - Placer, aligner et fixer le périscope portant vers le haut le chemin optique plus près à l’entrée du rail miroir dichroïque.
- Fixez le miroir chaud dans le rail, placer le rail au microscope. Veiller à ce que le rail est scié sur le côté droit afin de permettre l’entrée du laser infrarouge (Figure 2).
- Vérifiez que le faisceau laser se passe hors du microscope, tout d’abord sans l’objectif, puis avec l’objectif. Corriger la position du laser devant l’objectif avec le miroir du fond du périscope. Corriger la position du laser après l’objectif avec le haut de la page miroir du périscope.
- Mettre 1 µL de 500 perles fluorescentes nm dans le godet de verre et ajouter 10 mL d’eau distillée. Mettre la cuve au titre de l’objectif dans le support de cuve et régler la netteté de l’objectif (position Z) afin que l’objectif touche la surface de l’eau.
- Démarrez le logiciel maison acquisition contrôle l’AOTF, l’appareil photo et la scène piézoélectrique. Un logiciel gratuit comme micromanager est également utilisable. Activer le mode d’acquisition direct en appuyant sur le « Live » bouton.
- Ajuster la puissance du laser IR à 1 w.
-
Chaussez les lunettes (et ne le retirez pas avant la fin de l’expérience) et allumer le laser. Une perle doit être pris au piège à la mise au point du laser.
- Si aucune perle n’est emprisonné à la mise au point du laser, vérifier si le pointeur laser rouge (qui est colinéaire avec le laser IR) sort de l’objectif. Si non, recommencez les étapes de l’alignement, en particulier l’étape 2.13. Ou bien, augmenter la puissance du laser IR.
- Si le talon est coincé hors de discussion (de l’avion d’imagerie), déplacez doucement la position de la dernière lentille du dernier télescope (L4 dans la Figure 1) le long de l’axe optique pour amener le talon en bref avec le plan d’imagerie. Si ce n’est suffisant, déplacer l’objectif premier du dernier télescope (L3 dans la Figure 1) le long de l’axe optique.
- Si piégé perle n’est pas centré dans l’image, utilisez les miroirs 2 périscope pour ajuster la position de la trappe. Si la position du talon est modifiée en modifiant l’angle du premier miroir, également compenser la direction du faisceau en changeant l’angle correspondant du second miroir. Corriger la position de X seulement (1 vis de chaque rétroviseur), puis corrigez la position Y (1 vis de chaque rétroviseur).
- Si nécessaire, ajustez la position de la lentille 2nd de télescope pour observer le talon en bref.
- Si nécessaire, ajustez l’angle des miroirs périscope d’avoir le talon centré dans l’image.
3. l’Instrument d’interface
Remarque : La Figure 3 donne un schéma général des connexions carte de National Instruments (NI).
- Insérez la carte de sortie (NI-9263) dans le premier emplacement du châssis (cDAQ-9178). Notez que les autres modèles de cartes NI au moins 2 sorties analogiques et 3 entrées analogiques peuvent être utilisés.
- Insérez la carte d’entrée (NI-9215) dans la deuxième fente du châssis.
- Raccorder le premier galvanomètre à l’analogique sortie AO0 et l’AI0 d’entrée analogique avec câbles BNC. Notez qu’un adaptateur T permet de connecter 2 câbles BNC à l’un. Consultez le manuel de galvanomètre à localiser les broches sur la carte de conducteur du galvanomètre.
- De la même manière, connectez le deuxième galvanomètre à AO1 et AI1.
- Se connecter PFI1 à la IN de déclenchement de l’obturateur (dos du contrôleur).
- Connecter PFI0 à l’incendie de la caméra et à AI2.
- Branchez AI3 sur le déclenchement de l’obturateur (dos du contrôleur).
- Ajustez les réglages du contrôleur d’obturation. Utilisez les flèches pour modifier les valeurs de paramètre et appuyez sur le bouton « Select » pour valider le choix et passer au paramètre suivant. Mettre le paramètre « temps ouvert sec » à 000.000, le « temps fermé sec » à 000.000, le « mode » d’unique et « déclencheur » EXT. autoriser le contrôle de l’obturateur en appuyant sur le bouton « Activer ».
- Ouvrir Qt Creator (téléchargé à partir https://www.qt.io/, version gratuite).
NOTE : Qt Creator est l’environnement de développement intégré utilisé pour développer en C++, le logiciel de pinces optiques. Bibliothèque Qt est utilisé ici pour créer des widgets. - Ouvrez le fichier OT.pro (fourni dans les fichiers de code Qt). Cette action ouvre le projet. Changer le nom de l’entrée et la sortie dans le fichier de AOGenerator.cpp selon les cartes de crédit NI utilisé.
- Compilez et exécutez le logiciel de l’OT.
4. étalonnage de la Position du piège optique avec perles
-
Enregistrement d’un film de calibration
- Mettre 1 µL de 500 perles fluorescentes nm rouge dans la cuve de verre, puis remplir la cuvette avec 10 mL d’eau distillée. La figure 4 donne une vue de la cuvette dans le contexte de l’observation.
- Fixer la cuvette sur la scène piézoélectrique.
- Ajustez la position Z de la cuvette afin que l’objectif de détection plonge dans l’eau.
- Allumer le laser infrarouge et régler la puissance de 1 w.
- Activer le logiciel d’acquisition image.
- Pour acquérir des images, sélectionnez la durée d’exposition, le gain, le temps entre deux images, le nombre d’images à acquérir et la puissance du laser. Notez que pour l’étalonnage de pince optique avec des perles, l’illumination laser (561 nm) n’est pas nécessaire. L’effet 2 photons induit par le laser infrarouge est suffisant pour exciter la fluorescence d’un boudin piégé.
- Démarrez le logiciel maison de pinces optiques.
- Définissez les paramètres de pinces optiques pour tracer un cercle. Définir SamplingRate comme 250 samp/s, bufferSize que 1000, Waveform1 paramètres (galvo 1) sinusoïdal, nbPeriod 1, amplitude de 0,5 V, phase 0.0 rad, Offset 0,0 V, forme d’onde 2 paramètres (galvo 2) as sinusoïdal, nbPeriod 1, amplitude de 0,5 V, phase 1,57 rad, Offset 0,0 V.
- Vérifier la boîte « Paramètres AI » et le « Wait for il »... boîte.
- Démarrer l’acquisition d’images (500 ou 1000 images avec une fréquence d’images élevée, par exemple de 10 images par seconde).
- Allumez les pinces optiques en appuyant sur le bouton « Générer ! ».
- Laisser le talon piégé à remplir au moins deux cercles complets et arrêter les pinces optiques par non urgents le « Generating ! » bouton.
- Arrêter l’acquisition de l’image. Notez qu’un film de tiff et un fichier texte avec des tensions de galvanomètre sont créés par défaut « C:/TEMP / » dossier (sauf si un emplacement personnalisé est spécifié). Notez que plusieurs films de calibrage avec les fichiers de données associés peuvent être créés si nécessaire.
- Si le cercle n’est pas complète, le talon est perdu au cours de la trajectoire du cercle. Peut-être que la vitesse est trop élevée. Il diminue en diminuant le taux d’échantillonnage dans le logiciel de l’OT. Ou, en utilisant le pointeur laser rouge du laser infrarouge, vérifier si le laser est sortant de l’objectif au cours de la trajectoire de l’ensemble du cercle. Si ce n’est pas le cas, les miroirs du galvanomètre ne peuvent pas se conjuguer avec le plan arrière focal de l’objectif. Corriger les positions des galvanomètres en ce qui concerne le plan arrière focal de l’objectif, recommencer les étapes de l’alignement de l’étape 2.5.
- Sur les amplitudes de zéro et allumer le laser pour piéger une perle à une position fixe. Placez un point de repère à l’emplacement du piège.
-
Interpolation de la position avec analyse d’image
- Ouvrir Matlab, allez dans le dossier de l’étalonnage et exécuter le script « position2tension » (fourni dans les fichiers de code Matlab). Ce script calcule la fonction d’interpolation traduisant les tensions de galvanomètre à position piège optique.
- Choisissez que le nombre de films de calibration sera utilisé. Plusieurs films sont sélectionnables avec des trajectoires différentes, comme les deux ellipses perpendiculaires. Généralement, un film de calibrage unique avec une trajectoire circulaire est suffisant.
- Fournir la première et la dernière image dans la boîte de dialogue (boîte de dialogue un seul par film), les numéros des séquences avec une trajectoire claire et un bon rapport signal sur bruit.
- Fournir le chemin d’accès du fichier texte contenant les tensions lors de l’acquisition pour chaque film. Notez que le script lit le fichier et calcule la tension moyenne des deux galvanomètres pour chaque image.
- Fournir le chemin d’accès du film d’étalonnage correspondantes.
Remarque : Le script détecte le talon de chaque image avec une résolution de sous-pixel en ajustant une gaussienne 2D à la perle, à l’aide des fonctions personnalisées et des fonctions extraites de MTT26. Il affiche un graphique montrant la trajectoire de la bille. - Éliminer tout point mal détecté (valeurs aberrantes) en cliquant dessus.
- Vérifiez si l’interpolation carte pour x et y des positions laser calculée et affichée par le script, est terminée. S’il y a beaucoup de valeurs manquantes (régions blanches dans le plan), répéter l’opération avec un nouveau film de calibration, avec un meilleur rapport signal sur bruit, ou / et avec une vitesse plus lente des galvanomètres.
NOTE : Ces images et les valeurs d’interpolation sont automatiquement enregistrés dans le même dossier que l’image, avec le nom convertFct.mat.
5. montage des embryons de drosophile 27
- Recueillir des embryons de drosophile dans une cage, incubée à 25 ° C.
- Supprimer la levure, en passant le contenu de l’assiette à travers un tamis (taille des pores devrait être environ 100 µm).
- Lavez les embryons avec 100 % de Javel (hypochlorite de sodium de 2,6 %) pour 45 s pour enlever le chorion.
- Lavez les embryons avec de l’eau pendant 2 min.
- Mettre les embryons sur une garniture de gélose avec une brosse.
- Choisir environ 10 embryons selon l’étape désirée et aligner les embryons avec une pique ou un pinceau humide.
Remarque : L’alignement doit être réalisée selon la région d’intérêt (région d’intérêt aussi près que possible de l’objectif de détection). - À l’aide d’un diamant-marqueur, couper un morceau d’une lame de verre de 10 x 20 x 1 mm3.
- Ajouter la colle sur un côté de la pièce coupée et laisser sécher pendant 20 s.
- Retournez la pièce coupée et placez-le sur la ligne d’embryons, s’en tenir à la pointe de la lame.
- Installer cette préparation dans le porte-échantillon et le placer dans la cuve. La figure 4 donne une vue de la cuvette dans le contexte de l’observation.
- Mettre la cuve sur la scène piézoélectrique.
6. piégeage expérience In Vivo
-
Piégeage des contacts cellulaires — oscillations (Figure 5)
- Recherchez l’emplacement d’intérêt dans le tissu.
Remarque : À l’aide de mouches dans lequel sont marqués les cadhérines peut être utile si on a besoin de travailler dans le plan des jonctions adherens. - Déplacer le point médian de la jonction de cible sur la position du siphon (point de repère défini à l’étape 4.1.14) à l’aide de l’étape de piezo.
- Définissez les paramètres de piège pour atteindre les oscillations perpendiculaires à la ligne de contact. Définir les phases comme zéro. Définir les amplitudes en X et Y directions pour avoir un mouvement perpendiculaire à la ligne de contact. L’amplitude doit être généralement 0,1 V.
- Démarrer l’acquisition (avec une fréquence d’images rapide, par exemple de 10 images par seconde).
- Mettez les pinces optiques en appuyant sur le bouton « Générer ! ».
- Une fois terminé, éteignez l’acquisition d’image pincettes et arrêt. Un film et un fichier texte contenant des tensions galvanomètre lors de l’acquisition doivent maintenant apparaître dans le dossier spécifié.
- Piégeage des contacts cellulaires — tirez-libération (Figure 6)
- Recherchez l’emplacement d’intérêt dans le tissu.
- Déplacer la jonction de la cible à l’aide de l’étape de piezo afin que son point médian est typiquement de 1 µm écarter de la position de piège (point de repère défini à l’étape 4.1.14).
- Les amplitudes la valeur 0 pour avoir un piège stable.
- Démarrer l’acquisition d’images (avec une fréquence d’images rapide, par exemple de 10 images par seconde).
- Mettez les pinces optiques en appuyant sur le bouton « Générer ! ».
- Après le temps désiré, éteignez le piège et attendre pour se détendre, de se produire.
- Arrêter l’acquisition de l’image. Un film et un fichier texte contenant des tensions galvanomètre lors de l’acquisition doivent maintenant apparaître dans le dossier spécifié.
- Recherchez l’emplacement d’intérêt dans le tissu.
-
Kymographes semi-automatique génération et détection de la position de l’interface.
- Dans la fenêtre de commande de Matlab, charger la carte d’interpolation générée pendant la procédure d’étalonnage (4 b) : load('convertFct.mat'). Ceci fournit les variables fx et fy.
- Dans la fenêtre de commande Matlab, exécutez autokymo(fx,fy), fournies dans les fichiers de code Matlab. Le but de cette fonction est de générer un kymographes le long de la trajectoire du laser et pour détecter la position de la ligne de contact avec une résolution de sous-pixel pour chaque image.
- Sélectionnez le chemin d’accès de message texte contenant les valeurs de tension.
- Sélectionnez les numéros de la première et la dernière image du film à analyser.
- Sélectionnez le fichier de film tiff. Deux nouveaux chiffres apparaît : le premier est une image de la kymographes. Le second est un graphique de la détection des positions ligne et laser contact, par rapport au nombre d’image.
Remarque : La fonction enregistre le graphique représentant la position de l’échantillon et la position du laser versus le nombre d’image (figure matlab, jpg), le kymographes (image tiff) et le kymographes avec la position du laser (image tiff). Pour des expériences de piège constant, le kymographes doit être fait manuellement, par exemple à l’aide de ImageJ. La détection de l’interface de le kymographes peut alors se faire en utilisant le même algorithme.
7. mécaniques mesures
-
Mesures de la rigidité et la tension
- Effectuer une expérience d’oscillation (étape 6.1) et de l’analyse correspondante (étape 6.3) du film time lapse.
- Tracer la position de l’interface
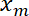 en fonction de la position de piège
en fonction de la position de piège  à l’aide de la fonction de tracé de Matlab ou d’autres données logiciel de traçage.
à l’aide de la fonction de tracé de Matlab ou d’autres données logiciel de traçage.
Remarque : Cela devrait être approximativement linéaire. - Effectuer un linéaire s’adapter, à l’aide de la boîte à outils Matlab « ezfit » gratuit ou tout autre logiciel permettant des ajustements. L’inverse de la pente de la fit fournit le rapport moyen
 .
. - Effectuer des estimations de l’apparente rigidité en flexion de l’interface, qui, en supposant que potentiel pour le piégeage, petites déformations et une quadratique est donnée par
 .
. 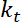 est la raideur du piège (Voir l’étape 8 pour l’étalonnage de rigidité de piège).
est la raideur du piège (Voir l’étape 8 pour l’étalonnage de rigidité de piège). - Effectuer des estimations de tension, qui peut être défini comme23:
 .
.
-
Mesures rhéologiques
- Effectuer des expériences de libération pull (étape 6.2) et l’analyse correspondante (étape 6.3)
- Ajustement de la courbe obtenue avec le modèle rhéologique personnalisé.
8. étalonnage de la raideur de piège
Remarque : La détermination des forces absolues nécessite la connaissance de la raideur de piège sur les interfaces. C’est accessible à l’aide de perles grâce à une procédure en deux étapes.
-
Détermination de la viscosité du cytosol
- Placez les embryons dans Huilehalocarbone et injecter à l’aide d’un programme d’installation de microinjection avec des billes de polystyrène fluorescent (1:1, 000 stock dilution, 0,46 µm de diamètre)23,27.
- Placer les embryons injectées sous le microscope.
- Suivre le mouvement des perles unique trouvé dans le cytosol. Extraire le déplacement quadratique moyenne des perles (utiliser un grand nombre de trajectoires > 100 perles). Déterminer la constante de diffusion de perle de la pente du déplacement quadratique moyenne. De la constante de diffusion viscosité par l’équation de Stokes-Einstein, déduire la viscosité apparente du cytosol. Dans l’embryon précoce, environ 3,5 Pa.s de viscosité est signalée23.
-
Détermination de la rigidité du piège sur perles
- Piège à billes unique dans le cytosol avec pinces optiques.
- Déplacer les billes de façon progressive entre deux positions de piège séparées par 0,5 µm
- Déterminer la raideur de piège sur perles, comme le rapport entre le coefficient de traînée et le temps de relaxation perle postées à un piège à l’autre.
Remarque : Le coefficient de traînée est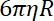 , où
, où 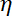 est la viscosité déterminée (8.1) et
est la viscosité déterminée (8.1) et  le rayon de la perle. Le temps de relaxation est obtenu à partir de crises exponentielles de la position de la perle, à l’aide de Matlab ou n’importe quel logiciel permettant des ajustements. Les valeurs typiques de la raideur de piège sont 120 ± 50 pN.µm-1 à l’excitation de laser 200 mW.
le rayon de la perle. Le temps de relaxation est obtenu à partir de crises exponentielles de la position de la perle, à l’aide de Matlab ou n’importe quel logiciel permettant des ajustements. Les valeurs typiques de la raideur de piège sont 120 ± 50 pN.µm-1 à l’excitation de laser 200 mW.
-
Détermination de la rigidité du piège sur l’interface de la cellule
- Concentrer le laser sur une ligne de contact et dévier (comme décrit à l’étape 6). Mesurer l’amplitude de déformation. Cela doit être répété sur plusieurs lignes de contact pour obtenir une moyenne représentative.
- Comparer la déformation produite avec celle induite par les perles poussés contre les lignes de contact. Étant donné que la déformation est inversement proportionnelle à la rigidité du piège, déduire la rigidité piège sur les contacts de la cellule.
NOTE : La rigidité du piège sur contacts cellule a été trouve généralement 2 à 3 fois plus petit que celui sur perles (0,46 µm de diamètre).
Résultats
La figure 5 montre les données expérimentales obtenues en imposant un mouvement sinusoïdal à la trappe. Le piège produit une déviation de l’interface, comme en témoigne les 3 clichés montrant 3 interface successifs postes (Figure 5 a)23. Films enregistrés sont utilisés pour générer un kymographes (Figure 5 b) et sont plus analysées afin de déterminer la position de l’interface avec une résolution de sous-pixel, utilisant une gaussienne monter le long de l’axe des x pour chaque image. Dans le régime des petites déformations, les positions du piège et l’interface sont proportionnelles (Figure 5). L’amplitude de la déflexion de l’interface par rapport à celui de la trappe (Figure 5) permet d’accéder à la tension d’interface ou de la rigidité (voir étape 7.1).
Expériences de sortie figure 6 spectacles expérimentaux obtenus à la suite de tirer. Le piège optique est allumé environ 1 µm loin le point médian de l’interface entre deux cellules, ce qui provoque l’interface dévier vers le piège position (Figure 6 a)24. Le piège est alors éteint après le temps désiré. La xm de la position de l’interface (Figure 6 b) est obtenu à partir de kymographs (Figure 6), à l’aide de Gauss s’insère le long de l’axe des x pour chaque image. Le graphique qui en résulte peut être comparé à l’hypothèse des modèles rhéologiques, par exemple, un modèle de Maxwell (Figure 6).
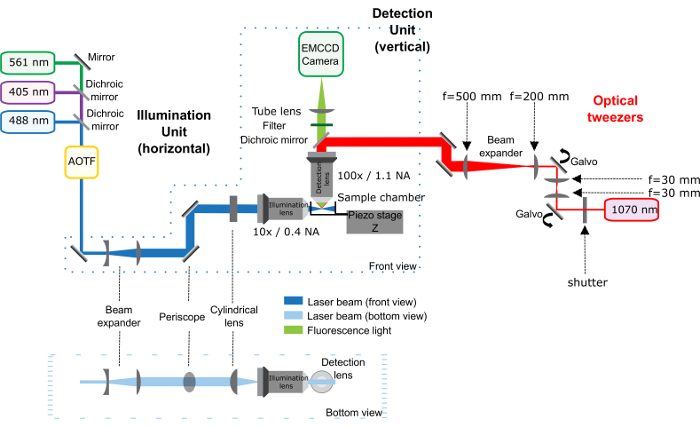
Figure 1 : schéma de l’installation de pinces optiques (tracé rouge) combiné avec le microscope de la nappe de lumière. Ce chiffre a été modifié par Bauchet, K. et al. 23. Le microscope de la nappe de lumière, composé par le dispositif d’éclairage et de l’unité de détection, est décrite précédemment25. Les pinces optiques correspondent à la partie rouge du régime : le laser infrarouge passe à travers un obturateur optique et 2 galvanomètres qui contrôlent la position de la trappe dans l’échantillon. Un 1-fold télescope est placé entre les 2 galvanomètres à garder la conjugaison entre eux. Ensuite, un télescope augmente la taille de la poutre par 2,5 fois et le périscope, il apporte à la hauteur du microscope. Le laser infrarouge pénètre dans l’objectif de la détection du microscope grâce à un miroir dichroïque. Des distances importantes entre les éléments optiques sont donnés directement dans la figure. Distance entre la dernière lentille (longueur focale 500 mm) et l’ouverture arrière de l’objectif est 500 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : maison mis à jour le chemin de fer tenant le miroir dichroïque et le miroir chaud. Le rail de miroir dichroïque du microscope a été coupé sur le côté gauche pour permettre l’entrée du laser infrarouge. Le miroir reflète la lumière infrarouge et transmet la lumière visible (fluorescence). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
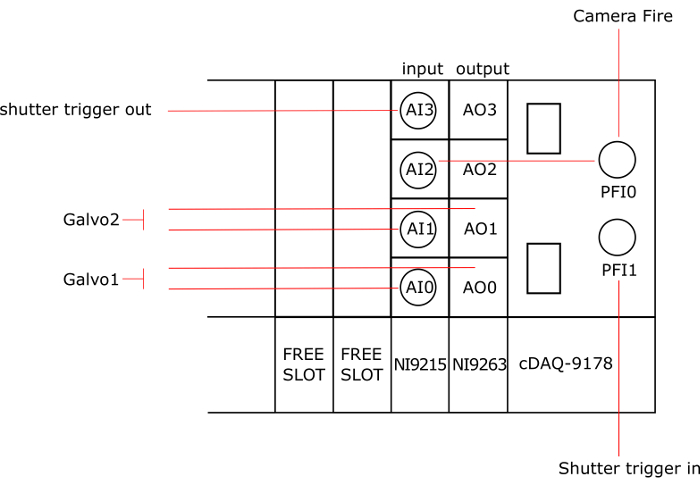
Figure 3 : connexion des instruments aux cartes NI. AO : analog output, AI : entrée analogique, AO0 et AI0 sont connectés à galvo1, AO1 et AI1 sont connectés à galvo2, PFI0 est reliée à l’incendie de la caméra, AI2 et PFI1 est relié à la détente dans de l’obturateur et AI3 est relié au déclencheur de l’obturateur. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : porte-échantillon dans le contexte de l’observation. Ce chiffre a été modifié par Chardès, C., et al. 25. les embryons sont immobilisées sur la lamelle de verre. La diapositive est détenue par le porte-échantillon. Le porte-échantillon est inséré dans la cuve de verre, détenue par le détenteur fixé au stade piézoélectrique. La nappe de lumière est horizontal et illumine les embryons du côté. L’objectif de détection est verticale, au-dessus de l’échantillon et plonge dans la cuve.
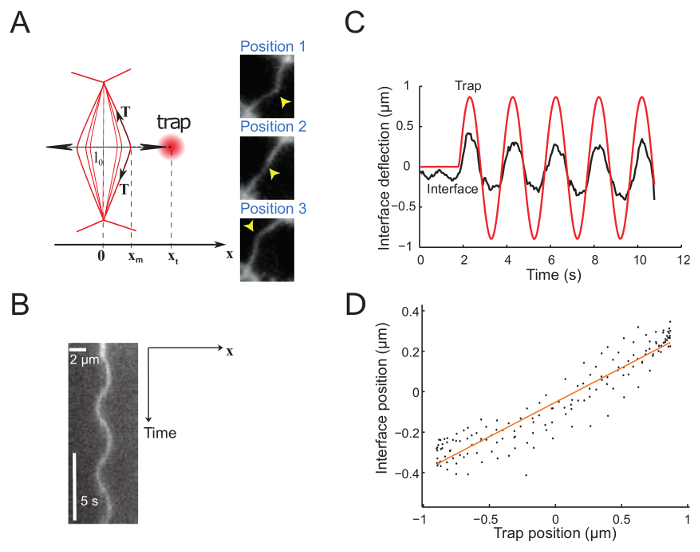
Figure 5 : Interface déformation imposée par un mouvement sinusoïdal de la trappe. Ce chiffre a été modifié par Bauchet, K. et al.,23. (A), le piège est déplacé sinusoïdalement perpendiculaire à l’interface. Les positions du piège et l’interface sont xt et xm, respectivement. Les panneaux de droite montrent trois images de l’interface à des positions différentes. La position de trap laser est indiquée par une flèche jaune. Interface sont pourvus d’un marqueur de la membrane (GAP43::mcherry). Kymographes (B) le long de l’axe défini par la direction du mouvement de piège (perpendiculaire à l’interface) (= durée 5 s). (C) représentant terrain de déviation par rapport au temps montrant le piège (ligne rouge) et les positions de l’interface (ligne noire épaisse). (D) Interface du poste en fonction de la position de piège pendant quelques cycles d’oscillation laser (Amplitude = 0,5 µm, période = 2 s). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
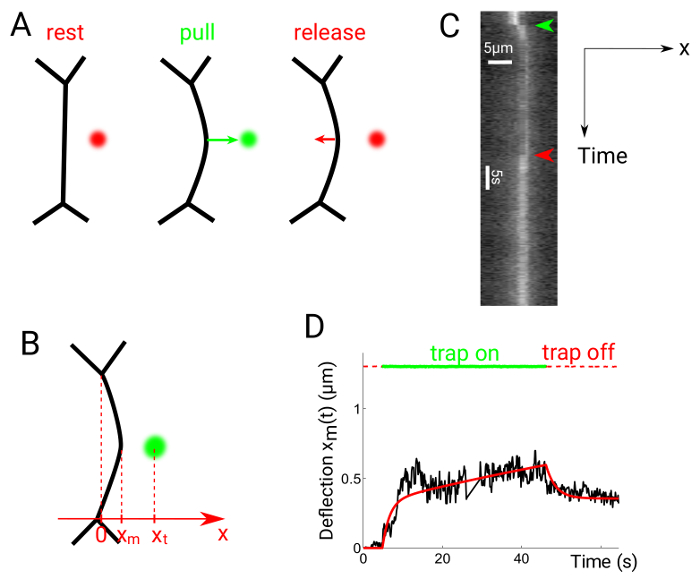
Figure 6 : déviation dans les expériences de traction-version de l’Interface. Ce chiffre a été modifié par Serge, A., et al. 24. (A), le piège est mis en marche à distance du point médian de l’interface, puis éteint à nouveau. (B) les positions de piège et l’interface sont xt et xm, respectivement. Kymographs sont produites le long de l’axe x, perpendiculaire au milieu de la ligne de contact. (C) kymographes d’une expérience de libération tirer. Contacts de la cellule sont pourvus d’Utrophin::GFP. (D) le terrain représentatif de déviation par rapport au temps montrant le piège (lignes pointillées de rouge/vert) et position de l’interface (ligne noire épaisse). La ligne rouge pleine indique un ajustement obtenu à l’aide d’un modèle rhéologique de Maxwell-type24. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Film supplémentaire 1 : Tweezing experiment. Taille du pixel = 194 nm, 10 ips, période d’oscillation de piège = 2 s, étiquetage : Gap43::mCherry. S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Des pinces optiques permettent d’effectuer des mesures mécaniques absolues directement dans l’épithélium en développement embryonnaire d’une manière non invasive. En ce sens, elle présente des avantages par rapport aux autres méthodes telles que l’ablation de laser, qui sont envahissantes et fournissent des mesures relatives, les forces magnétiques, qui nécessitent des injections, ou forcer l’inférence, qui repose sur des hypothèses et également fournissent relative mesures.
Le protocole comprend quelques étapes cruciales. Tout d’abord, comme la lentille d’objectif peut montrer les aberrations chromatiques et que le piège laser exécute un push de l’objet « en aval », il est important de vérifier que le laser IR intercepte le talon dans le plan d’imagerie et finalement correct pour elle (étape 2.18). Deuxièmement, la méthode s’appuie sur les mesures de position des contacts de la cellule. Il est donc essentiel d’utiliser un marqueur fluorescent de contraste élevé.
La qualité de la lentille de l’objectif et le faisceau laser sont essentiels au piégeage efficace. L’ouverture numérique de l’objectif devrait dépasser 1.0. Si le piégeage est inefficace, assurez-vous que le faisceau laser remplit l’ouverture arrière de la lentille de l’objectif.
Notre méthode est livré avec plusieurs limitations. Tout d’abord, il n’est pas clair ce qui exactement fournit le support pour le piégeage optique. Bien qu’un décalage d’indice de réfraction est détecté, son origine reste à déterminer. En second lieu, le processus d’étalonnage, si on s’intéresse à des mesures absolues, peut être un peu fastidieux, car il nécessite des expériences microrhéologie passive et étalonnage de la raideur de piège sur des billes. Il est important de reconnaître que le calibrage de la rigidité sur contacts cellule est sujette à l’incertitude expérimentale : elle s’appuie sur des mesures de la rigidité de piège à billes, qui peut être mesurée que dans le cytosol, mais pas à proximité de contacts cellule. Troisièmement, on ne sait pas comment les pinces optiques polyvalents peuvent être. Bien qu’ils sont capables de se déformer les cellules dans l’embryon de drosophile , autres tissus pourraient présenter une tension plus élevée ou plus difficiles d’accès (par exemple, en passant par une cuticule) et donc être moins sensible aux tweezing optique.
Optiques forces sont petites (< quelques dizaines de pN) et peut être donc insuffisante pour déformer les structures rigides ou très tendus. Pince magnétique sur les grosses particules serait probablement plus efficace dans ce cas.
Nous décrivons le couplage des pinces optiques d’un microscope de nappe de lumière, mais des pinces optiques peuvent être couplés à d’autres types de microscopes, par exemple une épifluorescence ou un microscope de disque de rotation confocal. L’introduction du laser IR piégeage dans le microscope dépend de la configuration de microscope. Elle exige surtout la possibilité d’ajouter un miroir dichroïque pour combiner les chemins d’accès pour la manipulation optique et d’imagerie. La plupart des compagnies de microscopie proposent des systèmes d’éclairage modulaire, avec un module de deux couches, qui permettent cette combinaison.
Plusieurs directions existent pour améliorer ou mettre à niveau de la technique. Une possibilité consisterait à diviser le temps de séjour de laser entre plusieurs postes ou pour utiliser plusieurs avancées techniques holographiques, pour produire plusieurs pièges. Cela pourrait permettre de créer des motifs plus complexes de force sur les cellules cibles ou contacts cellule. Une autre amélioration consisterait à concevoir une rétroaction en temps réel entre la déformation provoquée et la position de la trappe. Cela pourrait permettre de fluage bonne expériences dans lequel la force appliquée est maintenue constante pendant toute l’expérience.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par une Equipe de FRM Grant FRM DEQ20130326509, Agence Nationale de la Recherche ANR-Blanc Grant, Morfor ANR-11-BSV5-0008 (à la P.-F.L.). Nous reconnaissons l’infrastructure France-BioImaging pris en charge par le Français National Research Agency (ANR-10-INBS-04-01, « Investissements d’avenir »). Nous remercions Brice Detailleur et Claude Moretti de l’infrastructure de PICSL et le FBI pour l’assistance technique.
matériels
| Name | Company | Catalog Number | Comments |
| Ytterbium Fiber Laser LP, 10 W, CW | IPG Laser | YLM-10-LP-SC | including collimator LP : beam D=1.6 mm and red guide laser |
| Ø1/2" Optical Beam Shutter | Thorlabs | SH05 | |
| Small Beam Diameter Galvanometer Systems | Thorlabs | GVS001 | 1 for X displacement, 1 for Y displacement |
| 1D or 2D Galvo System Linear Power Supply | Thorlabs | GPS011 | galvanometers power supply |
| 2 lenses f = 30mm | Thorlabs | LB1757-B | relay telescope between 2 galva |
| Lens f = 200mm | Thorlabs | LB1945-B | 2.5X telescope |
| Lens f = 500mm | Thorlabs | LB1869-B | 2.5X telescope |
| Right-Angle Kinematic Elliptical Mirror Mount with Tapped Cage Rod Holes | Thorlabs | KCB1E | Periscope |
| Laser Safety Glasses, Light Green Lenses, 59% Visible Light Transmission, Universal Style | Thorlabs | LG1 | |
| 45° AOI, 50.0mm Diameter, Hot Mirror | Edmund Optics | #64-470 | |
| Multiphoton-Emitter HC 750/S | AHF | HC 750/SP | |
| CompactDAQ Chassis | National Instruments | cDAQ-9178 | |
| C Series Voltage Output Module | National Instruments | NI-9263 | Analog output module |
| C Series Voltage Input Module | National Instruments | NI-9215 | Analog input module |
| FluoSpheres Carboxylate-Modified Microspheres, 0.5 µm, red fluorescent (580/605), 2% solids | ThermoFisher Scientific | F8812 | calibration beads |
| C++ (Qt) home made optical tweezers software | developed by Olivier Blanc and Claire Chardès. Alternative solution: labview |
Références
- Lecuit, T., Lenne, P. -. F., Munro, E. Force generation, transmission, and integration during cell and tissue morphogenesis. Annual review of cell and developmental biology. 27 (1), 157-184 (2011).
- Heisenberg, C. -. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Sugimura, K., Lenne, P. -. F., Graner, F. Measuring forces and stresses in situ in living tissues. Development. 143 (2), 186-196 (2016).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in cell & developmental biology. 55, 119-130 (2016).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. Journal of Cell Biology. 149 (2), 471-490 (2000).
- Farhadifar, R., Roper, J. C., Aigouy, B., Eaton, S., Julicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Rauzi, M., Verant, P., Lecuit, T., Lenne, P. F. Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell biology. 10 (12), 1401-1410 (2008).
- Ma, X., Lynch, H. E., Scully, P. C., Hutson, M. S. Probing embryonic tissue mechanics with laser hole drilling. Physical Biology. 6 (3), 036004 (2009).
- Hutson, M. S., Tokutake, Y., et al. Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science. 300 (5616), 145-149 (2003).
- Bonnet, I., Marcq, P., Bosveld, F., Fetler, L., Bellaïche, Y., Graner, F. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface / the Royal Society. 9 (75), 2614-2623 (2012).
- Etournay, R., Popović, M., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current topics in developmental biology. 95, 93-144 (2011).
- Saha, A., Nishikawa, M., Behrndt, M., Heisenberg, C. -. P., Jülicher, F., Grill, S. W. Determining Physical Properties of the Cell Cortex. Biophysical journal. 110 (6), 1421-1429 (2016).
- Desprat, N., Supatto, W., Pouille, P. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental cell. 15 (3), 470-477 (2008).
- Mitrossilis, D., Röper, J. -. C., et al. Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation. Nature Communications. 8, 13883 (2017).
- Campàs, O., Mammoto, T., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2013).
- Serwane, F., Mongera, A., et al. In vivo quantification of spatially varying mechanical properties in developing tissues. Nature Methods. 14 (2), 181-186 (2017).
- Chiou, K. K., Hufnagel, L., Shraiman, B. I. Mechanical stress inference for two dimensional cell arrays. PLoS computational biology. 8 (5), e1002512 (2012).
- Ishihara, S., Sugimura, K. Bayesian inference of force dynamics during morphogenesis. Journal of theoretical biology. 313, 201-211 (2012).
- Brodland, G. W., Veldhuis, J. H., Kim, S., Perrone, M., Mashburn, D., Hutson, M. S. CellFIT: a cellular force-inference toolkit using curvilinear cell boundaries. PLoS ONE. 9 (6), e99116 (2014).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23, 247-285 (1994).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. -. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. , (2015).
- Clément, R., Dehapiot, B., Collinet, C., Lecuit, T., Lenne, P. -. F. Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis. Current biology: CB. 27 (20), (2017).
- Chardès, C., Ménélec, P., Bertrand, V., Lenne, P. -. F. Setting-up a simple light sheet microscope for in toto imaging of C. elegans development. Journal of visualized experiments. 87, e51342 (2014).
- Serge, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nature Methods. 5 (8), 687-694 (2008).
- Cavey, M., Lecuit, T. Imaging Cellular and Molecular Dynamics in Live Embryos Using Fluorescent Proteins. Drosophila. 420, 219-238 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon