Method Article
Sondando a célula mecânica com pinça óptica de grânulo-livre no embrião da drosófila
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Apresentamos uma instalação da pinça óptica acoplada a um microscópio de folha de luz e a sua aplicação a sonda mecânica de células sem grânulos no embrião da drosófila .
Resumo
Morfogênese requer a coordenação entre a padronização genética e forças mecânicas para robustamente moldar as células e tecidos. Portanto, um desafio para compreender processos morfogenéticas é diretamente medir forças celulares e propriedades mecânicas na vivo durante a embriogênese. Aqui, apresentamos uma instalação da pinça óptica acoplada a um microscópio de folha de luz, que permite aplicar diretamente as forças em contatos do celular do embrião da drosófila , enquanto imagens a uma velocidade de vários quadros por segundo. Esta técnica tem a vantagem que não exige a injeção de grânulos para o embrião, normalmente usado como sondas intermediárias no qual forças ópticas são exercidas. Nós detalhe passo a passo a execução da instalação e propor ferramentas para extrair informações mecânicas das experiências. Ao monitorar os deslocamentos de contatos do celular em tempo real, um pode executar medições de tensão e investigar a reologia dos contatos do celular.
Introdução
Desenvolvimento embrionário é um processo altamente reprodutível, durante o qual as células e os tecidos se deformam para moldar o futuro animal. Tais deformações foram mostradas para exigir a geração ativa de forças no celular nível1,2. Para compreender processos morfogenéticas, durante o qual as células e tecidos mudam a sua forma, é, portanto, chave para avaliar as propriedades mecânicas das células envolvidas e para medir as forças dentro do tecido durante o processo de3,4 . Epitelial, especialmente em Drosophila, têm sido amplamente estudados devido a sua geometria quase-2D e à sua fácil manipulação.
Um número de técnicas, portanto, foram desenvolvido por nós e outros para avaliar mecânica epitelial na vivo durante o desenvolvimento. Vamos dar uma rápida visão geral dos três principais técnicas usadas em tecidos epiteliais. Ablação a laser, um método amplamente usado, permite revelar o estresse mecânico local na célula junções5,6,7,8 ou em maior escala9,10,11 através da realização de cortes locais que interrompem a integridade mecânica do alvo. A dinâmica da abertura do corte a seguir fornece informações tanto na ablação prévia de stress e sobre a reologia do tecido12,13. Uma desvantagem da ablação a laser é que é invasivo, como exige a ruptura local do córtex celular. Daí, um só pode executar um número limitado de ablações se você quiser preservar a integridade do tecido. Outra desvantagem é que ablações só fornecem estimativas relativas da tensão em contatos de celular, desde que a velocidade de abertura depende de atrito viscoso, o que geralmente não é conhecido. Manipulação magnética também foi desenvolvida e usada em Drosophila, envolvendo o uso de Ferrofluidos14 ou lipossomas ultramagnetic15. Eles podem fornecer medições absolutas16,17, mas também são invasoras no sentido de que eles requerem a injeção de sondas no local desejado. Isto pode ser muito complicado dependendo do sistema, que não é sempre passível de injeções precisas. Uma terceira técnica, totalmente não-invasivo, é força inferência18,19,20. Força de inferência se baseia na suposição de equilíbrio mecânico em pontos triplos (fialoconídios entroncamentos ou vértices) e permite inferir as tensões em todos os celular contatos (e possivelmente, pressões em todas as células) por resolver um problema inverso. Para tensões, cada vértice fornece duas equações (X e Y). Isso resulta em um grande sistema de equações lineares que pode ser invertido sob algumas condições para avaliar a tensão em todos os contatos do celular. Enquanto este método é muito atraente, como não exige somente uma imagem segmentada e nenhuma experiência extra ou instalação, sua precisão é ainda a determinar, e novamente apenas fornece valores relativos, a menos que uma medida absoluta da calibração é executada.
Para superar algumas destas limitações, apresentamos neste artigo uma instalação da pinça óptica acoplado a um microscópio de luz folha aplicar forças controladas na escala celular no epitélio embrionário da Drosophila melanogaster. Pinça óptica têm sido utilizada para numerosas aplicações biológicas, incluindo as medições em proteínas simples e manipulação de células e organelas21. Aqui, nós relatamos as forças aplicadas na faixa de uns dúzia de pN, que é pequena, ainda suficientes para induzir deformações locais de contatos do celular e realizar medições mecânicas na vivo. Normalmente, usamos perpendicular deflexão de contatos do celular, monitorada através da análise de kymographs, para relacionar força-deformação. Importante, nossa configuração não exige a injeção de grânulos no local desejado no tecido, como Pinça óptica é capaz de exercer directamente forças nos contatos do celular. A atrelar a Pinça óptica para um microscópio de luz folha permite realizar imagens rápidas (vários quadros por segundo), que é muito sensível para uma análise mecânica em escalas de tempo curto e com reduzida fototoxicidade, desde a iluminação da amostra é limitada ao plano da imagem latente de22.
Globalmente, ópticas pinças são uma maneira não-invasiva para aplicar forças controladas em contatos do celular em in vivo, o embrião da drosófila e extrair informações mecânicas, tais como rigidez e tensão na célula contatos23, propriedades reológicas 24e gradiente ou anisotropia da tensão23.
Protocolo
1. criar o microscópio de luz folha
- Consulte a descrição da instalação anterior publicação25.
Nota: A instalação é composta de uma fase de microscópio vertical e um módulo de folha de luz, produzindo uma folha de luz no plano horizontal. Uma excitação da lente objetiva de 10x direciona a folha de luz em uma cubeta de vidro (Figura 4). A deteção da lente objetiva tem um alto at (1.1), que é necessário para o eficiente tweezing (veja abaixo).
2. criar o caminho de Pinça óptica
Nota: A Figura 1 dá um esquema geral da instalação do óptico.
- A unidade de laser 1070 nm e fixar a fibra na tabela óptica com um monte de V-braçadeira. Certifique-se de que o colimador de fibra é paralelo à tabela óptica (daí, horizontal) e que a altura selecionada aqui será a altura para todos os componentes ópticos alinhados na tabela óptica.
Nota: 100 mm pode ser uma boa escolha para esta altura. - Gire a chave da unidade de laser infravermelho e pressione o botão "Select" para ativar o ponteiro de alinhamento. A luz tem que ser a saída horizontal da fibra.
- Coloque o botão do obturador no caminho óptico e fixá-la à tabela óptica, para que o feixe de laser infravermelho passa através da abertura do obturador. Certifique-se de que a distância entre a mesa óptica e o centro da abertura do obturador é a altura escolhida no passo 2.1.
- Gire a chave do controlador do obturador, selecione o modo manual com as setas e pressione o botão "Enable" para abrir o obturador.
- Coloque, alinhar e corrigir o primeiro espelho do galvanômetro.
Nota: Os dois espelhos de galvanômetro precisa ser conjugada com a abertura traseira do objectivo da deteção, de modo que quando um dos espelhos é giro, o feixe de laser não fora a abertura traseira do objectivo. Note que a distância entre o primeiro galvanômetro e a abertura traseira do objectivo tem deve ser calculado para avaliar a posição deste galvanômetro em relação ao objectivo (f1 + f1 + f2 + f2 + f3 + f3 + f4 + f4 = 30 + 30 + 30 + 30 + 30 + 200 + 200 + 500 + 500 = 1550 mm; fi = distância focal da lente n ° eu). - Ligue a fonte de alimentação do galvanômetro. Certifique-se de que o Galvanómetro é movido para o resto do protocolo de alinhamento.
- Definir o Galvanómetro de zero deflexão (com NIMAX ou pinça óptica software - consulte a etapa 3 para conexões do galvanômetro).
- Coloque, alinhar e consertar o telescópio de relé, composto de duas lentes com uma distância focal de 30 mm.
- Coloque, alinhar e corrigir o segundo espelho do galvanômetro. Observe que a distância entre o dois Galvanómetro é 4f = 4 x 30 mm = 120 mm (f = distância focal).
- Colocar e fixar o telescópio.
Nota: O telescópio é composto de duas lentes que ampliam o feixe para uma largura de pelo menos igual ao diâmetro da abertura traseira da lente da objetiva. A lente com a menor distância focal deve vir em primeiro lugar. - Coloque, alinhar e corrigir o periscópio trazendo para cima o caminho óptico mais perto da entrada do trilho de espelho dicroico.
- Fixar o espelho quente no trilho, coloque o trilho no microscópio. Certifique-se de que o trilho está serrado no lado direito, para permitir a entrada do laser infravermelho (Figura 2).
- Verifica que a luz do laser está saindo o microscópio, primeiro sem o objetivo, em seguida, com o objetivo. Corrija a posição do laser antes o objectivo com o espelho de fundo do periscópio. Corrija a posição do laser após o objectivo com o espelho superior de periscópio.
- Colocar 1 µ l de beads fluorescente de 500 nm em cubeta de vidro e adicionar 10 mL de água destilada. Colocar a cubeta no âmbito do objectivo no suporte de cubeta e ajustar o foco do objetivo (posição Z) para que o objetivo toca a superfície da água.
- Inicie o software de aquisição caseiro controlando o AOTF, a câmera e o palco piezoelétrico. Também pode ser usado um software livre, como micromanager. Ligue o modo de aquisição ao vivo pressionando o botão "Live".
- Ajustar o poder do laser do IR para 1 w.
-
Ponha os óculos (e não removê-lo antes do final do experimento) e ligue o laser. Uma pérola deve ser preso no foco do laser.
- Se nenhum grânulo é prendido no foco do laser, verifique se o ponteiro laser vermelho (que é colinear com o laser IR) está saindo o objetivo. Se não, comece de novo as etapas de alinhamento, em especial passo 2.13. Ou, aumentar a potência do laser do IR.
- Se o grânulo é prendido fora de foco (do avião de imagem), movimente suavemente a posição da última lente dos últimos ao longo do eixo óptico para trazer o talão em foco com o avião da imagem latente do telescópio (L4 na Figura 1). Se não for suficiente, mover a primeira lente do último ao longo do eixo óptico do telescópio (L3 na Figura 1).
- Se encurralado grânulo não está centralizado na imagem, use os 2 periscópio espelhos para ajustar a posição da armadilha. Se a posição do cordão de é alterado mudando o ângulo do espelho primeiro, também compensa a direção do feixe, alterando o ângulo correspondente do segundo espelho. Corrija a posição de X somente (1 parafuso para cada mirror) e, em seguida, corrija a posição Y (1 parafuso para cada espelho).
- Se necessário, ajuste a posição da lente 2nd telescópio para observar o talão em foco.
- Se necessário, ajuste o ângulo dos espelhos periscópio para ter o talão centrado na imagem.
3. o instrumento de interface
Nota: Figura 3 dá um esquema geral das conexões cartão de instrumentos nacionais (NI).
- Insira o cartão de saída (NI-9263) no primeiro slot do chassis (cDAQ-9178). Note-se que outros modelos de cartas de NI, com pelo menos 2 saídas analógicas e 3 entradas analógicas podem ser usados.
- Insira o cartão de entrada (NI-9215) no segundo slot do chassi.
- Conectar o galvanômetro primeiro para o analógico AO0 e o AI0 entrada analógica com cabos BNC de saída. Observe que um adaptador T pode ser usado para conectar 2 cabos BNC para um. Consulte o manual do galvanômetro para localizar os pinos na placa de driver do galvanômetro.
- Da mesma forma, conecte o galvanômetro segundo AO1 e AI1.
- Conecte o PFI1 ao IN disparador do obturador (parte traseira do controlador).
- Ligue PFI0 para o fogo da câmera e ao AI2.
- AI3 Conecte o disparador do obturador (parte traseira do controlador).
- Ajuste as definições do controlador do obturador. Use as setas para alterar os valores de parâmetro e pressione o botão "Select" para validar a escolha e passar para o próximo parâmetro. Colocar o parâmetro "tempo aberto Seg" de 000.000, "segundo tempo fechado" de 000.000, "modo" SINGLE, e "gatilho" EXT. permitir o controle do obturador pressionando o botão "Ativar".
- Abra o QtCreator (descarregado a partir https://www.qt.io/, versão gratuita).
Nota: QtCreator é o ambiente de desenvolvimento integrado usado para desenvolver em C++, o software da pinça óptica. A biblioteca QT é usada aqui para criar widgets. - Abra o arquivo OT.pro (fornecido nos arquivos de código de Qt). Esta ação abrirá o projeto. Alterar o nome de entrada e de saída no arquivo AOGenerator.cpp de acordo com a placa (s) NI usado.
- Compilar e executar o software de OT.
4. calibração da posição armadilha óptica com miçangas
-
Gravação de um filme de calibração
- Colocar 1 µ l de 500 contas de nm vermelho fluorescente na cubeta de vidro e, em seguida, encher a cubeta com 10 mL de água destilada. A Figura 4 oferece uma vista a cubeta no contexto de observação.
- Corrigi a cubeta no palco piezoelétrico.
- Ajuste a posição de Z da cubeta para que o objetivo da deteção mergulha na água.
- Ligue o laser infravermelho e ajustar a potência de 1 w.
- Ative o software de aquisição de imagem.
- Para adquirir imagens de lapso de tempo, selecione o tempo de exposição, o ganho, o tempo entre duas imagens, o número de imagens a serem adquiridos e a potência do laser. Observe que, para a calibração de Pinça óptica com miçangas, a iluminação laser (561 nm) não é necessária. O efeito de 2-fóton induzido pelo laser infravermelho é suficiente para excitar a fluorescência de um preso do grânulo.
- Inicie o software caseiro Pinça óptica.
- Defina os parâmetros de Pinça óptica para traçar um círculo. Definir taxa amostragem como samp 250/s, o bufferSize como 1000, Waveform1 parâmetros (galvo 1) como Sinusoidal, nbPeriod 1, amplitude 0.5 V, fase rad 0.0, 0.0 V, parâmetros de forma de onda 2 (galvo 2) deslocamento como Sinusoidal, nbPeriod 1, amplitude 0.5 V, fase 1,57 rad, deslocamento 0,0 V.
- Verifique a caixa de "Parâmetros de AI" e o "esperar"... caixa.
- Inicie a aquisição de imagens (500 ou 1000 imagens com uma taxa de quadros alta, tais como 10 fps).
- Ligue a Pinça óptica, pressionando o botão "Gerar"!.
- Permitir que o grânulo preso completar pelo menos dois círculos completo e parar a Pinça óptica por un-pressionar o "gerar"! botão.
- Impedir a aquisição de imagem. Observe que um filme de tiff e um arquivo de texto com tensões de galvanômetro são criados no padrão "c: / TEMP /" pasta (a menos que um local personalizado é especificado). Observe que vários filmes de calibração com arquivos de dados associados podem ser criados, se necessário.
- Se o círculo não está completo, o grânulo é perdido durante a trajetória do círculo. Talvez a velocidade é muito alta. Diminuí-la, diminuindo a taxa de amostragem no software do OT. Ou, usando o ponteiro laser vermelho do laser infravermelho, verifique se o laser está saindo o objetivo durante a trajetória do círculo inteiro. Se não, os galvanômetro espelhos não podem ser conjugados com o plano de volta focal da lente da objetiva. Corrigi as posições do galvanómetro em relação ao plano focal volta do objectivo, começando novamente as etapas de alinhamento da etapa 2.5.
- Defina as amplitudes para zero e ligue os lasers para interceptar uma pérola em uma posição de correção. Coloque um marco na localidade de armadilha.
-
Interpolação de posição com análise de imagem
- Abrir o Matlab, vá para a pasta de calibração e executar o script "position2tension" (fornecido em arquivos de código Matlab). Este script calcula a função de interpolação traduzir tensões galvanômetro para posição de armadilha óptica.
- Escolha que o número de filmes de calibração será usado. Vários filmes podem ser selecionados com trajetórias diferentes, tais como duas elipses perpendiculares. Geralmente, um filme único de calibração com uma trajectória circular é o suficiente.
- Fornecer a primeira e a última imagem na caixa de diálogo (uma caixa de diálogo por filme), números de sequências com uma trajetória clara e bom sinal à relação de ruído.
- Forneça o caminho do arquivo de texto contendo as tensões durante a aquisição para cada filme. Note que o script lê o arquivo e calcula as médios tensões do dois Galvanómetro de cada imagem.
- Forneça o caminho do filme calibração correspondentes.
Nota: O script detecta o talão para cada frame com uma resolução de subpixel por encaixe um Gaussian 2D para o grânulo, usando funções personalizadas e extraído MTT26. Ele exibe um gráfico que mostra a trajetória do grânulo. - Elimine qualquer ponto mal detectado (outliers) clicando nele.
- Verifique se a interpolação mapear para x e y do laser posições calculado e exibido pelo script, é completa. Se há um monte de valores ausentes (regiões brancas no mapa), repita a operação com um novo filme de calibração, com um melhor sinal à relação de ruído, ou / e com uma velocidade mais lenta do galvanómetro.
Nota: Estas imagens e os valores de interpolação são salvas automaticamente na mesma pasta que a imagem, com o nome convertFct.mat.
5. montagem de embriões de Drosophila 27
- Coletar embriões da drosófila de uma gaiola, incubada a 25 ° C.
- Remover o fermento, passando o conteúdo da placa através de uma peneira (o tamanho dos poros deve ser cerca de 100 µm).
- Lave os embriões com lixívia de 100% (2,6% de hipoclorito de sódio) para 45 s para remover o córion.
- Lave os embriões com água por 2 min.
- Colocar os embriões em uma almofada de ágar com um pincel.
- Selecione a cerca de 10 embriões de acordo com o ponto desejado e alinhar os embriões com um pique ou um pincel úmido.
Nota: O alinhamento deve ser feito de acordo com a região de interesse (região de interesse mais próximo possível do objectivo de deteção). - Usando uma caneta de diamante-marcação, corte um pedaço de uma lâmina de vidro de 10 x 20 x 1 mm3.
- Adicionar a cola em um lado da peça cortada e deixe secar por 20 s.
- Vire o pedaço e coloque-o na linha de embriões, para colá-la na borda do slide.
- Instalar esta preparação em porta-amostras e coloque dentro da cubeta. A Figura 4 oferece uma vista a cubeta do contexto de observação.
- Colocar a cubeta no palco piezoelétrico.
6. prendendo o experimento In Vivo
-
Aprisionando os contatos do celular — oscilações (Figura 5)
- Encontre o local de interesse no tecido.
Nota: Usar moscas no qual as caderinas são rotuladas pode ser útil se um precisa trabalhar no plano dos adherens cruzamentos. - Mover o ponto central da junção alvo na posição de armadilha (Marco definido no passo 4.1.14) usando o palco de piezo.
- Defina os parâmetros de armadilha para atingir as oscilações perpendiculares à linha de contato. Defina as fases como zero. Definir as amplitudes em X e Y-direções para ter um movimento perpendicular à linha de contato. Normalmente, a amplitude deve ser 0,1 V.
- Inicie a aquisição (com uma taxa de quadros rápido, tais como 10 fps).
- Ligue a Pinça óptica pressionando o botão "Gerar"!.
- Quando terminar, desligue a aquisição de imagens de pinças e parar. Um filme e um arquivo de texto contendo as tensões do galvanômetro durante a aquisição agora devem aparecer na pasta especificada.
- Aprisionando os contatos do celular — puxe-lançamento (Figura 6)
- Encontre o local de interesse no tecido.
- Mova a junção de destino usando o palco piezo para que seu ponto médio é tipicamente 1 µm da posição do armadilha (Marco definido no passo 4.1.14).
- Defina as amplitudes como 0 para ter uma armadilha constante.
- Inicie a aquisição de imagem (com uma taxa de quadros rápido, tais como 10 fps).
- Ligue a Pinça óptica pressionando o botão "Gerar"!.
- Após o tempo desejado, desligue a armadilha e espere para um relaxamento para ocorrer.
- Impedir a aquisição de imagem. Um filme e um arquivo de texto contendo as tensões do galvanômetro durante a aquisição agora devem aparecer na pasta especificada.
- Encontre o local de interesse no tecido.
-
Geração kymograph semiautomático e detecção de posição de interface.
- Na janela de comando do Matlab, carregar o mapa de interpolação gerado durante o processo de calibração (4b): load('convertFct.mat'). Isto fornece as variáveis fx e fy.
- Na janela de comando do Matlab, execute autokymo(fx,fy), fornecido nos arquivos de código Matlab. O objetivo desta função é gerar um kymograph ao longo da trajetória do laser e para detectar a posição da linha de contato com resolução de subpixel para cada quadro.
- Selecione o caminho do arquivo de texto solicitado que contém os valores de tensão.
- Selecione os números do primeiro e último quadro do filme para ser analisado.
- Selecione o arquivo de filme de tiff. Dois novos números serão exibidos: O primeiro é uma imagem do kymograph. O segundo é um gráfico da detecção das posições laser e linha de contato, versus o número de imagem.
Nota: A função salva o gráfico que representa a posição da amostra e a posição do laser versus o número de imagem (figura do matlab, jpg), o kymograph (imagem tiff) e o kymograph com a posição do laser (imagem tiff). Para experiências armadilha constante, o kymograph tem que ser feito manualmente, por exemplo usando o ImageJ. A detecção de interface a partir do kymograph então pode ser feita usando o mesmo algoritmo.
7. mecânicas medições
-
Medições de tensão e rigidez
- Realize um experimento de oscilação (etapa 6.1) e a correspondente análise (etapa 6.3) do filme de lapso de tempo.
- Plotar a posição de interface
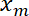 em função da posição de armadilha
em função da posição de armadilha  usando Matlab função de trama ou quaisquer dados software de plotagem.
usando Matlab função de trama ou quaisquer dados software de plotagem.
Nota: Isto deve ser aproximadamente linear. - Execute um linear caber, usando Matlab "ezfit" enciclopédia ferramentas ou qualquer software, permitindo que se encaixa. O inverso da inclinação do fit fornece a relação média
 .
. - Realizar estimativas da aparente rigidez de dobra da interface, que, assumindo uma função quadrática e pequenas deformações potenciais para a captura, é dada por
 .
. 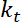 é a rigidez da armadilha (consulte a etapa 8 para calibração de rigidez armadilha).
é a rigidez da armadilha (consulte a etapa 8 para calibração de rigidez armadilha). - Realize estimativas de tensão, que pode ser definido como23:
 .
.
-
Medições reológicas
- Realizar experimentos de lançamento de tração (passo 6.2) e a análise correspondente (etapa 6.3)
- Ajuste a curva resultante com o modelo reológico personalizado.
8. calibração de rigidez a armadilha
Nota: A determinação das forças absolutas requer o conhecimento da rigidez de armadilha em interfaces. Isto pode ser acessado usando contas através de um procedimento em duas etapas.
-
Determinação da viscosidade citosol
- Coloque os embriões em óleo halocarbono e injetá-las usando uma configuração de microinjeção com esferas de poliestireno fluorescente (1:1, 000 diluição, 0,46 µm de diâmetro)23,27.
- Coloque os embriões injetados sob o microscópio.
- Acompanhar o movimento dos grânulos único encontrado no citosol. Extraia o deslocamento quadrado médio dos grânulos (usar um grande número de grânulos de trajetórias > 100). Determine a constante de difusão do grânulo de encosta do deslocamento quadrada. Relacionando a constante de difusão a viscosidade pela equação de Stokes-Einstein, deduza a viscosidade efetiva do citosol. O embrião, uma viscosidade de aproximadamente 3,5 PA. s é relatado23.
-
Determinação da rigidez de armadilha em grânulos
- Armadilha único grânulos no citoplasma com pinça óptica.
- Mova o talão de uma forma gradual entre duas posições de armadilha separadas por 0,5 µm
- Determine a rigidez de armadilha em grânulos, como a relação entre o coeficiente de arrasto e o tempo de relaxação de grânulo de posição de uma armadilha para o outro.
Nota: O coeficiente de arrasto é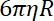 , onde
, onde 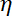 é a viscosidade determinada em (8.1) e
é a viscosidade determinada em (8.1) e  o raio do grânulo. O tempo de relaxamento é obtido a partir de exponenciais ajustes da posição do grânulo, usando Matlab ou qualquer software, permitindo que se encaixa. Valores típicos da rigidez de armadilha são 120 ± 50 pN.µm-1 na excitação de laser 200 mW.
o raio do grânulo. O tempo de relaxamento é obtido a partir de exponenciais ajustes da posição do grânulo, usando Matlab ou qualquer software, permitindo que se encaixa. Valores típicos da rigidez de armadilha são 120 ± 50 pN.µm-1 na excitação de laser 200 mW.
-
Determinação da rigidez da armadilha na interface celular
- Foco do laser em uma linha de contacto e desviá-lo (conforme detalhado na etapa 6). Medir a amplitude de deformação. Isto deve ser repetido em várias linhas de contato para obter uma média representativa.
- Compare a deformação produzida com isso induzida por grânulos empurrados contra as linhas de contato. Uma vez que a deformação é inversamente proporcional à rigidez da armadilha, deduza a rigidez de armadilha em contatos do celular.
Nota: A rigidez de armadilha em contatos do celular foi tipicamente encontrada 2 - a 3 vezes menor do que em grânulos (0,46 µm de diâmetro).
Resultados
A Figura 5 mostra os dados experimentais obtidos através da imposição de um movimento senoidal para a armadilha. A armadilha produz uma deflexão da interface, como exemplificado por 3 instantâneos mostrando 3 interface sucessivas posições (Figura 5A)23. Filmes gravados são usados para gerar um kymograph (Figura 5B) e ainda mais são analisados para determinar a posição da interface com resolução de subpixel, usando um Gaussian cabe ao longo da direção x para cada quadro. No regime de pequenas deformações, as posições de armadilha e interface são proporcionais (Figura 5). A amplitude da deflexão de interface em relação da armadilha (Figura 5) que dá acesso para a interface tensão ou rigidez (ver passo 7.1).
A Figura 6 mostra os dados experimentais obtidos através da realização de tração liberar experimentos. A armadilha óptica é ligada aproximadamente 1 µm longe do ponto médio da interface entre duas células, o que faz com que a interface desviar para a armadilha de posição (figura 6A)24. A armadilha então desliga-se após o tempo desejado. O posição xm da interface (Figura 6B) é obtido a partir de kymographs (Figura 6), novamente usando o Gaussian cabe ao longo da direção x para cada quadro. O gráfico resultante pode ser comparado com a hipótese de modelos reológicos, por exemplo, um modelo de Maxwell (Figura 6).
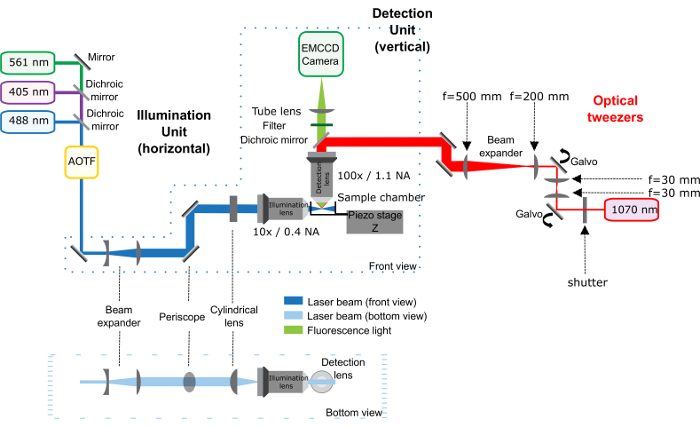
Figura 1: esquema de instalação a Pinça óptica (caminho vermelho) combinado com o microscópio de luz folha. Esta figura foi modificada de Bambardekar, K. et al . 23. O microscópio de folha de luz, composto pela unidade de iluminação e a unidade da deteção, é descrito anteriormente,25. A Pinça óptica corresponde a parte vermelha do regime: O laser infravermelho atravessa um obturador óptico e 2 Galvanómetros que controlam a posição da armadilha na amostra. Um 1-fold telescópio é colocado entre os 2 Galvanómetros para manter a conjugação entre eles. Em seguida, um telescópio aumenta o tamanho do feixe de 2.5-fold e o periscópio traz para a altura do microscópio. O laser infravermelho entra o objetivo da deteção do microscópio graças a um espelho dicroico. Importantes distâncias entre elementos ópticos são dadas diretamente na figura. Distância entre a lente última (comprimento focal 500 mm) e a abertura traseira do objectivo é 500 mm. clique aqui para ver uma versão maior desta figura.

Figura 2: caseiro trilho modificado segurando o espelho dicroico e o espelho quente. O trilho de espelho dicroico do microscópio foi cortado do lado esquerdo para permitir a entrada do laser infravermelho. O espelho dicroico reflete a luz infravermelha e transmite a luz visível (fluorescência). Clique aqui para ver uma versão maior desta figura.
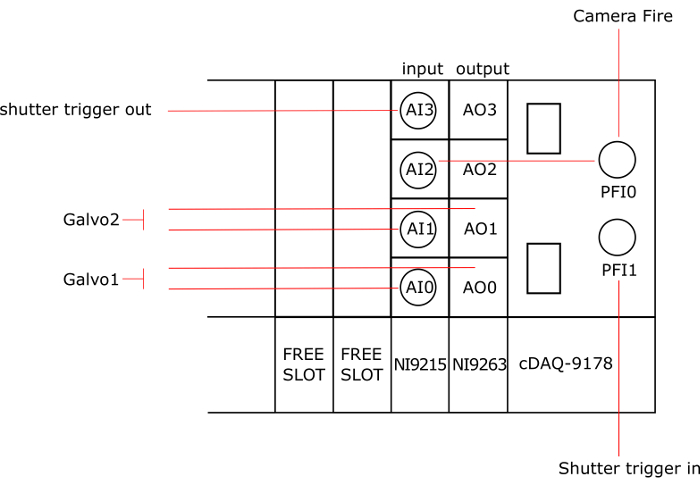
Figura 3: Conexão dos instrumentos aos cartões NI. AO: analógico de saída, AI: analógico de entrada, AO0 e AI0 estão ligados ao galvo1, AO1 e AI1 estão ligados ao galvo2, PFI0 está ligado ao fogo da câmera, para AI2 e PFI1 está ligado ao disparador do obturador em e AI3 está ligado ao disparador do obturador. Clique aqui para ver uma versão maior desta figura.

Figura 4: porta-amostras no contexto de observação. Esta figura foi modificada de Chardès, C., et al. 25. os embriões são imobilizados sobre a lamela de vidro. O slide é realizado pelo titular da amostra. Porta-amostras é inserido a cubeta de vidro, realizada pelo titular fixado à fase piezoelétrico. A folha de luz é horizontal e ilumina os embriões do lado. A lente objetiva de deteção é vertical, acima da amostra e aflore a cubeta.
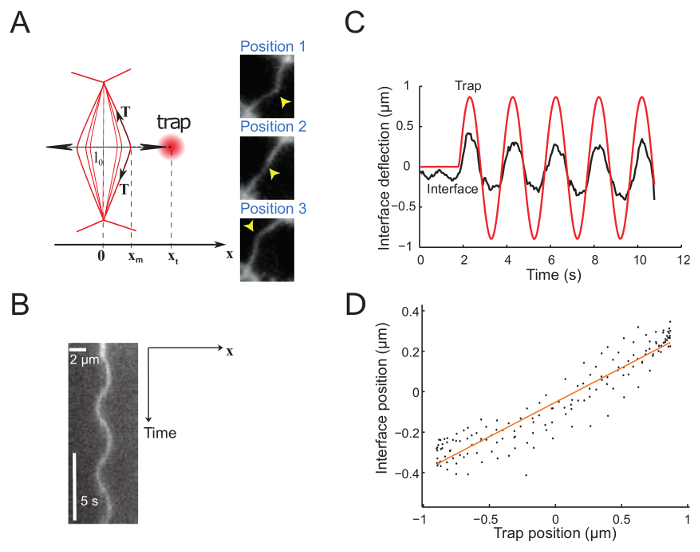
Figura 5: deflexão imposta pelo movimento senoidal da armadilha da Interface. Esta figura foi modificada de Bambardekar, K. et al.23. (A), a armadilha é movido sinusoidaa perpendicular à interface. As posições de armadilha e interface são xt e xm, respectivamente. Os painéis mostram três imagens da interface em posições diferentes. A posição de armadilha do laser é marcada por uma seta amarela. Interface são rotulados com um marcador de membrana (GAP43::mcherry). Kymograph (B) ao longo do eixo definido pela direção do movimento de armadilha (perpendicular à interface) (período = 5 s). (C) parcela representativa de deflexão versus tempo mostrando tanto armadilha (linha vermelha contínua) e posições de interface (linha preta sólida). (D) Interface posicionar-se como uma função da posição de armadilha durante alguns ciclos de oscilação do laser (Amplitude = 0,5 µm, período = 2 s). Clique aqui para ver uma versão maior desta figura.
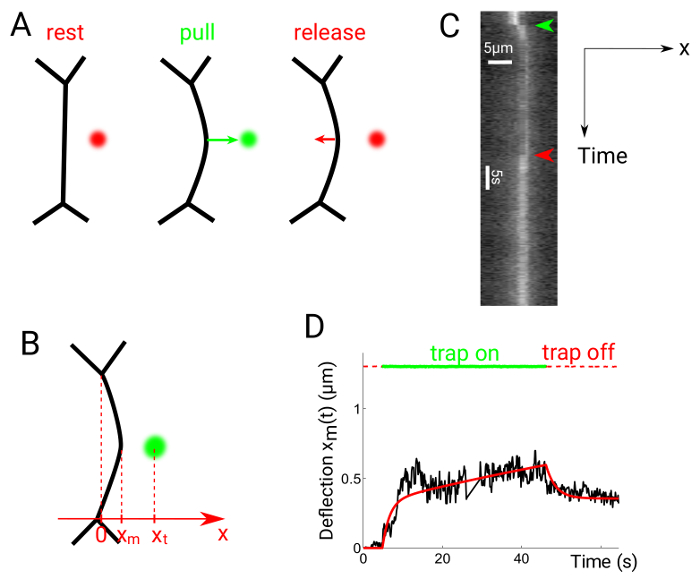
Figura 6: Interface deflexão em experimentos de puxar-lançamento. Esta figura foi modificada de Serge, r., et al. 24. (A), a armadilha é ligado a uma distância do ponto médio da interface, em seguida, novamente desligada. (B) as posições armadilha e interface são xt e xm, respectivamente. Kymographs são gerados ao longo da direção x, perpendicular ao ponto médio da linha contato. Kymograph (C) de um experimento de tração-lançamento. Contatos de célula são rotulados com Utrophin::GFP. (D) parcela representativa de deflexão versus tempo mostrando tanto a armadilha (linhas pontilhadas de vermelho/verde) e a posição de interface (linha preta sólida). A linha vermelha sólida mostra um ajuste obtido usando um modelo reológico de Maxwell, como24. Clique aqui para ver uma versão maior desta figura.
Complementar Movie 1: Tweezing experimento. Tamanho do pixel = 194 nm, 10 fps, período de oscilação de armadilha = 2 s, rotulagem: Gap43::mCherry. Clique aqui para baixar este arquivo.
Discussão
Pinça óptica permite realizar medições absolutas mecânicas diretamente no epitélio embrionário em desenvolvimento de forma não-invasiva. Nesse sentido, apresenta vantagens sobre outros métodos tais como a ablação a laser, que são invasivos e fornecem medidas relativas, forças magnéticas, que requerem injeções, ou forçar a inferência, que se baseia em suposições fortes e também fornecem relativo medições.
O protocolo inclui alguns passos críticos. Em primeiro lugar, como a lente objetiva pode mostrar as aberrações cromáticas e que a armadilha do laser empurra o objeto "a jusante", é importante verificar que o laser IR armadilhas o talão no plano de imagem e eventualmente correto para isso (passo 2.18). Em segundo lugar, o método baseia-se nas medidas da posição dos contatos do celular. Assim, é fundamental usar um marcador fluorescente de alto contraste.
A qualidade da lente objetiva e o feixe de laser são críticos à armadilhagem eficaz. A abertura numérica da lente da objetiva deve exceder 1.0. Se a caça é ineficaz, certifique-se de que o feixe de laser preenche a abertura traseira da lente da objetiva.
Nosso método vem com várias limitações. Primeiro, não é claro o que exatamente fornece o suporte para interceptação de óptica. Embora uma incompatibilidade de índice de refração é detectada, sua origem permanece para ser determinado. Em segundo lugar, o processo de calibração, se um está interessado em medições absolutas, pode ser um pouco entediante, como exige experiências microrheology passiva e calibração da rigidez de armadilha em grânulos. É importante reconhecer que a calibração da rigidez nos contatos do celular está sujeito à incerteza experimental: baseia-se em medições efectuadas a rigidez de armadilha em grânulos, que pode ser medido apenas no citosol, mas não perto de contatos do celular. Em terceiro lugar, não está claro como a Pinça óptica versátil pode ser. Embora eles são capazes de deformar as células do embrião de Drosophila , outros tecidos podem apresentar maior tensão ou mais difícil acesso (por exemplo, passando por uma cutícula) e, portanto, ser menos receptiva a Pinça óptica.
Forças ópticas são pequenas (< algumas dezenas de pN) e pode assim ser insuficiente para deformar-se estruturas rígidas ou altamente tensos. Pinça magnética sobre partículas grandes provavelmente seria mais eficaz neste caso.
Descrevemos aqui o acoplamento da pinça óptica para um microscópio folha de luz, mas Pinça óptica pode ser acoplada a outros tipos de microscópios, como uma epifluorescência ou microscópio confocal girando disco. A introdução do laser IR prendendo o microscópio depende da configuração de microscópio. Principalmente requer a possibilidade de adicionar um espelho dicroico para combinar os caminhos para manipulação de imagem e óptica. A maioria das empresas de microscopia propor sistemas de iluminação modular, com um módulo de duas camadas, que permitem que essa combinação.
Várias direções existem para melhorar ou atualizar a técnica. Uma possibilidade é dividir o tempo de permanência do laser entre várias posições, ou usar mais avançadas técnicas holográficas, para produzir várias armadilhas. Isto permitirá criar padrões mais complexos de força em contatos de célula ou células-alvo. Outra melhoria poderia ser para projetar um feedback em tempo real entre a deflexão causada e a posição da armadilha. Isto pode permitir a fluência adequada experimentos em que a força aplicada é mantida constante durante todo o experimento.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado por um FRM Equipe Grant FRM DEQ20130326509, Agence Nationale de la Recherche ANR-Blanc Grant, Morfor ANR-11-BSV5-0008 (a P.-F.L.). Reconhecemos a infra-estrutura de França-BioImaging suportada pelo francês Agência Nacional de pesquisa (ANR-10-INBS-04-01, «Investimentos para o futuro»). Agradecemos a Brice Detailleur e Claude Moretti da infra-estrutura de PICSL-FBI para assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Ytterbium Fiber Laser LP, 10 W, CW | IPG Laser | YLM-10-LP-SC | including collimator LP : beam D=1.6 mm and red guide laser |
| Ø1/2" Optical Beam Shutter | Thorlabs | SH05 | |
| Small Beam Diameter Galvanometer Systems | Thorlabs | GVS001 | 1 for X displacement, 1 for Y displacement |
| 1D or 2D Galvo System Linear Power Supply | Thorlabs | GPS011 | galvanometers power supply |
| 2 lenses f = 30mm | Thorlabs | LB1757-B | relay telescope between 2 galva |
| Lens f = 200mm | Thorlabs | LB1945-B | 2.5X telescope |
| Lens f = 500mm | Thorlabs | LB1869-B | 2.5X telescope |
| Right-Angle Kinematic Elliptical Mirror Mount with Tapped Cage Rod Holes | Thorlabs | KCB1E | Periscope |
| Laser Safety Glasses, Light Green Lenses, 59% Visible Light Transmission, Universal Style | Thorlabs | LG1 | |
| 45° AOI, 50.0mm Diameter, Hot Mirror | Edmund Optics | #64-470 | |
| Multiphoton-Emitter HC 750/S | AHF | HC 750/SP | |
| CompactDAQ Chassis | National Instruments | cDAQ-9178 | |
| C Series Voltage Output Module | National Instruments | NI-9263 | Analog output module |
| C Series Voltage Input Module | National Instruments | NI-9215 | Analog input module |
| FluoSpheres Carboxylate-Modified Microspheres, 0.5 µm, red fluorescent (580/605), 2% solids | ThermoFisher Scientific | F8812 | calibration beads |
| C++ (Qt) home made optical tweezers software | developed by Olivier Blanc and Claire Chardès. Alternative solution: labview |
Referências
- Lecuit, T., Lenne, P. -. F., Munro, E. Force generation, transmission, and integration during cell and tissue morphogenesis. Annual review of cell and developmental biology. 27 (1), 157-184 (2011).
- Heisenberg, C. -. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Sugimura, K., Lenne, P. -. F., Graner, F. Measuring forces and stresses in situ in living tissues. Development. 143 (2), 186-196 (2016).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in cell & developmental biology. 55, 119-130 (2016).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. Journal of Cell Biology. 149 (2), 471-490 (2000).
- Farhadifar, R., Roper, J. C., Aigouy, B., Eaton, S., Julicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Rauzi, M., Verant, P., Lecuit, T., Lenne, P. F. Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell biology. 10 (12), 1401-1410 (2008).
- Ma, X., Lynch, H. E., Scully, P. C., Hutson, M. S. Probing embryonic tissue mechanics with laser hole drilling. Physical Biology. 6 (3), 036004 (2009).
- Hutson, M. S., Tokutake, Y., et al. Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science. 300 (5616), 145-149 (2003).
- Bonnet, I., Marcq, P., Bosveld, F., Fetler, L., Bellaïche, Y., Graner, F. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface / the Royal Society. 9 (75), 2614-2623 (2012).
- Etournay, R., Popović, M., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current topics in developmental biology. 95, 93-144 (2011).
- Saha, A., Nishikawa, M., Behrndt, M., Heisenberg, C. -. P., Jülicher, F., Grill, S. W. Determining Physical Properties of the Cell Cortex. Biophysical journal. 110 (6), 1421-1429 (2016).
- Desprat, N., Supatto, W., Pouille, P. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental cell. 15 (3), 470-477 (2008).
- Mitrossilis, D., Röper, J. -. C., et al. Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation. Nature Communications. 8, 13883 (2017).
- Campàs, O., Mammoto, T., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2013).
- Serwane, F., Mongera, A., et al. In vivo quantification of spatially varying mechanical properties in developing tissues. Nature Methods. 14 (2), 181-186 (2017).
- Chiou, K. K., Hufnagel, L., Shraiman, B. I. Mechanical stress inference for two dimensional cell arrays. PLoS computational biology. 8 (5), e1002512 (2012).
- Ishihara, S., Sugimura, K. Bayesian inference of force dynamics during morphogenesis. Journal of theoretical biology. 313, 201-211 (2012).
- Brodland, G. W., Veldhuis, J. H., Kim, S., Perrone, M., Mashburn, D., Hutson, M. S. CellFIT: a cellular force-inference toolkit using curvilinear cell boundaries. PLoS ONE. 9 (6), e99116 (2014).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23, 247-285 (1994).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. -. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. , (2015).
- Clément, R., Dehapiot, B., Collinet, C., Lecuit, T., Lenne, P. -. F. Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis. Current biology: CB. 27 (20), (2017).
- Chardès, C., Ménélec, P., Bertrand, V., Lenne, P. -. F. Setting-up a simple light sheet microscope for in toto imaging of C. elegans development. Journal of visualized experiments. 87, e51342 (2014).
- Serge, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nature Methods. 5 (8), 687-694 (2008).
- Cavey, M., Lecuit, T. Imaging Cellular and Molecular Dynamics in Live Embryos Using Fluorescent Proteins. Drosophila. 420, 219-238 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados