Method Article
Prüfende Zelle Mechanik mit Wulst-freie optische Pinzetten in Drosophila Embryos
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir präsentieren Ihnen eine Setup der optischen Pinzette gekoppelt mit einem leichten Bogen Mikroskop und deren Umsetzung, Zelle Mechanik ohne Perlen in Drosophila Embryos zu erforschen.
Zusammenfassung
Morphogenese erfordert Koordination zwischen genetischen Musterung und mechanische Kräfte, die Zellen und Gewebe robust zu gestalten. Daher ist eine Herausforderung, morphogenetischen Prozesse verstehen zellulären Kräfte und mechanische Eigenschaften in Vivo in der Embryogenese direkt zu messen. Hier präsentieren wir eine Einrichtung der optischen Pinzette gekoppelt an ein leichtes Blatt-Mikroskop, wodurch Kräfte direkt auf Zell-Zell-Kontakte des frühen Embryos von Drosophila anzuwenden, während der Bildgebung mit einer Geschwindigkeit von mehreren Bildern pro Sekunde. Diese Technik hat den Vorteil, den es nicht erfordert, dass die Injektion von Perlen in den Embryo, normalerweise verwendet als Zwischenprodukt Sonden auf die optischen Kräfte ausgeübt werden. Wir ausführlich Schritt für Schritt die Umsetzung des Setups und Werkzeuge, um mechanische Informationsextraktion aus den Experimenten vorschlagen. Durch die Überwachung der Verschiebungen von Zell-Zell-Kontakten in Echtzeit, kann eine Spannung Messungen durchführen und Zellkontakte Rheologie untersuchen.
Einleitung
Embryonalentwicklung ist ein hoch reproduzierbarer Prozess, bei dem die Zellen und Gewebe verformen um das zukünftige Tier zu gestalten. Solche Verformungen haben gezeigt, dass erfordern die aktive Generation der Kräfte an der Zelle Level1,2. Um morphogenetischen Prozesse zu verstehen, während die Zellen und Gewebe ihre Form zu verändern, ist es daher Schlüssel für die mechanischen Eigenschaften der beteiligten Zellen beurteilen und messen die Kräfte innerhalb des Gewebes während der Prozess3,4 . Epitheliale Schichten, vor allem in Drosophila, wurden weitgehend durch ihre quasi-2D-Geometrie und ihre einfache Handhabung untersucht.
Eine Reihe von Techniken wurden so von uns und anderen epithelialen Mechanik in Vivo während der Entwicklung zu bewerten. Wir geben einen schnellen Überblick über die drei wichtigsten Techniken in epithelialen Geweben verwendet. Laser-Ablation, eine weit verbreitete Methode erlaubt es, die lokale mechanische Beanspruchung in der Zelle Kreuzungen5,6,7,8 oder im größeren Maßstab9,10,11 zeigen durch die Durchführung lokaler Kürzungen, die die mechanische Integrität des Ziels zu stören. Die Dynamik der Öffnung nach dem Schnitt informiert der Stress vor Ablation, sowohl auf die Rheologie der Gewebe12,13. Ein Nachteil der Laser-Ablation ist, dass es invasiv, wie es die lokale Störung des Kortex Zelle erfordert. Daher kann man nur eine begrenzte Anzahl von Ablationen durchführen, will man Gewebe Integrität zu bewahren. Ein weiterer Nachteil ist, dass Ablationen nur relative Schätzungen der Spannung am Zellkontakte, da die Öffnung Geschwindigkeit viskose Reibung abhängig ist, die nicht allgemein bekannt ist. Magnetische Manipulation hat auch entwickelt und in Drosophila, an denen entweder die Verwendung von Ferrofluide14 oder ultramagnetic Liposomen15verwendet. Sie bieten absoluten Messungen16,17, sondern sind auch in dem Sinne, dass sie die Injektion von Sonden an der gewünschten Stelle erfordern invasiv. Dies kann je nach System, sehr schwierig sein die nicht immer präzise Injektionen zugänglich ist. Ein drittes Verfahren, völlig nicht-invasiv, ist Kraft Inferenz18,19,20. Kraft Ableitung beruht auf der Annahme des mechanischen Gleichgewichts auf dreifache Punkte (Tricellular Kreuzungen oder Scheitelpunkte) und ermöglicht es, Spannungen überhaupt ableiten, Zell-Zell Kontakte (und gegebenenfalls Druck in allen Zellen) durch ein inverses Problem zu lösen. Für Spannungen bietet jeder Vertex zwei Gleichungen (X und Y). Daraus ergibt sich ein großes System von linearen Gleichungen, die unter bestimmten Bedingungen zur Spannung bei allen Zellkontakte Bewertung invertiert werden kann. Während diese Methode sehr attraktiv, da es nur eine segmentierte Bild und keine zusätzliche Experiment oder Setup erfordert, seine Genauigkeit ist noch zu bestimmen, und wieder es bietet nur relative Werte, wenn eine absolute Kalibrierung-Messung durchgeführt wird.
Um diese Einschränkungen zu überwinden, stellen wir in diesem Artikel eine Setup der optischen Pinzette gekoppelt an ein leichtes Blatt Mikroskop, kontrollierten Kräfte auf der Ebene der Zelle in der embryonalen Epithel von Drosophila Melanogasteranzuwenden. Optische Pinzette wurden für zahlreiche Anwendungen in der Biologie auch die Messungen auf einzelne Proteine und Manipulation von Organellen und Zellen21verwendet. Wir berichten hier angewendeten Kräfte im Bereich von ein paar Dutzend pN, die kleine ist noch ausreichend, um lokale Verformungen der Zellkontakte zu induzieren und mechanische Messungen in Vivodurchzuführen. In der Regel verwenden wir senkrecht Auslenkung des Zellkontakte, überwacht durch die Analyse der Kymographs, um Kraft auf Verformung zu beziehen. Wichtig ist, erfordert unser Setup nicht die Injektion von Perlen an der gewünschten Stelle im Gewebe, wie optische Pinzette Kräfte auf Zell-Zell-Kontakte direkt ausüben kann. Die Kopplung der optischen Pinzette zu einem leichten Bogen Mikroskop ermöglicht eine schnelle Bildgebung (mehrere Bilder pro Sekunde), was sehr spürbare für eine mechanische Analyse auf kurzen Zeitskalen und mit reduzierten Phototoxizität, da die Beleuchtung von der Probe ist auf der Ebene von imaging-22beschränkt.
Insgesamt, optische Pinzette sind eine nicht-invasive Weise kontrollierten Kräfte bei der in-vivo in Drosophila Embryos Zellkontakte anwenden und mechanische Informationsextraktion wie Steifigkeit und Spannung bei Zelle Kontakte23, rheologischen Eigenschaften 24, und Farbverlauf oder Anisotropie der Spannung23.
Protokoll
1. Einrichtung dem hellen Blatt-Mikroskop
- Beziehen sich auf die Beschreibung der Einrichtung im vorherigen Veröffentlichung25.
Hinweis: Das Setup besteht aus einem aufrechten Mikroskop Stadium und ein leichtes Blatt Modul erzeugen ein leichtes Blatt in der Horizontalebene. Ein 10 X Objektiv Erregung leitet das Licht Blatt in ein Glas Küvette (Abbildung 4). Die Erkennung Objektiv hat eine hohe NA (1.1), die für effiziente tweezing (s.u.) notwendig ist.
2. Aufbau der optischen Pinzette Weg
Hinweis: Abbildung 1 gibt eine allgemeine Regelung der optische Aufbau.
- 1070-nm-Laser-Einheit und befestigen Sie die Faser auf dem optischen Tisch mit einem V-Clamp-Mount. Sicherzustellen, dass die Faser-Kollimator parallel zum optischen Tisch ist (somit horizontale) und dass die hier gewählte Höhe die Höhe für die optischen Komponenten werden ausgerichtet auf die optischen Tisch.
Bemerkung: 100 mm kann eine gute Wahl für diese Höhe. - Drehen Sie den Schlüssel des Referats Infrarot-Laser, und drücken Sie die Schaltfläche "Auswählen" aktivieren Sie die Ausrichtung-Zeiger. Das Licht muss horizontal ausgehende der Faser.
- Platzieren Sie den Auslöser in den optischen Pfad, und an der optischen Tisch befestigen Sie, so dass die Infrarot-Laserstrahl durch die Öffnung des Verschlusses. Sicherzustellen, dass der Abstand zwischen den optischen Tisch und die Mitte der Öffnung des Verschlusses ist die Höhe im Schritt 2.1 gewählt.
- Drehen Sie den Schlüssel der Verschluss-Steuerung, wählen Sie den manuellen Modus mit den Pfeiltasten und drücken Sie die Schaltfläche "Aktivieren", den Auslöser zu öffnen.
- Legen Sie, richten Sie aus und fixieren Sie den ersten Galvanometer-Spiegel.
Hinweis: Die zwei Galvanometer Spiegel müssen an die hintere Blende des Ziels Erkennung konjugiert werden, dass wenn einem der Spiegel dreht, der Laserstrahl nicht aus der hinteren Öffnung des Ziels zu gehen. Beachten Sie, dass der Abstand zwischen der ersten Galvanometer und die hintere Öffnung des Ziels berechnet werden, um die Position dieser Galvanometer in Bezug auf das Ziel zu bewerten (f1 + f1 + f2 + f2 + f3 + f3 + f4 + f4 = 30 + 30 + 30 + 30 + 30 + 200 + 200 + 500 + 500 = 1550 mm; Fi = Brennweite der Linse n ° ich). - Schalten Sie die Stromversorgung Galvanometer. Sicherstellen Sie, dass die Galvanometers für den Rest des Protokolls Achse angetrieben werden.
- Auf null Ablenkung des Galvanometers festgelegt (NIMAX oder optische Pinzette Software - finden Sie in Schritt 3 Galvanometer-Verbindungen).
- Legen Sie, richten Sie aus und fixieren Sie das Relais Teleskop setzt sich aus den beiden Objektive mit einer Brennweite von 30 mm.
- Legen Sie, richten Sie aus und fixieren Sie den zweiten Galvanometer-Spiegel. Beachten Sie, dass der Abstand zwischen den zwei Galvanometers 4f = 4 x 30 mm = 120 mm (f = Brennweite).
- Positionieren Sie und befestigen Sie das Teleskop.
Hinweis: Das Teleskop besteht aus zwei Linsen, die den Strahl auf eine breite von mindestens gleich dem Durchmesser der hinteren Öffnung der Objektivlinse erweitern. Das Objektiv mit der kleinsten Brennweite sollte an erster Stelle. - Legen Sie, richten Sie aus und fixieren Sie das Periskop, das am Eingang der dichroitischen Spiegel Schiene nach oben den Strahlengang näher bringen.
- Beheben Sie die heiße Spiegel in der Schiene zu, legen Sie die Schiene in das Mikroskop. Stellen Sie sicher, dass die Schiene auf der rechten Seite ermöglichen den Eingang von der Infrarot-Laser (Abbildung 2) gesägt ist.
- Überprüfen Sie, dass das Laserlicht aus dem Mikroskop zunächst ohne das Ziel dann mit dem Ziel vor sich geht. Korrigieren Sie die Position des Lasers vor dem Ziel mit dem unteren Spiegel das Periskop. Korrigieren Sie die Position des Lasers, nachdem das Ziel mit dem oberen Spiegel das Periskop.
- 1 µL 500 nm fluoreszierende Kügelchen in die Glas-Küvette und fügen Sie 10 mL destilliertem Wasser hinzu. Die Küvette im Rahmen des Ziels in der Küvettenhalter und stellen Sie den Fokus des Objektivs (Z-Position), so dass das Ziel die Wasseroberfläche berührt.
- Starten Sie die Übernahme hausgemachte Software Steuerung der Aventurien, die Kamera und die piezoelektrischen Bühne. Eine kostenlose Software wie Mikromanager kann auch verwendet werden. Die live Akquisitionsmodus durch Betätigen der "Live" Tasters einschalten.
- Passen Sie die IR-Laserleistung, 1 w.
-
Die Brille aufsetzen (und entfernen Sie es nicht vor dem Ende des Experiments) und schalten Sie den Laser. Eine Perle sollte im Laserfokus gefangen zu sein.
- Wenn keine Perle im Laserfokus gefangen ist, überprüfen Sie, ob der rote Laser-Pointer (das mit dem IR-Laser kollinear) aus dem Ziel kommt. Wenn nicht, starten Sie erneut die Ausrichtung Schritte, insbesondere Schritt 2.13. Oder die IR-Laser-Leistung zu erhöhen.
- Wenn die Wulst unscharf (der Abbildungsebene) gefangen ist, sanft verschieben Sie die Position der letzten Linse des letzten Teleskop (L4 in Abbildung 1) entlang der optischen Achse, die Perle im Fokus mit der Abbildungsebene zu bringen. Wenn nicht genügend, Umzug der ersten Linse der letzten Teleskop (L3 in Abbildung 1) entlang der optischen Achse.
- Wenn eingeschlossene Perle im Bild nicht zentriert ist, verwenden Sie die 2 Periskop Spiegel ändern Sie die Position der Falle. Wenn die Position des Wulstes durch Ändern des Winkels des ersten Spiegels verändert wird, auch kompensieren Sie die Richtung des Strahls durch Veränderung der entsprechenden Winkel des zweiten Spiegels. Korrigieren Sie die X-Position nur (1 Schraube für jeden Spiegel), dann korrigieren Sie die Y-Position (1 Schraube für jeden Spiegel).
- Passen Sie ggf. die Position der Linse 2Nd Teleskop zu beobachten, die Perle im Fokus.
- Wenn nötig, passen Sie den Winkel der Periskop Spiegel, die Perle im Bild zentriert zu haben.
(3) Anbindung das Instrument
Hinweis: Abbildung 3 gibt eine allgemeine Regelung von National Instruments (NI) Karte Verbindungen.
- Legen Sie die Ausgabe-Karte (NI-9263) in den ersten Steckplatz des Chassis (cDAQ-9178). Beachten Sie, dass andere Modelle von NI Karten mit mindestens 2 Analogausgänge und 3 analog-Eingänge verwendet werden können.
- Legen Sie die Eingangskarte (NI-9215) in den zweiten Steckplatz des Gehäuses.
- Schließen Sie die ersten Galvanometer an den analogen Ausgang AO0 und den analogen Eingang AI0 mit BNC-Kabel. Beachten Sie, dass ein T-Adapter verwendet werden kann, mit einem 2 BNC-Kabel verbinden. Finden Sie das Galvanometer-Handbuch, die Stifte auf der Galvanometer-Treiber-Platine zu lokalisieren.
- Verbinden Sie auf die gleiche Weise die zweite Galvanometer AO1 und AI1.
- PFI1 an der Trigger IN der Auslöser (Rückseite der Steuerung) anschließen.
- Schließen Sie PFI0, um das Feuer der Kamera und AI2.
- AI3 an den Abzug aus den Auslöser (Rückseite der Steuerung) anschließen.
- Passen Sie die Einstellungen des Controllers Auslöser. Verwenden Sie die Pfeile, um die Parameterwerte ändern und drücken Sie die "Select" Taste bestätigen Sie die Wahl und an den nächsten Parameter übergeben. Setzen der "offenen Sek." Parameter, 000.000, "Zeit geschlossen sec", 000.000, "Modus" SINGLE und "Trigger" auf extern zulassen die Kontrolle des Verschlusses durch Drücken des Knopfes "Enable".
- Öffnen Sie QtCreator (heruntergeladen von https://www.qt.io/, kostenlose Version).
Hinweis: QtCreator ist die integrierte Entwicklungsumgebung verwendet, um die optische Pinzette Software in C++ zu entwickeln. Qt-Bibliothek wird hier verwendet, um Widgets zu erstellen. - Öffnen Sie die OT.pro-Datei (sofern in der Qt-Code-Dateien). Diese Aktion wird das Projekt geöffnet. Ändern Sie den Namen der ein-und Ausgabe in der Datei AOGenerator.cpp nach NI Karte(n) verwendet.
- Kompilieren Sie und führen Sie die OT-Software.
4. Kalibrierung der optischen Falle Position mit Perlen
-
Aufnahme eines Films Kalibrierung
- 1 µL von 500 nm rot fluoreszierenden Perlen in die Glas-Küvette, dann füllen Sie die Küvette mit 10 mL destilliertem Wasser. Abbildung 4 zeigt einen Blick auf die Küvette im Zusammenhang mit Beobachtung.
- Befestigen Sie die Küvette auf der piezoelektrischen Bühne.
- Passen Sie die Z-Position von der Küvette, sodass die Erkennung Ziel im Wasser eintaucht.
- Schalten Sie die Infrarot-Laser und legen Sie die macht, 1 w.
- Schalten Sie die Bild-Datenerfassungs-Software.
- Zeitraffer Bilder zu erwerben, wählen Sie die Belichtungszeit, die Verstärkung, die Zeit zwischen zwei Bildern, die Anzahl der Bilder erworben werden und die Laserleistung. Beachten Sie, dass die Beleuchtung für die optische Pinzette Kalibrierung mit Perlen, laser (561 nm) ist nicht erforderlich. Der 2-Photonen-Effekt durch die Infrarot-Laser induzierte ist genug, um die Fluoreszenz einer eingeschlossenen Raupe zu begeistern.
- Starten Sie die optische Pinzette hausgemachte Software.
- Legen Sie die optische Pinzette Parameter um einen Kreis zu verfolgen. Wie 250 Samp/s, die BufferSize als 1000, Waveform1 Parameter (Galvo 1) als sinusförmig, NbPeriod 1, 0,5 V, Amplitude phase 0.0 rad 0,0 V, Wellenform 2 Parameter (Galvo 2) als sinusförmig, NbPeriod 1, 0,5 V Amplitude, Phase 1,57 rad, Offset 0,0 V Offset SamplingRate eingestellt.
- Feld "AI-Parameter" und das "warten auf sie"... überprüfen Feld.
- Starten Sie die Bildaufnahme (500 oder 1000 Bilder mit einer hohen Bildrate, z. B. 10 fps).
- Schalten Sie die optische Pinzette durch Drücken der Taste "Generating!".
- Ermöglichen die eingeschlossene Wulst um mindestens zwei Vollkreise und stoppen der optischen Pinzette von UN-Drücken der "Generating!" Taste.
- Die Bildaufnahme zu stoppen. Beachten Sie, dass ein TIFF-Film und eine Textdatei mit Galvanometer Spannungen in der Standardeinstellung erstellt werden "c: / TEMP /" Ordner (außer ein benutzerdefinierter Speicherort angegeben ist). Beachten Sie, dass bei Bedarf mehrere Kalibrierung Filme mit zugehörigen Daten-Dateien erstellt werden können.
- Wenn der Kreis nicht abgeschlossen ist, geht die Wulst bei den Kreis-Flugbahn verloren. Vielleicht ist die Geschwindigkeit zu hoch. Verringern Sie ihn durch eine Verringerung der Sampling-Rate in der OT-Software. Oder mit der rote Laser-Pointer der Infrarot-Laser, überprüfen Sie, ob der Laser aus dem Ziel während der ganze Kreis Flugbahn kommt. Ist dies nicht der Fall, die Galvanometer-Spiegel können nicht mit der wieder Brennebene der Objektivlinse konjugiert werden. Korrigieren Sie die Positionen des Galvanometers in Bezug auf zurück Brennebene des Ziels, Schritt 2.5 wieder die Ausrichtung Schritte ab.
- Die Amplituden auf Null gesetzt und schalten Sie den Laser auf eine Perle an einer Fix Position zu fangen. Platzieren Sie ein Wahrzeichen an der Falle Position.
-
Position-Interpolation mit Bildanalyse
- Matlab öffnen, öffnen Sie den Ordner Kalibrierung und das "position2tension"-Skript (zur Verfügung gestellt, in der Matlab-Code-Dateien). Dieses Skript berechnet die Interpolationsfunktion Galvanometer Spannungen an optischen Falle Position zu übersetzen.
- Wählen Sie die Anzahl der Kalibrierung Filme verwendet wird. Mehrere Filme können mit verschiedenen Bahnen, wie zwei senkrecht Ellipsen ausgewählt werden. Im Allgemeinen reicht ein einziges Kalibrierung Film mit einer Kreisbahn.
- Die erste und letzte Bild bereitstellen, Zahlen im Dialogfeld (ein Dialogfeld pro Film), Sequenzen mit einem klaren Flugbahn und gutes Signal Rauschabstand.
- Geben Sie den Pfad der Textdatei mit den Spannungen während der Erfassung für jeden Film. Beachten Sie, dass das Skript die Datei liest und die mittlere Spannungen der beiden Galvanometers für jedes Bild berechnet.
- Geben Sie den Pfad des entsprechenden Kalibrierung Films.
Hinweis: Das Skript erkennt die Perle für jeden Frame mit einer Subpixel Auflösung durch den Einbau einer 2D Gauß um den Wulst mit benutzerdefinierten Funktionen und MTT26entnommen. Es zeigt eine graphische Darstellung der Wulst Flugbahn. - Beseitigen Sie alle schlecht erkannten Punkt (Ausreißer) indem Sie darauf klicken.
- Überprüfen Sie, ob die Interpolation für X Karte und y Laser Positionen berechnet und angezeigt, indem das Skript abgeschlossen ist. Wenn es gibt eine Menge von fehlenden Werten (weiße Regionen in der Karte), wiederholen Sie den Vorgang mit einem neuen Kalibrierung Film, mit einem besseren Signal Rauschabstand, oder / und mit einer langsameren Geschwindigkeit des Galvanometers.
Hinweis: Diese Bilder und die Interpolation-Werte werden automatisch im selben Ordner wie das Bild mit dem Namen convertFct.mat gespeichert.
5. Montage Drosophila Embryos27
- Sammeln von Drosophila Embryonen aus einem Käfig, inkubiert bei 25 ° C.
- Entfernen die Hefe, vorbei an der Platte Inhalt durch ein Sieb (Porengröße sollte etwa 100 µm).
- Waschen Sie die Embryonen mit 100 % Bleichmittel (2,6 % Natriumhypochlorit) für 45 s, das Chorion zu entfernen.
- Waschen Sie die Embryonen mit Wasser 2 min. lang.
- Setzen Sie die Embryonen auf einem Agar-Pad mit einer Bürste.
- Wählen Sie etwa 10 Embryonen nach der gewünschten Stufe und richten Sie die Embryonen mit einem Hecht oder einer feuchten Bürste.
Hinweis: Ausrichtung sollte je nach Region von Interesse (Region von Interesse, so nah wie möglich zum Ziel Erkennung) erfolgen. - Mit einer Diamant-Markierstift, schneiden Sie ein Stück von einem Objektträger 10 x 20 x 1 mm3.
- Fügen Sie Leim auf der einen Seite das geschnittene Stück, und trocknen lassen für 20 s.
- Umdrehen Sie das geschnittene Stück und legen Sie es auf der Linie von Embryonen, um es am Rand der Folie kleben.
- Installieren Sie dieses Präparat in der Probenhalter und legen Sie sie in die Küvette. Abbildung 4 zeigt einen Blick auf die Küvette im Kontext der Beobachtung.
- Setzen Sie die Küvette auf der piezoelektrischen Bühne.
(6) abfangen Experiment In Vivo
-
Abfangen der Zelle Kontakte – Schwingungen (Abbildung 5)
- Finden Sie den Ort von Interesse in das Gewebe.
Hinweis: Mit fliegen in die Cadherine beschriftet werden kann hilfreich sein, wenn man in der Ebene von Adherens Junctions zu arbeiten muss. - Verschieben der Ziel-Kreuzung Mittelpunkt auf die Falle Position (Wahrzeichen am Schritt 4.1.14) mit der Piezo-Bühne.
- Stellen Sie die Falle-Parameter, die Schwingungen senkrecht zur Oberleitung zu erreichen. Die Phasen als Null festgelegt. Legen Sie die Amplituden in X und Y-Richtung eine Bewegung senkrecht zur Oberleitung haben. Die Amplitude sollte in der Regel 0,1 V.
- Starten Sie den Erwerb (mit einer schnellen Bildrate, z. B. 10 fps).
- Schalten Sie die optische Pinzette drücken die Schaltfläche "Generieren!".
- Wenn fertig, schalten Sie die Pinzette und Stop Bildaufnahme. Ein Film und eine Textdatei mit Galvanometer Spannungen während der Akquisition sollte nun im angegebenen Ordner angezeigt werden.
- Abfangen der Zelle Kontakte – Pull-Version (Abbildung 6)
- Finden Sie den Ort von Interesse in das Gewebe.
- Verschieben Sie die Ziel-Kreuzung mit der Piezo-Bühne so dass seinen Mittelpunkt in der Regel 1 µm von der Falle Position (Wahrzeichen am Schritt 4.1.14).
- Festlegen Sie die Amplituden auf 0, eine stetige Falle zu haben.
- Starten Sie die Bildaufnahme (mit einer schnellen Bildrate, z. B. 10 fps).
- Schalten Sie die optische Pinzette drücken die Schaltfläche "Generieren!".
- Schalten Sie nach der gewünschten Zeit die Falle und warten auf Entspannung auftreten.
- Die Bildaufnahme zu stoppen. Ein Film und eine Textdatei mit Galvanometer Spannungen während der Akquisition sollte nun im angegebenen Ordner angezeigt werden.
- Finden Sie den Ort von Interesse in das Gewebe.
-
Halbautomatische Glomeruli Erzeugung und Erkennung der Schnittstelle Position.
- Im Matlab Command Window, laden die Interpolation Karte erzeugt während der Kalibrierung (4 b): load('convertFct.mat'). Dies stellt die fx und fy Variablen.
- In der Matlab-Befehlsfenster ausgeführt autokymo(fx,fy), in der Matlab-Code-Dateien zur Verfügung gestellt. Der Zweck dieser Funktion ist ein Glomeruli entlang der Flugbahn des Laser zu generieren und die Position der Fahrleitung mit Subpixel Auflösung für jeden Frame zu erkennen.
- Wählen Sie den angeforderten Text Dateipfad enthält die Spannungswerte.
- Wählen Sie die ersten und letzten Framenummern des Films analysiert werden.
- Wählen Sie die TIFF-Filmdatei. Zwei neue Figuren erscheint: der erste ist ein Bild von der Glomeruli. Das zweite ist ein Diagramm über den Nachweis von der Linie und Laser Polzahl, gegenüber der Bildnummer.
Hinweis: Die Funktion speichert die Grafik repräsentieren die Position der Probe und die Position des Lasers im Vergleich zu der Bildnummer (Matlab Figur, Jpg), die Glomeruli (TIFF-Bild) und die Glomeruli mit Laserposition (TIFF-Bild). Für stetige Fallenexperimente muss der Glomeruli manuell ausgeführt werden, zum Beispiel mit ImageJ. Die Erkennung der Schnittstelle aus der Glomeruli kann dann getan werden mit dem gleichen Algorithmus.
7. mechanische Messungen
-
Steifigkeit und Spannung Messungen
- Führen Sie eine Oszillation-Experiment (Schritt 6.1) und die entsprechende Analyse (Schritt 6.3) von den Zeitraffer.
- Plot die Schnittstelle Position
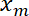 als Funktion der Position Falle
als Funktion der Position Falle  mit Matlab Plot-Funktion oder Daten Plotten Software.
mit Matlab Plot-Funktion oder Daten Plotten Software.
Hinweis: Dies sollte ungefähr linear sein. - Führen Sie eine lineare passen, mit Matlab "Ezfit" kostenlose Toolbox oder jede Software, die passt. Der Kehrwert der Steigung die Passform bietet das durchschnittliche Verhältnis
 .
. - Führen Sie Schätzungen über die scheinbare Biegesteifigkeit der Schnittstelle, die vorausgesetzt, kleine Verformungen und eine quadratische Potenzial für die Fallenjagd, ergibt sich aus
 .
. 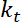 ist die Falle Steifigkeit (siehe Schritt 8 für die Falle Steifigkeit Kalibrierung).
ist die Falle Steifigkeit (siehe Schritt 8 für die Falle Steifigkeit Kalibrierung). - Führen Sie Schätzungen der Spannung, die als23definiert werden kann:
 .
.
-
Rheologische Messungen
- Führen Sie ziehen Freisetzungsversuche (Schritt 6.2) und die entsprechende Analyse (Schritt 6.3)
- Passen Sie die resultierende Kurve mit dem benutzerdefinierten rheologischen Modell.
8. Kalibrierung der Trap-Steifigkeit
Hinweis: Die Bestimmung der absoluten Kräfte erfordert die Kenntnis der Falle Steifigkeit auf Schnittstellen. Dies kann mit Perlen durch ein zweistufiges Verfahren zugegriffen werden.
-
Bestimmung der Viskosität Zytosol
- Legen Sie die Embryonen in Halocarbon Öl und injizieren sie mit einer Mikroinjektion Setup mit fluoreszierenden Polystyrol-Kügelchen (1:1, 000 Lager Verdünnung, 0,46 µm Durchmesser)23,27.
- Legen Sie die injizierten Embryonen unter dem Mikroskop.
- Verfolgen Sie die Bewegung der einzelnen Perlen in das Zytosol gefunden. Extrahieren Sie die mittlere quadratische Verschiebung der Perlen (verwenden Sie eine große Anzahl von Trajektorien > 100 Perlen). Bestimmen Sie die Wulst Verbreitung Konstante aus dem Hang der mittlere quadratische Verschiebung. Leiten Sie im Zusammenhang mit der Verbreitung konstante Viskosität durch die Stokes-Einstein-Gleichung ab, die effektive Viskosität der Zellflüssigkeit. In der frühe Embryo ist eine Viskosität von ca. 3,5 Pa.s gemeldeten23.
-
Bestimmung der Falle Steifigkeit auf Perlen
- Einzelne Perlen in das Zytosol mit optischen Pinzette zu fangen.
- Verschieben der Wulstes schrittweise Weise zwischen zwei Falle Positionen getrennt von 0,5 µm
- Bestimmen Sie die Falle Steifigkeit an Perlen, wie das Verhältnis zwischen den CW-Wert und die Perle Relaxationszeit von einem Falle Position zueinander.
Hinweis: Der CW-Wert ist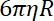 , wo
, wo 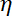 wird die Viskosität bestimmt (8.1) und
wird die Viskosität bestimmt (8.1) und  der Wulst-Radius. Die Relaxationszeit erhält man vom exponentiellen passt an die Perle mit Matlab oder jede Software, die passt. Typische Werte der Falle Steifigkeit sind 120 ±50 pN.µm-1 auf 200 mW-Laseranregung.
der Wulst-Radius. Die Relaxationszeit erhält man vom exponentiellen passt an die Perle mit Matlab oder jede Software, die passt. Typische Werte der Falle Steifigkeit sind 120 ±50 pN.µm-1 auf 200 mW-Laseranregung.
-
Bestimmung der Falle Steifigkeit auf Zelle Oberfläche
- Konzentriert sich des Lasers auf eine Oberleitung und (wie in Schritt 6 beschrieben) abzulenken. Messen Sie die Verformung Amplitude. Dies sollte auf mehrere Oberleitungen erhalten einen repräsentativen Durchschnitt wiederholt werden.
- Vergleichen Sie die erzeugte Verformung mit, dass induziert durch Perlen gegen Oberleitungen geschoben. Da die Verformung umgekehrt proportional zu der Falle Steifigkeit ist, leiten Sie die Falle Steifigkeit auf Zellkontakte ab.
Hinweis: Die Falle Steifigkeit auf Zellkontakte in der Regel 2 bis 3 fache kleiner als Perlen (0,46 µm Durchmesser) fand.
Ergebnisse
Abbildung 5 zeigt experimentelle Daten, die von imposanten eine sinusförmige Bewegung in die Falle. Die Falle erzeugt eine Auslenkung der Schnittstelle, wie durch die 3 Schnappschüsse zeigen 3 aufeinander folgende Schnittstelle Positionen (Abb. 5A)23veranschaulicht. Aufgenommene Filme sind ein Glomeruli (Abb. 5 b) erzeugt und werden weiter analysiert, um festzustellen, dass die Position der Schnittstelle mit Subpixel Auflösung, mit einer Gaußschen entlang der X-Richtung für jeden Frame passen. Im Regime der kleine Verformungen, die Falle und Schnittstelle sind proportional (Abbildung 5). Die Amplitude der Schnittstelle Durchbiegung im Verhältnis zu der Falle (Abbildung 5) haben Zugriff auf die Schnittstelle Spannung oder Steifigkeit (siehe Punkt 7.1).
Abbildung 6 zeigt experimentelle Daten erhalten durch die Durchführung ziehen lassen Sie Experimente. Die optische Falle eingeschaltet ist etwa 1 µm vom Mittelpunkt der Schnittstelle zwischen zwei Zellen, wodurch die Oberfläche in Richtung der Falle Position (Abb. 6A)24abzulenken. Die Falle wird dann nach der gewünschten Zeit abgeschaltet. Die Position Xm der Schnittstelle (Abb. 6 b) ergibt sich aus Kymographs (Abbildung 6), erneut mit Gauß entlang der X-Richtung für jeden Frame passt. Das resultierende Diagramm kann mit rheologischen Modelle, zum Beispiel eine Maxwell-Modell (Abbildung 6) die Hypothese verglichen werden.
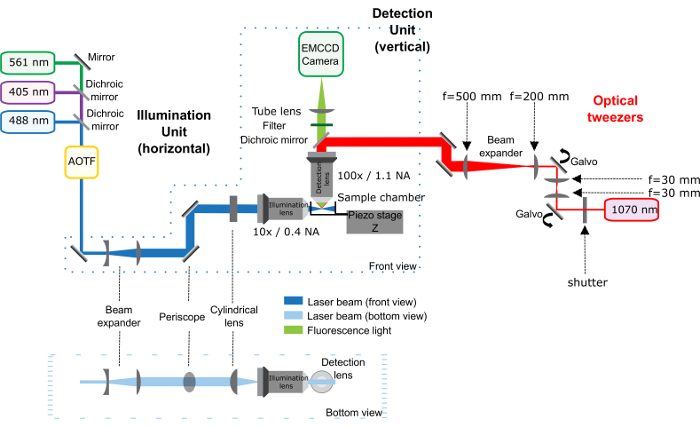
Abbildung 1: Schematische Darstellung der optischen Pinzette (roter Pfad) Einrichtung kombiniert mit dem leichten Bogen Mikroskop. Diese Zahl wurde von Bambardekar, K. Et Al. modifiziert 23. Das leichte Blatt Mikroskop, komponiert von der Beleuchtungseinheit und der Detektionseinheit beschrieben bereits25. Die optische Pinzette entsprechen den roten Teil des Systems: die Infrarot-Laser durchläuft einen optischen Verschluss und 2 Galvanometers, die die Position der Falle in der Probe zu steuern. Ein 1-fold Teleskop befindet sich zwischen den 2 Galvanometers, die Konjugation zwischen ihnen zu halten. Dann, ein Teleskop erhöht die Größe des Balkens von 2,5-Fach und das Periskop bringt es auf die Höhe des Mikroskops. Der Infrarot-Laser betritt die Erkennung Ziel des Mikroskops dank einem dichroitischen Spiegel. Wichtige Entfernungen zwischen optischen Elemente sind direkt in der Abbildung angegeben. Abstand zwischen der letzten Linse (Brennweite 500 mm) und die hintere Öffnung des Ziels ist 500 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: hausgemachte veränderten Schiene halten die dichroitischen Spiegel und heiße Spiegel. Die dichroitischen Spiegel-Schiene des Mikroskops wurde auf der linken Seite erlauben den Eingang von der Infrarot-Laser geschnitten. Die dichroitische Spiegel reflektiert das Infrarot-Licht und überträgt das sichtbare Licht (Fluoreszenz). Bitte klicken Sie hier für eine größere Version dieser Figur.
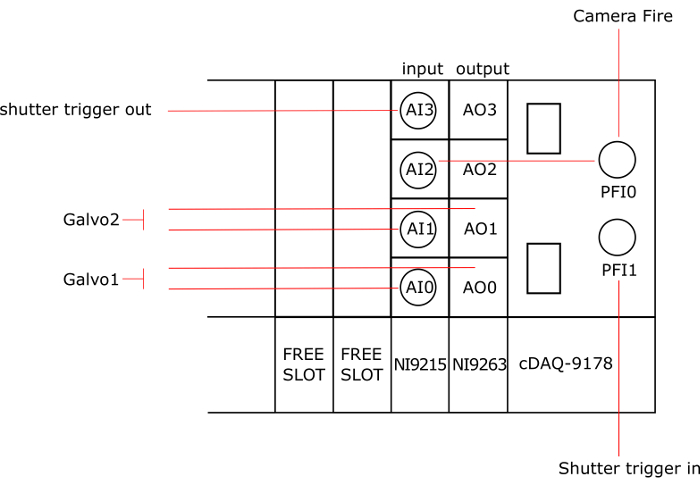
Abbildung 3: Verbindung der Instrumente zu den NI Karten. AO: Analogausgang, AI: Analogeingang, AO0 und AI0 mit galvo1 verbunden sind, AO1 und AI1 mit galvo2 verbunden sind, PFI0 das Feuer der Kamera, AI2 verbunden ist und PFI1 mit den Auslöser des Verschlusses verbunden ist und AI3 an den Abzug aus den Auslöser angeschlossen ist. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Probenhalter im Zusammenhang mit Beobachtung. Diese Zahl wurde von Chardès, C., Et al.modifiziert. 25. die Embryonen sind auf der Glas-Deckglas immobilisiert. Die Folie ist im Besitz der Probenhalter. Der Probenhalter steckt in der Glas-Küvette, gehalten durch den Inhaber der piezoelektrischen Bühne befestigt. Das leichte Blatt ist horizontal und die Embryonen von der Seite beleuchtet. Die Erkennung Objektivlinse ist vertikal, oberhalb der Probe und taucht in die Küvette.
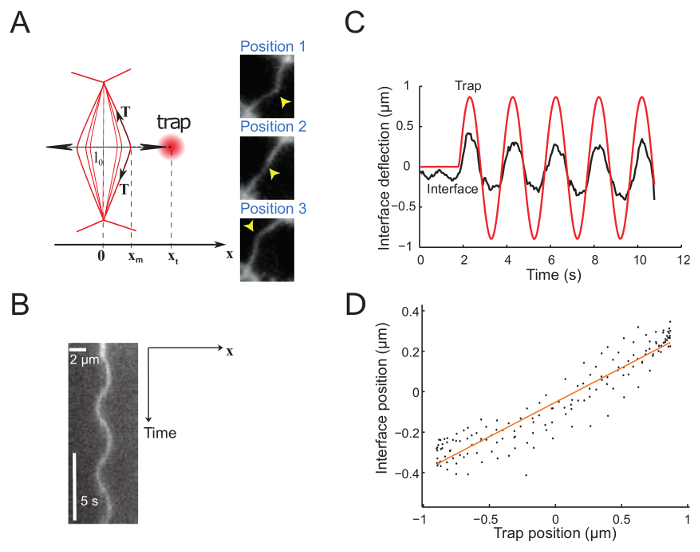
Abbildung 5: Schnittstelle Durchbiegung durch sinusförmige Bewegung der Falle verhängt. Diese Zahl wurde von Bambardekar, K. Et Al23geändert. (A) die Falle verschoben sinusähnlich senkrecht auf die Oberfläche. Die Falle und Schnittstelle sind Xt und Xm, beziehungsweise. Die richtigen Platten zeigen drei Bilder der Schnittstelle an verschiedenen Positionen. Die Laserposition Falle zeichnet sich durch eine gelbe Pfeilspitze. Schnittstelle mit einem Membran-Marker (GAP43::mcherry) gekennzeichnet sind. (B) Glomeruli entlang der Achse durch die Bewegungsrichtung Falle (senkrecht zum Interface) definiert (Periode = 5 s). (C) repräsentativen Grundstück der Ablenkung im Vergleich zur Zeit zeigt Trap (rote durchgezogene Linie) und Schnittstelle Positionen (schwarze durchgezogene Linie). (D) Schnittstelle zu positionieren als Funktion der Falle Position während der paar Zyklen der Laser Schwingung (Amplitude = 0,5 µm, Period = 2 s). Bitte klicken Sie hier für eine größere Version dieser Figur.
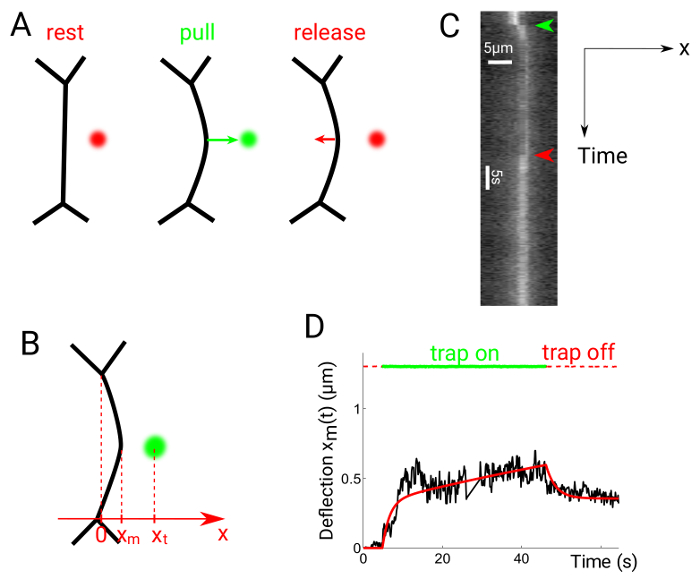
Abbildung 6: Schnittstelle Ablenkung in Pull-Freisetzungsversuche. Diese Zahl wurde von Serge, A., Et al.modifiziert. 24. (A) die Falle in einem Abstand vom Mittelpunkt der Schnittstelle eingeschaltet ist, dann wieder ausgeschaltet. (B) die Falle und Schnittstelle sind Xt und Xm, beziehungsweise. Kymographs sind entlang der X-Richtung, senkrecht zum Mittelpunkt der Fahrleitung generiert. (C) Glomeruli der Pull Freisetzungsversuch. Zellkontakte sind mit Utrophin::GFP versehen. (D) repräsentativen Grundstück der Ablenkung im Vergleich zur Zeit zeigt Trap (gepunktete rote/grüne Linien) und Schnittstelle Position (schwarze durchgezogene Linie). Die durchgezogene rote Linie zeigt eine Passform mit einer Maxwell-artige rheologischen Modell24erzielt. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergänzende Film 1: Experiment tweezing. Pixel-Größe = 194 nm, 10 fps, Trap Schwingungsperiode = 2 s, Kennzeichnung: Gap43::mCherry. Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Optische Pinzetten ermöglichen absolute mechanische Messungen direkt in der embryonalen Entwicklung Epithel in eine nicht-invasive Weise durchführen. In diesem Sinne bietet es Vorteile gegenüber anderen Methoden wie Laser-Ablation, die invasive und liefern relative Messungen, magnetische Kräfte, die Injektionen erfordern, oder zwingen Folgerung, die auf starke Annahmen beruht und auch relative Messungen.
Das Protokoll enthält ein paar wichtige Schritte. Erstens, da das Objektiv zeigen könnten, chromatische Aberrationen und, dass die Laser-Falle das Objekt schiebt "downstream", ist es wichtig zu prüfen, ob der IR-Laser die Perle in der Abbildungsebene fallen und schließlich richtig dafür (Schritt 2.18). Zweitens setzt die Methode auf die Messungen die Zellkontakte Stellung. Es ist somit entscheidend für einen hohen Kontrast fluoreszierenden Marker zu verwenden.
Die Qualität des Objektivs und der Laserstrahl sind entscheidend für die effektive überfüllen. Die numerische Apertur des Objektivs sollte 1,0 betragen. Wenn Trapping unwirksam ist, stellen Sie sicher, dass der Laserstrahl die hintere Blende des Objektivs füllt.
Unsere Methode kommt mit mehreren Einschränkungen. Erstens ist es nicht klar, was genau die Unterstützung für optische fallen bietet. Obwohl ein Missverhältnis der Brechungsindex erkannt wird, bleibt seine Herkunft bestimmt werden. Zweitens kann die Kalibrierung, wenn man in absoluten Messungen interessiert ist ein bisschen langweilig, wie es passive Microrheology Experimente und Kalibrierung der Falle Steifigkeit auf Perlen erfordert. Es ist wichtig zu erkennen, dass die Kalibrierung der Steifigkeit auf Zellkontakte experimentellen Unsicherheiten behaftet ist: sie stützt sich auf Messungen der Falle Steifigkeit auf Perlen, die nur in der Zellflüssigkeit, aber nicht in der Nähe von Zellkontakte gemessen werden kann. Drittens ist es unklar wie vielseitige optische Pinzette sein kann. Sind in der Lage, die Zellen des Embryos von Drosophila zu verformen, könnte andere Gewebe höhere Spannung oder schwieriger Zugang (z. B. Umweg über eine Kutikula) präsentieren und daher weniger zugänglich optische tweezing.
Optischen Kräfte sind klein (< paar Dutzend pN) und kann somit nicht ausreicht, um steif oder hoch gespannten Strukturen verformen. Magnetischen Pinzette auf große Partikel würde in diesem Fall wahrscheinlich effektiver sein.
Wir beschrieben hier die Kopplung der optischen Pinzette zu einem leichten Bogen Mikroskop, aber optische Pinzette kann auf andere Arten von Mikroskopen, z. B. einem Epifluoreszenz oder einem konfokalen Spinning Disk Mikroskop gekoppelt werden. Die Einführung der IR-Trapping-Laser in das Mikroskop hängt von der Mikroskopkonfiguration. Es erfordert vor allem die Möglichkeit, einen dichroitischen Spiegel, um die Pfade für Bildverarbeitung und optische Manipulation zu kombinieren. Die meisten Mikroskopie Unternehmen vorschlagen, modulare Beleuchtungssysteme, mit einem zwei-Schicht-Modul, wodurch diese Kombination.
Mehrere Richtungen existieren, um zu verbessern oder aktualisieren Sie die Technik. Eine Möglichkeit besteht darin, die Laser-Verweilzeit unter verschiedenen Positionen aufgeteilt oder um mehr verwenden fortgeschrittene holographische Techniken, um mehrere fallen zu produzieren. Damit könnten um komplexere Kraft Muster auf Zielzellen oder Zellkontakte zu erstellen. Eine weitere Verbesserung wäre ein Echtzeit-Feedback zwischen die Ablenkung verursacht und die Position der Falle zu entwerfen. Dies könnte richtige kriechen Experimente ermöglichen, in denen die aufgewendete Kraft während des Experiments konstant gehalten wird.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde durch eine FRM Equipe Grant FRM DEQ20130326509, Agence Nationale De La Recherche ANR-Blanc Grant Morfor ANR-11-BSV5-0008 (zur P.-f.l.) unterstützt. Wir erkennen Frankreich BioImaging Infrastruktur unterstützt durch die französische National Research Agency (ANR-10-INBS-04-01, «Investitionen in die Zukunft»). Wir danken Brice Detailleur und Claude Moretti aus der PICSL-FBI-Infrastruktur für technische Hilfe.
Materialien
| Name | Company | Catalog Number | Comments |
| Ytterbium Fiber Laser LP, 10 W, CW | IPG Laser | YLM-10-LP-SC | including collimator LP : beam D=1.6 mm and red guide laser |
| Ø1/2" Optical Beam Shutter | Thorlabs | SH05 | |
| Small Beam Diameter Galvanometer Systems | Thorlabs | GVS001 | 1 for X displacement, 1 for Y displacement |
| 1D or 2D Galvo System Linear Power Supply | Thorlabs | GPS011 | galvanometers power supply |
| 2 lenses f = 30mm | Thorlabs | LB1757-B | relay telescope between 2 galva |
| Lens f = 200mm | Thorlabs | LB1945-B | 2.5X telescope |
| Lens f = 500mm | Thorlabs | LB1869-B | 2.5X telescope |
| Right-Angle Kinematic Elliptical Mirror Mount with Tapped Cage Rod Holes | Thorlabs | KCB1E | Periscope |
| Laser Safety Glasses, Light Green Lenses, 59% Visible Light Transmission, Universal Style | Thorlabs | LG1 | |
| 45° AOI, 50.0mm Diameter, Hot Mirror | Edmund Optics | #64-470 | |
| Multiphoton-Emitter HC 750/S | AHF | HC 750/SP | |
| CompactDAQ Chassis | National Instruments | cDAQ-9178 | |
| C Series Voltage Output Module | National Instruments | NI-9263 | Analog output module |
| C Series Voltage Input Module | National Instruments | NI-9215 | Analog input module |
| FluoSpheres Carboxylate-Modified Microspheres, 0.5 µm, red fluorescent (580/605), 2% solids | ThermoFisher Scientific | F8812 | calibration beads |
| C++ (Qt) home made optical tweezers software | developed by Olivier Blanc and Claire Chardès. Alternative solution: labview |
Referenzen
- Lecuit, T., Lenne, P. -. F., Munro, E. Force generation, transmission, and integration during cell and tissue morphogenesis. Annual review of cell and developmental biology. 27 (1), 157-184 (2011).
- Heisenberg, C. -. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Sugimura, K., Lenne, P. -. F., Graner, F. Measuring forces and stresses in situ in living tissues. Development. 143 (2), 186-196 (2016).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in cell & developmental biology. 55, 119-130 (2016).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. Journal of Cell Biology. 149 (2), 471-490 (2000).
- Farhadifar, R., Roper, J. C., Aigouy, B., Eaton, S., Julicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Rauzi, M., Verant, P., Lecuit, T., Lenne, P. F. Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell biology. 10 (12), 1401-1410 (2008).
- Ma, X., Lynch, H. E., Scully, P. C., Hutson, M. S. Probing embryonic tissue mechanics with laser hole drilling. Physical Biology. 6 (3), 036004 (2009).
- Hutson, M. S., Tokutake, Y., et al. Forces for morphogenesis investigated with laser microsurgery and quantitative modeling. Science. 300 (5616), 145-149 (2003).
- Bonnet, I., Marcq, P., Bosveld, F., Fetler, L., Bellaïche, Y., Graner, F. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface / the Royal Society. 9 (75), 2614-2623 (2012).
- Etournay, R., Popović, M., et al. Interplay of cell dynamics and epithelial tension during morphogenesis of the Drosophila pupal wing. eLife. 4, e07090 (2015).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current topics in developmental biology. 95, 93-144 (2011).
- Saha, A., Nishikawa, M., Behrndt, M., Heisenberg, C. -. P., Jülicher, F., Grill, S. W. Determining Physical Properties of the Cell Cortex. Biophysical journal. 110 (6), 1421-1429 (2016).
- Desprat, N., Supatto, W., Pouille, P. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental cell. 15 (3), 470-477 (2008).
- Mitrossilis, D., Röper, J. -. C., et al. Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation. Nature Communications. 8, 13883 (2017).
- Campàs, O., Mammoto, T., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2013).
- Serwane, F., Mongera, A., et al. In vivo quantification of spatially varying mechanical properties in developing tissues. Nature Methods. 14 (2), 181-186 (2017).
- Chiou, K. K., Hufnagel, L., Shraiman, B. I. Mechanical stress inference for two dimensional cell arrays. PLoS computational biology. 8 (5), e1002512 (2012).
- Ishihara, S., Sugimura, K. Bayesian inference of force dynamics during morphogenesis. Journal of theoretical biology. 313, 201-211 (2012).
- Brodland, G. W., Veldhuis, J. H., Kim, S., Perrone, M., Mashburn, D., Hutson, M. S. CellFIT: a cellular force-inference toolkit using curvilinear cell boundaries. PLoS ONE. 9 (6), e99116 (2014).
- Svoboda, K., Block, S. M. Biological applications of optical forces. Annual Review of Biophysics and Biomolecular Structure. 23, 247-285 (1994).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. -. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. , (2015).
- Clément, R., Dehapiot, B., Collinet, C., Lecuit, T., Lenne, P. -. F. Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis. Current biology: CB. 27 (20), (2017).
- Chardès, C., Ménélec, P., Bertrand, V., Lenne, P. -. F. Setting-up a simple light sheet microscope for in toto imaging of C. elegans development. Journal of visualized experiments. 87, e51342 (2014).
- Serge, A., Bertaux, N., Rigneault, H., Marguet, D. Dynamic multiple-target tracing to probe spatiotemporal cartography of cell membranes. Nature Methods. 5 (8), 687-694 (2008).
- Cavey, M., Lecuit, T. Imaging Cellular and Molecular Dynamics in Live Embryos Using Fluorescent Proteins. Drosophila. 420, 219-238 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten